2017년 애멸구 월동집단과 비래 집단의 약제 감수성 비교
초록
애멸구는 중국에서 비정기적으로 비래하여 국내 벼 유묘에 식물병원성 바이러스를 매개하여 식량 생산량을 저하시킬 수 있는 주요 해충이다. 따라서 살충제에 대한 감수성 모니터링을 통해 우수 약제를 선발하는 것이 중요하다. 본 연구에서는 2017년 채집한 애멸구 7개 월동집단과 3개 비래집단을 대상으로 7개 약제에 대한 감수성 수준을 벼유묘침지법을 통해 평가하였다. 실험 약제에 대한 저항성비의 범위는 카보설판, 페노브카브, 피프로닐, 에토펜프록스, 디노테퓨란, 이미다클로프리그 그리고 티아메톡삼에 대해 0.6~3.8배, 1.0~6.6배, 0.8~4.2배, 2.1~29.4배, 0.8~6.4배, 0.4~4.8배 그리고 0.5~12.8배인 것으로 나타났다. 월동집단과 비래집단의 약제별 저항성비의 비교 분석 결과, 비래집단이 디노테퓨란에서 약 2.8배 이상 유의하게 높은 것으로 나타났다. 또한 비래집단인 GG_GP계통에서 에토펜프록스에 대해서 약 29.4배의 가장 높은 저항성비를 보여, 저항성 형질을 지닌 애멸구가 비래하는 것으로 확인되었다. 다양한 약제의 독성지표와 저항성비를 고려했을 때, 카보설판, 페노부카브, 피프로닐등의 약제가 월동집단과 비래집단에 효과를 나타낼 것으로 사료된다. 비래 애멸구와 월동집단에 대한 정기적인 약제 감수성 모니터링 결과는 효과적인 약제 선발에 중요한 정보를 제공하여 저항성 발달을 지연시키고 방제 효율을 증대시킬 것이다.
Abstract
The small brown planthopper (Laodelphax striatellus) is an important pest because it transmits several plant viral disease with the irregular migration from China. It is important to monitor the insecticide susceptibility for the selection of appropriate insecticides. Here, we carried out the susceptibility test of seven kinds of insecticides to the seven overwinter and three migratory populations by rice-seedling dipping methods. The resistance ratios were ranged as 0.6~3.8, 1.0~6.6, 0.8~4.2, 2.1~29.4, 0.8~6.4, 0.4~4.8 and 0.5~ 12.8-fold to carbosulfan, fenobucarb, fipronil, etofenprox, dinotefuran, imidacloprid and thiamethoxam, respectively. In the resistance ratio comparison between overwinter and migratory populations, the migratory population revealed 2.8-fold significantly higher resistance ratio in dinotefuran. In addition, the GG_GP migratory population showed the highest etofenprox resistance (29.4-fold) among 10 local populations, suggesting that the migratory population could come into Korea possessing the resistance factors to the dinotefuran and etofenprox. Considering the toxicity profiles among seven insecticides, carbosulfan, fenobucarb, and fipronil might be further applicable to control the overwinter and migratory populations in Korea. The periodical susceptibility test for the overwinter and migratory populations would provide valuable information to choose the appropriate insecticide, resulting in the increase of control efficacy and the retardation of resistant population development.
Keywords:
Laodelphax striatellus, Resistance, Monitoring, Insecticide, Migratory population키워드:
애멸구, 저항성, 모니터링, 살충제, 비래집단서 론
애멸구(Laodelphax striatellus Fallén, SBPH)는 벼의 주요 해충으로 한국, 중국, 일본을 포함한 동아시아 뿐만 아니라 시베리아, 북유럽 등지에 널리 분포하고 있으며, 흡즙으로 인한 직접피해보다는 줄무늬잎마름병(rice stripe virus disease)과 검은줄오갈병(black streaked dwarf virus disease)을 매개하여 큰 피해를 준다(Hyun et al., 1977; Falk and Tsai, 1998). 한국에서는 2000년부터 줄무늬잎마름병이 서해안과 남해안 지역에서 4,663 ha (2001년), 14,137 ha (2007년), 21,541 ha (2009년), 7,397 ha (2011년)이 발병된 바 있다(Lee et al., 2012). 애멸구는 국내에서 연 5세대 발생하는데 주로 4령 약충형태로 논둑이나 휴반에서 월동하고, 4월부터 주변 보리밭이나 논으로 이동한다(Bae et al., 1995). 또한, 애멸구는 5월 하순부터 6월 상순 사이에 기류를 타고 중국으로부터 비래하여 국내 밀도에 영향을 준다(Otuka et al., 2010; Kim et al., 2011). 애멸구의 주된 비래지역으로는 태안을 비롯한 부안, 신안, 완도, 진도, 해남 등 한반도 서남해안 지역에 집중되어 있다(Kim et al., 2011; Jeong et al., 2012).
애멸구의 방제는 주로 화학합성 살충제에 의존하고 있으며, 유기인계 계통인 acephate, chlorpyrifos, fenitrothion, fenthion, 카바메이트계 계통인 carbaryl, metolcarb, 페닐피라졸계 계통인 ethiprole, fipronil, 네오니코티노이드계 계통인 imidacloprid, thiamethoxam, nitempyram, 피레스로이드계 계통인 deltamethrin, 치아디아진 계통인 buprofezin이나 피리딘아조멕틴 계통인 pymetrozine 등 다양한 살충제들이 개발되어 사용되고 있다(Lee et al., 2005; Park et al., 2009). 그러나 중국 및 일본 등 국내외적으로 이들 약제에 대한 저항성이 보고되고 있는 실정이다(Sone et al., 1995; Endo et al., 2002; Lee et al., 2005; Gao et al., 2007; Wang et al., 2010; Nakao et al., 2011; Zhang et al., 2014; Elzaki et al., 2015, Jeong et al., 2016).
애멸구과 같은 비래해충에 의한 피해는 국내 월동해충의 밀도뿐만 아니라 비래해충의 비래시기와 비래량에 따라 크게 영향을 받는다. 따라서 애멸구 방제를 위하여 정확한 비래시기와 비래량을 살피는 것이 중요하며 국내에서는 전국 주요 지역에 예찰답을 설치하고 공중포충망 등을 통하여 모니터링을 실시하고 있다(Kwon et al., 2018). 한편 비래원에서 특정 살충제의 과다 사용으로 저항성이 발현된 해충이 비래되었음에도 불구하고 그에 대한 정확한 정보가 없다면, 국내로 유입된 비래해충을 방제하기 위한 살충제 선택에 있어서 잘못된 오류를 범할 수도 있다. 일본의 경우, 비래 애멸구 계통에서 imidacloprid에 대한 약제저항성이 높고, Fipronil에 대해 낮아 중국에서의 약제저항성 수준이 일본내 존재하는 계통과 다른 경향을 확인하였으며(Otuka et al., 2010), 우리나라에서도 2009년 애멸구 다비래시기에 비래 전과 비래 후, 다비래지역과 그 외 지역의 비교에서 imidacloprid 약제저항성이 비래로 인해 더 높아짐을 확인하였다(Jeong et al., 2016). 따라서 비래 애멸구의 방제전략을 수립하는데 있어서 국내뿐만 아니라 비래원(예: 중국)에서의 약제사용정보 및 저항성 수준 변동 등에 대해 지속적인 모니터링이 중요하다.
본 연구에서는 국내 월동집단과 비래집단을 채집하여 7종의 약제에 대한 저항성비를 벼유묘침지법을 통해 산출하여 비래집단이 저항성 형질을 보유하였는지 확인하고, 우수 약제 선발에 초점을 맞추고자 연구를 진행하였다.
재료 및 방법
대상 해충 및 사육방법
시험을 위한 애멸구는 9지역 10계통으로 2017년 3월부터 6월까지 집중적으로 채집하여 사용하였다. 먼저 월동집단은 충북 충주(CB_CJ), 충남 태안(CN_TA1), 경북 상주(GB_SJ)와 경북 영천(GB_YC), 강원도 고성군(GW_GS), 전북 부안 (JB_BA), 전남 신안(JN_SA)에서 채집한 7계통으로 대부분 3~4월에 채집한 월동 2세대 약충이었다. 그 다음으로 비래집단은 충남 태안(CN_TA2), 경기 김포(GG_GP), 전남 진도(JN_JD) 3계통으로 같은 해 애멸구의 비래시기인 5월말~6월초에 해당 지역 예찰 센터에 설치된 공중포충망에 비래유입이 확인되면, 직접 해당 지역의 관찰포 유묘에서 채집한 성충이었다(Table 1). 각 계통은 아크릴케이지(30 × 22 × 30 cm3) 안에 벼(추청벼) 유묘를 기주로 공급하여 사육하였으며, 사육 조건은 온도 25 ± 2oC, 상대습도 50~60%, 광조건 16L:8D 이었다. 애멸구 감수성 계통(SUS)은 전북 전주 소재의 국립농업과학원 작물보호과에서 10년 이상 살충제에 노출시키지 않고 누대 사육하였다.
실험약제
사용한 약제는 애멸구 방제에 상업적으로 등록되어 있는 대표적인 유효성분들로서 Insecticide Resistance Action Committee (IRAC)에서 제시한 작용 기작을 고려하여 선발하였는데, 카바메이트계인 fenobucarb (50% EC, ㈜경농), carbosulfan (20% SC, 한국삼공㈜), 페닐피라졸계인 firponil (0.5% FG, 바이엘크로롭사인언스㈜), 피레스로이드계인 etofenprox (20% EC, ㈜경농), 네오니코티노이드계인 imidacloprid (10% WP, 바이엘크롭사이언스㈜), dinotefuran (10% WP, ㈜팜한농), thiamethoxam (10% WG, 신젠타코리아㈜) 등 모두 7종을 사용하였다(Table 2).
생물검정 및 통계 분석
생물검정은 Zhang et al. (2015)의 벼줄기침지법(Rice-stem dipping method)을 변형한 벼유묘침지법(Rice-seedling dipping method)을 사용하였다(Jeong et al., 2017). 벼 품종은 추청벼로서 파종 후 3-4주된 어린 유묘의 줄기를 사용하였다. 포트로부터 벼 유묘를 뽑아 수돗물에 세척 후, 뿌리가 있는 채로 줄기를 길이 7 cm로 자르고 음건하였다. 5개의 유묘 줄기를 한 그룹으로 하여 희석한 약제에 30초간 침지 후, 상온에서 30분 이상 음건하였다. 약제 처리 된 줄기들을 뿌리부분이 포함되게 물이 묻은 거즈솜으로 감싼 후 유리시험관(φ27 × h200 mm)에 장착하였다. 각 유리시험관에 애멸구 3령 약충을 15마리씩 접종하고, 27 ± 2oC, 상대습도 60~70%, 광조건 16L:8D의 조건에서, 처리 72시간 후 사충수를 조사하였다. 반수치사농도(LC50)를 얻기 위하여 SPSS 13.0 (IBM Analytics, Armonk, NY)을 이용한 probit analysis를 수행하였다. 또한 비래집단과 월동집단의 약제별 저항성비의 통계적인 유의성 분석은 Sigma Plot 10.0 (SYSTAT Software, San Jose, CA)을 이용한 t-test를 통해 분석하였다.
결 과
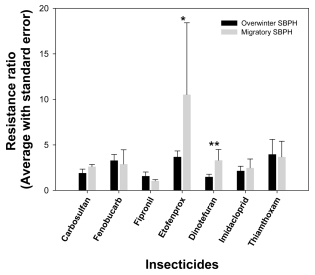
본 연구에서는 7개의 약제를 대상으로 7개 월동집단과 3개의 비래집단을 이용해서 반수치사농도를 포함한 독성 지표를 산출 후 저항성비를 도출하였다(Table 3, Table 4, Fig. 1).

Toxicity parameters of the seven overwinter Laodelphax striatellus populations to seven insecticides and its resistance ratio

Toxicity parameters of the three migratory Laodelphax striallus populations to seven insecticides and its resistance ratio
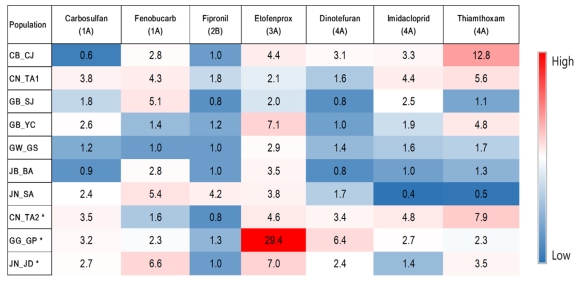
Heatmap representing the resistance ratio of 10 populations against seven insecticides in Laodelphax striatellus which was collected at 2017 in Korea. Three populations with asterisk (CN_TA2, GG_GP and JN_JD) is the migratory populations. The number in each cell reveal the actual resistance ratio which was listed in supplementary table 1 and 2.
카바메이트계 저항성
카바메이트계 약제는 곤충의 중추신경계에서 중요한 역할을 하는 아세틸콜린에스테라제와 결합하여 신경전달물질의 조절을 교란하여 치사시킨다(Fukuto, 1990). 본 연구에서는 carbosulfan과 fenobucarb 2 종에 대한 지역 계통의 저항성 비를 평가하였다. Carbosulfan과 fenobucarb의 저항성 비의 범위는 각각 0.6~3.8배와 1.0~6.6배였다(Table 3, 4, Fig. 1). 월동집단인 CN_TA1집단과 비래집단인 JN_JD집단에서 carbosulfan과 fenobucarb에 대해서 가장 높은 저항성 비를 보였다.
페닐피라졸계 저항성
Fipronil은 곤충의 중추신경계에 존재하는 GABA-gated chloride 채널에 결합하여 과흥분을 유도하여 곤충을 치사시키는 살충제이다(Gant et al., 1998). 지역 계통의 저항성비 조사 결과, 0.8~4.2배의 범위로 분포하고 있었으며, 월동 지역에서 채집한 JN_SA집단의 저항성 비가 가장 높은 것으로 나타났다(Table 3, 4, Fig. 1).
피레스로이드계 저항성
피레스로이드계 약제는 곤충의 중추신경계에 존재하는 Voltage-gated Na+ 채널에 결합하여 과흥분을 유도하여 곤충을 치사시킨다(Casida et al., 1983). 본 연구에서는 저항성 범위가 2.1~29.4배로 넓게 분포하는 것으로 나타났다(Table 3, 4, Fig. 1). 특히 비래집단인 GG_GP집단이 약 29.4배로 가장 높은 것으로 나타나, 해당 약제에 대한 저항성 형질을 지닌 집단이 비래 한 것으로 사료된다.
네오니코티노이드계 저항성
네오니코티노이드계는 침투 이행하는 특성이 있어 낮은 농도에서도 흡즙성 해충에 대한 효과가 높은 것으로 알려져 있다. 특히 nicotinic acetylcholine 수용체에 결합하여 신경 전달물질인 아세틸콜린의 정상적인 분비를 저해하여 마비를 통해 곤충을 치사에 이르게 한다(Matsuda et al., 2001). Dinotefuran, imidacloprid 그리고 thiamethoxam에 대한 지역 계통의 저항성비 범위는 0.8~6.4배, 0.4~4.8배 그리고 0.5~12.8배인 것으로 나타났다(Table 3 and 4, Fig. 1). 비래집단인 GG_GP집단과 CN_TA2집단에서 dinotefuran과 imidacloprid에 대해 각각 6.4배와 4.8배로 가장 높은 저항 성비를 지니고 있었다(Fig. 1). Thiamethoxam의 경우 국내 월동집단인 CB_CJ집단에서 12.8배로 가장 높은 저항성비를 보였다.
비래집단과 월동집단 간의 유의성 분석
10개 애멸구 계통의 7종 약제에 대한 저항성 비를 토대로 월동집단과 비래집단의 통계적인 유의성을 분석하였다(Jeong et al., 2016). 그 결과 dinotefuran에서 비래집단이 월동집단보다 2.8배 높은 저항성비를 통계적으로 유의하게 보였다(Fig. 2, P < 0.05). 이와 더불어 etofenprox의 경우, 강한 통계적인 유의성은 아니지만(P = 0.07), 비래집단인 GG_GP집단에서 실험 대상 집단 중에서 29.4배의 가장 높은 저항성을 지닌 것으로 나타났다(Fig. 1, 2).
고 찰
애멸구는 비정기적으로 국내로 유입되는 해충으로서 줄무늬잎마름병 등의 식물 병원성 바이러스를 매개하여 생산량 감소를 유발하는 주요 해충이다. 본 연구에서는 CN_TA2, JN_JD 그리고 GG_GP 지역에 비래 한 집단을 직접 채집 및 증식 하여 7종의 살충제에 대한 약제 감수성 수준을 평가하고 국내 월동집단의 약제 반응 수준과 비교하여 보았다. 약제 별 저항성 비의 통계적인 유의성 분석을 통해 dinotefuran에서 비래집단이 2.8배 높은 저항성을 지닌 것으로 확인되었다(Fig. 2). 또한 etofenprox의 경우 GG_GP집단에서 가장 높은 저항성비를 지닌 것으로 나타나(Fig. 1), 비래집단이 dinotefuran과 etofenprox에 대해서 저항성 형질을 지니고 비래 한 것으로 추정된다. 따라서 비래집단의 감수성 평가는 국내에서 방제 효율 증대를 위한 약제 선발에 중요한 정보를 제시할 것이다.
2009년도에 애멸구의 감수성 모니터링 연구에서는 21개 지역에서 채집한 계통에 대해서 10여종의 약제에 대해 수행하였다(Jeong et al., 2016). 해당 연구에서는 비래집단을 직접적으로 채집하여 독성 평가에 사용하지 않고, 비래 지역과 비비래 지역간의 저항성비를 조사하였다. 약제 별 통계적인 유의성 분석에서는 carbosulfan과 imidacloprid에서 비래 지역의 애멸구 집단의 저항성비가 통계적으로 높은 것으로 나타났다(Jeong et al., 2016). 하지만 본 연구에서는 dinotefuran과 etofenprox에서 저항성 형질을 지닌 집단이 유입한 것으로 나타났다. 즉 해마다 저항성을 지닌 인자가 다르게 유입될 수 있음을 의미한다. 또한 비슷한 시기에 채집한 집단이지만, 2017년 5월 29일에 채집한 2개 집단(CN_TA2와 JN_JD)은 7종의 약제에 대해 유사한 패턴을 보이지만, 같은 해 6월 9일에 채집한 GG_GP 집단은 etofenprox에서 높은 저항성을 보여, 해당 집단은 5월 29일에 비래 한 집단과 비래원이 다를 것으로 추정된다(Table 1, Fig. 1). 즉, 국내 애멸구 비래원은 동일 지역에서 반복적으로 유입되는 것이 아니라 비래 시기에 따라서 유입원이 다를 것으로 추정된다. 2017년 비래 애멸구의 밀도가 전반적으로 낮아 다양한 지역에서 샘플링을 통한 월동집단의 저항성비와 체계적인 비교를 하는데 한계가 있었다. 추후 비래 지역의 정기적인 모니터링을 통해 추가적인 샘플링을 통한 약제 저항성 정보는 비래원의 특성을 설명하는데 중요한 정보로 활용될 수 있을 것이다.
일본에서는 약제에 대한 생물검정 연구 결과를 애멸구 비래 근원 추적 연구에 기상 정보와 더불어 활용한 바 있다(Otuka et al., 2010). 일본 서부 지역에 비래 한 집단과 중국 장수성에서 채집한 집단의 감수성을 imidacloprid와 fipronil에 대해 미량국소처리법으로 평가 및 비교한 결과, 중국 집단과 일본 비래집단은 imidacloprid에만 저항성을 보였으나 fipronil에 대해서는 감수성을 보였다. 반면에 일본 지역 집단에서는 finpronil에 높은 저항성이 나타남에 따라, 중국 장수성 집단이 일본 서부 지역에 비래 함을 기상 정보와 더불어 확인하였다. 이와 마찬가지로, 약제에 대한 생물검정 연구 결과는 중국 근원지 집단과 국내 비래집단 간의 약제 감수성 비교를 통해 구체적인 비래 근원을 확인하는데 활용할 수 있을 것이다.
애멸구 국내 지역 집단과 비래집단의 약제에 대한 감수성 평가 모니터링 연구는 주요 약제에 대한 감수성 정보를 제공하여 우수 약제를 선발하는데 중요한 정보를 제공할 수있다. 특히 비래집단의 약제 감수성 결과는 해마다 비래원의 약제 사용 패턴에 변화를 감지하여 신속한 대응을 가능하게 할 것이다. 우수 약제의 사용은 궁극적으로 방제 효율을 증대시키고, 저항성 개체군의 발달을 지연시켜 궁극적으로 약제 사용의 가용 수명을 증대시킬 수 있다. 본 연구의 결과는 야외 포장에서 실질적인 애멸구 화학적 방제에 실질적인 정보를 제공해 줄 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ010821)의 연구비지원에 의해 수행되었습니다.
References
- Bae, S. D., Y. H. Song, and K. B. Park, (1995), Study on the bionomics of overwintering small brown planthopper, Laodelphax striatellus Fallén, in Milyang, Korean J. Appl. Entomol, 34(4), p321-327.
-
Casida, J. E., D. W. Gammon, A. H. Glickman, and L. J. Lawrence, (1983), Mechanisms of selective action of pyrethroid insecticides, Annu. Rev. Pharmacol. Toxicol, 23, p413-438.
[https://doi.org/10.1146/annurev.pa.23.040183.002213]

-
Elzaki, M. E. A., W. Zhang, and Z. Han, (2015), Cytochrome P450 CYP4DE1 and CYP6CW3v2 contribute to ethiprole resistance in Laodelphax striatellus (Fallén), Insect Mol. Biol, 24(3), p368-376.
[https://doi.org/10.1111/imb.12164]

-
Endo, S., A. Takahashi, and M. Tsurumachi, (2002), Insecticide susceptibility of the small brown planthopper, Laodelphax striatellus Fallén (Homoptera: Delphacidae), collected from East Asia, Appl. Entomol. Zool, 37(1), p79-84.
[https://doi.org/10.1303/aez.2002.79]

- Falk, B. W., and J. H. Tsai, (1998), Biology and molecular biology of viruses in the genus Tenuivirus, Annu. Rev. Phytopathol, 36, p139-163.
- Fukuto, T. R., (1990), Mechanism of action of organophosphorus and carbamate insecticides. Environ, Health Perspect, 87, p245-254.
- Gant, D. B., A. E. Chalmers, M. A. Wolff, H. B. Hoffman, and D. F. Bushey, (1998), Fipronil: action at the GABA receptor, Rev. Toxicol, 2, p147-156.
-
Gao, B., J. Wu, S. Huang, L. Mu, and Z. Han, (2007), Insecticide resistance in field populations of Laodelphax striatellus Fallén (Homoptera: Delphacidae) in China and its possible mechanisms, Int. J. Pest Manag, 54(1), p13-19.
[https://doi.org/10.1080/09670870701553303]

- Hyun, J. S., K. S. Woo, and M. I. Ryoo, (1977), Studies on the seasonal increase of the population of the smaller brown planthopper, Laodelphax striatellus (Fallén), Korean J. Plant Prot, 16(1), p13-19.
-
Jeong, I. H., S. W. Lee, B. R. Choi, S. H. Lee, and D. H. Kwon, (2016), Monitoring and evaluation of differential insecticide resistance profile in the immigrant vs. indigenous populations of the small brown planthopper (Laodelphax striatellus Fallén) in Korea, J. Asia Pac. Entomol, 19(1), p247-252.
[https://doi.org/10.1016/j.aspen.2015.12.002]

-
Jeong, I. H., S. W. Jeon, S. K. Lee, B. Park. S. K. Park, S. B. Lee, N. J. Choi, S. W. Lee, S. H. Lee, and D. H. Kwon, (2017), Insecticide cross-resistance and developmental characteristics on the two rice varieties, ‘Chinnong’ and ‘Chuchung’, of the imidacloprid-resistanct brown planthopper, Korean J. Pestic. Sci, 21(4), p381-388.
[https://doi.org/10.7585/kjps.2017.21.4.381]

-
Jeong, T. W., B. R. Kim, G. S. Han, D. W. Kang, I. Y. Jeong, H. S. Lim, and J. S. Kim, (2012), Evaluation of pesticide treatment for control of rice stripe virus after mass migration of small brown planthoppers, Res. Plant Dis, 18(3), p245-249.
[https://doi.org/10.5423/rpd.2012.18.3.245]

- Kim, J. S., G. S. Lee, C. S. Kim, H. S. Choi, S. H. Lee, M. K. Kim, H. R. Kwag, M. Nam, J. S. Kim, T. H. Noh, M. H. Kang, J. D. Cho, J. Y. Kim, H. J. Kang, J. W. Han, B. R. Kim, S. S. Jeong, J. H. Kim, S. J. Kuo, J. H. Lee, and T. S. Kim, (2011), Severe outbreak of rice stripe virus and its occurring factors, Korean J. Pestic. Sci, 15(4), p545-572.
-
Kwon, D. H., I. H. Jeong, S. J. Hong, M. P. Jung, K. S. Kim, S. W. Lee, and S. H. Lee, (2018), Incidence and occurrence profiles of the small brown planthopper (Laodelphax striatellus Fallén) in Korea in 2011-2015, J. Asia Pac. Entomol, 21(1), p293-300.
[https://doi.org/10.1016/j.aspen.2018.01.005]

-
Lee, B. C., S. Y. Cho, Y. N. Yoon, I. J. Kang, J. H. Lee, D. Y. Kwak, D. B. Shin, and H. W. Kang, (2012), Change in occurrence of rice stripe virus disease, Res. Plant Dis, 18(4), p402-405.
[https://doi.org/10.5423/rpd.2012.18.4.402]

- Lee, S. W., B. R. Choi, H. M. Park, and J. K. Yoo, (2005), Monitoring on insecticide resistance of major insect pests in paddy field, Korean J. Pestic. Sci, 9(4), p365-373.
-
Matsuda, K., S. D. Buckingham, D. Kleier, J. J. Rauh, M. Grauso, and D. B. Sattelle, (2001), Neonicotinoids: insecticides acting on insect nicotinic acetylcholine receptors, Trends Pharmacol. Sci, 22(11), p573-580.
[https://doi.org/10.1016/s0165-6147(00)01820-4]

- Nakao, T., A. Kawase, A. Kinoshita, R. Abe, M. Hama, N. Kawahara, and K. Hirase, (2011), The A2'N mutation of the RDL gamma-aminobutyric acid receptor conferring fipronil resistance in Laodelphax striatellus (Hemiptera: Delphacidae), J. Econ. Entomol, 104(2), p646-652.
-
Otuka, A., M. Matsumura, S. Sanada-Morimura, H. Takeuchi, T. Watanabe, R. Ohtsu, and H. Inoue, (2010), The 2008 overseas mass migration of the small brown planthopper, Laodelphax striatellus, and subsequent outbreak of rice stripe disease in western Japan, Appl. Entomol. Zool, 45(2), p259-266.
[https://doi.org/10.1303/aez.2010.259]

-
Sone, S., Y. Hattori, S. Tsuboi, and Y. Otsu, (1995), Difference in susceptibility to imidacloprid of the populations of the small brown planthopper, Laodelphax striatellus Fallén, from various localities in Japan, J. Pest. Sci, 20, p541-543.
[https://doi.org/10.1584/jpestics.20.541]

-
Wang, L., Y. Zhang, Z. Han, Y. Liu, and J. Fang, (2010), Cross-resistance and possible mechanisms of chlorpyrifos resistance in Laodelphax striatellus (Fallén), Pest Manag. Sci, 66(10), p1096-1100.
[https://doi.org/10.1002/ps.1984]

- Zhang, K., W. Zhang, S. Zhang, S. F. Wu, L. F. Ban, J. Y. Su, and C. F. Gao, (2014), Susceptibility of Sogatella furcifera and Laodelphax striatellus (Hemiptera: Delphacidae) to six insecticides in China, J. Econ. Entomol, 107(5), p1916-1922.
- Zhang, X., X. Liao, K. Mao, K. Zhang, H. Wan, and J. Li, (2015), Insecticide resistance monitoring and correlation analysis of insecticides in field populations of the brown planthopper Nilaparvata lugens (stål) in China 2012-2014, Pestic. Biochem. Physiol, 132, p13-20.