Deltamethrin의 경피반복노출에 따른 흰쥐의 3-PBA 배설과의 상관관계
초록
Pyrethroids (PYRs) 중 하나인 deltamethrin은 농업과 산업전반에 널리 쓰이고 있는 농약으로, 농업현장에서 농작업자의 노출수준과 같은 저농도의 노출이 만성적으로 반복되는 경우 인체의 대사 및 배설에 대한 연구가 필요하다. 본 연구에서는 우리나라 농작업자의 농약 노출수준인 저농도(0.0705 mg/kg bw)를 포함하는 중농도(0.7050 mg/kg bw), 고농도(7.0500 mg/kg bw) 수준에서 deltamethrin을 수컷 흰쥐에 7일 간격으로 3회 반복 노출시킨 후 대사체인 3-PBA의 배설량에 대한 변화를 살펴보고, 노출량과 배설량의 상관성을 확인하였다. 시험결과 뇨 중 3-PBA 배설은 농도와 양 모두에서 저, 중, 고 농도군 모두 피부를 통한 노출이 반복됨에 따라 뇨를 통한 3-PBA의 배설도 감소하였다. 특히 저농도군에서는 피부로 deltamethrin이 반복노출에 따른 뇨 중 3-PBA 배설이 유의적으로 감소하였다. 또한, 노출농도가 증가할수록 뇨를 통한 3-PBA 배설량은 증가하여 0.6 이상의 상관성을 보였으며, 이는 반복횟 수가 증가하여도 유사한 경향을 보였다. 본 연구결과 실제 농업현장의 농작업자에 대한 만성노출에 대해는 체내 축적은 경미할 것으로 예상된다. 또한, 뇨 중 3-PBA 배설량은 deltamethrin의 피부노출에 대한 단기 biomarker로 유용함을 확인하였다.
Abstract
Deltamethrin, one of the Pyrethroids (PYRs) pesticides, has been widely used in agriculture and industry. The study on human metabolism and excretion of deltamethrin is needed since low level of pesticide is exposed repeatedly in agricultural fields. This study is aimed to analyse urinary 3-Phenoxybenzoic acid (3-PBA) in male rats following three times of dermal exposure to deltamethrin with interval of 7 days; low (0.0705 mg/kg bw), medium (0.7050 mg/kg bw) and high (7.0500 mg/kg) level of exposure, and then investigate the time courses of urinary 3-PBA and dermal deltamethrin exposure. As a result, the urinary 3-PBA excretion in both concentration and amount were eliminated with increasing dermal exposures in all levels of deltamethrin exposure groups. The low level of deltamethrin groups showed especially significant decrease in urinary 3-PBA. Likely, the more exposure level of deltamethrin, the more urinary 3-PBA excretion showed high correlation between the repeated dermal exposure to deltamethrin and urinary 3-PBA excretion. This result is similar with the results when the number of repetition increases. Base on the results, accumulation of deltamethrin in agricultural workers who generally exposure to low levels of chronic pesticide may be negligible in body. We suggested that urinary 3-PBA excretion may be acute biomarker available to evaluate dermal exposure to deltamethrin.
Keywords:
Correlation, Deltamethrin, Urinary 3-PBA, Rat, Repeated dermal exposure키워드:
경피반복노출, 뇨중 3-PBA, 델타메쓰린, 상관관계, 흰쥐서 론
합성 pyrethroids (PYRs)는 농업과 가정 그리고 산업전반에서 널리 쓰이고 있어 사용자인 직접 살포자의 노출경로에 대한 연구가 다수 보고되고 있다. 선행연구에 따르면, PYRs는 낮은 수준으로 피부에 직접적으로 만성 노출될 경우 일시적으로 비정상적인 감각이상 증상들을 유발되며(ATSDR 2003), 인축에 대해서는 피부흡수율이 낮아서(<1.5%) 체내에 일단 흡수되면 대사가 빠르게 진행되어 비독성의 대사체로 체외로 배출되기 때문에 곤충에 비해 인체 독성은 극히 낮은 것으로 보고되었다(Bradberry et al., 2005). Deltamethrin 도 PYRs 농약 중 하나로 곤충의 나트륨채널에 민감하게 작용하여 살충효과는 빠른 반면, 가수분해로 인해 빠르게 분해되기 때문에 환경 잔류성이 낮고 인축에도 거의 독성이 나타나지 않는다(Hughes and Edwards 2010; Han et al., 2013).
Deltamethrin은 체내에 흡수되면 간에서 cytochrome P450에 의한 수산화반응과 esterase 효소에 의한 ester결합의 가수분해반응을 통해 주요 대사체인 3-Phenoxybenzoic acid (3-PBA)와 3-(2,2-Dibromovinyl)-2,2-dimethyl-cyclopropanecarboxylic acid (DBCA)로 대사되며, 이 대사체들은 sulfate와 glucuronide와 결합한 형태로 빠르게 전환되어 소변이나 변으로 체외로 배설된다(Anand et al., 2006). 따라서, 뇨 중의 3-PBA는 deltamethrin 뿐만 아니라 18개의 PYRs 농약에 주요한 대사체로 보고되고 있으며(Barr et al., 2010), 3-PBA는 PYRs 농약의 생물학적 모니터링 지표로 많이 연구되고 있다(Seo et al., 2007; Ahn et al., 2011; Kim et al., 2015).
흰쥐를 대상으로 PYRs의 경구 노출과 생체시료의 대사체의 상관성에 대한 연구에 따르면 모발, 혈액, 뇨의 생체시료 중 모발과의 상관성이 가장 높다고 보고한 바 있으나 (Appenzeller et al., 2017), 혈액 중의 3-PBA는 누적노출에 대한 정보로 활용될 수 있고, 뇨 중 3-PBA는 최근에 노출된 수준인 급성 평가에 활용될 수 있다고 보고되고 있다(Starr et al., 2014; Thiphon et al., 2014). 특히 포유류에서는 대사 체의 93%가 처음 24시간내 뇨를 통해 배설된다고 보고되고 있어, 노출 직후의 뇨시료 중 총 3-PBA 농도는 PYRs 농약 노출에 대한 biomarker로 사용할 수 있다(Ahn et al., 2011; Egeghy et al., 2011)
농약의 노출은 경구, 호흡, 그리고 피부를 통해 발생할 수있는데, PYRs에 의한 노출은 주로 호흡과 피부를 통해 발생하며(Hughes and Edwards 2010), 주로 주거용이나 직업적으로 사용되는 경우가 많기 때문에 피부를 통한 흡수율을 평가하는 것이 중요하다고 보고되고 있다(Zhang et al., 1991; Hughes and Edwards 2010). Deltamethrin은 작업자에 노출될 경우 열감과 피부 감각이상 같이 피부 증상들을 유발하며(Zhang et al., 1991; Kim et al., 2011), 1980년대 중국의 목화 농장 농작업자들 대부분이 피부감각과 관련된 증상이 관찰된다고 보고된 바 있어 농작업자의 주된 노출경로는 피부노출로 판단 된다(IPCS, 1990; Barlow et al., 2001).
한편, 생물학적 모니터링은 인체 내부 노출량(Internal dose)을 측정하기 위하여 생체시료를 분석하여서 정량 하는 것이다. 하지만, 이 방법은 노출경로의 구분이 어렵고 비특 이적 대사가 진행되므로 농약의 전체적인 노출 정도는 가능 하지만 특정 농약의 노출을 확인하기가 어렵다(Yang et al., 2007). 선행연구에서 우리나라 농작업자의 PYRs 농약의 모니터링을 위해 농작업자의 뇨 중 3-PBA 배설량을 분석한 연구가 다수 진행되었으며(Kimata et al., 2009; Song et al., 2014; Kim et al., 2015), 정량적으로 노출량을 예측하는 연구는 미비하였다. 또한 동물실험한 PYRs의 독성기작을 규명 연구는 주로 고농도 수준의 노출로 진행되어(Manna et al., 2005), 실제 농작업자의 작업환경과 유사한 노출수준인 저농도 연구는 미흡한 상황이다.
따라서 본 연구에서는 실제 우리나라 농작업자의 작업조 건과 유사한 노출농도로 설정하기 위해서 농촌진흥청에서 사용하고 있는 ‘한국형 농약 노출량 예측 모델(Korea Predictive Operator Exposure Model; KoPOEM)’을 통해 사과에 등록된 deltamethrin의 안전사용기준(Postharvest Interval; PHI)에 근거하여 살포횟수 및 노출수준으로 산정하고 이를 실험동물에 적용하였으며, 농작업자의 피부노출 경로에 맞게 랫드의 피부를 통해 반복 노출시킨 후 뇨 중 3-PBA 배설량 변화를 확인 함으로써 deltamethrin의 피부를 통한 반복노출과 뇨 중 3-PBA 배설량의 상관관계를 확인하고자 하였다.
재료 및 방법
시험물질 및 시약
Deltamethrin (99.8%)를 Bayer crop science (Leverkusen, Germany)로 부터 구입하여 사용하였으며, 대사체인 3-PBA (98%)과 내부표준물질인 2-PBA (98%), 유도체화 시약인 N-tert-Butyldimethylsilyl-N-methyltrifluoroacetamide (MTBSTFA, 97%), 추출 용매인 n-hexane (95%)과 toluene (99%)은 모두 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하여 사용하였다.
실험동물 및 사육조건
본 연구에서 수행된 동물실험은 국립농업과학원 실험동물 윤리위원회에서 승인(NAAS 1504) 받아 진행하였다. 실험 동물은 7주령 수컷 Sprague-Dawley (SD) 흰쥐를 ㈜ Koatech (Gyeonggi-Do, Korea)에서 구입하였으며, 일주일의 순화기간 후 피부에 이상 증상이 관찰되지 않은 개체만 사용하였다. 실험동물은 시험군간 체중차이가 평균체중의 ± 10%를 넘지 않도록 하였으며, 군별로 11마리를 사용하였다. 사육환 경은 온도 23 ± 3oC, 상대습도 50 ± 5%, 조명시간 12시간 및 조도 150-300 Lux로 하였다. 시험기간 동안 사육상자에 3마 리씩 넣어 사육되었으며, 실험동물용 고형사료와 물을 자유 급식 하였다
노출수준 및 시험군의 구성
농약의 농도 설정은 우리나라 농작업자가 deltamethrin 1% 유제를 사과 작물에 처리할 때 노출되는 deltamethrin 노출 수준으로 선정하고자 하였다. 농약 노출농도는 농촌진 흥청 KoPOEM을 이용하여 농약의 조제 및 살포에 노출되는 농도를 합한 농도를 저농도군(0.0705 mg/kg bw)으로 하였으며, 공비 10으로 중간농도군(0.7050 mg/kg bw), 고농도 군(7.0500 mg/kg bw)을 상위농도로 설정하였다. 노출횟수는 사과에 등록된 deltamethrin 1% 유제의 PHI인 수확 7일전 3회에 근거하여, 7일 간격으로 3회 처리하였다.
Deltamethrin의 반복 경피투여 시험
노출량은 농작업자 노출농도를 실험동물의 체중을 근거하여 환산해서 처리하였다. 경피투여를 위하여 실험 전날 실험동물의 등 부위 체표면적의 10% 이상을 제모하였으며, 시험당일 4 × 4 cm 크기의 거즈에 시험물질을 균일하게 도포 후 실험동물의 등에 부착 후 비자극성 테이프로 고정하였다. 노출시간은 KoPOEM에서 노출량 산정시 활용하는 6 시간으로 하였으며, 노출종료 후 테이프를 제거하고 멸균증 류수로 닦아냈다.
매 시험물질 노출 직후 24시간동안의 뇨 시료를 대사케이 지를 이용하여 수거하였으며, 마지막 노출 후 1주일 후 1회더 뇨 시료를 채취하였다. 채취된 뇨 시료는 2,000 rpm에서 10분 동안 원심분리(Hanil, Supra 22K, Incheon, Korea)한 후 여과하여 부피를 측정하였으며 분석 전까지 -70oC 이하에서 보관하였다.
뇨 시료 전처리 및 기기분석
뇨 중 3-PBA 분석을 위해 시료를 Schettgen et al. (2002) 방법에 의거하여 다음과 같이 전처리 하였다. 시료 1 mL에 내부표준물질(10 µg/mL 2-PBA in 50% methanol) 10 µL를 가하여 진탕한 후 HCl (12 N) 100 µL를 첨가하여 90oC, 1 시간 동안 반응시켰다. 반응액을 추출을 위해 n-hexane 500 µL를 가하여 10분간 진탕한 뒤 상층액만 분리하여 질소가 스로 완전히 건조 시켰다. 이후 유도체화 과정을 위해 Toluene 50 µL, 유도체시약 MTBSTFA 10 µL을 첨가하여 70oC에서 45분 동안 반응시켜 기기분석에 사용하였다. 뇨중 3-PBA의 정량을 위해 무처리군 뇨 시료에 3-PBA 0.98-2000 ng/mL의 농도로 첨가 후 동일한 전처리 과정을 거쳐 분석하였다.
분석에 사용된 기기는 Agilent 6890 Gas Chromatography에 연결된 Agilent 5973 MSD (Santa Clara, CA, USA)를 사용하였으며, 특정이온만 선택하여 분석하는 selected ion-monitoring (SIM) 방법을 이용하였다. GC/MS의 분석 조건은 Table 1과 같다. 분석결과는 각 시료의 chromatogram으로부터 피크면적을 측정한 뒤 내부표준물질의 피크 면적비(peak ratio)으로 산출하였다.
뇨 중 creatinine 분석
개체 별로 상이한 뇨 배설량과 신장상태 반영을 위해 creatinine으로 보정해 주기 위하여(Barr et al., 2005) 뇨 중 creatinine을 분석하였으며, Jaffe법을 응용한 선행연구(Kim et al., 2017) 방법을 활용하였다.
통계처리
통계분석은 SPSS ver. 12.0 (SPSS, Chicago, IL, USA)을 이용하였으며, one way ANOVA test를 실시 후 유의성 검증을 하였다. 뇨 중 3-PBA 검출수준과 deltamethrin 노출수 준의 상관성을 확인하기 위하여 선형 및 곡선형 회귀분석 (regression analysis)을 실시하였고 p<0.05인 경우 유의적으로 농도의존적이라고 판단하였다.
결과 및 고찰
체중변화
실험동물의 체중은 처리 전에 측정 후 실험기간인 21일까지 일주일에 2회씩 측정하였다. 전 실험기간 중 체중변화는 대조군을 포함한 모든 시험군에서 유의적인 차이를 나타내지 않았다(Fig. 1).
경피를 통한 deltamethirn의 반복 노출에 따른 뇨 중 3-PBA 변화
실험동물에 deltamethrin을 저농도(0.0705 mg/kg bw), 중농도(0.7050 mg/kg bw), 고농도(7.0500 mg/kg bw) 수준으로 피부를 통해 7일 간격으로 3회 처리한 후 24시간동안 채취된 뇨와 마지막 처리 7일 후에 채취된 뇨의 3-PBA 농도 (µg/ml)와 배설량(µg) 변화는 Fig. 2에 나타내었으며, 대조 군의 모든 뇨 시료에서 3-PBA가 검출되지 않았다.
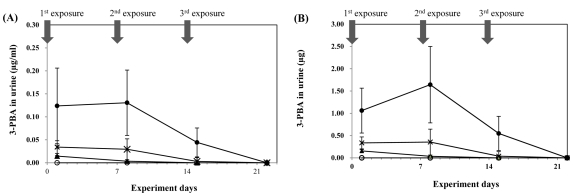
Time courses of concentration (A) and amount (B) of urinary 3-PBA excretion in rats following the repeated dermal exposure to deltamethrin ; control ( ○ ), 0.0705 mg/kg bw ( ▲ ), 0.705 mg/kg bw ( × ), 7.05 mg/kg bw ( ● ). Each plot represents the mean ± S.D of 10 animals.
처리 횟수별 농도(Fig. 2, A)및 배설량(Fig. 2, B) 변화를 살펴보면, 저농도군에서는 1회 처리에서 0.015 ± 0.001 µg/ ml, 2회 처리에서 0.003 ± 0.003 µg/ml의 농도로 유의적으로 감소하였다가(p<0.05) 3회 처리 이후부터는 검출되지 않았으며, 이는 배설량 변화에서도 유사한 경향을 보였다. 중농 도군에서도 1회 처리 시 0.033 ± 0.017 µg/ml, 2회 처리시 0.029 ± 0.023 µg/ml, 3회 처리시 0.003 ± 0.008 µg/ml로의 농도로 감소경향을 보였으나 유의적이지 않았고 마지막 처리 7일 후에는 불검출 되었다. 이는 고농도군에서도 유사한 경향을 보였다.
Creatinine으로 보정된 뇨 중 3-PBA 농도는 Table 2에 나타내었으며, 대조군에서 모두 불검출되었다. 저농도군에서는 1회 처리 시 1.375 ± 0.362 µg/g creatinine인 3-PBA의 농도가 2회 처리 시 0.300 ± 0.264 µg/g creatinine로 유의적으로 감소하였으며(p<0.05), 3회 처리와 그 7일 이후의 뇨에서는 검출되지 않았다. 중농도에서 1회 처리시 2.900 ± 1.300 µg/g creatinine, 2회 처리시 2.703 ± 2.105 µg/g creatinine로 유의적인 변화가 없었으나 3회 처리(0.301 ± 0.874 µg/g creatinine)에서 유의적으로 감소하였으며(p<0.05) 그 7일 이후에는 검출되지 않았다. 고농도군에서도 중농도군과 유사한 감소경향을 보였으나 유의적은 나타나지 않았다. 이상과 같이 뇨 중 3-PBA 배설은 농도와 양 모두에서 저, 중, 고 농도군 모두 피부를 통한 노출이 반복됨에 따라 뇨를 통한 3-PBA의 배설도 감소하는 것을 알 수 있다.

Creatinine-corrected concentration of urinary 3-PBA in rats following the repeated dermal exposure to deltamethrin(unit : µg/g creatinine)
실험동물을 이용한 PYRs의 피부노출 연구는 일부 진행되 었으나(Yavuz et al. 2010; Hughes and Edwards 2010; 2016) 이를 통한 뇨 중 배설량에 대한 연구, 특히 deltamethrin의 노출에 따른 뇨 중 3-PBA 배설과 관련된 연구는 극히 제한적이었다. 흰쥐에 deltamethrin을 1,750 nmol을 5.6 cm2의 피부에 노출시킨 후 뇨를 통한 3-PBA를 방사선 동위원소 방법으로 분석한 선행연구 결과 24시간 뇨 중 누적 3-PBA 배설량은 0.2 ± 0.003%이며 노출 후 5일이 지나면 누적량이 1.4 ± 0.3%로 증가한다고 보고되었으며(Hughes and Edwards 2016), PYRs의 일종인 cypermethrin의 경우 피부흡수율이 노출량의 1.2%만 뇨로 배설되며(Woolen et al. 1992), 경구를 통한 deltamethrin 노출이 3-PBA의 반감 기가 7.1시간이라는 보고된 바 있다(Sams and Jones 2012). 따라서 본 연구의 모든 농도 처리군에서 반복노출의 기간이 실제 농약제품을 사용조건을 고려했을 때의 7일이므로 deltamethrin의 노출에 따른 뇨 중 3-PBA가 다음 노출 전에 빠르게 감소하여 반복노출에 따른 체내 축적이 이루어지지 않고 배설됨으로 연속적으로 이어지는 노출에서도 누적되지 않고 체내는 항상성을 유지하는 것으로 판단된다.
한편, 사람을 대상으로 deltamethrin을 포함한 PYRs의 피부 흡수율을 살펴본 선행연구 결과 10% 미만으로 보고된바 있는데(Hughes and Edwards 2016), 흰쥐의 경우 사람에 비해 deltamethrin을 포함한 PYRs의 피부 투과율이 더 높다고 보고되었기에(Hughes and Edwards 2010) 농작업자와 같이 사람에게 동일한 농도로 노출되었을 때 피부를 투과하여 체내로 분포되고 체외로 배설되는 deltamethrin의 대사 경로에 대해서 농작업자가 동물보다 더 안전할 것으로 예상된다.
선행연구에서 태국 북부 농민 100명의 뇨 중 3-PBA는 4.29-9.57 ng/mL(0.80-256.2 µg/g creatinine)으로 나타났으 며(Thiphon et al., 2014), 중국의 섬유생산업종 종사자에서는 0.1-96 µg/L 수준(0.20-41 µg/g creatinine)으로 검출되었 고(Lu et al. 2013) 우리나라 고랭지 배추생산 종사자에서는 5.91-533.10 µg/g creatinine으로 검출되어(Kim et al., 2015), 본 시험에서 검출된 농도와 유사하거나 높게 나타났는데, 이는 사람을 대상으로 모든 PYRs의 노출경로가 포함되었기에 deltamethrin으로 국한된 본 시험에 비해 높게 나타난 것으로 생각된다.
또한 일본 농약살포자에 대한 연구에서 PYRs농약을 살포한 2일 이내 뇨 중 3-PBA 농도는 겨울(5.4 µg/g creatinine)에 비해 여름(12.3 µg/g creatinine)에 높게 나타났으며, 겨울에는 PYRs 살포와 뇨 중 3-PBA 농도가 유의적인 관련이 있다고 보고하는 등(Wang et al., 2007), 실제 농약사용시의 노출환경 중 환경, 바람, 습도 등 다양한 조건에 따라 노출량이 변화됨을 알 수 있다.
Deltamethrin 노출량과 뇨 중 3-PBA 배설과의 상관관계
실험동물에 deltamethrin을 저농도(0.0705 mg/kg bw), 중농도(0.7050 mg/kg bw), 고농도(7.0500 mg/kg bw) 수준에서 7일 간격으로 3회 처리하여, 각 처리 후 24시간 소변 시 료의 3-PBA를 분석한 결과는 Fig. 3 (1회처리). Fig. 4 (2회 처리), Fig. 5 (3회처리)와 같으며 농도(A)와 배설량(B)으로 구분하여 표기하였다. 마지막 처리 7일 후는 3-PBA가 모두 불검출이어서 나타내지 않았다.
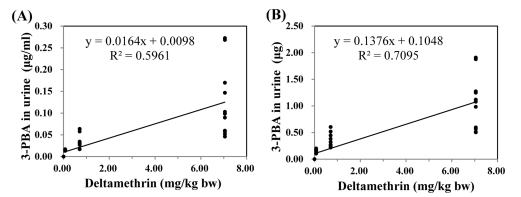
Correlation between 1st dermal exposure to deltamethrin and urinary 3-PBA excretion in rats ; concentration(A) and amount(B) of 3-PBA excretion in urine.
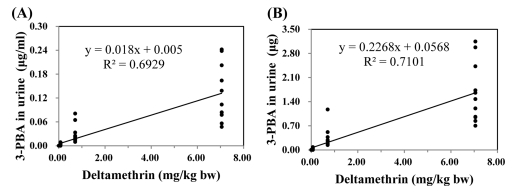
Correlation between 2nd dermal exposure to deltamethrin and urinary 3-PBA excretion in rats ; concentration(A) and amount(B) of 3-PBA excretion in urine.
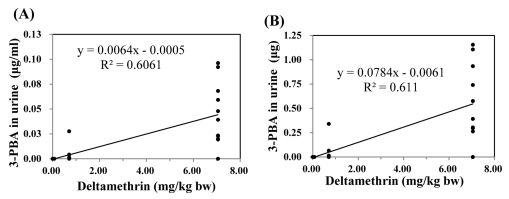
Correlation between 3rd dermal exposure to deltamethrin and urinary 3-PBA excretion in rats; concentration (A) and amount (B) of 3-PBA excretion in urine.
Deltamethrin의 피부 노출량에 따른 뇨 중 3-PBA 농도와의 상관성을 살펴보면, 1회 처리시 0.5961 (Fig. 3, A), 2회 처리시 0.6929 (Fig. 4, A), 3회 처리시 0.6061 (Fig. 5, A)으로 나타나 deltamethrin의 노출 농도가 증가할수록 뇨를 통한 3-PBA의 배설은 증가하는 것으로 나타났다. 또한, 3-PBA 배설량과의 상관성은 1회 처리시 0.7095 (Fig. 3, B), 2회 처리시 0.7101 (Fig. 4, B), 3회 처리시 0.6110 (Fig. 5, B)으로 3-PBA 농도와의 상관성보다 높게 나타났다.
이상과 같은 결과를 통해 피부를 통한 deltamethrin의 노출농도가 증가할수록 뇨 중 3-PBA 배설이 농도와 양 모두에서 정의 상관성을 가지고 증가하였으며, 노출 횟수가 반복되어도 유사한 경향을 나타내는 것을 알 수 있다. 동물실 험을 통한 deltamethrin 등 PYRs 노출농도와 노출횟수에 따른 뇨 중 3-PBA 배설 변화의 상관성에 대한 선행연구 결과가 미비하지만, deltamethrin의 노출이 반복되어 체내 대사를 거쳐 뇨와 변으로 배설되는 단계 중 본 연구결과를 고려했을 때 실제 농업현장에서 농작업자가 7일간격으로 deltamethrin을 살포하는 경우 체외 배설되어 반복노출에 의한 체내 축적은 미미한 것으로 생각되며, 뇨 시료의 3-PBA는 deltamethrin의 급성 피부노출에 대한 단기 biomarker로 중요한 자료의 의미를 가지는 것으로 판단된다.
향후 실제 포장에서 농작업자의 노출수준에서 평가된 뇨중 3-PBA의 배설 변화에 대한 연구를 통해 인체의 노출과 배설 상관성을 확인함으로써, 농약에 반복적으로 노출되는 농작업자의 만성적인 농약노출에 따른 배설량 추이에 대해 살펴볼 필요가 있다. 다만, 작업자의 체질량지수(Body Mass Index; BMI)가 낮아질수록 PYRs의 노출수준이 낮아진다고 보고(Yoo et al., 2016)되고 있어, 연구 대상자의 기본적인 정보, 포장시험조건, 작업자 보호장구 등에 대한 추가정보 및 대표성 있는 조건 선정이 필요할 것으로 생각된다. 또한, 과수 재배 농업인의 농약살포시 보호구 착용에 따라 뇨 중 3-PBA의 검출이 달라진다는 연구결과를 바탕으로 보호구 착용습관이 노출을 줄일 수 있다는 농업인의 농약노출 예방교육 등의 노력이 필요한 것으로 보인다(Oh et al., 2017).
Acknowledgments
This study was carried out with the support of “Research Program for Agricultural Science & Technology Development (Project No. PJ013392022018)”, National Institute of Agricultural Sciences, Rural Development Administration, Republic of Korea. This study was supported by 2018 the RDA Fellowship Program of National Institute of Agricultural Sciences, Rural Development Administration, Republic of Korea.
References
-
Ahn, K. C., S. J. Gee, H. J. Kim, P. A. Aronov, H. Vega, R. I. Krieger, and B. D. Hammock, (2011), Immunochemical analysis of 3-phenoxybenzoic acid, a biomarker of forestry worker exposure to pyrethroid insecticides, Anal. Bioanal. Chem, 401(4), p1285-1293.
[https://doi.org/10.1007/s00216-011-5184-z]

-
Anand, S. S., J. V. Bruckner, W. T. Haines, S. Muralidhara, J. W. Fisher, and S. Padilla, (2006), Characterization of deltamethrin metabolism by rat plasma and liver microsomes, Toxicol. Appl. Pharmacol, 212(2), p156-166.
[https://doi.org/10.1016/j.taap.2005.07.021]

-
Appenzeller, B. M., E. M. Hardy, N. Grova, C. Chata, F. Fays, O. Briand, H. Schroeder, and R. C. Duca, (2017), Hair analysis for the biomonitoring of pesticide exposure: comparison with blood and urine in a rat model, Arch. Toxicol, 91(8), p2813-2825.
[https://doi.org/10.1007/s00204-016-1910-9]

- ATSDR, (2003), Agency for Toxic Substances and Disease Registry, Toxicological profile for pyrethrins and pyrethroids, https://www.atsdr.cdc.gov/toxprofiles/tp155.pdf Accessed 9 November 2018.
-
Barlow, S. M., F. M. Sullivan, and J. Lines, (2001), Risk assessment of the use of deltamethrin on bednets for the prevention of malaria, Food Chem. Toxicol, 39(5), p407-422.
[https://doi.org/10.1016/s0278-6915(00)00152-6]

- Barr, D. B., A. O. Olsson, L. Y. Wong, S. Udunka, S. E. Baker, R. D. Whitehead, M. S. Magsumbol, B. L. Williams, and L. L. Needham, (2010), Urinary concentrations of metabolites of pyrethroid Insecticides in the general U.S. population: National health and nutrition examination survey 1999-2002, Environ. Health Perspec, 118(6), p742-748.
-
Barr, D. B., L. C. Wilder, S. P. Caudill, A. J. Gonzalez, L. L. Needham, and J. L. Pirkle, (2005), Urinary creatinine concentrations in the U.S. population: Implications for Urinary Biologic Monitoring Measurements, Environ. Health Perspec, 113(2), p192-200.
[https://doi.org/10.1289/ehp.7337]

-
Bradberry, S. M., S. A. Cage, A. T. Proudfoot, and J. A. Vale, (2005), Poisoning due to pyrethroids, Toxicol Rev, 24(2), p93-106.
[https://doi.org/10.2165/00139709-200524020-00003]

-
Egeghy, P. P., E. A. Cohen Hubal, N. S. Tulve, L. J. Melnyk, M. K. Morgan, R. C. Fortmann, and L. S. Sheldon, (2011), Review of pesticide urinary biomarker measurements from selected US EPA children’s observational exposure studies, Int J. Environl. Res. Public Health, 8(5), p1727-1754.
[https://doi.org/10.3390/ijerph8051727]

-
Han, Y. H., J. H. Park, J. S. Lim, Y. J. Lee, S. K. Lee, and K. S. Lee, (2013), Residual change of deltamethrin in stream water after spaying for pest control of stream levee, Korean J. Environ. Agric, 32(1), p78-83.
[https://doi.org/10.5338/kjea.2013.32.1.78]

-
Hughes, M. F., and B. C. Edwards, (2010), In vitro dermal absorption of pyrethroid pesticides in human and rat skin, Toxicol. Appl. Pharmacol, 246(1-2), p29-37.
[https://doi.org/10.1016/j.taap.2010.04.003]

-
Hughes, M. F., and B. C. Edwards, (2016), In vivo dermal absorption of pyrethroid pesticides in the rat, J. Toxicol. Environ. Health Part A, 79(2), p83-91.
[https://doi.org/10.1080/15287394.2015.1109571]

- IPCS, (1990), Environmental Health Creteria 97, Deltamethrin, World Health organization. International Programme on Chemical Safety.
-
Kim, A., K. Chon, K. H. Park, B. C. Moon, J. H. Ro, and M. K. Paik, (2017), The correlation between deltamethrin exposure and urinary 3-PBA concentrations in rats, Korean J. Environ Agric, 36(4), p293-298.
[https://doi.org/10.5338/kjea.2017.36.4.41]

- Kim, E. H., H. R. Lee, H. Choi, J. K. Moon, S. S. Hong, M. H. Jeong, K. H. Park, H. M. Lee, A. X. Hua, and J. H. Kim, (2011), Method validation for monitoring of agricultural worker exposure to insecticide fenthion, Korean J. Pestic. Sci, 15(4), p357-365.
- Kim, H. K., J. S. Song, H. S. Choi, and H. Y. Yu, (2015), evaluation of exposure to pyrethroid pesticides in highland cabbage farmers by using biological monitoring, Korean J. Pestic. Sci, 19(1), p41-46.
-
Kimata, A., T. Kondo, J. Ueyama, K. Yamamoto, J. Yoshitake, K. Takagi, K. Suzuki, T. Inoue, Y. Ito, N. Hamajima, M. Kamijima, M. Gotoh, and E. Shibata, (2009), Comparison of urinary concentrations of 3-phenoxybenzoic acid among general residents in rural and suburban areas and employees of pest control Wrms, Int. Arch. occup. Environ. Health, 82(10), p1173-1178.
[https://doi.org/10.1007/s00420-009-0424-7]

-
Lu, D., D. Wang, C. Feng, Y. Jin, Z. Zhouc, C. Wu, Y. Lin, and G. Wang, (2013), Urinary concentrations of metabolites of pyrethroid insecticides in textile workers, Eastern China, Environ. Int, 60, p137-144.
[https://doi.org/10.1016/j.envint.2013.08.004]

-
Manna, S., D. Bhattacharyya, T. K. Mandal, and S. Das, (2005), Repeated dose toxicity of deltamethrin in rats, Indian J. Pharmacol, 37(3), p160-164.
[https://doi.org/10.4103/0253-7613.16212]

-
Oh, J. S., and S. C. Roh, (2017), Evaluation of exposure level to pyrethroid pesticides according to protective equipment in male orchard farmers, Korean J Community Living Sci, 28(3), p391-401.
[https://doi.org/10.7856/kjcls.2017.28.3.391]

-
Sams, C., and K. Jones, (2012), Biological monitoring for exposure to deltamethrin: A human oral dosing study and background levels in the UK general population, Toxicol. Lett, 213(1), p35-38.
[https://doi.org/10.1016/j.toxlet.2011.04.014]

-
Schettgen, T., H. M. Koch, H. Drexler, and J. Angerer, (2002), New gas chromatographic-mass spectrometric method for the determination of urinary pyrethroid metabolites in environmental medicine, J. Chromatogr. B, 778(1-2), p121-130.
[https://doi.org/10.1016/s0378-4347(01)00452-2]

- Seo, J. C., J. S. Song, and H. S. Choi, (2007), Determination of 3-phenoxybenzoic acid in urine and exposure assessment of pyrethroid insecticides to human being, Korea J. Pestic. Sci, 11(2), p87-94.
-
Song, J. S., K. D. Kwon, H. S. Choi, and H. Y. Yu, (2014), Biological monitoring of the exposure level of organophosphorus and pyrethroid pesticides in floriculture workers and florists, Korea J. Pestic. Sci, 18(1), p41-47.
[https://doi.org/10.7585/kjps.2014.18.1.41]

-
Starr, J. M., S. E. Graham, D. G. Ross, R. Tornero-Velez, E. J. Scollon, M. J. DeVito, K. M. Crofton, M. J. Wolansky, and M. F. Hughes, (2014), Environmentally relevant mixing ratios in cumulative assessments: a study of the kinetics of pyrethroids and their ester cleavage metabolites in blood and brain; and the effect of a pyrethroid mixture on the motor activity of rats, Toxicology, 320(5), p15-24.
[https://doi.org/10.1016/j.tox.2014.02.016]

-
Thiphom, S., T. Prapamontol, S. Chantara, A. Mangklabruks, C. Suphavilai, K. C. Ahn, S. J. Gee, and B. D. Hammock, (2014), Determination of the pyrethroid insecticide metabolite 3-PBA in plasma and urine samples from farmer and consumer groups in northern Thailand, J Environ. Sci. Health B, 49(1), p15-22.
[https://doi.org/10.1080/03601234.2013.836862]

-
Wang, D., M. Kamijima, R. Imai, T. Suzuki, Y. Kameda, K. Asai, A. Okamura, H. Naito, J. Ueyama, I. Saito, T. Nakajima, M. Goto, E. Shibata, T. Kondo, K. Takagi, K. Takagi, S. Wakusawa, (2007), Biological monitoring of pyrethroid exposure of pest control workers in Japan, J occup. Health, 49(6), p509-514.
[https://doi.org/10.1539/joh.49.509]

-
Woollen, B. H., J. R. Marsh, W. J. D. Laird, and J. E. Lesser, (1992), The metabolism of cypermethrin in man: differences in urinary metabolite profiles following oral and dermal administration, Xenobiotica, 22(8), p983-991.
[https://doi.org/10.3109/00498259209049904]

- Yang, M. H., J. Y. Yang, B. N. Yi, and H. S. Lee, (2007), Application of physiologically based pharmacokinetic modeling with biological monitoring data for risk assessment, J. Environ. Toxicol, 22(1), p1-8.
-
Yavuz, O., A. Aksoy, Y. K. Das, M. Y. Gulbahar, G. F. Yarim, M. Cenesiz, E. Atmaca, and D. Guvenc, (2010), Repeated-dose 14-day dermal toxicity of different combinations of some synthetic pyrethroid insecticides, piperonyl butoxide, and tetramethrin in rats, Cutan. ocul. Toxicol, 29(1), p16-25.
[https://doi.org/10.3109/15569520903415076]

-
Yoo, M. S., Y. H. Lim, T. S. Kim, D. W. Lee, and Y. C. Hong, (2016), Association between urinary 3-phenoxybenzoic acid and body mass index in Korean adults: 1 st Korean National Environmental Health Survey, Ann Occup Environm Med, 28(1), p2-8.
[https://doi.org/10.1186/s40557-015-0079-7]

-
Zhang, Z. W., J. X. Sun, S. Y. Chen, Y. Q. Wu, and F. S. He, (1991), Levels of exposure and biological monitoring of pyrethroids in spraymen, Br. J. Ind. Med, 48(2), p82-86.
[https://doi.org/10.1136/oem.48.2.82]