Bacillus amyloliquefaciens PPL과 식물추출 혼합 제형의 식물병(토마토 시들음병, 고추 탄저병, 벼 잎집무늬마름병)과 흡즙성 해충(점박이응애, 복숭아혹진딧물)에 대한 실내활성 검정
초록
Bacillus amyloliquefaciens PPL은 3종의 병원성 곰팡이와 점박이응애와 복숭아혹진딧물을 방제하기 위해 식물추출물과 혼합한 제형 효과를 조사하였다. 녹두 추출물과 레시틴 영양원을 이용한 B. amyloliquefaciens PPL과 혼합한 식물추출 제형들은 토마토 시들음병(Fusarium oxysporum f. sp. lycopersici), 고추 탄저병(Colletotrichum gloeosporioides), 벼 잎집무늬마름병(Rhizoctonia solani)의 곰팡이병원균에 대해 항균활성을 나타냈다. 또한 점박이응애와 복숭아혹진딧물에 대한 살충효과는 NR 제형(B. amyloliquefaciens PPL + Azadirachta indica와 Derris elliptica)의 살충효과가 높았다. 처리농도별 살충효과에서는 점박이응애는 250배 농도와 복숭아혹진딧물은 1000배 농도까지 효과가 우수하였다. 따라서 Bt 독소 단백질에 의한 살충력이 강한 B. thuringiensis와는 달리 B. amyloliquefaciens PPL 을 이용하여 항균활성뿐만 아니라 살충능력도 향상시키는 결과를 얻었다. 이런 결과들은 지금까지의 항균·살충효과를 동시에 나타낼 수 있는 것에 대한 보고로서 동시 방제 가능성을 제고시킬 수 있는 결과이다.
Abstract
Bacillus amyloliquefaciens PPL, isolated from the feces of insect larvae, was evaluated the effectiveness of formulation with plant extracts on the ability to control against various phytopathogenic fungi and sucking pest. The formulations of plant extracts mixed with B. amyloliquefaciens PPL by substrate of mung bean extract and lecithin strongly inhibited the growth of Fusarium oxysporum f. sp. lycopersici, Colletotrichum gloeosporioides, Rhizoctonia solani. The insecticidal activity for the two spotted spider mite and green peach aphid was more effective the NR formulations (B. amyloliquefaciens PPL + Azadirachta indica and Derris elliptica). The spray concentration was diluted to 500 folds for two spotted spider mite and 1000 folds for green peach aphid. Therefore, B. amyloliquefaciens PPL, which is different from B. thuringiensis by Bt toxin protein, was found to improve the suppression of fungal pathogens as well as mortality of sucking pest. These results indicate that the formulations can simultaneously increase the possibility of bidirectional control on the antifungal and insecticidal effects.
Keywords:
Antifungal activity, Bacillus amyloliquefaciens PPL, Myzus persicae, plant extracts, Tetranychus urticae키워드:
항균활성, 아밀로리퀴페시언스 PPL, 복숭아혹진딧물, 식물추출물, 점박이응애서 론
농작물에 발생하는 주요 병해충들은 오래 전부터 광범위한 효과를 나타내는 화학합성농약 등을 사용하여 작물을 보호해 왔다. 최근에는 환경 및 인축에 큰 영향을 주지 않으면서 선택적 효과를 나타내는 작물보호제의 탐색과 개발도 활발히 이루어지고 있다. 하지만 장기간의 화학합성농약의 사용으로 인한 대상 병해충에 대한 저항성 발달 등의 문제가 야기되고 있다. 특히, 벼키다리병(Gibberella fujikuroi)은 benzimidazole계 살균제인 benomyl과 prochloraz 약제에 대한 저항성이 보고되었다(Ogawa and Takeda, 1990; Shin et al., 2008). 또한 점박이응애(Tetranychus urticae)와 배추좀 나방(Plutella xylostella) 등은 피레스로이드계, 유기인계, 카바메이트계 등의 살충제에서 높은 수준의 저항성 획득으로 방제에 어려움이 있다(Koh et al., 2009; Jeong et al., 2017). 미생물 살충제로 알려진 Bacillus thuringiensis (Bt)는 주로 섭식해충 방제용으로 cry toxin이라는 단백질이 주로 나방류 해충의 위장에서 작용하여 유충을 방제하는데 이용되고 있지만, 반복적인 살포로 인한 저항성 획득으로 살충효율이 떨어져 방제에 어려움을 겪고 있는 실정이다(Ferre and Van Rie, 2002). 그 중에 대부분의 농작물에 피해를 주는 해충으로 점박이응애와 복숭아혹진딧물(Myzus persicae)은 큰 문제를 야기하고 있다. 과수를 포함한 대부분의 원예작물을 가해하는 점박이응애는 초기에 잎이 백색으로 변색된 후 점차 갈색으로 변하고 고사하여 조기 낙엽 시킨다. 피해 잎은 가느다란 거미줄과 탈피껍질이 남아 있어 상품가치를 떨어 뜨린다. 또한 복숭아혹진딧물은 직접적인 흡즙으로 피해를 주며 감로를 분비하여 그을음병을 유발시키며 각종 바이러스를 매개하여 최근에 문제시되고 있는 해충 중의 하나이다.
이에 따라 주요 병해충 방제를 위해 환경문제 및 저항성 획득을 최소화하기 위한 효과적인 방법들로서 미생물과 천연식물추출물 유래 물질들을 응용하고 있다. 하지만 병해충 방제를 위해 사용되는 균주들은 대부분 국한되어 있으며, 배양조건에 의해 생산되는 대사물질의 양이나 농도에 의한 식물병원균의 항균능력에 대한 연구가 이루어져 왔다(Li et al., 2016). 또한 천연물질인 니코틴 계열, 로테논 계열, 님계열과 미생물 단백질 계열들은 주요 합성농약의 유효성분과 동일하거나 화학적인 가공을 위해 응용되었다. 님오일은 님나무(Azadirachta indica) 씨앗에서 추출한 azadirachtin을 주성분으로, 해충의 섭식을 저해하고 성장을 억제, 조절하며 탈피를 방지하는 등의 작용을 한다(Dayan et al., 2009). 니코틴은 Nicotiana tabaccum이나 Nicotiana rustica 같은 담배 잎의 니코틴을 주성분으로 유래 합성농약인 Imidacloprid등이 개발되어 진딧물 같은 흡즙성 해충 방제에 사용되고 있으며, 최근에는 파밤나방을 방제하기 위해 Bt와 혼합하여 이용되었다(Han et al., 2015). 또한, 데리스(Derris elliptica) 뿌리에서 추출한 주요 살충성분으로 알려진 로테논은 유충방제에서 유래하여 흡즙성 해충을 방제하는 접촉독성, 식독성 및 기피제로서(Kim and Kim, 2009), 채소류의 응애류, 배추흰나비, 총채벌레류, 잎벌레류, 바구미류, 과수의 진딧물류, 방패벌레류 등의 병해충에 효과가 있어 널리 사용되고 있다. 작물보호제들의 대상 병해충과 방제 효율을 높이기 위해 균주의 농도에 의존하여 병해충 방제제들이 개발되고 있지만, 화학 합성물질보다 만족스럽지 못한 방제 효율과 협소한 방제 대상을 극복하지 못하고 있다. 따라서 본 연구에서는 기존의 곤충 병원성 미생물 Bt를 탈피하여 풍부한 biosurfactants를 생산하고 항균활성이 우수한 B. amyloliquefaciens를 대상으로 기존의 배양방법을 변형 및 응용한 후 얻은 생산물과 식물추출물의 원료들을 혼합한 제형을 이용하여 환경문제 및 저항성 획득을 감소하면서 식물병원성 곰팡이병과 흡즙성 해충을 효과적으로 방제하고자 하였다.
재료 및 방법
균주 분리 및 동정
본 연구에서 사용된 생물적 방제균은 장수풍뎅이(Allomyrina dichotoma) 유충 분변 1 g을 9 ml의 phosphate buffer (pH7.5)에서 25oC, 100 rpm 조건으로 30분 동안 진탕 후 순차적으로 희석한 현탁액을 LB 배지에 200 ul씩 도말하여 28oC, 24시간 동안 배양하였다. 균주는 20% glycerol을 첨가하여 -80oC에서 저장하면서 동정과 활성 검정 실험에 사용하였다. 미생물의 동정을 위해 유전적 특성은 16S rRNA 유전자 분석을 수행하였으며, 균주를 LB 배지에서 배양한 후 Genomic DNA Prep Kit (Solgent Co., Ltd, Daejeon, South Korea)를 이용하여 genomic DNA를 추출하였다. 16S rRNA 유전자 증폭을 위해 universal primer는 27F (5'-AGAGTTTGATCATGGCTCAG-3')와 1492R (5'-GGATACCTTGTTACGACTT-3')을 이용하였다. 염기서열분석은 Solgent ASSA service (Solgent Co., Ltd, Daejeon, South Korea)에 의뢰하여 분석하였으며, 염기서열은 미국 국립생물정보센터(National Center for Biotechnology Information)에서 받아 MEGA6 program으로 계통도를 작성하였다. 계통도는 neighbor joining 알고리즘을 이용하여 작성하였고, Bootstrapping을 1,000회 반복하여 견고성을 확인하였다. 생화학적 특성은 Vitek2 compact system (bioMérieux, France)을 이용하여 46가지의 특성을 분석하였다. 순수 배양된 균주를 0.45% NaCl이 함유되어 있는 생리식염수에 혼합하여 Vitek densichek (bioMérieux, France)로 탁도 2 McFarland로 현탁한 후, BCL card (bioMérieux, France)에 분주하여 Vitek2 system에서 생화학 특성을 분석하였으며, Vitek2 Advanced Expert System (AES) software로 판독하여 균주를 동정하였다.
B. amyloliquefaciens PPL과 식물추출물 혼합제 제조 및 생물 검정
B. amyloliquefaciens PPL과 식물추출물 혼합 제형은 미생물 배양액과 식물추출 농자재들을 이용하여 제조하였다. B. amyloliquefaciens PPL은 MBP 배지(5% peptone, 5% mannitol, 1% mung bean extract, 0.45% yeast extract, 0.3% vegetable oil, 0.1% NaCl, 0.08% egg yolk)에서 28oC, 120 rpm으로 5일 진탕 배양하면서 1 × 108 cfu/ml 농도로 사용하였다. PPL 균주의 상등액을 회수한 후 0.2 μm membrane filter (Millipore Filter Corp., Bedford, MA, USA)로 여과하여 균을 제거하고 사용하였다. 식물추출물은 님(azadirachtin 0.75%), 데리스(rotenone 0.05%), 담배 잎 추출물(nicotine 2.2%)의 원재를 구입(그린포커스, 화성, 경기) 하였다. 미생물을 주요 재료로 사용하면서 님과 데리스 추출 혼합물(NR)과 담배 잎 추출 혼합물(TB)의 2종 제형물을 이용하여생물 검정을 하였다. 각 제형물의 혼합 농도와 살포농도는 미생물 상등액 60% (v/v), 님(Neem) 3% (v/v), 데리스(rotenone) 2% (v/v)와 담배 잎 추출물(nicotine)은 3% (v/v)의 유효성분과 보조성분을 혼합 제형 후 100배에서 1000배로 희석하여 살포하였다.
B. amyloliquefaciens PPL과 식물추출물 제형의 항균활성 검정
각 제형의 최종 농도가 0~30%와 Potato Dextrose Broth(PDB, Becton Dickinson GmbH) 배지 70~100%가 되도록 함유하고, agar 1.5%를 포함시킨 배지를 고압 멸균한 후 petri dish (60 mm × 15 mm)에 분주하여 평판배지를 만들었다. Potato Dextrose Agar (PDA, Becton Dickinson GmbH)에서 5일간 배양한 공시 병원균의 균사 선단에서 직경 5 mm의 균사 조각을 떼어내어 각 제형 함유별로 조제된 PDA 혼합 배지 위에 치상 3일 후 균사 생육 길이를 측정하였다. 균사 생육 억제율(%)은 제형물이 포함되지 않은 PDA에서 균사생육길이에 대한 각 제형 함유 비율별로 포함된 PDA에서의 균사 생육 길이로 나타냈다. 균사 생육 억제율(%) = (대조구 균총 길이 - 처리구 균총 길이) / 대조구 균총 길이 × 100. 각 처리는 독립적으로 3회 수행하였고, 수행 시 3반복 하였다. 본 연구에 사용된 식물병원성곰팡이병균들은 토마토 시들음병균 Fusarium oxysporum f. sp. lycopersici KACC 40043, 고추 탄저병균 Colletotrichum gloeosporioides KACC 40003, 벼 잎집무늬마름병원균 Rhizoctonia solani AG-1 KACC 40101로 이들 균주들은 농촌진흥청 국립농업 과학원 농업유전자원정보센터(Korean Agricultural Culture Collection (KACC), National Agrobiodiversity Center, Jeon-ju, Korea)에서 분양받아 사용하였다.
LC-MS/MS를 이용한 혼합 제형물의 biosurfactant 분석
각 제형물의 상층액을 n-butanol을 이용하여 유기용매 층을 분리하였다. 유기용매 분획층은 진공농축장치로 완전 농축하여 methanol로 녹인 후 0.2 μm syringe filter (Whatman, PTFE)로 여과하여 LC-MS/MS 분석을 위해 사용하였다. LC-MS/MS (API- 3200, AB SCIEX, Framingham, MA, USA) 분석에 사용된 컬럼은 Capcell Core C18 (2.1 mm I.D × 150mm, 2.7 um)이며, 분리용매는 A (0.1% formic acid in distilled water)와 B (0.1% formic acid in methanol)를 사용하였다. 모든 화합물은 ESI (electro spray ionization) 및 positive mode에서 이온화 하였고 MRM (Multiple Reaction Monitoring, Table 1) mode로 분석하였다. Biosurfactant의 표준용액은 Sigma-Aldrich에서 구입하였다: fengycin(CAS Number 102577-03-7), surfactin (CAS Number 24730-31-2), iturin A (CAS Number 52229-90-0). 각 표준액을 농도별로 희석하여 LC-MS/MS로 측정한 후 얻어진 크로마토 그램상의 peak 면적을 검량선과 비교하여 정량하였다.
Bacillus amyloliquefaciens PPL과 식물추출 제형의 해충방제 검정
본 실험에서 사용한 점박이응애와 복숭아혹진딧물은 전남 생물산업진흥원의 친환경농생명연구센터에서 분양 받아 25 ± 3oC의 유리온실에서 사육하였다. Petri dish (SPL, Insect breeding dish 90 × 15 mm, ventilation hole size 40 mm, Pocheon, Korea)에 일정한 크기(5 × 5 cm)의 수분이 공급된 filter paper와 탈지면을 놓은 후 고추 잎과 강낭콩 잎을 놓은 다음 복숭아혹진딧물과 점박이응애를 접종하였다. 복숭아혹진딧물은 무시충을 사용하였으며, 각 해충들을 엽절편 하나에 각각 20마리씩 접종하고 3반복 3회 검정하였다. Petri dish에 준비된 각 해충에 분무기로 1 ml씩 약제를 25 cm 거리에서 잎 절편에 골고루 묻게 살포한 후 약제 처리 후 1시간 동안 음건하였다. 각 처리구들은 25 ± 3oC(16L : 8D, RH 50~60%) 조건에서 보관하면서 생충수와 사충수를 조사하였다. 치사여부는 가는 붓으로 충체를 접촉하여 반응이 없거나 이동하지 못하는 개체를 죽은 것으로 판단하였다.
통계분석
각 처리 평균간의 차이에 의한 유의성 검정은 통계분석은 SPSS 23.0 software (IBM Corporation, Somers, New York, USA)를 사용하여 일원배치 분산분석을 한 후 F값에 의한 Duncan의 다중검정방법(Duncan's multiple range test)으로 유의수준 0.05에서 통계적 유의성을 검정하였다. 반수치사 시간(median lethal time: LT50)은 probit법(SPSS 23.0 software)을 이용하여 산출하였다.
결과 및 고찰
균주 분리 및 동정
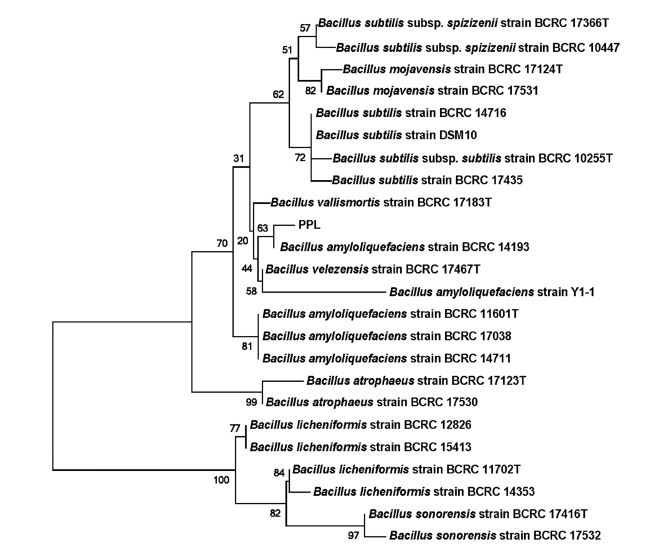
장수풍뎅이 유충에서 분리한 균주 PPL은 유전적 및 생화학적인 동정을 실시하였다. PPL 균주는 1.4 kb 16S ribosomal RNA 유전자 염기서열을 분석결과 B. amyloliquefaciens로 확인되었다(Fig. 1). Bacillus spp.의 분자계통도 분석결과에서 PPL 균주는 B. amyloliquefaciens BCRC 14193과 99.6%의 높은 상동성으로 일치하였다. 또한 염기서열을 바탕으로 한 계통수 분석에서도 Bootstrap 값이 63%로 비교적 높은 것으로 확인되었다. 다양한 식물병원균의 생물적 방제제로 활용되는 Bacillus 속 균주들은 토양 및 식물체 근권에 서식하면서 항균활성 및 식물의 생장을 촉진하는 것으로 보고되어 있다(Cawoy et al., 2011) 특히, B. amyloliquefaciens는 생물적 살충제와 생물비료로 응용되어 농업적인 측면에서 중요하게 이용되고 있다(Perez-Garcia, 2011; Li et al., 2015). 또한 PPL 균주는 Vitek 2 system을 이용한 생화학적 특성 검정 결과 B. amyloliquefaciens와 90% 유사하였다. PPL 균주는 β-xylosidase, Ala-Phe-Pro arylamidase, L-pyrrolydonyl-arylamidase, α-galactosidase, phenylalanine arylamidase, β-glucosidase를 생산하였고, D-mannitol, D-mannose, pyruvate, D-trehalose, palatinose, myo-inositol을 이용하였다. 또한 esculin hydrolysis, methyl-A-D-glucopyranoside acidification, tetrazolium red production, polymyxin B, kanamycin resistance을 나타냈으며 6.5%의 NaCl에서 견디는 특성으로 나타났다. 대부분 생물학 방제능력이 있는 B. amyloliquefaciens와 B. subtilis 들은 CLP를 포함한 다양한 biosurfactant들을 생성하여 항진균 및 항균 활성을 나타냈다(Mnif et al., 2016; Kang et al., 2017).
Bacillus amyloliquefaciens PPL과 식물추출 제형의 항균활성 검정
혼합 제형 2종 NR과 TB의 농도별 토마토 시들음병원균(F. oxysporum), 고추 탄저병원균(C. gloeosporioides), 벼 잎집무늬마름병원균(R. solani)에 대한 항균활성능력을 조사하였다(Fig. 2). 각 식물병원균에 대한 균사생육억제 능력은 제형물 종류에 따라 다소 차이는 있었지만 농도 함유량과 생육억제능력은 비례하였다. 즉 제형물 30% 함유된 PDA배지에서 공시한 병원성 곰팡이의 생육은 평균 62.2~66.6%의 항균활성을 나타냈으며, 특히 R. solani에 대해서 평균 75.9%로 두 제형물 모두 가장 높은 생장억제능력을 나타냈다. TB 제형물은 NR보다 F. oxysporum과 C. gloeosporioides에 대한 균사생장억제능력이 4.6~13.4% 더 우수하였으나, 농도가 높을수록 그 편차가 감소하였다. B. amyloliquefaciens의 TSB배지 배양 상등액이 40% 함유된 PDA에서 F. oxysporum, R. solani와 C. gloeosporioides에 대한 항균활성은 75.3~89.7%로 높은 억제능력을 나타낸 것으로 보고 되었다(Kang et al., 2017). TSB 배지에서 배양된 PPL 균주는 F. oxysporum과 R. solani에 대해서 30% 함유된 PDA 배지에서 80.4~87.1%로 항균활성이 높지만, C. gloeosporioides에 대해서는 69.2%의 균사생육억제능력이 있었다. 또한 B. amyloliquefaciens의 TSB 배양에서 공시된 병원균에 대한 항균활성이 60% 이상인 농도는 25% 이상일 경우 나타났으나(Kang et al., 2017), 본 연구의 혼합 제형물은 전체 유효성분의 함량은 감소되었지만 일부 병원균에 대해서 10% 함유농도에서 60% 이상의 항균능력이 있었다. 이런 결과들은 biosurfactant들을 생산하는 PPL 균주와 혼합된 식물추출물의 길항능력에 의한 상승작용이 항균활성능력을 더욱 높이는 결과를 가져왔다. Han et al. (2015)의 결과에서도 0.1~0.025% neem 단독 처리에 의한 파밤나방 유충살충율(6.7~0.0%)이 Bt와 혼합할 경우 함유 농도가 낮은 경우에도 살충율이 37~50% 증가하였다. 또한 TB와 NR 제형물에 함유된 5일 배양한 B. amyloliquefaciens PPL의 biosurfactant의 종류와 정량은 iturin A, surfactin, fengycin의 표준물질 피크와 추출물질의 크로마토그램 피크의 비교를 통해 실시하였다. Iturin A와 surfactin 표준물질의 검출시간은 각각 10.61분과 18.19분이었으며, fengycin 표준물질은 11.90, 12.48분이 유효 검출시간이었다(Fig. 3). 정량을 위해 LC-MS/MS의 피크면적을 계산한 결과 유효성분 iturin A는 8.5 mg/g이 검출되었고, fengycin과 surfactin 각각 185.6과 1.0 mg/g으로 검출되었다. 생물적 방제균 Bacillus sp. 항균물질은 cyclic lipopeptide 계통인 surfactin, iturin, fengycin 등을 생성한다고 알려져 있다. Surfactin은 직접적으로 항균 활성을 나타내거나 biofilm을 생성하여 식물 뿌리 표면에 병원균이 붙지 못하게 하여 식물을 보호하며, iturin과 fengycin은 다양한 병원균에 대해 강력한 항생작용을 한다고 알려져 있다(Ongena and Jaccques, 2008).
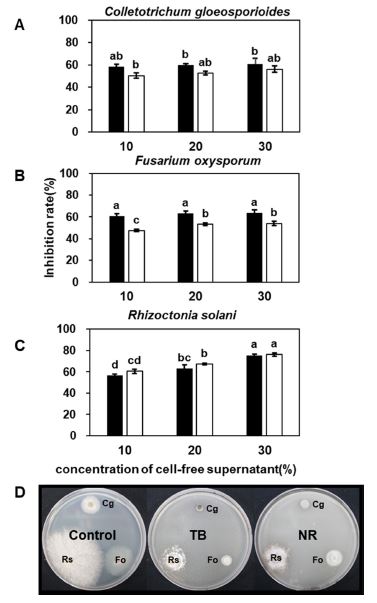
Effects of the TB and NR formulations grown on inhibition mycelial growth of phytopathogenic fungi (A-D). The fungal mycelial growth inhibitions of the formulations were determined on potato dextrose agar amended with different concentrations of formulations. A.Colletotrichum gloeosporioides KACC 40003 (Cg), B.Fusarium oxysporum f. sp. lycopersici KACC 40043 (Fo), C.Rhizoctonia solani AG-1 KACC 40101 (Rs). D. Antifungal activities of TB and NR formulations with 10% concentration against phytopathogenic fungal. The image is represented three independent experiments with similar results. Bacterial cells were grown in MBP broth at 28oC with shaking at 120 rpm. TB (■, B. amyloliquefaciens PPL + Nicotine) and NR (□, B. amyloliquefaciens PPL + Azadirachtin + Rotenone) formulations. Data were analyzed through ANOVA (P > 0.05), and if the F test was significant, differences were further elucidated through Duncan’s multiple range test. Different letters indicate significant different at P > 0.05.
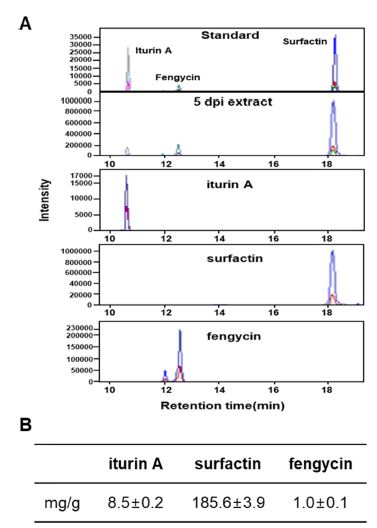
Biochemical analysis of cyclic lipopeptides produced by strain PPL. Bacterial cells were grown in MBP broth for 5 days at 28oC. The cell-free supernatants were acidified and extracted into n-butanol, and dissolved with methanol. A. LC-MS/MS total ion chromatogram profiles of the biosurfactants produced by B. amyloliquefaciens PPL grown on MBP broth. The top row profiles show the signal of positive molecular ions detected between 10 and 20 min. Note the difference in Y axis which are a direct indication of amounts. Standards were purchased from Sigma-Aldrich: fengycin (CAS Number 102577-03-7), surfactin (CAS Number 24730-31-2) and iturin A (CAS Number 52229-90-0). B. Values are given as milligram per gram of extract for each lipopeptide ± S.D. (n = 3 technical replicates only).
B. amyloliquefaciens PPL과 식물추출 제형의 해충 방제 효과
PPL 균주와 식물추출물의 혼합 제형물 NR과 TB의 처리 농도별로 딸기의 점박이응애와 고추의 복숭아혹진딧물을 대상으로 살충효과를 조사하였다. 점박이응애를 대상으로 NR을 처리한 결과 250~500배 농도까지 70%의 높은 살충율을 나타냈으며, 반수치사시간일은 3.60~6.74일이었다(Table 2). 하지만 750~1000배 농도까지 희석한 처리구에서는 21~40% 이하의 살충효과가 있었다. TB 처리구에서는 500배까지 희석한 처리구에서 58% 이상의 살충율을 나타냈다. PPL균주의 상등액을 50배 희석하여 처리한 경우 점박이응애에 대한 살충율은 28%로 효과가 낮았으나, 균주상등액과 식물 추출물을 혼합한 제형물 처리구에서는 53%까지 살충효과가 증대되었다. 살포 농도 500배 이상 처리구의 경우 PPL균주 처리구보다 높은 살충율을 나타냈으며 두 처리간의 통계적으로 모두 유의한 차이를 나타났다. PPL 균주의 대사물질이 함유된 물질은 점박이응애에 대해서 단독 처리할 경우 살충율이 낮았으나, 식물추출물과 혼합한 제형들에서는 그 효과가 상승하였다. TB 처리의 살포 농도가 높아질수록 살충율이 더 높아질 것으로 예상하였으나 250배에서 500배 희석농도에서는 통계적으로 유의한 차이가 없었다. 또한 NR과 TB의 처리구 모두 각각 750배와 1000배 농도부터 살충율이 급격히 감소하였다. 본 연구의 PPL 균주의 MBP 배지에서 사용된 배양 성분으로 egg yolk와 vegetable oil은 기존의 난황유라고 알려진 유기농자재의 주성분으로 이 현탁액을 이용하여 점박이응애 알에 대해 95%의 살란율과 성충에 대해 74.6% 이상의 높은 살비효과가 있는 것으로 보고되었다(Park et al., 2008). 본 연구에서는 이 성분을 일부 배양원으로 사용하여 배양한 PPL 균주에서 배양액에 함유된 대사물질과 님·데리스 추출물과 혼합하여 살포한 결과 500배 이상의 농도에서는 우수한 살비효과가 있는 것을 확인하였다.
복숭아혹진딧물의 처리 결과에서 NR을 1000배까지 희석한 처리구는 91~100%의 우수한 살충율을 나타냈으며, 반수치사시간은 1.18~4.74일이었다(Table 3). TB에서는 500배까지 희석한 처리구에서 97%의 높은 살충율을 나타냈으며, 반수치사시간은 1.12~2.57일이었다 1000배 처리구에서도 87%의 높은 살충율을 나타냈다. PPL 균주의 상등액을 50배 희석하여 처리한 경우 살충율은 79% 였으나, 식물추출물과 혼합한 제형물의 처리구는 8~21%의 살충효과가 증대되었다. 살포 농도 1000배 이상 처리구의 경우 PPL 균주 처리구 보다 높은 살충율을 나타냈으며 두 처리간의 통계적으로 모두 유의한 차이를 나타났다. 님과 데리스 혼합 제형물의 살포 농도가 높아질수록 살충율이 더 높아질 것으로 예상하였으나 250배에서 1000배 희석농도에서는 통계적으로 유의한 살충율의 변화가 없었다. 파밤나방 방제에서 고삼 추출물 단독 처리구가 Bt와 혼합 살포보다 2.7~13.3% 더 높은 살충율을 나타낸 결과와 달리 본 연구에서는 미생물의 대사물질과 식물추출물을 혼합할 경우 더 높은 살충효과를 나타냈다(Han et al., 2015). 이와 같이 일부 식물추출물은 미생물 또는 다른 성분과 혼용할 경우 살충율이 감소하는 경우도 있지만, 님과 같은 식물추출물은 혼용 시 상승작용 효과가 있는 것으로 알려져 있다(Moar and Trumble 1987; Han et al., 2015). 또한 Kim et al. (2009)의 연구에서 님(azadiracchitin 2%) 단독 처리한 경우 복숭아혹진딧물에 대한 살충율은 32~55%의 효과를 나타냈지만, 님은 고삼의 주요성분인 matrine과 혼용하여 살포하였을 때 목화진딧물 등의 해충에 대해 95% 이상의 높은 살충율을 나타냈다(Hwang et al., 2009). 님의 주요 살충성분인 azadiracchitin은 섭식저해, 탈피저해, 알의 부화 억제와 호르몬 균형 파괴 등의 작용 등 해충의 번식을 억제시키는 역할을 하면서, Bt 독소단백질의 해충 장내 수용체로의 접근과 결합에 관여하여 살충효과를 극대화시키는 것으로 알려져 있기 때문에 Bt 균주들과 주로 혼합하여 사용하였다(Moar and Trumble, 1987; Singh et al., 2007; Han et al., 2015). 또한 식물추출물은 대부분 약제 특성상 직접 접촉에 의한 독성효과가 높지만 잔효성이 낮아 살포 후 새로운 개체수 증가 시 살충효과가 낮아지기 때문에 다른 화합물 또는 미생물과 혼용하여 사용할 경우 효과가 극대화되는 것으로 나타났다. 따라서 본 연구는 Bt 독소 단백질에 의한 살충력이 강한 B. thuringiensis 와는 달리 B. amyloliquefaciens PPL을 이용하여 항균활성뿐만 아니라 살충능력도 향상시키는 결과를 얻었다. 또한 이런 결과들은 지금까지의 항균과 살충효과를 동시에 나타낼 수 있는 것에 대한 보고로서 동시 방제 가능성을 제고시키는 결과로서 처음이다.
Acknowledgments
본 연구는 농림축산식품부의 농림식품기술기획평가원 사업(118025-3)과 한국연구재단 이공분야기초연구사업(2018R1D1A3B07051266)의 지원에 의해 수행되었습니다.
References
- Cawoy, H., W. Bettiol, P. Fickers, and M. Ongena, (2011), Pesticides in the modern world-pestcides use and management, Bacillus based biological control of plant disease. InTech, Croatia, p273-302.
- Dayan, F. E., C. L. Cantrell, and S. O. Duke, (2009), Natural products in crop protection, Bioorg. Med. Chem, 17(12), p4022-4034.
- Ferre, J., and J. Van Rie, (2002), Biochemistry and genetics of insect resistance to Bacillusthuringiensis, Annu. Rev. Entomol, 47(1), p501-533.
-
Han, J. H., J. H. Yoon, S. J. Son, J. J. Kim, and S.Y. Lee, (2015), Combination effects of organic materials and Bacillusthuringiensis on Spodoptera exigua, Korean J. Pestic. Sci, 19(4), p411-417.
[https://doi.org/10.7585/kjps.2015.19.4.411]

-
Hwang, I. C., J. Kim, H. M. Kim, D. I. Kim, S. G. Kim, S. S. Kim, and C. Jang, (2009), Evaluation of toxicity of plant extract made by neem and matrine against main pests and natural enemies, Korean J. Appl. Entomol, 48(1), p87-94.
[https://doi.org/10.5656/ksae.2009.48.1.087]

-
Jeong, I. H., S. K. Lee, Y. Gao, S. W. Jeon, B. Y. Park, S. B. Lee, J. K. Jeong, S. W. Lee, S. H. Lee, and D. H. Kwon, (2017), Assessment of resistance levels of Plutella xylostella field populations to 11 pesticides and concept establishment for pesticide efficacy index, Korean J. Pestic. Sci, 21(2), p214-223.
[https://doi.org/10.7585/kjps.2017.21.2.214]

-
Kang, B.R., Y. H. Kim, H. S. Nam, and Y. C. Kim, (2017), Correlation between biosurfactants and antifungal activity of a biocontrol bacterium, Bacillus amyloliquefaciens LM11, Res. Plant Dis, 23(2), p177-185.
[https://doi.org/10.5423/rpd.2017.23.2.177]

-
Kim, I. S., and I. S. Kim, (2009), Status and future prospects of pest control agents in environmentally-friendly agriculture, and importance of their commercialization, Korean J. Environ. Agric, 28(3), p301-309.
[https://doi.org/10.5338/kjea.2009.28.3.301]

- Kim, S. K., J. H. Jin, C. K. Lim, J. H. Hur, and S. Y. Cho, (2009), Evaluation of insecticidal efficacy of plant extracts against major insect pests, Korean J. Pestic. Sci, 13(3), p165-170.
-
Koh, S. H., J. J. Ahn, J. S. Im, C. E. Jung, S. H. Lee, and J. H. Lee, (2009), Monitoring of acaricide resistance of Tetranychus urticae (Acari: Tetranychidae) from Korean apple orchards, J. Asia-Pacific Entomol, 12(1), p15-21.
[https://doi.org/10.1016/j.aspen.2008.10.004]

-
Li, H., M. A Soares, M. S. Torres, M. Bergen, and J. F. White Jr, (2015), Endophytic bacterium, Bacillus amyloliquefaciens, enhances ornamental host a resistance to diseases and insect pests, J. Plant Interact, 10(1), p224-229.
[https://doi.org/10.1080/17429145.2015.1056261]

-
Li, X., Y. Zhang, Z. Wei, Z. Guan, Y. Cai, and X. Liao, (2016), Antifungal activity of isolated Bacillus amyloliquefaciens SYBC H47 for the biocontrol of peach gummosis, PloS one, 11(9), p1-22.
[https://doi.org/10.1371/journal.pone.0162125]

-
Mnif, I., A. Grau-Campistany, J. Coronel-Leon, I. Hammami, M. A. Triki, Manresa A., and D. Ghribi, (2016), Purification and identification of Bacillus subtilis SPB1 lipopeptide biosurfactant exhibiting antifungal activity against Rhizoctonia bataticola and Rhizoctonia solani, Environ Sci Pollut Res Int, 23(7), p6690-6699.
[https://doi.org/10.1007/s11356-015-5826-3]

- Moar, W. J., and J. T. Trumble, (1987), Toxicity, joint action and mean time of mortality of Dipel 2X, avermectin B1, neem, and B. thuringiensis against beet armyworms (Lepidoptera: Noctuidae), J. Econ. Entomol, 80(3), p588-592.
-
Ongena, M., and P. Jacques, (2008), Bacillus lipopeptides: versatile weapons for plant disease biocontrol, Trends Microbiol, 16(3), p115-125.
[https://doi.org/10.1016/j.tim.2007.12.009]

-
Ogawa, K., and S. Takeda, (1990), Population of benomyl-resistant rice bakanae fungus in paddy field, Soc. Ann. Phytopathol. J, 56(2), p247-249.
[https://doi.org/10.3186/jjphytopath.56.247]

-
Park, J. H., K. Y. Ryu, B. M. Lee, and H. J. Jee, (2008), Effect of COY (Cooking oil and yolk mixture) on control of Tetranychus urticae, Korean J. App. Entomo, 47(3), p249-254.
[https://doi.org/10.5656/ksae.2008.47.3.249]

- Perez-Garcia, A., D. Romero, and A. de Vicente, (2011), Plant protection and growth stimulation by microorganisms: biotechnological applications and Bacilli in agriculture, Curr. Opin. Biotech, 22(2), p187-193.
- Shin, M. U., H. J. Kang, Y. H. Lee, and H. T. Kim, (2008), Detection for the resistance of Fusarium spp. isolated from rice seeds to prochloraz and cross-resistance to other fungicides inhibiting sterol biosynthesis, Korean J. Pestic. Sci, 12(3), p277-282.
-
Singh, G., P. J. Rup, and O. Koul, (2007), Acute, sublethal and combination effects of azadirachtin and Bacillus thuringiensis toxins on Helicoverpa armigera (Lepidoptera; Noctuidae) larvae, B. Entomol. Res, 97(4), p351-357.
[https://doi.org/10.1017/s0007485307005019]