
Pyraclostrobin에 대하여 저항성인 고추탄저병균의 균학적 특징 및 포장 적응력
초록
고추탄저병균 Colletotrichum acutatum 중에서 pyraclostrobin 저항성 3균주(15CY1, 15IS1, 15BY5)와 감수성 3균주(15BY4, 15MA1, 15GC1)를 선발하여 고추 열매에서 pyraclostrobin의 방제 효과와 포장 적응력을 조사하였다. Pyraclostrobin을 100 μg/mL 처리한 열매에 감수성 균주를 접종한 경우 탄저병에 대한 방제효과는 94.4%~100%로 효과가 우수하였던 반면에, 저항성 균주를 접종한 경우에는 7.3%~33.8%로 효과가 매우 낮았다. Pyraclostrobin 저항성 균주의 포장 적응력을 알아보기 위하여 PDA에서 균사생장, 고추 열매에서 포자발아, 병반에서 형성된 포자량을 조사하였는데, 저항성 균주와 감수성 균주 간에 유의적인 차이가 없었다. 하지만 셀로판막에서 침입률과 고추 열매에 대한 병원성을 실험한 결과, 저항성 균주가 감수성 균주보다 높은 침입률과 병원성을 보였다. 이상의 결과를 통해서 strobilurin계 살균제인 pyraclostrobin에 대해서 저항성인 C. acutatum의 포장 적응력은 감수성 균주보다 높을 것으로 예상되었다.
Abstract
The pyraclostrobin resistant 3 isolates (15CY1, 15IS1, 15BY5) and the sensitive 3 isolates (15BY4, 15MA1, 15GC1) were selected to investigate the control efficacy of pyraclostrobin on red pepper fruit and the field fitness of resistant isolates. When isolates sensitive to the fungicide were inoculated onto wounds on pepper fruits treated with 100 g/mL of pyraclostrobin, its control efficacy was very high from 94% to 100%. On the other hand, when inoculated with resistant strains, the efficacy was very low from 7.3% to 33.8%. In order to investigate the field fitness of C. acutatum isolates resistant to pyraclostrobin, the mycelial growth on PDA, spore germination on pepper fruits, and spores production on lesions were examined. There was no significant difference between resistant and sensitive isolates. However, as a result of the infection test on cellophane membranes and the pathogenicity test on pepper fruits, isolates of C. acutatum resistant to pyraclostrobin showed higher infection ratio and pathogenicity than the sensitive isolates. Based on the above results, it was expected that the field fitness of C. acutatum resistant to pyraclostrobin, a strobilurin fungicide, was higher than that of isolates sensitive the fungicide.
Keywords:
Colletotrichum acutatum, field fitness, pyraclostrobin, fungicide resistance키워드:
Colletotrichum acutatum, 포장 적응력, pyraclostrobin, 살균제 저항성서 론
고추는 남아메리카가 원산지로서, 현재는 아시아, 아프리카, 중남미, 동유럽 등의 아열대와 열대 지역에서 재배하는 주용한 조미채소이다. 전 세계적인 재배 면적은 190만 ha이며 생산량은 약 650만 톤이다(MacNeish, 1964; Vanitha et al., 2013). 가장 넓은 재배 면적을 가지고 있는 나라는 인도로, 전 세계 면적의 42.2%인 80만 ha에서 고추를 재배하며 연간 생산량은 140만 톤 정도이다(Adluri, 2017). 국내에서도 고추는 주요한 조미채소로서, 2018년 재배 면적은 28,824 ha이며, 9만7천여톤을 생산하고 있다. 매년 생산비가 증가하여 2018년 10 a 당 생산비가 367만원이었는데, 그 중에서 74.6%가 노동비이며 종자비와 농약비가 5.7%와 5.6%를 차지하고 있다(Korea Statistical Information Service, 2019). 최근 탄저병과 토마토반점위조바이러스에 대한 저항성 품종이 상품화되면서 종자비가 상승하여 농약비를 추월하였지만, 2017년까지는 노동비를 제외하면 농약비의 비율이 가장 높았던 것을 본다면, 고추의 생산비를 낮추어 농가소득을 증가시키는 방법 중의 하나가 농약 사용량을 줄이며, 효율적으로 사용하는 것이다.
식물병을 효율적으로 방제하기 위해서는 특별한 한 가지의 방제 방법만을 사용하기 보다는 여러 가지 방법을 종합적으로 사용해야 한다(Agrios, 2005; Adluri, 2017). 적절한 배수 관리, 윤작, 병든 식물의 제거와 같은 경종적 방제 방법, 다양한 천연물질과 미생물을 사용하는 생물적 방제 방법(Jeyalakshmi and Seetharaman, 1998; Rahman et al., 2013), 살균제를 사용하는 화학적 방제 방법, 그리고 최근에 상품화된 고추 탄저병 저항성 품종을 재배하는 방법(Rahman et al., 2011; Ridzuan et al., 2018) 등이 알려져 있다. 식물병을 방제하는데 특별한 효과적인 방법이 없을 경우 화학적 방제는 가장 효과적으로 사용할 수 있는 방법이다(Saxena et al., 2016). 국내에서도 고추 탄저병 방제를 위해서 149개 품목의 살균제가 등록되어 있는데(Korea Crop Protection Association, 2019), 이들을 작용기작별로 구분하면 6개의 작용기작 그룹에 속한다. 그 중 중요한 그룹이라면 스트로빌룰린계 살균제가 속하는 ‘다3군’, 트리아졸계 살균제가 속하는 ‘사1군’ 그리고 보호살균제가 속하는 ‘카군’ 등이다. 그 중 가장 최근에 개발된 ‘다3군’에 속하는 스트로빌룰린계 살균제를 대상으로, 2004년부터 고추 포장에서 분리한 병원균을 가지고 살균제 저항성 모니터링을 실시한 결과, 2015년에 분리한 균주에서 스트로빌룰린계 살균제에 대한 저항성균들이 검출되기 시작하였다(논문 투고 중).
살균제 저항성 병원균이 출현했을 때, 포장에서 저항성 관리를 위해서 출현한 저항성균의 fitness cost(적응력 부담치)를 조사하여야 한다. 만약 돌연변이에 의해서 살균제에 대한 저항성을 획득한 병원균이 fitness cost가 없다면, 살균제를 사용하지 않는다고 하더라도 저항성균의 밀도가 감소하지 않고 지속적으로 생존하게 된다. 그러한 살균제의 효과는 매우 낮을 것이며, 이러한 살균제를 다른 살균제와 혼합처리 또는 교호처리한다고 하더라도 뚜렷한 방제상의 잇점을 찾기가 어렵다. 하지만 fitness cost가 존재하는 저항성균이라면, 오랜 시간이 걸릴 수도 있지만 살균제를 사용하지 않음으로써 저항성균의 밀도를 감소시킬 수 있다(Mikaberidze and McDonald, 2015). 또 fitness cost가 존재하는 한, 대상 살균제를 낮은 수준으로 처리함으로써 살균제 저항성을 유발하는 선택압을 제거할 수도 있고, 원하는 수준의 방제효과를 얻을 수도 있다. 따라서 살균제 저항성 문제가 발생한 병원균에 대해서는 적응력 실험을 통해서 fitness cost가 존재하는 지의 여부를 검정해야 한다. Strobilurin계 살균제 저항성인 Alternaria alternata의 포장 적응력(fitness)을 조사하기 위해서 Karaoglanidis et al. (2011)은 배지 상에서 균사 생장 및 포자 형성, 병 발생 잠복기, 병원력, 식물 조직 위에서 포자 형성량 등을 조사하였으며, Plasmopara viticola는 잠복기간, 포자 형성과 침입 빈도 등을 조사하여 포장 적응력을 조사하였다(Corio-Costet et al. (2011).
본 실험에서는 2015년에 분리한 고추탄저병균 중에서 스트로빌룰린계 살균제에 속하는 pyraclostrobin에 대해서 저항성인 균과 감수성인 균을 3개씩 선발하여 실제 고추 열매에서 탄저병 방제효과가 떨어지는 지를 조사하였다. 또한 각 균주들의 균사생장, 포자 발아, 셀로판막 침입, 병반 상에서 포자 형성, 고추 열매에 대한 병원성 등을 조사하여, 고추탄저병균의 포장 적응력을 예측하고자 하였다.
재료 및 방법
실험에 사용한 병원균
2015년 충북 괴산을 비록한 주요 고추 재배지의 포장에서 병이 발생한 고추 열매를 채집한 후, 단포자 분리하여 얻은 탄저병균 Colletotrichum acutatum 균주 중에서 pyraclostrobin에 대한 감수성인 3균주(C. acutatum 15BY4, 15MA1, 15GC1), 그리고 저항성인 3균주(C. acutatum 15CY1, 15IS1, 15BY5)를 선발하였다. 선발한 모든 균주는 PDA 배지(potato dextrose agar; Becton, Dickinson and Company, DifcoTM)에 배양하여 4oC에서 보관하며 실험에 사용하였다.
병원균 접종 및 발병 조사
고추탄저병균을 PDA에 접종하고 25oC의 암조건에서 14일간 배양한 후, 멸균증류수를 이용하여 배지에 형성된 분생포자를 수확하였다. 수확한 포자현탁액을 4겹의 거즈에 여과하여 균사 등을 제거하고, 3,000 g로 15분간 2회 원심분리하여 분생포자를 세척하였다. 세척한 포자는 다시 멸균증류수에 현탁시켜 포자 밀도를 1×106개/mL로 조정한 다음, 접종원으로 사용하였다. 병원성 실험을 위해서 실험에 사용한 고추는 마니따 품종이며 푸른 고추를 사용하였다. 고추 열매는 1% NaClO 용액을 사용하여 1분간 표면 소독을 하고 증류수로 2회 세척한 후 실험실 내에서 풍건하여 사용하였다. 병원균을 고추 열매에 접종할 때에는 열매 표면에 인위적으로 상처를 내고 병원균을 상처 위에 점적하여 접종하는 상처 접종 방법과, 열매 표면에 상처를 내지 않고 포자현탁액을 분무 접종하는 무상처 접종 방법을 사용하였다. 상처 접종 때에는, 혈당침(ACCU-CHEK, softclix®)을 사용하여 고추 열매 표면에 상처를 내고, 상처 위에 준비한 병원균의 포자 현탁액을 10 μL씩 점적하였다. 무상처 접종은 상처를 내지 않은 열매 위에 준비한 병원균의 포자 현탁액을 고르게 분무하여 접종하였다. 탄저병균을 접종한 고추 열매는 습실처리한 플라스틱 용기(30 × 20 × 10 cm, W × L × H)에 넣어 25oC에서 5일간 습실 상태로 보관한 후, 뚜껑을 열고 상온에서 5일간 더 보관하면서, 접종한 탄저병균의 발병을 유도하였다. 플라스틱 용기에서 습도를 유지하기 위해서 종이 타올을 깔고, 200 mL의 증류수를 부어 주었다. 상처 접종 방법으로 병원균을 접종한 경우에는, 상처 부위에서 발생한 병반의 장경을 측정하여 병 발생 정도를 조사하였다. 하지만 무상처 접종 방법으로 병원균을 접종한 경우에는, 열매에 발생한 탄저병의 발생 정도를 발병지수로 조사하였다. 발병지수는 병이 나지 않은 것은 0, 병 발생 면적이 고추열매 면적의 10% 이하인 것은 1, 10% 이상 25% 이하는 2, 25% 이상 50% 이하는 3, 50% 이상은 4로 하였다.
한천희석법을 이용한 병원균의 pyraclostrobin 감수성 조사
실험에는 strobilurin계 살균제에 속하는 pyraclostrobin(a.i. 11%, SC)을 사용하였다. Pyraclostrobin의 최종 농도가 10, 2, 0.4, 0.08, 0.016, 0 μg/mL가 되도록 PDA 배지에 첨가하였다. 병원균은 PDA 배지에서 7일간 배양한 후, 균사 선단에서 직경 3 mm의 균사 조각을 떼어 살균제를 첨가한 PDA 배지에 접종하였다. 병원균을 접종한 배지는 25oC 암조건 배양기에서 7일간 배양한 후, 생장한 균총의 직경을 측정하였다. Pyraclostrobin의 균사생장 억제효과(%)는 아래식으로 계산하였다.
고추 열매에서 pyraclostrobin의 탄저병 방제 효과 조사
병원균은 상처 접종 방법으로 접종하였는데, 병원균을 접종하기 위해서 혈당침으로 상처를 낸 부위에 병원균을 접종하기 전에, 100, 10, 1, 0.1, 0 μg/mL의 농도로 조정한 pyraclostrobin (a.i. 22.9%, EC) 용액을 15 μL씩 점적하여 처리하였다. 살균제를 2시간 동안 실험실에서 풍건한 후, 포자 밀도를 1 × 106개/mL로 조정하여 준비한 포자 현탁액을 10 μL씩 점적하여 접종하였다. 병원균을 접종한 후, 위에서 기술한 방법과 같이 접종한 열매를 습실 처리한 플라스틱 상자에 넣어 탄저병의 발병을 유도하였다. Pyraclostrobin의 방제효과는 고추 열매에 형성된 병반의 장경을 측정하여 아래식으로 계산하였다.
균사 생장 조사
병원균인 C. acutatum을 PDA 배지에 접종하여 25oC의 암조건에서 7일간 배양한 후, 균사 생장을 조사하는 접종원으로 사용하였다. 균총의 선단부에서 지름 3 mm의 균사 조각을 떼어내어 새로운 PDA 배지에 접종하고, 25oC의 암조건에서 6일과 12일간 배양한 후에 C. acutatum의 균총의 길이를 각각 조사하였다.
고추 열매 표면에서 포자 발아율과 침입률 조사
선발한 균주의 포자 밀도가 1 × 106개/mL가 되도록 포자현탁액을 준비하고, 셀로판막(셀로판지, Bio-PeaceTM)을 올려놓은 고추 열매의 표면에 고르게 분무 접종하였다. 접종한 열매는 포화습도가 유지되도록 플라스틱 상자에 넣어 습실 처리를 하고, 접종한지 12, 24, 36, 48, 60, 72시간 후에 열매 표면에서 셀로판 막을 수거하여 포자 발아율을 조사하였다. 현미경으로 셀로판 막을 관찰하면서 포자의 발아관이 포자 장경보다 길게 형성된 경우만 발아한 것으로 인정하고 조사하였다. 포자의 침입률을 조사하기 위하여 접종한 지 36, 48, 60, 72시간 후에 셀로판막을 수거하여 zinic chlor-iodide 염색액(ZnCl2 50 g, Kl 20 g, I 0.5 g, 증류수 100 mL)으로 염색하여 조사하였다(Araki and Miyagi, 1977). 모든 처리는 3반복으로 실험하였고, 반복 당 100개의 포자를 조사하였다.
병반 상의 포자 형성량 조사
실험에 사용한 C. acutatum 6균주를 고추 열매에 각각 상처 접종하고 형성된 병반에서 분생포자의 수를 조사하였다. 앞에서 기술한 방법으로 병원균을 고추 열매에 상처 접종하여 발병을 유도하였다. 고추 열매에서 형성된 병반의 중앙부를 지름 3 mm인 원으로 잘라내어 형성된 포자 수를 조사하였다. 잘라낸 병반부를 2 mL tube에 넣고 충분히 흔들어 병반 위에 형성된 포자를 수확하였다. 혈구계산기를 사용하여 현미경 하에서 수확한 포자의 수를 조사하였고, 병반 면적(cm2)당 형성된 포자의 수를 계산하였다.
결과 및 고찰
Pyraclostrobin의 균사생장 억제효과
실험에 사용한 6균주 중에서 C. acutatum 15CY1, 15IS1, 15BY5는 pyraclostrobin에 대해서 저항성 반응을, 그리고 15BY4, 15MA1, 15GC1은 감수성 반응을 보였다(Fig. 1).
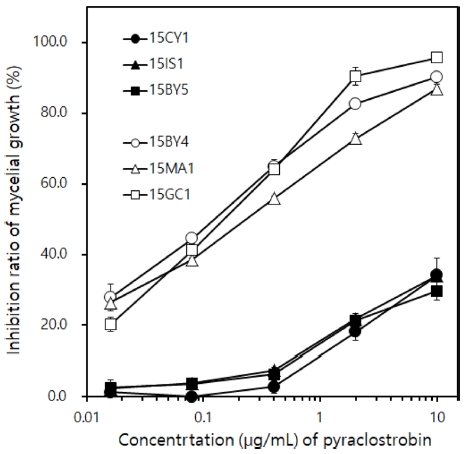
Inhibition effect (%) of pyraclostrobin on the mycelial growth of Colletotrichum acutatum causing pepper anthracnose on PDA with or without the fungicide at the indicated concentration. Among 6 isolates used in this experiment, resistant isolates (15CY1, 15IS1 and 15BY5) were indicated by closed symbols, while susceptible ones (15BY4, 15MA1 and 15GC1) was done by open symbols. Standard deviation bars are shown.
감수성인 15BY4와 저항성인 15BY5의 균사생장을 무처리 PDA 배지와 10 μg/mL pyraclostrobin PDA 배지에서 비교해 보면, 15BY4는 90.3%가 억제되는 반면에, 15BY5는 34.1% 밖에 억제되지 않았다. 이런 차이는 한천희석법을 사용하여 실험한 배지에서 뚜렷하게 확인할 수 있었다(Fig. 2)
고추 열매에서 pyraclostrobin의 병방제 효과
실험에 사용한 저항성 3균주와 감수성 3균주의 탄저병 방제효과를 고추 열매에서 실험하였다(Fig. 3과 4). 감수성인 15BY4, 15MA1, 15GC1은 100 μg/mL의 pyraclostrobin을 처리한 열매에서 100%, 94.4%, 100%의 우수한 효과를 보였으며, 처리하는 살균제의 농도가 낮아짐에 따라서 방제효과도 감소하였다. 하지만 100 μg/mL 처리구에서 조차 저항성인 15CY1, 15IS1, 15BY5의 방제효과는 33.8%, 7.3%, 22.7%로 매우 낮았다. 실험에 사용한 6균주는 실험실에서 PDA 배지를 사용하여 저항성 검정한 결과와 고추 열매 상에서 탄저병 발생을 억제하는 예방효과 간에 높은 상관관계가 있음을 알 수 있다.
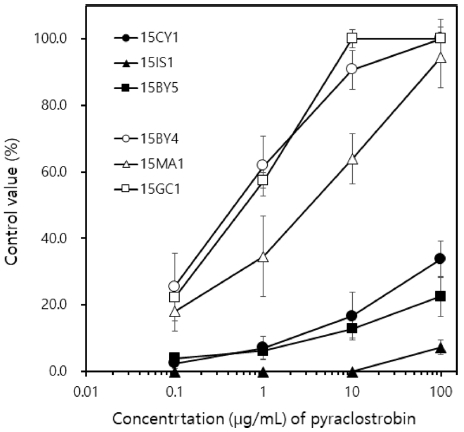
Controlling efficacy of pyraclostrobin against pepper anthracnose. Control efficacy was evaluated by inoculation test on pepper fruits. For inoculating the pathogen on pepper fruits, it was conducted an wound inoculation test. The solutions of pyraclostrobin prepared at different concentrations were dropped at 15 μL per wound. The spore suspension of Colletotrichum acutatum adjusted to 1 × 106 spore/mL was inoculated by dropping 10 μL per wound 2 hrs after application of the fungicide. The disease severity was investigated by measuring the length of lesion 10 days after inoculation. Standard deviation bars are shown.

Controlling activity of pyraclostrobin against pepper anthracnose caused by Colletotrichum acutatum on pepper fruits. Pyraclostrobin was treated at each indicated concentration by dropping 15 μL per wound 2 hrs before inoculation. A is a photograph of pepper inoculated with C. acutatum 15BY5 resistant to pyraclostrobin, B is one inoculated with C. acutatum 15BY4 sensitive to the fungicide.
균사 생장
Pyraclostrobin에 대한 저항성균의 균사 생장과 감수성균의 균사 생장을 25oC에서 비교하였는데, Fig. 5에서 보는 것과 같이 두 집단 간에는 차이가 없었다. 균사 생장의 차이는 살균제에 대한 저항성과 관련된 특징이라기보다는 각 균주 간의 특성이었다.
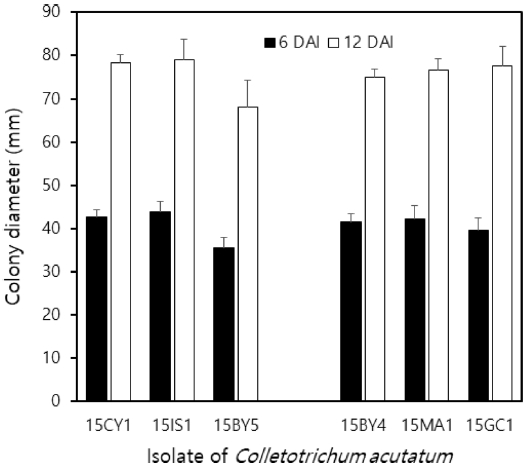
Mycelial growth of Colletotrichum acutatum on PDA at 25oC. For the experiment, 6 isolates, consisted with 3 resistant isolates (15CY1, 15IS1 and 15BY5) and 3 susceptible isolates (15BY4, 15MA1 and 15GC1), were used, of which colony diameter were measured after incubation for 6 (closed bar) and 12 days (open bar), respectively. Standard deviation bars are shown.
고추 열매 표면에서의 포자 발아율과 침입률
6균주 모두 셀로판막 위에서 12시간 배양한 후에는 50% 이상의 포자가 발아하였다. 다른 균주들에 비하여 저항성인 BY5와 감수성인 BY4의 발아율이 높았지만, 배양 시간이 길어지면서 저항성인 15CY1을 제외한 모든 균주 간에 발아율의 차이는 없었다. 72시간 배양한 후의 발아율을 보면 CY1만 77%가 발아하였고, 나머지 모든 균주는 85% 이상의 균주가 발아하였다. 조사한 각 배양 시간별로 발아율의 차이가 나타나는 것은 pyraclostrobin 저항성 여부가 균주의 발아율과 상관관계가 있는 것이 아니라, 각 균주가 가지고 있는 개별적인 특성이었다.
포자 침입률은 Araki와 Miyagi (1977)의 방법에 따라 zinc chlor-iodide 염색액으로 셀로판막을 염색하고 현미경으로 관찰하여 halo가 생긴 부위가 침입한 것으로 조사하였다. Fig. 6에서는 저항성인 15BY5와 감수성인 15BY4의 포자를 접종한 셀로판막을 zinc chlor-iodide 염색액으로 염색한 모습이다. BY4에 비해서 BY5 균주의 포자가 셀로판막에 대한 침입률이 높았다.
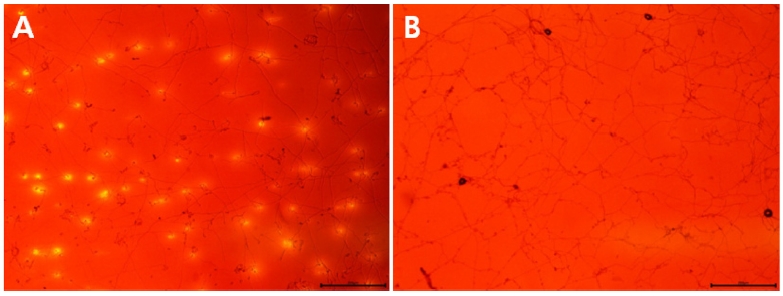
Penetration of Colletotrichum acutatum 15BY5 (A) and 15BY4 (B) on cellophane membrane. To observe the penetration of spores, the cellophane membranes were stained with zinc chlor-iodide solution after incubation at 25oC for 60 hrs. Each bar size was 200 μm.
BY5와 BY4뿐만 아니라 실험에 사용한 나머지 4균주의 결과를 비교하여 보아도 저항성인 15CY1과 15IS1이 감수성인 15MA1과 15GC1보다 침입률이 높았다. 결국 Table 2에서 보는 것과 같이 저항성 균주 모두가 다른 감수성 균주보다 침입률이 높았다. 감수성보다 저항성에서 침입률이 높은 경우는 본 실험뿐만 아니라 포도노균병균의 경우에도 보고되어 있다. Strobilurin계 살균제에 대해서 저항성인 Plasmopara viticola와 감수성인 균을 포도 잎 조각에 직접 접종하고 침입률을 조사한 결과, 저항성균의 침입률이 높게 나타났다.

Spore penetration ratio (%) of Colletotrichum acutatum isolates resistant or sensitive to pyraclostrobin on cellophane membrane placed on pepper fruits at 25oC
저항성균의 이런 특성은 선택압으로 살균제 처리가 없는 경우에 저항성균의 경합능력이 감수성균에 비해서 전혀 떨어지지 않는 이유가 되었다. 본 실험에서도 저항성균의 침입률이 감수성균보다 높기 때문에 고추 열매에 대한 병원성 역시 높게 나타났다고 생각한다.
병반 상에서의 포자 형성량
모든 균주의 포자 형성 능력을 비교하기 위해서 고추 열매에 6균주를 각각 접종하여, 병반 면적 당 형성된 포자의 수를 조사하였다. 그 결과 모든 균주 간에 통계적으로 유의성 있는 차이가 없었다(Fig. 7). 이 결과는 pyraclostrobin에 대한 저항성과 균주의 포자 형성 능력에는 차이가 없음을 보여 주었다.
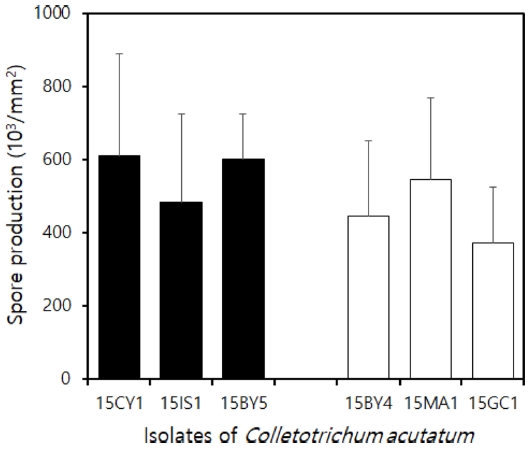
Spore production of each isolate of Colletotrichum acutatum at a lesion developed on pepper fruits. To inoculate each isolate of C. acutatum, pepper fruit was wounded, and the spore suspension prepared by adjusting spore density to 1 × 106 spores/mL was dropped on an wound by 15 μL. The disease development was carried out in the same method as described above. Standard deviation bars are shown.
탄저병 균주들에 대한 병원성 실험
Pyraclostrobin 저항성 3균주(15IS1, 15CY1, 15BY5)와 감수성 3균주(15GC1, 15BY4, 15MA1)의 고추에 대한 병원성 정도를 조사하기 위하여, PDA 배지에서 형성된 포자를 수확하여 고추 열매에 상처와 무상처 접종하였다. 상처 접종에서는 병 발생 정도를 병반의 직경을 측정하여 조사하였으며, 무상처 접종에서는 열매에서 발병 면적을 발병 지수를 이용하여 조사하였다. Table 3에서 보는 것과 같이 상처 접종에서는 저항성 균주와 감수성 균주 간에 통계적인 유의성이 없었다. 하지만 무상처 접종에서는 저항성 균주인 15IS1, 15CY1, 15BY5 세 균주의 병원성이 감수성 균주인 15GC1, 15BY4, 15MA1보다 강하였다. 이 결과는 Table 2의 결과와 부합하는 결과라고 생각한다. 이미 저항성 균주는 셀로판막에 대한 침입률이 감수성 균주보다 높게 나타났다. 상처를 내고서 병원균을 접종하는 경우, 병원균이 고추 열매를 침입하는데 막을 뚫고 침입할 필요가 전혀 없기 때문에 셀로판막에 대한 침입률과 병원성과는 전혀 관계가 없어보였다. 하지만, 무상처 접종을 실시할 경우에는 병원균이 고추 열매의 표피를 뚫고 침입해야 하기 때문에, 셀로판막에 대한 침입률이 높았던 저항성 균주가 열매에 대한 침입률도 높아 병의 발생이 많았을 것으로 생각한다.
살균제에 대하여 저항성인 병원균의 fitness cost (적응력 부담치)를 조사함으로써 저항성 관리를 위한 전략을 세우는데 필요한 여러 가지 정보를 얻을 수 있다(Fernández-Ortuño et al., 2008; Mikaberidze and McDonald, 2015). 그런데 fitness cost를 조사하는데 사용하는 요인은 일반적인 균학적 특성뿐만 아니라, 식물병원균에 따라서는 특별히 조사해야 하는 특성도 있다. 포도 노균병을 일으키는 Plasmopara viticola의 경우에는 병원균의 잠복기간, 포자 형성능력, 병원성 등을 조사하였고(Corio-Costet et al., 2011), Alternaria alternata, Botrytis cinerea, Colletotrichum acutatum의 경우에는 배지 상에서 균사생장과 포자발아를 조사하거나, 식물의 잎이나 열매에서 병원균의 병원성을 조사하였다(Karaoglanidis et al., 2011; Veloukas et al., 2014; Forcelini et al., 2018). 또한 A. alternata는 병원균을 접종하고 병징이 나타나기까지 잠복기간을 측정하기도 하였으며, Botrytic cinerea는 균핵 형성 능력과 다양한 조건에서 균핵의 생존력 등을 조사하기도 하였다. 포도노균병균인 Plasmopara viticola의 경우, 포자형성 능력과 병원균의 잠복기간 사이에 차이가 없었고, 저항성 균주가 감수성 균주보다 병원성이 높아, fitness cost는 없었다(Corio-Costet et al., 2011). 피스타치오에서 마름 증상을 일으키는 A. alternata의 경우, azoxystrobin에 대해서 저항성인 균주와 감수성인 균주가 배지 상에서 균사생장과 포자발아에 차이가 없었고, 기주식물에 대한 병원성은 저항성인 A. alternata가 감수성인 병원균보다 높았지만, 저항성 균주와 감수성 균주의 경합 실험에서는 균주에 따라서 경합 능력이 달라지는 결과가 나왔다(Karaoglanidis et al., 2011). 동일한 살균제인 azoxystrobin에 대해서 딸기에서 분리한 C. acutatum의 경우, 저항성인 균주와 감수성인 균주 사이의 균사생장, 병원성, 포자 형성 등에는 전혀 차이가 없었으며, 저항성인 C. acutatum은 감수성인 병원균과 경합 실험에서 그 밀도가 안정적으로 유지되었다(Forcelini et al., 2018). 또 다른 식물병원균인 B. cinerea의 경우, strobilurin계 살균제 저항성 균주는 감수성 균주와 비교하여 적응력이 떨어지지 않았지만, boscalid와 fluopyram과 같이 숙신산탈수효소 활성을 저해하는 살균제에 대해서는 감수성인 균주보다 저항성인 균주의 적응력이 감소하였다(Veloukas et al., 2014).
본 실험에서 고추탄저병균 C. acutatum의 PDA 배지에서 균사 생장과 고추 열매 위에서의 포자 발아 정도, 병반에서 형성된 포자량 등은 pyraclostrobin 저항성과 감수성 균주 간에 전혀 차이가 없었지만, 셀로판막에 대한 침입 정도와 고추 열매에 대한 병원성은 저항성 균주가 감수성 균주보다 크게 나타났다. 병원성 실험에서도 상처를 유발하고 병원균을 상처 부위에 접종한 경우에는 감수성 균주와 저항성 균주의 병원성 간에 통계적인 유의성이 없었지만, 상처를 유발하지 않고서 병원균을 접종하였을 때에는 Fig. 6과 Table 2에서 보는 것과 같이 셀로판막을 침입하는 능력이 우수하였던 저항성 균주의 병원성이 우수하였다. 본 실험에서 사용한 병원균을 가지고 경합 실험을 하지 않았기 때문에, 저항성과 감수성 균주 중에 경합 능력이 우수한 균주를 확정적으로 이야기할 수는 없으나, 포도노균병균처럼 침입력이 우수한 저항성 균주가 pyraclostrobin을 사용하지 않을 때조차 병원균 집단을 우점할 가능성이 높으며, pyraclostrobin을 사용한 상태에서 경합 실험을 한다면 그 결과는 더욱 뚜렷해질 것으로 예상한다. 따라서 pyraclostrobin에 대해서 저항성인 C. acutatum의 저항성 관리를 위해서 strobilurin계 살균제를 일정 기간 사용하지 않다가 다시 사용할 경우에도 저항성 균이 발생하였던 지역에서는 계속적으로 살균제 저항성이 문제가 될 소지가 클 것으로 생각된다. 따라서 저항성이 발생한 지역에서는 strobilurin계 살균제를 대체할 수 있는 다른 작용기작을 지닌 살균제의 개발이 필요하며, strobilurin계 살균제 저항성이 발생하지 않은 지역은 계속적인 저항성 모니터링과 더불어 저항성 발생이 용이한 살균제에 대한 철저한 저항성 관리가 필요하다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ0108212019)의 지원에 의하여 수행되었습니다.
References
- Adluri, P. K. (2017) A review on management of chilli anthracnose. Trends Biosci. 10:3719-3722.
- Agrios, G. N. (2005) Plant Pathology, 5th Ed. Academic Press, San Diego, p.922.
-
Araki, F. and Y. Miyagi (1977) Effects of fungicides on penetration by Pyricularia oryzae as evaluated by an improved cellophane method. J. Pesticide Sci. 2(4):457-461.
[https://doi.org/10.1584/jpestics.2.457]

-
Corio-Costet, M., M. Dufour, J. Cigna, P. Abadie and W. Chen (2011) Diversity and fitness of Plasmopara viticola isolates resistant to QoI fungicides. Eur J Plant Pathol. 129(2):315-329
[https://doi.org/10.1007/s10658-010-9711-0]

- Fernández-Ortuño, D., J. A. Torés, A. de Vicente and A. Pérez-García (2008) Mechanisms of resistance to QoI fungicides in phytopathogenic fungi. Int. Microbiol. 11:1-9.
-
Forcelini, B. B., C. S. Rebello, N. Wang and N. A. Peres (2018) Fitness, competitive ability, and mutation stability of isolates of Colletotrichum acutatum from strawberry resistant to QoI fungicides. Phytopathology 108(4):462-468.
[https://doi.org/10.1094/PHYTO-09-17-0296-R]

- Jeyalakshmi, C. and K. Seetharaman (1998) Biological control of fruit rot and die-back of chilli with plant products and antagonistic microorganisms. Plant Dis. Res. 13:46-48.
-
Karaoglanidis, G. S., Y. Luo and T. J. Michailides (2011) Competitive ability and fitness of Alternaria alternata isolates resistant to QoI fungicides. Plant Dis. 95(2):178-182.
[https://doi.org/10.1094/PDIS-07-10-0510]

- Korea Crop Protection Association (2019) Instructions for use of pesticide. pp.1695.
- Korea Statistical Information Service (2019) Agriculture, forestry and fishery statistics. http://kosis.kr/statisticsList/statisticsListIndex.do?menuId=M_01_01&vwcd=MT_ZTITLE&parmTabId=M_01_01, .
-
MacNeish, R. S. (1964) Ancient Mesoamerican civilization. Science 143(3606):531-537.
[https://doi.org/10.1126/science.143.3606.531]

-
Mikaberidze, A. and B. A. McDonald (2015) Fitness cost of resistance: Impect on management, In Fungicide resistance in plant pathogens; Ishii, H. and D. W. Hollomon, Eds; Springer: Japan, pp.77-89.
[https://doi.org/10.1007/978-4-431-55642-8_6]

- Rahman, M. A., M. A. Razvy and M. F. Alam (2013) Antagonistic activities of Trichoderma strains against chili anthracnose pathogen. Int. J. Microbiol. Mycol. 1(1):7-22.
- Rahman, M. S., M. S. Akhter, M. A. Maya, A. H. M. A. Rahman and A. M. Akanda (2011) Field resistance of chilli cultivars against anthracnose disease caused by Colletotrichum capsici. Thai J. Agri. Sci. 44(4):243-250.
-
Ridzuan, R., M. Y. Rafii, S. I. Ismail, M. M. Yusoff, G. Miah and M. Usman (2018) Breeding for anthracnose disease resistance in chili: progress and prospects. Int. J. Mol. Sci. 19(10):3122-3143.
[https://doi.org/10.3390/ijms19103122]

-
Saxena, A., R. Raghuwanshi, V. K. Gupta and H. B. Singh (2016) Chilli anthracnose: epidemiology and management. Front. Microbiol. 7:1-18.
[https://doi.org/10.3389/fmicb.2016.01527]

- Vanitha, S. M., S. N. S. Chaurasia, P. M. Singh and P. S. Naik (2013) Vegetable statistics. Tech. Bull. IIVR 51:250.
-
Veloukas, T., P. Kalogeropoulou, A. N. Markoglou and G. S. Karaoglanidis (2014) Fitness and competitive ability of Botrytis cinerea field isolates with dual resistance to SDHI and QoI fungicides, associated with several sdhB and the cytb G143A mutations. Phytopathology 104(4):347-356.
[https://doi.org/10.1094/PHYTO-07-13-0208-R]

