플라즈마 활성종을 이용한 딸기 및 토마토의 잔류농약 분해에서 오존 농도 및 접촉 시간과의 관계
초록
본 연구에서는 플라즈마 활성종 중 오존에 의한 작물 표면의 잔류 농약 제거능을 평가하기 위해 오존의 농도와 접촉 시간을 주요 변수로 실험을 수행하였다. 강력한 산화제인 오존을 발생시키기 위해 유전체 격벽 방식(Dielectric Barrier Discharge, DBD)의 플라즈마 발생원을 사용하였으며 오존의 농도는 1, 80 uL/L, 접촉시간은 10분과 60분의 조건으로 실험을 수행하였다. 딸기와 토마토의 표면에는 각각 20종의 농약을 도포하여 실험하였으며 두 작물에서 제거된 농약 중 통계분석이 가능한 4종을 선정하여 분석하였다. 토마토와 딸기 표면에서의 잔류농약 평균제거율은 각각 14%, 23%이며 작물별 특성을 살펴보면 토마토는 접촉시간의 영향을 많이 받으며 딸기는 오존 농도에 의한 영향을 많이 받는 것으로 확인되었다.
Abstract
The ozone is powerful reactive species to decompose the pesticide residues on the strawberry and tomato surfaces. Dielectric barrier discharge (DBD) was used as a plasma generating source using oxygen gas to generate ozone. The experiment was carried out by changing the contact time and the ozone concentration in order to confirm the ability to remove the residual pesticides. 20 species highly used pesticides were coated on the surface of strawberries and tomatoes. Reasonable 4 pesticide species were analyzed among the 20 species. The average pesticide removal rates on tomato and strawberry are 14%, 23%, respectively. The strawberry is sensitive to ozone concentration, on the other hand contact time affects more to tomato than strawberry.
Keywords:
Ozone, Plasma, Residual pesticide, Strawberry, Tomato키워드:
오존, 플라즈마, 잔류농약, 딸기, 토마토서 론
2019년 3분기 기준으로(1월~9월) 농축산물 무역 규모는 수출액 52억달러, 수입액 260억달러(KREI, 2019)이며 해마다 무역 규모는 점점 커지고 있으나 실질적으로 무역 수지는 큰 적자를 면하지 못하고 있다. 무역 수지 개선과 국민생활 수준의 향상을 위해서 농산물의 품질 향상은 반드시 필요하다.
농산물을 포함한 식품에서의 상품성 유지 또는 향상, 수송과 저장성 향상, 식량의 용도를 다양하게 하기 위한 목적으로 여러 형태의 식품가공(Food Processing) 방법을 사용하고 있으며 식품가공의 중요한 효과 및 목적 중 하나는 독성 물질을 제거하기 위한 것이다(Kaushik et al., 2009).
농산물 안전에서의 중요한 독성물질인 농약의 경우 소비자의 건강에 영향을 끼칠 수 있다는 부정적 인식에도 불구하고 농작물의 병해충 피해에 대한 안전성을 높이고 수확량을 확보할 수 있는 방법이기에 현재까지도 널리 사용되고 있다. 잔류농약의 제거를 위해 다양한 형태의 식품 가공 방법이 적용되고 있으며 이러한 선행 연구들에 대해 조사, 분류해 놓은 연구 조사도 있다(Keikotlhaile et al., 2010).
재료를 세척하거나 껍질을 벗기는 형태의 1차 가공에서부터 발효시키거나 굽거나 끓이거나 즙을 만들거나 통조림을 만드는 등의 2~4차 가공 방법을 통해 제품의 활용도와 품질을 높일 수 있으며 이 방법들 중 일부는 잔류농약을 제거하는 방법을 포함하기도 한다(Kaushik et al., 2009). 하지만 각각의 식품가공 방법으로 잔류농약을 제거할 경우 문제점이 발생하는 경우도 있는데 예를 들어, 세척(washing)만으로는 비극성 농약(non-polar pesticides)을 제거하기 쉽지 않으며, 껍질을 벗기거나(peeling) 데치는(hot water blanching) 방법은 품질저하, 열해 등의 문제가 발생할 수 있다(Kaushik et al., 2009).
플라즈마 처리는 수확 후 농산물의 잔류농약을 제거하는 좋은 대안이 될 수 있다. 대기압 상에서 플라즈마를 발생시키면 O, O2+, O3, OH*, NO나 NO2와 같은 산화 특성을 갖는 활성종들이 만들어지는데 이 중에는 유기물과 반응성이 높은 물질도 포함된다. 특히 오존의 경우 대기압 상에서 플라즈마를 발생시켜 만들 수 있는 대표적인 활성종이고 이오존을 이용해 잔류 농약을 제거하는 연구는 꾸준히 진행되어 왔다(Wang et al., 2019; Bai et al., 2010; Souza et al., 2018; Dorraki et al., 2016; Zhou et al., 2018).
딸기에 4종(azoxystrobin, cyprodinil, fludioxonil, pyriproxyfen)의 농약을 도포 후 전기적 조건을 달리하여 직접 처리하는 방식으로 잔류농약을 제거하는 연구(Misra et al., 2014), 밀폐된 저온 환경에서 표면에 농약(Paraoxon)을 도포한 사과를 원격 플라즈마(remote plasma) 처리하여 잔류농약을 제거하는 연구(Heo et al., 2014)등 플라즈마를 이용한 잔류농약 연구는 다양한 방법으로 시도되고 있다.
플라즈마 처리, 특히 산화력을 갖는 활성종을 이용하는 간접 플라즈마 처리 방식은 잔류농약을 제거하는 효율적인 방법임과 동시에 작물의 품질 저하를 줄일 수 있는 처리 방법이며 이에 대해 여러 선행 연구가 수행되었지만 다양한 종류의 플라즈마 처리 방식, 수많은 종류의 농약 그리고 무수히 많은 농작물이 있는 만큼 앞으로 연구해야 할 수 많은 과제가 있다. 따라서 본 연구에서는 플라즈마 활성종 중 오존의 농도와 접촉시간에 따른 작물과 농약별 잔류농약 제거에 대한 연구를 수행하고자 한다.
재료 및 방법
플라즈마 발생원 및 가스 분배 시스템
잔류농약 제거를 위한 실험에 사용된 플라즈마 발생원은 유전체 격벽방전(DBD, Dielectric Barrier Discharge)방식을 사용하였고 가스 종류와 유량의 원활한 제어를 위해 실린더 구조로 제작되었다(Fig. 1 (A)). 전극의 전체 길이는 200 mm이며, 알루미늄(AL6061) 재질의 접지 전극이 중심에 있고, 1.5 mm 간격으로 1 mm 두께의 유전체역할의 석영관이 둘러져 있으며, 그 석영관 외부에 폭 10 mm의 구리 테이프가 고전압 전극으로써 부착되어 있는 구조이다. 플라즈마 발생을 위해 고전압 증폭기(TREK 20/20C-HS, Trek Inc.)와 함수 발생기(AFG3021C, Tektronix)를 사용하였다.
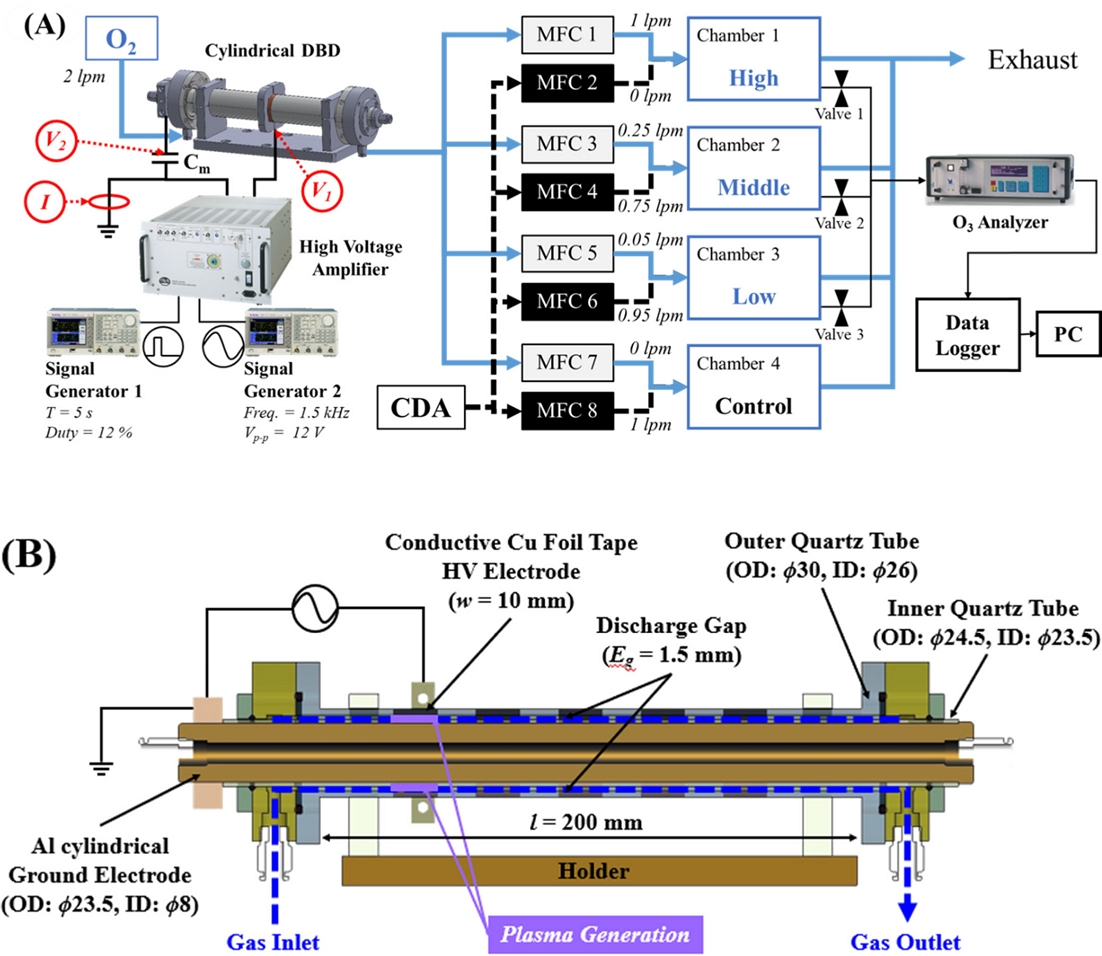
(A) Residual pesticide removal plasma system including gas distribution system and (B) Cylinder type DBD plasma source structure diagram.
단일 플라즈마 발생원을 사용하여 여러 농도의 오존을 생성하기 위해 가스 분배 시스템을 제작하였다. 가스 분배 시스템은 플라즈마 발생원에서 생성되어 공급된 고농도의 오존을 건조공기(Clean Dry Air, CDA)와 혼합해 여러 농도의 오존으로 만들어 각 실험 챔버에 공급하였다. 본 실험에서는 고농도, 중농도, 저농도의 오존과 순수 CDA의 4종류의 가스를 공급하도록 설정하였다(Fig. 1 (B)).
플라즈마의 특성을 구분하기 위해 고려되는 주요 요소는 전기적 특징과 가스상 활성종이 있다. 전기적 특성 측정을 위한 장치로 전압은 고전압 프로브(P6015A, Tektronix), 전류는 전류변환기(110A, Pearson)를 사용하여 오실로스코프(DPO4104B-L, Tektronix)를 통해 측정하였다. 가스 활성종중 오존을 측정하기 위해 오존 측정기(GM-6000PRO, Anseros)를 사용하였다.
플라즈마 발생원의 운전 방법은 간헐적 방전 방식을 사용하였다. 1 uL/L의 경우 100초마다 0.1초씩 반복 방전하였고 이때 전압과 주파수는 각각 24 kVpp, 5 kHz이다. 80 uL/L의 경우 3.5초마다 1.5초씩 반복 방전하였고 전압과 주파수는 각각 24 kVpp, 1 kHz이다.
농약의 선정 및 실험 방법
실험에 사용된 농약은 다빈도 검출 농약 중 20종을 선정하였으며 Table 2과 같은 농도로 3차 증류수에 희석하여 사용하였다. 농약의 초기 잔류 농도는 농약안전사용지침(RDA, 2019)을 참고하여 딸기는 잔류농도 1 mg/kg, 토마토는 0.5 mg/kg가 되도록 결정하였다. 예비 실험을 통해 물 8 L 기준으로 Table 2에 표시된 것처럼 딸기는 각각의 농약 농도범위가 15~75 mg/kg, 토마토는 50~500 mg/kg인 침지액을 제조하여 딸기와 토마토를 침지하고 건조하였고, 이때 각 작물 중 농약의 잔류량은 설정기준치인 약 1 mg/kg, 0.5 mg/kg에 가깝게 측정됨을 확인하였다.
농약을 도포한 작물을 원격으로 개방 가능한 5 L의 밀폐용기 내에 각각 3개씩 위치시키고 이 밀폐용기(5 L)를 30 L의 플라즈마 반응챔버에 설치한 후 플라즈마를 발생시켜 반응챔버의 활성종 농도를 각 목표 농도(1, 80 uL/L)로 설정하였다. 각 목표 농도에 도달하면 5 L 밀폐용기를 개방하여 플라즈마 활성종과 작물을 10분 및 60분간 접촉시킨 후 시료를 채취하였다.
잔류농약 분석방법
시험작물 중 잔류농약 분석방법(Oh et al., 2019)은 QuEChERS 법과 Agilent사의 LC-MS/MS를 사용하였다. 시료 10 g에 1% acetic acid이 포함된 acetonitrile을 첨가하고 QuEChERS 추출기(1600 mini-G, SPEX sample Prep, Metuchen, USA)를 이용하여 1,300 rpm으로 2분간 추출하였다. 그후 EN Extraction kit (4 g MgSO4, 1 g NaCl, 1 g NaCitrate, 0.5 g disodium citrate sesquihydrate)을 첨가하고 다시 추출기를 이용해 1,300 rpm으로 30초간 진탕한 후 3,500 rpm으로 5분(4oC)동안 원심 분리하였다. 정제는 상징액 8 mL을 15 mL의 EN-General d-SPE tube (900 mg MgSO4, 150 mg PSA (primary secondary amine))에 가하여 1분간 진탕한 후 3,500 rpm에서 5분간 원심분리 하였다. 이후 0.2 um syringe filter를 통과시킨 상징액 500 uL와 acetonitrile 500 uL를 혼합한 후 LC-MS/MS로 기기 분석하였다. LC-MS/MS의 분석조건은 Table 3과 같다.
결과 및 고찰
플라즈마 발생원 전기, 화학적 특성
전압과 전류의 파형은 Fig. 2와 같이 DBD방전의 형태를 띄고 있으며 2.16 nF의 Dummy 축전기를 이용하여 Lissajou Curve를 측정하여 확인한 전력은, 1 uL/L의 경우 0.67W, 80 uL/L의 경우 0.4W의 전력이 소모되었다.
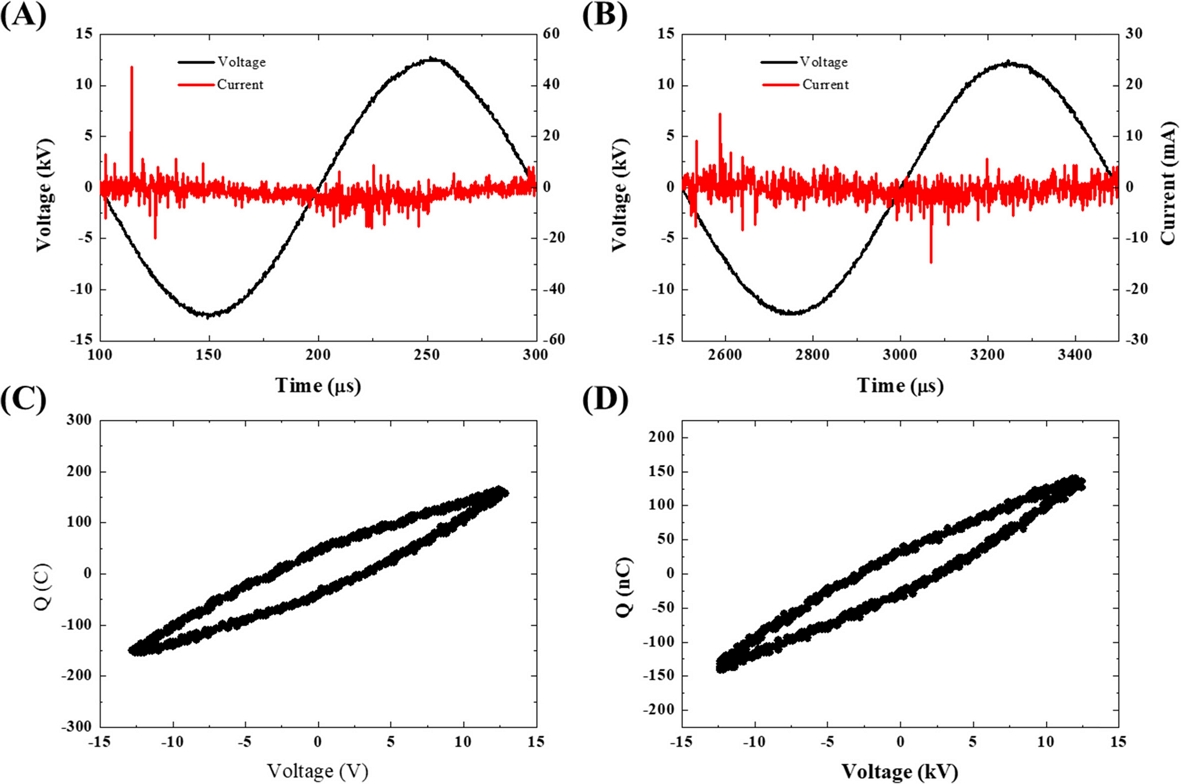
Voltage, current waveforms when generating (A) 1 uL/L ozone, (B) 80 uL/L ozone and Lesaju when generating (C) 1 uL/L ozone, (D) 80 uL/L ozone according to plasma conditions.
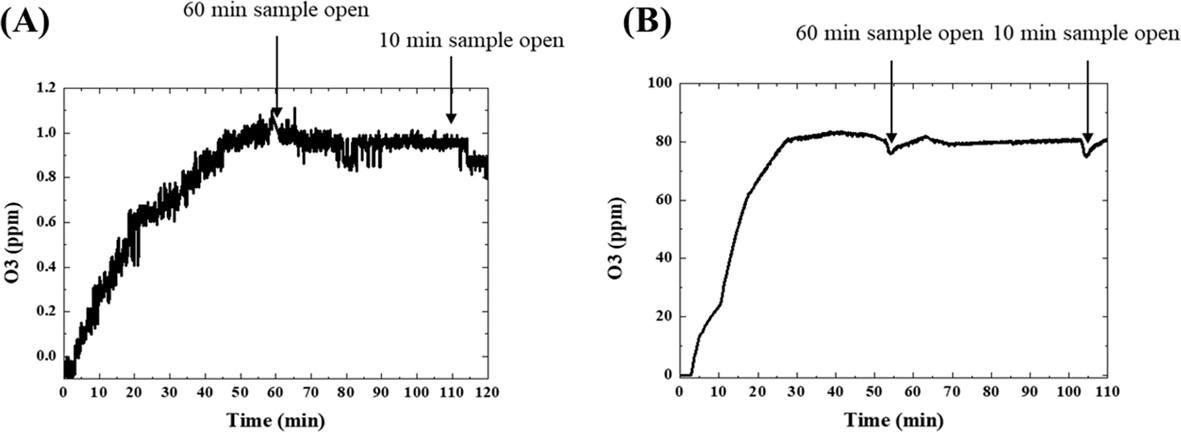
플라즈마 발생원을 이용하여 운전조건별 발생하는 오존의 농도를 측정하였다. 목표 오존농도를 1과 80 uL/L으로 설정하였고 각각 50분, 30분 후에 목표 농도에 도달하였다.
오존농도 및 접촉시간에 따른 20종 농약의 분해율
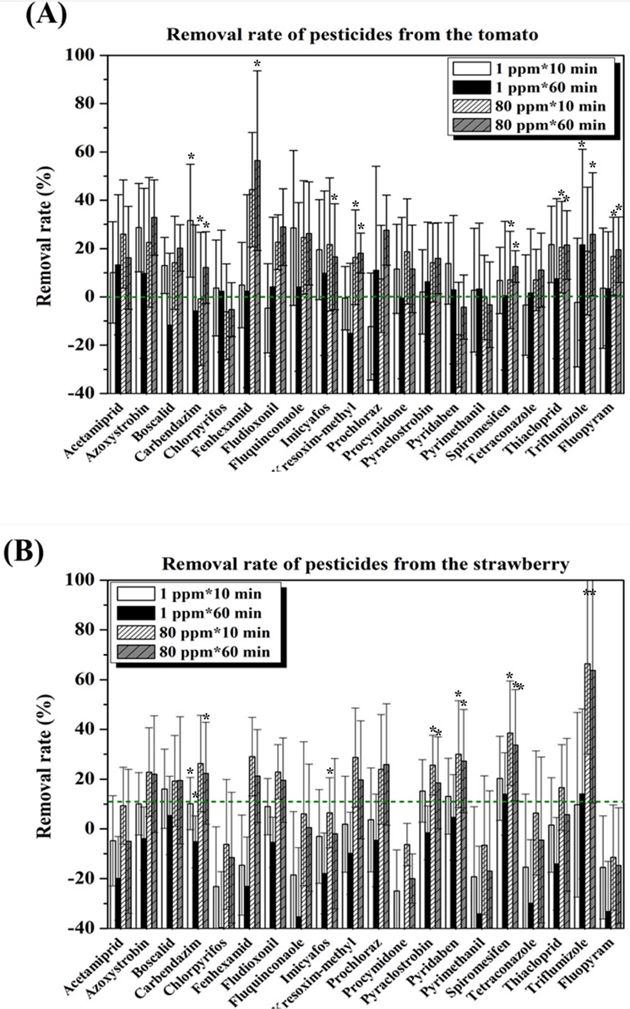
토마토 및 딸기 중 잔류농약의 분해율은 Fig. 4에 제시하였다. 토마토 중 Fenhexamid의 잔류량은 80 uL/L 농도의 오존을 10분과 60분 처리한 결과 초기 농도 0.56 mg/kg에서 처리 후 각각 0.31 mg/kg, 0.24 mg/kg 으로 초기 잔류량 대비 각각 44%와 56%의 농약이 제거됨을 확인하였고 딸기 중 Triflumizole의 잔류량은 80 uL/L 농도의 오존을 10분과 60분 처리한 결과 초기 농도 0.063 mg/kg에서 처리 후 각각 0.021 mg/kg, 0.022 mg/kg으로 초기 잔류량 대비 각각 66%와 64%의 농약이 제거됨을 확인하였다. 그러나, 전반적으로 편차가 커서 의미 있는 분석을 위한 농약종의 선별이 필요하다.
분석을 위한 농약 선별
본 연구의 모든 실험은 3회 반복 수행하였다. 그 결과는 SPSS 통계프로그램(version 24.0, SPSS Institute Inc., USA)의 일원배치 분산분석 (One-way ANOVA)을 사용하여 분석하였으며, 유의성은 p<0.05 수준에서 Duncan’s multiple range test로 검증하였다.
토마토 잔류농약의 경우 제거율이 -5% 보다 낮게 나오는 경우인 boscalid, carbendazim, chlorpyrifos, kresoxim-methyl, prochloraz, pyridaben 등을 제외하고 다시 분석을 하고 딸기 잔류농약의 경우 마찬가지로 제거율이 -5% 보다 낮게 나오는 경우인 acetamiprid, carbendazim, chlorpyrifos, fenhexamid, fludioxonil, fluquinconaole, imicyafos, kresoximmethyl, procymidone, pyrimethanil, tetraconazole, thiacloprid, fluopyram 등을 제외한 후 두 작물에서 공통으로 존재하는 농약은 azoxystrobin, pyraclostrobin, spiromesifen, triflumizole의 4종을 확인할 수 있었다. 따라서 이 4종에 대해 오존농도별, 접촉시간별, 작물별 영향을 분석하였다.
농약에 따른 작물별 제거율
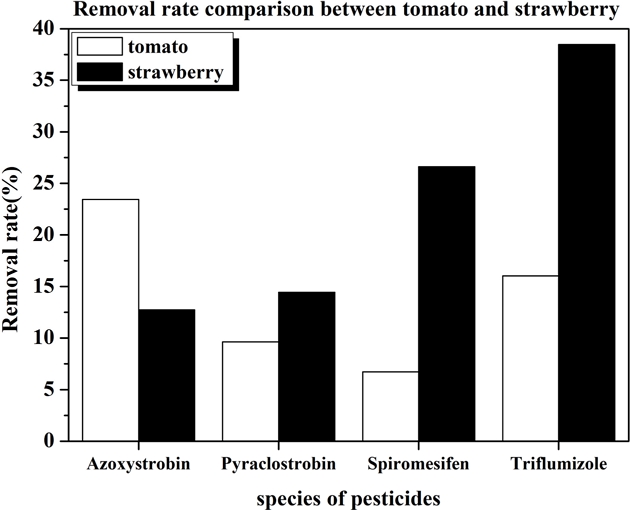
먼저 작물별 각각의 농약에 대한 분해율을 Fig. 6에 표시하였다. Azoxystrobin에 대해서는 토마토의 제거율이 딸기의 제거율보다 높았으나 pyraclostrobin, spiromesifen, triflumizole의 경우는 딸기에서의 제거율이 높았고 4종의 농약제거율을 모두 평균을 내면 토마토의 경우 14%, 딸기의 경우 23%의 농약이 제거되어 딸기에서의 잔류농약이 더 많이 제거되었음을 확인하였다. 작물에 따라 농약 분해 효과가 달리 나타나는 현상에 대한 원인 분석을 위해 추가연구가 필요하다.
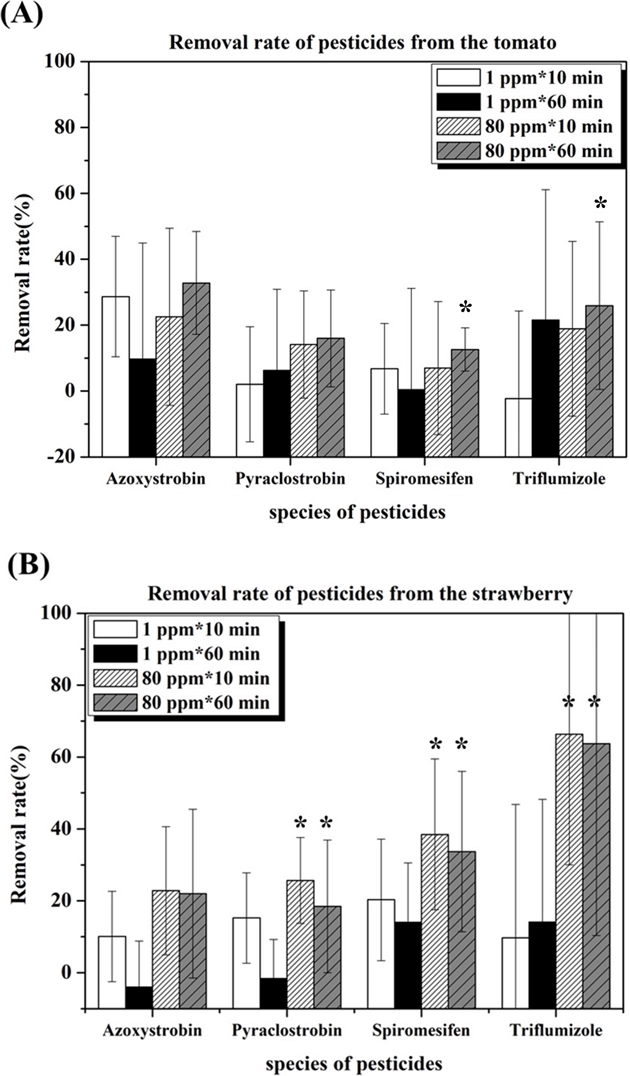
Comparison of Residual Pesticide Removal Rate of (A) Tomato and (B) Strawberry about 4 Pesticides by Plasma Condition. (* indicates significant difference from control group p<0.05).
오존 농도와 접촉시간에 따른 잔류 농약 분해율
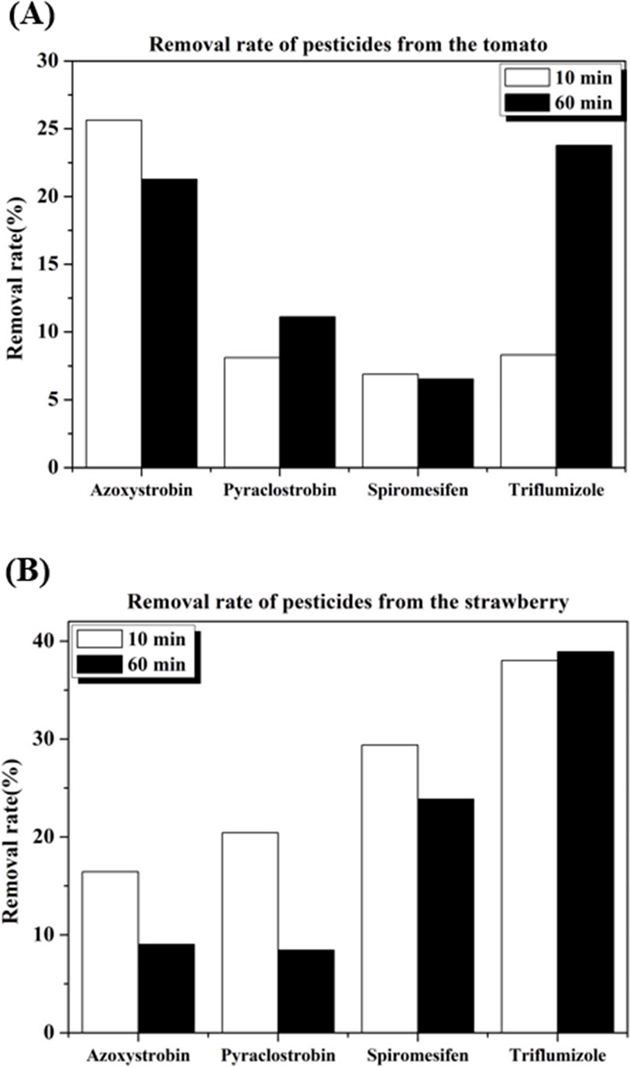
토마토 및 딸기에서의 변수인 오존농도와 접촉시간 가운데 어떤 인자가 더 영향력이 큰지를 확인하기 위해 오존농도 변화에 따른 농약의 제거율과 접촉시간에 따른 농약의 제거율을 비교하였다. 오존 농도의 경우 1 uL/L과 80 uL/L으로 약 80배의 차이가 존재하는데 토마토의 경우 4종의 농약의 분해율 평균은 1 uL/L의 경우 9.2%이고 80 uL/L의 경우 18.8 %로 약 2배 증가하였으나, 딸기의 경우는 1 uL/L의 경우 9.7%이고 80 uL/L의 경우 36.4%로 약 3.7배 증가함을 확인하여 오존 농도에 대한 민감성은 토마토보다 딸기가 더큼을 알 수 있다(Fig. 7).
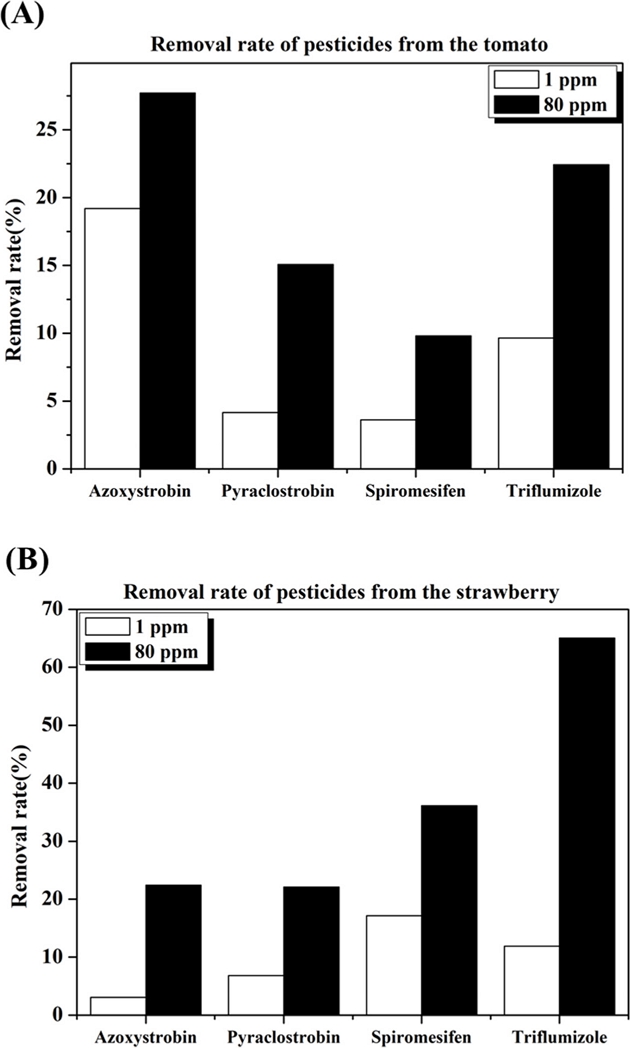
Comparison of Residual Pesticide Removal Rates of (A) Tomato and (B) Strawberry about 4 Pesticides by O3 Concentration.
접촉 시간의 경우 10분과 60분으로 약 6배의 차이가 있고 각 작물별로 분해율을 비교해보면 토마토의 경우 10분 처리시 4종의 농약에 대한 분해율 평균은 12.2%이고 60분의 경우 15.7% 였으며 딸기의 경우는 10분 처리시 26.1%, 60분의 경우 20.1% 분해되었고 이를 통해 접촉시간에 대한 민감성은 딸기보다 토마토가 큼을 확인할 수 있다(Fig. 8).
결 론
플라즈마 활성종 중 오존활성종을 각기 다른 농도와 접촉시간으로 딸기 및 토마토에 잔류하는 20종의 농약을 대상으로 분해율을 평가하였다. 이 중에서 비교분석이 가능한 4종의 농약에 대하여 작물별, 오존농도별, 접촉시간별 농약의 분해율을 비교 평가하였다.
4종의 농약제거율 평균은 딸기의 경우 23%, 토마토의 경우 14%로 딸기가 더 많이 제거되었다. 오존농도의 변화에 따른 제거율 증가는 딸기가 토마토에 비해 우세하였고 접촉시간의 변화에 따른 제거율은 토마토가 딸기에 비해 영향을 많이 받았다.
이와 같은 결과는 작물별로 오존의 농도 또는 접촉시간의 영향력이 다름을 의미하여 작물의 특성별로 오존을 적용하는 방법이 달라야 함을 뜻하므로 추가연구를 통해 작물별 처리조건을 확립할 필요가 있다.
Acknowledgments
본 연구는 국가핵융합연구소(NFRI)의 ‘미래선도 플라즈마-농식품 융합기술 개발(Plasma Farming)‘ R&D프로그램과 농촌진흥청 공동연구사업(과제번호: PJ012510032019)의 지원을 받아 수행되었습니다.
References
-
Bai, Y., J. Chen, Y. Yang, L. Guo and C. Zhang (2010) Degradation of organophosphorus pesticide induced by oxygen plasma: Effects of operating parameters and reaction mechanisms Chemosphere 81(3):408-414.
[https://doi.org/10.1016/j.chemosphere.2010.06.071]

-
Dorraki, N., V. Mahdavi, H. Ghomi and A. Ghasempour (2016) Elimination of diazinon insecticide from cucumber surface by atmospheric pressure air-dielectric barrier discharge plasma. Biointerphases 11(4):041007.
[https://doi.org/10.1116/1.4971382]

-
Heo, N. S., M. K. Lee, G. W. Kim, S. J. Lee, J. Y. Park and T. J. Park (2014) Microbial inactivation and pesticide removal by remote exposure of atmospheric air plasma in confined environments. Journal of Bioscience and Bioengineering. 117(1):81-85.
[https://doi.org/10.1016/j.jbiosc.2013.06.007]

-
Kaushik, G., S. Satya and S. N. Naik (2009) Food processing a tool to pesticide residue dissipation - A review, Food Res. Int. 42(1):26-40.
[https://doi.org/10.1016/j.foodres.2008.09.009]

-
Keikotlhaile, B. M., P. Spanoghe and W. Steurbaut (2010) Effects of food processing on pesticide residues in fruits and vegetables: A meta-analysis approach. Food and Chemical Toxicology 48(1):1-6.
[https://doi.org/10.1016/j.fct.2009.10.031]

- Korea Rural Economic Institute (2019) Trends in import and export of agricultural products from FTA Countries, 7(3). http://library.krei.re.kr/pyxis-api/1/digital-files/6b2499cb-2594-4a63-a609-85704d2698ba, . Accessed 20 November 2019.
-
Misra, N. N., S. K. Pankaj, T. Walsh, F. O’Regan, P. Bourke and P. J. Cullen (2014) In-package nonthermal plasma degradation of pesticides on fresh produce J. Hazard. Mater. 271:33-40.
[https://doi.org/10.1016/j.jhazmat.2014.02.005]

-
Oh, Y. J., I. S. Hwang, S. W. Park, G. H. Choi, S. H. Ryu, H. Y. Kwon, E. S. Hwang, J. H. Kim and H. S. Lee (2019) Effects of Chlorine Dioxide Solution on Reduction of Pesticide Residues in The Apple and Perilla leaf. Korean J. Pestic. Sci. 23(3):135-145.
[https://doi.org/10.7585/kjps.2019.23.3.135]

- Rural Development Administration (2019) Pesticide. https://www.nongsaro.go.kr/portal/ps/psz/psza/contentMain.ps?menuId=PS03949&pageIndex=1, . Acceseed 2019.
-
Souza, L., P de, L. R. D. A Faroni, F. F. Heleno, F. G. Pinto, M. E. L. R de Queiroz and L. H. F. Prates (2018) Ozone treatment for pesticide removal from carrots: Optimization by response surface methodology. Food Chem. 243:435-441.
[https://doi.org/10.1016/j.foodchem.2017.09.134]

-
Wang, S., J. Wang, T. Wang, C. Li and Z. Wu (2019) Effects of ozone treatment on pesticide residues in food: a review. Int. J. Food Sci. Technol. 54(2):301-312.
[https://doi.org/10.1111/ijfs.13938]

-
Zhou, R., R. Zhou, F. Yu, D. Xi, P. Wang, J. Li, X. Wang, X. Zhang, K. Bazaka and K. Ostrikov (Ken) (2018) Removal of organophosphorus pesticide residues from Lycium barbarum by gas phase surface discharge plasma. Chem. Eng. J. 342(15):401-409.
[https://doi.org/10.1016/j.cej.2018.02.107]