차나무 추출물 함유 유기농업자재 중 주성분 정량분석법 확립
 ; Jeewon Rhee
; Jeewon Rhee ; Hyoin Yoon
; Hyoin Yoon ; Hyejin Yu
; Hyejin Yu ; Suyoung Ju1
; Suyoung Ju1 ; Sung-Jin Lim2
; Sung-Jin Lim2 ; Geun-Hyoung Choi
; Geun-Hyoung Choi ; Hyo-Sub Lee
; Hyo-Sub Lee ; Sang-Won Park
; Sang-Won Park
초록
본 연구는 병해충관리용 유기농업자재의 품질관리를 위하여 차나무 추출물이 함유된 유기농업자재의 원료인 tea tree oil과 tea seed oil의 주성분을 선정하고 유기농업자재 제품 중 주성분의 정량분석법을 확립하고자 하였다. Tea tree oil의 주요 활성성분은 terpinen-4-ol, γ-terpinene, α-terpinene이며 tea seed oil에는 지방산인 oleic acid와 linoleic acid가 가장 많이 함유된 것으로 알려져 있다. 이 성분들의 항균활성 및 살충효과가 보고되어 있어 이 성분들을 tea tree oil과 tea seed oil의 주성분으로 각각 선정하였다. Tea tree oil의 주성분을 분석하기 위하여 유기농업자재 제품을 10% tween 20에 2배 희석한 후 ENVI-Carb SPE로 정제하였고, tea seed oil 주성분 분석을 위해서 isooctane으로 추출한 후 메틸화하여 GC-FID로 분석하였다. 회수율 시험 결과 평균 회수율은 70.0-105.4% 수준이었고, 상대 표준편차는 10% 미만이었다. 따라서 본 연구에서 확립된 분석법은 차나무 함유 유기농업자재 중 tea tree oil과 tea seed oil의 주성분을 정량하는데 활용 가능하며 이를 통해 병해충관리용 유기농업자재 공시제품의 품질관리에 기여할 수 있을 것으로 생각된다.
Abstract
Tea tree oil and tea seed oil are increasingly used as raw materials of commercial organic inputs. However, at present, reliable quantification methods to determine the actual amount of their active ingredients in commercial organic inputs are not available. Thus, this study was conducted to develop analytic methods to quantify active ingredients in organic inputs derived from tea tree oil and tea seed oil. Tea tree oil contains a lot of terpinen-4-ol, γ-terpinene and α-terpinene, which can act crop protection chemicals. Tea seed oil typically contains oleic acid and linoleic acid with a reported antifungal and insecticidal activity. To quantify the three active ingredients of tea tree oil, organic inputs were diluted two-fold with 10% tween 20 followed by solid phase extraction using ENVI-Carb cartridge. For oleic acid and linoleic acid, saponification and methylation were conducted after extraction with isooctane. Recoveries of five selected ingredients ranged from 70.0 to 105.4% and the relative standard deviation was within 10% by analysis using GC-FID. This suggests that the methods tested here were suitable for the quantitative analysis from commercial organic inputs containing tea tree oil and tea seed oil and can contribute to control the quality of commercial organic inputs.
Keywords:
Active ingredient, Analytical method, Organic inputs, Tea seed oil, Tea tree oil키워드:
유기농업자재, 주성분, 분석법, 차나무 추출물서 론
유기농업자재란 “유기농축산물을 생산, 제조·가공 또는 취급하는 과정에서 사용할 수 있는 허용물질을 원료 또는 재료로 하여 만든 제품”을 말하며 크게 토양 개량용 또는 작물 생육용 유기농업자재와 병해충관리용 유기농업자재로 구분하여 관리되고 있다(MAFRA, 2020). 병해충관리용 유기농업자재는 주로 식물추출물이 많이 사용되고 있으며, 현재 님, 고삼, 제충국 등 50여 종 이상의 식물 추출물이 유기농업자재의 원료로 사용되고 있다(Kim et al., 2015; Choi et al., 2017). 그 중 차나무 추출물을 원료로 하여 제조된 유기농업자재는 10개 제품이 공시되어 있다(NAQS, 2020). 이때 원료로 사용된 차나무 추출물은 tea tree oil과 tea seed oil 2가지가 사용되고 있다.
Tea tree oil은 호주의 고유식물인 Melaleuca alternifolia의 정유로써 Melaeuca oil이라고도 한다. Tea tree oil은 항염(Brand et al., 2002; Koh et al., 2002; Hammer et al., 2003) 및 항균(Hammer et al., 2003; Carson et al., 2002; Hammer et al., 2002) 활성을 가지고 있는 것으로 보고되어 있으며, 여러 국가에서 오랜 기간 동안 국소치료제로 사용해 왔다(Carson et al., 2006). 특히 tea tree oil의 항균효과는 다양한 범위에 발현되는 것으로 알려져 있으며(Hart et al., 2000), tea tree oil은 약 100개의 terpene과 관련 알코올 성분들을 함유하고 있는 것으로 잘 알려져 있다(Carson et al., 2002; Brophy et al., 1989). ISO (International Standard) 4730는 판매되는 tea tree oil의 조성 중 14 성분의 최대 또는 최소값을 “Oil of Melaeuca-terpinen-4-ol type”에 규정하였다(ISO, 2004).
Tea seed oil은 중국이 원산지인 Camellia oleifera의 종자에서 얻은 오일로서 tea oil 또는 camellia seed oil이라고도 불린다(Yu et al., 2013). Camellia oleifera는 중국의 남부지역에 고루 분포하고 있는 차나무과의 관목이며, 우리나라에서는 유차(油茶)나무라고 불리고 있다. Tea seed oil은 중국에서 식용유로 사용되기도 하고(Yu et al., 1999), 전통적으로 복통 및 화상 등에 약으로 사용되기도 하였다(Zhang et al., 2007). Tea seed oil은 팜 오일, 올리브오일, 코코넛 오일과 함께 4개의 식용 가능한 나무 오일이며(Lee & Yen, 2006), 중국에서 연간 20만톤이 생산됨에 따라 중국 남부경제에 중요한 역할을 하고 있다(Wang et al., 2008; Ma et al., 2011). Tea seed oil에는 oleic acid 및 linoleic acid 등 불포화 지방산이 풍부하기 때문에 ‘동양의 올리브 오일’이라고도 불리고 있다(Long et al., 2008). 이러한 식물추출물을 원료로 하여 병해충관리용 유기농업자재 제품을 공시하기 위해서는 공시 기준에 따라 제출서류를 제출해야 하는데, 그 중 하나가 주성분 검사성적서 및 분석방법이다. 그 동안 병해충관리용 유기농업자재의 원료로 사용되는 식물추출물의 주성분 분석법 개발과 관련된 연구들이 일부 수행되어왔으며(Lee et al., 2013; Lim et al., 2014a; Lim et al., 2014b; Lim et al., 2015; Yang et al., 2016b; Choi et al., 2016), tea tree oil과 tea seed oil이 함유하고 있는 성분의 함량에 대한 연구(Carson et al., 2006; Brophy et al., 1989)가 수행되어 왔으나, 차나무 추출물을 함유한 유기농업자재 제품 중 주성분 분석법 개발에 대한 연구는 전무한 상황이다. 따라서 본 연구에서는 차나무 추출물을 함유한 유기농업자재의 품질관리를 위해서 원료로 사용된 tea tree oil과 tea seed oil의 다량함유성분 및 작물보호활성성분을 바탕으로 이들의 주성분을 선정하고자 하였고, 이를 함유한 유기농업자재 제품 중 주성분 함량을 정량 하기 위한 분석법을 확립하고자 하였다.
재료 및 방법
시약 및 표준품
Terpinen-4-ol (96.71% purity)과 α-terpinene (90% purity) 표준품은 각각 HWI group (Rülzheim, Germany)와 Tokyo Chemical Industry Co., Ltd. (Tokyo, Japan)에서 구입하였고, oleic acid (100% purity) 표준품은 Honeywell Fluka (Seelze, Germany)에서 구입하였다. γ-terpinene (97% purity), linoleic acid (98.5% purity), methyl oleate (99% purity), methyl linoleate (98.5% purity) 표준품과 tween 20, 14% BF3 (Boron trifluoride)는 Sigma-Aldrich (Saint Louis, USA)로부터 구입하였다. Acetone, isooctane, methanol, NaOH (sodium hydroxide), sodium sulfate anhydrous는 Merck (Darmstadt, Germany)에서 구입하였다. ENVI-Carb SPE (500 mg, 6 mL) 및 HLB SPE (60 mg, 3 mL) cartridge는 각각 Supelco (Philadelphia, USA) 및 Waters (Milford, USA) 로부터 구입하였다. Tea tree oil 에센셜 오일은 Niceday (Seoul, Korea)와 FGB (Melbourne, Australia)에서 2종을 구입하였고, tea seed oil 에센셜 오일은 Skinmate (Bucheon, Korea)와 Herbpeople (Guri, Korea)에서 2종을 구입하였다. 차나무 함유 유기농업자재 7종은 4개의 유기농업자재 제조업체로부터 구입하여 분석에 사용하였다.
차나무 추출물의 주성분 선정
유기농업자재 공시 기준에 “주성분이란 제품의 품질관리를 위하여 그 효과나 대표성 등을 나타낼 수 있는 이화학적 성분이나 규격을 의미한다”라고 정의하고 있다. 따라서 차나무 추출물의 원료인 tea tree oil과 tea seed oil의 주성분을 선정하기 위해서 이들이 함유하고 있는 성분을 문헌조사하였고 고유성분, 작물보호기능성분, 다량 함유성분을 바탕으로 주성분을 선정하였다.
Tea tree oil 주성분 분석
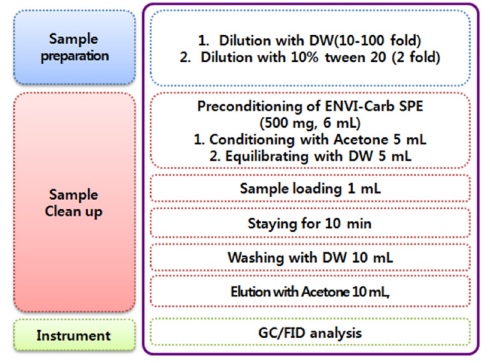
Tea tree oil을 함유한 유기농업자재의 주성분 분석을 위한 정제방법으로는 S PE c artridge를 사용하였다. 에센셜오일의 경우 acetone으로 희석하고 유기농업자재 제품은 물에 10-100배 희석한 후 10% tween 20 용액과 1:1(v/v)로 섞어 정제용 시료로 준비하였다. Acetone 5 mL와 증류수 5mL를 순차적으로 흘려주어 활성화 한 ENVI-Carb SPE (500mg, 6 mL)에 정제용 시료 1mL를 주입하고 10분간 정치하였다. 10 mL의 증류수로 씻어준 후 acetone 10 mL로 주성분을 용출하였다(Fig. 1). 정제된 시료 중 1mL를 syringe filter (0.45 μm)로 여과한 다음 GC를 이용하여 Table 1의 기기조건에서 분석하였다.
Tea seed oil 주성분 분석
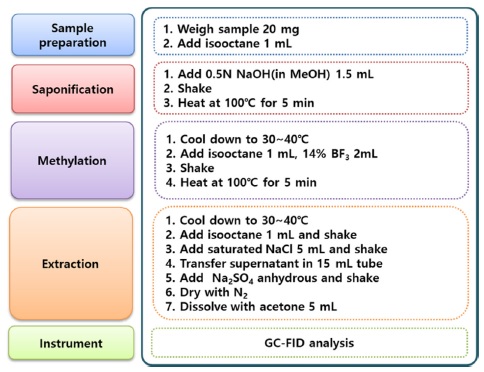
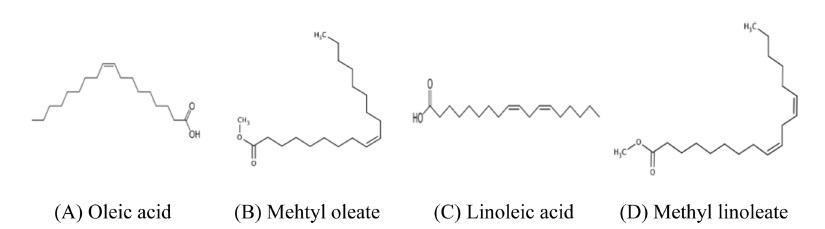
차나무 추출물을 함유한 유기농업자재 제품 중 tea seed oil의 주성분 oleic acid와 linoleic acid를 분석하기 위하여 Choi et al. (2016)의 피마자유를 함유한 유기농업자재 중 ricinoleic acid 분석법과 같은 방법으로 정량분석법을 확립하였다(Fig. 2). Choi et al. (2016)는 피마자유를 원료로 사용하는 유기농업자재 제품의 주성분 ricinoleic acid를 정량하기 위한 saponification과 methylation에 최적의 반응 시간을 확립하였다. 액상 유기농업자재 20 mg에 isooctane 1 mL를 첨가하여 반응용 시료로 준비하였고, 0.5 N methanolic NaOH 1.5 mL를 첨가하고 혼합하여 100°C에서 5분간 가온하였다. 이후 30~40°C로 냉각하여 isooctane 1 mL와 14% BF3 용액 2mL를 첨가하고 혼합하여 100°C에서 5분간 가온하였다. 다시 30~40°C로 냉각하여 isooctane 1 mL를 첨가하고 30초간 격렬하게 진탕하였다. 포화식염수 5mL를 가하고 진탕하여 수 층과 분리된 isooctane 층을 무수황산나트륨으로 탈수시켰다. 수 층에 isooctane 1.5 mL를 추가로 넣고 2~3회 추출하였다. Isooctane 층을 질소농축하여 acetone 5mL로 재용해한 후 40배 희석하여 0.45 μm syringe filter로 여과한 다음 Table 2의 기기조건에서 정량분석을 실시하였다. 검량선은 각각 acetone에 희석한 methyl oleate와 methyl linoleate의 표준용액을 사용하여 작성하였고, 분석 시료 중 methyl oleate와 methyl linoleate 함량을 계산한 후 이를 지방산 전환계수를 사용한 환산식에 따라 각각 oleic acid와 linoleic acid의 함량으로 환산하였다. 지방산 전환계수는 지방산과 지방산 메틸에스테르의 분자량 비로 산출하였다 (Devries et al., 1999).
※ oleic acid의 지방산 전환계수 : 0.9527
※ linoleic acid의 지방산 전환계수 : 0.9524
시험방법의 유효성 확인
Tea tree oil 및 tea seed oil 주성분의 정량분석을 위한 시험방법의 유효성은 검량곡선의 직선성, 정량한계(limit of quantitation, LOQ), 회수율 및 상대표준편차를 사용하여 검증하였다. 검량곡선의 직선성은 표준용액 6개 농도를 Table 1과 Table 2의 조건에서 각각 3반복 주입하여 얻은 평균값으로 작성하였고, 기기상 S /N비(signal to noise ratio)가 10이 되는 농도를 분석물질 각각의 기기정량한계(Instrument LOQ; ILOQ)로 정하고, 희석배수를 고려하여 분석정량한계(Method LOQ; MLOQ)를 산출하였다. 회수율 시험은 2개 이상의 수준으로 처리하고 상기의 분석방법에 따라 3회 반복 수행 하였다.
결과 및 고찰
주성분 선정
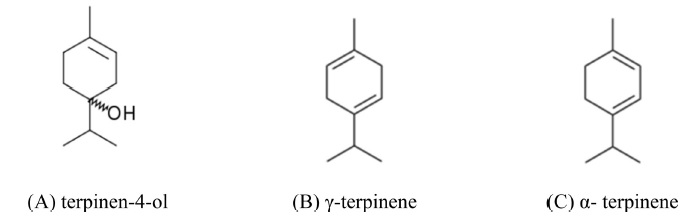
ISO 4730(2004)에 따르면 tea tree oil에는 terpinen-4-ol이 30-48% 수준으로 함유되어 있어 tea tree oil의 대표성분으로 볼 수 있으며, tea tree oil이 최적의 항균활성을 나타내기 위해서는 terpinen-4-ol이 최소한 30% 이상 함유되어 있어야 한다고 보고되어 있다. 또한 γ-terpinene이 10-28%, α-terpinene이 5-13% 수준으로 함유하고 있어 이들 3개의 성분이 tea tree oil에 가장 많이 함유되어 있는 성분으로 보고 되어 있다(ISO, 2004). 이 성분들은 Candida albicans, Escherichia coli, Staphylococcus aureus 등의 세균(Carson & Riley, 1995)과 곰팡이균(Hammer et al., 2003; Carson et al., 2006)에 대한 항균활성이 있으며, 살충효과(Ma & Zhang, 2004; Abbassy et al., 2009; Klauck et al., 2014)에 대해서도 보고되어 있다.
유차나무(Camellia oleifera) 종자에는 평균적으로 47.83%의 오일이 함유되어 있으며, 유차나무 종자에서 추출한 tea seed oil에는 지방산이 다량 함유되어 있다. 그 중 oleic acid (C18:1)는 53.5~76.7%, linoleic acid (C18:2)는 2.0~5.6% 수준으로 함유되어 있어 tea seed oil 중 2가지 성분이 가장 다량 함유된 성분으로 보고되어 있다(Ma et al., 2011; Shao et al., 2015; Yang et al, 2016a). Oleic acid는 세포막의 정상적인 기능을 방해하여 병원균을 죽이는 살균효과, 진딧물 등에 대한 살충효과가 있으며 이끼에 대한 제초효과가 있는 것으로 알려져 있다(Paranjape et al., 2014). 따라서 tea tree oil 판정용으로 terpinen-4-ol, γ-terpinene, α-terpinene 세가지 성분을 주성분으로 선정하였고(Fig. 3), tea seed oil 판정용으로 oleic acid, linoleic acid 두 성분을 주성분으로 선정하였다(Fig. 4).
Tea tree oil 주성분 분석을 위한 정제방법
차나무 추출물을 함유한 유기농업자재 제품 중 tea tree oil의 주성분인 terpinen-4-ol, γ-terpinene, α-terpinene을 분석하기 위해 ENVI-Carb SPE cartridge로 정제 하였다(Fig. 1). 유기농업자재 제품에 부자재로 함유되어 있는 계면활성제를 전처리 과정에서 제거하고자 SPE (solid phase extraction) 정제방법이 활용되며, 제품을 물로 희석한 수용액 상태의 시료를 적용할 수 있는 Envi-carb 또는 HLB cartridge의 유용성이(Lee et al., 2013; Lim et al., 2014a; Lim et al., 2014b; Lim et al., 2015; Yang et al., 2016b; Choi et al., 2016)에서 검증된 바 있다. 정제하기 전 유기농업자재의 희석방법에 따른 효율을 비교한 결과, 표준용액을 물로 희석해서 cartridge에 주입한 경우 회수율이 23.4~40.5%, 희석하지 않고 주입한 경우 26.1~37.8%, 10% tween 20으로 2배 희석하여 주입한 경우 55.5~61.1%로 나타났다. 따라서terpinen-4-ol, γ-terpinene, α-terpinene 세 성분을 동시에 분석하기 위해서는 10% tween 20으로 2배 희석한 후cartridge에 주입하는 것이 효율적인 것으로 확인되었다. 수용해도가 1,767mg/L인 terpinen-4-ol은 비교적 물에 잘 녹지만, γ-terpinene, α-terpinene은 수 용해도가 각각 5.92mg/L, 8.72 mg/L로 물에 잘 녹지 않는 특성을 가지고 있다(Carson et al., 2006; Bio-pesticides Database (BPDB), University of Hertfordshire). 계면활성제는 수용액 내의 소수성 성분의 용해도를 증가시키는 역할을 하기 때문에 (Rosen, 1989; Lee et al., 2002), 오히려 제품을 희석할 때 계면활성제를 첨가함에 따라 분석 효율이 증가한 것으로 보인다.
시험방법의 유효성 검증
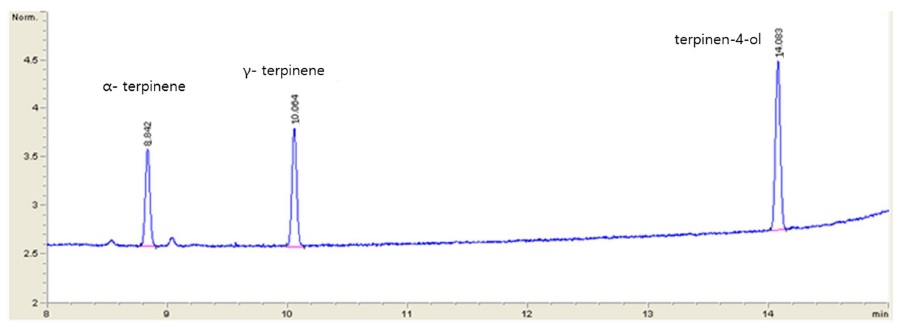
Tea tree oil의 주성분의 GC-FID 분석을 통한 크로마토그램을 Fig. 5에 나타내었으며, 결정계수(R2)는 모두 0.9997이상으로 직선성이 양호한 수준으로 확인되었다. Terpinen-4-ol, γ-terpinene, α-terpinene의 기기정량한계(ILOQ)는 모두 0.5mg/L이고 분석정량한계(MLOQ)는 20mg/L이었다. Tea tree oil을 함유하지 않은 유기농업자재 제품을 control 시료로 사용하였으며, 대상 성분에 대한 특이성은 나타나지 않았다. 회수율을 20, 200mg/L 두 수준에서 확인한 결과terpinen-4-ol은 평균 103.2~105.4%, γ-terpinene은 75.9~100.5%, α-terpinene은 70.0~82.9% 수준으로 확인되었고, 상대표준편차는 모두 10% 이하로 확인되어 전처리 방법이 차나무추출물 함유 유기농업자재 중 tea tree oil의 주성분 terpinen-4-ol, γ-terpinene, α-terpinene의 분석에 적합함을 확인하였다(Table 3).
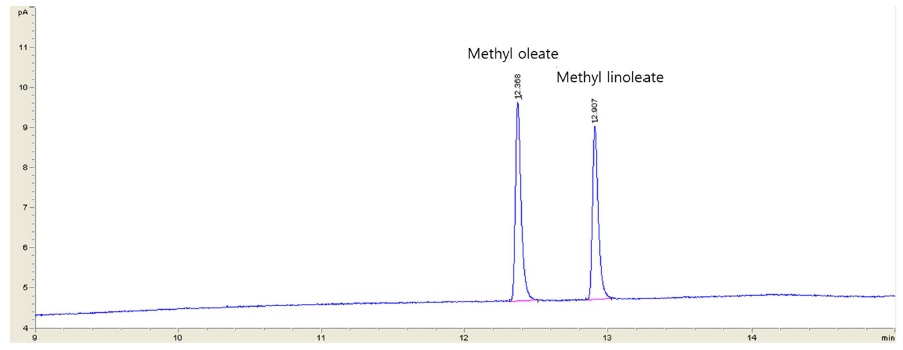
또한 tea seed oil의 주성분의 GC-FID 분석을 통한 크로마토그램을 Fig. 6에 나타내었으며, 이들 결정계수(R2)은 모두 0.9997 이상으로 직선성이 양호한 수준으로 확인되었다. Oleic acid, linoleic acid의 기기정량한계(ILOQ)는 모두 0.1mg/L이었고, 분석정량한계(MLOQ)는 oleic acid 95.27 mg/L, linoleic acid 95.21 mg/L 이었다. Oleic acid 및 linoleic acid 200 mg/L, 500 mg/L 두 수준에서 회수율을 확인한 결과, oleic acid의 평균 회수율은 70.8~89.3%, linoleic acid는 76.4~97.6%이었으며, 상대표준편차도 모두 10% 이하로 확인되어 전처리 방법이 유기농업자재 중 oleic acid 및 linoleic acid 분석에 적합함을 확인하였다(Table 3).
유기농업자재 중 주성분 함량
확립된 분석법을 활용하여 분석한 결과, Tea tree oil 에센셜 오일 2종에는 terpinen-4-ol 12.45~35.29%, γ-terpinene 5.74~13.66%, α-terpinene 2.94~6.19%의 수준으로 함유되어 있었다. 차나무 추출물 함유 유기농업자재 중에서는 1개 제품에서만 terpinen-4-ol 5.79%, γ-terpinene 3.76%, α-terpinene 1.11% 수준으로 함유되어 있는 것으로 나타났다(Table 4). Tea seed oil 에센셜 오일 2종에는 oleic acid 53.68~69.22%, linoleic acid 8.38~16.50% 수준으로 함유되어 있었으며, 차나무 추출물 함유 유기농업자재 제품 중 액상과 고상 7개의 제품에서 oleic acid 0.01~2.09%, linoleic acid 0.01~1.33% 수준으로 함유되어 있는 것으로 나타났다(Table 5). 같은 종류의 오일의 경우에도 원료의 품종 및 재배지역에 따라 화학적 조성 및 함량이 달라질 수 있으며(Yang et al., 2016a; Yang et al., 2008), 유기농업자재 제조공정의 차이까지 고려하면 제품 중 주성분의 함량을 일률적으로 관리하기는 어려운 점이 있다. 그러나 확립된 분석법을 통해 유기농업자재 제품에 사용된 원료의 확인 및 함량 미달 제품의 관리 등 유기농업자재의 공시 제품의 품질관리에 기여할 수 있을 것으로 생각된다.

The amount (%) of active substances in essential oils and commercial organic inputs derived from tea tree oil
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ0136302)의 지원에 의해 이루어진 것임.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Abbassy MA, Abdelgaleil SAM, Rabie RYA, 2009. Insecticidal and synergistic effects of Majorana hortensis essential oil and some of its major constituents. Entomologia Experimentalis et Applicata, 131(3):225-232.
[https://doi.org/10.1111/j.1570-7458.2009.00854.x]

-
Brand C, Grimbaldeston MA, Gamble JR, Drew J, Finlay- Jones JJ, Hart PH, 2002. Tea tree oil reduces the swelling associated with the efferent phase of a contact hypersensitivity response. Inflammation Research, 51(5):236-244.
[https://doi.org/10.1007/PL00000299]

-
Brophy JJ, Davies NW, Southwell IA, Stiff IA, Williams LR, 1989. Gas chromatographic quality control for oil of Melaleuca terpinen-4-ol type (Australian tea tree). Journal of Agricultural and Food Chemistry, 37(5):1330-1335.
[https://doi.org/10.1021/jf00089a027]

-
Carson CF, Riley TV, 1995. Antimicrobial activity of the major components of the essential oil of Melaleuca alternifolia. Journal of Applied Bacteriology, 78(3):264-269.
[https://doi.org/10.1111/j.1365-2672.1995.tb05025.x]

-
Carson CF, Mee BJ, Riley TV, 2002. Mechanism of action of Melaleuca alternifolia (tea tree) oil on Staphylococcus aureus determined by time-kill, lysis, leakage, and salt tolerance assays and electron microscopy. Antimicrobial Agents and Chemotherapy, 46(6):1914-1920.
[https://doi.org/10.1128/AAC.46.6.1914-1920.2002]

-
Carson CF, Hammer KA, Riley TV, 2006. Melaleuca alternifolia (tea tree) oil: a review of antimicrobial and other medicinal properties. Clinical Microbiology Reviews, 19(1):50-62.
[https://doi.org/10.1128/CMR.19.1.50-62.2006]

-
Choi GH, Kim L, Lee DY, Jin CL, Lim SJ, et al., 2016. Quantitative analyses of ricinoleic acid and ricinine in Ricinus communis extracts and its biopesticides, Journal of Applied Biological Chemistry, 59(2):165-169.
[https://doi.org/10.3839/jabc.2016.030]

-
Choi GH, Jeong DK, Jin CL, Rho JH, Park BJ, et al., 2017. Thermal Stability of Representative Bioactive Compounds in Biopesticide Derived from Castor Oil or Wormseed Extract under Controlled Temperature. Korean Journal of Environmental Agriculture, 36(1):17-21.
[https://doi.org/10.5338/KJEA.2017.36.1.06]

-
Devries JW, Kjos L, Groff L, Martin B, Cernohous K, et al., 1999. Studies in Improvement of Official Method 996.06. Journal of AOAC International, 82(5):1146-1155.
[https://doi.org/10.1093/jaoac/82.5.1146]

-
Hammer KA, Carson CF, Riley TV, 2002. In vitro activity of Melaleuca alternifolia (tea tree) oil against dermatophytes and other filamentous fungi. Journal of Antimicrobial Chemotherapy, 50(2):195-199.
[https://doi.org/10.1093/jac/dkf112]

-
Hammer KA, Carson CF, Riley TV, 2003. Antifungal activity of the components of Melaleuca alternifolia (tea tree) oil. Journal of Applied Microbiology, 95(4):853-860.
[https://doi.org/10.1046/j.1365-2672.2003.02059.x]

-
Hart PH, Brand C, Carson CF, Riley TV, Prager RH, et al., 2000. Terpinen-4-ol, the main component of the essential oil of Melaleuca alternifolia (tea tree oil), suppresses inflammatory mediator production by activated human monocytes. Inflammation Research, 49(11):619-626.
[https://doi.org/10.1007/s000110050639]

- International Organisation for Standardisation. 2004. Oil of Melaleuca, terpinen-4-ol type (Tea tree oil). ISO 4730. International Organisation for Standardisation, Geneva, Switzerland.
-
Kim JH, Choi GH, Kang JE, Park BJ, 2015. Stability of representative active compounds on commercial biopesticides based on neem or Sophora flavescens extract under controlled temperature. The Korean Journal of Pesticide Science, 19(2):88-92.
[https://doi.org/10.7585/kjps.2015.19.2.88]

-
Klauck V, Pazinato R, Stefani LM, Santos RC, Vaucher RA, et al., 2014. Insecticidal and repellent effects of tea tree and andiroba oils on flies associated with livestock. Medical and Veterinary Entomology, 28 (Suppl. 1):33-39.
[https://doi.org/10.1111/mve.12078]

-
Koh KJ, Pearce AL, Marshman G, Finlay‐Jones JJ, Hart PH, 2002. Tea tree oil reduces histamine-induced skin inflammation. British Journal of Dermatology, 147(6):1212-1217.
[https://doi.org/10.1046/j.1365-2133.2002.05034.x]

-
Lee CP, Yen GC, 2006. Antioxidant activity and bioactive compounds of tea seed (camellia oleifera abel.) oil. Journal of Agricultural and Food Chemistry, 54(3):779-784.
[https://doi.org/10.1021/jf052325a]

-
Lee JW, Jin CL, Jang KC, Choi GH, Lee HD, et al., 2013. Investigation on the insecticidal limonoid content of commercial biopesticides and neem extract using solid phase extraction. Journal of Agricultural Chemistry and Environment, 2(4):81-85.
[https://doi.org/10.4236/jacen.2013.24012]

-
Lim SJ, Jeong DY, Choi GH, Park BJ, Kim JH, 2014a. Quantitative Analysis of Matrine and Oxymatrine in Sophora flavescens Extract and Its Biopesticides by UPLC. Journal of Agricultural Chemistry and Environment, 3(2):64-73.
[https://doi.org/10.4236/jacen.2014.32008]

-
Lim SJ, Lee JH, Kim JH, Choi GH, Cho NJ, et al., 2014b. Determination of dimethyl disulfide, diallyl disulfide, and diallyl trisulfide in biopesticides containing Allium sativum extract by gas chromatography. Korean Journal of Environmental Agriculture, 33(4):381-387.
[https://doi.org/10.5338/KJEA.2014.33.4.381]

-
Lim SJ, Kim JH, Choi GH, Park BJ, 2015. Quantitative analysis of rotenone and deguelin in biopesticides containing derris extract by ultra performance liquid chromatography. Korean Journal of Environmental Agriculture, 34(1):52-56.
[https://doi.org/10.5338/KJEA.2015.34.1.05]

- Long Z, Wang D, 2008. Chemical constituents of olive oil and from Camellia oleifera seed oil. Journal of the Chinese Cereals and Oils Association, 23:121-123.
- Ma ZQ, Zhang X, 2004. Insecticidal activity of terpinen-4-ol against larvae of the oriental armyworm, Mythimna separata (Walker) (Lepidoptera: Noctuidae). Acta Entomologica Sinica, 47:329-333.
-
Ma J, Ye H, Rui Y, Chen G, Zhang N, 2011. Fatty acid composition of Camellia oleifera oil. Journal für Verbraucherschutz und Lebensmittelsicherheit, 6(1):9-12.
[https://doi.org/10.1007/s00003-010-0581-3]

- Ministry of Agriculture, Food and Rural Affairs (MAFRA), 2020. Enforcement regulation of Act on the promotion of environment-friendly agriculture and the management of and support for organic foods, etc., Ministry of Agriculture, Food and Rural Affairs Act No. 354. Sejong, Korea.
- National Agricultural Products Quality Management Service, 2020. National notice for Environment-friendly Agricultural and Organic inputs product, https://www.naqs.go.kr/contents/contentsTab.do?menuId=MN50068, (Accessed Nov. 22. 2020).
-
Paranjape K, Gowariker V, Krishnamurthy VN, Gowariker S, 2014. The Pesticide Encyclopedia. p.334, CABI.
[https://doi.org/10.1079/9781780640143.0000]

- Rosen MJ, 1989. Surfactant and interfacial phenomena. John Wiley and Sons, New York, pp. 170-202.
-
Shao P, Liu Q, Fang Z, Sun P, 2015. Chemical composition, thermal stability and antioxidant properties of tea seed oils obtained by different extraction methods: Supercritical fluid extraction yields the best oil quality. European Journal of Lipid Science and Technology, 117(3):355-365.
[https://doi.org/10.1002/ejlt.201400259]

- Wang XN, Chen YZ, Wu LQ, Liu RK, Yang XH, et al., 2008. Oil content and fatty acid composition of Camellia oleifera seed. Journal of Central South University of Forestry & Technology, 28(3):11-17.
-
Yang SA, Jeon SK, Lee EJ, Im NK, Jung JY, et al., 2008. Bioactivity and Chemical Composition of the Essential oil of Tea tree (Melaleuca alternifolia). Journal of Life Science, 18(12):1644-1650.
[https://doi.org/10.5352/JLS.2008.18.12.1644]

-
Yang C, Liu X, Chen Z, Lin Y, Wang S, 2016a. Comparison of oil content and fatty acid profile of ten new camellia oleifera cultivars. Journal of Lipids, 2016:1-6.
[https://doi.org/10.1155/2016/3982486]

-
Yang JY, Ryu SH, Lim SJ, Chio GH, Park BJ, 2016b. Quantitative determination of ascaridole, carvacrol and pcymene in the biopesticides products derived from chenopodium ambrosioides L. extracts by gas chromatography. Korean Journal of Environmental Agriculture, 35(3):211-215.
[https://doi.org/10.5338/KJEA.2016.35.3.27]

- Yu YS, Ren SX, Tan KY, 1999. Study on climatic regionalization and layer and belt distribution of oiltea ccamellia quality in china. Journal of Natural Products, 14(2):123-127.
-
Yu X, Li Q, Du S, Zhang R, Xu C, 2013. A novel process for the aqueous extraction of oil from Camellia oleifera seeds and its antioxidant activity, Grasas Y Aceites, 64(4):407- 414.
[https://doi.org/10.3989/gya.106412]

- Zhang DQ, Tan XF, Peng WX, Liu QM, Zeng YL, et al., 2007. Improved application of Camellia oleifera on biomass energy by enlarging its production. Acta Scientiarum Naturalium Universitatis Sunyatseni, 46(Supp):109-110.
Song-Hee Ryu, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0003-0648-0124
Jeewon Rhee, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0001-5621-6618
Hyoin Yoon, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0002-0890-7235
Hyejin Yu, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0002-2779-781X
Suyoung Ju, Consumer Product & Environment Business Division, KOTITI Testing & Research Institute, Researcher, https://orcid.org/0000-0002-0620-4771
Sung-Jin Lim, Agricultural Technology Division, Jeonju Agricultural Technology Center, Researcher, https://orcid.org/0000-0002-9945-6176
Geun-Hyoung Choi, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0003-1991-1544
Hyo-Sub Lee, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0002-7021-2541
Sang-Won Park, Residual Agrochemical Assessment Division, National Institute of Agricultural Sciences, Rural Development Administration, Researcher, https://orcid.org/0000-0002-4354-3094
Presentation of methodology, Sung-Jin Lim, Geun- Hyoung Choi and Hyo-Sub Lee; Experimental participation, Jeewon Rhee, Hyoin Yoon, Hyejin Yu and Suyoung Ju; Consultation, Sang-Won Park; Establishment of experimental plan and writing, Song-Hee Ryu.