HPLC-DAD/MS를 이용한 농산물 중 살균제 Carpropamid의 정밀 잔류분석법 확립
Correspondence to: * E-mail: kjh2404@snu.ac.kr
초록
본 연구는 대부분의 농작물 중 살균제 carpropamid의 잔류량을 정밀하게 분석할 수 있는 단성분 분석법을 개발하고자 하였다. 대표 농작물로 배추, 사과, 현미, 고추를 선정하였으며, 균질화된 농작물 시료 중 carpropamid 잔류분을 acetone을 이용하여 진탕 추출하고 액-액 분배법과 Florisil 크로마토그래피법을 통해 정제하였다. C8 및 C18 역상컬럼이 장착된 액체크로마토그래피를 이용해 UV 220 nm 파장에서 carpropamid를 정량분석하였으며, 질량분석기를 통해 잔류분을 확인하였다. 본 분석법을 통한 carpropamid의 기기정량한계는 2 ng으로 분석정량한계는 0.02 mg/kg이었다. 표준용액을 3수준 (분석정량한계 ×1, ×10, ×100), 3반복으로 무처리 시료에 첨가하고 본 분석법의 회수율을 산출한 결과 84~112%이었으며, 농산물 종류에 상관없이 반복 간 분석오차는 10% 미만으로 우수한 정밀성을 보였다.
Abstract
This study was performed to establish a single residue analytical method for determining fungicide carpropamid residues in various agricultural commodities. Korean cabbage, apple, brown rice and green pepper were selected as representative crops. Samples were homogenized, extracted with acetone and purified by liquid-liquid partition and Florisil column chromatography. Carpropamid residues were analyzed at 220 nm with reversed phase HPLC equipped octylsilyl and octadecylsilyl column and confirmed using mass spectrometry. ILOQ (Instrumental limit of quantitation) of carpropamid was 2 ng and MLOQ (Method LOQ) was 0.02 mg/kg. Mean recoveries from four kinds of crop samples fortified at three levels (MLOQ, 10LOQ, 100LOQ) in triplicate were in the range of 84~112%. Relative standard deviations of the analytical method were all less than 10%, irrespective of crop types.
Keywords:
Carpropamid, HPLC, Analytical method키워드:
액체크로마토그래피, 분석법서 론
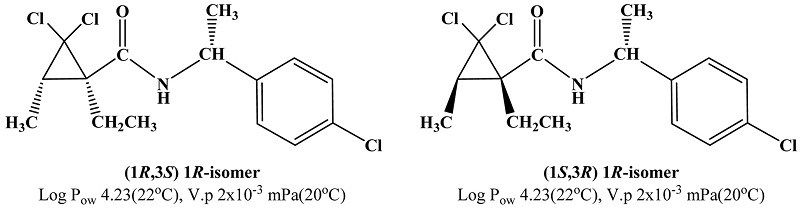
Carpropamid는 cyclopropanecarboxamide계 살균제로써 분자 내 3개의 키랄성 탄소의 존재로 인하여 총 4종의 부분입체이성질체로 구성되어 있으며 주요 2종의 부분입체이성질체가 전체의 95%이상을 구성하고 있다(Fig. 1). 일본 Nihon Bayer Agrochem사와 독일 Bayer AG사가 1994년에 공동으로 개발하였으며 국내에는 1996년 종자소독제로 처음 소개된 이후 1998년부터 작물에 사용되었다(Tomlin, 2009). 현재 국내에선 액상수화제인 솔라자(동부한농, 바이엘)과 iminoctadine tris (albesilate)와의 합제인 넘보원(동부한농)이 판매되고 있으며, 종자처리수화제로서 살충제 imidacloprid와 살균제 fludioxonil의 합제인 자바라(동부한농)와 imidacloprid와 살균제 prochloraz의 합제인 기라성(바이엘)이 판매되고 있다(한국작물보호협회, 2012). Carpropamid는 벼의 잎도열병, 목도열병, 세균벼알마름병, 흰잎마름병 방제에 사용되고 있으며(한국작물보호협회, 2012), 원인균인 Pyricularia oryzae의 melanin 생합성을 저해함으로써 약효를 나타낸다(Tomlin, 2009).
Carpropamid 분석은 가스크로마토그래피(Gas Chromatography; GC)와 액체크로마토그래피(High-Performance Liquid Chromatography; HPLC) 모두 가능하다. Seiji (2002)은 현미와 콩을 대상으로 GC-electrochemical detection (ECD)를 이용하여 잔류분석하였고, 박 등(2009)과 박(2011)은 토양의 잔류분석을 위해 GC-ECD를 사용하였다. Chu 등(2005)은 사과주스를 대상으로 GC-MS를 이용한 반면, Rizzutti 등(2007; 2009)은 LC-MS를 이용한 다성분 동시분석법으로 콩의 잔류분을 분석하였다. Seiji (2002), 박 등(2009) 및 박 (2011)이 제시한 GC-ECD 분석법은 별도의 유도체화 과정을 거치지 않고 바로 기기분석하는 방법이지만, 현재 식품공전 상 carpropamid 분석법은 sodium hydride, methyl iodide, 및 dimethyl sulfoxide 시약을 사용하여 carpropamid를 alkylation한 후 GC-NPD로 분석하는 방법으로 효율성이 떨어진다. 또한, 식품공전 상의 carpropamid 분석법은 단성분 분석법이 아닌 pencycuron과의 동시분석법으로 묶여있어서 carpropamid 잔류허용기준이 설정되어 있는 모든 농산물을 대상으로 정밀 잔류분석을 수행하는데 한계가 있다(식품의약품안전처, 2015a).
따라서, 본 연구에선 다양한 농산물에 보편적으로 적용할 수 있는 정확하고 정밀한 carpropamid 단성분 분석법을 개발하고자 하였으며, 이를 위해 각 작물 군의 대표작물을 선정하여 표준화된 공전시험법으로 사용될 수 있도록 하였다.
재료 및 방법
시약, 재료 및 기구
Carpropamid 표준품(99.9%)은 Fluka (USA)에서 구입하였고, acetonitrile, acetone, dichloromethane, ethyl acetate, n-hexane은 HPLC급으로 Burdick & Jackson (USA)로부터 구입하여 사용하였다. 또한 sodium chloride, 무수 sodium sulfate, formic acid는 GR급을 사용하였다. Florisil (60-100 mesh)은 Fluka (USA)에서 흡착 크로마토그래피용으로 구입하였으며 실험에 사용하기 전에 130°C 오븐에서 5시간 이상 활성화시켰다. 시료 균질화를 위해 믹서기(한일, HMF-1000A)를 이용하였고 추출을 위해 진탕추출기(SA-2s, Taitec, Japan)을 사용하였으며 시료 추출액 농축 시 감압농축기(R-114, Buchi, Switzerland)를 사용하였다. 추출액은 GF/A 여과지(Whatman International Ltd., UK)를 사용하여 여과하였다.
대표 작물의 선정 및 시료 손질
식품공전에 carpropamid 잔류허용기준이 설정되어 있는 작물 품목은 쌀과 기타농산물로써 각각 1.0 mg/kg, 0.05 mg/kg 이하이고(식품의약품안전처, 2015b), 분석법 확립을 위한 대표 작물로서 채소류인 배추와 고추, 곡류인 현미, 과일류인 사과를 선정하였다. 회수율 분석 대상 농산물은 시중에서 유통 중인 무농약 작물로 구입하였다. 배추, 사과 및 고추는 믹서기를 이용하여 균질화 하였고, 현미는 믹서기로 분쇄한 후 표준체 420 μm를 통과시켜 균질화 하였다. 균질화된 시료는 분석할 때까지 비닐백에 담아 -20°C에서 보관하였다.
표준용액 조제
Carpropamid 표준품을 1,000 mg/L가 되도록 acetonitrile에 용해시켜 stock solution을 조제하였으며, working solution은 분석 당일에 stock solution으로부터 acetonitrile을 이용하여 0.05, 1, 5, 10 mg/L 농도로 조제하였다. Stock solution은 냉장고 4°C에 보관하였으며 실험기간 동안 carpropamid 분해는 발생하지 않았다.
HPLC 분석조건 설정
작물 중 carpropamid의 분석은 diode array detector (DAD)가 장착된 Agilent 1100 series HPLC (Agilent, USA)를 사용하였다. Carpropamid 표준용액 1 mg/L을 분석하여 최적의 흡광파장을 선정하였다. 분석칼럼으로는 역상 C18 칼럼인 YMC-Pack Pro C18 (250 × 4.6 mm, 5 μm), Shiseido CapcellPack C18 (150 × 4.6 mm, 3 μm), Phenomenex Gemini-NX C18 (150 × 4.6 mm, 3 μm, USA)과 역상 C8 칼럼인 Agilent Eclips XDB-C8 (150 × 4.6 mm, 5 μm, USA)을 사용하여 작물 종류별 최적의 분석칼럼과 이동상 조성 및 유속 등 분리조건을 설정하였다(Table 1).
검출한계, 정량한계, 분석의 반복성 및 표준검량선의 직선성
Carpropamid 표준용액 1, 0.5, 0.1, 0.05 mg/L을 차례로 HPLC에 주입하여 크로마토그램의 signal과 noise의 비를 구하여 기기검출한계(Instrumental limit of detection; ILOD) 및 정량한계(Instrumental limit of quantitation; ILOQ)를 계산하였다. Carpropamid 표준용액 0.1 mg/L을 배추 및 사과의 분석조건 하에서 연이어 7번 HPLC에 주입하여 크로마토그램 상의 머무름 시간(tr), 피크의 면적, 피크 높이의 변이를 비교 검토하여 분석의 반복성을 확인하였으며, carpropamid 표준용액 0.05~10 mg/L 범위의 표준검량선을 작성하여 직선성을 확인하였다.
Carpropamid 추출 및 분배조건 최적화
일반적으로 잔류농약 추출에 널리 사용되고 있는 acetone, acetonitrile 및 methanol 중에서 극성용매이면서 앞선 문헌에서 carpropamid를 추출하는데 사용된 바 있는 acetone을 추출용매로써 선정하였다(Seiji, 2002; 박 등, 2009; 박, 2011). 최적의 분배조건을 설정하기 위하여 본 연구에서는 액-액 분배 용매로 많이 사용되고 있는 n-hexane, dichloromethane 및 ethyl acetate을 검토하였다. 이를 위해 분액여두에 포화식염수 50 mL와 증류수 50 mL를 넣고 carpropamid 표준용액을 처리하여 혼합액이 1 mg/L 수준이 되게 한 후, 분배 용매를 각각 100 mL, 50 mL씩 두 번 첨가하여 분배함으로써 각 분배 용매별 분배효율을 산출하였다.
Florisil 흡착 크로마토그래피 정제조건 최적화
추출액 정제를 위해 정제과정에 많이 쓰이는 Florisil를 이용하여 glass 칼럼 정제를 수행하였다. 안지름 15 mm, 길이 350 mm의 유리칼럼에 Florisil 10 g과 무수 sodium sulfate 3 g을 차례로 건식충진하여 정제용 유리칼럼을 만들고 용출 용매로 많은 연구에서 사용되고 있는 ethyl acetate/n-hexane 혼합액을 사용하였다. Ethyl acetate 비율을 5% 또는 10%씩 높이면서 용출 혼합액 100 mL를 Florisil 칼럼에 흘려보내 각 용출액의 carpropamid 용출율을 검토하였다.
분석칼럼의 머무름 특성 및 칼럼 효율성 확인
다양한 시료 매질 하에서 HPLC상의 carpropamid 피크의 머무름 특징을 확인하기 위해 capacity factor (k)를 머무름 시간과 보정머무름시간(tr'; adjusted retention time)을 이용해 계산하였다(이 등, 2009). 또한, HPLC 칼럼의 효율성을 측정하기 위해 이론단수(Number of plates; N)는 머무름 시간과 피크의 너비를 이용하여 계산하였고, 이론단 높이(Height of theoretical plates; H)는 계산된 N과 칼럼의 길이를 이용하여 계산하였다(Rood, 2007).
tR=머무름 시간, t0 = dead time
tR' = tR − t0=보정 머무름 시간
N = 5.545 × (tR/Wh)2
Wh=피크 1/2 높이의 피크 너비
H =컬럼 길이(mm) / N
분석법 검증을 위한 회수율 실험
전처리 과정을 확정한 이후, 전처리과정의 시료채취량 및 분석조작 중의 희석배율을 고려하여 기기정량한계(ILOQ)로부터 분석정량한계(Method LOQ; MLOQ)를 산출하였다(이 등, 2009). 본 연구의 기기분석법 및 전처리법을 포함한 전과정을 검증하기 위해 무처리 시료에 표준용액 첨가법에 따라 3수준(MLOQ, 10MLOQ, 100MLOQ) 3반복으로 처리된 시료를 이용해서 회수율과 상대표준편차를 구하였다. 균질화된 시료 25 g을 정밀히 달아 100 mL의 acetone을 가하여 1시간 동안 진탕 추출하였다. 현미는 추출 전에 증류수 25 mL를 넣어 시료를 습윤화시켰다. 추출물을 흡인여과하고, 30 mL acetone으로 잔사 및 용기를 씻어내어 앞의 여액과 합한 다음 40°C 이하의 수욕조에서 감압 농축하였다. 농축잔사를 50 mL 포화 식염수가 담긴 500 mL 분액여두에 50 mL 증류수와 ( )Tj100 mL n-hexane으로 헹구어 담고 격렬히 진탕한 후 층이 분리될 때까지 정치하였다. n-Hexane 층을 무수 sodium sulfate에 통과 시켜 탈수한 후, 다시 n-hexane 50 mL을 가하여 한 번 더 분배 추출하고 추출액을 합하여 40°C 이하에서 감압농축한 후 n-hexane 5 mL에 재용해 하여 정제에 사용하였다. 추출액 정제를 위해 Florisil 유리 칼럼에 n-hexane 100 mL를 가하여 세척하고 추출액 5 mL를 첨가한 다음 ethyl acetate:n-hexane (5/90, v/v)용액 100 mL로 세척해서 버렸다. 그 후 ethyl acetate:n-hexane (10/90, v/v)용액 100 mL를 가하여 용리시켜 받았다. 용리액을 40°C 이하에서 감압농축한 후 5 mL acetonitrile로 재용해하여 HPLC로 분석하였다.
처리수준 및 작물종류간의 회수율 결과의 유의적 검정
확립된 분석법에 따라 잔류분석을 수행할 때 carpropamid 잔류수준 정도와 작물종류에 따라 분석법의 정확도에 차이가 발생하는지를 확인하기 위해 처리수준에 따른 작물별 회수율 결과로부터 통계프로그램인 SPSS (ver 14.0.2KO, SPSS Inc., USA)를 이용하여 일원분산분석(one-way analysis of variance, ANOVA)을 수행하였으며 사후분석을 위해 다중범위검정(Duncan)을 p ≤ 0.05 수준에서 수행하였다.
LC/MS를 이용한 확인분석
HPLC-DAD를 이용하여 분석된 잔류분의 신뢰성을 확보하기 위해 LC/MS로 확인 분석하였다. LC/MS 분석은 Varian 500-MS IT-MASS spectrometer (Varian, USA)를 사용하였으며 ESI (Electron spray ionization) positive mode에서 이온화하였고 SIM (Selective ion monitoring) mode를 이용하였다. 칼럼은 작물 종류에 관계없이 역상 C18 칼럼인 Phenomenex Kinetex C18 (100 × 2.1 mm, 2.6 μm, USA)을 사용하였다(Table 2).
결과 및 고찰
Carpropamid의 UV 흡광 파장 결정
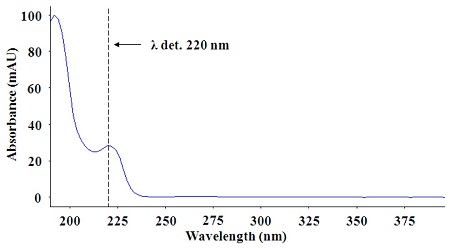
Carpropamid는 형광을 발생하는 특성을 나타내지 않기 때문에 UV 흡광검출기를 적용하였다. 화합물의 UV 흡광 특성을 조사하기 위해 carpropamid 표준용액 1 mg/L을 DAD로 분석한 결과, 그림과 같이 최대 흡광파장이 220 nm에서 관찰되어 분석 시에 HPLC 정량 분석을 위한 흡광 파장을 220 nm으로 결정하였다(Fig. 2).
HPLC 분석 칼럼 및 기기 분석 조건 결정
Carpropamid는 총 4개의 이성질체로 구성되어 있고 그중 2개의 주요 이성질체가 전체의 95% 이상을 차지하는 특징을 가지고 있다. 따라서, HPLC 분석 시 주요 2개의 이성질체를 분리, 정량하는 방식이 아닌 1개의 피크로 검출될 수 있는 기기조건으로 설정하고자 하였다. 먼저 YMC-Pack Pro C18 (250 × 4.6 mm, 5 μm)을 이용하였으나, 두 개의 이성질체가 완전히 분리되거나 하나로 합쳐지지 않은 피크로 나타났다(Fig. 3a). 칼럼의 길이를 보다 짧은 Shiseido CapcellPack C18 (150 × 4.6 mm, 3 μm)으로 바꾸어 분석한 결과 앞선 칼럼보다는 피크가 합쳐진 형태로 나타났지만 여전히 피크띠가 넓게 나타났다(Fig. 3b). 따라서, 칼럼의 종류를 Agilent Eclipse XDB-C8 (150 × 4.6 mm, 5 μm)으로 변경하여 분석한 결과, 피크의 모양이 Gaussian 분포형태를 보여 본 칼럼으로 최종 결정하였다(Fig. 3c). 하지만, 현미와 고추의 경우 새로운 방해물질과의 분리를 위하여 Phenomenex Gemini-NX C18 (150 × 4.6 mm, 3 μm)를 이용하여 분석하였다. 이동상은 용출용매인 acetonitrile과 water의 비율과 속도를 조절하여 carpropamid 분리를 최적화 하였다. 그 결과, 현미, 사과, 배추 시료 분석 시 이동상 조성은 acetonitrile 비율이 65%로 결정하였고 고추 시료 분석 시 이동상 조성은 acetonitrile 비율이 60%로 결정되었다. 유속은 현미, 사과, 배추 시료 분석 시 1.0 mL/min으로 고추 시료 분석 시 1.1 mL/min으로 작물에 따라 세분화하였다. 확립된 기기분석조건은 carpropamid의 입체화학적 특성과 농산물별 매질효과의 상이함으로 인해 작물별로 설정되었으나 공정분석법으로 가장 우선시 되어야 할 분석의 신뢰성을 확보하는데 최적화된 조건이라 사료된다.
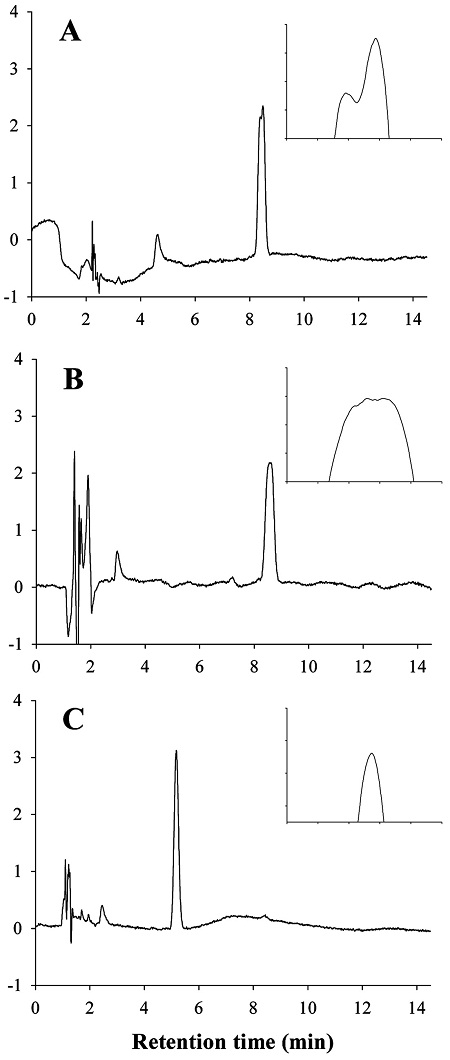
HPLC analysis of carpropamid using different analytical columns. A; YMC-Pack Pro C18 (250 × 4.6 mm, 5 μm), acetonitrile : water = 70 : 30 (v/v), B; Shiseido CapcellPack C18 (150 × 4.6 mm, 3 μm), acetonitrile : water = 60 : 40 (v/v), C; Agilent Eclipse XDB-C8 (150 × 4.6mm, 5 μm), acetonitrile : water = 65 : 35 (v/v).
HPLC 분석의 기기검출한계, 기기정량한계 및 반복성
기기검출한계(ILOD)는 기기 상 피크로 인정할 수 있는 한계로써 크로마토그램 상 S/N (signal과 noise)비가 3배 이상 수준에 해당하는 농약의 양으로 결정하며, 기기정량한계(ILOQ)는 기기 상으로 신뢰성 있게 정량할 수 있는 한계로 S/N비가 10배 이상 되는 농약의 양으로 정한다(Fong 등, 1999; Miller, 2005). ILOD와 ILOQ를 결정하기 위해 다양한 농도의 표준용액을 분석하였으며 그 결과, carpropamid의 기기정량한계(ILOQ)는 2 ng이었다. 분석기기의 안전성을 확인하기 위해 분석의 반복성 시험을 수행하였다. 역상 C8 칼럼(Agilent Eclips XDB-C8, 150 × 4.6 mm, 5 μm, USA)을 사용하여 65% acetonitrile 이동상 조건 하에서 설정된 정량한계 2 ng을 7번 반복 측정하였다. 그 결과, 머무름시간, 피크 면적 및 높이의 반복 분석 간 오차가 작아 재현성 있는 기기분석이 가능함을 확인하였다(Table 3).
검량선의 직선성(Linearity)
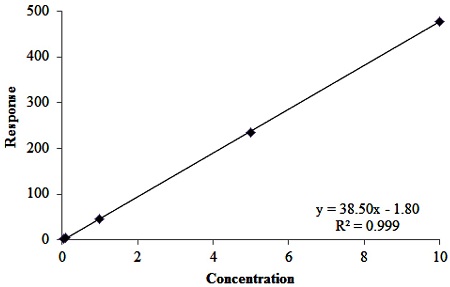
다양한 농도의 표준용액을 분석하여 농약농도와 피크 면적와의 회귀방적식을 계산하였으며 결정계수(R2)를 산출하였다. 검량선의 범위는 0.05~10 mg/L이었으며, 여러번 반복하여 검량선을 작성하였을 때 R2값은 0.999로 양호하였다(Fig. 4).
액-액 분배 조건 확립
추출액으로부터 분석 방해물질을 제거하기 위해 액-액 분배법을 사용하였다. 액-액 분배는 물과 비극성 용매를 이용하여 비극성인 농약성분을 작물의 극성 방해물질로부터 분리해 내는 방법이다. n-Hexane, ethyl acetate 및 dichloromethane을 사용하였으며 분배 용매별 100 mL의 1회 분배 회수율은 63.1~77.7%이었으나, 분배 용매 50 mL로 추가 분배할 경우 회수율이 97.6~113.0%이었다(Table 4). 따라서, 100 mL 및 50 mL씩 두 번 액-액 분배하는 것으로 분배 조건을 결정하였다. 분배 용매로 검토한 세 가지 용매 모두 양호한 회수율을 보였으나, 이 중에서 방해물질의 추출이 적고 이후 정제과정으로 진행하는데 효율적인 n-hexane을 분배 용매로 선정하였다.
Florisil 칼럼 정제 최적화
농산물 중 잔류농약 분석은 미량성분을 정량하기 때문에 최대한 분석 방해물질을 제거할 필요성이 있다. 액-액 분배는 작물 중 당이나 알코올 등 극성 방해물질을 제거할 수 있고, 정제과정은 색소나 유지 등 액-액 분배에서 제거하지 못한 많은 분석 간섭물질로부터 농약성분만을 분리해 낼 수 있다(Fong 등, 1999). 용출 용매 ethyl acetate/n-hexane 혼합액을 사용하였으며, ethyl acetate 비율을 10%씩 높이면서 용출 혼합액 100 mL씩 용출시켜 carpropamid 용출율을 검토한 결과, ethyl acetate 비율이 10%일 때 71.9%가 용출되었고 이 후 20% 비율일 때 38.9%의 용출율을 보였다(Table 5). 정제조건을 보다 세분화하기 위해 ethyl acetate 비율을 5%씩 높이면서 carpropamid 용출 특성을 추가 검토하였으며, ethyl acetate 5% 용출액 100 mL에서는 carpropamid가 용출이 되지 않고 그 이후 ethyl acetate 10% 용출액 100 mL의 용출율이 89.5%로 대부분이 회수되었다(Table 5). 따라서, ethyl acetate/n-hexane 5:95 (v/v) 혼합액 100 mL로 칼럼을 세척하고 ethyl acetate/n-hexane 10:90 (v/v) 혼합액 100 mL로 carpropamid를 용출하는 Florisil 정제조건을 확립하였다.
분석칼럼의 carpropamid 머무름 특징 및 칼럼 효율성
확립된 전처리법에 따라 배추, 현미, 사과 및 고추 시료를 전처리한 후 Table 1에 따라 분석하였을 때, HPLC 크로마토그램에서 carpropamid의 머무름 특성 및 칼럼 효율성을 확인하였다. Carpropamid의 머무름 시간은 배추에서 5.29분, 사과 5.31분, 현미 6.18분, 고추 6.92분이었으며(Table 6), Fig. 5에서 보듯이 크로마토그램 상에서 carpropamid의 peak 주위로 분석 방해물질이 관찰되지 않았기 때문에 다양한 농산물 매질로부터 carpropamid를 선택적으로 분석할 수 있음을 확인할 수 있었다.
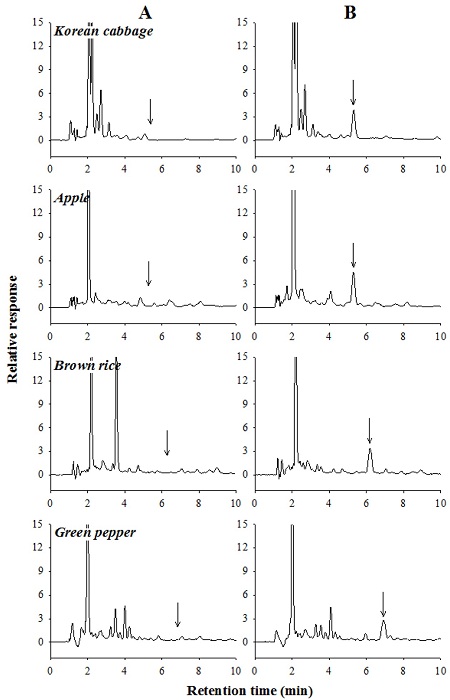
HPLC chromatograms of carpropamid in crop extracts. A; control, B; fortified with carpropamid at 0.2 mg/kg.
작물종류별 상이한 매질하에서 HPLC상의 carpropamid 피크의 머무름 특징을 확인하기 위해 capacity factor인 k값을 산출하였으며, 배추, 사과, 현미, 고추에서 각각 4.32, 4.26, 5.09, 5.87이었다(Table 6). 배추와 사과는 동일한 분석조건에서 분석하였기 때문에 각각 4.32, 4.26의 유사한 k값이 산출되었고, 현미는 C8칼럼보다 머무름 특성이 높은 C18칼럼으로 분석하였기 때문에 상대적으로 높은 5.09 값이 계산되었다. 고추는 이동상의 acetonitrile 비율이 다른 작물에 비해 60%로 낮았고 C18칼럼으로 분석하였기에 가장 높은 5.59이 산출되었다. Capacity factor가 낮으면 짧은 시간내에 분석이 가능하지만 해당 peak의 선택성 및 분해능을 확보하기 어렵고, 반대로 capacity factor가 너무 크면 분석의 선택성 및 분해능을 높일 수 있지만 많은 시료를 분석하는데 한계가 있다. 앞선 문헌에서 이 등(2009)는 fenhexamid 을 분석하는데 k값이 4.53~5.46, 이 등(2010)은 cyprodinil 분석 시 k값이 3.12~3.94 그리고 Kwon 등(2011)은 orystrobin 및 대사체를 분석하는데 k값이 4.5~6.5되는 분석조건으로 결정하였다.
이론단수(N)과 이론단 높이(H)는 칼럼의 분리 효율을 나타내며, N은 클수록 H는 작을수록 칼럼의 분리효율이 높다(김강진 등, 1997; McNair and Miller, 1997; Rood, 2007). Fig. 5와 같이 크로마토그램상의 carpropamid의 N은 배추, 사과, 현미, 고추 시료에서 각각 3519, 3545, 3677, 3157이었으며 H는 0.043, 0.042, 0.041, 0.048 mm이었다(Table 6). 한편, 이 등(2009)은 fenhexamid 분석 시 N값이 18252~22952이었고 이 등(2010)은 cyprodinil 분석 시 N값이 23451~27731으로 모든 경우에서 18000 이상이었다. 이는 carpropamid의 머무름 시간이 fenhexamid (9.74~11.44분)이나 cyprodinil(8.98~10.33분)보다 짧고 carpropamid의 2개 이성질체가 한 개의 peak로 나타나 fenhexamid이나 cyprodinil 보다 peak 띠가 넓게 나타났기 때문이다.
분석정량한계(MLOQ)
분석정량한계(MLOQ)는 시료 전처리 및 분석과정을 통틀어 전체 분석법으로 시료기준으로 분석물질을 정량할 수 있는 한계치를 일컫으며(이 등, 2009), 분석장비의 검출한계 또는 정량한계로부터 시료채취량, 전처리 과정 중의 희석 또는 농축배율 등을 감안하여 산출된다. 앞서 설정된 HPLC를 통한 carpropamid의 기기정량한계(ILOQ)가 2 ng, HPLC 시료 주입량이 20 μL이었으며, 확정된 전처리 과정 중 최종 시험용액 부피가 5 mL, 시료채취량 25 g이므로 본 연구의 분석정량한계는 0.02 mg/kg로 산출되었다. 이는 식품의약품안전처에서 추천하고 있는 0.05 mg/kg 이하 또는 MRL의 1/2을 충족하는 수준이었으며(이영득, 2009), carpropamid의 농산물 최저 잔류허용기준인 0.05 mg/kg 수준을 정량할 수 있는 수준이었다.
분석법의 회수율
본 연구에서 확립된 전처리법 및 기기분석법을 이용하여 농약이 처리되지 않은 배추, 사과, 현미 및 고추에 표준용액 첨가법에 따라 3수준으로 농약을 첨가하고 회수율 시험을 수행하였다. 처리 수준은 MLOQ (0.02 mg/kg), 10MLOQ(0.2 mg/kg, 100MLOQ (2 mg/kg)이었으며, 3번 반복 실험하였다. 회수율 결과, MLOQ 수준에서는 88~112%, 10MLOQ 수준에서는 84~100%, 100MLOQ 수준에서는 87~97%의 양호한 회수율을 보였고, 정밀성(C.V < 10%)도 우수하여 식약처 분석법 기준인 회수율 70~120%, C.V ≤ 20%을 만족하였다(Table 7). 농약 처리수준별 회수율의 유의적 차이를 확인한 결과, 현미와 고추는 처리수준별 유의적 차이를 확인할 수 없었지만 배추와 사과에서는 낮은 처리수준에서 유의적으로 회수율이 높게 산출되었다(Table 7). 작물별 회수율 결과를 살펴보았을 때, 사과 작물에서 처리수준에 관계없이 회수율이 높았지만 나머지 작물에서의 회수율 결과 간에는 유의적 차이를 확인할 수 없었다. 따라서, 본 연구를 통해 확립된 carpropamid 분석법은 작물 잔류수준의 정도나 작물 종류에 따라 정확도의 차이를 보이지 않아 광범위한 작물의 잔류수준을 검정에 적용될 수 있는 분석법임을 확인할 수 있었다.
잔류분의 재확인
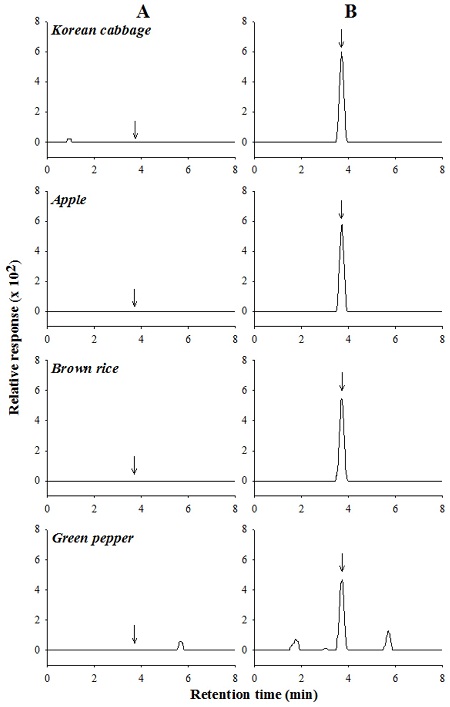
본 연구에선 HPLC로 검출된 carpropamid 잔류분을 재확인할 수 있는 LC/MS법을 확립하였다. ESI (electro spray ionization) positive mode에서 이온화하였고 이동상은 HPLC와 같은 acetonitrile/water 혼합액에 추가로 0.1% formic acid를 사용하였다. Formic acid는 LC/MS 분석 시 이동상으로 많이 사용되는 시약으로, 이온화를 위한 proton을 제공하고 해당 peak의 모양을 향상시키는 장점을 가지고 있다(이 등, 2011). 최적화된 이온화조건에서 m/z 100~400 범위를 scan하여 1 mg/L 표준용액의 total-ion chromatogram(TIC)과 carpropamid의 mass spectrum을 얻었다(Fig. 6). Carpropamid은 분자식이 C15H18Cl3NO이고 nominal mass는 333.0으로서 carpropamid의 ESI(+) mass spectrum은 m/z 334에서 [M+H+]이온을 확인할 수 있었다. 또한 carpropamid의 구성원자 중 Cl원자가 3개 존재하고, Cl의 동위원소 35Cl와 37Cl 비율이 100:32.5이기 때문에, [M+H=334]+, [M+2+H=336]+ 및 [M+4+H=338]+의 비가 100:96.6:22.3으로 나타나서 이러한 동위원소 비율을 잘 반영하고 있다. 따라서, SIM 분석을 위한 최적 ion으로 m/z 334을 선정하였다. 확립된 LC/MS법에 따라 농산물 시료 중 carpropamid 잔류분을 재확인한 결과, 모든 시료에서 분석 방해물질은 관찰되지 않아 잔류분의 재확인 분석법으로 이용 가능함을 확인하였다(Fig. 7).
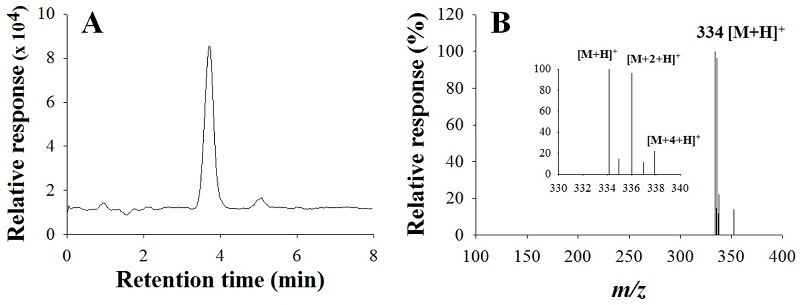
LC/MS total-ion chromatogram (A) and mass spectrum (B) of carpropamid. A standard solution (1 mg/L) was analyzed.
Acknowledgments
본 연구는 2012년도 식품의약품안전청 용역연구개발과제의 연구개발비 지원(09072잔류약997-4403)에 의해 수행되었으며 이에 감사드립니다.
Literature Cited
-
Chu, X. G., X. Z. Hu, and H. Y. Yao, (2005), Determination of 266 pesticide residues in apple juice by matrix solid-phase dispersion and gas chromatography-mass selective detection, Journal of Chromatography A, 1063, p201-210.
[https://doi.org/10.1016/j.chroma.2004.12.003]

- Fong, W. G., H. A. Moye, J. N. Seiber, and J. P. Toth, (1999), Pesticide Residues in food: Methods, Technologies, and Regulations, Wiley Interscience, 3-4, 40-44, Canada.
-
Kwon, C. H., Y. D. Lee, and M. H. Im, (2011), Simultaneous determination of orysastrobin and its isomers in rice using HPLC-UV and LC-MS/MS, Journal of Agricultural and Food Chemistry, 59, p10826-10830.
[https://doi.org/10.1021/jf202228p]

- McNair, H. M., and J. M. Miller, (1997), Basic Gas Chromatography, 7, 51, Wiley Interscience, USA.
- Miller, J. M., (2005), Chromatography : conseps and contrasts, (2nd), Wiley Intersciense, p286-287, USA.
-
Pizzutti, I. R., A. Kok, R. Zanella, M. B. Adaime, M. Hiemstra, C. Wickert, and O. D. Prestes, (2007), Method validation for the analysis of 169 pesticides in soya grain, without clean up, by liquid chromatography-tandem mass spectrometry using positive and negative electrospray ionization, Journal of Chromatography A, 1142, p123-136.
[https://doi.org/10.1016/j.chroma.2006.12.030]

-
Pizzutti, I. R., A. Kok, M. Hiemstra, C. Wickert, and O. D. Prestes, (2009), Method validation and comparison of acetonitrile and acetone extraction for the analysis of 169 pesticides in soya grain by liquid chromatography-tandem mass spectrometry, Journal of Chromatography A, 1216, p4539-4552.
[https://doi.org/10.1016/j.chroma.2009.03.064]

- Rood, D., (2007), The Troubleshooting and Maintenance Guide for Gas Chromatographyers, p16-17, 22, Wiley-VCH, USA.
- Seiji, N., (2002), Application for rapid and simultaneous detamination method on the analysis of chlorothalonil and carpropamid, Annual Reports of Fukuoka City Institute for Hygiene and Environment, 27, p141-145.
- Tomlin, C. D. S., (2009), The Pesticide Manual, (15th), p436-437, British Crop Protection Council, Hampshire, UK.
- 김강진, 김하석, 이대운, 이원, (1997), 분석화학, (제4판), p698, 자유아카데미.
- 박병준, 권오경, 김진경, 김진배, 김진호, 윤순강, 심재한, 홍무기, (2009), 영농지역에서 작물재배 형태에 따른 농약의 잔류성과 유출특성, 한국환경농학회지, 28(2), p194-201.
- 박병준, (2011), 전국 논토양과 시설하우스 토양 중 잔류농약 모니터링과 노출성 평가, 농약과학회지, 15(2), p1-6.
- 식품의약품안전처, (2015a), 식품공전.
- 식품의약품안전처, (2015b), 식품의 농약 잔류허용기준.
- 이영득, (2009), 식품공전 잔류농약분석법 실무 해설서, p3, 식품의약품안전청.
- 이영득, 오재호, 장상원, (2011), 고성능 액체크로마토그래피와 질량분석법을 이용한 농산물 중 Phenothrin 및 Silafuofen 의 정밀 잔류분석법 개발, 15(4), p389-400.
- 이혜리, 류명주, 박희원, 나예림, 송혁환, 금영수, YongzheZhu, 김정한, (2009), HPLC를 이용한 배추, 사과, 감귤, 고추 중 살균제 Fenhexamid의 정밀 분석법 확립, 13(4), p223-231.
- 이혜리, 류명주, 김은혜, 문준관, 도정아, 오재호, 권기성, 임무혁, 이영득, 김정한, (2010), HPLC를 이용한 사과, 감귤, 배 추, 고추 중 살균제 Cyprodinil의 분석법 확립, 14(4), p371-380.
- 한국작물보호협회, (2012), 농약사용지침서, 삼정인쇄공사, 248-249, 786-787.