곰솔(Pinus thunbergii)에서 소나무재선충(Bersaphelenchus xylophilus) 나무주사 약제의 효율적인 평가법 개발

초록
소나무재선충(Bursaphelenchus xylophilus) 소나무류의 가장 치명적인 해충의 하나로 우리나라를 비롯하여 중국, 일본, 스페인, 포르투갈 등지에서 발생하고 있다. 살선충제 나무주사는 효과적인 방제법의 하나이나 야외나 실내실험의 많은 제약이 있다. 본 연구에서는 이러한 한계점을 극복하기 위한 대체 효과 평가법을 제시하기 위하여 수행하였다. 곰솔의 가지에서 소나무재선충의 증식은 수분 손실이 적은 가지에서 증식이 많이 되었으며 파라핀 도포는 수분손실을 78.6% 감소시켰다. 소나무재선충 접종 한 달 후 자른 가지에서 소나무재선충의 증식은 접종 부위로부터 상하간에 차이가 없었으며 5cm구간과 10cm 구간 사이에도 차이가 없었다. 접종 나무의 굵기가 작을수록 재선충의 증식량이 많았으며 접종 동일 면의 증식량이 많았다. 곰솔과 소나무에서 재선충의 증식은 수종간에는 차이가 없었으며 접종밀도가 높을수록, 증식기간이 길수록 증식이 많이 되었다. Emamectin benzoate 2.15% EC와 morantel tartrate 8% SL을 곰솔에 수간주입 후 가지를 절단하여 소나무재선충을 접종하여 증식량을 조사한 결과 60일 후에 두 약제 모두 재선충의 증식을 유의하게 감소시켰다. 따라서 수간주사 한 소나무재선충의 효과를 검정하기 위하여 수간주사 한 나무의 가지에 소나무재선충을 접종하여 효과를 검정하는 방법을 제시한다.
Abstract
Pine wood nematode (PWN), Bursaphelenchus xylophilus is one of the most serious pests of pine tree. Trunk injection of some nematicides in tree is well known as an effective control method. However there are some limitating factors which hindering the efficacy of trunk injection in field or potted tree. In this study we suggested easy and useful alternative screening methods of nematicides against PWN. Reproduction of PWN was influenced by tree twig moisture (high reproduction in high moisture trig) and paraffin coating was 78.6% reduced moisture loss in tested twig. There were no reproduction different in up and down site from infection site of twig at 1 month after inoculation of PWN and also distance (5 and 10 cm) from inoculation site of PWN did not influence the reproduction of PWN. Numbers of reproduced PWN were higher with decreasing diameter of twig. Numbers of reproduced PWN were similar to P. thunbergii and P. densiflora. However reproduction was increased depending on high inoculation density and longer propagation period. When inoculation of PWN on cut twig injected with emamectin benzoate 2.15% EC and morantel tartrate 8% SL in trunk of Pinus thunbergii in the field, PWN number were significantly reduced than untreated control. We suggest this screening method for PWN control agents.
Keywords:
inoculation, nematicide, pine wood nematode, screening, trunk injection키워드:
접종, 소나무재선충, 살선충제, 나무주사, 선발서 론
소나무재선충(Bursaphelenchus xylophilus)은 소나무를 비롯하여 Abies, Picea, Pseudotsuga, Lalix, Cedrus, 및 Tsuga spp.속의 기주에서 증식하여 나무를 죽이는 병원체이다(Kishi, 1995; Takeuchi, 2008). 소나무재선충은 미국과 캐나다 및 멕시코 등지의 북미 지역이 원산으로(Dwinell, 1997) 원산지인 북미 지역에서는 소나무류가 저항성이어 소나무재선충에 감염되어도 시들음이나 고사와 같은 피해를 받고 있지 않으나(Dwinell and Nickle, 1989) 우리나라를 비롯하여, 일본, 대만, 중국 및 포르투갈 등지에서는 소나무류에 치명적 피해를 유발시키고 있다(Cheng et al., 1983; Tzean and Jan, 1985; Mamiya, 1988; Yi et al., 1989; Mota et al., 1999). 특히 우리나라와 일본에서 우점종인 곰솔(Pinus thunbergii)과 소나무(P. densiflora)는 감수성이 높아 소나무재선충에 감염되면 100% 고사된다(Kishi, 1995; Takeuchi, 2008).
소나무재선충에 의한 피해는 일본에서 처음 발생하였는데 1905년 Nakasaki 지역에서 소나무재선충에 의한 피해가 처음 발생한 이후(Yano, 1913) 현재는 Aomori와 Hokkaido를 제외한 일본 전역으로 확산되어 있고, 피해량도 1932년에 11,700 m3에서 매년 증가하여 1979년에는 2,432,700 m3에 이르렀는데 1980년대 이후에는 매년 1,000,000 m3 이상의 피해가 발생하고 있다(Mamiya, 1988; Kishi, 1995; Futai, 2008).
우리나라에서는 1988년 부산 금정산에서 최초로 소나무 고사목에서 소나무재선충이 확인 된(Yi et al., 1989) 이후 피해확산과 방제를 위하여 많은 노력을 기울이고 있음에도 불구하고, 부산과 울산 및 경남지역에서 대규모 피해지가 발생되고 있으며 전남의 목포와 신안, 제주도 및 동해안의 강릉과 동해, 내륙인 경기도 광주지역에까지 피해가 확산되고 있다(Shin, 2008). 2000년 이후 매년 피해면적이 급증하여 2005년에는 7,811 ha의 피해면적에 862,542그루의 소나무재선충 감염목이 제거되었으며 방제비용은 950만 $에 이르고 있다(Shin, 2008). 특히 우리나라는 국토의 63.9%인 6,375천 ha가 산림으로 구성되어 있고, 소나무림이 전체 산림의 23.1%인 1,473천 ha로 구성되어 있어(Korea Forest Service, 2009) 소나무재선충을 방제하지 않을 경우 전체 산림의 건전성에 치명적 손실요인이 될 수 있다.
소나무재선충에 의한 소나무류의 고사를 막기 위한 방법으로는 소나무재선충 자체를 죽이는 방법과 솔수염하늘소와 같은 매개충을 죽이는 방법으로 대별할 수 있는데 전자의 경우 morantel tartrate나 abamectin, emamectin benzoate와 같은 살선충제를 소나무재선충 침입 전에 소나무에 수간주사하여 소나무재선충의 증식을 막는 방법이 있고(Takai et al., 2000; Lee et al., 2009), 후자의 경우 매개충의 우화시기에 메프 유제와 같은 살충제를 항공 살포하거나 메탐소디움 액제를 이용하여 피해목을 훈증시키는 방법이 있다(Korea Forest Research Institute, 2006).
소나무재선충 피해지에서는 피해목을 벌채하여 훈증하는 방법을 주로 사용하고 있으나 이는 재선충에 감염 된 소나무를 처리하는 사후 방편으로 보호수나 조경수 또는 확산 억제가 필요한 지역에서는 나무주사가 현실적으로 가장 적합한 방법이다. 그리고 약제가 비산되어 주변 생태계에 유입되거나 사용자에게 직접 노출되지 않아 환경이나 사람에 대한 영향이 적고, 항공방제나 지상부 약제살포의 경우 처리 지역의 제한이나 강우나 바람 등 기상조건의 영향을 받는데 비하여 나무주사는 영향을 받지 않는다. 그러나 임지 내에서 많은 수의 나무에 주사를 하는 것은 많은 노동력이 필요하고, 비용이 많이 들기 때문에 대면적에 적용하기는 어려운 단점이 있다(Kamata, 2008). 하지만 이러한 단점에도 불구하고, 나무주사는 소나무재선충병의 피해를 예방할 수 있는 가장 효과적인 방법으로 소나무재선충병 예방을 위한 수간주사용 방제제의 연구가 다수 수행 된 바 있다(Takai et al., 2000; 2001; 2003a).
이러한 소나무재선충에 대한 방제제의 효과를 검정하는 방법에는 방제제를 물에 희석하여 plate나 petri-dish, 시험관 등에 넣은 후, 소나무재선충을 투입하여 치사 유무를 조사하는 방법과(Kong et al., 2006; Elbadri et al., 2008) 잿빛곰팡이병균(Botrytis cineria)을 배지에서 배양한 후, 방제제를 희석하여 솜에 묻혀 곰팡이 균사가 자라있는 배지의 중앙부에 놓고, 소나무재선충을 접종 한 후, 섭식에 의한 줄어든 균사의 양을 조사하거나 증식 된 소나무재선충의 수를 조사하는 방법이 있다(Mackeen et al., 1997; Takai et al., 2000). 두 가지 방법은 단시간 내에 많은 방제제의 효과를 검정할 수 있는 장점을 가지고 있지만 선발 된 방제제를 소나무에 수간주사하여 동일 한 효과가 있는지 부가적인 연구가 필요하다. 이는 살선충 효과가 우수한 방제제라 하더라도 소나무의 수체 내에서 이동이 되지 않아 선충을 죽일 수 없는 경우가 있기 때문인데 fosthiazate의 경우 잿빛곰팡이병균배지 상에서 선충 증식 억제 효과는 99.7%인데 비하여 수간주사를 할 경우 소나무재선충 방제효과가 없었다(Lee et al., 2009).
소나무에 수간주사를 하는 방법은 나무의 수간에 드릴을 이용하여 천공을 하고 여기에 약제를 주입하게 되는데 천공 구멍에 약제를 채우기도 하고, 천공부위에 주입병을 삽입하여 약제를 주입하기도 한다(Lee et al., 2008). 이러한 천공과 약제주입을 위해서는 소나무의 수간 직경이 최소 2 cm 내외가 되어야 하는데 3년생 이상의 묘목이 필요하다. 따라서 수간주사 실험을 하기 위해서는 3년생 이상의 묘목을 화분에 이식하고, 일정 기간 경과하여 활착이 된 후 실험을 수행하여야 하기 때문에 준비기간이 한 달 이상 소요된다. 또한 실험 후 소나무재선충이 감염 된 고사목은 소각이나 훈증과 같은 처리가 필요로 하며 소나무재선충 발생지에서 실험을 하거나 차단 된 공간 내에서만 실험이 가능하다.
야외에서의 수간주사 실험은 소나무재선충 발생지에서만 가능하고, 실험이 끝난 후 발생하는 고사목은 벌목 후 집제하여 킬퍼와 같은 약제로 훈증처리하고 있다. 따라서 야외에서 수간주사 효과를 검정하는 것은 소나무재선충 확산의 우려도 있고, 실험 후 고사목 처리를 위한 시간과 비용이 많이 들어가는 단점이 있다.
따라서 본 연구에서는 수간주사를 통한 소나무재선충에 대한 선충 활성 검정을 쉽고, 간편하게 수행하면서 실제 야외실험과 동일 한 결과를 얻을 수 있는 방법을 찾기 위하여 수행하였는데 자연림 내에 있는 소나무에 수간주사를 한 후 가지 부분을 절단하여 소나무재선충을 접종하여 살선충 효과를 검정하는 방법을 강구하였다.
재료 및 방법
소나무재선충
소나무재선충은 소나무재선충병의 피해지역인 경남 진주 지역에서 소나무재선충에 감염된 해송 시료를 채취하여 실험실에 가져와 깔때기법으로 분리한 후 사용하였는데(Korea Forest Service, 2005) 실험을 할 때마다 2일전에 시료를 채취하고, 깔때기에서 분리한 당일 접종하였다.
소나무류 가지에서 소나무재선충 증식 조사
직경 2 cm 내외의 마디가 없는 곰솔의 곧은 가지를 전정가위를 이용하여 절단하였다. 절단한 곰솔의 가지 토막은 지퍼팩에 넣고, 실험실로 운반한 뒤 20 cm 내외가 되도록 잘랐다. 자른 가지는 파라핀을 가열하여 녹인 다음 소나무 절단면을 녹인 파라핀 액에 1-2초간 넣은 후 빼내어 파라핀으로 도포 한 처리와 도포를 하지 않은 무처리로 구분하여 처리하였다. 처리 후 각 가지 토막의 가운데 부분 1 cm를 칼을 이용하여 수피부분을 한 쪽 부분이 붙어있게 절개하였다. 절개 한 부분에 솜을 넣은 후, 직경 1 cm당 1,000마리의 소나무재선충 1 ml를 피펫으로 접종하였다. 접종 후 접종 부분의 건조를 막기 위하여 파라필름으로 싼 뒤, 다시 가정용 호일로 싸고, 전체 무게를 측정하였다. 무게 측정 후 25°C 항온기에 원래 가지의 윗부분이 위로 향하도록 세워서 보관하였다. 30일 후 전체 무게를 측정 한 뒤, 접종 부분을 중심으로 위쪽과 아래쪽 3-5 cm부분과 8-10 cm 부분을 톱으로 자르고, 자른 부분의 무게를 다시 측정하였다. 톱으로 자른 나무토막은 도끼와 전정가위를 이용하여 5 mm 이하의 폭으로 쪼갠 뒤 깔데기법으로 소나무재선충을 분리하였는데 킴와이프 1장을 깐 깔데기 속에 쪼갠 나무를 넣고, 증류수를 나무 시료들이 잠기도록 채웠다. 하루가 지난 후 분리 된 소나무재선충을 해부현미경 하에서 계수하였다. 한 개의 나뭇가지를 한 반복으로 5반복 수행하였다.
말구 직경이 25 cm 내외인 곰솔을 직경이 20 (20.5 ± 1.6) cm 내외인 부분과 15 (15.6 ± 1.0), 10 (10.0 ± 0.5), 5(5.1 ± 0.4) cm 내외인 부분으로 나누어 20 cm 길이로 절단하였다. 절단 한 나무토막은 가정용 랩을 이용하여 절단면을 싼 후, 소나무재선충을 접종하였는데 직경 7 mm 드릴로 천공한 후, 직경 당 1,000마리의 선충을 접종하였다. 모든 처리에서 선충 접종 시 전체 접종량은 1 ml가 되게 처리하였으며 처리 후 천공 부위를 솜으로 막았다. 천공부위는 파라필름으로 감고, 쿠킹호일로 다시 감은 뒤 무게를 재었다. 처리 후 25 ± 5°C의 실험실 내에 보관하였는데 자른 토막 면이 원래 소나무가 서 있는 방향으로 세워 두었고, 30일 후에 전체 무게를 조사한 후 접종 부위로부터 위와 아래 3-5 cm 부분과 8-10 cm 부분을 톱으로 잘랐다. 자른 원판을 소나무재선충을 접종한 부분과 반대부분으로 구분하여, 무게를 잰 다음 상기의 방법으로 소나무재선충을 분리하여 현미경 하에서 계수하였다. 한 개의 수간부 토막을 한 반복으로 5반복 수행하였다.
자연림의 곰솔과 소나무에서 직경 2 cm 내외의 마디가 없는 곧은 가지를 30 cm 내외 길이로 절단 한 뒤, 지퍼팩에 넣어 실험실로 운반하였다. 파라핀을 절단면 양쪽에 도포한 후, 가지 절단면의 파라핀 도포가 소나무재선충에 미치는 영향과 동일한 방법으로 소나무재선충을 접종하고, 25°C 항온기에 원래 가지의 윗부분이 위로 향하도록 세워서 보관하였다. 소나무재선충의 접종 밀도는 직경 cm 당 10, 100, 1,000마리를 접종 하였고, 조사는 처리 후 10, 20, 30일 후에 하였는데 파라핀 도포 실험과 동일한 부분을 잘라 선충 밀도를 조사하였다. 하나의 가지를 한 반복으로 8반복 처리하였다. 곰솔의 가지 평균직경은 2.3 ± 0.1 cm였고, 소나무는 2.3 ± 0.2 cm였다.
야외에서 수간주사 효과 검정
소나무재선충 방제용 농약으로 우리나라에 등록되어 있는 morantel tartrate 8% 액제와 emamectin benzoate 2.15% 유제를 실험에 이용하였다(Korea Crop Protection Association 2011). Morantel tartrate 유제는 아마진계 농약으로 사용적기는 11월부터 다음 해 3월까지이며 emamectin benzoate는 Streptomyces avermitilis 토양세균으로부터 분리한 천연물 유도형 농약으로 1-2월에 원액을 수간주사 한다(Tomlin, 2006; Korea Crop Protection Association, 2011).
2011년 2월 10일 경남 진주시 가좌동 경상대학교 주변의 곰솔 천연림에서 수간주사를 하였다. 수간주사를 하기 전에 흉고직경을 측정하였고, 충전식 휴대용 드릴을 이용하여 6.5 mm 직경의 드릴로 지상부로부터 1 m 부근에 30° 각도로 천공한 뒤 emamectin benzoate 2.15% 유제는 피펫을 이용하여 직경 cm당 1 ml를 주입하였고, morantel tartrate 8% 액제는 220 ml를 주입병을 이용하여 주입하였다. Emamectin benzoate 처리목은 흉고직경에 따라 천공하는 구멍의 수는 달리하였으며 morantel tartrate는 1개의 구멍을 천공한 후 주입병을 삽입하였다(Lee et al., 2008). 무처리는 물만 수간주사하였고, 한 그루의 나무를 한 반복으로 10반복 처리하였다. 수간주사 처리목의 평균흉고직경은 10.7 ± 2.3(6.0-15.0) cm였다.
수간주사 한 달과 두 달 후 각 처리목을 대상으로 지상부에서 가장 가까운 가지를 한 가지씩 절단한 뒤 직경 2 cm 내외의 마디가 없는 곧은 부분을 전정가위를 이용하여 절단하였다. 절단한 가지 토막은 지퍼팩에 넣고, 실험실로 운반한 뒤 20 cm 내외가 되도록 잘랐다. 자른 가지는 앞에서 언급한 방법으로 파라핀으로 도포 한 후, 소나무재선충을 접종하고, 파라필름과 쿠킹호일로 접종부위 둘레를 싸 메었다. 무게를 측정한 후, 25°C 항온기에 세워서 30일 동안 보관하였고, 한 달 후에 접종부분으로부터 상하로 3-5 cm 되는 부분을 톱으로 자른 뒤 무게를 재고, 전술 Tm0 한 바와 같은 방법으로 소나무재선충의 밀도를 조사하였다. 각 나무에서 채취한 하나의 가지를 한 반복으로 10반복 처리하였다.
가지 절단면의 파라핀 도포 유무에 따른 소나무재선충 증식수의 비교는 t-test로 두 집단간 차이를 비교(PROC TTEST)하였고, 접종원으로부터 상하 거리별에 따른 증식량의 차이는 각 처리 가지의 조사 부분별 전체 증식수를 구한 뒤, 각 부분별에서 증식 된 비율을 계산해서 평균간 차이를 Tukey test로 분산분석(PROC ANOVA) 하였다(Cho, 2006). 곰솔의 직경별에 따른 소나무재선충의 증식량은 각 경급별(직경 5, 10, 15, 20 cm)로 구분하여 평균간 차이를 Tukey test로 분산분석(PROC ANOVA) 하였으며(Cho, 2006) 전체 자료를 대상으로 직경과 증식과의 상관관계를 상관분석(PROC CORR) 하였다(Cho, 2006). 또한 소나무재선충 접종방향과 반대방향의 증식량 차이는 t-test로 집단 간 차이를 비교(PROC TTEST)하였다(Cho, 2006). 수간주사 효과도 처리별로 소나무재선충의 증식수를 Tukey test로 분산분석(PROC ANOVA) 하였다(Cho, 2006).
결 과
소나무류 가지에서 소나무재선충 증식 조사
가지 절단면의 파라핀 도포는 곰솔 가지의 수분 손실을 78.6% 감소시켰다 (Pr>|t|=<0.0001)(Table 1).
또한 선충의 증식수에도 영향을 미쳐 파라핀을 도포하여 수분손실이 적은 처리에서 증식이 많이 되었다(Pr>|t|=<0.0048) (Table 1).

Effect of paraffin sealing on twig moisture and reproduction of pine wood nematode, Bursaphelenchus xylophilus in twig of Japanese black pine, Pinus thunbergii at 30 days after nematode inoculation
전체적으로 소나무재선충을 접종한 후 수분손실이 많이 될수록 소나무재선충의 증식은 적게 되었다(Fig. 1).
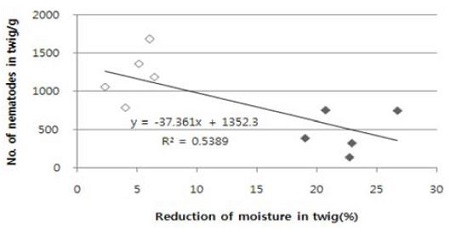
Effect of reduction of moisture in twig on pine wood nematode reproduction in twig of Japanese black pine, Pinus thunbergii at 30 days after nematode inoculation in 25°C incubator. Open diamond were paraffin sealing treatment in edge of cutting side of Japanese black pine twig and dark diamond were no paraffin sealing treatment.
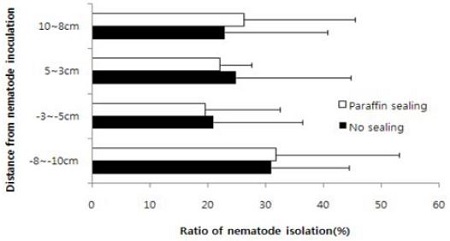
소나무재선충 접종부위로부터 거리별에 따른 증식수는 파라핀 sealing 유무와 관계없이 차이가 없었다(Fig. 2).
곰솔의 수간 직경에 따른 소나무재선충의 증식량을 조사한 결과는 Fig. 3과 같았다.
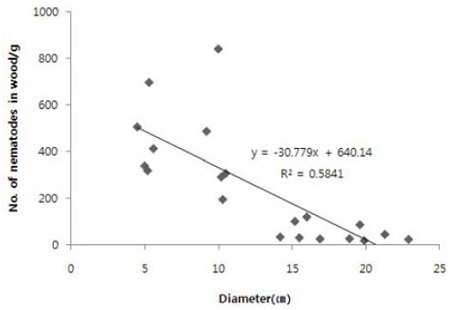
직경이 작을수록 소나무재선충 증식수는 많아 직경 5 cm에서 453.9마리/g이 증식되어 20 cm의 41.8마리/g에 비하여 9배 이상의 차이를 보였다(df=3, 16, F=11.01, P<0.0004).
소나무재선충 접종면과 반대쪽 면의 증식된 선충수는 전체적으로 선충을 접종한 면과 동일 부분의 선충 증식이 많았는데(동일부위 증식 선충수=301 ± 70.0/g wood, 접종 반대부위 증식 선충수=190 ± 44.3 g wood, Pr|t|=<0.0218) 직경별로는 20 cm인 경우만 통계적 차이가 있었다(Fig. 4, Pr|t|=<0.0286).
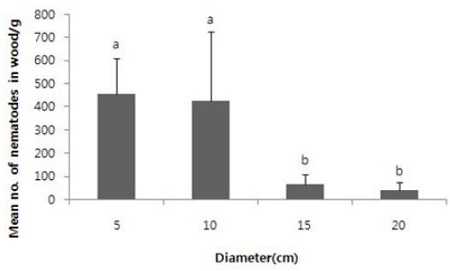
Effect of diameter log on reproduction of pine wood nematode in Japanese black pine at 30 days after inoculation of 1000 Ijs/diameter of log cm in 25°C incubator. The same lower case letters above the bars in each diameter indicate no significant difference among the means (Duncan’s multiple range test at P<0.0004). Bar was standard deviation.
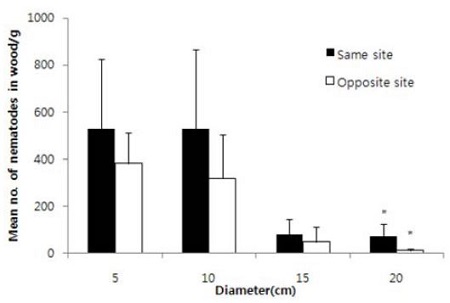
Mean reproduced number of pine wood nematodes depending on sampling sites (same vs opposite site of inoculation) in Japanese black pine log. Nematodes were isolated from log. *was indicated significant difference among the means (T-test, P<0.0286). Bar was standard deviation.
실험에 이용한 전체 곰솔의 직경과 g당 선충수를 비교한 결과는 Fig. 5와 같았다. 직경이 작을수록 증식되는 소나무재선충의 수는 증가하였다.
소나무재선충의 접종농도와 접종 후 기간은 소나무재선충의 증식수에 영향을 미쳤으나 곰솔과 소나무의 두 수종 간에는 대부분 차이를 보이지 않았다(Table 2, Fig. 6). 소나무재선충 10마리와 100마리 접종 시에는 소나무 가지에서 곰솔에 비하여 증식수가 많은 경향을 보였으나 100마리 접종 후 20일차 조사를 제외하고는 통계적 차이는 없었으며 1,000마리 접종의 경우 곰솔에서 증식수가 많은 경향이었으나 1,000마리 접종 후 20일차 조사에서만 통계적 차이를 보였다.

Analysis of variance for main effects and interaction of pine tree species, inoculation concentration of pine wood nematode, and days after inoculation on number of pine wood nematode in twig
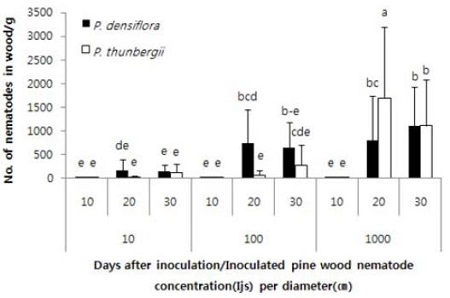
Effect of days after inoculation and inoculation concentration of pine wood nematode on number of alive pine wood nematodes in twig (mean diameter was 2.3 cm) of Pinus densiflora and P. thunbergii in 25°C incubator. The same lower case letters above the bars indicate no significant difference among the means (Duncan’s multiple range test at P<0.0001). Bar was standard deviation.
소나무재선충 방제용으로 등록 된 두 종의 농약을 곰솔에 수간주사하고, 한 달 후에 가지를 채취하여 소나무재선충을 접종한 결과 emamectin benzoate 2.15% 유제를 수간주사한 가지에서는 195.1마리의 소나무재선충만이 생존하여 무처리구의 3075.4마리와 큰 차이를 보였으나 morantel tartrate 8% 액제 처리에서는 2329.3마리가 분리되어 무처리와 차이가 없었다(df=11, 18, F=2.41, P<0.0472)(Fig. 7). 그러나 수간주사 60일 후에 채취한 가지에 소나무재선충을 접종 한 결과 emamectin benzoate 2.15% 유제와 morantel tartrate 8% 액제 처리 모두 무처리구에 비해 적은 선충수를 보였다(df=11, 18, F=3.57, P<0.0082). 수간주사 30일 후에 채취한 가지의 소나무재선충 접종 30일 후 수분 손실량은 모든 처리에서 차이를 보이지 않았는데(df=11, 18, F=1.27, P< 0.3176) emamectin benzoate 2.15% 유제 처리에서는 4.1 ± 1.3%, morantel tartrate 8% 액제 처리에서는 4.5 ± 1.8%, 무처리구에서는 3.4 ± 1.4%였다. 수간주사 60일 후 채취한 가지에 소나무재선충을 접종하고, 30일 후의 가지 내 수분감소율은 30일 후에 처리한 것에 비하여 현저하게 높았으나 처리 간 차이는 없었다(emamectin benzoate 2.15% 유제 처리 21.1 ± 6.0%, morantel tartrate 8% 액제 처리 22.8 ± 4.9%, 무처리 25.0 ± 7.2%).
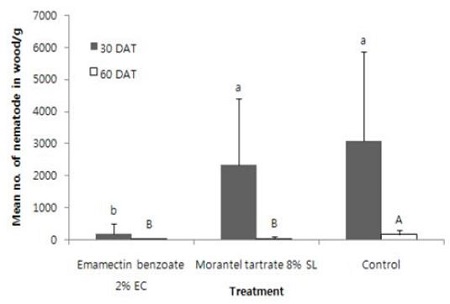
Efficacy of trunk injection of emamectin benzoate 2% EC and morantel tartrate 8% SL against pine wood nematode in Japanese black pine at 30 and 60 days after treatment. Pine wood nematodes were inoculated on the twig of injected trunk of Japanese black pine. The same lower case and upper case letters above the bars in each days after treatment (DAT) indicate no significant difference among the means (Duncan’s multiple range test at P<0.05). Bar was standard deviation.
고 찰
소나무재선충 방제를 위한 약제의 선발은 다른 해충 방제제의 개발과는 달리 살선충 활성 검정과 소나무 수체 내 이동 검정이라는 두 가지 인자를 모두 고려하여야 한다. 그러나 기존의 방법들은 상대적으로 수행하기가 용이하고, 1차적으로 필요한 살선충 활성 검정에 많이 치우쳐 있거나 소나무에 직접 적용하는 연구로의 진척이 적었다(Kong et al., 2006, 2007; Elbadri et al., 2008, Lee et al., 2010). 이는 소나무에 대한 실험들이 비용과 시간, 노력이 많이 드는 단점을 가지고 있고, 실험 후 소나무재선충 감염목을 완벽하게 제거해야 하는 단점이 있기 때문으로 현장에 적용할 수 있는 소나무재선충 방제제 개발에 부합하는 실험방법의 개발이 매우 필요한 실정이다. 본 연구에서는 소나무에 수간주사나 또는 방제제를 처리한 후, 소나무에 직접 소나무재선충을 접종하는 실험방법을 개선하여 소나무의 일부 가지부분을 채취한 뒤, 여기에 소나무재선충을 접종하여 방제 효과를 규명하는 방법의 적용가능성을 알아보기에 수행하였다. 그러기 위하여 1차적으로 소나무 가지에 소나무재선충을 접종 시 적정 농도와 증식에 소요되는 기간, 접종하는 가지나 나무의 적정 크기, 절단한 가지의 건조가 소나무재선충 증식에 어떤 영향을 미치는지의 규명과 2차적으로는 실제 수간주사를 통해 가지부분에 소나무재선충을 접종하여 수간주사의 효과를 규명하였다.
파라핀으로 절단 부분을 도포 할 경우 가지의 건조 방지효과가 4배 이상 높았으며 소나무재선충의 증식은 3배 가량 높았다. 자연 상태에서는 수분이나 동화산물의 이동이 지속적으로 이루어지지만 소나무에서 가지를 잘라 소나무재선충을 접종 할 경우 이러한 이동이 차단되고, 아울러 자연 상태와는 달리 나무의 건조가 진행된다. 따라서 자연 상태와 유사한 조건을 형성할 수 있는 방법을 알아보기 위하여 수행하였는데 Oku et al.(1989)은 시험관에 살균수를 넣고, 여기에 절단한 가지 부분을 삽입하고, 소나무재선충을 접종 한 후 소나무재선충의 이동력을 검정하였다. 그러나 본 연구와 같이 방제제를 수간주사 한 후, 물에 담구면 방제제가 희석되어 약효가 감소 할 우려가 있어 감나무의 접목 시 수분증발과 병해충 침입 방지를 위해 사용하는 도포제인 파라핀을 활용하였는데 건조방지 효과가 우수하여 모든 실험에 적용하여 사용하였다.
소나무의 수분함량이 적을수록 소나무재선충의 증식은 감소하였는데 살아있는 나무에서는 소나무재선충이 감염되면 체관부가 건조해지고, 형성층이 괴사되어 함수량이 감소한다(Ikeda and Suzaki, 1984; Kuroda et al., 1991; Fukuda et al., 1992). 따라서 수체 내 수분함량과 재선충의 증식사이에는 밀접한 관련이 있는 것으로 생각되며 본 연구에서와 같이 가지부분을 절단하여 소나무재선충의 증식과 관련 된 실험을 할 경우 건조 조건을 동일 시 하게 하는 것이 매우 중요할 것으로 생각되는데 본 실험과 같이 파라핀으로 도포하는 것이 매우 유용할 것이다.
한편 모든 실험은 25°C에서 수행하였는데 소나무재선충의 생존은 20-35°C 사이에서 7일 후까지 차이가 없고, 이동력은 10°C에 비하여 30°C에서 활발하며(Rutherford et al., 1990) 증식은 20°C에서 가장 잘 되었는데(Takemoto, 2008), 소나무재선충의 생활사는 30°C에서는 3일이 걸리고, 25°C에서는 4-5일이 걸린다(Mamiya, 1975). 그러나 소나무재선충을 접종한 소나무의 고사는 20°C 이하에서는 발생하지 않았다(Kishi, 1995). 따라서 본 연구에서는 소나무재선충의 생존과 증식에 문제가 없고, 소나무에 대한 고사가 발생하는 25°C에서 실험을 수행하였다.
소나무재선충 접종 부위로부터 소나무재선충의 이동은 방향성이 없이 상하로 이동하였는데 소나무재선충을 매개하는 솔수염하늘소가 소나무재선충을 소나무에 감염시킬 때 솔수염하늘소가 소나무 신초의 초두부를 가해하는 동안 감염되어 전체 소나무 수간으로 확산(Kobayashi et al., 1984)되는 것을 고려하면 소나무 수체 내에서 소나무재선충은 상하간에 자유로이 이동하는 것으로 생각된다. 소나무재선충의 수체 내 이동이나 증식은 수종에 따라 다르며 30°C에서 2년생 곰솔의 원줄기에서 이동력을 조사한 결과, 2.5 cm 구간을 24시간 후에 25% 이상의 선충이 이동하였고, 5 cm 구간은 2.5 cm의 절반정도 이동하였다(Oku et al., 1989). 따라서 소나무의 가지를 절단하여 소나무재선충을 접종하고, 선충을 조사할 때는 온도와 접종 농도를 고려하여 조사부위를 결정해야 할 것으로 생각되며 실험 결과의 객관적 평가를 위해서는 접종 부위로부터 동일한 위치를 조사하는 것이 필수적 일 것이다.
소나무 직경별에 따른 소나무재선충의 증식은 5 cm와 10 cm가 15 cm나 20 cm에 비하여 10배 가량 높았다. 소나무나 곰솔 모두 유령목이 노령목에 비하여 소나무재선충에 감수적이다(Kishi, 1999). 따라서 가지나 수간부의 일부를 이용하여 소나무재선충 증식이나 생존과 같은 실험을 할 때에는 소나무재선충의 용이한 증식과 공간 이용의 수월성, 작업량의 감소 등을 고려하여 2-5 cm 내외의 것을 이용하는 것이 바람직 할 것으로 생각된다. 한편 소나무재선충의 접종부위와 반대 부분 간 소나무재선충의 밀도 차이는 직경 15 cm 이내에서는 차이가 없었고, 20 cm에서는 접종 부위의 소나무재선충 증식량이 많았다. 따라서 15 cm 이내의 소나무를 대상으로 실험할 때는 가지나 수간의 전체나 일부분을 무작위로 사용해도 상관이 없으나 20 cm 이상의 대경목에서는 시료를 채취하는 부분도 소나무재선충의 접종부위를 중심으로 동일 한 곳에서 채취를 해야 할 것이다.
곰솔과 소나무 간에는 소나무재선충의 증식에 차이를 보이지 않았다. 두 수종 모두 소나무재선충에 감수적인 수종으로(Takeuchi, 2008) 두 수종의 추출물에서 소나무재선충의 탈피율도 동일하다(Mamiya, 1983). 직경 당 100마리 이하로 소나무재선충을 접종 한 경우는 소나무가 곰솔에 비하여 증식량이 많았으나 1,000마리 접종 시에는 곰솔에서 증식량이 많았다. 따라서 접종 농도를 적게 할 경우에는 소나무를 실험 대상목으로 하고, 고농도 선충 접종 시에는 곰솔이 유리 할 것으로 생각된다. 또한 직경 당 10마리 접종 시에는 증식량이 적고, 증식 속도가 느려 실내에서 소나무재선충 살선충 효과를 검정하기에는 부적절 할 것으로 생각되며 100마리나 1,000마리 수준으로 접종하는 것이 바람직할 것으로 생각되는데 100마리 접종 후 30일 후에 조사하거나 1,000마리 접종 후 20일 경과 후에 조사하는 것이 바람직 할 것으로 생각된다. 그리고 소나무재선충의 이동이 30°C에서는 24시간 후에도 2.5 cm를 이동하고, 3일만 경과하면 한 세대를 경과하지만(Mamiya, 1975; Oku et al., 1989) 본 실험의 결과에서는 접종 10일 후에는 접종 농도와 상관없이 생존이나 증식되는 소나무재선충이 매우 적었다. Iwahori와 Futai (1996)도 3년생 곰솔에 2,000마리의 소나무재선충을 접종 시 21일째에 왕성한 증식을 보였다.
소나무재선충의 매개충이 운반하는 소나무재선충의 밀도나 우리나라나 일본에서 소나무재선충 매개에 가장 많이 관여하는 솔수염하늘소가 매개하는 소나무재선충의 밀도는 지역이나 년도, 보유하는 곰팡이의 종류에 따라 차이를 보이는데(Kobayashi et al., 1984; Maehara and Futai, 1996, 2002), Kim et al. (2009)에 의하면 우리나라에서 솔수염하늘소로부터 이탈 되는 소나무재선충의 수는 3,570마리였다. 한편 솔수염하늘소는 기주인 소나무를 이동하여 다니는데 암컷의 경우 6.4본, 수컷은 7.2본을 옮겨 다닌다고 하였는데(Kim et al., 2011) 한 그루의 소나무에 한 마리의 솔수염하늘소가 가해를 한다고 가정하면 500여 마리의 소나무재선충이 하늘소로부터 기주로 이탈된다. 따라서 단순한 비교는 곤란하지만 본 연구에서 설정한 흉고 직경 당 100마리나 1,000마리 수준의 접종 농도가 자연 상태와 현저한 차이를 보이는 조건은 아닌 것으로 생각된다.
소나무재선충 방제에 등록되어 있는 농약은 수간주사 30일 후에는 emamectin benzoate에서만 효과가 있었고, morantel tarterate에서는 효과가 없었으나 수간주사 60일 후에는 두 약제 모두 효과가 있었다.
Morantel tartrate는 수간주입 된 약액이 소나무 전체로 이동하는데 2-3개월이 소요되는 이동성이 느린 약재이기 때문에 약효가 늦게 발현된 것으로 생각되며(Korea Crop Protection Association, 2011) emamectin benzoate의 경우 이동력이 빨라 30일 후에도 소나무재선충 증식 억제 효과가 나타난 것으로 생각된다. 한편 소나무재선충의 증식수는 동일 처리 간에도 차이가 많았는데 이는 처리한 약제의 수간이나 수관 내의 이동이 일정하게 이루어지지 못하기 때문으로 생각된다. 실제로 abamectin이나 emamectin benzoate의 경우 동일 나무에서 측정하는 부분에 따라 잔류되는 약량의 차이를 보이고, 하나의 수간판을 4등분 하였을 때 잔류되는 량에도 차이를 보였다(Takai et al., 2003b; Lee et al., 2009). 수간이나 수관 내로 수분의 이동은 수관부의 엽량이나 가지의 량, 토양 내 수분의 함량, 광합성량 등에 따라 영향을 받는다. 따라서 수체 내로의 약제 이동이 여러 가지 조건에 따라 따를 수 있기 때문에 수간 주입한 약제의 효과를 검정하기 위해서는 다양한 부분의 가지를 이용하여 증식여부를 조사하는 것도 필요할 것으로 생각된다.
본 연구는 제한적이기는 하지만 소나무의 가지나 일부분을 이용하여 소나무재선충에 대한 방제제 개발 실험을 수행할 수 있음을 입증하였다.
References
- Cheng, H. R., M. Lin, W. Li, and Z. Fang, (1983), The occurrence of a pine wilting disease caused by a nematode found in Nanjing, Forest Pest and Disease, 4, p1-5.
- Cho, I. H., (2006), Statistical consulting and SAS lecture, Youngjin.com, p805.
-
Dwinell, L. D., (1997), The pinewood nematode: regulation and mitigation, Ann. Rev. Phytopathol, 35, p153-166.
[https://doi.org/10.1146/annurev.phyto.35.1.153]

- Dwinell, L. D., and W. R. Nickle, (1989), An overview of the pinewood nematode ban in North America, General Technical Report SE-55, North America Forestry Commission Publication No. 2, Southeastern Forest Experimental Station, Forest Service, United States Department of Agriculture.
-
Elbadri, G. A. A., D. W. Lee, J. C. Park, H. B. Yu, H. Y. Choo, S. M. Lee, and T. H. Lim, (2008), Nematicidal screening of essential oils and herbal extracts against Bursaphelenchus xylophilus, Plant Pathol. J, 24, p178-182.
[https://doi.org/10.5423/PPJ.2008.24.2.178]

- Fukuda, K., T. Hogetsu, and K. Suzuki, (1992), Phytosynthesis and water status of pine-wood nematode-infected pine seedlings, J. Jpn. For. Soc, 74, p1-8.
-
Futai, K., (2008), Pine wilt in Japan: from first incidence to the present, In Pine wilt disease: Zhao, B. G. Eds, Springer, Japan, p5-25.
[https://doi.org/10.1007/978-4-431-75655-2_2]

- Ikeda, T., and T. Suzuki, (1984), Influence of pine-wood nematodes on hydraulic conductivity and water status in Pinus thunbergii, J. Jap. For. Soc, 66, p412-120.
- Iwahori, H., and K. Futai, (1996), Changes in nematode population and movement in pine seedlings with the development of pine wilt disease: suppressive effects of water extracts from infected pine seedlings on the movement of nematodes, Appl. Entomol. Zool, 31, p1-20.
-
Kamata, N., (2008), Intergrated pest management of pine wilt disease in Japan: tactics and strategies, In Pine wilt disease: Zhao, B. G. Eds, Springer, Japan, p304-322.
[https://doi.org/10.1007/978-4-431-75655-2_32]

-
Kim, D. S., S. M. Lee, C. S. Kim, D. W. Lee, and C. G. Park, (2011), Movement of Monochamus alternatus Hope (Coleoptera: Cerambycidae) adults among young black pine trees in a screen cage, Korean J. Appl. Entomol, 50, p1-6.
[https://doi.org/10.5656/KSAE.2010.04.0.014]

-
Kim, D. S., S. M. Lee, H. S. Huh, N. C. Park, and C. G. Park, (2009), Escape of pine wood nematode, Bursaphelenchus xylophilus, through feeding and oviposition behavior of Monochamus alternatus and M. saltuarius (Coleoptera: Cerambycidae) adult, Korean J. Appl. Entomol, 48, p527-533.
[https://doi.org/10.5656/KSAE.2009.48.4.527]

- Kishi, Y., (1995), The pinewood nematode and Japanese pine sawyer, Thomas, Tokyo, p302.
- Kishi, Y., (1999), Influence of tree age on wilt and mortality of pines after inoculation with Bursaphelenchus xylophilus, J. Jpn. For. Soc, 81, p330-333.
-
Kobayashi, F., A. Yamane, and T. Ikeda, (1984), The Japanese pine sawyer beetle as the vector of pine wilt disease, Ann. Rev. Entomol, 29, p115-135.
[https://doi.org/10.1146/annurev.en.29.010184.000555]

-
Kong, J. O., S. M. Lee, Y. S. Moon, S. G. Lee, and Y. J. Ahn, (2006), Nematicidal activity of plant essential oils against Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae), J. Asia-Pacific Entomol, 9, p173-178.
[https://doi.org/10.1016/S1226-8615(08)60289-7]

- Kong, J. O., S. M. Lee, Y. S. Moon, S. G. Lee, and Y. J. Ahn, (2007), Nematicidal activity of cassia and cinnamon oil compounds and related compounds toward Bursaphelenchus xylophilus (Nematoda: Parasitaphelenchidae), J. Nematol, 39, p31-36.
- Korea Crop Protection Association, (2011), Guide book of pesticides using, Samjung Press, Seoul, Korea.
- Korea Forest Research Institute (KFRI), (2006), Technique guide of forest disease and insect pests, KFRI, p300.
- Korea Forest Service, (2005), Practical manuals for effective control of pine wood nematode, p228, (In Korean).
- Korea Forest Service, (2009), Statistical yearbook of forestry 2008, Korea Forest Service, http://www.forest.go.kr.
- Kuroda, K., T. Yoshihiro, and S. Ito, (1991), Development of the pine-wilt disease in Pinus densiflora from the stand point of water conduction, J. Jpn. For. Soc, 73, p69-72.
- Lee, D. W., S. M. Lee, S. H. Lee, and H. Y. Choo, (2010), Nematicidal activity of some herval extracts against the pine wood nematode, Bursaphelenchus xylophilus, Korean J. Soil Zool, 14(1-2), p43-49.
- Lee, S. M., D. S. Kim, C. S. Kim, H. Y. Choo, and D. W. Lee, (2008), Possibility of simultaneous control of pine wilt disease and Thecodiplosis japonensis and or Matsucoccus thunbergianae on black pine (Pinus thunbergii) by abamectin and emamectin benzoate, Korean J. Pesticides Sci, 12, p363-367.
- Lee, S. M., D. S. Kim, S. G. Lee, N. C. Park, and D. W. Lee, (2009), Selection of trunk injection pesticides for preventive of pine wilt disease by Bursaphelenchus xylophilus on Japanese black pine (Pinus thunbergii), Korean J. Pesticides Sci, 13, p267-274.
-
Mackeen, M. M., A. M. Ali, M. A. Abdullah, R. M. Nasir, N. B. Mat, A. R. Razak, and K. Kawazu, (1997), Antinematicidal activity of some Malaysian plant extracts against the pine wood nematode, Bursaphelenchus xylophilus, Pestic. Sci, 51, p165-170.
[https://doi.org/10.1002/(SICI)1096-9063(199710)51:2<165::AID-PS623>3.0.CO;2-2]

- Mamiya, Y., (1975), The life history of the pine wood nematode, Bursaphelenchus lignicolus, Jpn. J. Nematol, 5, p16-25.
- Mamiya, Y., (1983), The effect of wood tissues on the molting rate of the dauerlarvae of Bursaphelenchus xylophilus, Japanese J. Nematol, 13, p6-13.
- Mamiya, Y., (1988), History of pine wilt disease in Japan, J. Nematol, 20, p219-226.
- Maehara, N., and K. Futai, (1996), Factors affecting both the numbers of pinewood nematode, Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae), carried by the Japanese pine sawyer, Monochamus alternatus (Coleoptera: Cerambycidae), and the nematode's life history, Appl. Entomol. Zool, 31, p443-452.
-
Maehara, N., and K. Futai, (2002), Factors affecting the number of Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae) carried by several species of beetles, Nematology, 4, p653-658.
[https://doi.org/10.1163/15685410260438944]

-
Mota, M., H. Braasch, M. A. Bravo, A. C. Penas, W. Burgermeister, K. Metge, and E. Sousa, (1999), First report of Bursaphelenchus xylophilus in Portugal and in Europe, Nematology, 1, p727-734.
[https://doi.org/10.1163/156854199508757]

-
Oku, H., T. Shiraishi, and K. Chikamatsu, (1989), Active defense as a mechanism of resistance in pine against pine wilt disease, Ann. Phytopath. Soc. Japan, 55, p603-608.
[https://doi.org/10.3186/jjphytopath.55.603]

- Rutherford, T. A., Y. Mamiya, and M. Webster, (1990), Nematode-induced pine wilt disease: factors influencing its occurrence and distribution, Forest Science, 36, p145-155.
-
Shin, S. C., (2008), Pine wilt in Korea, In Pine wilt disease: B. G. Zhao Eds, Springer, Japan, p26-32.
[https://doi.org/10.1007/978-4-431-75655-2_5]

-
Takai, K., T. Soejima, T. Suzuki, and K. Kawazu, (2000), Emamectin benzoate as a candidate for a trunk-injection agent against the pine wood nematode, Bursaphelenchus xylophilus, Pest Manag. Sci, 56, p937-941.
[https://doi.org/10.1002/1526-4998(200010)56:10<937::AID-PS213>3.0.CO;2-B]

-
Takai, K., T. Soejima, T. Suzuki, and K. Kawazu, (2001), Development of a water-soluble preparation of emamectin benzoate and its preventive effect against the wilting of potgrown pine trees inoculated with the pine wood nematode, Bursaphelenchus xylophilus, Pest Manag. Sci, 57, p463-466.
[https://doi.org/10.1002/ps.301]

-
Takai, K., T. Suzuki, and K. Kawazu, (2003a), Development and preventative effect against pine wilt disease of a novel liquid formulation of emamectin benzoate, Pest Manag Sci, 59, p365-370.
[https://doi.org/10.1002/ps.651]

-
Takai, K., T. Suzuki, and K. Kawazu, (2003b), Distribution and persistence of emamectin benzoate at efficacious concentrations in pine tissues after injection of a liquid formulation, Pest Manag. Sci, 60, p42-48.
[https://doi.org/10.1002/ps.777]

-
Takemoto, S., (2008), Population ecology of Bursaphelenchus xylophilus, In Pine wilt disease: B. G. Zhao Eds, Springer, Japan, p105-122.
[https://doi.org/10.1007/978-4-431-75655-2_12]

-
Takeuchi, Y., (2008), Host fate following infection by the pine wood nematode, In Pine wilt disease: B. G. Zhao Eds, Springer, Japan, p235-249.
[https://doi.org/10.1007/978-4-431-75655-2_23]

- Tomlin, C. D. S., (2006), A world compendium the pesticide manual, BCPC.Hampshire, UK.
- Tzean, S., and S. Jan, (1985), The occurrence of pinewood nematode, Bursaphelenchus xylophilus in Taiwan, p38-39, In Proceedings of the 6th ROC symposium of electron microscopy.
- Yano, M., (1913), Investigation on the causes of pine mortality in Nagasaki prefecture, Sanrinkoho, 4, p1-14.
- Yi, C. K., B. H. Byun, J. D. Park, S. I. Yang, and K. H. Chang, (1989), First finding of the pinewood nematode, Bursaphelenchus xylophilus (Steiner et Buhrer) Nickle and its insect vector in Korea, Res. Rep. For. Res. Inst, 38, p141-149.