노지재배 홍고추에 대한 Cyenopyrafen 및 Fluopicolide의 생산단계 잔류특성연구
초록
본 연구는 지리적으로 다르게 위치한 노지재배 홍고추 시험포장 2곳에서 cyenopyrafen 및 fluopicolide 약제 처리 후 잔류특성으로부터 생산단계 잔류허용기준 설정을 위한 기초자료로 활용하기 위하여 수행하였다. 농약 안전사용기준에 따라 1회 약제 처리 후 0, 1, 3, 5, 7 및 10일차에 시료를 수확하였고, cyenopyrafen 및 fluopicolide를 각각 HPLC/DAD 및 GC/ECD로 기기분석을 수행하였다. Cyenopyrafen 및 fluopicolide의 분석법 정량한계는 각각 0.02 mg/kg 및 0.004 mg/kg이었고, 회수율은 79.2~111.8%였으며, 변이계수 10% 이내였다. 노지재배 홍고추에 대한 cyenopyrafen의 반감기는 시험포장 I 및 II에서 각각 2.9일 및 3.0일, fluopicolide는 각각 5.7일 및 5.1일이었다. 본 연구 결과에서 노지재배 홍고추 중 cyenopyrafen 및 fluopicolide의 잔류량은 약제 처리 후 잔류허용기준 이하로 검출되었으며, 따라서 소비자의 식품섭취에 따른 농약 노출에 대한 위해 우려가 없는 것으로 판단된다.
Abstract
The present study was performed to predict the pre-harvest residue limits (PHRLs) of cyenopyrafen and fluopicolide on red pepper under two different field conditions. The pesticides were treated one time by foliar spray according to good agricultural practice. Red peppers were harvested at 0, 1, 3, 5, 7 and 10 days after treatment and the residues of cyenopyrafen and fluopicolide were analyzed by HPLC/DAD and GC/ECD, respectively. Limit of quantitation (LOQ) of cyenopyrafen and fluopicolide were 0.02 mg/kg and 0.004 mg/kg, respectively. The recoveries of cyenopyrafen and fluopicolide were ranged to 79.2%~111.8%, with coefficient of variation ±10%. The biological half-lives of cyenopyrafen for field I and field II were calculated to be 2.9 days and 3.0 days, respectively, and fluopicolide were 5.7 days and 5.1 days, respectively. The results of this study showed that cyenopyrafen and flupicolide on red pepper were detected below the maximum residue levels established in Korea and these residue levels is not posed a health risks to consumers.
Keywords:
Cyenopyrafen, fluopicolide, half-life, pre-harvest residue limit, red pepper키워드:
사이에노피라펜, 플루오피콜라이드, 반감기, 생산단계잔류허용기준, 홍고추서 론
우리나라 국민의 식생활에서 중요한 부식 채소인 홍고추는 고온성 작물로 다양한 기능성과 함께 소비 및 이용이 확대되고 있으며, 노지재배채소 중 약 20%의 비율을 차지하여, 1975년 이래 채소류 중 가장 넓은 재배면적을 차지하고 있다(RDA, 2014). 작물 특성상 과채류 중 고온과 많은 일조량이 요구되는 노지재배 작물로 병충해 위험이 크다(Kim and Choi, 2000; Kim et al., 2009). 고추의 바이러스병 발병율은 노지재배 및 시설재배에서 각각 약 30% 및 10%의 발병율을 나타내고, 노지재배시 강우로 인한 탄저병 발병률은 약 40%이다(Yang et al., 2008). 우리나라 고추재배에서 발생하는 병해는 총 29종, 충해는 총 35종으로 생산량에 심각한 피해를 준다(RDA, 2014). 따라서, 고추에 대한 병충해를 방제하기 위하여 살균제 477종, 살충제 411종, 제초제 77종 등이 등록되어 사용되고 있다(RDA, 2017). 농약의 사용은 농작업자의 노동력 절감 및 고품질의 작물생산에 필수적이나, 소비자에 대한 위해성이 반드시 고려되어야 하므로, 정부에서는 농산물의 생산·유통단계에서 농약의 안전성조사를 통하여 관리하고 있으며, 총 부적합 중 고추류(홍고추)의 부적합이 2011년 총 861회 중 102회(26회), 2012년 총 794회 중 99회(38회), 2013년 총 716회 중 93회(37회), 2014년 총 797회 중 81회(27회), 2015년 총 892회 중 66회(21회)로 총 부적합 횟수의 약 10%이며 홍고추에서 그 비율이 가장 높게 나타났다(NAPQMS, 2011-2015). 안전성 조사에서 농약에 대한 안전기준인 농약잔류허용기준을 초과하는 부적합 농산물은 생산자에게 유통을 차단하기 위한 폐기 및 출하연기 등의 조치로 인하여 경제적인 손실을 주게 되고, 소비자에게 농약의 안전성에 대한 우려가 높아질 수 있다. 특히 홍고추는 대부분 건조하여 고춧가루로 유통되며, 건고추에서 농약 잔류량이 1.7~8.2배 증가하여 잔류허용기준을 초과하는 경우가 많아 소비자에게 고추가루 섭취에 따른 위해 가능성에 대한 우려가 있을 수 있다 (Kim et al., 2006). 따라서 농산물의 생산단계에서 농약잔류허용기준 설정에 따른 사전관리는 농산물의 유통단계 에서의 농약에 대한 안전관리를 강화하는데 중요하다.
Cyenopyrafen 및 fluopicolide은 각각 2008년 및 2006년에 고추에 등록되어 사용되고 있다. Cyenopyrafen은 복합체II에 작용하는 미토콘드리아 전자운송억제제(Mitochondrial Electron Transport Inhibitor)인 새로운 기작의 살비제로(Riga et al., 2015), 차먼지응애에 대한 방제효과가 85.96%로 우수하다. Fluopicolide는 benzamide계에 속하는 난균성 병원균에 의해 발생하는 질병을 제어하고, 고추 역병관리를 위한 약제이다(Bajya and Ranjith, 2016; Jackson et al., 2010; Wang et al., 2014). Cyenopyrafen 및 fluopicolide의 국내 농산물에 대한 잔류허용기준이 각각 농산물 16종 및 14종에 대하여 설정되어 농약이 사용되고 있으나, 국내 해당 농산물에 대한 잔류특성 연구가 cyenopyrafen은 포도, fluopicolide는 방울토마토 및 엇갈이배추로 적용 농산물에 대한 잔류특성 연구가 부족하다(Lee et al., 2011; Hur et al., 2015; Lee et al., 2015).
본 연구에서 cyenopyrafen 및 fluopicolide의 노지재배 홍고추에 대한 잔류성 시험을 수행하여 농약 잔류량의 경시적 감소에 따른 통계학적 방법을 적용하여 생물학적 반감기와 감소상수를 산출하여 생산단계 잔류허용기준 설정을 통한 농산물의 안전성 확보하는데 활용하고자 한다.
재료 및 방법
시험약제 및 시약
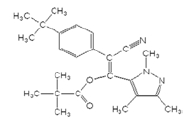
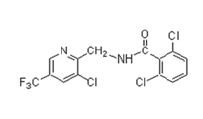
포장시험 약제는 cyenopyrafen 25% 액상수화제(상표명: 쇼크, (주)한국삼공), fluopicolide 5% 액상수화제(상표명: 해나루, (주)동방아그로)를 사용하였고, 안전사용기준 및 잔류허용기준은 Table 1과 같다(KCPA, 2017). Cyenopyrafen(순도 97.3%) 및 fluopicolide (순도 99.9%) 분석용 표준품은 Sigma-Aldrich (USA)에서 구입하여 사용하였고, 화학적 구조 및 물리화학적 특성은 Table 2와 같다(Turner, 2015). Acetonitrile, dichloromethane, n-hexane, acetone 및 ethyl acetate는 잔류분석 등급 또는 HPLC급, sodium sulfate anhydrous와 sodium chloride는 GR급으로 Merck (Germany) 및 Junsei chemical (Japan)에서 구입하여 사용하였다. Solidphase extraction cartridge (florisil 1 g, 6 cc)는 Agilent Technologies (USA)에서 구입하여 사용하였다.

Good agricultural practice and maximum residue limit of cyenopyrafen and fluopicolide on red pepper in Korea
포장시험
노지재배 홍고추(품종: 스마트) 시험포장은 충청남도 서산시 고북면 장요리 (시험포장 I) 및 충청남도 서산시 지곡면 환성리(시험포장 II)로 지리적 차이를 고려하여 시험포장 간 직선거리가 약 30 km인 2개 시험포장을 선정하여 수행하였다. 시험구는 무처리구(1반복)와 처리구(3반복)로 구성하여 시험구당 면적은 10m2 이상으로 설계하였다. Cyenopyrafen 및 fluopicolide시험약제 처리는 농약 안전사용기준에 적합하게 각각 2000배 및 1000배로 희석 조제하여, 충전식 자동 분무기((주)퍼펙트엘 EL969)를 사용하여 1.45 kgf/cm2의 압력으로 처리구당(10 m2) 2 L 수준으로 살포하였다.
시료채취 및 전처리
홍고추 시료는 약제처리 후 0, 1, 2, 3, 5, 7 및 10일차에 생육 정도가 균일하고 출하시기에 적합한 시료를 1 kg 이상(30개체 이상) 채취하였다. 채취한 시료는 라벨로 표지를 한 polyethylene bag에 넣은 후 24시간 이내에 실험실로 운반하였다. 실험실로 운반된 시료는 개체 무게를 측정한 후, 꼭지를 제거하고 3분할로 절단하여 -75oC 이하의 초저온 냉동고에 보관하였다. 시료 전처리는 초저온 냉동고에 보관한 시료를 homogenizer로 균질화하고, 보관용과 분석용 시료분리하여 냉동보관(-20oC 이하)하였다.
분석법 확립 및 잔류분석시험
분석법의 정량한계(Limit of quantification, LOQ)는 S/N ratio 10 이상인 최소검출량에 최종희석 용매량, 기기주입량, 시료량 및 희석배수를 고려하여 아래의 식으로 산출하였다(Lee, 2013).
표준검량선의 직선성 확인을 위한 검량선 표준용액은 cyenopyrafen 및 fluopicolide 분석용 표준품을 각각 acetonitrile 및 acetone에 용해하여 1,000 mg/L 표준용액을 조제한 후, 단계별로 희석하여 cyenopyrafen은 0.05, 0.1, 0.5, 1.0 및 5.0 mg/L, fluopicolide는 0.01, 0.05, 0.1, 0.5 및 1.0 mg/L 수준으로 조제하였다. 표준검량선의 직선성은 기기분석 chromatogram상의 피크면적을 기준으로 작성한 표준검량선의 회귀식에 의한 결정계수(r2) 값을 확인하였다.
회수율 시험은 무처리 시료(10 g)에 정량한계의 10배 및 50배 수준으로 cyenopyrafen과 fluopicolide 표준용액을 3반복 처리하여 균일하게 혼합하여 수행하였다. 각각의 시료에 100 mL acetonitrile을 넣고 20분간 진탕한 후 추출물을 감압여과하였고, 여과액은 1 L 분액여두에 옮겨 100 mL 포화식염수, 300 mL 증류수를 넣은 후 dichloromethane 100 mL으로 1회 분배 한 뒤 유기용매 층을 sodium sulfate에 통과시켜 수분을 제거하고 rotary vacuum evaporator를 이용하여 감압 농축하였다. 농축 건고물은 최종적으로 n-hexane 4 mL로 재용해하였다. Cyenopyrafen 분석을 위한 정제는 n-hexane 4 mL로 활성시킨 florisil cartridge (1 g, 6 cc)에 재용해한 시료용액 2 mL을 넣은 후, n-hexane 10 mL 및 n-hexane/ethyl acetate (95/5, v/v) 2 mL로 세정하고, n-hexane/ethyl acetate (95/5, v/v) 5 mL 및 n-hexane/ethyl acetate (90/10, v/v) 8 mL로 용출하였다. 용출액은 N2 gas로 농축하고 acetonitrile 2 mL로 재용해하여 HPLC-DAD로 분석하였다(Table 3). Fluopicolide 분석을 위한 정제는 정제는 n-hexane 4 mL로 활성시킨 florisil cartridge (1 g, 6 cc)에 재용해한 시료용액 2 mL을 넣은 후, n-hexane/dichloromethane (80/20, v/v) 5 mL을 세정하고, n-hexane/dichloromethane/acetonitrile (48.5/50/1.5, v/v/v) 10 mL로 용출 하였으며, 용출액은 N2 gas로 농축하고 acetone 2 mL로 재용해하여 GC-ECD로 분석하였다(Table 4).
저장안정성시험은 무처리시료(10 g)을 사용하여 cyenopyrafen 및 fluopicolide에 대하여 각각 정량한계의 50배인 1.0 mg/L 및 0.2 mg/L 농도수준으로 3반복 처리하여 균일하게 혼합한 후, 냉동조건(-20oC 이하)에서 cyenopyrafen은 76일, fluopicolide는 59일간 보관한 후, 회수율시험과 동일한 방법으로 분석시험을 수행하였다.
포장시험에서 채취한 시료 중 cyenopyrafen 및 fluopicolide의 시료채취 일자별로 무처리구 및 처리구의 잔류량 확인은 회수율시험과 동일하게 분석시험을 수행하였다.
결과 처리
홍고추 중 cyenopyrafen 및 fluopicolide의 감소상수 및 생물학적 반감기는 시간경과에 따른 잔류량을 회귀분석을 통한 일차반응식 Ct= C0·e−kt (Ct: t에서의 잔류량, C0: 초기잔류량, -k: 감소상수, t: 시간)에 적용하여 산출하였으며, F-test 및 t-test를 이용한 유의성 검정을 통하여 95% 신뢰수준의 감소상수 및 반감기를 산출하였다(MFDS, 2014).
결과 및 고찰
기상조건
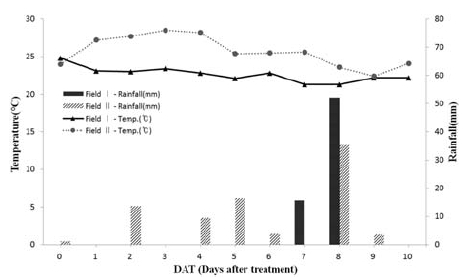
홍고추에 대한 cyenopyrafen 및 fluopicolide의 포장시험 수행기간(2014년 7월 29일~2014년 9월 5일) 중 기온은 시험포장 I 및 시험포장 II에서 각각 21.3~24.8oC 및 22.4~28.5oC였고, 강우량은 시험포장 I은 약제처리 후 7일 및 8일에 각각 15.7 mm/day 및 52.2 mm/day, 시험포장 II는 약제처리 후 0, 2, 4, 5, 6, 8 및 9일 차에 1.2 mm/day~35.5 mm/day였다(Fig. 1). 시험포장 II의 0일차 강우는 1.2 mm/day의 적은 량으로 오전 6시경이었으며, 약제 처리는 작물 표면이 강우에 의한 영향으로 습기가 없는 것을 확인한 후에 살포하여, 0일차 초기 잔류량에 영향을 주지 않았고, 2일차의 강우는 cyenopyrafen 및 fluopicolide의 1일차와 2일차의 잔류량이 차이가 적어 약제처리 후 초기 잔류량에 강우에 의한 영향이 없는 것으로 판단되었다(Fig. 2). 약제 처리 후 4일차 이후에는 시험포장 I 및 II에서 강우가 있었으며, 노지재배 특성상 강우에 의한 영향은 배제할 수 없으나, 시험포장 I 및 II의 잔류량 변화 및 반감기가 유사하여 강우의 영향에 의한 시험포장간 차이는 없었다(Fig. 2).
분석법 검증
홍고추 시료 중 cyenopyrafen 및 fluopicolide의 기기분석 chromatogram상의 머무름 시간은 11.8분 및 7.9분이었으며, 무처리시료에서 정량분석에 영향을 줄 수 있는 간섭물질이 없는 것을 확인하였다(Fig. 3, 4). Cyenopyrafen 및 fluopicolide의 분석법 정량한계는 0.02 mg/kg 및 0.004 mg/kg이었고, 표준검량선의 회귀방정식과 결정계수(r2)는 각각 y = 2.28057x − 6.91267 (r2= 0.99726) 및 y = 2776.58640x + 42.42824 (r2 = 0.99848)로 결정계수(r2)가 0.99 이상으로 표준검량선의 직선성을 확인하였다.
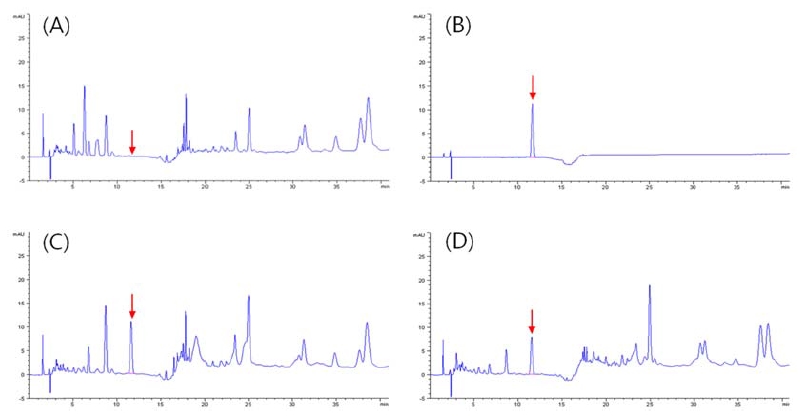
Representative Chromatograms of cyenopyrafen at control sample (A), 0.5 mg/L standard solution (B), recovery at 0.2 mg/L (C) and 0 day sample after treatment on red pepper (D).
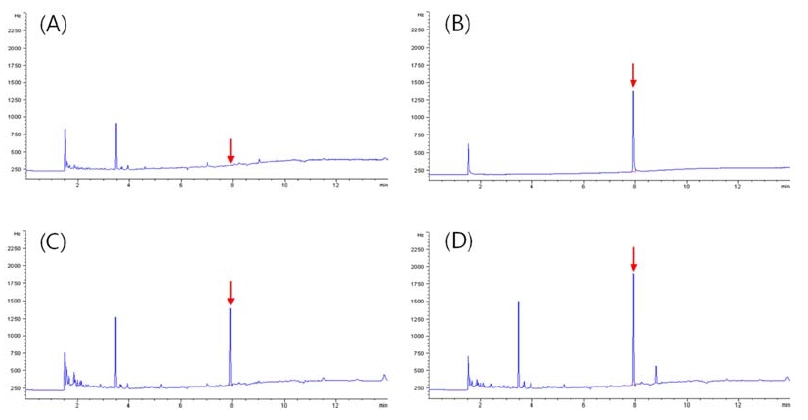
Representative chromatograms of fluopicolide at control sample (A), 0.5 mg/L standard solution (B), recovery at 0.2 mg/L (C) and 0 day sample after treatment on red pepper (D).
회수율시험을 분석법정량한계의 10배 및 50배 농도수준에서 수행한 결과, cyenopyrafen 및 fluopicolide의 회수율범위는 각각 79.2~92.7% 및 101.4~111.8%로 70~120% 이내였으며(Table 5), 변이계수(coefficient of variation)는 10% 이하로 국내외의 농약 잔류성시험 분석법 확립 기준에 적합하였다(EC, 2015; MFDS, 2014; RDA, 2016).
잔류성시험 포장에서 채취한 홍고추 시료 중 cyenopyrafen 및 fluopicolide는 시료 채취일에서 잔류분석 완료일까지 -20oC 이하의 냉동보관조건에서 각각 76일 및 59일간 안정한 것을 확인하였다.
생산단계 잔류특성에 따른 반감기 및 감소상수 산출
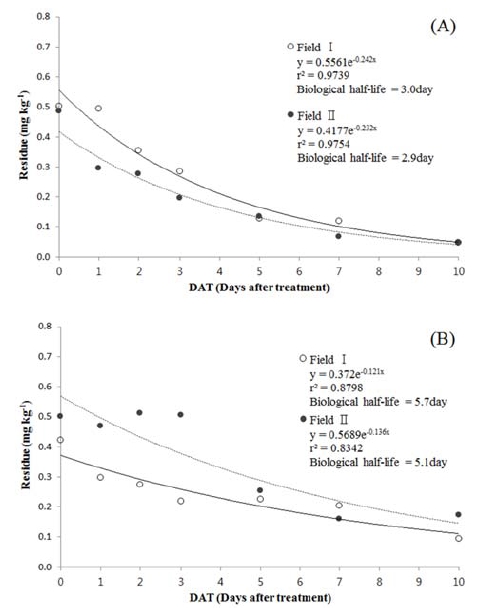
노지재배 홍고추에 대하여 cyenopyrafen 및 fluopicolide을 2개 시험포장을 대상으로 농약안전사용기준에 따라 각각 1회 처리한 후 일자별(0, 1, 2. 3, 5, 7 및 10일) 잔류량의 변화추이를 확인하였다. Cyenopyrafen의 초기 잔류량은 시험포장 I 및 II에서 각각 0.502 mg/kg 및 0.485 mg/kg의 수준으로 잔류허용기준 3.0 mg/kg보다 약 6배 낮게 검출되었고, fluopicolide의 경우 각각 0.422 mg/kg, 0.502 mg/kg의 수준으로 잔류하여 MRL 1.0 mg/kg보다 약 2배 낮은 수준이었고, 각 포장간 초기 부착량의 차이는 10% 이내로 유사하였다(MFDS, 2016). Cyenopyrafen의 잔류량의 변화는 시간이 경과함에 따라 감소하여 약제 처리 후 10일차에 시험포장 I 및 II에서 모두 0.048 mg/kg이었고, fluopicolide는 시험포장 I 및 II에서 약제 처리 후 10일차에 각각 0.095 mg/kg 및 0.174 mg/kg으로, 노지재배 홍고추에서 cyenopyrafen 및 fluopicolide의 약제 처리 후 시간경과에 따른 잔류량 감소경향은 유사하였다(Fig. 2).
홍고추의 노지재배에서 cyenopyrafen 및 fluopicolide 약제 처리 후 일자별 잔류량을 적용하여, 산출한 회귀식 및 회귀계수는 F-test 및 t-test를 수행하여 유의성을 확인하였고, 회귀계수의 95%신뢰구간은 cyenopyrafen의 시험포장 I 및 II에서 각각 0.2420 ± 0.0455 및 0.2316 ± 0.0423, fluopicolide는 각각 0.1209 ± 0.0514 및 0.1361 ± 0.0697으로 시험포장 간 회귀계수는 유사하였으며(Table 6), 회귀계수의 95% 신뢰구간 하한값을 생산단계 잔류허용기준 산출을 위한 감소상수로 적용하였다. 통계학적으로 유의성이 검증된 회귀계수를 적용하여 산출된 반감기는 cyenopyrafen의 시험포장 I 및 II에서 각각 2.9일 및 3.0일, fluopicolide는 각각 5.7일 및 5.1일로, 시험포장의 차이에 따른 반감기는 유사하여, 노지재배 홍고추의 생산단계 잔류허용기준 설정에 적용 가능한 잔류성 시험결과가 도출되었다(Fig. 2). 노지재배 조건의 작물 중 cyenopyrafen의 반감기는 배 5.2~9.8일 및 복숭아 6.0~6.3일로 유사하였고, 시설재배 조건에서 fluopicolide의 반감기는 엇갈이 배추 4.2~14.9일, 방울토마토 12.8~15일 및 포도 12.4~23.9일에 비하여 노지재배 조건인 홍고추 중반감기가 상대적으로 짧은 것은 노지 재배시 강우, 이슬 및 높은 광의 강도가 잔류량의 감소에 영향을 미치게 된다(Lee et al., 2006; Lee et al., 2011; Lee et al., 2015; MFDA 2014).
본 연구는 노지재배 홍고추에 대한 cyenopyrafen 및 fluopicolide 약제 처리 후 시료채취 일자별 잔류량을 확인하여 생산단계에서 cyenopyrafen 및 fluopicolide가 잔류허용 기준 이하인 안전한 수준으로 잔류하는 것을 확인하였고, 통계학적 방법으로 산출된 감소상수 및 반감기는 홍고추 생산단계 잔류허용기준 산출에 적용하여, 소비자의 식품섭취에 따른 농약 노출에 대한 안전성을 확보하고 강화하는데 중요한 자료로 활용할 수 있다.
Acknowledgments
본 연구는 2014년 농산물의 생산단계 농약 잔류허용기준 설정을 위한 시험연구 과제로 수행되었으며, 식품의약품안전처의 연구비 지원에 감사 드립니다.
References
- Bajya, D. R., and M. Ranjith, (2016), Evaluation and dosage standardization of novel molecule, cyenopyrafen 30% SC against yellow mite (Polyphagotarsonemus latus) in chilli (Capsisum annuum), Indian J. Agricultural Sci, 86(2), p247-249.
- European Commission, (2015), Guidance document on analytical quality control and method validation procedures for pesticides residues analysis in food and feed, SANTE/11945/2015.
-
Hur, K. J., M. J. Woo, J. Y. Kim, M. Saravanan, C. H. Kwon, Y. W. Son, and J. H. Hur, (2015), Establishment of Pre-Harvest Residue Limits (PHRLs) of Fluopicolide and Metrafenone in Cherry Tomato (Lycopersicon esculentum Mill.), Korean J. Environ. Agric, 34(4), p328-335.
[https://doi.org/10.5338/kjea.2015.34.4.49]

-
Jackson, K. L., J. Yin, A. S. Csinos, and P. Ji, (2010), Fungicidal activity of fluopicolide for suppression of Phytophthora capsici on squash, Crop Protection, 29, p1421-1427.
[https://doi.org/10.1016/j.cropro.2010.08.001]

- Kim, K. R., and J. H. Choi, (2000), Agricultural labor hours of field-grown red pepper farmers in korea, Korean J. Community Living Sci, 11(1), p120-121.
- Kim, K. I., H. T. Kim, K. S. Kyung, C. W. Jin, C. H. Jeong, M. S. Ahn, S. W. Sim, S. S. Yun, Y. J. Kim, K. G. Lee, K. D. Lee, W. J. Lee, and J. B. Lim, (2006), Monitoring of pesticide residues in peppers from farmgate and pepper powder from wholesale market in chungbuk area and their risk assessment, Korean J. Pestic. Sci, 10(1), p15-21.
- Kim, K. R., K. S. Lee, H. C. Kim, and E. Y. Song, (2009), Health status and musculoskeletal workload of red pepper farmers, J. Ergon. Soc. Korea, 28(3), p7-15.
- Korea Crop Protection Association, (2017), Guideline of Crop Protection Products, http://www.koreacpa.org Accessed 01 April 2017.
- Lee, H. D., O. J. You, Y. B. Ihm, H. Y. Kwon, Y. D. Jin, J. B. Kim, Y. H. Kim, S. S. Park, K. S. OH, S. L. Ko, T. H. Kim, J. G. Noh, and K. S. Kyung, (2006), Residual Characteristics of some Pesticides in/on Pepper Fruits and Leaves by Different Types, Growing and Processing Conditions, Korean J. Pestic. Sci, 10(2), p99-106.
- Lee, C. R., J. H. Hong, J. S. Lim, and K. S. Lee, (2011), Residue Patterns of Azoxystrobin and Cyenopyrafen in Grape between Rainshield and Plastic House Conditions, Korean J. Pestic. Sci., 15(2), p97-103.
- Lee, Y. D., (2013), Practical book of Korea food code pesticide residue analysis method, Ministry of Food and Drug Safety, Republic of Korea, p79.
-
Lee, D. Y., D. K. Jeong, G. H. Choi, D. Y. Lee, K. Y. Kang, and J. H. Kim, (2015), Residual Characteristics of Bistrifluron and Fluopicolide in Korean Cabbage for Establishing Pre-Harvest Residue Limit, Korean J. Pestic. Sci, 19(4), p361-369.
[https://doi.org/10.7585/kjps.2015.19.4.361]

- Ministry of Food and Drug Safety, (2014), Manual on the methods for pesticide residues for pre-harvest residue limits, Republic of Korea, p19-21.
- Ministry of Food and Drug Safety, (2014), Establishment for pre-harvest residue limin of agricultural product, Republic of Korea, p9-12.
- Ministry of Food and Drug Safety, (2016), Residual criteria for harmful substances for pre-harvest agricultural products. No. 2016-80.
- National Agricultural Products Quality Management Service, (2011, 2012, 2013, 2014 and 2015), National agricultural products quality management statistics annual report.
-
Riga, M., A. Myridakis, D. Tsakireli, E. Morou, E.G. Stephanou, R. Nauend, T. Van Leeuwen, V. Douris, and J. Vontas, (2015), Functional characterization of the Tetranychus urticae CYP392A11, a cytochrome P450 that hydroxylates the METI acaricides cyenopyrafen and fenpyroximate, Insect Biochemistry and Molecular Biology, 65, p91-99.
[https://doi.org/10.1016/j.ibmb.2015.09.004]

- Rural Development Administration, (2014), Pepper, p10-14, 206-265.
- Rural Development Administration, (2016), Bulletin of Pesticide Registration Investigator (Guidance of pesticide residue test), RDA Notification No. 2016-38.
- Rural Development Administration, (2017), Pesticide information service, Pesticide registration Status Inquiry, http://pis.rda.go.kr Accessed 01 April 2017.
- Turner, J. A., (2015), The Pesticide Manual, 17th edition, British Crop Production Council, UK, p260-261, 518.
-
Wang, W., L. Yan, R. Meng, J. Zhao, X. Zhang, X. Han, and Z. Ma, (2014), Sensitivity to Fluopicolide of wild type isolates and biological characteristics of fluopicolide-resistant mutants in Pseudoperonospora cubensis, Crop Protection, 55, p119-126.
[https://doi.org/10.1016/j.cropro.2013.09.012]

- Yang, S. G., Y. W. Seo, J. G. Kim, G. J. Choi, and J. H. Lee, (2008), Improvement effect of rain-shelter cultivation and greenhouse cultivation for the pesticide-free in pepper, Korean J. Organic Agric, p111-118.