
콩명나방의 세포성 면역과 이를 억제하여 Bacillus thuringiensis 병원력을 향상시키는 비티플러스
초록
재배되는 팥(Vigna angularis)에 피해를 주는 콩명나방(Maruca vitrata)에 대한 방제 약제를 평가하였다. 시판되는 9종 살충제 가운데 신경독성을 가진 화학합성약제 4종, 곤충성장조절제(insect growth regulator: IGR) 3종 및 비티(Bacillus thuringiensis) 생물농약 2종을 콩명나방 유충을 대상으로 일차 스크리닝하였다. 각 약제별 처리 추천농도에서 화학합성 약제는 IGR과 비티 약제에 비해 방제력에서 우수하였다. IGR과 비티 약제는 모두 유사한 방제 효과를 나타냈다. 이들은 모두 콩명나방 유충의 발육에 따라 약효가 감소하였다. 이 가운데 비티 약제의 살충력을 높이기 위해 Xenorhabdus nematophila 세균 배양액을 첨가한 비티플러스를 제조하였다. 이 비티플러스는 비티 단독에 비해 현격하게 높은 살충력을 나타냈다. 살충력의 증가 이유는 X. nematophila 세균 배양액이 함유하고 있는 면역억제 능력에서 기인된 것을 확인하였다. 콩명나방 유충은 아이코사노이드에 반응하여 세포성면역반응을 야기하는 데 X. nematophila 세균 배양액에 함유된 아이코사노이드 생합성 억제자는 세포성 면역 반응을 현격하게 억제하였다. 본 연구는 콩명나방 유충을 방제하기 위해 비티 약제에 면역억제제를 첨가하여 병원력을 극대화하는 기술을 제공한다.
Abstract
This study evaluated control efficacies of insecticides against the legume pod borer, Maruca vitrata, infesting and causing serious economic damage on the Adzuki bean, Vigna angularis. Preliminary screening was performed with 9 commercial insecticides of 4 different neurotoxic chemicals, 3 different insect growth regulator (IGR), and 2 different Bacillus thuringiensis (Bt) biopesticides. At recommended doses, the chemical insecticides were superior to IGR or biopesticides in control efficacies, while IGR and Bt insecticides exhibited similar control efficacies against M. vitrata. With larval development, the control efficacies decreased in all insecticides. To improve Bt control efficacy, bacterial metabolite of Xenorhabdus nematophila was effective to Bt spores. The resulting bacterial mixture was called “BtPlus”. BtPlus significantly increased Bt toxicity against M. vitrata compared to Bt alone. The increased toxicity was reasoned by the immunosuppressive activity of the X. nematophila-cultured medium. Larvae of M. vitrata exhibited cellular immune response induced by eicosanoids. The X. nematophila-cultured medium possessed inhibitors against eicosanoid biosynthesis. This study suggests a technique to enhance Bt toxicity with addition of an immunosuppressive agent against M. vitrata.
Keywords:
Biopesticide, eicosanoids, immune, insecticide, Maruca vitrata키워드:
생물농약, 아이코사노이드, 면역, 살충제, 콩명나방서 론
열대 및 아열대 지역을 중심으로 널리 분포하는 콩명나방(Maruca vitrata Fabricius)은 포충나방과(Crambidae)의 들명나방아과(Pyraustinae)에 속하며(Paek et al., 2010), 콩과(Fabaceae), 백합과(Liliaceae), 아욱과(Malvaceae)식물의 잎, 꽃 및 꼬투리를 가해하는 해충이다(Sharma, 1998; Bae,2001). 특히 국내에서는 비교적 널리 재배하는 팥(Vigna angularis)의 최대 해충으로 알려지고 있다. 팥은 콩과류에 속한 식량작물로서 팥죽과 같은 주요 식품의 재료뿐만 아니라 건강 한방 재료로서도 소비되고 있다. 1989년 전국에 26,480 ha의 재배 면적을 가지고 있었으나 매년 감소하여 2011년 통계 자료는 불과 3,650 ha로 줄었다(KOSTAT, 2011). 그러나 소비량은 크게 줄지 않아 수입에 의존하고 있으며 자급률은 30% 이하이다. 여기에 콩명나방은 꼬투리를 가해하는 일차해충으로 팥 생산량에 크게 위협을 주고 있다(Jung et al., 2009). 콩명나방의 심각한 피해는 주로 동남아시아, 남아시아, 중앙아메리카, 남아메리카의 아열대 지역에 재배되는 콩과 작물에서 보고되고 있다(Singh and van Emden, 1979; Margam et al., 2011). 특히 사하라 사막 남부아프리카 지역에서는 매년 동부(Vigna unguiculata) 수확량의 20~80%의 피해를 주는 최대 해충으로 주목받고 있다(Sharma, 1998).
미토콘드리아 cox 1 유전자 분석에 의해 국내에서 채집된 콩명나방 집단은 동남아시아 지역에 발생하는 콩명나방 집단과 유전적으로 근접도가 높은 것으로 보고되었다(Kim et al., 2016). 국내에서 4월부터 11월까지 성충들이 채집된 표본 기록(Bae, 2011)이 있으나, 이 해충의 연중 생활사는 명확하게 밝혀져 있지 않다. 현재까지 중부지역에서는 월동 가능성이 낮을 것으로 추정되고 있고(Jung et al., 2016), 월동 이후 발생 시기가 분명하지 않으며 현재 팥이나 녹두의 꽃과 꼬투리에서 유충 피해가 관찰되는 8~9월 전까지 적어도 2~3 개월 기간 동안 콩명나방의 서식처와 기주의 종류가 명확하지 않다. 아프리카 지역의 경우 동부를 가해하는 콩명나방이 건조기가 되면 대체기주로 이동하여 가해하게 된다(Bottenberg et al., 1997). 콩명나방의 기주는 재배종 및 야생종을 포함하여 콩과에 속한 50종 이상을 포함하고 있다고 알려져 있다(Tayler, 1978). Pterocarpus santalinoides와 Centrosema pubescens가 이러한 건조기에 산란 기주 및 유충의 먹이로 이용되며, 우기에 대체기주로는 Lonchocarpus sericeus와 L. cyanescens, Tephrosia platycarpa가 이용된다(Arodokoun et al., 2003). 따라서 국내에서도 콩명나방이 월동 이후 다른 콩과 재배작물 또는 야생 콩과 식물들을 대체 기주로 이용하면서 7~8월 경에 성충이 팥으로 이동하여 가해할 가능성이 있다. 만약 콩명나방이 국내 월동을 하게 된다면 매년 국내로 이주하여 오는 집단과 더불어 지속적으로 콩과작물의 주요 해충으로 피해를 주어 농가 소득에 심각한 위협을 주게 될 것으로 예측된다.
콩명나방을 방제하기 위해 화학 살충제를 중심으로 다양한 방제 수단이 개발되어 왔다. 화학적 방제 수단으로 유기인계와 다이아마이드 계통의 살충제가 콩명나방에 대해서 우수한 야외 살충효과를 나타냈다(Grigolli et al., 2015). 국내에서도 시판되고 있는 살충제를 중심으로 콩명나방 방제효과가 검증되었다(Kim et al., 2016). 이 결과 콩명나방의 방제에 신경독을 가진 약제들의 높은 방제 효과가 밝혀졌다. 그러나 콩명나방 유충의 먹이 가해가 꽃과 꼬투리 내부에서 이뤄지고 또한 서식지 주변에 그물망을 형성하여 살포된 살충제에 직접 노출을 피할 수 있고, 주기적 살포에 따른 약제 저항성 발달에 따라 화학방제의 효율이 낮아지고 있다(Ekesi, 1999). 비화학적 방법으로 콩명나방에 저항성을 보이는 동부 작물의 재래적 육종기술(Oghiakhe et al., 1995)에서 유전공학기술을 이용하여 비티(Bacillus thuringiensis) 세균 유래 독소단백질 Cry1Ab를 발현시키는 형질전환 동부의 육종(Srinivasan, 2008)이 시도되었다. 또 다른 비화학적 방제 기술로서 콩명나방에 특이적 곤충병원성을 주는 벡큘로바이러스가 탐색되어 생물적 방제 기술도 개발되었다(Lee et al., 2007). 국내에서 재배되는 팥이 주로 건강식 또는 한약재로 사용되기에 화학농약을 통한 방제를 가급적 줄이고 생물농약을 중심으로 콩명나방을 방제할 필요성이 있다.
본 연구는 팥 작물을 가해하는 콩명나방을 대상으로 안전한 살충제의 개발이라는 궁극적 목표를 가지고 비티를 중심으로 방제효과를 높일 수 있는 비티플러스 약제의 개발에 목적을 두었다. 비티플러스의 개념은 비티 세균에 대한 곤충의 방어기작으로서 면역 방어 체계를 억제하여 비티의 병원성을 높이는 데 개발 전략을 가지고 있다(Seo and Kim, 2011). 곤충의 면역은 태생적으로 프로그램 된 선천성면역의 모습을 가진다(Kim, 2008). 이러한 곤충 면역 반응은 외래 인자를 인식하는 단계에서 이를 감염부위 주변 또는 몸의 다른 부위로 면역 신호를 전달하는 중개 반응 그리고 궁극적으로 혈구세포와 지방체를 중심으로 펼쳐지는 세포성 및 체액성 면역으로 구성된다(Gillespie et al., 1997). 이 가운데 면역 중개물질로서 아이코사노이드는 중심적 역할을 담당하게 된다(Stanley, 2000). 아이코사노이드는 탄소수 20개의 다가불포화지방산 유도체로서 프로스타글란딘(prostaglandin: PG), 류코트리엔(leukotrien: LT) 그리고 에폭시아이코사노이드(epoxyeicosatrienoic acid: EET)를 포함하게 된다. 이 가운데 PG와 LT의 곤충 면역에 관련 생리적 기능이 밝혀졌다(Shrestha and Kim, 2009). EET의 경우는 최근모기류에서 최초로 3종류의 EET가 동정되었으며, 이들이 면역반응과 연계되어 있는 것을 간접적으로 제시하여(Xu et al., 2016) 곤충류도 이들 3부류의 아이코사노이드가 존재하고, 면역기능을 담당하고 있는 것으로 간주되고 있다. 이들 아이코사노이드는 생체막에 존재하는 인지질에 존재하는 탄소수 20개의 다가불포화지방산인 아라키도닉산을 phospholipase A2 (PLA2) 효소의 촉매 작용으로 유리하여 일련의 산화효소들의 개별적 작용으로 생합성 되게 된다(Burke and Dennis, 2009). 따라서 PLA2 효소 활성을 억제하면 곤충 면역 저하를 유발하기에 이를 이용하여 일부 곤충병원세균은 자신의 병원력을 발휘하게 된다(Kim et al., 2005).
본 연구는 면역억제물질로서 Xenorhabdus nematophila 곤충병원세균의 배양액을 사용하였다. 이러한 이유는 X. nematophila의 배양액에는 곤충의 아이코사노이드 생합성에 관여하는 PLA2를 억제시킬 수 있는 물질이 포함되어 있기 때문이다(Seo et al., 2012). 따라서 X. nematophila의 배양액은 대상 곤충의 면역기능을 떨어뜨려 비티 세균을 보호하여주는 효과를 나타내기에 세균 살충력을 높여주는 효과를 기대할 수 있다. 실제로 비티 포자와 X. nematophila 배양액을 혼합하여 처리한 결과 나방류에 대한 높은 방제효과를 보여 주었다(Eom et al., 2014). 따라서 본 연구는 이러한 기술을 콩명나방에 적용하기 위해 수행되었다.
재료 및 방법
실험곤충
콩명나방은 2004년 수원시 팥 포장에서 채집된 이래 실내에서 약 13년간 누대 사육된 집단을 이용하였다. 유충은 Jung et al. (2007)의 인공사료가 변형되어 팥나방 인공사료와 같은 조성의 인공사료(Heo et al., 2009)를 이용하여 사육하였고, 성충은 10% 설탕물을 제공하였다. 실내 사육 환경은 온도 25 ± 1oC, 광조건 16:8시간 (L:D), 상대습도 60 ± 10%를 유지하였다.
살충제 감수성 분석
유충을 대상으로 먹이 침지법으로 약제 처리하였다. 분석된 유충은 2령과 4령으로 누대 사육 집단에서 임의로 선발하여 9 종의 살충제(Table 1) 약효 분석에 이용되었다. 약제 희석은 각 상용 살충제의 추천농도를 기준으로 실시하였다. 인공사료 조각(1.5 × 1.5 × 1.5 cm)을 조제된 약제 현탁액에 1분간 침지하였다. 직경 9 cm의 원형 용기에 여과지를 깔고 약제 처리된 먹이를 올려놓고, 미리 6시간 동안 굶긴 유충을 24시간 섭식 처리하였다. 약제 처리 이후는 무처리 먹이를 제공하고 7일 동안 매일 사망 개체수를 계수하였다. 각 처리는 10마리씩 3반복으로 실시하였다. 이때 사망한 유충은 외부 자극에 대해서 자발적 움직임이 없는 개체로 규정하였다. 반수치사농도(median lethal concentration: LC50)와 시간(median lethal time: LT50)은 프로빗 분석법(Raymond, 1985)을 이용하여 산출하였다.
세균 배양
X. nematophila 균주는 NBTA 평판배지(peptone 5 g, beef extract 3 g, NaCl 5 g, bromothymol blue 0.025 g, triphenyl-2,3,5-tetrazolium chloride 0.040 g, agar powder 15 g, 탈이온증류수 1 L)에 세균을 도말한 후 48시간 동안 28oC에서 배양하여 파란색으로 형성된 단일 균총을 선발하였다. 이균총을 2 mL의 TSB (MBcell, Seoul, Korea)에서 24시간 동안 교반 배양(28oC, 250 rpm)한 후, 이 가운데 1 mL의 배양액을 곧바로 1 L의 TSB 배지에 접종하여 48시간 동안 위와 동일한 조건으로 배양하였다. 이 세균배양액은 시험에 이용될 때까지 4oC에 보관하였다.
비티 균주는 안동대학교 곤충분자생리실에 글리세롤 액침표본으로 보관되어 있는 B. thuringiensis ssp. aizawai (BtA)와 B. thuringiensis ssp. kurstaki (BtK)를 TSB 평판배지에 세균을 도말한 후 24시간 동안 28oC에서 배양하여 단일 균총을 얻었다. 각 균주별 단일 균총은 2 mL의 TSB 배지를 이용하여 위와 동일한 배양조건에서 250 rpm으로 교반하며 접종원으로 배양하였고, 이 가운데 1 mL의 배양액을 곧바로 1 L의 TSB 배지에서 접종하여 48시간 동안 동일한 조건으로 배양하였다. 이 후 비티 균주의 포자 형성을 유도하기 위해 두 비티 배양액을 37oC에서 5시간 동안 열충격 처리를 한 후, 4oC에서 72시간 동안 저온 처리하였다. 포자형성은 위상차 광학현미경(BX-PHD, Olympus, Tokyo, Japan)을 이용하여 1,000배 배율에서 확인하였고, 4,000 rpm에서 30분간 원심분리를 하여 배양액 내의 포자농도를 100배로 농축하였으며, 실험에 이용될 때까지 4oC 냉장고에 보관하였다.
비티플러스 제조
세 종류의 비티플러스가 제조되었다. X. nematophila 배양액은 앞에서 기술한 48시간 배양액으로 이를 증류수로 1,000배 희석한 용액을 ‘Xn’이라 명명한다. 그리고 비티 세균은 1010 spores/mL의 포자 농도로 균주에 따라 ‘BtA’ 또는 ‘BtK’라 명명한다. 비티 단독의 경우는 1 mL의 BtK 또는 BtA에 99 mL의 증류수를 혼합했다. 비티플러스의 경우 단독 비티를 포함하는 경우는 1 mL의 BtK 또는 BtA에 99 mL의 Xn을 혼합했다. 두 종의 비티 균주를 모두 포함한 비티플러스의 경우는 각 비티 균주 1 mL를 혼합하고 여기에 98 mL의 Xn을 혼합했다.
PLA2 효소활성
콩명나방 5령충의 혈강에 X. nematophila 세균배양액 1 μL를 주입하였다. 처리 후 25oC에서 8시간이 소요된 후 혈림프를 추출하여 혈구에 존재하는 PLA2 활성을 분석하였다. PLA2 효소활성 측정에 사용된 1-hexadecanoyl -2-(1-pyrenedecanoyl)-sn-glycerol-3-phosphatidylcholine은 Molecular Probes (Eugene, OR, USA) 그리고 bovine serum albumin(BSA)은 Sigma-Aldrich Korea (Seoul, Korea)에서 구매하여 사용하였다. PLA2 효소활성의 측정은 형광물질 pyrene이 부착된 인지질을 기질로 사용하여 형광분석법으로 측정하였다(Radvanyi et al., 1989). PLA2 효소는 파밤나방 5령충의 혈구세포로부터 추출되었다. 간략하게, 약 1 mL의 파밤나방 혈림프로부터 혈구를 분리하고, 400 μL의 인산완충용액(50 mM phosphate buffer saline, 0.7% NaCl, pH 7.4: PBS)으로 현탁액을 만들었다. 이후 초음파분쇄기(Sonopuls GM2070, Bendelin Inc., Berlin, Germany)로 단백질을 추출하였다. 추출된 단백질은 Bradford (1976)의 방법으로 정량화하였다. 기질은 99.5% 에탄올을 이용하여 10 mM로 조제하였다. BSA는 PBS 용액을 이용하여 10%로 조제하였다. Tris 완충용액(pH 7.0)은 증류수를 이용하여 50 mM로 조제하였다. 염화칼슘은 증류수로 1 M을 조제하였다. 반응용액(2 mL)은 50 mM의 Tris 완충용액 1,900 μl, 50 μL의 효소추출액, 12 μL의 염화칼슘, 20 μL의 BSA, 그리고 10 μl의 억제자로 구성되었다. 이 혼합액을 25oC에서 5분간 반응시켰다. 이후 20 μL 기질을 첨가하고 2분간 반응시켰으며 excitation 345 nm와 emission 398 nm 조건에서 형광분광광도계(FA 257, Spectronic Instruments, Madison, WI, USA)를 이용하여 효소 반응을 측정하였다.
세포성 면역분석 - 혈구활착
콩명나방 5령충 5마리를 70% 에탄올에 10초 동안 침지 후에 복부 첫 번째 다리를 잘라 스며 나오는 혈림프(약 300 μL)를 700 μL의 항응고 완충용액(98 mM NaOH, 186 mM NaCl, 17 mM Na2EDTA, 41 mM citric acid, pH 4.5)에 수거하였다. 이를 원심분리(1,000 × g, 3분)한 후 혈구 침전물에 다시 1 mL의 항응고 완충용액으로 다시 현탁액을 만든 후 얼음에 40분간 반응시켰다. 이후 다시 원심분리하여 상등액 400 μL를 제거하여 곤충세포배양액인 TC100로 나머지 300 μL를 채워 넣었다. 이 혈구현탁액을 40 μL에 X. nematophila 세균배양액인 Xn을 최종 농도가 0, 2, 10, 20%가 되도록 각 96 well plate에 첨가하였다. 상온(25oC)에서 40분간 반응 후에 혈구의 활착을 위상차현미경(IX70, Olympus, Tokyo, Japan)으로 400배의 배율에서 조사하였다. 활착된 혈구세포 형태는 주로 과립혈구와 부정형형구로서 허족(pseusopodia) 또는 돌기(filopodia)의 성장으로 구분하였다. 각 처리는 3반복으로 실시되었다. 각 반복은 임의의 100개의 혈구세포 가운데 활착된 혈구수 비율로 산출하였다.
세포성 면역분석 - 소낭형성
콩명나방 5령충을 대상으로 혈구세포의 소낭형성이 분석되었다. 열처리(70oC, 20분)로 사멸된 X. nematophila 균주를 5 × 104의 세포수로 각 유충 혈강에 주입하였다. 세균 주입 후 8시간 후에 유충 몸을 항문에서 입까지 절개한 후 소화관, 지방체 그리고 기관지 주변에 형성된 소낭을 계수하였다. 각 처리는 5마리의 유충을 이용하여 반복하였다. 면역억제제로 dexamethasone (Dex)을 이용하였으며, 이 약제는 dimethylsulfoxide (DMSO)로 용해시켜 100 μg/L의 농도로 준비하였다. 또 다른 면역억제제로서 Xn 배양액을 증류수로 10배(10X) 또는 100배(100X)로 희석하여 준비하였다. 이들 억제제는 모두 0.5 μL의 주입 부피로 0.5 μL의 세균용액과 혼합하여 곤충 혈강에 주입하였다. 대조구로서 억제제 단독 또는 세균 단독 처리가 실시되었다. 각 처리는 5마리의 유충으로 반복되었다.
통계분석
모든 살충효과에 대한 생물검정 결과는 백분율 자료로서 arsine 변환 후 SAS PROC GLM (SAS Institute, 1989)을 이용하여 ANOVA 분석 및 처리 평균간 비교를 실시하였다.
결 과
농가에 시판되고 있는 살충제 가운데 신경독성을 지닌 화학살충제와 곤충성장조절제 및 생물농약을 대상으로 콩명나방 방제 효과를 비교하였다(Fig. 1). 처리된 살충제의 농도는 각 제품의 추천 희석농도를 기준으로 처리하였다. 전체적으로 신경독성을 지닌 살충제가 곤충성장조절제 및 생물농약에 비해 우수한 방제력을 나타냈다. 또한 4령충에 비하여 2령충에 대해서 방제 효과가 우수하였다. 곤충성장조절제와 생물농약 사이에 크게 뚜렷한 방제 효과 차이를 나타내지 않았다.
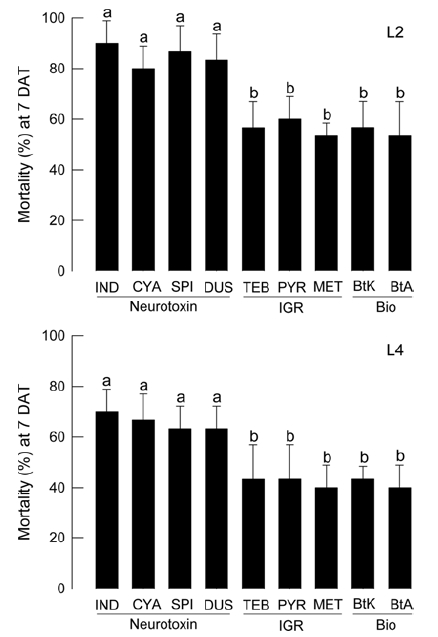
Toxicity screening of 9 commercial insecticides against M. vitrata larvae at second (‘L2’) and fourth (‘L4’) instar. All insecticides and their acronyms are described in Table 1. These insecticides are classified into neurotoxic chemical (‘Neurotoxin’), insect growth regulator (‘IGR’), and biopesticide (‘Bio’). Except IND (2,000 fold dilution), all insecticides were diluted at 1,000 folds. Dipping and feeding method was used for this bioassay. Each treatment was replicated three times. Each replication used randomly chosen 10 larvae. Mortality was measured at 7 days after treatment (DAT). Different letters above standard deviation indicate significant difference among means at Type I error = 0.05 (LSD test).
환경 또는 비표적 생물체에 비교적 안전한 곤충성장조절제와 생물농약의 약효를 심층적으로 분석하기 위해 각각 6가지 서로 다른 농도로 처리하여 반수치사약량과 반수치사 시간을 각각 조사하였다(Table 2). 반수치사약량을 기준으로 살펴보면 곤충성장조절제들이 생물농약에 비해 독성이 높아 보이나 반수치사약량의 95% 신뢰구간을 통해서 비교하여 보면 상호 뚜렷한 차이를 나타내지 않았다. 유사한 경향은 약제들 사이에 반수치사시간 비교에서도 나타났다. 그러나 콩명나방의 발육시기에 따라 이들 살충제에 대한 감수성 차이는 뚜렷하게 나타났다. 이러한 결과는 비티 살충제 기반 생물농약을 콩명나방 방제에 적용하려면 신경독성을 나타내는 화학 살충제 효과만큼 방제력을 높이는 기술 개발이 필요하였다.

Toxicities (median lethal concentration (LC50) and time (LT50)) of IGR and biopesticides against M. vitrata larvae
두 가지 서로 다른 비티 약제에 포함된 상이한 비티 세균균주들(BtK와 BtA)을 이용하여 각각이 독립적으로 살충독소단백질을 발현시키도록 이들의 세균 포자형성을 유도하게 하였다. 이후 최종 살포 농도가 108 spore/mL의 비티 포자농도가 되도록 각각 약량을 조절하였다. 여기에 X. nematophila 세균 배양액(Xn)이 1,000배 희석된 조건으로 비티 약제에 첨가하여 비티플러스 약제를 제조하였다. 이러한 조건에서 비티 단독(BtA, BtK) 또는 Xn 단독을 대조 처리로 비티플러스의 살충력 향상 효과를 검정하였다(Fig. 2). Xn 단독 처리는 두 유충 영기에서 거의 유의성이 없는 살충효과를 보였다. 그러나 비티 단독 처리는 2령충에서 약 45% 그리고 4령충에서 약 35%의 살충력을 나타냈다. 그러나 비티플러스의 경우는 비티의 농도가 비티 단독과 동일하지만 X. nematophila 배양액의 도움으로 2령충에서는 약 82% 그리고 4령충에서는 약 75%의 살충력을 나타냈다.
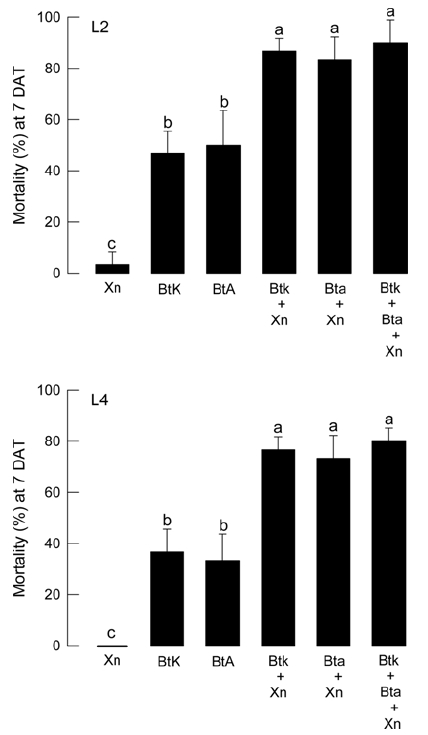
Enhanced toxicity of BtPlus compared to single Bacillus thuringiensis (‘Bt’) treatments against M. vitrata larvae at second (‘L2’) and fourth (‘L4’) instar. Two Bt strains were used: B. thuringiensis aizawai (‘BtA’) and kurstaki (‘BtK’). ‘Xn’ represents 1,000 folds-diluted cultured broth of X. nematophila. BtPlus includes ‘BtK+Xn’, ‘BtA+Xn’, ‘BtK+BtA+Xn’. Dipping and feeding method was used for this bioassay. Each treatment was replicated three times. Each replication used randomly chosen 10 larvae. Mortality was measured at 7 days after treatment (DAT). Different letters above standard deviation indicate significant difference among means at Type I error = 0.05 (LSD test).
콩명나방에 대한 비티플러스의 살충력 상승효과를 검정하기 위해 X. nematophila 세균 배양액의 면역억제효과를 분석하였다. 이 세균 배양액을 콩명나방의 혈구세포 용액에 첨가한 결과 세균 배양액 농도에 비례하여 혈구 활착정도가 현격하게 줄었다(Fig. 3). 특히 세균 배양액에 PLA2 효소 활성 물질이 포함되어 있어 세포성 면역을 줄일 수 있기에 콩명나방의 혈구세포의 PLA2 활성을 분석한 결과 X. nematophila 배양액의 첨가에 따라 억제되는 것을 관찰하였다(Fig. 4).
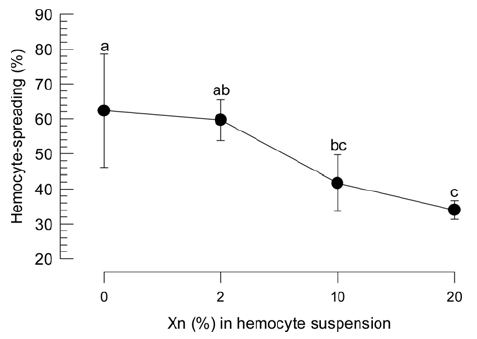
Hemocyte-spreading assay of M. vitrata larvae at fifth instar. Each treatment was replicated three times. Each measurement used randomly chosen 100 cells and was calculated into percent of number of spread hemocytes. ‘Xn’ represents 1,000 folds-diluted cultured broth of X. nematophila. Mortality was measured at 7 days after treatment (DAT). Different letters above standard deviation indicate significant difference among means at Type I error = 0.05 (LSD test).
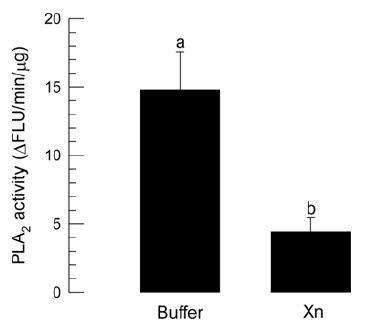
Suppression of hemocyte PLA2 activity of M. vitrata larvae at fifth instar by X. nematophila metabolites. ‘Xn’ represents 1,000 folds-diluted cultured broth of X. nematophila. ‘Buffer’ represents PBS for control. Different letters above standard deviation indicate significant difference among means at Type I error = 0.05 (LSD test).
콩명나방 유충은 세균 침입에 대해서 혈구 소낭형성의 면역반응을 나타냈다(Fig. 5). 혈구 소낭은 주로 기관지와 지방체 주변에 흑갈색의 덩어리로 나타났다(Fig. 5A). 이 소낭은 세균을 혈강에 주입한 후 1시간이 경과하면서 뚜렷하게 나타났고, 시간이 경과함에 따라 이 소낭의 숫자는 증가하여 8시간 이후에는 약 30개의 최대 소낭 개수를 개체별로 나타냈다(Fig. 5B). 그러나 콩명나방의 혈구 소낭형성 기능은 아이코사노이드 생합성억제자인 dexamethasone (Dex) 처리에 의해 크게 감소하였다(Fig. 6). 유사하게 X. nematophila 세균배양액 처리에 따라서도 혈구 소낭형성 능력은 뚜렷하게 감소하였다. 이러한 경향은 두 가지 세균 배양액 희석에서 동일하게 나타났다.
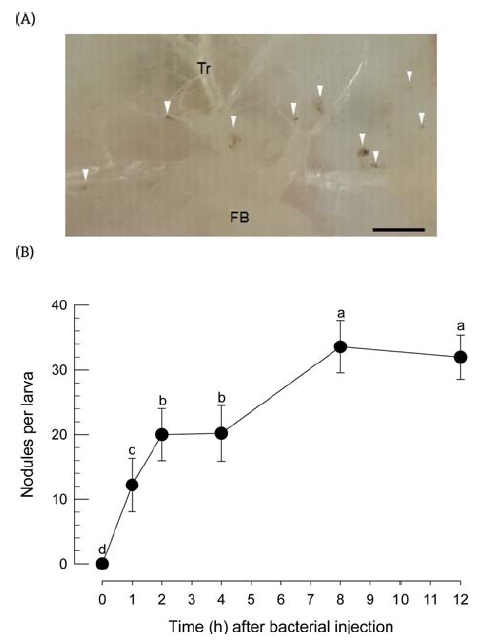
Hemocyte nodule formation of M. vitrata in response to bacterial infection. Each fifth instar larva was injected with 0.5 L of heat-killed X. nematophila (5 × 104 cells/L) and kept in 25oC. (A) Nodules near to fat body (‘FB’) or trachea (‘Tr’). Arrow heads indicate nodules. (B) Time course of nodule formation after bacterial injection. Each measurement represented 5 individuals. Different letters above standard deviation indicate significant difference among means at Type I error = 0.05 (LSD test).
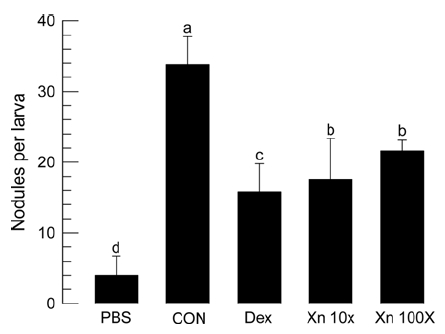
Inhibitory activity of the bacterial cultured broth of X. nematophila (‘Xn’) on hemocyte nodule formation of M. vitrata. Xn cultured broth was filtered through 0.22 μm membrane and diluted into 10 (‘10X’) or 100 (‘100X’) folds with phosphate buffered saline (‘PBS’). Dexamethasone (‘Dex’) was dissolved in DMSO to be 100 μg/μL. Each fifth instar was injected with mixture of 0.5 μL of heat-killed X. nematophila (5 × 104 cells/μL) and 0.5 μl of PBS, Xn or Dex. The treated larvae were kept in 25oC for 8 h. Each measurement represented 5 individuals. Different letters above standard deviation indicate significant difference among means at Type I error = 0.05 (LSD test).
고 찰
콩명나방 유충에 대한 살충제 감수성이 분석되었다. 콩명나방에 등록된 살충제가 없기 때문에 나방류 방제에 이용되는 9종의 상용 살충제를 감수성 분석에 이용하였다. 이들의 선발은 작용기작을 중심으로 신경독 4종과 IGR 3종 그리고 생물농약 2종으로 구성하였다. 각 살충제의 추천농도(indoxacarb를 제외하고 대부분 1,000배 희석)에서 처리한 결과 신경독 살충제의 경우 IGR가 생물농약에 비해 효과가 월등하였다. 어린 2령을 대상으로 신경독 살충제는 80% 이상의 방제 효과를 주었으나, IGR과 생물농약은 60%의 방제 효과를 넘지 못하였다. IGR과 생물농약의 낮은 살충력은 4령충에서는 더욱 심각하여 불과 40%의 방제력을 나타냈다. 유충의 영기가 진행함에 따라 콩명나방이 낮아지는 감수성은 이전 연구에서 보고하였다(Kim et al., 2016). 이러한 발육에 따른 감수성 변화는 높아지는 해독효소 활성 및 작용점 변화까지 포함하는 것으로 파밤나방(Spodoptera exigua)의 연구에서 보고되었다(Kim et al., 1997). 그러나 콩명나방의 경우 이러한 해독효소 및 작용점에 대한 연구는 부재하여 영기 진행에 따른 살충제 감수성 저하에 대한 생화학적 기작 설명에 대한 직접적 결론을 내리기는 아직 어렵다.
본 연구는 환경 친화형으로 콩명나방을 방제하기 위해 비티 기반의 생물농약의 개발에 목표를 두었다. 앞에서 설명한 기존 비티 살충제의 방제력의 한계는 새로운 기술 개발을 요구하였다. 이에 기존의 비티플러스 연구(Eom et al., 2014)를 바탕으로 이 기술을 콩명나방의 비티 살충력 향상에 응용하였다. 산업적 응용을 목표로 최종 살포액의 조성은 비티 균주가 108 spore/mL 그리고 X. nematophila 세균 배양액은 1,000배 희석하여(이를 ‘Xn’) 제조하였다. 이 비티플러스는 비티 단독에 비해 2령과 4령 모두에서 거의 두 배 가까운 방제력 향성 효과를 나타내어 신경독의 화학농약과 유사한 방제 효과를 나타냈다. 유사한 비티플러스가 파밤나방과 배추좀나방(Plutella xylostella)에 대해서는 거의 100%에 가까운 방제 효과를 주었다(Seo and Kim, 2011; Eom et al., 2014). 이러한 차이는 콩명나방에 대한 효과적 비티 균주의 선발이 필요한 것으로 사료된다. 비티는 내독소단백질인 Cry 단백질이 대상 곤충에 따라 차등적 살충효과를 주고 있다. 예를 들어, 파밤나방과 배추좀나방의 경우 Cry1Ac와 Cry1Ca의 독소단백질은 차등성 방제 효과를 주게 되는 데, 이는 Cry 단백질이 중장에서 결합하는 비티 수용체 가운데 하나인 캐드헤린(cadherin)에 대한 차등적 결합력으로 설명이 된다(Park and Kim, 2013). 콩명나방 2령충에 대한 다양한 Cry 독소단백질(Cry1Aa, Cry1Ab, Cry1Ac, Cry1Ca, Cry2Aa)의 살충력이 실시되었고, 이 가운데 Cry1Ab가 가장 높은 살충력을 지닌다고 보고하였다(Srinivasan, 2008). 이는 비교적 Cry1Ac를 다량으로 발현시키는 BtK와 Cry1Ca를 발현시키는 BtA에 비해 다른 균주의 선택이 필요하다는 것을 제시하고 있다.
비티플러스의 살충력 향성 효과를 설명하기 위해 콩명나방을 대상으로 면역반응을 분석하였다. 전체 면역 반응 가운데 세포성 면역 반응이 본 연구에서 분석되었다. 비티 침입에 따라 다양한 항생단백질의 발현이 포함되어 체액성 면역 반응도 중요하다(Bel et al., 2013). 그러나 기존의 비티플러스 연구에서 비티 세균에 대해서 혈구의 응집 및 활착행동 변화가 관찰되었고 이는 비티의 살충력 변화와 관련성이 있다는 것을 발표하였기에(Kwon and Kim, 2008) 본 연구에서는 혈구 중심의 활착행동과 소낭형성이 분석되었다. 콩명나방의 혈구 활착행동은 X. nematophila 세균배양액의 1,000배 희석된 용액 Xn 처리에 따라 억제되었다. 두 농도인 Xn의 10배 및 100배 희석에서도 이러한 억제 효과는 나타났다. 즉, 비티플러스 형태로 제조된 방제제의 살포 농도가 Xn이고 이를 충체에 처리하여 체내에 흡수될 경우 10배 또는 100배의 낮은 농도에 이를 수 있기에 본 연구 결과는 처리된 비티플러스가 콩명나방 혈구세포의 활동을 억제할 수 있다는 것을 제시하고 있다. Xn의 체내 흡수에 대한 직접적 결과는 없지만, 비티와 X. nematophila 세균을 복합 처리하면 비티의 중장세포 붕괴에 따라 X. nematophila의 혈강 침입을 보여 주었다(Jung and Kim, 2006). 따라서 Xn은 비티의 도움으로 혈강에 침입이 가능할 것으로 사료된다. 물론 Xn에 포함된 일부 이차대사산물의 충체내 직접 침입 가능성도 배제할 수 없다.
혈구소낭형성도 Xn 처리에 따라 억제되었다. 혈구소낭형성은 세균과 같은 소형 외래인자 침입에 대해서 혈구세포가 효과적으로 체내 세균을 제거하는 면역반응을 보이는 과정(Lavine and Strand, 2002)으로 크게 두 과정으로 구성된다. 하나의 과정은 혈구세포들의 협력 작용으로 우선은 과립혈구가 감염 세균 주변으로 둘러싸면서 부정형혈구를 모아 여러 겹의 혈구층을 형성하는 세포반응이다. 이후 페놀옥시데이즈 촉매에 따른 멜라닌반응으로 뭉쳐진 혈구 덩어리의 암화과정이 일어난다. 이 과정을 통해 끌려진 세균의 치사가 일어나게 된다. Xn 대사물질은 콩명나방의 이 혈구소낭형성을 억제하였다. 두 과정 가운데 어떠한 과정을 Xn이 억제하였는지는 본 연구결과는 직접적으로 분석하지 않았다. 그러나 Xn 물질이 PLA2 효소반응을 억제하는 것을 미뤄 여러 단계에서 Xn이 소낭형성과정을 억제하였을 것으로 추정된다. Seo et al. (2012)은 Xn 배양액에 8종의 PLA2 억제 대사산물이 있다고 밝혔다. 즉, PLA2의 활성 억제는 아이코사노이드 생합성을 억제하는 것으로 콩명나방의 면역 중개 과정이 현격히 줄었을 것으로 추정된다. 아이코사노이드는 혈림프 속에 순환되는 혈구세포의 밀도를 증가시킨다(Park and Kim, 2012). 특히 PG류가 이 과정에 관여하는 것으로 파밤나방에서 밝혀졌다. 증가된 혈구세포는 세균에서 분비되는 신호물질에 반응하여 아이코사노이드의 농도 차이가 형성되고, 이 농도 차이를 따라 혈구세포는 세균 쪽으로 모이게 된다(Merchant et al., 2008). 세균 주변으로 모인 혈구세포는 앞에서 기술한 혈구활착행동으로 세균 집단을 둘러싸게 된다. 또한 PG류는 페놀옥시데이즈를 합성하여 세포질에 축적하고 있는 편도혈구의 세포붕괴를 유발한다(Shrestha and Kim, 2008). 이 편도세포 붕괴를 통해 혈장으로 빠져나온 페놀옥시데이즈는 일련의 단백질분해 반응의 산물로서 prophenoloxidase-activating peptidase의 촉매반응으로 활성화된다(Kanost and Jiang, 2015). 활성화된 페놀옥시데이즈는 아미노산 타이로신을 기반으로 유도된 카테콜아민(catecholamine)류의 퀴논화를 촉매하게 된다(Zhao et al., 2007). 이를 통해 얻어진 퀴논류는 암화반응을 촉매하여 소낭형성을 마치게 한다. 따라서 Xn의 PLA2 억제효과는 아이코사노이드 생합성을 억제하여 소낭형성의 여러 단계에 관여하는 아이코사노이드의 중개 과정을 억제하게 된다. 이를 통해 콩명나방은 세균에 대해서 효과적 세포성 면역반응이 소낭형성 능력을 잃게 된다.
이상의 결과는 본 연구에서 개발한 비티플러스 기술의 원리를 설명하여 주고 있다. 즉, X. nematophila의 배양액에 포함된 PLA2 억제물질이 콩명나방의 면역반응을 낮추어 비티의 병원력을 높인 것으로 추정하고 있다. 즉, 비티의 곤충에 대한 병원력이 비티가 생산하는 독소단백질인 Cry가 중장세포막을 파괴하여 중장세포가 붕괴되면 소화관 내부에 서식하고 있던 여러 미생물들이 혈강으로 침입하여 들어와 패혈증을 유발하는 과정을 통해 곤충의 치사를 유발하여 이뤄진다(Bravo et al., 2011). 이때 이를 억제하려는 곤충의 혈강 및 소화관 내부에서 일어나는 면역반응을 Xn이 낮춰주어 비티의 병원력을 더욱 효과적으로 발휘하도록 도와주어 비티와 Xn의 협력 작용을 설명하고 있다. 이를 통해 비티플러스는 신경독성을 지닌 화학농약과 유사한 살충력을 발휘할 수 있게 되었다. 또한 본 연구는 콩명나방에 대해서 더욱 효과적 비티플러스를 제조할 수 있는 기술적 단서를 제공하고 있다. 다양한 비티 가운데 콩명나방에 효과적인 비티를 선발하는 것으로 특히 Cry1Ab를 발현하는 비티 균주를 찾아 비티플러스 제조에 이용하는 것이다. 향후 콩명나방 방제에 더욱 효과적인 비티플러스 개발 후속 연구가 요구된다.
Acknowledgments
본 연구는 농촌진흥청 아젠다연구사업(과제번호: PJ01182003)으로 지원되었다.
References
- Arodokoun, D. Y., M. Tamò, C. Cloutier, and R. Adeoti, (2003), The importance of alternative host plants for the annual cycle of the legume pod borer, Maruca vitrata Fabricius (Lepidoptera: Pyralidae), Insect Sci. Appl, 23, p103-113.
- Bae, Y. S., (2001), Family Pyraloidea: Pyraustinae & Pyralinae. Economic Insects of Korea 9, Ins. Koreana Suppl, 16, p252.
-
Bel, Y., A. K. Jakubowska, J. Costa, S. Herrero, and B. Escriche, (2013), Comprehensive analysis of gene expression profiles of the beet armyworm Spodoptera exigua larvae challenged with Bacillus thuringiensis Vip3Aa toxin, PLoS One, 8, pe81927.
[https://doi.org/10.1371/journal.pone.0081927]

- Bottenberg, H., M. Tamò, D. Arodokoun, L. E. N. Jackai, B. Singh, and O. Youm, (1997), Population dynamics and migration of cowpea pests in northern Nigeria: implications for integrated pest management. In Advances in cowpea research, Singh, B. B., D. R. Mohan Raj, K. E. Dashiell, & L. E. N. Jackai Eds., Co-publication of International Institute of Tropical Agriculture (IITA) and Japan International Center for Agricultural Sciences (JIRCAS) IITA Ibadan, Nigeria, p271-284.
-
Bradford, M. M., (1976), Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Anal. Biochem, 72, p248-254.
[https://doi.org/10.1006/abio.1976.9999]

-
Bravo, A., S. Likitvivatanavong, S. S. Gill, and M. Goberon, (2011), Bacillus thuringiensis: a story of a successful bioinsecticide, Insect Biochem. Mol. Biol, 41, p423-431.
[https://doi.org/10.1016/j.ibmb.2011.02.006]

- Burke, J. E., and E. A. Dennis, (2009), Phospholipase A2 structure/function, mechanism, and signaling, J. Lipid Res, 50, pS237-S242.
-
Ekesi, S., (1999), Insecticide resistance in field populations of the legume pod-borer, Maruca vitrata Fabricius (Lepidoptera: Pyralidae), on cowpea, Vigna unguiculata (L.), Walp in Nigeria, Intl. J. Pest Manage, 45, p57-59.
[https://doi.org/10.1080/096708799228058]

-
Eom, S., Y. Park, H. Kim, and Y. Kim, (2014), Development of a high efficient “Dual Bt-Plus” insecticide using a primary form of an entomopathogenic bacterium, Xenorhabdus nematophila, J. Microbiol. Biotechnol, 24, p507-521.
[https://doi.org/10.4014/jmb.1310.10116]

- Gillespie, J. P., M. R. Kanost, and T. Trenczek, (1997), Biological mediators of insect immunity, Annu. Rev. Entomol, 42, p611-643.
-
Grigolli, J. F. J., A. L. F. Lourencao, and C. J. Avila, (2015), Field efficacy of chemical pesticides against Maruca vitrata Fabricius (Lepidoptera: Crambidae) infesting soybean in Brazil, Am. J. Plant. Sci, 6, p537-544.
[https://doi.org/10.4236/ajps.2015.64058]

-
Heo, H., Y. Son, B. Seo, J. Jung, and Y. Kim, (2009), A molecular marker discriminating the soybean podworm, Matsumuraeses phaseoli and the podborer, M. falcana (Lepidoptera: Tortricidae), Korean J. Appl. Entomol, 48, p547-551.
[https://doi.org/10.5656/ksae.2009.48.4.547]

-
Jung, S., and Y. Kim, (2006), Synergistic effect of Xenorhabdus nematophila K1 and Bacillus thuringiensis subsp. aizawai against Spodoptera exigua (Lepidoptera: Noctuidae), Biol. Control, 39, p201-209.
[https://doi.org/10.1016/j.biocontrol.2006.07.002]

-
Jung, J. K., B. Y. Seo, J. H. Park, J. K. Moon, B. S. Choi, and Y. H. Lee, (2007), Developmental characteristics of soybean podworm, Matsumuraeses phaseoli (Lepidoptera: Tortricidae) and legume pod borer, Maruca vitrata (Lepidoptera: Pyralidae) on semi-synthetic artificial diets, Korean J. Appl. Entomol, 46, p393-399.
[https://doi.org/10.5656/ksae.2007.46.3.393]

-
Jung, J. K., B. Y. Seo, J. R. Cho, Y. H. Kwon, and G. H. Kim, (2009), Occurrence of lepidopteran insect pests and injury aspects in Adzuki bean fields, Korean J. Appl. Entomol, 48, p29-35.
[https://doi.org/10.5656/ksae.2009.48.1.029]

- Jung, J. K., B. Y. Seo, Y. Kim, and S. W. Lee, (2016), Can Maruca vitrata (Lepidoptera: Crambidae) over-winter in Suwon area?, Korean J. Appl. Entomol, 55, p439-444.
-
Kanost, M. R., and H. Jiang, (2015), Clip-domain serine proteases as immune factors in insect hemolymph, Curr. Opin. Insect Sci, 11, p47-55.
[https://doi.org/10.1016/j.cois.2015.09.003]

- Kim, Y., (2008), Strategies to develop novel antibiotics and antiinflammatory agents by exploiting insect immune responses, J. Basic Life Res. Sci, 8, p25-33.
- Kim, Y., J. Lee, S. Kang, and S. Han, (1997), Variation in insecticide susceptibilities of the beet armyworm, Spodoptera exigua (Hbner): esterase and acetylcholinesterase, Korean J. Appl. Entomol, 36, p172-178.
-
Kim, Y., D. Ji, S. Cho, and Y. Park, (2005), Two groups of entomopathogenic bacteria, Photorhabdus and Xenorhabdus, share an inhibitory action against phospholipase A2 to induce host immunodepression, J. Invertebr. Pathol, 89, p258-264.
[https://doi.org/10.1016/j.jip.2005.05.001]

- Kim, Y., M. Sadekuzzaman, M. Kim, K. Kim, Y. Park, and J. K. Jung, (2016), Genetic character and insecticide susceptibility on a Korean population of a subtropical species, Maruca vitrata, Korean J. Appl. Entomol, 55, p257-266.
- KOSTAT, (2011), Year 2011 - Yield Statistics in Agricultural Products, kosis.kr/ups3/upload/101/IG/plantstat11.pdf (acccessed on May 10, 2017).
- Kwon, B., and Y. Kim, (2008), Benzylideneacetone, an immunosuppressant, enhances virulence of Bacillus thuringiensis against beet armyworm, Biol. Control, 101, p36-41.
- Lavine, M. D., and M. R. Strand, (2002), Insect hemocytes and their role in immunity. Insect Biochem, Mol. Biol, 32, p1295-1309.
- Lee, S. T., R. Srinivasan, Y. J. Lo, and N. S. Talekar, (2007), Identification, characterization and bioassays of Maruca vitrata multiple nucleopolyhedrosis (MaviNPV) against Maruca vitrata (Lepidoptera, Pyralidae), BioControl, 52, p801-819.
- Margam, V. M., B. S. Coates, M. N. Ba, W. Sun, C. L. Binso-Dabire, I. Baoua, M. F. Ishiyaku, J. T. Shukle, R. L. Hellmich, F. G. Covas, S. Ramasamy, J. Armstrong, B. R. Pittendrigh, and L. L. Murdock, (2011), Geographic distribution of phylogenetically-distinct legume pod borer, Maruca vitrata (Lepidoptera: Pyralidae: Crambidae), Mol. Biol. Rep, 38, p893-903.
-
Merchant, D., R. L. Ertl, S. I. Rennard, D. W. Stanley, and J. S. Miller, (2008), Eicosanoids mediate insect hemocyte migration, J. Insect Physiol, 54, p215-221.
[https://doi.org/10.1016/j.jinsphys.2007.09.004]

-
Oghiakhe, S., L. E. N. Jackai, and W. A. Makanjuola, (1995), Evaluation of cowpea genotypes for field resistance to the legume pod borer, Maruca testulalis, in Nigeria, Crop Prot, 14, p389-394.
[https://doi.org/10.1016/0261-2194(95)98918-l]

- Paek, M., J. Hwang, K. Jung, T. Kim, M. Kim, Y. Lee, Y. Cho, S. Park, H. Le, D. Ku, J. Jeong, K. Kim, D. Choi, E. Shin, J. Hwang, J. Lee, S. Kim, and Y. Bae, (2010), Checklist of Korean insects, Nature & Ecology, Seoul, Korea.
-
Park, J., and Y. Kim, (2012), Change in hemocyte populations of the beet armyworm, Spodoptera exigua, in response to bacterial infection and eicosanoid mediation, Korean J. Appl. Entomol, 51, p349-356.
[https://doi.org/10.5656/ksae.2012.09.0.038]

-
Park, Y., and Y. Kim, (2013), RNA interference of cadherin gene expression in Spodoptera exigua reveals its significance as a specific Bt target, J. Invertebr. Pathol, 114, p285-291.
[https://doi.org/10.1016/j.jip.2013.09.006]

-
Radvanyi, F., L. Jordan, F. Russo-Marie, and C. Bon, (1989), A sensitive and continuous fluorometric assay for phospholipase A2 using pyrene-labeled phospholipids in the presence of serum albumin, Anal. Biochem, 177, p103-109.
[https://doi.org/10.1016/0003-2697(89)90022-5]

- Raymond, M., (1985), Log-probit analysis Basic program for microcomputer, Cah. ORS-TOM. Sr. Ent. md. et Parasitol, 23, p117-121.
- SAS Institute, Inc, (1989), release 6.03 Ed, SAS Institute, Cary, NC.
-
Seo, S., and Y. Kim, (2011), Development of “Bt-Plus” biopesticide using entomopathogenic bacterial (Xenorhabdus nematophila, Photorhabdus temperata ssp. temperata) metabolites, Korean J. Appl. Entomol, 50, p171-178.
[https://doi.org/10.5656/ksae.2011.07.0.24]

- Seo, S., S. Lee, Y. Hong, and Y. Kim, (2012), Phospholipase A2 inhibitors synthesized by two entomopathogenic bacteria, Xenorhabdus nematophila and Photorhabdus temperata subsp, temperata. Appl. Environ. Microbiol, 78, p3816-3823.
-
Sharma, H. C., (1998), Bionomics, host plant resistance, and management of the legume pod borer, Maruca vitrata - a review, Crop Prot, 17, p373-386.
[https://doi.org/10.1016/s0261-2194(98)00045-3]

-
Shrestha, S., and Y. Kim, (2008), Eicosanoids mediate prophenoloxidase release from oenocytoids in the beet armyworm Spodoptera exigua, Insect Biochem. Mol. Biol, 38, p99-112.
[https://doi.org/10.1016/j.ibmb.2007.09.013]

-
Shrestha, S., and Y. Kim, (2009), Various eicosanoids modulate the cellular and humoral immune responses of the beet armyworm, Spodoptera exigua, Biosci. Biotech. Biochem, 73, p2077-2084.
[https://doi.org/10.1271/bbb.90272]

-
Singh, S. R., and H. F. van Emden, (1979), Insect pests of grain legumes, Annu. Rev. Entomol, 24, p255-278.
[https://doi.org/10.1146/annurev.en.24.010179.001351]

-
Srinivasan, R., (2008), Susceptibility of legume pod borer (LPB), Maruca vitrata to δ-endotoxins of Bacillus thuringiensis (Bt) in Taiwan, J. Invertebr. Pathol, 97, p79-81.
[https://doi.org/10.1016/j.jip.2007.06.005]

-
Stanley, D. W., (2000), Eicosanoids in Invertebrate Signal Transduction System, Princeton University Press, Princeton.
[https://doi.org/10.1515/9781400865055]

- Taylor, T. A., (1978), Maruca testulalis, an important pest of tropical grain legumes, In Pests of Grain Legumes: Ecology and Control Singh, S. R., H. F. Emden, & T. A. Taylor Eds., Academic Press, London, p193-200.
-
Xu, J., C. Morisseau, J. Yang, K. S. Lee, S. G. Kamita, and B. D. Hammock, (2016), Ingestion of the epoxide hydrolase inhibitor AUDA modulates immune responses of the mosquito, Culex quinquefasciatus during blood feeding, Insect Biochem. Mol. Biol, 76, p62-69.
[https://doi.org/10.1016/j.ibmb.2016.06.011]

-
Zhao, P., J. Li, Y. Wang, and H. Jiang, (2007), Broad-spectrum antimicrobial activity of the reactive compounds generated in vitro by Manduca sexta phenoloxidase, Insect Biochem. Mol. Biol, 37, p952-959.
[https://doi.org/10.1016/j.ibmb.2007.05.001]
