배추좀나방 지역 계통의 11개 약제에 대한 저항성 수준 평가와 약제효력지수에 대한 개념 설정
초록
배추좀나방은 현재까지 95종의 약제에 약 777여건 이상의 저항성 발달이 보고된 십자화과 가해 해충으로 서, 저항성 개체군의 효과적인 관리를 위해서는 저항성 발달 여부의 신속한 평가가 중요하다. 본 연구에서는 현재 상용화되고 있는 11종의 약제를 대상으로 5개 주요 배추 재배지에서 채집한 계통을 대상으로 옆침지법을 통해 저항성 수준을 조사하였다. 그 결과, Dinotefuran을 제외한 10종의 약제는 감수성 계통 대비 0.1~3.3배의 낮은 저항성 수준을 보였다. Dinotefuran은 5개 지역 계통에서 약 5.7~69.4배의 저항성비를 나타내었다. 생물검정을 통한 저항성수준 평가와 더불어 분자 마커를 이용하여 피레스로이드계와 다이아마이드계 약제의 저항성 돌연변이의 빈도를 측정하였다. 피레스로이드계 약제 저항성과 유관한 kdr과 super-kdr돌연변이 빈도는 0.07(약 7%)과 0.13(약 13%)으로서 2004년 지역 계통 대비 감소된 것으로 확인되었다. 다이아마이드계 약제 저항성과 관련된 것으로 알려진 Ryanodine receptor상의 G4946E 돌연변이 빈도는 GG_TB과 GG_YY집단에서 18.4%와 79.2%로 조사되었다. 약제 추천농도의 배추좀나방에 대한 효력 검정의 수단으로서 약제효력지수(pesticide efficacy index, PEI)를 수립하여 약제 별로 평가한 결과, 네오니코티노이드계와 다이아마이드계 약제의 추천농도에서 배추좀나방에 대한 효력이 감소된 것을 확인하였다.
Abstract
Diamondback moth (DBM), Plutella xylostella, is a major pest of cruciferous crops, and 777 cases of resistance development to 95 kinds of insecticides have been reported to date. For the efficient management of insecticide-resistant populations of P. xylostella, therefore, of importance is a rapid evaluation of resistance level in field populations. Here, we investigated the resistance levels of five field populations to 11 insecticides by leaf-dipping methods. 10 insecticides (except dinotefuran) showed low resistance ratios of 0.1~3.3 fold compared to the susceptible strain. However, five field populations exhibited a wide range of resistance ratios (5.7 to 69.4 folds) to dinotefuran. Molecular diagnostic method was used to measure the allele frequencies associated with resistance to pyrethroid and diamide insecticides. The allele frequencies of kdr and super-kdr mutations associated with pyrethroid resistance were approximately 7% and 13%, respectively, which were found to be lower than those in 2004 survey. The allele frequency of G4946E on the ryanodine receptor gene, known as a molecular marker of diamide insecticide, was found to be 18.4% and 79.2% in the GG_TB and GG_YY populations, respectively. The pesticide efficacy index (PEI) was established to evaluate the efficacy of recommended concentrations of 11 pesticides to P. xylostella. The PEI indicated that the efficacy of neonicotinoid and diamide was decreased.
Keywords:
Insecticide, Monitoring, Pesticide efficacy index, Plutella xylostella, Resistance키워드:
살충제, 모니터링, 약제효력지수, 배추좀나방, 저항성서 론
배추좀나방 (Plutella xylostella)은 전세계적으로 배추, 무, 양배추 등 십자화과 작물에 심각한 경제적 피해를 유발하는 주요 해충이다(Cheng, 1988; Talekar and Shelton, 1993). 유충 시기에 직접적인 섭식을 통해 식물체 엽육을 가해하며 광합성을 저해하여 고사시킨다. 배추좀나방의 주요 방제는 화학합성 살충제를 사용하여 이뤄졌으나, 1950년대 유기염소계 살충제에 대하여 저항성이 보고된 이후(Ankersmit, 1953), 유기인계와 카바메이트계(Noppun et al., 1983), 피레스로이드계(Hama, 1987), Bacillus thruringiensis (Bt)계(Tabashnik et al., 1990), 곤충성장조절제(Perng et al., 1988) 등 대부분의 약제에 저항성이 발달한 것으로 보고되고 있다. 또한 1990년대 이후에 사용되기 시작한 네오니코티노이드계(Ninsin, 2004)와 다이아마이드계(Troczka et al., 2012) 약제들에 대해서도 저항성이 발달한 것으로 보고된 바 있다. 절지동물 약제 저항성 데이터베이스(Arthropod Pesticide Resistance Database, APRD)에 따르면 2016년까지 저항성 발달 보고 건수가 777건으로 절지동물 중에서 저항성 발생 보고 빈도가 가장 높았으며, 약 95종의 약제 유효성분에 대해 저항성을 보이는 것으로 알려져 있다(Whalon et al., 2008).
국내의 경우, 1991년 대관령 지역 계통에서 Bt계 약제에 대한 저항성 발달(41.3배)이 공식적으로 보고되었다(Song, 1991). 그 다음 유기인계, 피레스로이드계, 유기염소계 그리고 Bt계 약제 4종에 대해서 4개 지역계통에 대한 저항성 수준 평가 결과, Bt계 약제를 제외하고 유기인계, 피레스로이드계, 유기염소계 약제에서 각각 3.3~61.1배, 7.5~141.7배, 10.5~33.3배 저항성이 발달한 것으로 나타났다(Lee et al., 1993). 이 후 추가적으로 카바메이트계(Cho et al., 2001)와 Bt계(Kim et al., 2010) 약제들에 저항성 발달이 추가로 보고되었다. 생물검정을 통한 저항성 발달 평가 방법 이외에도, 신속한 야외 개체군의 저항성 수준 측정을 위해 유전자 마커를 기반으로 한 저항성 진단 연구가 수행되었다. 피레스로이드계 약제 저항성 작용점인 Voltage-sensitive sodium channel (VSSC) 상의 L1014F와 T929I 돌연변이가 보고되었는데, PASA (PCR Amplification of Specific Allele)와 rt-PASA (real-time PASA) 방법을 이용하여 국내 야외 집단에서 각각 100%, 75~100%의 매우 높은 빈도의 저항성 돌연변이가 존재하는 것으로 확인하였다(Kwon et al., 2004a; 2004b). Acetylcholinesterase (AChE) 상의 저항성 관련 돌연변이를 스크리닝하여 유기인계 저항성과 관련된 3종의 돌연변이(A201S, G227A, A441G)의 존재를 확인하였고(Baek et al., 2005), 야외 집단의 A201 (298)S와 G227 (324)A 돌연변이 형질빈도는 각각 67~100%와 68.5~100%로서 매우 높은 수준인 것으로 나타났다(Kim et al., 2011; 2012).
효과적인 약제 저항성 개체군의 관리를 위해서는 다양한 약제에 대한 저항성 수준을 평가하여 효력이 높은 약제를 선발해 주는 시스템 구축이 필요하다(Kwon et al., 2015). 효과적인 약제 사용은 궁극적으로 저항성 개체군 발달을 지연시켜 살충제 가용 수명을 증대시킬 수 있다. 본 연구에서는 5개 지역의 배추좀나방 계통을 대상으로 11개 약제에 대한 저항성 발달 여부를 생물검정(옆침지법)을 통해 평가하였다. 또한 피레스로이드계와 다이아마이드계 약제 저항성 발달 여부를 분자마커를 이용하여 정량적으로 측정하였다. 마지막으로 등록 약제의 추천농도에 대한 효력을 평가하기 위해 약제효력지수(Pesticide Efficacy Index, PEI)라는 개념을 설정하여 배추좀나방에 대한 약효를 평가하였다. 생물검정과 유전자 진단을 통한 배추좀나방의 약제 저항성 수준평가 연구는 저항성 개체군 발달 여부를 확인하는데 중요한 기초 정보를 제공하며, 특히 약제효력지수는 살충제를 포함한 약제의 해충에 대한 효력을 확인하기 위한 중요한 정보를 제공해 줄 것이다.
재료 및 방법
대상곤충 및 사육방법
실험에 사용한 5개 지역계통은 2015년 4월부터 11월까지 강원도 양양시(GW_YY), 강원도 태백시(GW_TB), 전라북도 무주군(JB_MJ), 전라남도 해남군(JN_HN), 제주도(JJ)의 배추 재배단지에서 채집하였다(Table 1). 지역 계통의 유지 및 증식은 아크릴케이지(30 × 30 × 30 cm3)안에 배추 유묘(정식 후 15일)를 정기적으로 공급하여 누대 사육하였으며, 사육 조건은 온도 25 ± 2oC, 상대습도 50~60%, 광조건 16L:8D이었다. 배추좀나방 감수성 계통(SUS)은 전북 전주 소재의 국립농업과학원 작물보호과에서 10년 이상 살충제에 노출시키지 않고 누대 사육하였다.
실험약제
연구에 사용한 약제는 배추좀나방 방제에 상업적으로 등록되어 있는 11종의 살충제로서 Acetamiprid (5% SL, 신엑스, ㈜경농), Bacillus thuringiensis subsp. kurstaki (25% WP, 스콜피온, ㈜한얼싸이언스), Chlorantraniliprole (5% WG, 알타코아, ㈜팜한농), Cypermethrin (5% EC, 아그로텍피레스, ㈜아그로텍), Diflubezuron (25% WP, 디밀린, 신젠타코리아㈜), Dinotefuran (10% WP, 오신, ㈜팜한농), Emamectin Benzoate (2.15% EC, 에이팜, 신젠타코리아㈜), Etofenprox (20% EC, 세베로, ㈜경농), Imidacloprid (10% WP, 코니도, 바이엘크롭사이언스㈜), Indoxacarb (5% SC, 스튜어트골드, ㈜팜한농) 그리고 Pyridalyl (10% EW, 프레오, ㈜동방아그로)이다. Insecticide Resistance Action Committee(IRAC)에서 제시한 살충제의 계열 구분법에 따르면 모두 8개 계열로 구분이 된다(Table 2).
생물검정
생물검정은 기존에 보고된 엽침지법(leaf dipping method)을 따라 수행하였다(Shelton et al., 1993). 요약하여 설명하면, 각각의 약제를 증류수에 순차적인 농도로 희석하였으며, 배추(Brassica rapa L. ssp pekiensis) 잎 절편 (지름 6 cm)을 각 농도의 살충제 용액에 10초간 침지 후 꺼낸 다음, 30분 이상 충분히 음건하였다. 약제가 처리 된 절편의 건조를 막기 위하여 여과지(지름 9 cm, ADVANTEC, Filter-Paper No.1)에 약 0.2 ml의 증류수를 분주하여 페트리디쉬(지름 9 cm, SPL Lifi Sciences, Cat. NO. 10090)에 옮겼으며, 그 위에 실내 증식한 배추좀나방 3령 유충을 10마리씩 5반복 접종하였다. 사충수 조사는 10개 약제의 경우 접종 후 48시간에 수행하였으며, 곤충성장조절제 계통인 Diflubenzuron은 약제 독성 특성을 고려하여 처리 120시간 후에 사충수를 조사하였다. 6개 계통의 약제 별 반수치사농도(LC50) 산출은 다음 과정을 통해 수행되었다. 먼저, Abbott의 공식을 따른 보정사충률을 산출 후(Abbott, 1925), SPSS 13.0 (IBM Analytics)을 이용한 Probit 분석을 수행하였다(Finney, 1971). 5개 지역 계통의 저항성비는 약제 별로 해당 지역 계통의 반수치사농도(LC50)를 감수성 계통의 값으로 나누어 산출하였다.
Genomic DNA 추출 및 약제 작용점 유전자 증폭
배추좀나방 지역 계통 20-25마리 개별 개체로부터 ExgeneTM Tissue SV plus (GeneAll Biotechnology, Co. LtD, Seoul)를 사용하여 제조사의 프로토콜을 따라 수행하였다. 배추좀나방 한 마리를 1.5 ml 마이크로튜브에 넣은 후, Plastic pestle(Bel-Art - SP Scienceware, NJ)을 이용하여 200 μl의 TL 버퍼와 함께 조직을 마쇄하였다. 그 후에 20 μl proteinase K를 첨가 후 56oC에서 12시간에 보관하였다. 마쇄액의 상층액을 SV컬럼에 넣은 후 12,000 g에서 20초간 원심분리하였다. 하층액을 제거한 후 700 μl의 TW buffer로 2회 세척 후, 100 μl AE buffer로 gDNA를 분리하였다. gDNA의 정량은 NanoDrop 1000 UV-Vis Spectrophotometer (Thermo Fisher Scientific Inc., Waltham, MA)를 이용하였으며, 집단의 저항성 돌연변이를 측정하기 위해 지역 별로 개별 개체의 gDNA를 25 ng−1μl로 희석 후 각각 5 μl씩 분주하여 모은 후 후속 저항성 관련 작용점 유전자 증폭에 사용하였다.
피레스로이드계와 다이아마이드계 약제 저항성 관련 돌연변이를 포함하고 있는 작용점 부분 유전자 단편을 증폭하였다. 전체 40 μl 반응액에, 각각 4 μM의 프라이머(Table 3), 10 mM dNTP, 0.8 μl Taq Polymerase (GenAll Taq DNA polymerase), 100 ng genomic DNA를 첨가하였으며, PCR 조건은 초기 94oC / 2 min × 1 cycle과 94oC / 30 sec + 58oC / 30 sec + 72oC / 90 sec에서 35 cycle로 수행하였다. 전기영동을 통한 유전자 증폭 확인 후, NICEM을 통해 ABI 3730(Thermo Fisher Scientific Inc.)를 이용하여 염기서열 분석을 수행하였다. 피레스로이드 저항성에 관여하는 VSSC상에 존재하는 T929I와 L1014F 돌연변이와 다이아마이드계약제 저항성과 유관한 Ryandine receptor (RyR) 상의 G4946E 돌연변이에 해당하는 염기의 비율은 Chromas (Technelysium Pty. Ltd.)을 이용하였으며, 이 중에서 G4946E 돌연변이 형질빈도는 Sonoda 등이 제안한 정량적염기서열분석 공식을 기반으로 산출하였다(Sonoda et al., 2017).
추천 농도 대비 약제 효용성 검정 및 통계 분석
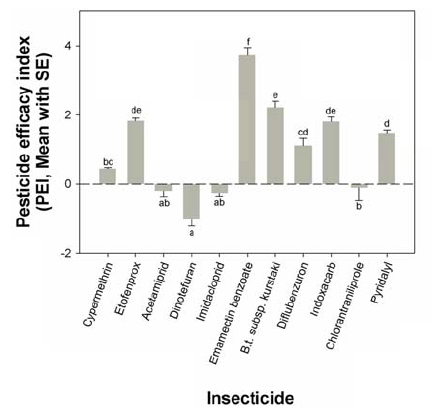
배추좀나방 지역 계통에 대한 약제 별 효율을 검정하기 위해 약제효력지수(Pesticide Efficacy Index, PEI)라는 개념을 도입하였다. PEI 값의 산출은 먼저 약제 별 추천 농도를 각 지역 계통의 LC90으로 나눈 후 그 값을 로그 변환하였다. 그 다음 각 지역 계통의 로그치환 값들의 평균값을 PEI로 선정하였다. 약제 별 PEI 지수가 양(+)의 값을 지닐 경우 유효한 약제로 규정하며, 0과 음(-)의 값은 약효가 둔화된 것으로 간주하였다. 본 연구에서는 각 약제 별 PEI 값 산출 후, 통계적인 유의성을 검정하기 위해 일원분산분석을 수행하였으며, Tukey's HSD (honestly significant difference test)를 통해 평균간 차이를 검정하였다(IBM SPSS Statistics version 23, IBM corporation).
결과 및 고찰
생물검정기반 약제 저항성 수준
8개 계열에 포함하는 11종 살충제의 약제 저항성비를 옆 침지기법으로 조사하였다. 피레스로이드계에 속하는 Cypermethrin과 Etofenprox의 감수성 계통 대비 저항성 비는 2.2~3.3배와 1.1~2.8배로서 낮은 수준의 저항성을 보였다(Fig. 1A and 1B; Supplementary Table 1). 3종의 네오니코티노이드계 약제인 Acetamiprid, Dinotefuran 그리고 Imidacloprid 약제 저항성비는 각각 0.5~3.1배, 5.7~69.4 그리고 0.8~2.4배인 것으로 나타났다(Fig. 1C, 2D and 2E; Supplementary Table 1). 이 중에서 Dinotefuran에서 GN_MJ 계통의 저항성 비가 69.4배로서 해당 약제에 대한 저항성이 발달하였음을 확인하였다. 또한 Dinotefuran의 추천 약량이 일부 지역 계통의 반수치사농도 대비 낮은 것으로 나타났다. 나머지 5개 계열에 포함되는 Emamectin benzoate, Bacillus thuringiensis subsp. kurstaki, Diflubenzurone, Indoxacarb, Pyridalyl 약제 저항성비는 각각 0.1~1.4배(Fig. 2A), 0.9~1.3배(Fig. 2B), 0.2~1.6배(Fig. 2C), 0.3~1.5배(Fig. 2D), 그리고 0.6~1.5(Fig. 2F)배로서 조사 지역에서 저항성이 발달하지 않았음을 알 수 있었다(Supplementary Table 1). Bacillus thuringiensis subsp. kurstaki 의 경우는 반수치사농도가 0.8-1.6 mg−1L로 2010년 김 등의 강원도 채집계통에서와 큰 차이가 없는 것으로 보아 지역적 저항성이 거의 발달되지 않은 것으로 생각된다(Kim et al., 2010). 반면에 Chlorantraniliprole의 저항성비는 0.3~30.7배였으며 GN_SC계통의 반수치사농도는 추천농도보다 높게 나타나 일부 지역 계통에서 저항성이 발달된 것으로 사료되었다(Fig. 2E). 요약하면, 11개 약제 중에서 추천농도에서도 저항성을 나타내는 약제는 3종의 네오니코티노이드계약제와 다이아마이드계인 것으로 나타났다. 그 중에서도 Dinotefuran에서 대부분의 지역 계통에서 높은 저항성 발달이 나타나 앞으로 해당 계통의 약제를 이용한 방제에 주의가 요구된다.
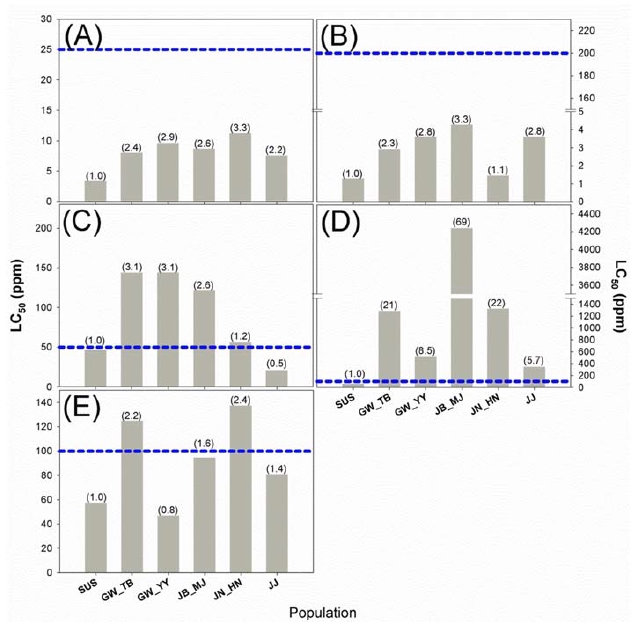
Resistance ratio of pyrethroid and neonicotinoid insecticides to five different population in Plutella xylostella in Korea. The blue-dotted line represent the recommended concentration of commercial insecticide product. A, Cypermethrin; B, Etofenprox; C, Acetamiprid; D, Dinotefuran; E, Imidacloprid.
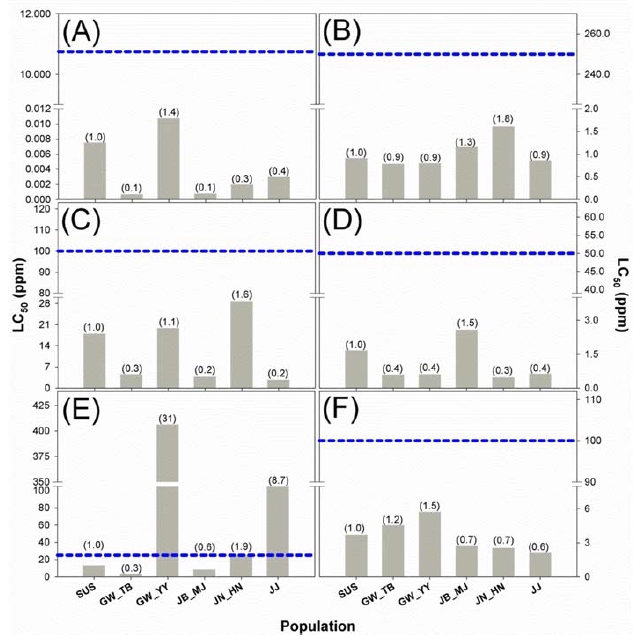
Resistance ratio to six different insecticides in Plutella xylostella in Korea. The blue-dotted line represent the recommended concentration of commercial insecticide product. A, Emamectin benzoate; B, Bacillus thuringiensis subsp. kurstaki; C, Diflubenzuron; D, Indoxcarb; E, Chlorantraniliprole; F, Pyridalyl.
피레스로이드와 다이아마이드계열 저항성 돌연변이 진단
피레스로이드계와 다이아마이드계열의 약제 저항성 관련 돌연변이의 형질빈도를 해당 유전자 돌연변이를 포함하고 있는 작용점 유전자 부위를 증폭하여 염기서열 분석을 통해 확인하였다. 피레스로이드계 약제 작용점인 VSSC상의 kdr과 super-kdr에 관여하는 L1014F와 T929I의 저항성 관련 돌연변이 빈도는 0~100%와 20~100%로서 GW_TB 집단에서 매우 높은 것으로 나타났다(Table 4). 다이아마드계 저항성에 관여하는 것으로 알려진 RyR 상의 G4946E돌연변이는 0~79.2%의 빈도로 분포하였으며, GW_TB 개체군에 존재하는 것으로 나타났다.

The signal ratio and allele frequency of point mutations associated with resistance of pyrethroid and diamide insecticides, respectively
앞선 연구에서 국내 피레스로이드계 약제 저항성 돌연변이 형질빈도 측정 연구에서 대부분의 지역계통에서 L1014F 돌연변이는 100% 포화상태였고, T929I 돌연변이는 75% 이상으로서 피레스로이드계 약제에 높은 저항성을 보였다(Kwon et al., 2004a). 하지만, 본 연구에서는 GW_YY와 GW_TB 지역을 제외하고 JB_MJ, JB_HN 그리고 JJ 지역에서 T929I와 L1014F 돌연변이 빈도는 평균 7%와 13%로서 매우 낮아진 것을 확인할 수 있었다. 다양한 작용점을 기반으로 한 약제가 배추좀나방 방제에 사용이 되어 피레스로이드 약제에 의한 도태압의 상대적 감소에 기인한 것으로 사료된다.
국내 배추좀나방의 다이아마이드계 약제 저항성 관련 돌연변이 존재 여부는 Steinbach et al. (2015)에 의해 처음으로 보고되었다. 2014년 Bongnam-ri와 Sangsan-ri 집단의 12-24마리 유충에서 추출한 DNA에서 G4946E 이형접합자 개체의 빈도는 12%와 30%였으며, 특히, 방제가 실패한 Sangsan-ri 집단의 경우 70%의 동형접합자 저항성 개체가 존재하는 것으로 보고하였다(Steinbach et al., 2015). 이러한 결과는 국내에서 다이아마이드계 저항성 배추좀나방 집단이 그 당시에 이미 출현한 것을 의미한다. 본 연구에서는 G4946E 돌연변이 형질빈도가 GW_TB와 GW_YY 집단에서 18.4%와 79.2%로 각각 발견되었다. RyR 상의 G4946E는 다양한 분자생리학적 연구를 통해 표현형 저항성과 매우 높은 상관관계가 있는 것으로 보고되었다(Guo et al., 2014; Troczka et al., 2012). 하지만 본 연구에서 G4946E 돌연변이 빈도는 실제 포장에서 발견된 저항성비와 상관관계가 없었다. 복합적인 저항성 인자로는 RyR 상의 추가 돌연변이(E1338D, Q4594L 그리고 I4790M 등)(Guo et al., 2014)과 과발현 해독효소가 관여할 것으로 사료된다. 앞으로 저항성비와 상관성이 높은 돌연변이 탐색과 전사체 분석을 통한 해독효소의 관여 여부를 확인하는 연구가 필요할 것으로 사료된다.
추천 농도 대비 약효 수준 측정
배추좀나방에 대한 시험 약제들의 추천사용농도의 적합성을 알아보기 위한 것으로 약제효력지수(PEI)를 각 약제 별로 산출하였다(Fig. 3). 추천농도와 5개 치사농도간의 거리를 측정하는 것으로 양(+)의 값은 추천농도가 지역 집단에 대해 유효함을 의미하고, 0과 음(-)의 값은 지역 계통의 LC90값과 약제의 추천농도가 비슷하여 약효가 낮아졌음을 의미한다. 11개 약제간 비교를 해 보았을 때, 8종(Cypermethrin, Etofenprox, Emamectin benzoate, B.t. subsp. kurstaki, Diflubenzuron, Indoxcarb 및 Pyridalyl) 약제는 양의 값을 나타내며 효력이 우수한 편으로 나타났다. 이 가운데서 Emamectin benzoate의 효력이 가장 우수한 것으로 나타났다. 반면에 Acetamiprid, Dinotefuran, Imidacloprid, 그리고 Chlorantraniliprole을 포함하는 4개 약제는 음의 값을 나타내며 추천 농도의 효력이 낮아 저항성이 발달한 것으로 나타났다(F10, 44 = 64.6, P < 0.001). 이 중에서 Dinotefuran이 가장 큰 음의 값을 나타내며 저항성이 가장 높게 발달하였다.
PEI 지수는 등록 약제의 약효 여부를 제시하여 대상 해충의 저항성 발달 여부를 간접적으로 평가하는데 기여할 수 있다. 추천농도와 비슷한 지역 계통의 LC90 값과 제품의 추천농도간의 효과를 평가하는 것이 필요하지만, probit 분석에 의한 직선회귀식에서 외삽에 의한 LC90 값의 변이가 큰 것으로 나타났다(Data not shown). 따라서, 본 연구에서는 상대적으로 95% 신뢰구간 값이 안정적인 LC50 값을 사용하였다. 앞으로 야외 집단의 실내 저항성 수준 정보와 야외 포장 실험에서의 방제 효력 간의 연관성을 규명하여 PEI 지수의 정교화 작업이 필요하다고 생각된다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ010821)의 연구비지원에 의해 수행되었습니다. Supplementary Table 1은 해당 링크(https://www.researchgate.net/publication/317929293_Supplementary_table_1_Toxicity_parameter_against_11_insecticides_from_five_local_populations_in_Plutella_xylostella)에서 다운로드 받을 수 있습니다.
References
-
Abbott, W., (1925), A method of computing the effectiveness of an insecticide, J. Econ. Entomol, 18, p265-267.
[https://doi.org/10.1093/jee/18.2.265a]

-
Ankersmit, G., (1953), DDT-resistance in Plutella maculipennis (Curt.)(Lep.) in Java, Bull. Entomol. Res, 44, p421-425.
[https://doi.org/10.1017/s0007485300025530]

-
Baek, J. H., J. I. Kim, D.-W Lee, B. K. Chung, T. Miyata, and S. H. Lee, (2005), Identification and characterization of ace1-type acetylcholinesterase likely associated with organophosphate resistance in Plutella xylostella, Pestic. Biochem. Physiol, 81, p164-175.
[https://doi.org/10.1016/j.pestbp.2004.12.003]

-
Cheng, E. Y., (1988), Problems of control of insecticide-resistant Plutella xylostella, Pestic. Sci, 23, p177-188.
[https://doi.org/10.1002/ps.2780230211]

- Cho, J. -M., K. -J. Kim, S. -M. Kim, D. -S. Han, and J. -H. Hur, (2001), Diamondback moth (Plutella xylostella L.) resistance to organophosphorus and carbamate insecticides in Kangwon alpine vegetable croplands, Korean J. Pestic. Sci, 5, p30-35.
- Finney, D., (1971), Probit Analysis, 3rd ed, Cambridge University Press, J. Pharm. Sci, 60, p1432-1432.
- Guo, L., P. Liang, X. Zhou, and X. Gao, (2014), Novel mutations and mutation combinations of ryanodine receptor in a chlorantraniliprole resistant population of Plutella xylostella (L.), Sci. Rep, 4, p6924.
- Hama, H., (1987), Development of pyrethroid resistance in the diamondback moth, Plutella xylostella Linn (Lepidoptera: Yponomeutidae), Appl. Entomol. Zool, 22, p166-175.
-
Kim, J. I., Y. R. Joo, M. Kwon, G. H. Kim, and S. H. Lee, (2012), Mutation in ace1 associated with an insecticide resistant population of Plutella xylostella, J. Asia Pac. Entomol, 15, p401-407.
[https://doi.org/10.1016/j.aspen.2012.02.008]

- Kim, Y. -R., M. -S. Cho, S. -M. Oh, S. -W. Kim, Y. -N. Youn, and Y. -M. Yu, (2010), Resistance and susceptibility of diamondback moth, Plutella xylostella strains collected from different region in Korea to Bacillus thuringiensis, Korean J. Pestic. Sci, 14, p123-132.
-
Kim, Y. H., J. -H. Lee, and S. H. Lee, (2011), Determination of organophosphate and carbamate resistance allele frequency in diamondback moth populations by quantitative sequencing and inhibition tests, J. Asia Pac. Entomol, 14, p29-33.
[https://doi.org/10.1016/j.aspen.2010.11.007]

- Kwon, D. H., B. R. Choi, H. M. Park, S. H. Lee, T. Miyata, J. M. Clark, and S. H. Lee, (2004a), Knockdown resistance allele frequency in field populations of Plutella xylostella in Korea, Pestic. Biochem. Physiol, 80, p21-30.
- Kwon, D. H., J. M. Clark, and S. H. Lee, (2004b), Estimation of knockdown resistance in diamondback moth using realtime PASA, Pestic. Biochem. Physiol, 78, p39-48.
-
Kwon, D. H., T. -J. Kang, Y. H. Kim, and S. H. Lee, (2015), Phenotypic-and genotypic-resistance detection for adaptive resistance management in Tetranychus urticae Koch, PloS one, 10, pe0139934.
[https://doi.org/10.1371/journal.pone.0139934]

- Lee, S., Y. Cho, and D. Kim, (1993), Comparative study of toxicological methods and field resistance to insecticides in diamondback moth (Lepidoptera: Plutellidae), Korean J. Appl. Entomol, 32, p323-329.
-
Ninsin, K. D., (2004), Acetamiprid resistance and crossresistance in the diamondback moth, Plutella xylostella, Pest Manag. Sci, 60, p839-841.
[https://doi.org/10.1002/ps.933]

-
Noppun, V., T. Mitata, and T. Saito, (1983), Susceptibility of four strains of the diamondback moth, Plutella xylostella L., against insecticides, J. Pestic. Sci, 8, p595-599.
[https://doi.org/10.1584/jpestics.8.595]

-
Perng, F., M. Yao, Hung Hung, and C. Sun, (1988), Teflubenzuron resistance in diamondback moth (Lepidoptera: Plutellidae), J. Econ. Entomol, 81, p1277-1282.
[https://doi.org/10.1093/jee/81.5.1277]

-
Shelton, A. M., J. Robertson, J. Tang, C. Perez, S. Eigenbrode, H. Preisler, W. Wilsey, and R. Cooley, (1993), Resistance of diamondback moth (Lepidoptera: Plutellidae) to Bacillus thuringiensis subspecies in the field, J. Econ. Entomol, 86, p697-705.
[https://doi.org/10.1093/jee/86.3.697]

- Song, S. S., (1991), Resistance of diamondback moth (Plutella xylostella L. : Yponomeutidae : Lepidoptera) against Bacillus thuringiensis Berliner, Korean J. Appl. Entomol, 30, p291-293.
- Sonoda, S., K. Inukai, S. Kitabayashi, S. Kuwazaki, and A. Jouraku, (2017), Molecular evaluation of diamide resistance in diamondback moth (Lepidoptera: Yponomeutidae) populations using quantitative sequencing, Appl. Entomol. Zool, p1-5.
-
Steinbach, D., O. Gutbrod, P. Lmmen, S. Matthiesen, C. Schorn, and R. Nauen, (2015), Geographic spread, genetics and functional characteristics of ryanodine receptor based target-site resistance to diamide insecticides in diamondback moth, Plutella xylostella, Insect Biochem. Mol. Biol, 63, p14-22.
[https://doi.org/10.1016/j.ibmb.2015.05.001]

-
Tabashnik, B. E., N. L. Cushing, N. Finson, and M. W. Johnson, (1990), Field development of resistance to Bacillus thuringiensis in diamondback moth (Lepidoptera: Plutellidae), J. Econ. Entomol, 83, p1671-1676.
[https://doi.org/10.1093/jee/83.5.1671]

-
Talekar, N., and A. Shelton, (1993), Biology, ecology, and management of the diamondback moth, Ann. Rev. Entomol, 38, p275-301.
[https://doi.org/10.1146/annurev.en.38.010193.001423]

-
Troczka, B., C. T. Zimmer, J. Elias, C. Schorn, C. Bass, T. E. Davies, L. M. Field, M. S. Williamson, R. Slater, and R. Nauen, (2012), Resistance to diamide insecticides in diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae) is associated with a mutation in the membranespanning domain of the ryanodine receptor, Insect Biochem. Mol. Biol, 42, p873-880.
[https://doi.org/10.1016/j.ibmb.2012.09.001]

- Whalon, M. E., R. M. Mota-Sanchez, R. M. Hollingworth, and L. Duynslager, (2008), Artrhopods Resistant to Pesticides Database (ARPD), http://www.pesticideresistance.org Accessed 13 May 2017.