호박꽃과실파리(Bactrocera scutellata) 방제를 위한 효과적 살충제 스크리닝 기술
초록
호박꽃과실파리(Bactrocera scutellata)는 호박꽃을 가해하는 해충이다. 본 연구는 이 해충을 방제하는 데 유효한 살충제를 선발하기 위한 약제 스크리닝 생물검정법을 구축하려 수행되었다. 우선 기존 여러 과실파리에 적용된 생물검정법 기술을 조사하였다. 이 가운데 야외 조건에서 호박꽃과실파리의 살충제 적용 대상이 되는 번데기와 성충에 대한 생물검정법을 선발했다. 이를 통해 번데기는 토양혼화처리법 그리고 성충은 먹이혼화처리법이 각각 고려되었다. 이 생물검정법들의 유효성을 입증하기 위해 기존에 다른 과실파리에서 적용된 살충제를 대조약제로 국내 유사한 살충 목적으로 다른 해충에 적용되고 있는 약제를 선발하여 적용하였다. 두 생물검정법은 대조약제에서 특징적인 양독반응 또는 완전방제 효과를 나타냈고, 국내 시판되는 후보 약제에서도 방제 효과를 확인할 수 있었다. 반면에 살충제 저항성이 비교적 높은 오리엔탈과실파리(B. orientalis)의 경우는 동일한 생물검정법을 통해 호박꽃과실파리에 비해 감수성이 낮은 것을 확인할 수 있었다. 본 연구는 호박꽃과실파리를 대상으로 발육 시기별로 적합한 약제 스크리닝 기술을 구축하였다.
Abstract
The striped fruit fly, Bactrocera scutellata, is an insect pest infesting pumpkin flowers. This study was performed to establish bioassays screening insecticides to effectively control the fruit flies. Different bioassay techniques assessed in several tephritid fruit flies were investigated and selected to apply mortality assessment pertinent to pupal and adult stages of B. scutellata. From this approach, soil drench and diet mixture bioassays were considered for pupal and adult stages, respectively. To validate these bioassays, two commercially available insecticides registered for controlling other insect pests in a similar purpose were tested with two reference insecticides, which had been used to control other tephritid fruit flies. The two selected bioassays exhibited typical dose-mortality response or complete control efficacy in reference insecticides. Under these conditions, these bioassays showed that the two test insecticides were effective to control B. scutellata. In addition, the pupal bioassay showed that the oriental fruit fly, B. orientalis, pupae were less susceptible than pupae of B. scutellata against the test and reference insecticides. This might be reasoned by developing a relatively higher insecticide resistance of B. dorsalis due to selective pressure in fields. This study established two bioassays to screen insecticides to control B. scutellata.
Keywords:
Bactrocera scutellata, Bactrocera dorsalis, Bioassay, Insecticide, Screening키워드:
호박꽃과실파리, 오리엔탈과실파리, 살충제, 생물검정법, 스크리닝서 론
기후변화와 국제 교역량 증가로 외래 해충의 출현이 늘고 있다(Jung et al. 2015; Lyu and Lee 2017). 우리나라 검역 본부에서는 60 종의 금지해충을 규정하고 있는 데 이 가운데 41 종이 과실파리이다(Kim et al., 2017a). 여기서 과실파리는 주로 과실파리과(Tephritidae)에 속한 파리류로서 이 과는 약 4,400 종 이상을 포함하고 있는 대형 분류군이다(White and Elson-Harris, 1992; Norrbom et al.. 1999). 반면에 국내에서 기록된 과실파리과 곤충은 모두 90 종으로 이들은 Dacinae 아과에 4 종, Phytalmiinae 아과에 4 종, Tephritinae 아과에 39 종, 그리고 Trypetinae 아과에 43 종으로 분류된다(Han and Kwon. 2010; Han et al., 2014). 이 가운데 해충으로 알려진 과실파리는 Dacinae 아과에 속한 호박꽃과실파리(Bactrocera scutellata)와 호박과실파리(B. depressa) 두 종이다.
호박꽃과실파리는 제주 지역에 자생하는 노랑하늘타리(Trichosanthes kirilowii var. japonica Kitam)에 서식하지만, 작물 피해는 주로 호박에서 보고되고 있다(Kim et al., 2017b). 호박에 대한 피해 규모는 Kim et al. (2010) 조사에 의하면 암꽃에 30.7%, 수꽃에 53.8%로 보고하였다. 호박꽃과실파리 성충은 연 2 회 발생을 보이며 우화최성기는 7월 중순~8월 초순과 9월 상순으로 알려졌으나(Kim et al., 2010), 최근 국내 월동 성충집단의 보고에 따라 남부지역을 중심으로 5~6월의 월동세대 발생이 추가되어야 한다(Al Baki et al., 2017). 호박꽃과실파리는 화분매개충으로 식물체 유래의 시노몬(synomon)인 raspberry ketone (RK: 4-(4-Hydroxyphenyl)-2-butanon)에 특이적으로 유인된다(Kim et al., 2017b). 야외 모니터링을 위해서는 보다 안정된 화합물인 Cuelure (CL: 4-(4-Acetoxyphenyl)-2-butanon)가 이용되고 있다(Kim et al., 2012, 2017b).
호박꽃과실파리 유충은 호박꽃 내부에 서식하기 때문에 살포용 약제에 노출되지 않아 방제에 어려움을 주고 있다. 따라서 이 해충의 방제는 야외 대기 중에 노출된 성충을 대상으로 유살(attract-to-kill)기술이 주목받았다(Kim et al., 2017b). 여기에 Bactrocera 속에 속한 수컷들이 교미 전에 무리화(lekking)와 화합물섭취(pharmacophagy) 행동을 보이게 되는 데(Hee and Tan 2004), 이를 이용하여 RK 또는 CL의 유인제에 살충제를 혼합하여 수컷박멸기술(male annihilation technique)이 호박꽃과실파리 방제에 제기되었다(Kim et al., 2017b). 또한 많은 과실파리 암컷의 경우는 알을 만들기 위해서는 먹이를 통해 영영원의 공급을 받아야 하는 영양의존형(anautogenic) 생식을 보이는 데(Drew and Yuval, 2000), 이를 이용하여 단백질성 유인물질에 살충제를 혼합하여 암컷박멸기술(female annihilation technique)을 개발하게 된다(Kim and Kim, 2016). 현재 이러한 목적으로 과실파리류 방제에 널리 사용되고 있는 GF120 (Dow AgroScience, Indianapolis, IN, USA)은 효모추출물에 스피노사드(spinosad) 살충제를 가미하여 개발된 것이다(Rivis et al., 2004). 번데기의 경우는 토양 속에서 용화하기 때문에 토양관주 또는 훈증처리 방식이 약제 처리 기술에 유효할 수 있다(Stark et al., 2004; Yee et al., 2009).
본 연구는 호박꽃과실파리 방제용 살충제를 선발하는 데 궁극적 목표를 두고 방제의 표적이 되는 번데기와 성충 발육시기에 효과적으로 작동할 수 있는 약제를 스크리닝하는 생물검정법을 구축하는 데 목표를 두었다. 아울러 구축된 생물검정법을 적용하기 위해서는 기존에 다른 과실파리에서 적용하고 있는 약제를 대조약제로 두고 국내에서 유사한 목적으로 다른 해충에 방제되고 있는 두 약제를 선택하여 생물검정법의 실효성을 분석하였다.
재료 및 방법
호박꽃과실파리와 오리엔탈과실파리(B. dorsalis) 실내 증식
제주 지역에서 자생하고 있는 노랑하늘타리 꽃에서 호박꽃과실파리 유충을 채집하였다. 수거된 유충은 호박꽃을 먹이로 실내 조건(온도 24~27oC, 광주기 16:8 (L:D), 상대습도 60~80%)에서 증식되었다. 노숙 유충 시기에 먹이 주변에 상토를 투입하여 용화를 유도하였으며, 우화된 성충은 인공사료(이스트추출물: 전지분유: 설탕: 물 = 2: 2: 4: 1, g/g)와 물을 공급받았다.
오리엔탈과실파리는 대만 타이중에 소재하는 국립중흥대학교(National Chung Hsing University) 곤충학과에서 누대 사육하는 실내집단을 이용하였다. 오리엔탈과실파리의 누대 사육은 Huang and Chi (2014)의 방법을 이용하였다. 사육 조건은 온도 24 ± 1oC, 광주기 16:8 h (L:D), 상대습도 60~80%였다. 유충은 5 g의 벤조산나트륨(sodium benzoate, Sigma-Aldrich, Milan, Italy), 240 g의 설탕(granulated sugar, Taiwan Sugar Corporation, Tainan, Taiwan R.O.C), 140 g의 효모(Vietnam-Taiwan Sugar Company Limited, Thanh Hoa, Vietnam), 20 mL의 염산(Sigma-Aldrich), 480 g의 소맥립(wheat grain) 그리고 1.1 L의 증류수를 혼합하여 만든 인공사료를 먹이로 공급하였다. 성충은 200 g의 효소추출물(Yeast Hydrolysate Enzymatic, MP Biomedicals, LLC, Illkirch-Graffenstaden, France), 40 g의 설탕(granulated sugar), 10 mL의 단백질당화액(protein hydrolyzate, Alco Standard corporation, Pennsylvania, USA) 그리고 50 mL의 증류수를 혼합하여 만든 인공사료를 먹이로 공급하였다. 실험에 사용된 번데기는 용화 후 5 일 이내의 개체들로 구성되었다.
호박꽃과실파리 번데기에 토양 살충제 처리
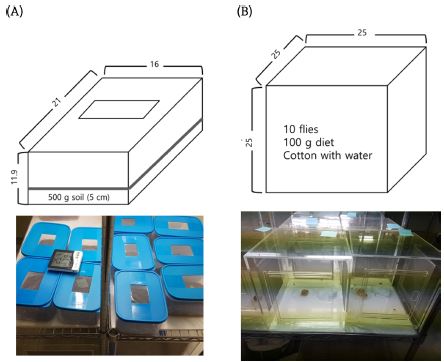
번데기에 대한 약제 생물검정은 토양혼화 처리법을 이용하였다. 실험약제는 dimethyl sulfide (팔라딘®, 유제, 99.65%, 경농)이고 대조약제는 diazinon (다이아톤®, 입제, 3%, 성보화학)을 분석에 이용하였다. 실험용기(21 × 16 × 11.9 cm)에 500 g의 상토를 채웠다. 뚜껑은 8 × 6 cm의 구멍을 내고 망을 씌워 공기유통이 가능하게 하였다. 상토에 소정의 농약을 넣고 실험용기를 닫고 흔들어 약제가 토양에 고루 섞이도록 하였다. 이 처리 토양에 15 마리의 번데기를 깊이 5 cm 이내에 묻었다. 이후 10 ml의 물을 상토 위로 분주하여 습기를 유지하게 하였다. 각 농약 농도 처리는 1~3 반복으로 실시되었다. 온도 24~27oC 그리고 상대습도 60~80%의 실내 조건에서 보관하면서 매일 우화 개체수를 계수하였다. 우화는 번데기 표피층을 벗고 토양 위로 올라오는 개체로 판정하였다.
호박꽃과실파리 성충의 살충제에 대한 영향
성충에 대한 약제 생물검정은 먹이혼화 처리법을 이용하였다. 실험약제는 식물추출물이 함유된 친환경자재(응칠이®, 액제, 80%, 고려바이오)를 사용하였고, 대조약제는 스피노사드(Entrust®, 입상수화제, 80%, 동부하이텍)를 실험에 이용하였다. 우화 후 3~21 일이 지난 개체들을 대상으로 인공사료(이스트: 전지분유: 설탕: 물 = 2:2:4:1, g/g)에 처리 약제를 혼합하였다. 실험용기는 아크릴케이지(25 × 25 × 25 cm)에 각 10 마리를 처리하였다. 또한 물을 뭍인 솜을 성충에게 제공하였다. 각 농약 농도 처리는 1~3 반복으로 실시되었다. 제한된 공시충 상황에서 한편으로 양독반응의 신빙성을 주기 위해 살충력이 0~100%의 범위를 보이면 반복수를 늘리고, 0% 또는 100%의 살충력을 보이는 경우에는 반복수를 줄였다. 살충력이 처리된 실험용기는 상기의 호박꽃과실파리 사육 조건에 두고 매일 사망 개체수를 계수하였다.
통계분석
모든 살충효과에 대한 생물검정 결과는 백분율 자료로서 arsine 변환 후 SAS PROC GLM (SAS Institute, 1989)을 이용하여 ANOVA 분석 및 처리 평균간 비교를 실시하였다.
결 과
호박꽃과실파리 적용 약제 생물검정법
호박꽃과실파리에 대한 효과적 살충제 개발을 위하 생물검정 기술을 개발하고자 유사한 과실파리류의 약제 생물검정 방법을 조사하였다(Table 1). 유충의 경우는 먹이에 혼화처리하거나 또는 유충을 직접 약액에 침지하여 효과적 약제를 선발하는 것으로 나타났다. 반면에 번데기의 경우는 주로 토양에 서식하기 때문에 일반 살포용 화학약제의 경우는 토양관주 처리를 실시하였다. 반면에 훈증제의 경우는 밀폐된 공간을 이용하여 훈증처리를 한 경우도 있다. 성충은 일부 직접 가슴 등면에 국부처리하여 중앙치사농도를 산출하기도 하지만 주로 이들 과실파리류의 섭식 습성을 이용하여 먹이에 약제를 혼화하여 처리하는 생물검정이 대부분을 차지하였다.
호박꽃과실파리의 경우 암컷 성충이 호박꽃 봉오리 내부에 알을 산란하고 유충은 호박꽃 내부에서 서식하고 자라기 때문에 외부의 살충제 처리에 노출되기 어렵다. 따라서 이 과실파리 방제는 번데기 또는 성충에 대해서 방제 효과를 규명하는 것이 효과적 살충제를 스크리닝하는 데 의미가 있다(Fig. 1). 번데기의 경우는 다른 과실파리류의 약제 스크리닝과 같이 토양처리 방식을 채택하여 일정량(500 g)의 토양에 약제를 혼합하고 처리될 공시충을 이 곤충의 땅 속 용화 장소(권기면, 미보고자료)인 5 cm 토양 깊이 이내로 자리하게 하여 생존 번데기가 우화하게 하였다. 약제 처리 후에는 일정량의 수분(10 ml)을 뿌려주어 약제 처리된 토양의 수분이 유지되도록 하였다. 성충의 경우는 호박꽃과실파리의 단백질 섭취 행동을 이용하여 인공사료에 약제를 혼합하여 스크리닝하는 방식을 택했다.
국내 시판 토양 처리제의 호박꽃과실파리 번데기에 대한 방제 효과
토양혼화처리를 통한 생물검정 방식으로 국내 토양 병해충 처리 약제인 dimethyl sulfoxide (팔라딘®)의 살충력을 분석하였다(Table 2). 대조 약제로서 현재 과실파리 토양처리제로 사용되고 있는 다이아지논(diazinon, 다이아톤®) 입제를 분석하였다. 본 연구에서 개발된 생물검정법을 통해 호박꽃과실파리 번데기에 대해서 다이아지논은 분석된 처리농도 구간(0.18~1.8 g 약제/500 g 토양)에서 전형적 양독(dose-mortality)반응을 나타냈다. 동일한 생물검정법으로 dimethyl sulfide 유제에 대해서 분석한 결과 0.3 ml 이상의 농도에서는 100%의 방제 효과를 나타내었고 이 이하의 농도에서는 양독반응을 나타냈다. 완전 방제 효과를 주는 농도를 추정하려는 실험에서 제한된 공시충으로 최저 농도(0.075 mL/500 g) 처리의 경우 1 회 반복(15 마리)만 실시하여 평가하였다.
이상의 생물검정 결과는 국내에서 일반 병해충에 대해서 적용되던 dimethyl sulfide가 과실파리방제에도 유효할 수 있다는 것을 나타냈다. 이 결과를 바탕으로 국내 검역의 금지 과실파리로 주목을 받고 있는 오리엔탈과실파리 번데기에 대해서 방제 효과가 있는 지를 대만 현지에서 분석하였다. 여기에서도 대조 약제로 다이아지논을 적용하였다(Fig. 2). 동일한 생물검정 방법으로 오리엔탈과실파리 번데기에 적용한 결과 호박꽃과실파리에서 100% 방제 효과를 줄 수 있는 다이아지논 농도(3 g 약제/500 g 토양)에서 불과 약 55%의 살충력을 나타냈다. 이러한 낮은 방제 효과 결과는 dimethyl sulfide에서도 나타나 호박꽃과실파리에서 100%의 방제 효과를 줄 수 있는 두 농도(0.3 ml와 0.6 ml 약제/500 g 토양)에서 최대 약 85%의 살충력을 보이는 데 그쳤다.
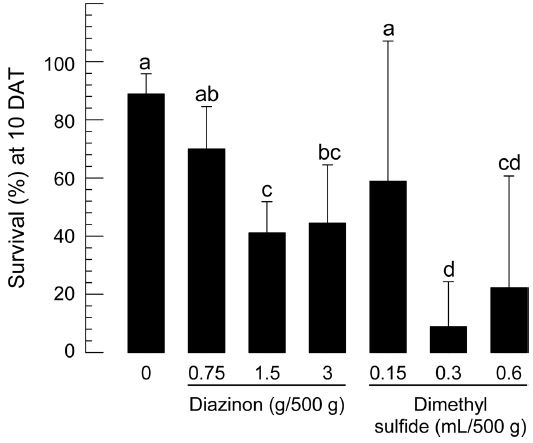
Toxicities of diazinon and dimethyl sulfide against pupae of B. dorsalis. Bioassay used soil drench treatment. Each dose of insecticide was mixed with 500 g soil containing 15 pupae in a test cage and sprayed with 10 mL water. Successful adult emergence of the treated pupae was measured at 10 days after treatment (DAT). Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
국내 시판 친환경 작물보호제의 호박꽃과실파리 성충에 대한 방제 효과
호박꽃과실파리 성충에 대한 약제 생물검정은 인공사료에 살충제를 혼합하여 처리하였다. 친환경 작물보호제로 알려진 식물추출물(응칠이, 고려바이오, 한국)에 대해서 이뤄졌다(Table 3). 대조 약제로 사용한 스피노사드의 경우 처리 1일 후에는 사망하는 개체가 나타나지 않았지만, 이후 기간이 경과하면서 사망하는 개체가 증가하여 6 일차에는 가장 낮은 농도(12.5 ppm) 처리에서도 100% 방제 효율을 나타냈다. 응칠이는 비교적 속효성을 발휘하여 200 ppm 처리에서는 처리 2 일 경과하면 모두 사망하였다. 또한 처리 농도별로 전형적 양독반응을 나타냈다.
고 찰
과실파리류의 방제 표적이 되는 발육시기인 번데기와 성충에 대해서 호박꽃과실파리의 약제 스크리닝 생물검정법이 본 연구로 구축되었다. 기존의 과실파리류의 약제 스크리닝기술을 종합한 결과 번데기의 경우는 토양혼화 또는 관주처리가 유효한 스크리닝 기술로 판단되었다. 그러나 성충의 경우는 이들의 섭식 습성을 이용하여 먹이 가운데 약제를 혼합하여 처리하는 섭식 처리가 유효한 생물검정법으로 선발되었다. 각각의 발육태에 대해서 구축된 생물검정법을 적용한 결과 현재 다른 과실파리에서 적용하여오고 있는 대조약제에서 뚜렷한 양독반응 및 완전방제 효과를 얻었다. 이를 기반으로 국내 약제에 대해서 약효 검증을 실시한 결과 호박꽃과실파리 번데기에 dimethyl sulfide가 유효하다는 것을 확인하였다. 성충의 경우는 친환경 농자재인 응칠이가 200 ppm 이상에서 완전방제 효과를 줄 수 있다는 것을 확인하였다. 일반적으로 주로 적용 범위가 넓은 살충제인 유기인계, 피레스로이드 그리고 아바멕틴이 과실파리류의 효과적 방제를 보여 주었다. 과실파리에 대한 약제 분석이 가장 많이 이뤄진 종은 경제적으로 피해가 가장 심각한 오리엔탈 과실파리에서 비롯된다. Lin et al. (2010)은 14 종의 살충제를 오리엔탈과실파리 성충에 대한 비교 독성을 분석한 결과 다음과 같은 독성 순서를 발표하였다: proclaim < alpharmethrin < cyhalothrin < phoxim < cypermethrin < trichlorphon < methomyl < avermectin. 귤과실파리(B. minax)를 대상으로 본 연구의 응칠이와 유사한 식물추출물이 기존의 과실파리 적용 화학 살충제와 비교되었는데 이 식물추출물 보다는 아바멕틴(avermectin)이 우수한 방제효과를 주었다(Liu et al., 2015). 따라서 호박꽃과실파리 번데기를 방제하는 경우보다 다양한 약제 선발이 필요할 것으로 사료된다.
본 연구에서 개발된 생물검정법으로 국내 금지급 과실파리로 분류된 오리엔탈과실파리 번데기에 대해서 유사한 약효 검증이 이뤄졌다. 흥미롭게도 호박꽃과실파리에서 100% 방제효과를 주는 농도에서 오리엔탈과실파리는 비교적 낮은 방제 효과를 나타냈다. 이러한 약제감수성 차이는 오리엔탈과실파리가 대부분의 약제에 대한 저항성 획득으로 여겨진다. 화학 농약의 살포가 빈번하게 이뤄지고 있는 오리엔탈과실파리의 경우 약제 저항성이 알려져 있는 데 Pan et al. (2005)은 아바멕틴 살충제의 경우 지역 마다 저항성 정도가 상이하여 중국의 Fujian 지역 집단의 반수치사약량이 3.14 mg/L인 반면, Chenghai 지역 집단은 9.26 mg/L 그리고 Minnah 지역 집단은 8.25 mg/L로서 거의 3 배 가량 약제 감수성 차이를 나타냈다. 따라서 본 연구에서 본 약제 감수성 차이는 오리엔탈과실파리가 호박꽃과실파리에 비해 살충제 살포에 보다 많이 노출되어 선발되어 비교적 높은 저항성을 발현한 것으로 사료된다. 두 과실파리에서 이러한 차등적 방제효과는 본 연구에서 구축된 생물검정법의 실효성을 뒷받침하여 주었다.
성충의 경우는 국내 시판되는 dimethyl sulfide도 적용될 수 있는 약제로 평가된 가운데, 대조약제로 분석된 스피노사드의 우수한 방제효과를 확인할 수 있었다. 스피노사드는 토양에 서식하는 actinomycete 세균(Saccharopolyspora spinosa Mertz & Yao)에서 유래된 살충 성분인 spinosyn A와 spinosyn D가 17:3의 비율로 혼합되어 구성된다(Ruiu, 2015). 이 성분은 곤충의 아세틸콜린 중추신경계를 교란하는 신경독으로 특히 주요 과실파리류에 대해서 높은 섭식독성을 나타내지만, 포유류에 독성이 낮고 천적류에 대한 환경영향이 적다(Stark et al., 2004). 그러나 흥미롭게도 본 연구에서 약효가 검증된 응칠이의 경우는 높은 농도의 스피노사드에 비해서도 비교적 속효성으로 나타났다. 현재 개발되고 있는 과실파리 모니터링 트랩의 경우 시노몬 형태의 유인물질을 주고 이를 섭식하면서 주변 끈끈이에 부착하여 포획하게 되는 데 여기에 기절효과를 줄 수 있는 약제가 포함된다면 유인되어 섭식한 개체가 다시 트랩에서 빠져나가는 확률을 줄여 트랩 효율을 올릴 수 있다. 따라서 이러한 목적으로 모니터링 트랩을 개발하는 경우 스피노사드에 비해 응칠이가 우수할 것으로 사료된다.
Acknowledgments
본 연구는 iPET의 수출전략기술개발사업의 일환으로 수행되었습니다. 아울러 대만 현지의 연구를 위해 농촌진흥청 국제공동연구(PJ012075)의 일환으로 지원받았습니다.
References
- Al Baki, A., E. Keum, H. Kim, Y. Song, Y. Kim, G. Kwon, and Y. Park, (2017), Age grading and gene flow of overwintered Bactrocera scutellata populations, J. Asia Pac. Entomol., 20(4), p1402-1409.
- Drew, R. A. I., and B. Yuval, (2000), The evolution of fruit fly feeding behavior, In Fruit Flies (Tephritidae): Phylogeny and Evolution of Behaviour, Aluja, M., and A. L. Norrbom Eds, CRC Press, Boca Raton, Florida, p731-750.
- Flores-Estévez, N., S. G. Vasquez-Morales, T. Cano-Medina, L. R. Sánchez-Velásquez, J. C. Noa-Carrazana, and F. Díaz-Fleischer, (2013), Insecticidal activity of raw ethanolic extracts from Magnolia dealbata Zucc on a tephritid pest, J. Environ. Sci. Health B, 48(7), p582-586.
- Han, H. Y., and Y. J. Kwon, (2010), A list of North Korean tephritoid species (Diptera: Tephritoidea) deposited in the Hungarian natural history museum, Korean J. Syst. Zool., 26(3), p251-260.
- Han, H. Y., S. W. Suk, Y. B. Lee, and H. S. Lee, (2014), National list of species of Korea「Insect」(Diptera II), National Institute of Biological Resources, Incheon, p1-268.
- Huang, Y-B, and H. Chi, (2014), Fitness of Bactrocera dorsalis (Hendel) on seven host plants and an artificial diet, Turk. Entomol. Derg., 38(4), p401-414.
- Jung, M. P., H. H. Park, S. G. Lee, and K. H. Kim, (2013), Prediction of adult emergence time and generation number of overwintered small brown planthopper, Laodelphax striatellus according to RCP8.5 climate change scenario, Korean J. Appl. Entomol., 52(4), p427-430.
- Kim, Y., and D. Kim, (2016), Integrated pest management against Bactrocera fruit flies, Korean J. Appl. Entomol., 55(4), p359-376.
- Kim, Y. P., S. W. Jeon, S. G. Lee, K. H. Kim, N. J. Choi, and C. Y. Hwang, (2010), Seasonal occurrence and damage of Bactrocera scutellata (Diptera: Tephritidae) in Jeonbuk province, Korean J. Appl. Entomol., 49(4), p299-304.
- Kim, D. S., Y. S. Jang, K. S. Choi, T. J. Kang, and H. Y. Jeon, (2012), Olfactory responses of Bactrocera depressa (Diptera: Tephritidae) in the field and laboratory, J. Subtrop. Agri. Biotechnol., 28, p33-44.
- Kim, Y., D. Kim, K. Park, and H. Han, (2017a), Manual for security system against high risk fruit flies, HongReung Science, Seoul, Korea.
- Kim, K., M. Kim, G. Kwon, and Y. Kim, (2017b), Technologies required for development of trap-based MAT control against the striped fruit fly, Bactrocera scutellata, Korean J. Appl. Entomol., 56(1), p51-60.
- Lin, Y. Y., L. Zeng, T. Jin, and Y. Y. Lu, (2010), Susceptible toxicity baseline data of the different types of insecticides for susceptible strains of oriental fruit fly, J. Environ. Entomol., 32(2), p215-219.
- Liu, H., G. Jiang, Y. Zhang, F. Chen, X. Li, J. Yue, C. Ran, and Z. Zhao, (2015), Effect of six insecticides on three populations of Bactrocera (Tetradacus) minax (Diptera: Tephritidae), Curr Pharm Biotechnol., 16(1), p77-83.
- Lyu, D. P., and H. S. Lee, (2017), The red imported fire ant, Solenopsis invicta Buren (Hymenoptera: Formicidae: Myrmicinae) discovered in Busan sea port, Korea, Korean J. Appl. Entomol., 56(4), p437-438.
- Norrbom, A. L., L. E. Carroll, F. C. Thompson, I. M. White, and A. Freidberg, (1999), Systematic database of names, In Fruit Fly Expert System and Systematic Information Database, Thompson, F. C. Ed, Diptera Data Dissemination Disk 1 & Myia, p65-251.
- Ortiz-Urquiza, A., I. Garrido-Jurado, C. Santiago-Alvarez, and E. Quesada-Moraga, (2009), Purification and characterisation of proteins secreted by the entomopathogenic fungus Metarhizium anisopliae with insecticidal activity against adults of the Mediterranean fruit fly, Ceratitis capitata (Diptera: Tephritidae), Pest Manag. Sci., 65(10), p1130-1139.
- Pan, Z. P., L. Zeng, and Y. Y. Lu, (2005), Monitoring of resistance of oriental fruit fly adults to insecticides in South China, J. South China Agr. Univ., 26(4), p23-26.
- Rivis, H. C., N. W. Miller, and R. I. Vargas, (2004), Effects of aging and dilution on attraction and toxicity of GF-120 fruit fly bait spray for melon fly control in Hawaii, J. Econ. Entomol., 97(5), p1659-1665.
- Ruiu, L., (2015), Insect pathogenic bacteria in integrated pest management, Insects, 6(2), p352-367.
- SAS Institute, Inc., (1989), SAS/STAT User’s Guide, release 6.03 Ed., SAS Institute, Cary, NC.
- Shishir, M. A., A. Akter, M. Bodiuzzaman, M. A. Hossain, M. M. Alam, S. A. Khan, S. N. Khan, and M. M. Hoq, (2015), Novel toxicity of Bacillus thuringiensis strains against the melon fruit fly, Bactrocera cucurbitae (Diptera: Tephritidae), Biocontrol Sci., 20(2), p115-123.
- Stark, J. D., R. Vargas, and N. Miller, (2004), Toxicity of spinosad in protein bait to three economically important tephritid fruit fly species (Diptera: Tephritidae) and their parasitoids (Hymenoptera: Braconidae), J. Econ. Entomol., 97(3), p911-915.
- White, I. M., and M. M. Elson-Harris, (1992), Fruit flies of economic significance: their identification and bionomics, CABI International, Wallingford, UK.
- Yee, W. L., L. A. Lacey, and B. J. Bishop, (2009), Pupal mortality and adult emergence of western cherry fruit fly (Diptera: Tephritidae) exposed to the fungus Muscodor albus (Xylariales: Xylariaceae), J. Econ. Entomol., 102(6), p2041-2047.
- Zhang, R., E. B. Jang, S. He, and J. Chen, (2015), Lethal and sublethal effects of cyantraniliprole on Bactrocera dorsalis (Hendel) (Diptera: Tephritidae), Pest Manag. Sci., 71(2), p250-256.