시설재배 키위 중 carbendazim과 diethofencarb 혼합제의 잔류특성
초록
본 연구는 시설재배 키위를 대상으로 carbendazim과 diethofencarb 혼합살균제의 잔류특성을 분석하고, 그에 따른 안전사용기준 설정의 기초자료를 확보하고자 수행하였다. Carbendazim과 diethofencarb의 잔류량은 시험약제(carbendazim·diethofencarb 수화제, 25%+25%) 1000배 희석액을 시설재배지 키위에 수확일을 기준으로 14일과 21일전에 7~10일 간격으로 2~3회에 거쳐 살포한 후 수확한 키위를 대상으로 두 성분을 각각 분석하여 산출하였으며, 각 성분의 잔류량 분석에는 HPLC-FLD와 HPLC-UVD를 이용하였다. 그 결과, carbendazim과 diethofencarb의 정량한계는 각각 0.04와 0.025 mg/kg 이었고, 회수율은 각각 110.3~114.7%와 91.8~94.6%, 저장안정성은 각각 102.2%와 100.9% 이었으며, 회수율 및 저장안정성의 변이계수는 모두 10% 미만이었다. 시험구 키위에서 carbendazim의 잔류량은 0.11~0.26 mg/kg 범위였으며, diethofencarb의 잔류량은 0.67~1.15 mg/kg 범위였다. 이는 현재 고시되어 있는 carbendazim과 diethofencarb의 국내 잔류허용기준(3.0 mg/kg) 보다 낮은 수준이었다. 이러한 결과는 키위에 대한 carbendazim과 diethofencarb 혼합살균제의 안전사용기준을 설정하는데 중요한 기초자료가 될 것으로 사료된다.
Abstract
This study was carried out to investigate residual characteristics of fungicides mixture of carbendazim and diethofencarb in kiwifruit under greenhouse condition and consequentially to obtain basic data for guideline on safe use of this fungicides mixture in kiwi. The tested fungicides mixture (carbendazim·diethofencarb wettable powder, 25%+25%) were diluted at 1,000 times and sprayed 2~3 times onto the kiwi with 7~10 days interval, and then fruits were collected at 14 and 21 days after final application. The residues of carbendazim and diethofencarb in kiwifruit were analyzed by HPLC-FLD and HPLC-UVD, respectively. Limits of quantitation of carbendazim and diethofencarb were 0.04 and 0.025 mg/kg, respectively. The recoveries of carbendazim and diethofencarb were ranged to 110.3~114.7% and 91.8~94.6%, respectively, with below 10% of coefficient of variation. The storage stabilities of carbendazim and diethofencarb were 102.2% and 100.9%, respectively, with below 10% of coefficient of variation. The residues of carbendazim and diethofencarb in all treatment samples were ranged to 0.11~0.26 and 0.67~1.15 mg/kg, respectively. These levels were lower than maximum residue limit (3.0 mg/kg) in kiwifruit. These results might be basic information to construct guideline for safe use of fungicides mixture of carbendazim and diethofencarb in kiwi.
Keywords:
Carbendazim, diethofencarb, fungicides mixture, kiwifruit, pesticide residues키워드:
카벤다짐, 디에토펜카브, 혼합살균제, 키위, 농약잔류서론
국내에서의 키위(참다래) 재배는 1990년대부터 본격화 되었고, 1999년 이후 시설재배가 성행하면서 생산량도 급증하였다. 2012년 기준 국내 키위 재배면적은 약 1,200 ha이며, 기후 온난화와 소비자 기호 상승으로 인하여 제주에서 경남, 전남지역으로 재배가 확산되고 있는 실정이다(NIHHS, 2017; RDA, 2012).
국내 키위 재배지에서 발생하는 주요 병해충으로는 궤양병, 꽃썩음병, 연부병, 점무늬병, 잿빛곰팡이병, 깍지벌레, 잎말이나방, 열매꼭지나방, 박쥐나방, 풍뎅이류 등이 있다(Paik et al., 1993a; Paik et al., 1993b; Koh et al., 2003a; Koh et al., 2003b). 이 중 잿빛곰팡이병은 진균의 일종인 Botrytis cinerea에 의해서 발병하며, 주로 잎, 꽃, 어린 열매, 저장 중 과실 등에 발생한다(Michailides and Elmer, 2000; Williamson et al., 2007). 잿빛곰팡이 병원균이 잎에 감염되어 발병되면 처음 수침상의 작은 반점이 형성되고 점차 진전되면서 갈색의 대형 병반으로 확대된다. 주로 잎 끝부분에서부터 발병되는 일이 많으며, 습하면 병반상에 잿빛의 분생포자가 밀생한다. 개화기에 다습하면 꽃잎을 통해서도 감염되는데, 감염된 병원균은 증식한 후 어린 과실에 침입하여 꽃잎과 열매를 진한 갈색으로 부패시킨다. 저장 중 과실에 발병하면 처음에는 과육이 변색되고, 심하면 과실전체가 부패한다. 특히, 과실에 피해가 많아 재배 농가에서 문제가 심각한 실정인데, 현재 국내에 등록되어 사용되고 있는 키위 잿빛곰팡이병 방제 약제는 보스칼리드 입상수화제, 이프로디온 수화제 등이 있다(KCPA, 2018).
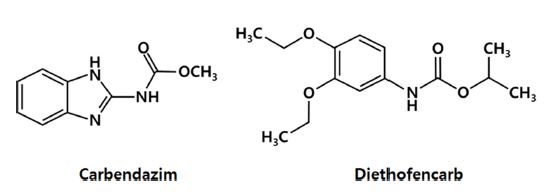
Carbendazim과 diethofencarb 혼합제는 카바메이트계 화합물의 혼합살균제로 잿빛곰팡이병 전문약제이다(Fig. 1). 침투이행성 및 잔효성이 있으며, 균사의 침입저해, 진전억제 등의 효과가 있고, 과채류에 발생하는 잿빛곰팡이 병원균뿐만 아니라 벤지미다졸계 약제의 내성균에도 작용하여 예방 및 치료효과를 나타낸다(KCPA, 2018). 국내에서는 처음으로 인삼 잿빛곰팡이병 방제약제로 등록되어 사용되고 있다(KCPA, 2018). 하지만 현재까지 이 약제가 키위 잿빛곰팡이병 방제약제로 등록·고시 되지는 않았으며, 키위에서의 잔류특성에 대한 보고도 전혀 없는 실정이다.
따라서 본 연구에서는 시설재배지의 키위를 대상으로 carbendazim·diethofencarb 수화제(25%+25%)를 살포하여 경과일수별 키위 과실의 잔류수준을 조사함으로써 carbendazim과 diethofencarb의 키위에 대한 잔류특성을 구명하고, 그에 따른 안전사용기준 설정의 기초자료를 확보하고자 하였다.
재료 및 방법
시험약제
시험에 사용된 약제는 carbendazim·diethofencarb 수화제(깨끄탄, 25%+25%)이며, 물에 1,000배 희석하여 사용하였다.
시험포장
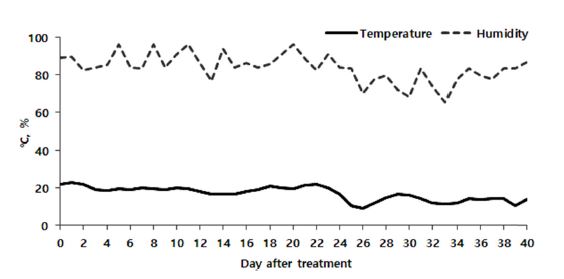
약제살포 시험구는 제주특별자치도 서귀포시 성산읍 신산리에 위치한 시설재배 농가의 비닐하우스 내에 배치하였다. 시험구 당 면적은 약 15 m2로 하였으며, 각 시험구는 3반복으로 배치하였다. 약제살포 시험은 2010년 10월 1일부터 11월 10일까지 약 40일간 수행하였다. 시험작물인 키위(골드키위)의 관리는 관행적 방법에 준하여 수행하였다. 시험기간 중 시설재배지의 온도 및 습도는 WSN-803(㈜우성하이텍)을 이용하여 시험포장 내 4개 지점에서 50분 간격으로 측정하였으며, 이를 평균하여 일평균 온도와 습도로 산출하였다. 일평균 온도와 습도는 Fig. 2에 나타내었는데, 시험기간 중 시설재배지의 평균기온은 17.0℃, 평균습도는 83.7%였다.
약제살포 및 시료채취
시험약제 1,000배 희석액을 주행식동력분무기(TU-26, ㈜동양테크툴)를 이용하여 시험구(15 m2) 당 약 4 L 살포하였다. 약제살포는 키위 수확일을 2010년 11월 10일로 설정한 후 이를 기준으로 수확 14일전과 21일전에 7~10일 간격으로 2~3회 수행하였다(Table 4). 수확일에 채취한 키위의 한 개당 평균 무게는 107.8 ± 17.7 g (n=20)이었으며, 처리구 당 약 5.0 kg씩 채취하였다. 채취한 과실은 꼭지를 제거하고 4분법으로 절단한 후 대칭이 되는 부위를 선택하여 PE bag에 넣은 후 −60℃에 보관하면서 잔류분석에 이용하였다.
기기분석 조건
키위 과실의 carbendazim과 diethofencarb 잔류량은 각각 HPLC-FLD와 HPLC-UVD를 이용하여 분석하였으며, 각 성분의 분석조건은 Table 1에 나타낸 것과 같다.
표준검량선 작성
Carbendazim과 diethofencarb 각각에 대한 표준용액을 제조한 후 기기분석 하여 표준검량선을 작성하였다. Carbendazim의 경우는 표준품(96%) 20.8 mg을 methanol 100 mL에 녹여 200 mg/L의 용액을 제조한 후 methanol로 2배 희석하여 100mg/L의 표준용액을 만들었다. 이 용액을 methanol로 순차적으로 희석하여 0.2, 0.5, 1.0, 2.0, 5.0, 10.0 mg/L의 용액을 조제하였으며, 각 용액 10 μL를 HPLC-FLD에 주입하여 나타난 크로마토그램상의 피크 면적을 기준으로 표준검량선을 작성하였다. Diethofencarb의 경우는 표준품(97%) 51.5 mg을 acetone 100 mL에 녹여 500 mg/L의 용액을 제조한 후 일정량을 취하여 acetonitrile로 5배 희석하여 100 mg/L의 표준용액을 만들었다. 이 용액을 acetonitrile로 순차적으로 희석하여 0.1, 0.2, 0.5, 1.0, 2.0, 5.0, 10.0 mg/L의 용액을 조제하였으며, 각 용액 10 μL를 HPLC-UVD에 주입하여 나타난 크로마토그램상의 피크 면적을 기준으로 표준검량선을 작성하였다.
잔류농약 분석
Carbendazim 잔류량 분석을 위하여 세절한 키위 50 g을 homogenizer에 넣고 acetonitrile 100 mL와 NaCl 20 g을 첨가하여 5,000 rpm에서 3분간 균질화하였다. 균질화 한 시료를 200 rpm에서 30분간 진탕추출 한 후 원심분리(3,000 rpm, 3분)하였다. 상등액 20 mL을 취하여 40℃ 수욕상에서 감압농축 한 후 농축잔사를 5 mL dichloromethane으로 재용해하여 Sep-Pak silica cartridge (1 g, 6 cc)로 정제하였다. Sep-Pak silica cartridge는 5 mL dichloromethane으로 세척하여 안정화 한 후 재 용해액 5 mL를 cartridge 상부에 가하여 흘려버렸다. 계속하여 5 mL dichloromethane을 가하여 세척한 후 10 mL dichloromethane : acetone (7 : 3, v/v) 용액으로 용출하였다. 용출액은 40℃ 수욕상에서 감압농축 하였으며, 2 mL의 methanol로 재 용해하여 HPLC 분석에 사용하였다.
Diethofencarb 잔류량 분석을 위하여 세절한 키위 20 g을 homogenizer에 넣고 acetone 100 mL을 가하여 5,000 rpm에서 3분간 균질화하였다. 추출물은 Celite 545를 통과시켜 흡인여과하고 용기 및 잔사는 같은 용매 50 mL로 세척하여 앞의 여과액과 합하였다. 여과액은 40℃ 수욕상에서 감압농축 한 후 분액여두에 옮기고 포화 NaCl 30 mL, 증류수 100 mL, hexane 70 mL을 가하여 분배하였다. 층이 분리되면 hexane 층을 sodium sulfate 층을 통과시켜 탈수하였으며, 같은 방법으로 분배추출을 1회 더 반복하였다. 추출액은 40℃ 수욕상에서 감압농축 하였으며, 5 mL의 acetonitrile로 재 용해하여 HPLC 분석에 사용하였다.
회수율 및 저장안정성 시험
Carbendazim 회수율 시험 시료는 세절한 무처리 키위 50 g에 carbendazim 10 mg/L 용액을 각각 2.5와 5.0 mL 처리하여 잔류농도가 0.5 및 1.0 mg/kg이 되도록 3반복으로 처리하여 균일하게 혼화하였고, diethofencarb 회수율 시험 시료는 세절한 무처리 키위 20 g에 diethofencarb 100 mg/L 용액을 각각 0.1과 0.2 mL 처리하여 잔류농도가 0.5 및 1.0 mg/kg이 되도록 3반복으로 처리하여 균일하게 혼화하였으며, 상기의 시료분석 방법과 동일한 방법으로 분석하여 회수율을 구하였다. 저장안정성 시험 시료는 채취한 무처리 시료를 세절한 후 carbendazim (100 mg/L)과 diethofencarb (100 mg/L) 용액 각각을 2.0 mg/kg이 되도록 3반복으로 처리하여 제조하였으며, 다른 분석시료와 함께 −60℃에 냉동보관 하였다가 분석 시 상기의 시료분석 방법과 동일한 방법으로 분석하여 시험물질의 저장안정성을 평가하였다.
결과 및 고찰
표준검량선
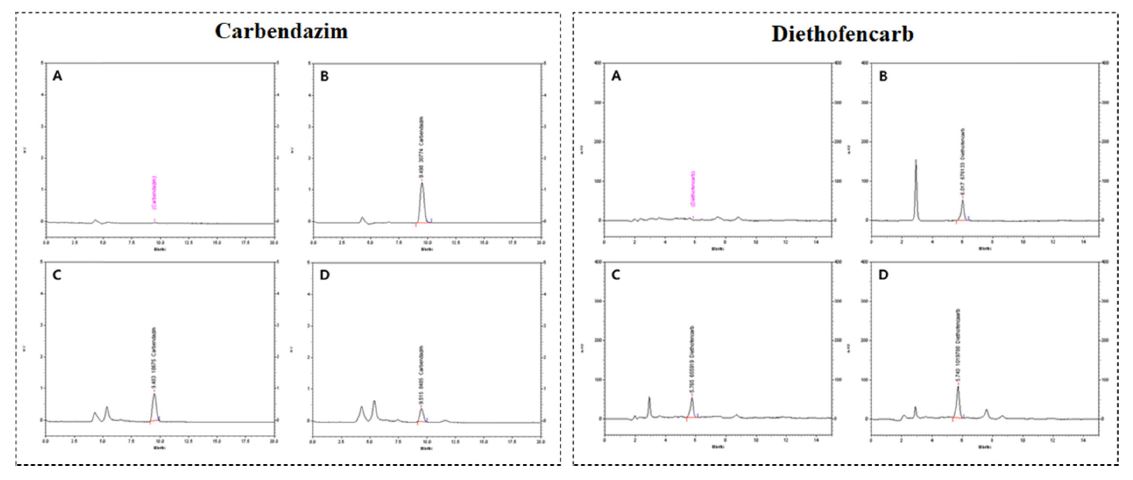
키위의 carbendazim과 diethofencarb의 잔류량 산출을 위하여 각기 다른 농도의 표준용액을 HPLC-FLD와 HPLC-UVD로 각각 분석하여 본 결과, carbendazim의 머무름 시간은 9.428~9.515 min, diethofencarb의 머무름 시간은 5.562~6.020 min이었다. 표준용액을 분석한 대표적인 크로마토그램은 Fig. 3에 나타내었는데, 크로마토그램상의 피크 면적을 기준으로 표준검량선을 작성하여 본 결과, carbendazim과 diethofencarb의 검량선 회귀방정식은 각각 y = 690.71x − 1104(R2 = 0.9968)와 y = 34536x − 12459(R2= 0.9999)로 나타나 직선성은 모두 매우 양호한 것으로 확인되었다.
정량한계
HPLC-FLD와 HPLC-UVD를 이용하여 carbendazim과 diethofencarb 표준품 각각을 분석하여 본 결과, 각 성분의 최소검출량(limit of detection, LOD)은 2와 1 ng (S/N = 10)이었으며, 이를 기준으로 시료량 및 분석조작 중의 희석배수 등을 감안하여 정량한계를 산출하여 본 결과, 본 분석법의 정량한계(limit of quantitation, LOQ)는 각각 0.04와 0.025 mg/kg으로 확인되었다(Table 2). 이는 국내 잔류농약분석법의 일반적인 기준인 0.05 mg/kg 미만 또는 잔류허용기준의 1/2 이하에 적합한 결과였다(Lee, 2012).
회수율 및 저장안정성
잔류분석 방법의 적합성을 검증하기 위하여 두 수준 농도(0.5 및 1.0 mg/kg)의 carbendazim과 diethofencarb에 대한 분석법의 회수율을 평가한 결과, 회수율은 각각 110.3~114.7%와 91.8~94.6% 였으며, 변이계수는 각각 0.3~1.8%와 3.5~7.5%로 확인되었다(Table 2). 분석시료를 저장하는 동안 carbendazim과 diethofencarb의 안정성을 확인하기 위하여 각 성분을 2.0 mg/kg이 되도록 처리한 후 저장안정성 시험을 수행한 결과, 회수율은 각각 102.2%와 100.9% 였으며, 변이계수는 각각 7.9%와 4.4%로 확인되었다(Table 3). 이 결과들은 모두 농촌진흥청에서 권고하는 단성분 분석 회수율 범위인 70~120%, 변이계수 10% 이내의 기준에 부합하는 것으로 상기 분석 방법이 키위 중 carbendazim과 diethofencarb의 잔류량을 구명하기에 적합한 것으로 확인되었다(RDA, 1997).
키위 중 잔류농약
Carbendazim과 diethofencarb 혼합제를 키위 수확일을 기준으로 수확 14일전과 21일전에 7~10일 간격으로 2~3회 살포한 후 수확한 과실의 잔류량을 분석하여 본 결과, carbendazim의 잔류량은 수확 14일전 2회 살포시 0.26 mg/kg, 3회 살포시 0.23 mg/kg, 수확 21일전 2회 살포시 0.10 mg/kg, 3회 살포시 0.19 mg/kg으로 확인되었고, diethofencarb의 잔류량은 수확 14일전 2회 살포시 0.76 mg/kg, 3회 살포시 1.15 mg/kg, 수확 21일전 2회 살포시 0.67 mg/kg, 3회 살포시 0.97 mg/kg으로 확인되었다(Table 4). Carbendazim과 diethofencarb의 잔류량을 분석한 대표적인 크로마토그램은 Fig. 3에 나타내었다. Carbendazim의 경우 수확 14일전 2회 살포가 3회 살포 보다 잔류량이 다소 높은 것으로 확인되었는데, 이는 기상상태, 작물의 상태, 재배환경 등이 잔류량에 영향을 미쳐 나타난 결과로 사료되었다. 하지만 그 외 시험 처리구에서는 두 시험약제 모두 처리 횟수가 많고 최종 약제 살포일이 수확 예정일에 가까울수록 잔류량이 높은 경향을 보여, 키위에서 두 약제 모두 처리 횟수와 최종 처리 후 경과 일수가 잔류량 변화의 중요한 요소임을 알 수 있었다.
동일한 처리조건에서 carbendazim과 diethofencarb의 잔류량을 비교해 보면, carbendazim의 잔류량이 diethofencarb보다 낮게 나타나는 것을 확인할 수 있었다. 이는 Qin et al.(2016)이 목화에서 carbendazim과 diethofencarb의 반감기를 확인하였을 때, carbendazim의 반감기(약 2.3일)가 diethofencarb의 반감기(약 9.0일) 보다 짧게 나타난 것과 일치하는 결과였다. 따라서 키위에서도 carbendazim의 반감기가 diethofencarb 보다 짧아 동일한 처리조건에서 carbendazim의 잔류량이 diethofencarb 보다 낮게 나타나는 것으로 사료되었다.
키위 중 carbendazim의 국내 잔류허용기준(maximum residue limit, MRL)은 2012년 0.5 mg/kg에서 3.0 mg/kg으로 변경 고시되었으며, diethofencarb의 국내 잔류허용기준은 2016년 3.0 mg/kg으로 행정예고 되어 2017년 고시되었다. 따라서 현재 두 성분의 국내 잔류허용기준은 모두 3.0 mg/kg이다(MFDS, 2017). 본 연구에서 carbendazim과 diethofencarb 혼합제를 키위 수확일을 기준으로 수확 14일전과 21일전에 7~10일 간격으로 2~3회 살포한 후 확인한 잔류량은 모두 현재 고시되어 있는 잔류허용기준 보다 낮은 수준이었다. 이러한 결과를 기반으로 본다면 carbendazim과 diethofencarb 혼합제를 키위 수확 14일전에 7~10일 간격으로 3회 이하 살포하는 것은 농약잔류허용기준에 전혀 문제가 되지 않을 것으로 판단되었다.
결론
Carbendazim과 diethofencarb 혼합살균제는 잿빛곰팡이병 전문약제인데, 아직까지 시설재배 키위를 대상으로 두 성분의 잔류특성을 분석하여 보고한 바는 없는 실정이다. 따라서 본 연구에서는 carbendazim과 diethofencarb 혼합제를 시설재배지 키위에 수확일을 기준으로 14일과 21일전에 7~10일 간격으로 2~3회에 거쳐 살포한 후 각 성분에 대한 잔류량을 분석하였다. 그 결과, 모든 시험구에서 두 성분의 잔류량은 현재 고시되어 있는 국내 잔류허용기준 보다 낮은 수준인 것을 확인할 수 있었다. 이러한 결과를 기반으로 볼 때, carbendazim과 diethofencarb 혼합제를 키위 수확 14일 전에 7~10일 간격으로 3회 이하 살포하는 것은 농약잔류허용기준에 전혀 문제가 되지 않을 것으로 판단되었다.
Acknowledgments
이 논문은 2016년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(2016R1A6A1A03012862)의 지원에 의하여 이루어진 것이며, 이에 감사드립니다.
Literature Cited
-
Koh, Y. J., J. G. Lee, D. H. Lee, and J. S. Hur, (2003a), Botryspheria dothidea, the causal organism of ripe rot of kiwifruit (Actinidia deliciosa) in Korea, Plant Pathol. J., 19(5), p227-230.
[https://doi.org/10.5423/ppj.2003.19.5.227]

-
Koh, Y. J., J. G. Lee, J. S. Hur, and J. S. Jung, (2003b), Incidences and causal agents of postharvest fruit rots in kiwifruits in Korea, Res. Plant Dis., 9(4), p196-200.
[https://doi.org/10.5423/rpd.2003.9.4.196]

- KCPA, (2018), Korea Crop Protection Association, http://koreacpa.org/index3/guide/sub03.php.
- Lee, Y. D., (2012), Practical book of pesticide residue analysis method of food code, 3rd ed, National Institution of Food and Drug Safety Evaluation, Korea.
-
Michailides, T., and P. Elmer, (2000), Botrytis gray mold of kiwifruit caused by Botrytis cinerea in the United States and New Zealand, Plant Disease, 84(3), p208-223.
[https://doi.org/10.1094/pdis.2000.84.3.208]

- MFDS, (2017), Pesticide MRLs in Food, Ministry of Food and Drug Safety, p359.
- NIHHS, (2017), Status of Domestic Kiwi Industry, National Institute of Horticultural & Herbal Science, http://www.nihhs.go.kr/usr/main/mainPage.do.
- Paik, J. C., B. J. Cha, and Y. J. Koh, (1993a), Ecological investigation of occurrence of major diseases and insects in kiwifruit: current state of culture and occurence of diseases and insects in kiwifruit, Sunchon Natl. Univ. Bull., 12(1), p75-82.
- Paik, J. C., B. J. Cha, and Y. J. Koh, (1993b), Ecological investigation of occurrence of major diseases and insects in kiwifruit: symptoms, pathogens and ecology of major diseases in kiwifruit, Sunchon Natl. Univ. Bull., 12(1), p83-93.
-
Qin, X., X. Yingming, S. Yang, Z. Lijie, W. Lin, S. Yuebing, and L. Xuefeng, (2016), Determination of Carbendazim and Diethofencarb in Cotton and Soil by High-Performance Liquid Chromatography, Analytical Letters, 49(10), p1631-1639.
[https://doi.org/10.1080/00032719.2015.1116006]

- Rural Development Administration (RDA), Notification No. 1997-3, (1997), Guideline of test for pesticide registration.
- Rural Development Administration (RDA), Publication registration. No. 11-1390804-000249-01, (2012), Countermeasures in competitiveness improvement by agricultural item in response to FTA.
-
Williamson, B., B. Tudzynski, P. Tudzynski, and J. A. L. Van Kan, (2007), Botrytis cinerea: the cause of grey mould disease, Mol. Plant Pathol., 8(5), p561-580.
[https://doi.org/10.1111/j.1364-3703.2007.00417.x]