Bacillus velezensis MWS28을 이용한 포도 흰얼룩병의 생물적 방제 Biological Control of White Stain Symptom on Grape Fruit by Bacillus velezensis MWS28
초록
포도 흰얼룩병은 주로 수확기 때 포도송이 표면에 발생하는 병으로 포도품질의 저하의 원인이 되나 수확기에 임박하여 발생하므로 화학약제의 사용이 어렵다. 따라서 본 연구는 선발된 MWS28를 이용하여 포도 흰얼룩병을 생물학적으로 방제하고자 하였다. MWS28 균주는 포도 흰얼룩병균인 A. acutatum과 T, roseum에 강력한 항균력을 보이며 16s rRNA 염기서열 분석 결과 Bacillus velezensis MWS28로 동정되었다. 어린 잎을 이용한 이들 두 원인균에 대한 MWS28 균주의 생물검정 결과는 포도송이를 이용한 포도 흰얼룩병 실험 결과와도 일치하여 간이검정법으로 활용 가능하였다. MWS28 균주와 0.02% PEMS 및 0.3% sodium alginate 복합처리는 MWS28 단독 처리보다 흰얼룩병 방제효과가 크게 증진되었다. 흰얼룩병 자연발생 포장에서의 MWS28 균주 복합처리제의 처리 효과는 방제가 72%였으며 이와 같은 결과는 생물학적 방제제로서는 매우 우수한 방제효율이었다. 따라서, 본 연구에서 수행한 길항균 MWS28을 이용한 포도 흰얼룩병의 생물학적 방제는 친환경 농업에서 성공적으로 쓰여질 수 있음을 의미한다.
Abstract
The white stain symptom on grape vine (Vitis vinifera L.) was recorded as one of new disease in Korea. Two fungal pathogens of Tricothecium roseum and Acremonium acutatum are casual organisms for the disease development of white stain symptom. In this study, Bacillus strain MWS28 was selected as one among the biocontrol agents based on antibiosis screening against A. acutatum and T. roseum. The selected strain was identified as B. velezensis MWS28 by 16s RNA sequencing data analysis. The strain MWS28 inhibits the mycelial growth and spore germination against two pathogens strongly. The leaf disc assay displayed, control values as 73.1%, 80.3% against A. acutatum and T. roseum, respectively when treated with MWS28 suspensions. When grape fruits were treated synergistically combination of MWS28 suspension with 0.3% sodium alginate solution, there was a greater suppressive effect than treatment with MWS28 cell suspension alone in field condition. Thus, this study indicated that the biocontrol of white stain symptoms is possible by treatment with MWS28 suspensions under field conditions for eco-friendly farming.
Keywords:
Alginate, B. velezensis MWS28, Biological control, Grape, White stain symptoms키워드:
바실러스 벨라젠시스MWS28, 생물적방제, 포도, 알긴산염, 포도 흰얼룩병서 론
포도(Vitis vinifera L.)는 강수량이 적고 온난한 기후에서 재배하는 과수로 여름철 습도가 높고 강우가 집중되는 우리 나라의 경우 병해충에 의한 피해가 많다. 또한 포도는 와인 제조용 보다는 주로 생식용으로 소비되는 특성상 과실의 당도와 외관은 포도품질과 등급을 결정한다. Oh et al. (2014)의 결과를 보면 포도 흰얼룩병은 Tricothecium roseum 과 Acremonium acutatum에 의하여 주로 발생되는 것으로 밝혀졌으며 주로 습도가 높거나 환기가 불량한 시설 재배에서 발생하고, 가지, 잎, 줄기, 포도송이 등에서 발병하며 수확기에 접어들면 포도의 표면에 급격하게 증가하여 경제적 손실을 초래한다. T. roseum 의 경우 멜론(Cucumis melo L.), 감귤(Citrus unshiu), 배(Pyrus serotina Rehder), 토마토(Solanum lycopersicum)등의 과실에서 분홍빛썩음병(Pink mold rot)을 일으키는 것으로 보고된 바 있다(Kwon et al., 1998; Han et al., 2012; Kwon et al., 2013a; 2013b). A. acutatum 은 Oh et al. (2014a)에 의하여 포도 흰얼룩병의 원인균으로 최초로 보고되었으며 T. roseum 균과 혼합 감염되는 특징이 있다. 특히 노지에서 병원균이 감염되면 수확 후 저온저장 시설에서도 발생이 지속되어 포도의 품질이 현저히 저하된다. 본 병해는 국내의 경우 관리가 불량한 노지 및 시설하우스 포도농가에 피해가 많으며 수확기가 임박한 8월 중순 이후부터 발병이 크게 증가하는 것으로 알려져 있다(Oh et al., 2014b). 아직 등록된 약제가 없으며 수확기에 임박하여 발생하게 되므로 화학약제의 사용은 권장되지 않으며 방제도 어려운 실정이다.
과수의 경우 생물적 방제는 Bacillus subtilis, B. amyloliquefaciens 등의 Bacillus 속 미생물을 이용한 포도 노균병, 복숭아(Prunus persica) 잿빛무늬병 등 다양한 병해에 대한 생물방제가 시도되었다(Zhang et al., 2017; Zhou et al., 2008). 포도 흰얼룩병의 경우 2014년 보고(Oh et al., 2014a)된 포도 신종병해로 국내외적으로 연구된바 없다. 특히 식물병의 생물방제용으로 다양한 작물에 실용화되고 있는 Bacillus속의 많은 종들이 농업적으로 활용되며 그 기작 연구도 다양하게 연구되고 있는데 농작물에 사용되는 대부분의 Bacillus 균주는 cyclic lipopeptides (CLP)인 sufactin, iturin, fengycin 등의 항균 활성물질을 생산하는 것으로 유명하며 이들 물질의 유도체 다양성에 따라 병해의 억제활성이 달라지며, 분류체계도 최근 유전적 특성에 따라 B. amyloliquefaciens, B. velezensis, B. siamensis로 분류되고 있다(Ongena et al., 2009; Fan et al., 2017). 이들이 생산하는 CLP 유도체는 항진균, 항세균 효과 뿐 아니라 식물의 면역기능을 활성화시켜 식물의 생물적 및 비생물적 요인에 스트레스 경감효과를 갖게 한다고 하며 대체로 식물의 수량증 대, 품질개선 및 작물보호활성에 대한 연구가 많다(Guo et al., 2015; Borris et al., 2018).
본 연구에서는 포도흰얼룩병균에 대한 항진균 활성이 우수한 Bacillus속 M28 균주를 선발하여 동정하고 농가포장 적용을 위한 포자발아억제, 포도잎 절편검정 및 포도흰얼룩병 방제를 위한 포장 시험을 수행하였다.
재료 및 방법
길항미생물의 분리, 동정 및 병원균
포도 흰얼룩병에 억제효과가 우수한 균주의 선발을 위하여 4월 중순경 경기도 안성시 한경대학교 경관농장 포도원에서 생육이 우수한 포도나무의 근권을 중심으로 10-15 cm 깊이에서 토양을 채취하였다. 내생포자 형성 바실러스균의 선발 빈도를 높이기 위하여 처리된 토양시료 1g과 생리식염수(NaCl 0.85%) 9 ml을 추가하여 80oC의 수조에 60분간 담가 그램 음성균의 밀도를 낮추었다. 열처리 된 토양시료는 1 ml tube에서 10−2-10−4의 농도로 희석하여 TSA 배지에 도말하고, 28oC에서 2일간 배양하였다. 배양 후 단일 콜로니를 분리하여 순수분리하고, 20% 글리세린이 포함된 cryotube (1.5 ml)에 현탁한 다음 -75oC 초저온 냉동고에 보관하였다. 총 230개 균주 중 포도 흰얼룩병균 2종에 균사저지효과가 가장 우수한 MWS 28 균주를 시험에 공시하였다. 포도 얼룩병에 대한 균사생장 억제시험은 7일간 PDA 배지 위에서 배양된 A. acutatum과 T. roseum를 코르크 보러(내경 5 mm)로 잘라낸 디스크를 PDA가 분주된 87.5 mm 크기의 페트리 디쉬의 중앙에 치상하고 좌우 3 cm 위치에 직경 8 mm의 페이퍼디스크를 치상하였다. TSA에 24시간 배양한 O.D값 1.0으로 조정된 분리 균주 현탁액 0.05 ml를 페이퍼 디스크에 흡수시킨 다음 28oC 암 상태로 일주간 배양하면서 균사생장억제 효과가 우수한 균주를 선발하였다.
선발된 MWS28 균주는 16S rRNA 분석을 통하여 동정하였다. 길항미생물의 chromosomal DNA 추출은 3 ml의 LB broth 배지에서 16시간 동안 배양시킨 배양액으로 Insta Genetm Matrix (BIO_RAD)을 이용하여 추출하였다. 16S rRNA 부분의 증폭을 위하여 universal primer인 27F 5‘(AGA GTT TGA TCM TGG CTC CTC AG)3'와 1492R primer5'(TAC GGY TAC CTT GTT ACG ACT T)3'를 이용하였다. PCR은 2720 Thermal Cycler (Applied Biosystems, UK)를 사용하여 98oC에서 10분의 denaturation 후 98oC에서 10초, 55oC에서 30초, 72oC에서 1분 과정을 35회 반복한 후 마지막으로 72oC에서 7분간 반응시켰다. PCR 산물은 전기영동 후 자외선 조사기에서 밴드를 확인하였다. 확인된 밴드는 MEGA-spinTM Agarose Gel Extraction Kit (Intron, Korea)의 방법에 따라 정제한 후 염기서열 분석을 위해 시퀀싱 분석 서비스(Macrogen, South Korea)를 이용하였다. 16S rRNA를 결과를 MEGA X 프로그램에서 Clustal W를 이용하여 염기서열을 분석한 후(Chenna et al., 2003) 염기 서열의 homology는 천랩의 BLAST 프로그램(EzTaxon-e)을 이용하여 데이터를 비교 분석하였으며(Chun et al., 2007), MEGA X 프로그램을 이용하여 계통 분류도를 작성하였다. 계통도 작성은 Neighbor-joining 알고리즘(Saitou and Nei, 1987)을 사용하였고, 1000회 반복으로 bootstrapping (Felsenstein, 1985)을 수행하여 계통도를 작성 하였다.
분석된 MWS28 16s 유전자 정보는 NCBI (national Center for Biotechnology Information)에 등록하였다(Accession no: MK208682).
B. amyloliquefaciens group의 정확한 동정을 위해 생화학 검정을 실시하였다. 생화학 검정은 매뉴얼에 따라 API50CHB kit (BioMërieux, France)를 이용하여 분석하였다. 선발된 균주는 20% glycerol이 포함된 TSB 배지가 담긴 cryovial (1.5 ml Nalgene)에 담아 -70oC 초저온 냉동고에 보존하였으며 TSA 배지에 옮겨 시험에 공시하였다. TSA에 12시간 배양된 길항균은 멸균 증류수에 희석하여 농도 별로 포도에 살포하거나 접종원으로 사용하였다. 공시병원균인 포도 흰얼룩병균은 한경대 원예학과 과수학 실험실에 보존 중인 Tricothecium roseum과 Acremonium acutatum 균주를 분양받아 PDA 사면배지에 보존하여 사용하였다(Oh et al., 2014a). T. roseum과 A. acutatum 균주는 PDA 페트리디쉬에서 28oC로 1주간 배양하여 형성된 분생포자를 헤마사이토메타로 포자수를 계측하여 ml 당 포자수가 10만개가 되도록 농도를 조정하였다.
MWS28균주의 항균력 검정
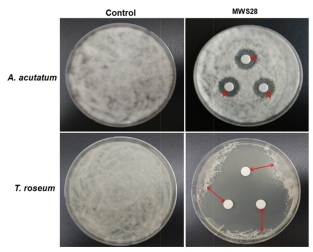
선발된 MWS28 균주의 항균력 측정을 위하여 1 × 105 spores/ml 농도로 조절한 A. acutatum과 T. roseum의 포자현탁액을 PDA plate에 각각 100 µl를 도말하였다. MWS28 균의 배양여액은 TSB (Tryptic Soy Broth)에 24시간 배양한 길항균을 8,000 rpm으로 5분간 원심분리(CT15RE, Hitachi Koki Co., Ltd., Japan)후, 1 ml의 상등액을 취하여 0.25 µm syringe filter (AD. 13CP045AS, Advantec, Houston, TX, USA)를 이용하여 여과하였다. 직경 8 mm의 paper disc (Toyo Co. Japan)에 50 µl의 길항균 배양여액을 분주하고 1분간 완전히 흡수시킨 후에 PDA plate의 정가운데를 기준으로 3 cm 떨어진 3지점에 치상하였다. 28oC incubator (DS-14MC, Dasol Scientific Co., Ltd., Hwaseong, Korea)에서 3일간 배양 후 paper disc 둘레에 나타난 생장 저지대(inhibition zone)의 직경을 디지털 밀림자(Digimetic caliper, Mitutoyo Co., Tokyo, Japan)를 이용하여 측정하였다.
B. velezensis MWS28 균주 배양액 처리에 의한 포도 흰얼 룩병균 포자 발아억제
B. velezensis MWS28에 의한 포도 흰얼룩병균의 포자억 제를 구명하기 위하여 TSB에서 2일간 배양한 길항균 MWS28 배양액을 10,000G로 10분간 원심분리하여 상등액과 균체층으로 분리한 다음 상등액은 균체의 완벽한 제거를 위하여 0.25 µm syringe filter (AD. 13CP045AS, Advantec, Houston, TX, USA)를 통과시켰다. 무균상태의 배양액처리는 배양원액, 10배, 100배, 1000배로 희석한 다음, PDA에서 7일간 배양된 A. acutatum과 T. roseum 균사체로부터 수확한 분생포자를 ml 당 1 × 105개가 되도록 처리 별로 추가하였다. 침전된 MWS28 균체는 배양액의 영향을 제거하기 위하여 살균증류수로 2회 spindown하여 여분의 배양액을 제거하여 1 × 106 cell/ml, 1 × 107 cell/ml, 1 × 108 cell/ml 농도로 하여 배양액 처리와 같은 방법으로 병원균 포자수를 조정하여 MWS28 균체농도에 따른 포자발아억제 유무를 시험하였다. 처리 총량은 1 ml로 하였으며 24 well plate를 이용하였다. 처리를 마친 시료는 암 조건으로 28C 항온기에 배양시키면서 24시간, 48시간, 72시간 간격으로 포자발아율을 헤마사이토메타를 이용하여 측정하였다. 포자발아율(%)은 (발아한 포자수/전체 포자수) * 100으로 하였다.
포도잎을 이용한 포도 흰얼룩병 억제효과
포도잎을 이용한 포도 흰얼룩병 억제시험을 위하여 한경 대학교 경관농장 포도원 노지포장의 캠벨얼리 품종의 직경 7-8 cm의 어린잎을 채취하여 세척 후 4oC에서 12시간 안정화 시킨 다음 22.5 mm 코르크 보러(Cork Borer No 12)를 사용하여 잎을 원형 디스크로 절취하였다. 이때 절취된 잎은 새로 뻗은 포도덩굴의 어린잎으로 채취시기에 관계없이 연중 수확하여 사용하였다. 200 × 200 × 15.0 mm 크기의 플라스틱 사각 플레이트에 습실처리 후 한 처리당 6개의 잎디스크를 정렬한 다음 PDA에서 1주간 배양된 A. acutatum과 T. roseum 균의 콜로니 디스크(φ 5.0 mm)를 어린잎 디스크 절편 가운데에 접종하였다. 암 조건으로 27oC 인큐베 이터에서 5일간 배양 후, 디스크당 병반면적을 조사하였다. 처리 별 3반복하였으며 반복당 6개의 잎 디스크를 처리하였다.
길항균 MWS28과 증량제 혼용처리에 의한 포도흰얼룩병 억제효과 증진
수확한 포도송이를 이용한 생물검정실험에서 포도 흰얼룩 병에 대한 MWS28 균주의 길항효과를 증진시키기 위해 계면활성제인 PEMS (Polyoxy Ethylene Methylpoly Siloxane, Makupica SL, Hankook Samgong Co., Ltd.) 0.02%를 사용 하였고, 길항균 세포의 포도표면 부착성 증진을 위하여 0.3% 알긴산염(Soudium alginate, Junsei Chemical Co., Ltd., Tokyo, Japan)을 사용하였다. 병 발생을 위하여 PDA에 접종하여 28oC 항온기에서 1주간 배양시킨 A. acutatum과 T. roseum을 살균증류수로 희석하여 각각의 농도가 1 × 105 spores/ml이 되도록 조정하였다. 준비된 길항균을 처리 별로 분무 살포한 다음 24시간 풍건한 다음 병원균을 분무 접종하였다. 각각의 시료는 습도 90%, 온도 27oC인 인큐 베이터에 암조건으로 하여, 7일 후 처리구 당 10알을 채취하여 병반수를 조사하였다.
B. velezensis MWS28 처리의 농가실증시험
포도 흰얼룩병이 상습적으로 발생하는 경기도 안성시 소재 비닐하우스 거봉포도 재배농가에서 1처리당 10송이씩 각각의 처리 별로 포도송이에 8월 중순부터 1주간격으로 3회 분무 살포하였다. 공시 길항균인 MWS28은 TSA에 24시간 동안 30oC incubator에서 배양된 균주를 살균증류수에 1 × 108 cells/ml로 희석하여 사용하였으며, 실험 0.02% PEMS와 0.3% 알긴산염을 혼합하여 처리구 당 2리터를 분무 살포하였다. 대조약제는 디페노코나졸(푸르겐, 경농)를 2,000 배로 희석하여 살포하였다. 처리 7일 후, 발병율 및 방제가를 조사하였다. 발병율은 포도 한송이당 흰얼룩병반이 감염된 포도알 수를 조사하여 평균하였으며 발병율은 흰얼룩병이 감염된 감염된 한 개의 포도알 당 형성된 병반수를 조사하여 방제효과를 평가하였다.
통계분석
길항미생물 처리를 통한 병원균의 균사생장, 발아율, 포도잎 및 과실을 이용한 처리구 간의 유의성검정은 SAS 9.3 (SAS Institute Inc, USA)을 이용한 Duncan의 다중검정방법 (Duncan’s multiple range test)으로 5% 수준에서 통계 분석하였다.
결과 및 고찰
길항미생물의 동정
선발길항균 MWS28은 16s rRNA 염기서열 분석 결과, B. velezensis CR-502T와 99.93%, B. siamensis KCTC13613T와 99.93%, B. subtilis subsp. subtilis NCIB3610T와 99.78%, B. amyloliquefaciens DSM7T와 99.70%의 매우 높은 유사성을 보였다. 계통도 분석 결과, B. amylolique-faciens group과 같은 계통인 것을 확인할 수 있었다(Fig. 1). B. amyloliquefaciens group은 16S rRNA 염기서열의 유사성이 매우 높은 group으로 이를 통해 정확한 동정이 불가능 하며 유전체 분석을 통해 구별할 수 있음을 보고된바 있다(Dunlap et al., 2016). 그러나 최근 연구에서 이들 group이 대사 경로에서 차이가 있음을 비교 유전체 분석을 통해 확인하였으며, L-arabinose, D-xylose, mannose, trehalose 이용성을 통해 확인한 바 있다(Chun et al., 2019). 선발길항균 MWS28의 API50CHB의 생화학적 검정 결과, B. velezensis와 더 높은 유사성을 보였다(Table 1). 따라서 선발 길항균을 B. velelzensis MWS28 (NCBI accession No: MK208682)로 동정하였다.
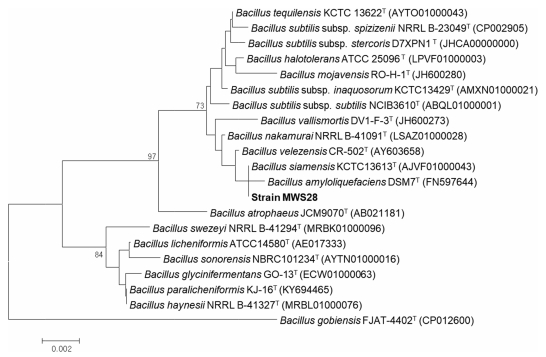
Neighbor-joining phylogenetic tree based on 16S rRNA gene sequences of strain MWS28 and the closely related species. Numbers at nodes are bootstrap values (percentages of 1000 replications); only values more than 70% are shown. Bar, 0.002 substitutions per nucleotide position (NCBI accession number of MWS28 :.MK208682).
MWS28균주의 항균력 검정
MWS28 균주의 배양여액을 이용하여 A. acutatum과 T. roseum의 항균력 검정을 진행한 결과는 Fig. 2와 같다. A. acutatum과 T. roseum의 저지원은 각각 15.6 ± 0.6, 40.8 ± 1.6 mm로, 길항균에 의해 두 병원균 모두 억제되었으며 A, acutatum보다 T, roseum균에 강한 항균 활성을 나타내었다. 농업용으로 쓰이는 바실러스균속은 보통 bacillomycin D, fengycin, iturin A, surfactin과 같은 cyclic lipopeptide를 생산하여 항균활성을 나타낸다(Hiradate et al., 2002; Kloepper et al., 2004; Chen et al., 2009). Maget et al. (1992)의 연구결과에 의하면 iturin A, surfactin는 동시에 존재할 때, 항진균 활성을 높이는 것으로 알려져 있다. 또한, B. amyloliquefaciens 는 IAA, 2,3-butanediol등의 식물생육 호르몬에 관여하는 물질을 생산하여 식물에 영향을 준다(Ramirez and Kloepper, 2010; Yang et al., 2011).
B. velezensis MWS28 균주 배양액 처리에 의한 포도 흰얼 룩병균의 포자 발아억제
MWS28 균주 배양액에 대한 A. acutatum 포자발아억제는 원심분리하여 Bacterial cell을 제거 후 0.25 um (포어사 이즈)의 멤브레인 휠터를 통과시킨 배양원액(상등액) 처리에서 가장 좋았으며 24시간 후에는 포자발아가 거의 이루어 지지 않다가 48, 72시간 후에는 점차 발아율이 증가하였다(Table 2). 한편 배양액을 제거한 Bacterial live cell 처리에서는 길항균 배양원액 처리와 동일하게 매우 낮은 발아율을 나타내었으며 72시간 후에도 발아율 10% 정도의 우수한 발아억제력을 나타내었다(Table 3). 이와 같은 결과를 보아 MWS28 균의 포자발아억제는 배양액에 포함된 항균 활성 물질뿐만 아니라 MWS28균체가 병원균의 포자접촉에 의한 균사체 용해효소의 생산 혹은 미 동정 억제물질이 작용할 것으로 생각된다. 길항균 MWS28의 밀도는 높을수록 A. acutatum 균주의 포자발아가 억제되는 것으로 보아 1 × 108 cfu/ml 이상의 밀도 유지가 포도 흰얼룩병 생물방제에 중요한 요인임을 알 수 있다. T. roseum 처리의 경우에도 A. acutatum의 포자억제 양상과 같은 경향을 나타냈으며 T. roseum 균 무처리의 포자 발아율은 A. acutatum 보다 매우 낮은 경향을 보였다(Table 4, 5). Lee et al. (2013b)의 결과를 보면 B. amyloliquefaciens subsp. plantarum CC110 배양액과 bacterial cell 처리가 오이 노균병을 동일하게 억제 하였다는 연구 결과를 발표하였는데 포자 발아억제에는 길항균 배양액에 포함된 항균 활성물질 뿐만 아니라 증류수에 Bacterial cell만 희석하여 처리한 병원균의 포자발아억제 활성도 동일한 억제 활성을 나타낸다고 할 수 있다. 따라서 길항균이 갖는 식물병원균에 대한 생물방제효과는 항균활성뿐 아니라 길항균이 직접 병원균에 접촉하여 포자발아 억제 물질을 내거나 균사체 분해효소의 생산 등의 작용기전이 있을 것으로 생각된다.

Inhibition of conidia germination to A. acutatum by bacterial cell and supernatant of B. velezensis MWS28

Inhibition of conidia germination to T. roseum by bacterial cell and supernatant of B. velezensis MWS28
포도잎을 이용한 포도흰얼룩병 억제효과 검정
잎 절편을 이용한 생물검정 결과, MWS28 무처리구에서는 A. acutatum에 대하여 병반면적율이 96.0%였으며 MWS28 처리구에서는 38.3%로 MWS28균의 처리로 병반 면적율이 대폭 감소하였다(Fig. 3, Table 6). T. roseum 균에 의한 병 발생은 89.1%인 반면, 길항균인 MWS28 처리 포도 잎에서는 20.0%의 병반면적율을 나타내었다(Table 6). 포도 흰얼룩병균인 A. acuatum과 T. roseum에 대한 길항균 MWS28 균주의 처리효과를 방제가로 환산해보면 각각 60%, 78%로 MWS28 처리가 포도 흰얼룩병의 포도잎 절편 검정에서도 효과적이었으며 항균활성 검정에서의 결과와도 일치하는 경향이었다(Fig. 4, Table 6). Fig. 3과 4에서와 같이 포도 흰얼룩병에 의한 병해증상은 직경 7-8 cm 미만의 어린잎에 심한 갈변화를 동반하여 28oC에서 3-4일 후면 조직의 괴사가 일어나며 잎표면은 균사체로 덮이게 되는데 7-8 cm 이상의 성엽(노화된 잎)에서는 얼룩병이 발생하지 않으므로 시험을 위해서는 시료채취에 주의를 기울여야 한다.
포도에 시험된 몇 가지 연구를 살펴보면 포도 잎에 B. subtilis B27과 B29를 처리하였을 때 잿빛곰팡이병(Botrytis cinerea)를 억제하였으며(Lee et al., 2013a), B. subtilis KS1 균주도 잿빛곰팡이병을 억제함을 밝혔다(Furuya et al., 2011; Maachia et al., 2015). B. amyloliquefaciens의 항진균 활성 비교 연구에서 Botrytis cinerea를 억제하는 항균물질의 생산이 B. subtilis, B. licheniformis, B. spizizenii 등의 바실러스균에 비해 월등히 높다고 평가하고 있다(Pretorius et al., 2015). 이와 같은 길항균의 특성을 비교해보면 포도흰얼 룩병에 대한 B. amyloliquefaciens 항진균 활성도 다른 종에 비해 훨씬 높을 것으로 생각된다. 또한 포도 흰얼룩병은 노지포장의 어린잎에 발병하지는 않으나 포도과실이 없어 시험할 수 없는 경우 포도 흰얼룩병의 농약평가, 길항균의 역가검정 등에 유용하게 활용 될 수 있을 것으로 생각된다.

Decreased lesion area to A. acutatum by treatment of bacterial cell of MWS28 in young leaf disc assay (Left: Control, Right: MWS28).

Decreased lesion area against two pathogens of white stain symptom by treatment of bacterial cell of MWS28 for young leaf disc assay

Decreased lesion area to T. roseum by bacterial cell of MWS28 in young leaf disc assay (Left: Control, Right: MWS28).
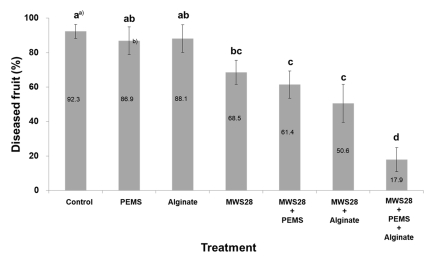
Suppression of White stain symptoms causing T. roseum by combined treatment of B. velezensis MWS28 on postharvest grapes ‘Campbell early’. Bacterial and fungal spore suspension was adjusted as 1 × 108 cells/ml and 1 × 105 spores/ml respectively. The final treatments were added with 0.02% of PEMS and 0.3% of sodium alginate. a) Means followed by a same letter (s) in the column are not significantly different by Duncan’smultiple range test (DMRT) at p=0.05, b) Values are means standard errors (±).
길항균 MWS28과 알긴산염 혼용처리에 의한 포도 흰얼 룩병 억제효과
포도과실을 이용한 기내실험에서 A. acutatum에 의한 포도 흰얼룩병에 대한 MWS28균주 처리효과는 0.02% PEMS와 0.3%의 알긴산염를 혼합한 처리가 병 발생율 19.6%로 가장 낮았다(Fig. 6). 한편 MWS28를 단독 살포한 경우에는 65.5%의 발병률을 나타낸 것으로 보아 MWS28균주는 0.02% PEMS와 0.3% 알긴산염의 혼합처리 할 경우 방제효율이 크게 상승됨을 확인 할 수 있었다. 이와 같은 결과는 T. roseum에 의한 포도흰얼룩병 방제 시험에서도 동일한 패턴을 보였다(Fig. 7). 사용된 PEMS는 유기실리콘계열의 전착제로 국내 농약허용기준에서 면제되는 유효성분으로 화학농약의 전착제로 사용되고 있다. 알긴산염는 해초류에서 분리한 천연성분으로 물리화학적으로 안정적일 뿐만 아니라 인체에 해가 없어 고착성 증진을 위한 농식품류의 원료로 빈번하게 사용된다(Bashan, 1987). 알긴산염은 길항곰팡이 또는 유용 세균 세포의 담체화(encapsulation) 제제용으로도 빈번하게 사용되며, 길항균인 Gliocladium virens G17과 G20에 알긴 산염 처리 시에는 혼용처리하지 않은 처리구에 비해 모잘록 병의 생물학적 방제효과를 증진시키며, Alternaria와 알긴산 염을 혼용 처리하였을 때는 미생물제초제로서의 효과를 증진시켰다(Lumsden and Locke, 1989; Walker et al., 1983; Gent et al., 2003). Mclaughlin et al. (1992)은 효모와 알긴 산염를 혼용 살포한 처리가 대조처리보다 사과 잿빛곰팡이 병의 억제를 증진시킨다고 보고하였다. 이러한 결과로 보아 선발 길항균 MWS28균을 이용한 포도흰얼룩병의 생물방제 효율 증대에는 PEMS와 알긴산염의 복합처리가 매우 유용함을 알 수 있다(Fig. 6, 7).
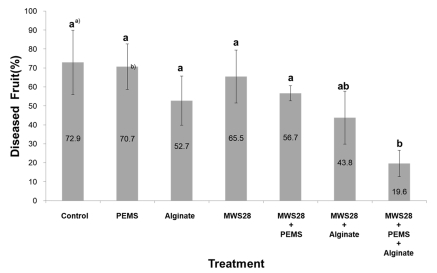
Suppression of white stain symptoms causing A. acutatum by combined treatment of B. velezensis MWS28 on postharvest grapes ‘Campbell early’. Treatment of bacterial and conidial suspension was adjusted as 1 × 108cells/ml and 1 × 105spores/ml respectively. The final treatment was added as 0.02% of PEMS and 0.3% of sodium alginate. a) Means followed by a same letter (s) in the column are not significantly different by Duncan’s multiple range test (DMRT) at p = 0.05, b) Values are means standard errors (±).

Suppression of White stain symptoms on grapes ‘Kyoho’ by B. velezensis MWS28 treatment. Diseased grape (%) examined treatment after 7 days. (A) Control treatment (B) Chemical spray of Difenoconazole (C) Cell suspension of B. velezensis MWS28 (D): Cell suspension of B. velezensis MWS28 with 0.02% PEMS and 0.3% sodium alginate.
B. velezensis MWS28처리의 농가실증시험
포도 흰얼룩병이 자연발생하는 포도농장에서 길항균 MWS28을 실험한 결과, 무처리의 병 발생은 71%였으며 대조약제인 디페노코나졸 처리는 15.3%로 억제효과가 처리중 가장 우수하였다. 길항균 단독처리는 35%, MWS28과 0.02% PEMS 및 0.3% 알긴산염를 복합 살포한 처리는 20%로 화학농약인 difenoconazole과 유사한 포도 흰얼룩병 방제 효과를 나타내었다(Fig. 7, Table 7). MWS28 균주의 포도과실 처리는 포도 흰얼룩병균을 억제할 뿐 아니라 포도의 생체중, 안토시아닌 함량 및 당도(브릭스)증가 등의 부수적인 기능이 조사되었으며 차후의 시험 결과에 따라 포도의 품질개선용으로도 활용될 수 있을 것이다(data not shown). 이러한 결과로 보아 MWS28균주는 포도흰얼룩병의 생물방 제와 포도 품질 증진제로 친환경 농가의 포도재배에 활용될 것으로 생각된다.
Acknowledgments
본 연구는 2018년도 농림식품기술기획평가원(IPET)의 연구과제(Grant No: 117121011SB010)로 수행되었으며 연구비 지원에 감사 드립니다.
References
- Bashan, Y., (1987), Alginate beads as synthetic inoculant carriers for slow release of bacteria that affect plant growth, Applied and Environmental Microbiology, 51(5), p1089-1098.
-
Borriss, R., A. Danchin, C. R. Harwood, C. Medigue, P. C. Eduardo, P.C. Sekowska, and D. Vallenet, (2018), Bacillus subtilis, the model Gram-positive bacterium: 20 years of annotation refinement, Microbial Biotechnology, 11(1), p3-17.
[https://doi.org/10.1111/1751-7915.13043]

-
Chen, X. H., A. Koumoutsi, R. Scholz, K. Schneider, J. Vater, R. Sussmuth, J. Piel, and R. Borriss, (2009), Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens, J. Biotechnol, 140(1-2), p27-37.
[https://doi.org/10.1016/j.jbiotec.2008.10.011]

-
Chenna, R., H. Sugawara, T. Koike, R. Lopez, T. J. Gibson, D.G. Higgins, and J. D. Thompson, (2003), Multiple sequence alignment with the Clustal series of programs, Nucleic Acids Res, 31(13), p3497-3500.
[https://doi.org/10.1093/nar/gkg500]

-
Chun, J., J. H. Lee, Y. Jung, M. Kim, S. Kim, B. K. Kim, and Y. W. Lim, (2007), EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences, International Journal of Systematic and Evolutionary Microbiology, 57, p2259-2261.
[https://doi.org/10.1099/ijs.0.64915-0]

-
Chun, B. H., K. H. Kim, S. E. Jeong, and C. O. Jeon, (2019), Genomic and metabolic features of the Bacillus amyloliquefaciens group-B. amyloliquefaciens, B. velezensis, and B. siamensis-revealed by pan-genome analysis, Food Microbiology, 77, p146-157.
[https://doi.org/10.1016/j.fm.2018.09.001]

-
Dunlap, C. A., S. J. Kim, S. W. Kwon, and A. P. Rooney, (2016), Bacillus velezensis is not a later heterotypic synonym of Bacillus amyloliquefaciens; Bacillus methylotrophicus, Bacillus amyloliquefaciens subsp. plantarum and ‘Bacillus oryzicola’ are later heterotypic synonyms of Bacillus velezensis based on phylogenomics, International Journal of Systematic and Evolutionary Microbiology, 66(3), p1212-1217.
[https://doi.org/10.1099/ijsem.0.000858]

- Fan, B., J. Blom, H-P. Klenk, and R. Borris, (2017), Bacillus amyloliquefaciens, Bacillus velezensis, and Bacillus siamensis form an “Operational Group B. amyloliquefaciens” within the B. subtilis species complex, Frontiers in Microbiology, 22(8), p1-18.
-
Felsenstein, J., (1985), Confidence limits on phylogenies: An approach using the bootstrap, Evolution, 39(4), p783-791.
[https://doi.org/10.2307/2408678]

-
Furuya, S., M. Mochizuki, Y. Aoki, H. Kobayashi, T. Takayanagi, M. Shimizu, and S. Suzuki, (2011), Isolation and characterization of Bacillus subtilis KS1 for the biocontrol of grapevine fungal diseases, Biocontrol Science and Technology, 21(6), p705-720.
[https://doi.org/10.1080/09583157.2011.574208]

-
Gent, D. H., H. F. Schwartz, and S. J. Nissen, (2003), Effect of commercial adjuvants on vegetable crop fungicide coverage, absorption and efficacy, Plant Dis, 87(5), p591-597.
[https://doi.org/10.1094/pdis.2003.87.5.591]

- Guo, J. H., C. H. Jiang, P. Xie, Z. Y. Huang, and Z. H. Fa, (2015), The plant healthy and safety guards plant growth promoting rhizobacteria (PGPR), Transcriptomics, 3(2), p109.
- Han, K. S., S. C. Lee, J. S. Lee, and J. W. Soh, (2012), First report of pink mold rot on Tomato fruit caused by Trichothecium roseum (Pers.) in Korea. Res, Plant Dis, 18(4), p396-398.
-
Hiradate, S., S. Yoshida, H. Sugie, H. Yada,and Y. Fujii, (2002), Mulberry anthracnose antagonists (iturins) produced by Bacillus amyloliquefaciens RC-2, Phytochemistry, 61(6), p693-698.
[https://doi.org/10.1016/s0031-9422(02)00365-5]

-
Kloepper, J. W., C. M. Ryu, and S. Zhang, (2004), Induced systemic resistance and promotion of plant growth by Bacillus spp, Phytopathology, 94(11), p1259-1266.
[https://doi.org/10.1094/phyto.2004.94.11.1259]

- Kwon, J. H., S. W. Kang, J. T. Lee, H. K. Kim, and C. S. Park, (1998), First report of pink mold rot on matured fruit of Cucumis melo caused by Trichothecium roseum (Pers.) Link ex Gray in Korea, Korean J. Plant Pathol, 14(6), p642-645.
-
Kwon, J. H., H. S. Lee, S. L. Choi, Y. J. Cho, O. H. Choi, H. S. Cho, and C. K. Shim, (2013a), Pink mold rot on Asian pear (Pyrus serotina Rehder) caused by Trichothecium roseum (Pers.) Link ex Gray in Korea, Korean J. Organic Agric, 21(3), p373-380.
[https://doi.org/10.11625/kjoa.2013.21.3.373]

-
Kwon, J. H., D. W. Kang, O. H. Choi, and H. S. Shim, (2013b), Pink mold rot on Unshiu orange (Citrus unshiu Mac.) caused by Trichothecium roseum (Pers.) Link ex Gray in Korea, Res. Plant Dis, 19(3), p226-228.
[https://doi.org/10.5423/rpd.2013.19.3.226]

-
Lee, S. Y., H. Y. Weon, J. J. Kim, J. H. Han, and W. G. Kim, (2013a), Biological Control of cucumber powdery mildew by Bacillus amyloliquefaciens M27, The Korean Journal of Mycology, 41(4), p268-273.
[https://doi.org/10.4489/kjm.2013.41.4.268]

-
Lee, S. Y., H. Y. Weon, J. J. Kim, and J. H. Han, (2013b), Cultural characteristics and mechanism of Bacillus amyloliquefacien subsp. plantarum CC110 for biological control of cucumber downy mildew, The Korean Society of Pesticide Science, 17(4), p428-434.
[https://doi.org/10.7585/kjps.2013.17.4.428]

- Lumsden, R. D., and J. C. Locke, (1989), Biological control of damping-off caused by Pythium ultimum and Rhizoctonia solani with Gliocladium virens in soilless Mix, Phytopathology, 79(3), p361-366.
- Maget, D. R., L. Thimon, F. Peypoux, and M. Ptak, (1992), Surfactin/iturin A interactions may explain the synergistic effect of surfactin on the biological properties of iturin A, Biochimie, 74(12), p1047-1051.
- Maachia, B., E. Rafik, M. Chérif, P. Nandal, T. Mohapatra, and P. Bernard, (2015), Biological control of the grapevine diseases 'grey mold' and 'powdery mildew' by Bacillus B27 and B29 strains, Indian Journal Experimental Biology, 53(2), p109-115.
- Mclaughlin, R. J., C. L. Wilson, S. Droby, R. Ben-Arie, and E. Chalutz, (1992), Biological control of postharvest diseases of grape, peach, and apple with the yeasts Kloeckera apiculata and Candida guilliermondii, Plant Disease, 76(5), p470-473.
-
Oh, S. Y., K. W. Nam, and D. H. Yoon, (2014a), Identification of Acremonium acutatum and Trichothecium roseum isolated from grape with white stain symptom in Korea, Mycobiology, 42(3), p269-273.
[https://doi.org/10.5941/myco.2014.42.3.269]

-
Oh, S. Y., K. W. Nam, and D. H. Yoon, (2014b), Ecological characteristics of white stain symptom on the grape in Korea, Korean Journal of Environmental Agriculture, 33(3), p178-183.
[https://doi.org/10.5338/kjea.2014.33.3.178]

-
Ongena, M., and P. Jacques, (2009), Bacillus lipopeptides : Versatile wapons for plant disease biocontrol, Trends Microbiol, 16(3), p115-25.
[https://doi.org/10.1016/j.tim.2007.12.009]

-
Pretorius, D., J. van Rooyen, and K. G. Clarke, (2015), Enhanced production of antifungal lipopeptides by Bacillus amyloliquefaciens for biocontrol of postharvest disease, New Biotechnology, 32(2), p243-252.
[https://doi.org/10.1016/j.nbt.2014.12.003]

- Ramirez, C. A., and J. W. Kloepper, (2010), Plant growth promotion by Bacillus amyloliquefaciens FZB45 depends on inoculum rate and P-related soil properties, Biology and Fertility of Soils, 46(8), p835-844.
- Saitou, N., and M. Nei, (1987), The neighbor-joining method: a new method for reconstructing phylogenetic trees, Mol Biol Evol, 4(4), p406-425.
-
Tanaka, K., Y. Amaki, A. Ishihara, and H. Nakajima, (2015), Synergistic effects of [Ile7]surfactin homologues with Bacillomycin D in suppression of gray mold disease by Bacillus amyloliquefaciens biocontrol strain SD-32, J. Agric. Food Chem, 63(22), p5344-5353.
[https://doi.org/10.1021/acs.jafc.5b01198]

-
Tamura, K., D. Peterson, N. Peterson, G. Stecher, M. Nei, and S. Kumar, (2011), MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods, Mol Biol Evol, 28(1), p2731-2739.
[https://doi.org/10.1093/molbev/msr121]

-
Yang, T., Z. Rao, X. Zhang, Q. Lin, H. Xia, Z. Xu, and S. Yang, (2011), Production of 2,3-butanediol from glucose by GRAS microorganism Bacillus amyloliquefaciens, J. Basic Microbiol, 51(6), p650-658.
[https://doi.org/10.1002/jobm.201100033]

-
Yu, G. Y., J. B. Sinclair, G. L. Hartman, and B. L. Bertagnolli, (2002), Production of Iturin A by Bacillus amyloliquefaciens suppressing Rhizoctonia solani, Soil Biology and Biochemistry, 34(7), p955-963.
[https://doi.org/10.1016/s0038-0717(02)00027-5]

-
Zhou, T., K. E. Schneider, and X .Z. Li, (2008), Development of biocontrol agents from food microbial isolates for controlling post-harvest peach brown rot caused by Monilinia fructicola, International Journal of Food Microbiology, 126(1-2), p180-185.
[https://doi.org/10.1016/j.ijfoodmicro.2008.05.020]

-
Zhang, X., Y. Zhou, Y. Li, X. Fu, and Q. Wang, (2017), Screening and characterization of endophytic Bacillus for biocontrol of grapevine downy mildew, Crop Protection, 96, p173-179.
[https://doi.org/10.1016/j.cropro.2017.02.018]