생물검정 방법에 따른 벼멸구의 독성 반응과 최적 관찰 시기 설정
초록
해충의 살충제에 대한 시간에 따른 독성 반응은 생물검정 방법에 따라 다를 수 있으므로 최적 관찰 시간을 설정하는 것이 중요하다. 본 연구에서는 벼멸구와 이미다클로프리드를 선정하여, 근권처리법, 줄기침지법 그리고 미량국소처리법에 대한 독성 반응을 관찰하였다. 해당 생물검정법을 수행 후 24시간 간격으로 7일 동안 사충율을 측정하고 반수치사농도(LC50)와 반수치사시간(LT50)을 산출하였다. 그 결과 반수치사농도(LC50)는 시간이 늘어남에 따라 감소하는 경향을 나타내었고, 반수치사시간(LT50)은 농도가 증가함에 감소하는 경향을 나타내었다. 회귀 분석을 통해 독성 반응 시간을 고려할 경우 3 종류의 생물검정법 중 미량국소처리법이 가능 빠른 독성을 나타내었고, 처리 농도(혹은 약량)를 고려할 경우 근권처리법이 저농도에서 가장 우수한 효과를 보였다. 최적 관찰 시간은 농도별 사충율의 분산 차이가 가장 큰 구간을 고려하여 선정하였는데, 근권처리법과 줄기침지법에서는 4일차가 가장 큰 분산을 보여 관찰 시기로 적합한 것으로 나타났고, 미량국소침지법은 처리 후 1일차가 적당한 관찰 일자인 것으로 확인되었다. 또한 감수성과 저항성 계통을 이용하여 관찰 시간 별 저항성 비를 비교하였다. 그 결과 최적 관찰 일자 값을 중심으로 저항성 비가 2배 미만으로 일정하게 나타나 저항성 평가에도 중요한 정보를 제시하는 것으로 확인하였다. 결론적으로, 해충의 약제에 대한 반응은 생물검정 방법에 따라 다르게 나타나는데, 시간 별 사충율의 분산 차이는 합리적인 최적 관찰 시점을 설정하는데 활용할 수 있을 것이다.
Abstract
It is important to establish the optimum observation time because the toxic response of insect pesticides may be different depending on the bioassay method over time. In this study, we observed the mortality of three different types of bioassay methods (root zone treatment, stem dipping, and topical application methods) by using Nilaparvata lugens and imidacloprid. The mortality was observed every 24 h for 7 days and we determined median lethal concentration (LC50) and median lethal time (LT50). As a result, LC50 and LT50 tended to decrease with increasing time and concentration, respectively. When considering the regression analysis LC50 vs. observation time and LT50 vs. concentration, the topical application and root zone treatment methods were effective to reduce the observation time and usage amount of imidacloprid, respectively. Appropriate observation time point for three bioassay methods was selected by the largest delta variance of mortalities of each concentration. The results were shown as the 4th day is appropriate for root zone treatment and stem dipping methods, and 1st day is acceptable for the topical application method. We compared the resistance ratios by optimum observation time using the imidacloprid resistance strain. The resistance ratio is constantly less than 2 times based on the optimum observation time, suggesting it is also helpful for the determination of resistance ratio. In conclusion, the response of pesticides was varied depending on the bioassay methods and the delta variance of the mortality would useful to establish the optimum observation time to each bioassay method for various insect pests.
Keywords:
Toxicity response, Nilaparvata lugens, imidacloprid, bioassay, observation time키워드:
독성 반응, 벼멸구, 이미다클로프리드, 생물검정, 관찰시간서 론
현재까지 약 28개 작용점 그룹으로 구성된 살충제들이 농업 및 위생 해충의 방제에 적용되어 식량 증산과 인류 보건에 기여하고 있다(Sparks and Nauen, 2015). 각 살충제에 대한 해충의 독성 반응 지표는 살충제의 작용기작 이해에 중요한 정보를 제공하며, 해당 해충의 생태적 특성을 고려하여 줄기침지법, 관주법, 스프레이법, 근권처리법, 미량국소처리법 등의 생물검정법과 접목되어 관찰되고 있다(Paramasivam and Selvi, 2017). 생물검정에서 반수치사시간, 반수치사농도, 기절 시점, 회복 시점 등 해당 약제의 독성에 의해 나타나는 포괄적인 현상 등을 나타내는 독성 반응 지표는 대상 약제의 작용기작에 따라 다양하게 나타날 수 있으며, 동일한 작용기작을 지닌 약제의 경우에도 생물검정법이 달라지면 여러 종류의 변수(예: 식물체의 흡수량, 이행 중 분해율, 해충의 흡즙량, 약제의 해충 표피 침투율등)들에 의해 다르게 나타난다(Durmuşoğlu et al., 2015).
동아시아에서 이동성 곤충으로 알려진 벼멸구는 병원성 바이러스를 매개하는 주요 해충으로서(Dyck and Thomas, 1979; Paik, 1977), 다양한 약제에 대한 체계적인 생물검정법들이 개발되어 독성 지표 산출에 활용이 되었다(Heinrichs, 1981; Heong, 2011). 예로서, 독성 반응 관찰 시점은 미량국소처리법의 경우, 카바메이트계와 유기인계 약제는 처리 후 24-48시간에 관찰을 한 사충율로 하고, 이미다클로프리드는 처리 후 72시간이 지난 사충율을 사용하여 독성학적 지표 산출에 사용한다(Matsumura and Sanada-Morimura, 2010; Min et al., 2014). 반면에 생장조절제인 피메트로진의 경우, 처리 후 7일차에 관찰한 사충율을 독성 지표 산출에 사용하거나, 해당 시기의 사충율 값의 변이가 높아 산란한 알의 부화율까지 고려하여 독성 평가 지표에 사용하기도 한다(Tsujimoto et al., 2016). 줄기침지법의 경우, ethioprole은 처리 3일차를 관찰 시점으로, 피메트로진은 24-120 시간 관찰 후 사충율을 고려하려 사용하고 있다(Garrood et al., 2016; Liu et al., 2013). 위의 결과는 생물검정방법과 작용기작에 따라 관찰 시점을 다변화해야 함을 의미하는데, 현재까지 최적 관찰 시점을 체계적으로 설정하는 방법에 대한 연구에 대한 언급은 제시된 바 없다. 대부분 실험자가 일정 기간 동안 정기적인 사충율 관찰을 수행 후 독성 지표가 가장 잘 분석되는 시점을 기준으로 결정한다. 따라서 해충의 신규 약제나 대상 약제의 독성 반응 지표를 도출하기 위해 합리적인 관찰 시점을 체계화 할 수 있는 개념 설정이 필요하다.
본 연구에서는 체계적인 관찰 시점을 설정하기 위해 3종류의 생물검정법을 토대로 관찰 일자별 해당 농도의 사충율을 산출하여 동일 약제에 대한 독성 반응이 다르게 나타남을 확인하고, 각 일자별 사충율의 분산값을 토대로 변이력이 가장 크게 나타나는 날짜를 최적 관찰 날짜로 선정하였다. 또한 이미다클로프리드 저항성 벼멸구의 저항성비의 변동을 비교하여, 최적 관찰 시점이 저항성 연구에도 중요한 정보를 제시할 수 있음을 소개하였다.
재료 및 방법
대상 해충 및 사육
본 실험에 사용한 벼멸구 감수성 계통은 1985년 채집 이후 살충제 노출없이 국립농업과학원 해충 사육실에서 유지해온 것이다. 벼멸구 저항성 계통은 이미다클로프리드 약제에 약 20회 이상 도태되어 유지된 계통이다. 사육에 사용한 벼의 품종은 추청벼로 발아후 15-20일 지난 유묘를 사용하였다. 실내 사육 조건은 온도 25도, 습도 60-80%, 일장(L:D) 16:8이다. 벼멸구는 30 × 30 × 30 cm 크기의 아크릴케이지 내에서 사육하였다.
세 종류의 생물검정법
본 연구에서는 Heong (2011)이 제시한 생물검정법을 약간 변형하여 이미다클로프리드 약제를 이용하여 근권처리법, 줄기침지법 그리고 미량국소처리법을 적용하여 벼멸구의 독성 반응을 관찰하였다. 대상 약제는 이미다클로프리드로서 근권처리법(Root zone treatment method)과 줄기침지법(Stem dipping method)에는 제품(코니도, 동부한농, 10% SC)을 사용하였고, 미량국소처리법(Topical application method)에는 원제(95%)를 사용하였다. 미량국소침지처리법에서 원제를 사용한 이유는 아세톤에 희석하여 정확한 약량에 노출된 애멸구의 독성 반응을 평가하기 위해서이다. 생물검정을 위해 제품은 물로 희석하였고, 원제는 100% 아세톤으로 희석하였다. 실험에 사용한 벼멸구는 성충으로 탈피 후 3-5일 지난 암컷을 사용하였다. 먼저 근권처리법은 제품 약액을 일정 농도 범위로 희석(0.032 – 1.6 ppm)한 후 25 ml 약액을 유리 시험관(지름 3 cm× 높이 20 cm)에 분주 하였다. 유묘의 뿌리 부분을 솜으로 감싼 다음 이미 분주 된 시험관 약액에 밀어 넣어 뿌리 부분에 스며들도록 한 후 애멸구 암컷을 각 유리 시험관에 10마리씩 접종하였다. 두번째로 줄기침지법은 일정 농도로 희석된 약액을 준비 후 20일이 지난 유묘의 줄기 부분을 30초간 침지 후 후드에서 1시간 동안 음건한 후, 유묘의 뿌리 부분을 솜으로 말아 25 ml의 물이 든 유리 시험관에 넣어 자연스럽게 스며들도록 한 후, 벼멸구 10마리를 접종하였다. 마지막으로 미량국소처리법은 암컷 성충을 이산화탄소에 5초 마취 후 마이크로어플리케이터를 이용하여 0.22 μl씩 복부와 가슴부위에 처리 하였다. 약액에 처리된 벼멸구는 유묘가 준비된 유리 시험관 튜브로 바로 옮겨졌다. 각 생물검정법은 3반복 이상 수행되었으며, 벼멸구 접종 후 이탈을 막기 위해 시험관의 상층부를 메쉬망으로 막았다. 사충율의 관찰은 24시간 간격으로 7일 동안 수행되었다. 각각의 관찰 시간 별 반수치사농도(LC50)와 농도별 반수치사시간(LT50)은 Abbott의 공식을 따른 보정사충률을 산출 후(Abbott, 1925), SPSS 23.0 (IBM Analytics, New York)를 이용하여 프로빗 분석을 통해 계산하였다(Finney, 1971).
반응 속도 관찰 및 최적 관찰 시간 설정
반수치사농도와 반수치사시간을 이용하여 벼멸구의 이미다클로프리드 약제에 대한 농도와 시간에 대한 반응 속도를 계산하였다. 먼저 반수치사농도와 반수치사시간을 역수 로그 치환 후 로그 치환 된 관찰 시간과 처리 농도 간의 직선 회귀식을 Sigma Plot 10.0 (SYSTAT Software, San Jose, CA)을 이용하여 구하였다. 벼멸구의 각 생물검정법에 대한 최적 관찰 시간은 일자별 사충율의 분산을 구하고 그 분산의 차이가 가장 큰 날짜를 선정하였다.
감수성 계통과 저항성 계통 간의 저항성비 변동 비교
저항성 계통을 대상으로 3종류의 생물검정법을 적용하였으며, 각 시간별 반수치사농도를 산출하였다. 저항성 비는 각 시간별 저항성 계통의 반수치사농도를 감수성 계통의 반수치사농도로 나눈 값으로 하였다.
결 과
생물검정방법 별 사충율
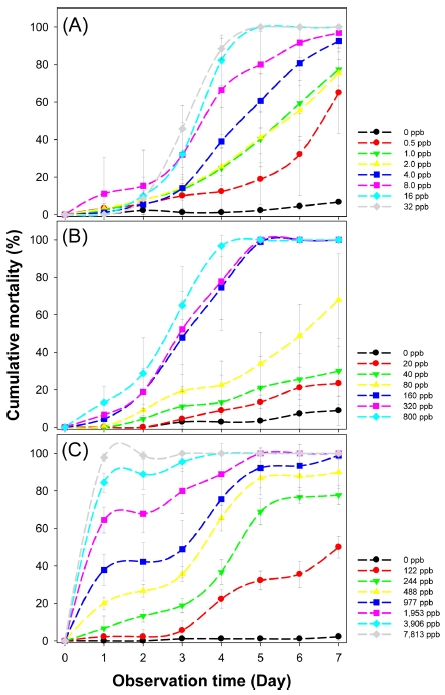
3가지 처리 방법에 따른 생물 반응을 24시간 간격으로 7일 동안 조사하여 보았다. 무처리의 사충율은 7일 동안 10% 미만으로서 각각의 생물검정법이 적합한 것으로 나타났다(Fig. 1). 각각의 생물검정법에 따라 벼멸구의 독성 반응은 근권처리법(Fig. 1A)과 줄기침지법(Fig. 1B)은 처리 2-3일부터 독성 반응을 나타내었으며, 미량국소처리법(Fig. 1C)은 처리 1일 후 독성이 나타나기 시작했다. 따라서 처리 방법에 따라 벼멸구의 독성이 다른 것으로 나타났다.
반수치사농도와 반수치사시간
3가지 생물검정법에서 24시간 단위로 관찰된 사충율을 바탕으로 반수치사시간과 반수치사농도를 산출하였다(Table 1 & 2). 먼저 반수치사농도의 경우, 근권처리법에서는 반수치사농도가 3일차부터 측정이 가능하였는데, 87 ppb에서 0.2 ppb로 감소하였다(Table 1). 줄기침지법의 경우 1일차에는 5875 ppb였으며 7일차에는 53.5 ppb였다. 미량국소처리법에서는 초기에는 592 ppb였으며, 6일차에는 25.3 ppb로 감소하였다. 3가지 생물검정법의 감소속도(기울기값)는 6.0, 2.8, 1.6으로서 미량국소처리법에서 가장 값이 낮아 미량국소처리법에서 독성 반응 속도가 가장 빠른 것으로 나타났다(Fig. 2A).
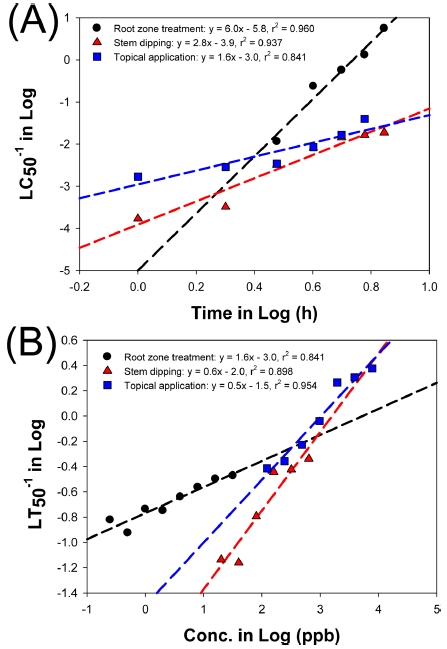
Linear regression of LC50 vs. observation time (A) and LT50 vs. imidacloprid concentration (B), respectively, by three bioassay methods: root zone treatment, stem dipping and topical application methods.
반수치사시간의 경우 낮은 농도에서는 높은 값의 반수치사시간이 산출되었고, 높은 농도에서 낮은 값의 반수치사시간값이 산출되었다(Fig. 2B). 근권처리법의 경우, 0.25 ppb에서 6.6일이였으나 32 ppb에서는 3일인것으로 나타났다. 줄기침지법에서는 가장 낮은 농도에서는 13.7일이였으나, 가장 높은 농도에서는 2.2일이였다. 미량국소처리법에서는 최저 농도에서는 2.6일이였으며 최고 농도에서는 0.4일인 것으로 관찰되었다. 회귀분석을 통해 기울기값을 산출하였을 때, 각 생물검정법 별로 1.6, 0.6, 0.5로서 농도에 대한 벼멸구의 반응은 근권침지법에서 가장 효과적인 것으로 나타났다(Fig. 2B)
최적 독성 평가 시기 설정
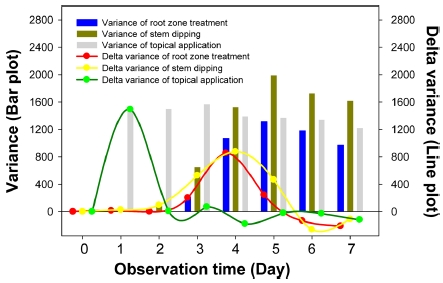
앞서 Fig. 1에서 생물검정법에 따라 벼멸구의 사충율 반응이 다른 것을 확인할 수 있었다. 따라서 각 처리 방법 별로 적합한 관찰 시간을 설정하는 것이 중요하다. 본 연구에서는 각 사충율의 분산값을 이용하여 분산차이가 가장 큰 구간을 벼멸구의 이미다클로프리드에 대한 농도 반응이 고르게 분포할 것으로 가정하고 측정하였다. 근권처리법과 줄기침지법은 벼멸구 접종 후 2-3일차부터 독성 반응이 나타나기 시작하는데, 분산차가 가장 높은 구간은 4일차로서 해당 방법은 4일차에 관찰하는 것이 적합한 것으로 나타났다. 미량국소처리법은 처리 후 1일차부터 가장 높은 분산차이를 보여 처리 후 1일차가 최적 관찰 시점인 것으로 나타났다. 결론적으로 사충율의 분산차이 분석은 생물검정법의 최적 관찰 시기 설정을 가능하게 한다.
감수성 계통과 저항성 계통의 저항성 비 비교
벼멸구 약제 감수성 계통과 이미다클로프리드 저항성 계통 간의 저항성 비를 24시간 간격으로 7일 동안 비교하여 보았다(Fig. 4, Table 3). 근권처리법에서는 3일차부터 7일차까지 저항성비가 4배, 40배, 56배, 75배 그리고 200배로 나타나 관찰 일자별로 저항성비가 증가하는 것으로 나타났다. 특히 4일차에서 6일차까지는 저항성 배수가 일정하였으나, 7일차부터 2배 이상 증가하였다. 줄기침지법에서는 1일차부터 15배, 18배, 82배, 108배, 152배, 154배 그리고 125배로 나타나 4일차부터 7일차까지저항성 배수가 2배 이하로 일정하였다. 마지막으로 미량국소처리법에서는 69배, 80배, 61배, 85배, 130배 그리고 275배로 나타나 1일차부터 5일차까지는 2배 이하로 안정적이였으나 6일차에 증가하였다. 각 생물검정법을 기준으로 저항성비 변동은 근권처리법에서는 40배, 줄기침지법에서는 108배, 그리고 미량국소처리법에서는 69배로 나타났다.

LC50 (ppb) by three different bioassay methods from the imidacloprid resistance strain in N. lugens.
결론적으로 최적 관찰 일자를 중심으로 반수치사농도가 2배 이하의 패턴을 보였으므로 해당 일자를 중심으로 저항성비를 측정하는 것이 적합함을 알 수 있었다.
고 찰
해충의 살충제에 대한 반응은 작용기작과 생물검정법에 따라 다르게 나타날 수 있다. 본 연구에서는 벼멸구와 이미다클로프리드 약제를 선정 후 3종류 생물검정방법에 의해 독성 반응이 다름을 확인하였다(Fig. 2). 이미다클로프리드는 네오니코티노이드계의 약제로서 곤충의 중추신경계에 니코틴계 아세틸콜린 수용체(nicotinic acetylcholine receptor)의 신경전달 작용을 막아 궁극적으로 신경전달물질인 아세틸콜린의 분비를 교란시켜 마비를 통해 곤충을 치사시키는 것으로 알려져 있다(Tomizawa and Casida, 2005). 특히, 귤나무이(Diaphorina citri)에서는 배설물량 측정 연구를 통해 이미다클로프리드가 섭식저해를 유발하여 독성을 일으키는 것으로 보고한 바 있다(Boina et al., 2009). 3종류 처리 방법별로 독성 반응을 비교하였을 때, 미량국소처리법에서는 처리 1일차부터 가장 빨리 효과가 나타났고, 근권처리법과 줄기침지법은 약 2-3일부터 독성 반응을 나타내기 시작했다. 이러한 독성 반응 시기가 다르게 나타나는 이유로는 미량국소처리법은 직접적으로 충의 큐티클에 접촉 후 투과하여 작용점에 전달되기 때문이며, 근권처리법은 뿌리를 통해 간접적으로 식물체 줄기로 이행되는데 시간이 걸림에 따라 반응이 접촉독 보다 상대적으로 늦기 때문이다. 줄기침지법은 접촉독과 섭식독이 동시에 나타날 수 있지만, 초기 처리 농도가 미량국소침지법보다 낮고 식물 체내 이행율이 낮아서 2-3일차부터 독성이 나타난 것으로 사료된다. 3종류의 생물검정법을 토대로 약량을 기반으로 한 독성 반응의 특성을 비교하면, 이미다클로프리드는 접촉독 보다는 섭식독에 의한 효과가 훨씬 우세한 것을 확인할 수 있었다(Fig. 1).
약제에 대한 생물반응을 조사하는데 있어서 해당 화합물과 생물검정법을 토대로 체계적인 최적 관찰 시기를 설정하는 것이 중요하다. 본 연구에서 최적 관찰 시기의 설정은 관찰 일자별 해당 농도의 사충율 분산차이를 통해서 결정하였다. 분산은 값들의 불규칙한 분포 정도를 나타내는 통계량으로서, 분산값이 크다는 것은 처리 농도별 사충율의 값이 저농도에서 고농도까지 다양하게 분포하고 있음을 의미한다. 근권처리법과 줄기침지법에서는 관찰 일자별 분산차의 변동이 3일차부터 나타나기 시작해서 4일차에서 가장 높았으며, 5일차부터는 분산차이가 감소하였다(Fig. 3). 미량국소처리법의 경우, 1일차부터 가장 높은 분산차를 보였으며, 2일차부터 7일차동안 일정하게 유지되는 것으로 나타나 처리 1일차에 사충율을 관찰하는 것이 적합함을 확인하였다(Fig. 3). 이러한 관찰시기 설정은 다양한 화합물에 대한 대상 해충의 적합한 생물검정법 선정 후 최적 독성 지표 산출에 적용이 가능할 것으로 사료된다.
저항성계통을 이용하여 관찰 일자별 저항성비의 변동을 생물검정법 별로 조사한 결과, 저항성비가 1-2배 정도 차이가 있었으며 관찰 일자가 7일차에 가까울수록 저항성비가 증가하는 것을 확인하였다(Fig. 4, Table 3). 6일차부터 저항성비가 증가하는 이유는 해당 생물검정법에서 농도별 사충율이 70%이상 편중되어 있어서 외삽에 의한 반수치사농도가 산출되었기 때문인 것으로 사료된다(Fig. 1). 반면에 최적 관찰 시점을 중심으로 1-3일은 생물검정법 별로 2배 미만의 저항성비를 보였으므로 최적 관찰시기가 저항성 비 평가에도 적합한 것으로 나타났다(Fig. 4).
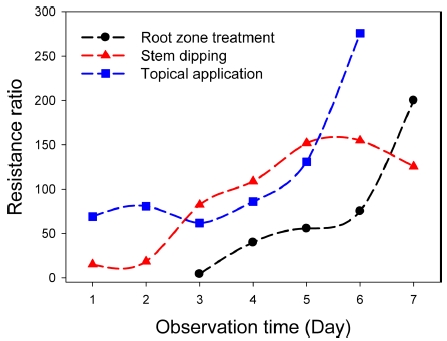
Resistance ratio between susceptible and imidacloprid resistance strain against imidacloprid by three different bioassay methods during 7 days.
생물검정법의 선정은 실험자에게 주어진 가용 시간, 경제성, 실험 목적에 의해 결정될 수 있다. 반수치사농도와 반수치사농도의 시간과 농도에 대한 회귀직선식을 고려해 보았을 때, 미량국소처리법은 단시간에 결과를 확인할 수 있으나 초기에 고농도가 요구되는 단점이 있고, 근권처리법의 경우 상대적으로 저농도의 약량이 요구되나 관찰 시점이 상대적으로 장시간 요구되는 단점이 있는 것으로 나타났다. 따라서 본 연구에서 제시한 다양한 농도에 해당하는 일자별 사충율, 회귀분석을 통한 기울기값, 농도별 사충율의 분산차이등은 최적 관찰 시간을 설정하는데 도움을 줄 뿐만 아니라 실험자가 경제성을 고려한 생물검정을 선정한 근거로도 활용할 수 있을 것이다.
References
-
Abbott, W., (1925), A method of computing the effectiveness of an insecticide, J. Econ. Entomol, 18(2), p265-267.
[https://doi.org/10.1093/jee/18.2.265a]

-
Boina, D. R., E. O. Onagbola, M. Salyani, and L. L. Stelinski, (2009), Antifeedant and sublethal effects of imidacloprid on Asian citrus psyllid, Diaphorina citri, Pest Manag. Sci, 65(8), p870-877.
[https://doi.org/10.1002/ps.1767]

-
Durmuşoğlu, E., A. Hatipoğlu, M. O. Gurkan, and G. Moores, (2015), Comparison of different bioassay methods for determining insecticide resistance in European Grapevine Moth, Lobesia botrana (Denis & Schiffermuller) (Lepidoptera: Tortricidae), Turk. Entomol. Derg, 39(3), p271-276.
[https://doi.org/10.16970/ted.93098]

- Dyck, V. A., and B. Thomas, (1979), The brown planthopper problem, Brown planthopper: Threat to rice production in Asia, International rice research institute, Philippines, p3-17.
- Finney, D., (1971), Probit Analysis, 3rd ed. Cambridge University Press, J. Pharm. Sci, 60, p1432-1432.
-
Garrood, W. T., C. T. Zimmer, K. J. Gorman, R. Nauen, C. Bass, and T. G. Davies, (2016), Field-evolved resistance to imidacloprid and ethiprole in populations of brown planthopper Nilaparvata lugens collected from across South and East Asia, Pest Manag. Sci, 72(1), p140-149.
[https://doi.org/10.1002/ps.3980]

- Heinrichs, E., S. Chelliah, S. L. Valencia, M. B. Arceo, L. T. Fabellar, G. B. Aquino, and S. Pickin, (1981), Manual for testing insecticides on rice, Int. Rice Res. Inst.
- Heong, K. L., K. H. Tan, C. P. F. Garcia, L. T. Fabellar, and Z. Lu, (2011), Research methods in toxicology and insecticide resistance monitoring of rice planthoppers, Int. Rice Res. Inst.
-
Liu, J., J. Zhang, X. Qin, Y. Chen, F. Yuan, and R. Zhang, (2013), Toxic effects of pymetrozine on the brown planthopper, Nilaparvata lugens (Stål) (Homoptera: Delphacidae), J. Entomol. Sci, 48(1), p17-22.
[https://doi.org/10.18474/0749-8004-48.1.17]

-
Matsumura, M., and S. Sanada-Morimura, (2010), Recent status of insecticide resistance in Asian rice planthoppers, Jpn. Agric. Res. Q, 44(3), p225-230.
[https://doi.org/10.6090/jarq.44.225]

-
Min, S. J, S. W. Lee, B.-R. Choi, S. H. Lee, and D. H. Kwon, (2014), Insecticide resistance monitoring and correlation analysis to select appropriate insecticides against Nilaparvata lugens (Stål), a migratory pest in Korea, J. Asia Pac. Entomol, 17(4), p711-716.
[https://doi.org/10.1016/j.aspen.2014.07.005]

- Paik, W. H., (1977), Historical review of the occurrence of the brown planthopper in Korea, The rice brown planthopper, Food and Fertilizer Technology Center for the Asian and Pacific Region, Taipei, p230-246.
- Paramasivam, M., and C. Selvi, (2017), Laboratory bioassay methods to assess the insecticide toxicity against insect pests-A review, J. Entomol. Zool. Stud, 5(3), p1441-1445.
-
Sparks, T. C., and R. Nauen, (2015), IRAC: Mode of action classification and insecticide resistance management, Pestic. Biochem. Physiol, 121, p122-128.
[https://doi.org/10.1016/j.pestbp.2014.11.014]

-
Tomizawa, M., and J. E. Casida, (2005), Neonicotinoid insecticide toxicology: mechanisms of selective action, Annu. Rev. Pharmacol. Toxicol, 45, p247-268.
[https://doi.org/10.1146/annurev.pharmtox.45.120403.095930]

-
Tsujimoto, K., S. Sugii, S. Sanada-Morimura, and M. Matsumura, (2016), A new method for monitoring the susceptibility of the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae), to pymetrozine by combining topical application and measurement of offspring number, Appl. Entomol. Zool, 51(1), p155-160.
[https://doi.org/10.1007/s13355-015-0374-3]