충북지역 한지형 마늘 재배지에서 뿌리응애 발생양상 및 살충제 감수성
초록
마늘 재배지에서 뿌리응애(R. robini)의 발생양상과 21종 살충제의 살충효과를 평가하였다. 뿌리응애 발생양상은 2015년부터 2017년까지 충북 5개지역에서 조사하였다. 뿌리응애 발생은 증평지역이 가장 높은 밀도를 나타내었으며, 단양, 보은, 청주, 제천 순으로 조사되었다. 마늘의 생육기 중 뿌리응애 발생양상은 3월 초순부터 수확기까지 점차 증가하는 양상을 나타내었다. 뿌리응애에 대한 21종 살충제의 방제효과는 권장농도로 처리하여 조사하였다. 실내 시험에서 약제 처리 3일 후 spirotetramt 22 SC, benfuracarb 30 WG, abamectin 1.8 EC, dimethoat 46 EC, milbemectin 1 EC가 92.8% 이상의 높은 살충효과를 나타내었다. 포장 방제효과는 benfuracarb 30 WG가 처리 후 10일, 20일차 모두에서 가장 높게 나타났으며, 그 외 spirotetramt 22 SC, benfuracarb 30 WG, abamectin 1.8 EC, dimethoat 46 EC 약제 모두 약제 처리 후 20일차에서 90% 이상의 방제효과가 조사되었다. 따라서 뿌리응애의 발생양상을 기준으로 방제시기를 설정하고, 방제효과가 높았던 약제들을 사용한다면 효율적인 뿌리응애 방제가 가능할 것으로 생각된다.
Abstract
This study was conducted to assess the seasonal occurrence, contact and ingestion toxicity of 21 insecticides on bulb mite in garlic fields. The density of the bulb mite population was surveyed from five districts in North Chungcheong Province between 2015 and 2017. Bulb mite population density was the highest in Jeungpyeong, followed by Danyang, Boeun, Cheongju and Jecheon in that order. The density of bulb mite populations during the growing season was increased from after early March to harvest. Insecticidal activities of 21 insecticides on the R. robini were evaluated at the recommended concentration. In laboratory testing, insecticidal activities of spirotetramt 22 SC, benfuracarb 30 WG, abamectin 1.8 EC, dimethoat 46 EC and milbemectin 1 EC showed above 92.8% at 3 days after treatment. Control efficacy was the highest at 10 days and 20 days after treatment with benfuracarb 30 WG, and the spirotetramt 22 SC, benfuracarb 30 WG, abamectin 1.8 EC, dimethoat 46 EC insecticides were more than 90% effective at 20 days after treatment. Therefore, it is thought that effective control of bulb mites can be possible by setting the period control based on the seasonal occurrence of bulb mites and using insecticides with high control efficacy.
Keywords:
Control efficacy, insecticidal activity, occurrence, Rhizoglyphus robini키워드:
방제효과, 살충효과, 발생양상, 뿌리응애서 론
국내에서 재배되는 마늘은 기후와 풍토에 적응되어온 생태형 품종으로 분화되어 추운 지역에서 재배되는 한지형 마늘과 따뜻한 지역에서 재배되는 난지형 마늘로 나뉜다(Hwang, 1993). 따라서 난지형 마늘 재배지역은 한지형 마늘 재배지역보다 평균기온이 높기 때문에 해충의 발생 및 피해가 주로 보고되고 있으며, 그 중에 뿌리응애에 대한 연구가 대다수를 차지한다(Choi et al., 1998; Na et al., 1998).
뿌리응애(Rhizoglyphus robini Claparede)는 응애목(Acarina) 가루응애과(Acaridae) Rhizoglyphus 속에 속하며 주로 파속작물인 마늘, 파, 양파 등과 구근류인 백합, 튤립 등에 피해를 주는 해충으로 국내에 널리 분포되어 있다(Diaz et al., 2000). 특히 마늘에서는 지하부의 뿌리와 인경을 가해하여 직접적인 1차 피해를 입히며 피해를 입은 부위가 썩게 되면서 고자리파리, 세균, 곰팡이 같은 병원체에 의한 2차 피해가 나타난다(Gerson et al., 1981).
마늘재배 시 가장 피해가 큰 해충인 뿌리응애의 발생지역은 난지형 마늘재배지인 전남지역 고흥과 무안 등에서 주로 발생이 많았으며 발생시기는 10월 파종기부터 발생하여 월동 후 4월부터 급격하게 밀도가 증가하는 발생양상이다(Choi, 1988). 국내 마늘주산단지의 저장마늘에서도 뿌리응애 감염율이 1994년 63%로 저장마늘에서도 뿌리응애가 발생이 심한 것으로 보고하였다(Na et al., 1988). 하지만 중부지역 한지형 마늘재배지에서의 뿌리응애 발생양상은 아직까지 연구된 바가 없어 뿌리응애를 방제하는데 농가에서 많은 어려움을 겪고 있다.
국내 마늘에서 발생하는 뿌리응애를 대상으로 등록된 방제약제는 21품목이 있으며, 그 중 주로 사용되어지고 있는 합성피레스로이드 계통과 유기인계 계통이 9종으로 등록농약의 43%를 차지하고 있다(KCPA, 2018). 하지만 유기인계 계통 약제의 지속적인 사용은 유기인계 계통에 대한 뿌리응애의 저항성 발달을 유도하여 방제에 어려움을 초래하며, 지속적인 뿌리응애 방제를 위한 수단으로 타 계통간의 교호 살포가 필요하다(Kuwahara, 1988; Kuwahara et al., 1991; Chen and Lo, 1990).
따라서 국내 중부지역 한지형 마늘재배지에서 뿌리응애 발생양상을 조사하고 계통별 약제의 살충력을 검정하고 우수 방제약제를 선발하여 뿌리응애에 대한 방제전략을 수립하는데 기여하고자 본 연구를 수행하였다.
재료 및 방법
발생밀도 조사
마늘 생육기에 발생하는 뿌리응애 밀도를 조사하기 위하여 충북 5개지역(단양군, 보은군, 제천시, 증평군, 청주시)한지형 마늘 재배농가 15곳을 선정하였으며, 2015년부터 2017년까지 3년간 월동 후인 3월 초순부터 6월 중순 수확기까지 10일 간격으로 수행하였다. 밀도조사는 포장을 5구획으로 나눈 후 구획별 피해받은 마늘 5주씩 총 25주를 채취하였으며, 실험실내에서 Fan and Zhang (2003)이 제시한 형태를 기준으로 실체현미경하(Olympus BX53, Olympus, Japan)에서 동정한 후 밀도를 조사하였다.
시험곤충
뿌리응애는 충북 단양지역 마늘 재배지에서 2017년부터 2018년까지 2년간 마늘 생육초기인 4월경 생육이 좋지 않은 마늘 위주로 시료를 채취하여 실험실 내 실체현미경하(Olympus BX53, Olympus, Japan)에서 관찰하였다. 관찰 시 발견된 뿌리응애를 수집하였으며, 지역구분 없이 플라스틱 사육용기(21 × 8 × 7.5 cm)에서 마늘 인편을 먹이로 주며 사육한 후 성충과 약충을 실험에 사용하였다. 사육 조건은 온도 25 ± 1oC, 광주기 16L:8D, 상대습도 65 ± 5%였다.
시험약제
마늘 생육기 중 관주 처리가 가능한 등록약제 6종(benfuracarb WG, carbosulfan SC, clothianidin SC, dimethoate EC, fenitrothion EC, hexythiazox WP)과 등록되지 않은 약 제 15종(abamectin EC, acrinathrin SC, azocyclotin WP, abamectin+thiamethoxam SC, bifenthrin WP, chlorfenapyr SC, cyenopyrafen SC, cyflumetofen SC, emamectin benzoate EC, etoxazole SC, fenpropathrin EC, milbemectin EC, spirodiclofen WP, spirotetramat SC, tebufenpyrad EC)을 선발하여 사용하였다. 등록되지 않은 약제 선발기준은 기존 타작물 응애류에 등록이 많이 되어 있는 약제와 약제의 살충제 작용기작 계통을 기준으로 선발하였다. 사용된 살충제에 대한 유효성분량, 제형 및 추천농도는 Table 1과 같다(KCPA, 2018).
살충효과 실내검정
뿌리응애의 실내 살충활성 검정은 약제의 접촉독성을 조사하였다. 시험에 사용된 뿌리응애는 실체현미경하(Olympus BX53, Olympus, Japan)에서 부드러운 붓으로 성충만을 선택하여 한 마리씩 Insect breeding dish (50 × 15 mm, SPL 310050®)에 접종하였다. 약제 처리는 추천 배수로 희석된 약제를 공시충이 충분히 젖을 때까지 분무용 스프레이(3.5 cm × 11.3 cm)를 이용하여 10회(5 ml) 살포하였다. 약제 처리된 뿌리응애 성충은 약제가 묻지 않은 동일한 크기의 Insect breeding dish에 상토를 1 cm 정도 깔고 증류수로 상토를 충분히 적신 후 접종하였으며, 먹이로는 약제처리 되지 않은 마늘 인편을 공급하였다. 접종 후 3일, 7일 후 사충수를 실체현미경하(Olympus BX53, Olympus, Japan)에서 조사하였다. 뿌리응애는 현미경 내에서 이동반경이 넓어 움직임이 활발하기 때문에 약제 처리 후 살충효과의 사망 기준은 붓으로 건드렸을 때 다리가 움직이지 않으면 사망한 것으로 판단하였다. 모든 시험은 4반복으로 수행하였으며 사충율(%)은 사충수/총 마리수 × 100로 산출하였다.
방제효과 포장검정
실내 검정에서 살충효과가 우수했던 약제 4종에 대하여 포장 내 방제효과를 조사하였다. 포장검정은 충북농업기술원 마늘연구소 내 전년도 10월 20일에 파종한 한지형 마늘 단양종을 파종한 사양토 재배포장에서 수행하였다. 처리약제는 뿌리응애 밀도가 반복당 50마리를 초과하였을 때인 4월 13일에 처리하였으며, 실내검정과 동일한 배수로 희석하여 토양 내 마늘 뿌리까지 묻도록 관주 처리하였다. 무처리구는 동일한 방법으로 물만 처리하였다. 약제처리일인 4월 13일 전일에는 비가 오지 않았고 약제처리 22시간 후인 14일 아침 7시부터 시간당 0.5 mm의 비가 3시간정도 내렸다. 시험구는 처리구당 20 m2씩 난괴법 3반복으로 수행하였다. 방제효과 조사는 약제 처리전과 처리 10일과 20일 후 각각 2회 조사하였다. 조사방법은 포장 내 마늘을 채취하여 실험실 내 실체현미경하(Olympus BX53, Olympus, Japan)에서 조사하였으며, 실내검정과 동일한 방법으로 사망 유무를 판단하여 생충수를 조사하였다. 방제가(control value, %)는 무처리 대비 [(무처리구 뿌리응애 마리수-처리구 뿌리응애 마리수)/무처리구 뿌리응애 마리수] × 100으로 산출하였다. 모든 처리의 반복 당 조사 주수는 10주로 하였다.
자료분석
약제별 실내 살충효과와 포장 방제효과 비교는 PC용 통계패키지인 MYSTAT (Systat software Inc., ChicagoIL, USA)를 이용하여 Duncan’s Multiple Range Test (DMRT)로 분석하였다.
결과 및 고찰
뿌리응애 발생현황
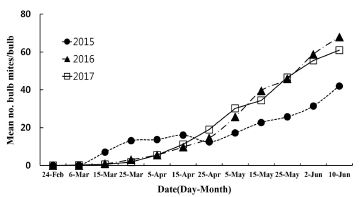
충북지역 한지형 마늘 재배지에서 2015년부터 2017년까지 뿌리응애 발생밀도를 조사한 결과(Fig. 1) 마늘 파종 후인 11월부터 1월까지는 발생하지 않았으며(data not show), 월동 후 3월 상순경부터 발생이 시작되어 6월 중순 수확기까지 점진적으로 밀도가 늘어가는 양상을 나타내었다. 가장 높은 밀도를 나타낸 시기는 수확 전 마지막 조사일인 6월 10일이었으며, 구당 42.0마리 이상 발생하였다. 한지형 마늘주 재배 지역별 발생 양상은 모든 지역에서 마늘의 수확기로 갈수록 밀도가 점차 높아지는 경향을 나타내었다(Fig. 3). 조사기간 중 가장 밀도가 높은 시기인 6월 10일경 청주지역에서 구당 100.0마리로 가장 발생이 많았으나, 제천지역에서는 구당 21.3마리로 가장 발생이 적었다. 조사기간 중 뿌리응애 발생이 낮았던 제천지역은 3년 모두 3월 하순부터 발생이 시작되어 점점 밀도가 높아져 2015년 6월 10일에 구당 55.5마리가 발생하였다. 단양지역에서는 3월 상순부터 구당 0.1마리로 낮게 발생하기 시작하여 수확기인 6월 상순경 2015년부터 2017년까지 각각 구당 44.5, 85.0, 66.9마리의 뿌리응애가 발생하였다. 증평지역에서는 2016년과 2017년은 3월 중순부터 발생이 시작되어 점차 밀도가 높아졌으며, 2017년 6월 10일에 가장 높은 밀도인 구당 78.5마리가 발생하였다. 청주지역은 2015년에 구당 32.5마리로 낮게 발생하였지만 2016년과 2017년도에는 5월 상순부터 급격하게 발생이 증가하여 수확기에는 각각 구당 100.0, 78.5마리가 발생하였다. 보은지역에서는 뿌리응애 발생이 2015년에는 3월 상순이었고, 이 후 3월 하순까지 발생이 증가하다가 5월 상순까지 다시 감소하는 경향을 보였다. 하지만 6월 상순부터 다시 발생이 증가하였다. 이러한 발생양상은 남부지역 고흥군 난지형 마늘에서 뿌리응애 밀도가 마늘 월동 후인 3월 상순부터 수확기까지 점차 밀도가 증가하는 결과와 일치한다(Choi et al., 1988). 하지만 난지형 마늘에서는 뿌리응애가 마늘 파종 직후인 10월과 11월에도 낮은 밀도로 발생하는 것으로 보고되어져 있다(Choi et al., 1988). 마늘은 지역별 기후에 따라서 생태형이 한지형과 난지형 마늘로 구분되어져 있어(Hwang et al., 2009) 추운 지역인 중부이북지역은 한지형 마늘, 남부지역은 난지형 마늘의 재배가 되어 왔기 때문에 난지형 마늘의 파종이 한 달 정도 빠르며 기온도 더 온화하여 마늘 파종 후부터 월동 전까지 뿌리응애가 발생하는 것으로 생각된다(Choi, 1988), 국내 발생현황 연구로는 Choi (1988)가 전남지역 마늘 재배 단지별로 토양 내밀도조사를 한 결과 파종기인 10월 상순부터 12월까지 증가하였으며, 월동 후 다시 4월 상순부터 지속적으로 밀도가 증가하여 수확기까지 증가하는 양상으로 본 연구결과와 비슷한 경향을 나타내었다.
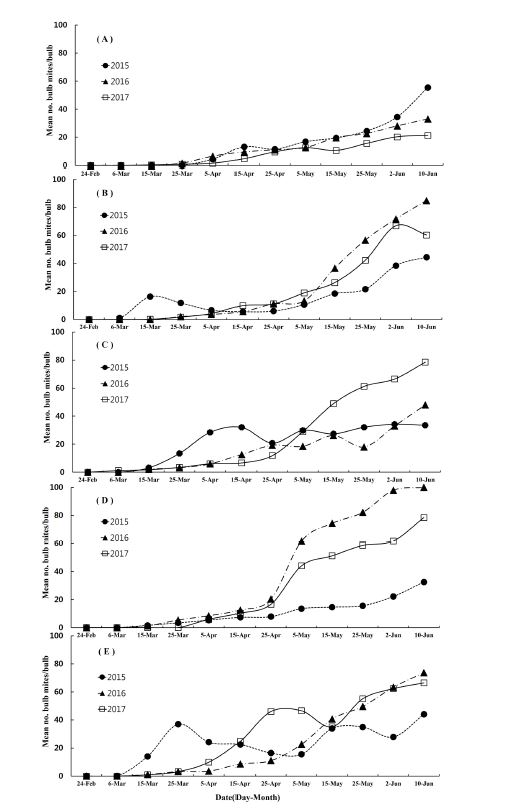
Density of Rhizoglyphus robini on northern garlic in Chungbuk area, A: Jechun, B: Danyang, C: Chongju, D: Jeungpyeong E: Boeun.
뿌리응애 실내 살충효과
뿌리응애의 살충효과를 비교하기 위하여 응애류에 대하여 시판되고 있는 약제들을 추천농도(ppm)로 희석하여 실내 검정하였다(Table 2). 각각의 추천농도로 약제 처리 후 3일차 조사에서 가장 살충효과가 높았던 약제는 benfuracarb로 88.4%의 살충율을 나타났으며, tebufenpyrad가 88.0%, milbemectin이 87.6%, dimethoate와 spirotetramat가 각각 86.8%, 86.4%로 조사되었다. 약제처리 후 7일차 조사에서는 spirotetramat가 가장 높은 95.4%의 살충효과가 나타났으며, benfuracarb와 abamectin이 각각 93.2%, 93.0%로 조사 되었고, dimethoate와 milbemectin이 동일하게 92.8%의 높은 살충효과가 나타났다. 본 실내검정에서 효과가 좋았던 abamectin은 점박이응애 암컷성충에 대하여 5 ppm 약제 처리 후 48시간 조사에서 100%의 살충효과를 보이는 것으로 보고된바 있다(Hoy and Cave, 1985).
뿌리응애 포장 방제효과
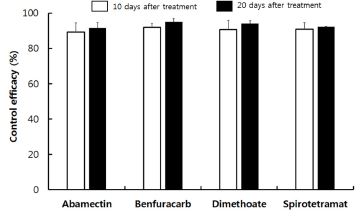
실내 검정에서 살충효과가 높게 나타난 4가지 약제에 대하여 포장 조건하에서 방제효과를 조사하였다(Table 3). 4가지 약제의 토양 방제효과는 약제를 토양 관주처리 한 후 10일차에서 benfuracarb가 91.9%로 가장 높게 조사 되었으며 나머지 3가지 약제도 90% 전후로 높게 나타났다. 약제 처리 후 20일차에서도 benfuracarb가 95.0%의 가장 높은 방제효과를 나타내었으며, 약제 처리 후 시간이 지남에 따라 방제효과는 높아지는 경향을 나타내었다. 뿌리응애에 대한 방제 시험으로는 마늘 생육초기인 4월 중순경 약제를 관주처리 하였을 때 본 실험에서 사용된 dimethoate의 방제효과는 약제 처리 후 17일차에서 81.4%, 75일차에서 86.2%로 조사되었다(Choi and Lee, 1987). 하지만 뿌리응애 방제를 위하여 dimethoate와 benfuracarb 같은 유기인계와 카바메이트계 계통의 지속적인 약제사용은 저항성을 발달시키는 것으로 알려져 있다(Kuwahara, 1986). Kuwahara (1988)는 dimethoate에 대한 뿌리응애의 저항성 정도를 조사한 결과 감수성 계통 대비 낮은 지역은 2.2배, 가장 높은 지역은 427배에 이르는 것으로 보고하였으며, Chen and Lo (1990)의 결과에서도 감수성 계통과 대비하여 4.5배부터 1,454배에 이르는 매우 높은 저항성 발달을 보고하였다. 이러한 저항성 발달을 억제하기 위해서는 뿌리응애 방제 시 유기인계 및 카바메이트계의 연속사용을 최소화 하고 타계통 약제를 이용하여 교호살포 하는 것이 필요할 것으로 생각되며, 본 실험에서 사용된 테트로이드 계통인 spirotetramat과 항생제 계통인 abamectin과 같은 약제를 적용시킬 수 있을 것으로 생각된다. 테트로이드 계통인 spirotetramat는 acetyl-CoA carboxylase를 저해하여 살충효과가 나타나는 것으로 알려져 있으며(Nauen, 2005), 이러한 작용점은 귤녹응(Panonychus citri)에 10 ppm을 처리 시 방제효과가 100%로 보고된 바 있다(Ouyang et al., 2012). 또한 점박이응애(Tetranychus urticae) 암컷성충에 200 ppm 처리 시 99.5%의 살충효과와 산란력을 93% 저하시킨다고 보고하였다(Nauen, 2005). 항생제 계통으로 살충효과가 높게 조사된 abamectin은 이미 많은 응애류 방제시 사용되고 있는 약제로 차응애(T. kanzawai)에 110 ppm 농도를 처리 후 14일차에서 93.5%의 높은 방제효과가 있으며, 점박이응애(T. urticae)에 0.6 ppm으로 처리시 24시간 후에 90.0%의 살충효과가 보고되어 있다(Park et al., 1995; Chung et al., 2014).
따라서 기존에 마늘 등록약제로 등록되어 있는 유기인계와 카바메이트계인 dimethoate와 benfuracarb와 함께 본 실험에서 방제효과가 매우 높게 나타난 다른 두 계통인 abamectin과 spirotetramat을 교호살포 할 경우 뿌리응애의 저항성 발달을 억제하여 농약처리 회수를 낮추고 사용량을 줄여 생산비와 경제적 피해를 최소화 할 수 있을것으로 생각되어 추후 두 약제를 포함한 타계통 약제들의 약제등록이 지속적으로 추가되야 될 것으로 생각된다.
Acknowledgments
이 논문은 농촌진흥청 지역농업연구기반 및 전략작목육성 지역특화기술개발과제(PJ0126312019)의 지원에 의하여 이루어진 것입니다.
References
- Chen, J. S., and K. C. Lo, (1990), Toxicity of organophosphorus insecticides to Diaziono-reversely-selected, pesticide-pressure-relaxed and field-resistant strains of bulb mite Rhizoglyphus robini (Acari: Acaridae). Exp. Appl, Acarol, 8(4), p243-252.
- Choi, I. H., and H. R. Lee, (1987), Control of Rhizoglyphus robini in garlic, Res. Rep. RDA, p51-52.
- Choi, C. S., I. S. Park, and J. H. Lee, (1988), Studies on the ecology and the control method of the bulb mite Rhixoglypus echinopus, F.&R. Res. Rept. RDA, 30(2), p14-19.
- Chung, S. O., H. J. Kim, S. D. Bae, S. A. Jang, and C. G. Park, (2014), Efficacy of acaricides and insecticides to Tetranychus kanzawai and Aphis egomae, J. Agri. Life Sci, 48(5), p1-8.
- Diaz, A., K. Okabe, C. J. Eckenrode, M. G. Villani, and B. M. OConnor, (2000), Biology, ecology, and management of the bulb mites of the genus Rhizoglyphus (Acari:Acaridae), Exp. Appl. Acarol, 24(2), p85-113.
- Fan, Q. H., and Z. Q. Zhang, (2003), Rhizoglyphus echinophus and Rhizoglyphus robini (Acari: Acaridae) from Australia and New Zealand: identification, host plants and geographical distribution, Systematic & Applied Acarology Special Publications, 16(1), p1-16.
-
Gerson, U., Yathom, S., and J. Katan, (1981), A demonstration of bulb mites control by solar heating of the soil, Phytoparasitica, 9, p153-155.
[https://doi.org/10.1007/bf03158459]

- Hwang, J. M., (1993), Genetic diversity and classification of garlic cultivars by multivariate analysis, J. Kor. Soc. Hort. Sci, 34(4), p257-264.
- Hwang, J. M., H. T. Ha, and H. S. Choi, (2009), Field performance of seed garlic on cultivars collected from the different growing regions, Kor. J. Hort. Sci. Technol, 27(4), p567-571.
-
Hoy, M. A., M. A. F. E. Cave, (1985), Laboratory evaluation of avermectin as a selective acaricide for use with Metaseiulus occidentalis (Nesbitt) (Acarina: Phytoseiidae), Exp. Appl. Acarol, 1(2), p139-152.
[https://doi.org/10.1007/bf01270593]

- KCPA, (2018), User’s manual of pesticides, Korea crop protection association, 1, p558.
- Kuwahara, M., (1986), Resistance of the bulb mite, Rhizoglyphus robini Claparede (Acarina: Acaridae), to insecticides, I. resistance patterns to organophosphorus insecticides. Jpn. J. Appl. Entomol, 30(4), p290-295.
- Kuwahara, M., (1988), Resistance of the bulb mite, Rhizoglyphus robini Claparede to organophoshorus insecticides, J. Appl. Entomol, 22, p96-100.
- Kuwahara, M., Y. Jonno, and T. Shishido, (1991), Mechanism of fenitrothion resistance in the organophosphate-resistant bulb mite, Rhizoglyphus robini Claparede (Acarina: Acaridae). Appl. Ent, Zool, 26(2), p205-214.
- Na, S. Y., M. R. Jo, D. S. Kim, K. W. Park, J. G. Woo, and K. T. Kim, (1998), Survey on the pests of stored garlic, Korean J. Appl. Entomol, 37(1), p65-71.
-
Nauen, R., (2005), Spirodiclofen: mode of action and resistance risk assessment in tetranychid pest mites, J. Pestic. Sci, 30(3), p272-274.
[https://doi.org/10.1584/jpestics.30.272]

-
Ouyang, Y., G. H. Montez, L. Liu, and E. E. Grafton-Cardwell, (2012), Spirodiclofen and spirotetramat bioassays for monitoring resistance in citrus red mite, Panonychus citri (Acari: Tetranychidae), Pest Manag. Sci, 68(5), p781-787.
[https://doi.org/10.1002/ps.2326]

- Park, C. G., M. H. Lee, J. K. Yoo, J. O. Lee, and B. R. Choi, (1995), Relative toxicity of abamectin to the predatory mite Amblyseius womersleyi Schicha (Acari: Phytoseiidae) and twospotted spider mite Tetranychus urtica Koch (Acari: Tetranychidae), Korean J. Appl. Entomol, 34(4), p360-367.