농산물 중 신규 등록 농약 pydiflumetofen의 잔류 분석을 위한 QuEChERS 방법 적용
초록
이 연구는 LC-MS/MS와 QuEChERS 방법을 이용한 농산물 중 신규 등록 농약인 살균제 pydiflumetofen의 잔류농약 분석법을 확립하기 위하여 수행하였다. 먼저 추출 방법을 확립하기 위하여 각각의 농산물을 acetatebuffering 방법(AOAC Official Method 2007.01법)과 citrate-buffering 방법(EN 15662법)으로 추출한 후 회수율을 산출하였으며, 모두 71.7-113.5%의 유효한 회수율을 보여 두 방법 모두 농산물 중 pydiflumetofen을 추출하기 적합한 것으로 판단되었다. 시료의 정제는 dispersive-SPE 방법을 이용하였으며, 흡착제의 종류와 조성을 달리한 6가지의 d-SPE tube (25 mg PSA, 25 mg PSA+25 mg C18, 25 mg PSA+2.5 mg GCB, 50 mg PSA, 50 mg PSA+50 mg C18 and 50 mg PSA+50 mg GCB)를 이용하여 정제하였다. 그 결과 모든 조성에서 70-120%의 우수한 회수율을 보였지만 50mg의 GCB가 들어있는 d-SPE tube를 이용하여 정제한 경우는 저조한 회수율을 보였다. 이러한 결과는 chlorophyll 등의 색소와 비극성 탄소화합물을 제거하는데 효과적인 GCB에 시험농약인 pydiflumetofen이 흡착되어 저조한 회수율을 보인 것으로 판단되었다. 또한 기기분석 과정에서 생기는 matrix effect를 조사한 결과 대부분 낮은 수준의 matrix effect (-20%<ME%<20%)를 보였지만 현미와 대두 일부 시료에서 중간 수준의 matrix effect (-50%<ME%<-20% 또는 20%>ME%>50%)를 보였다. 결론적으로 농산물 중 pydiflumetofen을 분석하기 위해서 LC-MS/MS를 이용한 QuEChERS 방법을 적용할 수 있을 것으로 판단되었지만 matrix effect를 고려하면 matrix matched standard calibration을 이용하여 정량하는 것이 바람직하다고 판단되었다.
Abstract
This study was carried out to determine analytical method for the residual pesticide of new fungicide pydiflumetofen in agricultural products using QuEChERS method with LC-MS/MS. In order to optimize extraction method, recoveries of pydiflumetofen in agricultural products were calculated after extraction using acetate-buffering (AOAC Official Method 2007.01) and citrate-buffering (EN 15662) methods. Those were found to be 70-120%, efficiently, indicating that two methods were suitable to extract pydiflumetofen in agricultural products. Purification of samples was used by different sorbents compositions (25 mg PSA, 25 mg PSA+25 mg C18, 25 mg PSA+2.5 mg GCB, 50 mg PSA, 50 mg PSA+50 mg C18 and 50 mg PSA+50 mg GCB). As results, recoveries ranged from 70 to 120% were found to be great under all sorbents. However, recovery of purified pydiflumetofen using d-SPE tube containing GCB of 50 mg was found to be low. That is because test pesticide, pydiflumetofen, was adsorbed to GCB removing pigment like a chlorophyll and non-polar hydrocarbon compound. The matrix effect has been calculated to survey the effect during ionization of the analyte in the MS detector. The matrix effects of the instrumental analysis process were mostly low, but showed a moderate matrix effect in some samples of brown rice and soybean. Finally, in order to analyze residual pesticide of pydiflumetofen in agricultural products, modified QuEChERS method with LC-MS/MS can be applied. However, it is suitable to quantify amount of pesticide using matrix matched standard calibration considering results of matrix effects.
Keywords:
Pydiflumetofen, 잔류농약, LC-MS/MS, QuEChERS, matrix effect키워드:
Pydiflumetofen, pesticide residue, LC-MS/MS, QuEChERS, matrix effect서 론
잔류농약 분석은 1960년대 저지방 식품 중 유기염소계 살충제와 비극성 농약을 대상으로 Mills에 의해 최초 고안되었다. 이 방법은 수분이 다량 함유된 채소류와 과실류는 acetonitrile로 추출하고 건조 시료(hays, grains, feedstuff)는 물과 acetonitrile을 혼합하여 추출한 후 비극성 용매인 petroleum ether, dichloromethane 및 n-hexane을 이용하여 액액분배 하였으며, Florisil을 이용한 chromatography 방법으로 정제하여 잔류농약을 분석하였다(Mills et al., 1963; Wessel, 1967). 이후 유기인계 농약을 분석하기 위하여 산이 첨가된 charcoal을 이용한 정제법이 개발되었으며(Storherr et al., 1971), 다양한 극성의 농약을 분석하기 위하여 acetone으로 시료를 추출하고 sodium chloride를 첨가하여 액액분배의 효율 향상을 도모하였다(Wilkowska and Biziuk, 2011). Luke et al. (1975)은 다양한 GC system의 선택성을 이용하여 정제 과정을 최소화하려는 연구를 시도하였으며, 이러한 것들이 현재 잔류농약 분석의 근간이 되고 있다. 예를 들면 질소와 인을 선택적으로 검출할 수 있는 GC-NPD 및 형광물질을 포함하고 있는 화합물을 선택적으로 검출할 수 있는 HPLC-FLD 등이 개발 및 보급되면서 정제 과정이 간소화되었다. 또한 잔류농약을 분석하는 과정에서 다량의 chlorinated solvent를 사용하였지만 이러한 용매의 발암 가능성이 제기됨에 따라 분석과정에서 사용량을 줄이는 연구가 시도되었다(Lynge et al., 1997; Wilkowska and Biziuk, 2011). 그 후 acetone으로 희석된 추출물을 SPE (solid phase extraction)를 이용하여 분석하는 방법이 고안되어 액액분배 과정을 생략 할 수 있게 되었지만(Casanova, 1996) 추출 과정에서 다량의 acetone을 사용할 수밖에 없었다. 이후에 Mills method에 근간하여 물과 비극성 용매의 분리를 위하여 추출과정에서 MgSO4 또는 NaCl을 첨가한 후 acetonitrile로 추출한 후역상 SPE를 사용한 정제가 시도되었으며(Lee et al., 1991), 이 방법은 다양한 정제법을 연구하는 기초가 되었다(Fillion et al., 2000). 그 밖에도 microwave-assisted extraction(MAE), accelerated solvent extraction (ASE), matrix solidphase dispersion (MSPD), solid-phase microextraction (SPME) 및 supercritical fluid extraction (SFE) 등 다양한 추출법이 고안되었다(Camel, 2000; Ramos et al., 2002; Barker, 2000; Wandencki et al., 2004; Ling and Teng, 1997). 이렇게 발전한 잔류농약 분석 방법은 현재까지도 많이 이용되고 있지만(Wilkowska and Biziuk, 2011) 다량의 유기용매를 사용하기 때문에 폐기물 처리에 문제가 발생하고 분석에 많은 시간과 노동력을 투입하면서 많은 비용이 소모된다는 단점이 있기 때문에(Beyer and Biziuk, 2008) 연구자들은 최소한의 용매를 이용하여 신속하고 정확한 잔류농약 분석을 위해 여러가지 방법을 시도하였다.
현재에는 식품과 환경시료 중 잔류농약 분석에 사용되는 용매의 양을 최소화하고 분석 시간을 단축하면서 효율적이고 신속한 분석법을 개발하는데 집중되어 있으며, 이러한 취지에 맞는 QuEChERS (quick, easy, cheap, effective, rugged and safe)방법이 Anastassiades et al. (2003)에 의해 고안되었다. 이 방법은 시료를 acetonitrile로 추출하고 MgSO4를 이용하여 시료 중 물과 추출용매를 분리하고 primary secondary amine (PSA) 등의 흡착제를 이용한 분산고상추출법(dispersive-solid phase extraction, d-SPE)으로 시료를 정제하여 고감도 분석 장비인 GC-MS/MS와 LC-MS/MS로 분석하는 방법이다(Wilkowska and Biziuk, 2011). d-SPE방법에 사용되는 PSA는 다양한 극성을 가진 유기산, 극성을 가진 색소 그리고 수소의 당과 지방을 제거하는데 사용된다. GCB(graphitized carbon black)는 sterol과 chlorophyll과 같은 색소를 제거하는데 사용되며, C18은 lipid와 같은 비극성 물질을 제거하는데 사용된다(Martin et al., 2017).
이 연구를 위한 살균제 농약인 pydiflumetofen ([3-(difluoromethyl)-N-methyl-N-[1-methyl-2-(2,4,6-trichloro phenyl)ethyl]-1H-pyrazole-4-carboxamide])은 succinate dehydrogenase inhibitor로 Syngenta에서 개발한 신규 살균제이다(Duan et al., 2019). 이 농약은 식물 곰팡이 병원균의 호흡을 저해하여 식물 균류의 질병을 효과적으로 방제하는 새롭게 개발된 살균제로 잿빛 곰팡이병, 균핵병 및 점무늬병에 효과가 우수한 것으로 알려져 있으며(Avenot and Michailides, 2010; Hou et al., 2017), 기존의 살균제에 비하여 효과가 우수하여 농약 사용량을 획기적으로 줄여준다는 보고가 있다(Duan et al., 2019). Pydiflumetofen은 전세계적으로 채소류, 과실류 및 곡류 등에 등록되어 사용되고 있으며, 국내에도 방제용 농약 사용을 위한 등록 절차가 진행되고 있으므로 신속 정확한 잔류농약 분석법 확립이 필요하다.
따라서 이 연구는 QuEChERS 방법을 이용한 농산물 중 pydiflumetofen의 신속 분석법을 확립하여 농산물 중 잔류 농약의 안전성 확보에 기여하기 위하여 수행되었다.
재료 및 방법
대상 농약 및 농산물
대상 농약은 살균제 pydiflumetofen이었으며, 시험 작물은 국민영양통계 조사 결과 다소비 식품 30선(KHIDI, 2016) 중 농산물만 검토한 후 식품분류의 분포도를 고려하여 쌀, 대두, 사과, 고추, 감귤, 배추를 선정하였다. 쌀의 경우 잔류 농약 분석에서는 현미로 분석하기 때문에 현미에 대하여 분석법을 확립하였다. 무처리 시료는 친환경 농산물 판매소에서 구입하였으며, 무처리 시료에 시험 농약이 검출되지 않음을 확인한 후 사용하였다.
시약 및 재료
Pydiflumetofen 표준품의 순도는 99.4%이었으며, 신젠타 코리아에서 분양받아 사용하였다. 시료를 추출하고 기기분석에 사용된 acetonitrile은 Merck사(Darmstadt, Germany)의 PR (pesticide residue)등급을 사용하였으며, LC의 이동상으로 사용된 formic acid는 Sigma-Aldrich사(Massachusetts, USA)의 제품을 이용하였다. 잔류농약 분석 과정에서 사용된 QuEChERS 추출 pouch와 d-SPE tube는 Agilent사(California, USA)의 제품을 사용하였으며, 원심분리기와 추출기는 각각 한일과학산업㈜사(Incheon, Korea)의 combi-514R 제품과 SPEX사(New Jersey, USA)의 1600 MiniG 제품을 사용하였다.
표준용액 조제
Pydiflumetofen의 표준품을 약 20.12 mg을 칭량하여 20mL의 acetonitrile로 용해하여 1,000 mg/L의 stock solution을 조제하였으며, 이를 LC gradient grade acetonitrile로 희석하여 100, 50, 25, 10 및 5 mg/L의 working solution으로 조제하였다. 검량선 작성용 표준용액을 조제하기 위하여 0.01, 0.02, 0.04, 0.1, 0.2 및 0.4 mg/L의 농도로 되도록 acetonitrile을 이용하여 희석하였으며, 무처리 시료를 추출한 용액과 acetonitrile로 각각 2배 희석하여 0.005, 0.01, 0.02, 0.05, 0.1 및 0.2 mg/L의 matrix matched standard와 pure standard를 조제하였다.
기기분석 조건
Pydiflumetofen은 분자 구조 내에 3개의 chlorine와 2개의 fluorine이 포함되어 있으며, 카보닐기에 탄소 사슬이 결합되어 있는 ketone 구조이기 때문에 GC-ECD로 분석이 가능하다. 또한 분자 구조 내에 3개의 질소가 포함되어 있어 GC-NPD로도 분석이 가능할 것으로 판단되었지만 신속 분석법을 확립하기 위하여 LC-MS/MS를 분석 장비로 선정하였다(Rong et al., 2018). 분석에 사용한 LC는 AB SCIEX사(미국)의 Exion LCTM이었으며, tandem mass spectrometer는 AB SCIEX TRIPLE QUADTM 5500 모델을 사용하였다. 시료 중 화합물을 분리하기 위하여 비극성과 극성물질을 효과적으로 분리할 수 있는 ODS (octadecyl-silica) 역상 column인 Advance materials technology사(미국)의 Halo C18 (2.1 mm I.D. × 150 mm L., 2.7 μm)을 사용하였다. 이동상은 protonation enhancer로 작용하는 formic acid를 증류수와 methanol에 첨가하여 0.1%의 농도가 되도록 조제하여 사용하였으며, 분석용 시료는 1 μL씩 주입하여 잔류농약을 분석하였다. 또한 시험 농약의 선택성과 감도 향상을 위하여 MRM (multiple reaction monitoring) mode로 분석하였으며, MRM 조건을 확립하기 위하여 표준용액 10 μg/kg을 infusion mode로 scan 분석 후 감도가 우수한 2개의 ion을 선정하여 정량이온(quantitation ion)과 정성이온(confirmation ion)으로 설정하였다. 기기분석 결과 pydiflumetofen의 선구이온(precursor ion)은 426.1 m/z이었으며, 정량이온과 정성이온은 각각 192.9와 123.1 m/z이었으며, 최종 확립한 기기분석 조건과 표준용액 분석 크로마토그램을 Table 1과 Fig. 1에 제시하였다.
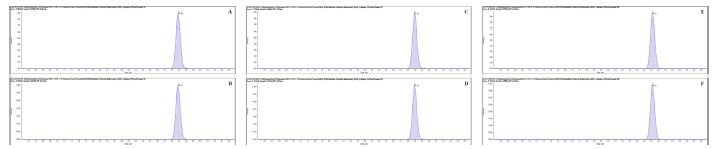
Standard chromatograms of pydiflumetofen at 0.05 mg/L. A; quantitation ion of solvent standard (426.1>192.9), B; confirmation ion of solvent standard (426.1>123.1), C; quantitation ion of matrix matched standard based on Kimchi cabbage extract solvent (426.1>192.9), D; confirmation ion of matrix matched standard based on Kimchi cabbage extract solvent (426.1>123.1), E; quantitation ion of matrix matched standard purified by d-SPE method within GCB (426.1>192.9), F; confirmation ion of matrix matched standard purified by d-SPE method within GCB (426.1>123.1).
잔류농약 분석법 확립
시험농약의 분석법은 QuEChERS 방법에 준하여 확립하고자 하였다. 추출 방법을 확립하기 위하여 AOAC Official Method 2007.01 방법인 acetate-buffering법(6 g MgSO4, 1.5 g NaOAc)과 EN 15662 방법인 citrate-buffering법(4 g MgSO4, 1 g NaCl, 1 g Na3Cit·2H2O, 0.5 g Na2HCit·1.5H2O)을 이용하여 추출한 후 회수율을 산출하는 방법으로 분석법의 효율을 검증하였으며, 추출물에 대한 농약의 matrix effect를 고려하여 최종 추출 방법을 확립하였다. 또한 정제 과정에 사용되는 흡착제의 종류와 양에 따른 분석 효율을 검증하기 위하여 Table 2에 제시한 바와 같은 조성을 이용하여 분석하였으며, 잔류농약 분석 과정은 다음과 같았다. 시료 10 g(현미와 대두는 5 g)를 50 mL conical centrifuge tube (FalcornTM, 미국)에 정확히 칭량하고 acetonitrile 10mL을 첨가한 후 1,300 rpm으로 5분간 진탕 추출하였다. 건조 시료 중 잔류농약의 추출을 위하여 일정량의 증류수로 습윤화하는 과정이 필수적이기 때문에(Kim et al., 2017) 현미와 대두의 경우 10 mL의 증류수를 이용하여 1시간동안 습윤화한 후 추출하였다. 추출한 시료에 각각의 QuEChERS 추출 pouch를 첨가하고 손으로 격렬하게 흔든 후 연속해서 1,300 rpm으로 1분간 진탕하였으며, 이 추출물을 3,500 rpm으로 5분간 원심 분리하였다. 대두는 시료에 다량의 지방과 단백질이 emulsifier로 작용하여(Lee and McClements, 2010) 물과 유기용매의 분리가 명확하지 않고 추출된 용액의 양이 적어지는 현상이 발생하기 때문에 12,000 rpm으로 10분간 원심 분리하여 분석의 효율을 향상시켰다. 시료를 정제하기 위하여 원심 분리한 시료의 상징액을 Table 2에 제시한 흡착제 조성에 1 mL씩 가하고 약 30 초간 voltexing하고 이를 다시 12,000 rpm으로 5분간 원심 분리하였다. 상징액을 acetonitrile을 이용하여 2배 희석하여 Table 1에 제시한 기기분석 방법을 이용하여 잔류농약을 분석하였다.
분석법 검증
분석법의 정량한계(limit of quantitation, LOQ)는 signal 대비 noise가 10 이상이면서 기기분석 상에서 재현성을 보이는 농도인 5 μg/kg으로 설정하였으며(Costa et al., 2015), 분석법을 검증하기 위하여 분석 장비의 재현성 및 회수율 시험을 수행하였다. LOQ, 10 LOQ 및 50 LOQ 농도의 표준용액을 7회 반복 분석하여 peak 면적, peak 높이 및 머무름 시간의 평균과 상대표준편차(relative standard deviation, RSD)를 산출하는 방법으로 분석 장비의 재현을 검증하였으며, 회수율은 무처리 시료에 표준용액을 0.05(10LOQ) 및 0.25(50LOQ) mg/kg의 농도가 되도록 처리한 후 확립된 분석법으로 3반복 분석하여 산출하였다.
Matrix effect
Matrix effect는 MS 검출기 내의 이온화 과정에서 생기는 시료와 분석 물질간의 영향으로 이를 저감하기 위한 다양한 연구가 시도되었다. 그 중 matrix effect (ME, %)를 가장 효과적이고 간단하게 상쇄시킬 수 있는 방법이 matrix matched calibration방법이다(Kittlaus et al., 2011). 따라서 이 연구에서도 matrix effect를 조사하기 위하여 pure standard와 matrix matched standard를 모두 기기 분석하여 얻은 peak의 면적을 기준으로 calibration curve를 작성하였으며, 직선식의 기울기를 이용하여 matrix effect를 산출하였다(식 (1)) (Economou et al., 2009). 또한 matrix effect(%)는 이온 억제(suppression) 또는 상승(enhancement) 강도 (intensity) 정도를 표현하는데 사용되는 수치이며, matrix effect value가 –20%<ME%<+20%이면 영향이 낮음(low)으로 판정하고 –50%<ME%<-20% 또는 +20%> ME%>+50%이면 중간(medium) 정도의 영향으로 판정한다. ME%<-50% 또는 ME%>+50%인 경우에는 matrix의 영향이 높은(high) 것으로 판정한다(Economou et al., 2009).
| (1) |
결과 및 고찰
분석기기의 재현성 시험
확립된 기기분석 조건하에서 LOQ, 10LOQ 및 50LOQ 농도의 표준용액을 반복 분석하여 기기의 재현성을 확인하였으며, 결과를 Table 3에 제시하였다. LOQ, 10LOQ 및 50LOQ 농도의 pydiflumetofen 표준용액을 기기 분석하여 얻어진 peak 면적의 평균 RSD는 각각 1.3, 1.7 및 1.9%이었으며, peak 높이의 평균 RSD는 각각 2.8, 3.0 및 3.7%이었다. 또한 pydiflumetofen의 머무름 시간의 평균 RSD는 0.4, 0.3 및 0.5%로 분석 장비의 재현성은 우수한 것으로 판단되었다(Melgar et al., 2010).
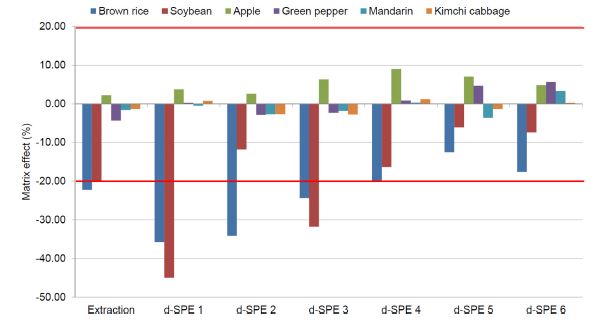
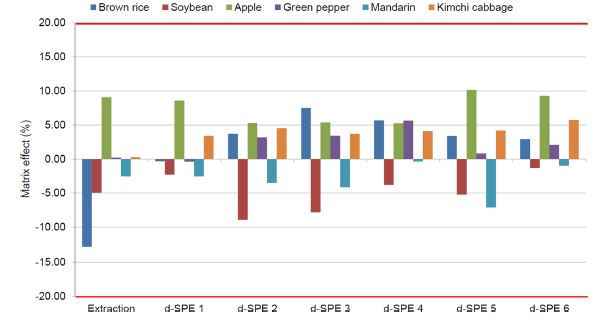
Matrix effect
Acetate-buffering 방법으로 추출한 시료 중 pydiflumetofen의 matrix effect는 Fig. 2에 제시한 바와 같이 –12.8-9.1%로 low signal suppression 또는 enhancement를 보였지만 citrate-buffering 방법으로 추출한 시료의 경우 Fig. 3에 제시한 바와 같이 –22.2-2.3%로 나타났으며, 특히 현미와 대두 추출물 중 pydiflumetofen의 matrix effect가 medium signal suppression을 보였다. 하지만 matrix effect를 저감할 수 있는 가장 쉬운 방법은 불순물을 최대한 제거하고 희석하는 것이라는 보고(Stahnke et al., 2012; Guo et al., 2019)와 같이 50 mg의 PSA를 이용하여 정제하면서 matrix effect 는 감소하는 경향을 보였다. Acetate-buffering 방법으로 추출하고 흡착제를 달리하여 정제한 시료 중 pydiflumetofen 의 matrix effect는 –8.9-10.2%로 정제 전 matrix effect와 유사하였다. 또한 citrate-buffering 방법으로 추출하여 정제한 시료 중 pydiflumetofen의 matrix effect는 현미와 대두를 제외하고 정제 전과 후 모두 낮은 결과를 보였으나 현미와 대두의 경우 25 mg의 PSA에 C18과 GCB를 추가하여 정제한 시료 중 pydiflumetofen의 중간 정도의 matrix effect를 보였다. 하지만 PSA 50 mg을 기반으로 정제할 경우 matrix effect가 저감되는 경향을 보였다. 다른 시료에서는 정제에 따른 matrix effect 감소 효과가 뚜렷하게 나타나지 않았다. 이러한 결과는 PSA 등의 흡착제의 종류와 양에 따라 matrix effect의 차이가 없었다는 Dušek et al. (2017)의 보고와 유사하였는데, 이는 두 연구에서 모두 전체적으로 낮은 matrix effect를 보였기 때문이라고 판단되었다. Matrix effect를 조사한 결과 모두 어느 정도의 영향은 있는 것으로 나타났기 때문에 농산물 중 pydiflumetofen을 LC-MS/MS를 이용한 QuEChERS 방법으로 분석하기 위해서는 matrix matched standard calibration로 정량하는 것이 바람직하다고 판단되었다.
The matrix effects (%) of pydiflumetofen in samples extracted by acetate-buffering method and purified six d-SPE methods.
회수율 시험
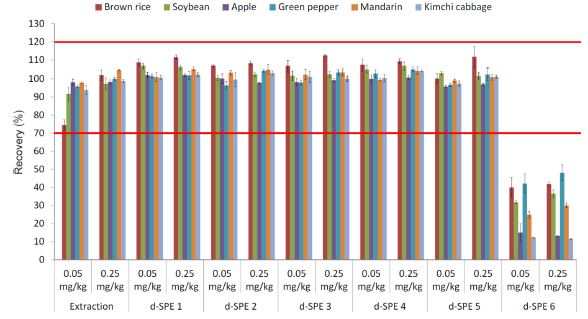
Acetate-buffering과 citrate-buffering 방법으로 추출한 후 정제 과정을 거치지 않은 시료 중 pydiflumetofen의 평균 회수율은 각각 85.3-113.5와 71.7-105.3%로 두 추출 방법 모두 잔류분석에 적합한 것으로 판단되었다. 각각의 방법을 이용하여 추출한 후 흡착제의 조성과 양을 달리한 6가지의 d-SPE tube를 이용하여 정제한 시료 중 pydiflumetofen의 회수율은 Fig. 4와 5에 제시한 바와 같이 50 mg의 GCB를 이용하여 정제한 경우를 제외하고 모두 유효한 회수율 범위인 70-120%를 만족하였다(FAO, 2016). 두 가지 방법으로 추출한 시료를 PSA 25 mg과 50 mg을 이용하여 정제한 pydiflumetofen의 회수율은 모두 70-120%의 유효한 회수율을 보여 농산물 중 pydiflumetofen은 PSA의 양에 의존적이지 않은 것으로 판단되었다. PSA 25 mg과 50 mg에 추가로 각각 C18을 25 mg과 50 mg을 추가하여 정제한 경우도 모두 유효한 회수율을 보여 PSA와 마찬가지로 농산물 중 pydiflumetofen의 회수율에 영향이 없는 것으로 판단되었다. 또한 PSA 25 mg에 GCB를 2.5 mg를 추가하여 정제했을 때는 모두 유효한 회수율을 보였지만 GCB가 50 mg 추가된 경우에는 모든 농산물에서 저조한 회수율을 보였다. Acetatebuffering 방법으로 추출한 후 정제한 결과와 citrate-buffering 방법으로 추출한 후 정제한 결과 모두 같은 경향이었다. 비극성 농약은 GCB에 흡착하여 낮은 회수율을 보였다는 보고(Chen et al., 2011)와 같이 Log Pow가 3.8이면서 다량의 할로겐 원소와 aromatic 구조의 비극성 농약임을 감안하면 시험농약인 pydiflumetofen은 GCB의 양에 따라 회수율이 달라질 것이라고 판단되었다. 또한 pydiflumetofen보다 더 많은 할로겐 원소가 포함되어 있는 aromatic 화합물인 broflanilide 역시 GCB에 흡착하기 때문에 그 양이 회수율에 영향을 미치는 결정적 원인이라는 보고(An et al., 2018)가 있으며, Guo et al. (2019)는 GCB를 10 mg 이상 사용하여 정제한 경우 일부 농약의 회수율이 낮아진다고 보고하였다. 따라서 색소와 steroid compound를 제거하는 GCB(Martins et al., 2017)는 분석 물질에 따라 다르게 적용해야 한다고 판단되었다. 결과적으로 회수율 시험 결과와 matrix effect 등을 고려하면, 농산물 중 pydiflumetofen의 QuEChERS 방법을 적용한 잔류농약 분석을 위해서 acetate-buffering 방법으로 추출하고 PSA에 C18 등 다른 흡착제를 추가하여 정제하되, GCB의 양은 시료의 클로로필이나 카로테노이등의 함량에 따라 선택적으로 사용하는 것이 바람직하다고 판단 되었다.
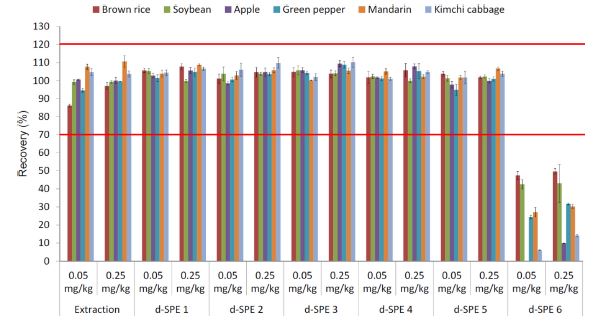
Recovery of pydiflumetofen in six test crops extracted by acetate-buffered and purified using six d-SPE methods.
Recovery of pydiflumetofen in six test crops extracted by citrate-buffered and purified using six d-SPE methods.
Recovery chromatograms of pydiflumetofen in Kimchi cabbage fortified at 0.25 mg/kg. A; quantitation ion of pydiflumetofen in extract sample without purification, B; confirmation ion of pydiflumetofen in extract sample without purification, C; quantitation ion of pydiflumetofen in purification sample within PSA 25 mg and GCB 2.5 mg, D; confirmation ion of pydiflumetofen in purification sample within PSA 25 mg and GCB 2.5 mg.
결 론
Matrix effect는 불순물의 제거와 희석하면서 저감될 수 있지만 Dušek et al. (2017)의 보고와 같이 이 연구에서는 대부분 matrix의 영향이 낮은 경향이었기 때문에 정제와 희석으로 인한 matrix 영향의 감소가 명확하게 보이지 않았다. 또한 다양한 추출 방법과 정제 방법에서 모두 어느 정도의 matrix effect가 존재하기 때문에 보다 정확한 정량을 위해서는 matrix matched standard calibration을 이용하는 것이 바람직하다고 판단되었다. 농산물 중 pydiflumetofen은 흡착제의 양과 종류에 상관없이 우수한 회수율을 보이지만 GCB의 양이 회수율을 결정하는 요인으로 작용했으며(Guo et al., 2019), Li et al. (2009)이 보고한 바와 같이 GCB가 회수율 저하의 원인이 되어 작물에 따라 다르게 적용해야 할 것으로 판단되었다. 또한 C18과 PSA를 단독으로 사용하여 정제하는 것보다 GCB를 혼합하여 정제하는 것이 효과적이었다는 보고(An et al., 2018)와 같이 시료에 따라 흡착제의 조성을 변형하면 QuEChERS 방법을 이용하여 다양한 매질에 대한 시험농약 분석이 가능할 것으로 판단되었다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구 개발사업(과제번호: PJ013594)의 지원에 의해 수행되었으며, 이에 감사드립니다.
References
-
An, X., J. Xu, F. Dong, X. Liu, X. Wu, R. Wang, and Y. Zheng, (2018), Simultaneous determination of broflanilide and its metabolites in five typical Chinese Soils by a modified quick, easy, cheap, effective, rugged, and safe method with ultra high performance liquid chromatography and tandom mass spectrometry, J. Sep. Sci, 41(24), p4515-4524.
[https://doi.org/10.1002/jssc.201800631]

- Anastassiades, M., S. J. Lehotay, D. tajnbaher, and F. J. Schenck, (2003), Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solidphase extraction” for the determination of pesticide residues in produce, J. AOAC Int, 86(2), p412-431.
-
Avenot, H. F., and T. J. Michailides, (2010), Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi, Crop Prot, 29(7), p643-651.
[https://doi.org/10.1016/j.cropro.2010.02.019]

-
Barker, S. A., (2000), Application of matrix solid-phase dispersion in food analysis, J. Chromatog. A, 880(1-2), p63-68.
[https://doi.org/10.1016/s0021-9673(99)01290-x]

- Beyer, A., and M. Biziuk, (2008), Methods for determining pesticides and polychlorinated biphenyls in food sample – Problem and challenges, Critical Reviews in Food Science and Nutrition, 48(10), p888-904.
-
Camel, V., (2000), Microwave-assisted solvent extraction of environmental samples, Trend. Anal. Chem, 19(4), p229-248.
[https://doi.org/10.1016/s0165-9936(99)00185-5]

- Casanova, J. A., (1996), Use of solid-phase extraction disks for analysis of moderately polar and nonpolar pesticides in high-moisture foods, J. AOAC Int, 79(4), p936-940.
-
Chen, G., P. Cao, and R. Liu, (2011), A multi-residue method for fast determination of pesticides in tea by ultra performance liquid chromatography-electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procesure, Food Chem, 125(4), p1406-1411.
[https://doi.org/10.1016/j.foodchem.2010.10.017]

-
Costa, A. I., M. E. Queiroz, A. A. Neves, F. A. de Sousa, and L. Zambolim, (2015), Determination of pesticides in lettuce using solid-liquid extraction with low temperature partitioning, Food Chem, 181, p64-71.
[https://doi.org/10.1016/j.foodchem.2015.02.070]

-
Duan, Y., Q. Xiu, H. Li, T. Li, J. Wang, and Zhou M., (2019), Pharmacological characteristics and control efficacy of a novel SDHI fungicide pydiflumetofen against Sclerotinia sclerotiorum, Plant Disease, 103(1), p77-82.
[https://doi.org/10.1094/pdis-05-18-0763-re]

- Dušek, M., V. Jandovská, and J. Olšovská, (2017), Analysis of multiresidue pesticides in dried hops by LC–MS/MS using QuEChERS extraction together with dSPE clean-up, J. Inst. Brew, 124(3), p222-229.
-
Economou, A., H. Botitsi, S. Antoniou, and D. Tsipi, (2009), Determination of multi-class pesticides in wines by solidphase extraction and liquid chromatography-tandem mass spectrometry, J. Chromatogr. A, 1216(31), p5856-5867.
[https://doi.org/10.1016/j.chroma.2009.06.031]

- Fillion, J., F. Sauve, and J. Selwyn, (2000), Multiresidue method for the determination of residues of 251 pesticides in fruits and vegetables by gas chromatography–mass spectrometry and liquid chromatography with fluorescence detection, J. AOAC Int, 83(3), p698-713.
- Food and Agriculture of the United Nations (FAO), (2016), Submission and evaluation of pesticide residues data for the estimation of maximum residue levels in food and feed, p32.
-
Guo, J., M. Tong, J. Tang, H. Bian, X. Wan, L. He, and R. Hou, (2019), Analysis of multiple pesticide residues in polyphenol-rich agricultural products by UPLC-MS/MS using a modified QuEChERS extraction and dilution method, Food Chem, 274, p452-459.
[https://doi.org/10.1016/j.foodchem.2018.08.134]

-
Hou, Y. P., X. W. Mao, J. X. Wang, S. W. Zhan, and G. Zhou, (2017), Sensitivity of Fusarium asiaticum to a novel succinate dehydrogenase inhibitor fungicide pydiflumetofen, Crop Prot, 96, p237-244.
[https://doi.org/10.1016/j.cropro.2017.02.011]

-
Kim, J. W., H. Kwon, S. M. Hong, J. H. Shim, H. S. Lee, D. B. Kim, and B. C. Moon, (2017), Method development of multiple pesticide residues in rice straw silage, Korean J. Pest. Sci, 21(4), p395-416.
[https://doi.org/10.7585/kjps.2017.21.4.395]

-
Kittlaus, S., J. Schimanke, G. Kempe, and K. Speer, (2011), Assessment of sample cleanup and matrix effects in the pesticide residue analysis of foods using postcolumn infusion in liquid chromatography–tandem mass spectrometry, J. Chromatog. A, 1218(46), p8399-8410.
[https://doi.org/10.1016/j.chroma.2011.09.054]

- Korea health industry development institute (KHIDI), (2016), National food & nutrition statistics I: based on 2014 Korea national health and nutrition examination survey, p57.
-
Lee, S. J., and D. J. McClements, (2010), Fabrication of proteinstabilized nanoemulsions using a combined homogenization and amphiphilic solvent dissolution/evaporation approach, Food Hydrocol, 24(6-7), p560-569.
[https://doi.org/10.1016/j.foodhyd.2010.02.002]

-
Lee, S. M., M. L. Papathakis, C. F. Hsiao-Ming, and J. E. Carr, (1991), Multipesticide residue method for fruits and vegetables: California Department of Food and Agriculture, Fresenius’ J. Anal. Chem, 339(6), p376-383.
[https://doi.org/10.1007/bf00322352]

- Li, L., W. Li, D. Qin, S. Jiang, and F. Liu, (2009), Application of graphitized carbon black to the QuEChERS method for pesticide multiresidue analysis in spinach, J. AOAC Int, 92(2), p538-547.
-
Ling, Y. C., and H. C. Teng, (1997), Supercritical fluid extraction and clean-up of organochlorine pesticides and polychlorinated biphenyls in mussels, J. Chromatog. A, 790(1-2), p153-160.
[https://doi.org/10.1016/s0021-9673(97)00734-6]

- Luke, M., J. E. Froberg, and H. T. Masumoto, (1975), Extraction and cleanup of organochlorine, organophosphate, organonitrogen and hydrocarbon pesticides in produce for determination by gas–liquid chromatography, J. Assoc. Off. Anal. Chem, 58(5), p1020-1026.
- Lynge, E., A. Auttila, and K. Hemminki, (1997), Orgarnic solvent and cancer, Cancer Causes & Control, 8(3), p406-419.
-
Martins, M. L., M. Kemmerich, O. D. Prestes, L. Maldaner, I. C. S. F. Jardim, and R. Zanella, (2017), Evaluation of an alternative fluorinated sorbent for dispersive solid-phase extraction clean-up of the quick, easy, cheap, effective, rugged, and safe method for pesticide residues analysis, J. Chromatogr. A, 1514, p36-43.
[https://doi.org/10.1016/j.chroma.2017.07.080]

-
Melgar, M. J., M. Santaeufemia, M. A. Garcia, (2010), Organophosphorus pesticide residues in raw milk and infant formulas from spanish northwest, J. Environ. Sci. Health. B, 45(7), p595-600.
[https://doi.org/10.1080/03601234.2010.502394]

- Mills, P. A., J. H. Onley, and R. A. Guither, (1963), Rapid method for chlorinated pesticide residues in nonfatty foods, J. Assoc. Off. Anal. Chem, 46, p186-191.
-
Ramos, L., E. M. Kristenson, and U. A. T. Brinkman, (2002), Current use of pressurised liquid extraction and subcritical water extraction in environmental analysis, J. Chromatog. A, 975(1), p3-29.
[https://doi.org/10.1016/s0021-9673(02)01336-5]

-
Rong, L., X. Wu, J. Xu, F. Dong, X. Liu, and Y. Zheng, (2018), Determination of Pydiflumetofen Residues in Some Foods of Plant and Animal Origin by QuEChERS Extraction Combined with Ultra-Performance Liquid Chromatography- Tandem Mass, Food Anal. Methods, 11(10), p2682-2691.
[https://doi.org/10.1007/s12161-018-1178-1]

- Stahnke, H., S. Kittlaus, G. N. Kempe, and L. Alder, (2012), Reduction of matrix effects in liquid chromatography– electrospray ionization–mass spectrometry by dilution of the sample extracts: how much dilution is needed? Analytic, Chem, 84(3), p1474-1482.
- Storherr, R. W., P. Ott, and R. R. Watts, (1971), A general method for organophosphorus pesticide residues in nonfatty foods, J. Assoc. Off. Anal. Chem, 54(3), p513-516.
-
Wardencki, W., M. Michulec, and J. Curyło, (2004), A review of theoretical and practical aspects of soild-phase microextraction in food analysis, Int. J. Food Sci. Tech, 39(7), p703-717.
[https://doi.org/10.1111/j.1365-2621.2004.00839.x]

- Wessel, J. R., (1967), Collaborative study of a method for multiple organophosphorus pesticide residues in nonfatty foods, J. Assoc. Off. Anal. Chem, 50, p430-439.
-
Wilkowska, A., and M. Biziuk, (2011), Determination of pesticide residues in food matrices using the QuChERS methodology, Food Chem, 125(3), p803-812.
[https://doi.org/10.1016/j.foodchem.2010.09.094]