
유세포분석기를 이용한 농약의 in vitro 소핵생성 평가
초록
농약의 독성 영향 평가는 인체와 환경보건에 주요한 관심사이다. 농약의 유전독성 평가방법 중 하나인 소핵시험에 대한 flow-cytometry의 적용성을 평가하고자 하였다. 양성대조물질로 mitomycin C와 colchicine을 사용하여 CHL cell에 처리한 후 flow cytometry 분석법을 이용하여 소핵 발생 여부를 조사하였다. 그 결과, 양성대조군의 소핵 발생률이 음성대조군에 비해 2.4~4.2배로 높게 나타났다. 따라서, flow-cytometry 분석법이 기존의 현미경 관찰법과 유사한 결과를 도출하면서 보다 신속하고 효율적인 실험법임을 확인하였다. 또한, 소핵을 생성하는 것으로 알려진 농약 2종(pendimethalin, mancozeb)을 CHL cell에 처리한 후 flow cytometry 분석법을 이용하여 소핵 발생 여부를 확인하였다. Pendimethalin 및 mancozeb 처리군의 소핵 발생수는 처리 농도가 증가할수록 유의적으로 증가하였다. 본 연구를 통해 flow cytometry 측정법이 농약의 소핵생성 시험에 이용할 수 있어 시간 및 편리성 측면에서 효율이 높은 방법임을 확인하였다.
Abstract
Pesticides have been recognized as one of major concern to human and environmental health. This study is aimed to evaluate whether flow cytometry analysis is a suitable method for micronuclei test, one of genotoxicity test of pesticides on human. We evaluated the number of micronuclei in the positive control (mitomycin C, colchicine) treated groups in Chinese hamster lung cells using flow cytometry. As a results, micronucleus rate in positive control were 2.4~4.2 much higher than in negative control group. These results indicate that flow cytometry method is a quicker and more efficient method for obtaining similar results to the conventional microscopic observation method. Also, pendimethalin (PM) and mancozeb (MZ), which are reported as pesticides causing genotoxicity, were treated with CHL cells, and the occurrence of micronuclei was confirmed by flow cytometry analysis. The occurrence of micronuclei in PM and MZ treated group was significantly increased with a dose-dependent manner, compared with negative control group. These results suggest that micronuclei assay using flow-cytometry analysis could be efficient high-throughput method for quantifying the formation of micronuclei.
Keywords:
flow cytometry, mancozeb, micronuclei, pendimethalin키워드:
유세포분석기, mancozeb, 소핵, pendimethalin서 론
화학농약의 노출에 의한 유전독성 평가 방법으로 유전자돌연변이 시험, 염색체 이상 시험, 소핵시험 등이 수행되고 있는데 소핵시험의 경우 in vivo 실험을 통한 다염성 적혈구중 소핵을 가진 적혈구를 계수함으로써 소핵유발 빈도를 측정하고 있다(농촌진흥청고시 제2018-32호). 최근 동물대체시험이 활성화되고 국제적인 시험법으로 인정받으면서, 기존의 in vivo 소핵시험법 이외에도 배양세포를 이용한 in vitro 시험법이 OECD 유전독성시험 가이드라인으로 제정되어 국제적으로 사용되고 있다(Lilienblum et al., 2008).
In vitro 소핵시험법은 in vitro 염색체 이상 시험에 비해 객관적인 방법으로 평가가 가능하고 판독이 용이하여 유전독성시험 초기 스크리닝 시험으로 선호되고 있다(Garriott et al., 2002). 그러나, 현미경 관찰을 통한 소핵 판별이 측정에 장시간이 소요되고 판별결과에 개인차가 심하다는 단점을 가지고 있다. 이를 보완하고자 핵의 형광염색을 통한 flow cytometry (유세포분석기) 측정법을 통해 보다 신속하고 효율적인 소핵 측정방법이 연구되고 있으며(Avlasevich, 2006; Shi et al., 2010; Yao, 2013; Balmus 2015), 이미지 분석, laser scanning cytometry를 이용한 연구도 시도되고 있다(Riedy et al., 1991; Vral et al., 1994; Nüsse and Kramer, 1997; von et al., 2000). Flow cytometry 분석법은 소핵 뿐만이 아닌 핵, 세포막 형광염색을 이용한 cytotoxicity 실험및 apoptosis 판별 실험 등에 폭넓게 적용되고 있는 실험방법이다(Mentz, 1998; Brando, 2000).
제초제인 pendimethalin은 준치사농도(3.6 mg/L) 처리시 현저한 DNA 손상과 소핵생성을 유도하며(Ahmad and Ahmad, 2016), mouse bone marrow cell에서 소핵생성을 유의적으로 증가시키는 것으로 보고된 바 있다 (Dimitrov et al., 2006; Ansari et al., 2018). Mancozeb는 종자 처리, 옆면 살포(foliar application)에 사용되는 살진균제로서, 포유류에서 발암 가능성이 의심되며(Belpoggi et al., 2002), in vitro에서 산화 메커니즘을 통한 노출에 의해 DNA 손상을 유도하는 것으로 보고 되었다(Calviello et al., 2006; Srivastava et al., 2012). 또한, rat를 이용한 in vivo 실험에서 mancozeb 처리 시 소핵생성이 유의적으로 증가했다는 연구가 보고된 바 있다(Goldoni et al., 2014).
따라서, 본 시험에서는 소핵생성 시험에서 현미경 관찰의 시간 및 편의성 단점을 보완하고자 flow cytometry를 이용하여 in vitro 소핵생성 시험의 적용성을 확인하고, 선행연구에서 in vivo와 in vitro에서 소핵을 유발하는 것으로 알려진 농약 원제 2종(pendimethalin, mancozeb)을 이용하여 소핵생성을 추가로 확인하였다.
재료 및 방법
시험 세포 및 시약
세포주는 Chinese Hamster Lung (CHL) cell을 American Type Culture Collection (ATCC)로 부터 구입해 사용하였다. 배양액은 10% Fetal Bovine Serum (Gibco)과 2mM L-Glutamine을 포함한 MEM (Minimum Essential Medium, Gibco)을 사용하였으며, 세포는 5% CO2, 37oC 조건에서 2~3일 간격으로 계대배양하여 사용하였다. 각 처리군은 음성대조군, 양성대조군, 시험물질 처리군으로 구성하였다. 음성대조군은 DW (distilled water)와 DMSO를, 양성대조군은 mitomycin C (MMC)와 colchicine (COL)을 사용하였고, 시험물질 처리군은 pendimethalin과 mancozeb를 사용하였다. Mitomycin C, colchicine, pendimethalin, mancozeb는 Sigma에서 구입하여 사용하였다.
양성대조물질 및 시험물질 처리농도 설정
시험물질 노출시간은 3시간과 24시간으로 구분하였으며, 양성대조물질도 동일한시험조건으로 수행하였다(Wakata et al., 2006). 시험농도 선정에 사용하는 세포독성은 570 nm에서 흡광도를 측정하여 다음의 식을 이용하여 산출하였다.
본 시험의 소핵관찰 신뢰도를 확인하기 위하여 OECD TG에서 제시한 세포독성 55 ± 5% 범위의 농도로 선정하였으며, MMC는 3시간과 24시간 처리군에서 각각 80 μg/ml과 40 μg/ml를, colchicine은 3시간과 24시간 처리군에서 각각 5.0 μg/ml과 0.5 μg/ml로 하였다. 시험물질은 세포독성이 55 ± 5%인 경우를 최고농도로 선택하여 공비 2로 하여 하위 시험농도 2개를 포함한 총 3개의 농도를 시험하였으며 (OECD, 2016), 모든 시험군은 3반복 수행하였다.
In vitro 소핵생성 시험
시험은 OECD TG 487의 in vitro 소핵시험법을 근거로 수행하되(OECD, 2016), flow cytometry 측정을 위하여 형광물질 EMA (ethidium monoazide)와 SYTOX green을 순차적으로 중복 염색하는 단계를 추가하였다(Avlasevich, 2006; Shi et al., 2010; Yao, 2013). CHL cell을 6 well plate에 배양 (1.5×105 cells/ml)하여 시험물질을 처리한 후, trypsin EDTA를 처리하여 cell을 채집하였다. 채집된 세포는 EMA로 염색한 후, RNase와 핵산 염료 시약인 SYTOX green을 포함하는 용액으로 염색 및 세척하였다.
Flow cytometry 측정
소핵생성은 CytoFLEX 세포분석기(Beckman Coulter)로 측정하였으며, CyExpert 1.0 (Beckman Coulter)을 이용하여 데이터 수집 및 분석은 수행하였다. 유동 세포 계측 데이터는 영역 및 gating logic의 구성을 포함하여 수집하였고, 소핵 생성율은 시료당 최고 10,000개의 gating된 핵산 중 소핵(EMA-/SYTOX+)의 수집을 통해 결정하였다. 즉, 세포막이 손상된 사멸된 세포의 DNA는 EMA와 SYTOX green으로 중복 염색되며, SYTOX green에만 염색되는 소핵과 구별하였다(Avlasevich, 2006; Shi et al., 2010; Yao, 2013). 소핵선별에 사용한 gating절차를 A, B, C, D 순으로 Fig. 1와 같이 소핵의 생성 여부와 생성 정도를 비교하기 위한 기준을 설정하였다. 우선, gating을 수행하여 불특정 particle을 제거하고 (Fig. 1A, B), 삼각형 gating 구간에 존재하는 2개의 군집은 정상 세포와 소핵으로, 삼각형 gating 구간 밖에 존재하는 군집은 사멸된 세포의 핵으로 판단하였다(Fig. 1C). 삼각형 gating 구간에서 형광값이 낮은 군집을 소핵으로 선별하여 소핵 생성 정도를 판단하였다(Fig. 1D).
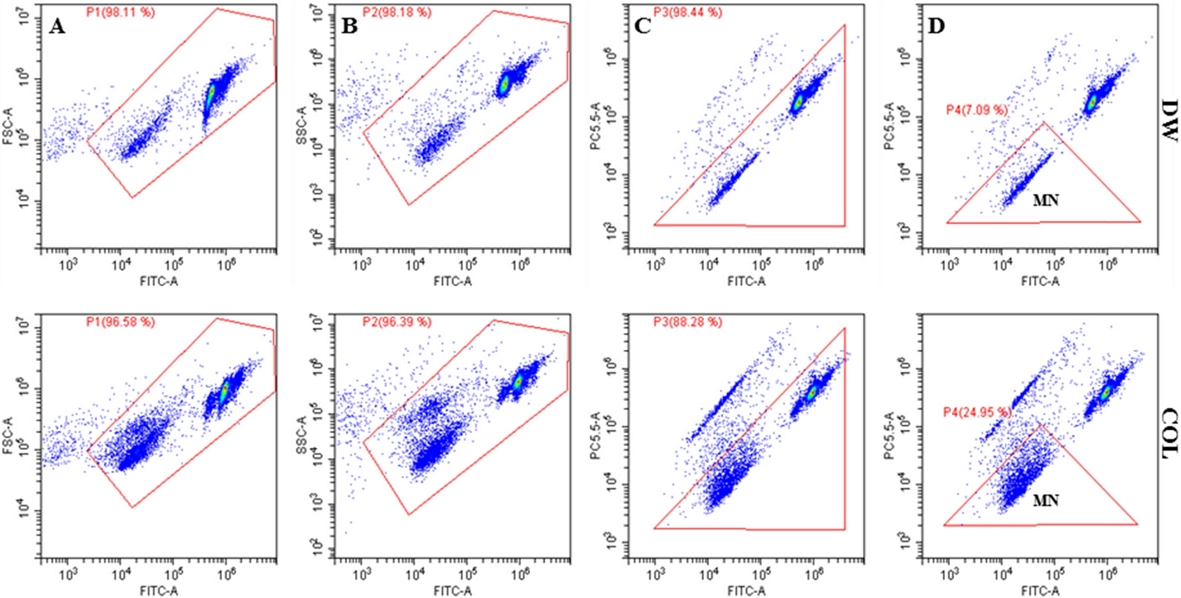
Gating strategies of the flow cytometric analysis of MN frequency in CHL cells. CHL cells were treated and processed following the in vitro micronuclei assay procedures. Events must meet the following criteria in order to be scored as nuclei, apoptotic bodies or MN: the events must fall within FSC versus FITC region (A); within SSC versus FITC region (B) and to be EMA-negative (C). The MN gate was set to collect events with 1/100 to 1/10 of the SYTOX-associated fluorescence as G1 nuclei (D). PC5.5 means red fluorescence indicating EMA and FITC green fluorescence indicating SYTOX green. COL, colchicine; FSC, forward scatter; SSC, side scatter.
통계처리 및 소핵판정
통계처리 및 판정은 SPSS (statistical Package for the Social Sciences, version 20)을 이용하여 양성대조물질 검증을 위하여 t-test를, 시험물질의 농도별 검증을 위하여 one-way ANOVA (Analysis of variance)를 실시하였으며, 유의수준 0.05에서 유의성을 검증하였다. 그리고 one-way ANOVA는 Scheffé’s test를 통해 사후검정하였다. 판정기준은 시험물질 처리군이 소핵 발생빈도가 용량상관성을 나타내면서 음성대조군에 비해 통계적인 유의성을 보이며 2배 이상의 소핵을 형성시킬 때 양성으로 판정하였다(Miller et al., 1995; Shi et al., 2010).
결과 및 고찰
양성대조물질을 이용한 소핵생성 평가
양성대조군의 소핵생성 정도를 확인하여 flow cytometry 분석법의 적용성을 확인하기 위하여, MMC와 COL를 각각 3시간과 24시간 처리하여 소핵생성 수준을 확인하였다. Fig. 2에는 음성 및 양성대조군에 대해 유세포분석기를 통한 gating(위) 및 소핵 유발율(아래)에 대한 결과를 나타내었다.
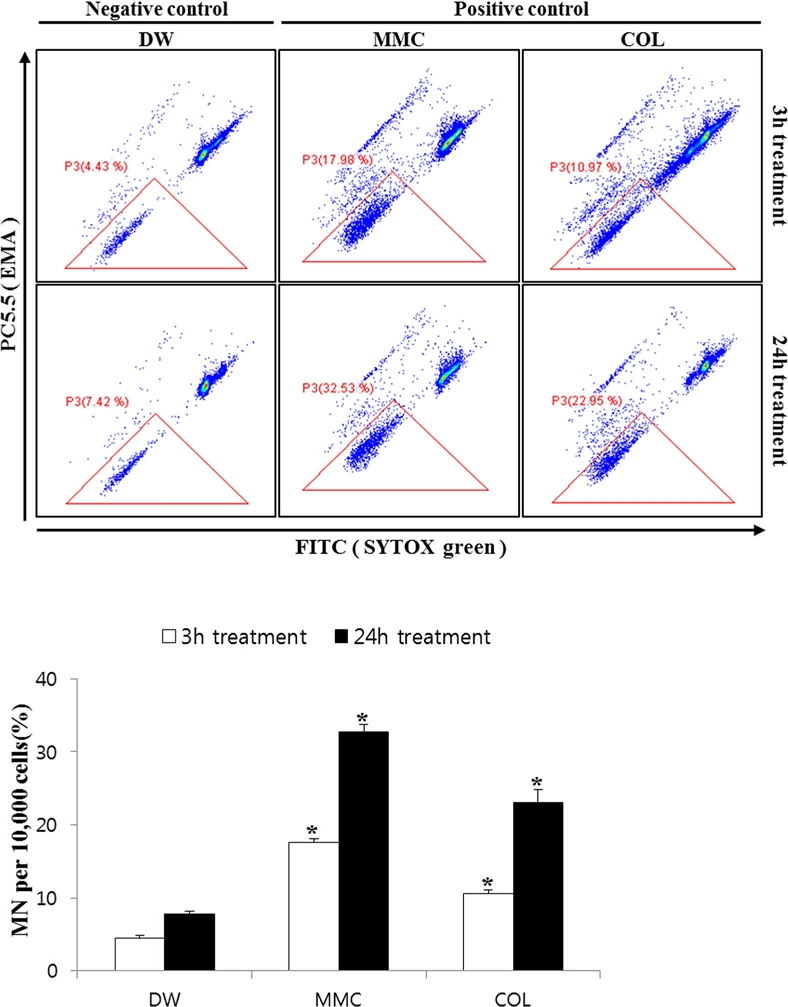
Micronuclei formation induced by positive controls (MMC, colchicine) in CHL cells. CHL cells were treated with MMC and colchicine at different concentrations for 3hours and 24hours respectively. Micronuclei were determined with SYTOX green. Cells were counterstained with EMA (red) to show apoptotic bodies staining. MMC, mitomycin C; COL, colchicine. *, indicate a significantly difference of means between DW group and MMC group or DW group and colchicine group by t-test at P<0.05.
음성대조군으로 DW를 3시간, 24시간으로 노출한 결과 10,000개의 세포 중에 각각 4.4 ± 0.4와 7.7 ± 0.4%의 소핵을 생성하였다. MMC 처리군은 3시간, 24시간 처리군에서 각각 17.5 ± 0.5%와 32.7 ± 1.0%의 소핵이 생성되었고, COL 처리군은 각각 10.5 ± 0.5%와 23.0 ± 1.9%의 소핵이 생성되었다. 이는 음성대조군에 비해 양성대조군인 MMC와 COL의 소핵생성 수준이 3시간 처리시 각각 4.0배 및 2.4배로 유의적으로 증가하였고, 24시간 처리시에도 각각 4.2배 및 3.0배로 유의적으로 증가함에 따라 양성대조군의 판별력이 높음을 알 수 있다(p<0.05).
Flow cytometry를 이용한 선행연구에서 인체 간암세포인 HepG2 cell (Le et al., 2016)과 rat bone marrow erythrocytes (Fiedler et al., 2010)를 이용한 소핵생성을 확인한 결과 MMC와 COL 처리군 모두 음성대조군에 비해 소핵생성이 약 5배 높게 나타났으며, 현미경 관찰법과 flow cytometry 분석법이 높은 일관성을 나타냄에 따라 in vivo 및 in vitro 소핵시험에서 flow cytometry의 높은 활용성과 소요시간 절감에 대해 보고한 바 있다. 본 시험의 CHL cell의 소핵생성율을 flow cytometry를 이용하여 확인한 결과 음성대조군에 비해 양성대조군의 소핵생성율이 유의적으로 높게 나타나 flow cytometry의 적용성이 타당한 것으로 확인되었다.
농약을 이용한 소핵생성 평가
시험농약인 pendimethalin과 mancozeb의 소핵생성 정도를 확인하기 전 세포독성을 먼저 확인 한 결과, pendimethalin을 40 μg/ml로 3시간과 24시간 처리시 각각 49.8 ± 2.5%, 44.9 ± 1.9%이었으며, mancozeb을 80 μg/ml로 3시간과 24시간 처리시 세포독성은 각각 50.9 ± 1.6%, 40.7 ± 1.5%으로 나타났다. 이를 근거로 각각 하위농도 2개를 포함하도록 pendimethalin은 10 μg/ml (저), 20 μg/ml (중), 40 μg/ml (고)을, mancozeb는 20 μg/ml (저), 40 μg/ml (중), 80 μg/ml (고)로 각각 3시간 및 24시간 처리한 후 소핵생성을 평가하였다.
CHL cell에서 pendimethalin 처리시 소핵생성율을 flow cytometry로 측정한 결과는 Fig. 3과 같다. 음성대조군(DMSO)을 3시간과 24시간 처리시 각각 4.4 ± 0.4%와 5.0± 0.5%의 소핵을 생성한 데 비해 pendimethalin을 3시간 동안 저농도 및 중농도, 고농도 처리시 각각 6.1 ± 0.3%, 6.5 ± 0.2, 17.3 ± 1.0%의 소핵이 유발하여, 음성대조군에 비해 각각 1.4배, 1.5배, 3.9배 소핵이 유의적으로 증가하는 경향을 나타내었다(p<0.05). 또한, pendimethalin을 24시간 처리했을 때 각각 저농도 6.1 ± 0.4%, 중농도 13.7 ± 1.2%, 고농도 18.8 ± 3.4%로 소핵이 생성하여, 음성대조군에 비해 양성대조군의 소핵발생이 저, 중, 고농도에서 각각 1.2배, 2.7배, 3.8배 유의적으로 농도의존적 증가하였다(p<0.05).
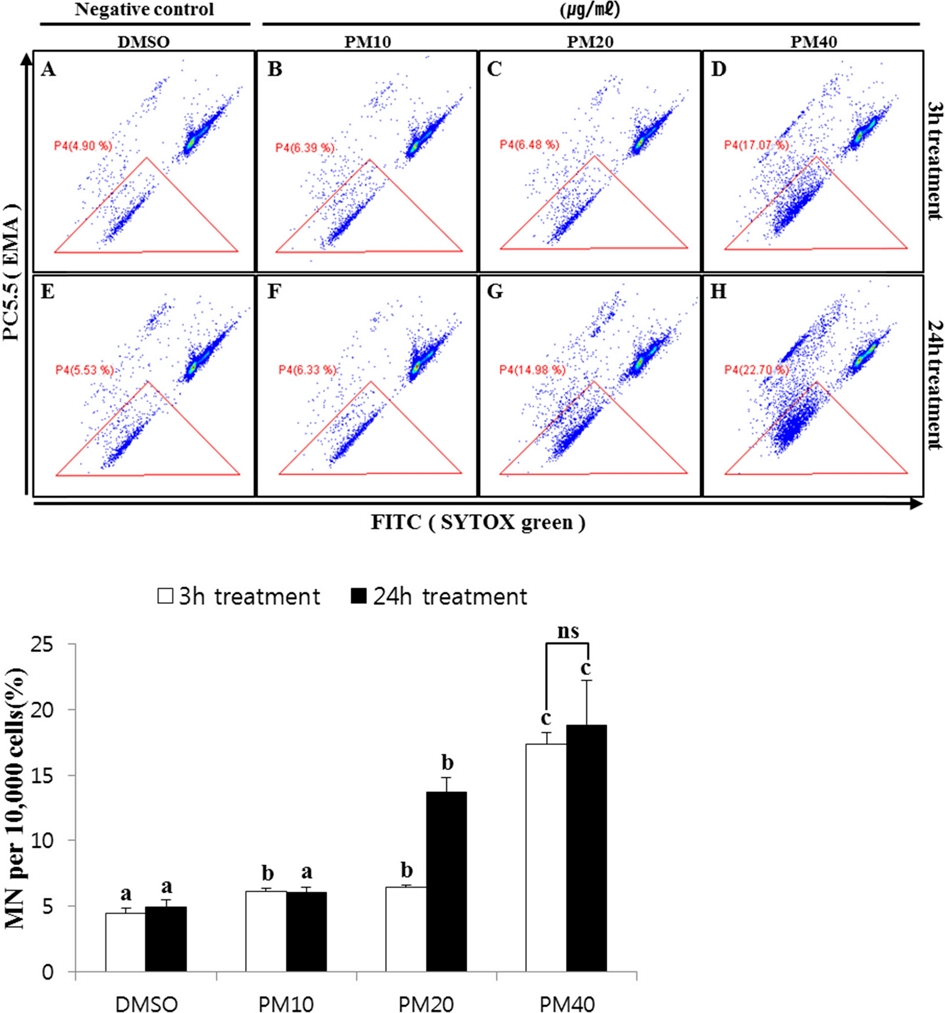
Micronuclei formation induced by pendimethalin(PM) in CHL cells. CHL cells were treated with PM and DMSO at different concentrations for 3hours and 24hours respectively. Micronuclei were determined with SYTOX green. Cells were counterstained with EMA(red) to show apoptotic bodies staining. PM, Pendimethalin. a, b, c, indicate a significantly difference between means by Scheffé’s test at P<0.05.
선행연구로 mouse bone marrow polychromatic erythrocytes (PCEs)와 human lymphocytes에 pendimethalin을 처리한 연구에서도 소핵생성이 유의적으로 증가했다는 보고된 바 있으며(Dimitrov et al., 2006; Ansari et al., 2018), 본 시험에서 flow cytometry를 이용하여 CHL cell에서 pendimethalin의 소핵 생성을 시험한 결과 음성대조군에 비해 유의적으로 증가한 양상을 보여 pendimethalin이 in vitro의 CHL cell에서 소핵을 생성하는 것을 확인할 수 있었다.
동일한 시험조건에서 mancozeb 처리하여 소핵 생성을 살펴본 결과를 Fig. 4에 나타내었다. Mancozeb를 저농도 (20 μg/ml), 중농도(40 μg/ml), 고농도(80 μg/ml)로 3시간 처리한 경우 소핵생율은 각각 8.8 ± 0.4, 10.9 ± 0.8, 24.0 ± 1.6%로 나타나 음성대조군에 비해 소핵생성율이 저농도 2.0배, 중농도 2.5배, 고농도 5.4배로 처리농도가 증가할수록 소핵생성이 유의적으로 농도의존적 증가하였다(p<0.05). 또한, 24시간 처리한 경우에도 저농도 7.4 ± 2.9%, 중농도 12.4 ± 1.1%, 고농도 53.1 ± 1.8%의 소핵이 생성되어, 음성대조군에 비해 저농도 1.5배, 중농도 2.5배, 고농도 10.7배로 소핵생성이 유의적으로 증가하여 3시간 처리시의 결과와 유사하였다(p<0.05).
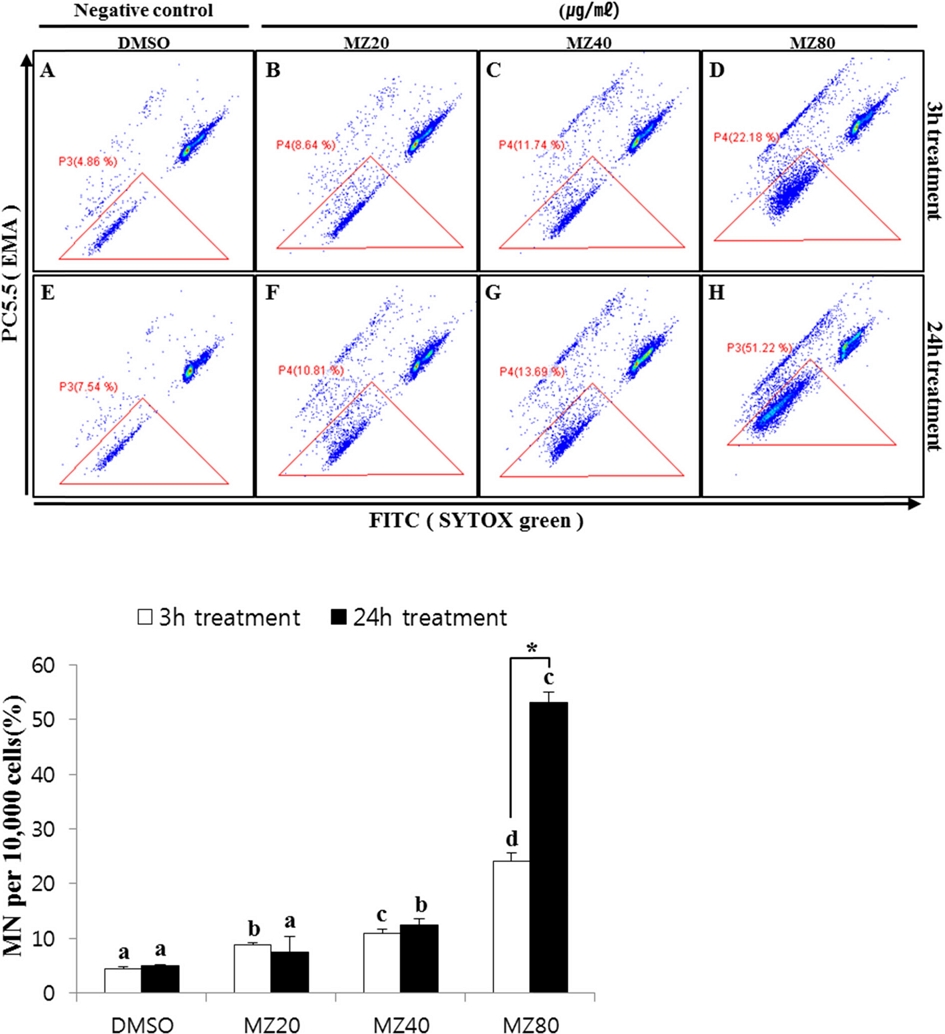
Micronuclei formation induced by mancozeb (MZ) in CHL cells. CHL cells were treated with MZ and DMSO at different concentrations for 3hours and 24hours respectively. Micronuclei were determined with SYTOX green. Cells were counterstained with EMA(red) to show apoptotic bodies staining. MZ, Mancozeb. a, b, c, d, indicate a significantly difference between means by Scheffé’s test at P<0.05, *P<0.05.
선행연구에서 rat bone marrow polychromatic erythrocytes (PCEs)와 human lymphocytes에 mancozeb를 처리한 결과 소핵 생성이 유의적으로 증가했다는 보고되었으며(Srivastava et al., 2012; Goldoni et al., 2014), 본 연구에서도 mancozeb를 처리한 CHL cell에서 소핵생성을 flow cytometry를 이용하여 확인한 결과 음성대조군에 비해 유의적으로 증가한 양상을 보여 mancozeb가 in vitro의 CHL cell에서 소핵을 생성하는 것을 확인할 수 있었다.
본 시험을 통해 pendimethalin과 mancozeb의 소핵 생성율을 flow cytometry를 이용하여 측정한 결과, pendimethalin 및 mancozeb 처리군 모두에서 처리 농도가 증가할수록 소핵 생성이 유의적으로 증가함을 알 수 있다(p<0.05). 본 여러 선행연구를 통해서도 flow cytometry 분석을 통해 다량의 데이터를 신속하고 정확하게 수집할 수 있었다. 반면, Fig. 2와 같이 모든 시료에 동일한 gating 절차가 사용되지만 gating 초기 설정은 다소 주관적인 판단을 할 수 있음에 따라 현미경을 통한 시험결과에 비해 가변성을 보일 수 있다. 또한 분석의 민감도 측면에서 현미경 관찰을 통한 분석은 유사분열을 완료한 세포만 소핵으로 판별하지만, flow cytometry를 이용한 분석은 크기와 응축에 따라 중기 단계의 염색체를 포함할 수 있으므로, flow cytometry 분석법은 현미경 관찰법보다 소핵의 범위가 더 포괄적으로 확인할 수있다(Le Bihanic et al., 2016).
Flow cytometry 분석법은 많은 실험과 검증이 이루어졌지만 아직까지 연구중인 실험방법으로서 신뢰성 있는 검증이 더욱 필요한 상태인 상황이다.
본 연구에서 수행된 동일한 시험조건에 대한 기존 현미경관찰을 통해 소핵을 관찰하고 이를 flow cytometry로 계수한 소핵생성 정도와 비교함으로서 본 연구에서 구축된 시험법의 적용성을 보다 더 면밀히 확인할 수 있을 것으로 기대한다. 또한 본 시험의 후속연구로 flow cytometry를 이용한 in vivo 소핵생성 시험의 검증을 위해 pendimethalin과 mancozeb에 의한 영향을 확인함으로써 in vivo 소핵시험법의 in vitro 소핵시험법으로의 대체 가능성을 확인할 계획이다. 선행연구(Avlasevich, 2006; Shi et al., 2010; Yao, 2013; Balmus 2015)에서 사용시약과 시간 및 편의성 측면에서 효율이 높다고 제안된 Flow cytometry를 본 연구의 소핵시험에 적용함으로서 유전독성평가 기술의 개선에 기여할 것으로 기대된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ01283502)의 지원에 의하여 이루어진 것입니다.
References
-
Ahmad, I. and M. Ahmad (2016) Fresh water fish, Channa punctatus, as a model for pendimethalin genotoxicity testing: A new approach toward aquatic environmental contaminants. Environ. Toxicol. 31(11):1520-1529.
[https://doi.org/10.1002/tox.22156]

-
Ansari, S. M., Q. Saquib, S. M. Attia, E. M. Abdel-Salam, H. A. Alwathnani, M. Faisal, A. A. Alatar, A. A. Al-Khedhairy and J. Musarrat (2018) Pendimethalin induces oxidative stress, DNA damage, and mitochondrial dysfunction to trigger apoptosis in human lymphocytes and rat bone-marrow cells. Histochem. Cell Biol. 149(2):127-141.
[https://doi.org/10.1007/s00418-017-1622-0]

-
Avlasevich, S. L., S. M. Bryce, S. E. Cairns and S. D. Dertinger (2006) In vitro micronucleus scoring by flow cytometry: differential staining of micronuclei versus apoptotic and necrotic chromatin enhances assay reliability. Environ Mol Mutagen. 47(1):56-66.
[https://doi.org/10.1002/em.20170]

-
Balmus, G., N. A. Karp, B. L. Ng, S. P. Jackson, D. J. Adams and R. E. McIntyre (2015) A high-throughput in vivo micronucleus assay for genome instability screening in mice. Nat. Protoc. 10(1):205-215.
[https://doi.org/10.1038/nprot.2015.010]

-
Belpoggi, F., M. Soffritti, M. Guarino, L. Lambertini, D. Cevolani and C. Maltoni (2002) Results of long-term experimental studies on the carcinogenicity of ethylene-bis-dithiocarbamate (Mancozeb) in rats. Ann. N. Y. Acad. Sci. 982:123-136.
[https://doi.org/10.1111/j.1749-6632.2002.tb04928.x]

-
Brando, B., D. Barnett, G. Janossy, F. Mandy, B. Autran, G. Rothe, B. Scarpati, G. D’Avanzo, J. L. D’Hautcourt, R. Lenkei, G. Schmitz, A. Kunkl, R. Chianese, S. Papa and J. W. Gratama (2000) Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. Cytometry. 42(6):327-346.
[https://doi.org/10.1002/1097-0320(20001215)42:6<327::AID-CYTO1000>3.0.CO;2-F]

-
Calviello, G., E. Piccioni, A. Boninsegna, B. Tedesco, N. Maggiano, S. Serini, F. I. Wolf and P. Palozza (2006) DNA damage and apoptosis induction by the pesticide Mancozeb in rat cells: involvement of the oxidative mechanism. Toxicol Appl Pharmacol. 211(2):87-96.
[https://doi.org/10.1016/j.taap.2005.06.001]

-
Dimitrov, B. D., P. G. Gadeva, D. K. Benova and M. V. Bineva (2006) Comparative genotoxicity of the herbicides Roundup, Stomp and Reglone in plant and mammalian test systems. Mutagenesis. 21(6):375-382.
[https://doi.org/10.1093/mutage/gel044]

-
Fiedler, R. D., S. K., Weiner and M. Schuler (2010) Evaluation of a modified CD71 MicroFlow method for the flow cytometric analysis of micronuclei in rat bone marrow erythrocytes. Mutat. Res. 703(2):122-129.
[https://doi.org/10.1016/j.mrgentox.2010.08.006]

-
Garriott, M. L., J. B. Phelps and W. P. Hoffman (2002) A protocol for the in vitro micronucleus test. I. Contributions to the development of a protocol suitable for regulatory submissions from an examination of 16 chemicals with different mechanisms of action and different levels of activity. Mutat. Res. 517(1-2):123-134.
[https://doi.org/10.1016/S1383-5718(02)00059-1]

- Goldoni, A., C. R. Klauck, S. T. Da Silva and M. D. Da Silva, P. G. Ardenghi and L. B. Da Silva (2014) DNA damage in Wistar rats exposed to dithiocarbamate pesticide mancozeb. Folia Biol. 60(4):202-204.
-
Le Bihanic, F., S. Di Bucchianico, H. L. Karlsson and K. Dreij (2016) In vivo micronucleus screening in zebrafish by flow cytometry. Mutagenesis. 31(6):643-653
[https://doi.org/10.1093/mutage/gew032]

-
Lilienblum, W., W. Dekant, H. Foth, T. Gebel, J. G. Hengstler, R. Kahl, P. J. Kramer, H. Schweinfurth and K. M. Wollin (2008) Alternative methods to safety studies in experimental animals: role in the risk assessment of chemicals under the new European Chemicals Legislation (REACH). Arch. Toxicol. 82(4):211-236.
[https://doi.org/10.1007/s00204-008-0279-9]

- Mentz, F., S. Baudet, K. Maloum, Z. Azgui, O. Sevin, M. F. Vinsobre, C. Dujarric, K. Brefort, M. C. Chretien and H. Merle-Beral (1998) Quantification of apoptosis by the Abbott CD4000 hematology analyzer. Hematol. Cell Ther. 40(5):183-188.
-
Miller, B. M., E. Pujadas and E. Gocke (1995) Evaluation of the micronucleus test in vitro using chinese hamster cells: Results of four chemicals weakly positive in the in vivo micronucleus test. Environ. Mol. Mutagen. 26(3):240-247.
[https://doi.org/10.1002/em.2850260309]

-
Nüsse, M. and K. Marx (1997) Flow cytometric analysis of micronuclei in cell cultures and human lymphocytes: advantages and disadvantages. Mutat. Res. 392(1-2):109-115.
[https://doi.org/10.1016/S0165-1218(97)00049-9]

- OECD (2016) OECD Guideline for the Testing of Chemicals. Test No.487: In Vitro Mammalian Cell Micronucleus Test.
- RDA (Rural Development administration) (2018) agrochemicals control act. P223-225. R.D.A., korea.
-
Riedy, M. C., K. A. Muirhead, C. P. Jensen and C. C. Stewart (1991) Use of a photo-labeling technique to identify nonviable cells in fixed homologous or heterologous cell populations. Cytometry. 12(2):133-139.
[https://doi.org/10.1002/cyto.990120206]

-
Shi, J., R. Bezabhie and A. Szkudlinska (2010) Further evaluation of a flow cytometric in vitro micronucleus assay in CHO-K1 cells: a reliable platform that detects micronuclei and discriminates apoptotic bodies. Mutagenesis. 25(1):33-40.
[https://doi.org/10.1093/mutage/gep040]

-
Srivastava, A. K., W. Ali, R. Singh, K. Bhui, S. Tyagi, A. A. Al-Khedhairy, P. K. Srivastava, J. Musarrat and Y. Shukla (2012) Mancozeb-induced genotoxicity and apoptosis in cultured human lymphocytes. Life Sci. 90(21-22):815-824.
[https://doi.org/10.1016/j.lfs.2011.12.013]

-
von der Hude, W., S. Kalweit, G. Engelhardt, S. McKiernan, P. Kasper, R. Slacik-Erben, H. G. Miltenburger, N. Honarvar, R. Fahrig, B. Gorlitz, S. Albertini, S. Kirchner, D. Utesch, F. Potter-Locher, H. Stopper and S. Madle (2000) In vitro micronucleus assay with Chinese hamster V79 cells - results of a collaborative study with in situ expo-sure to 26 chemical substances. Mutat Res 468(2):137-163.
[https://doi.org/10.1016/S1383-5718(00)00045-0]

-
Vral, A., F. Verhaegen, H. Thierens and L. de Ridder (1994) The in vitro cytokinesis-block micronucleus assay: a detailed description of an improved slide preparation technique for the automated detection of micronuclei in human lymphocytes. Mutagenesis. 9(5):439-443.
[https://doi.org/10.1093/mutage/9.5.439]

-
Wakata, A., A. Matsuoka, K. Yamakage, J. Yoshida, K. Kubo, K. Kobayashi, N. Senjyu, S. Itoh, H. Miyajima, S. Hamada, S. Nishida, H. Araki, E. Yamamura, A. Matsui, V. Thybaud, G. Lorenzon, D. Marzin and E. Lorge (2006) SFTG international collaborative study on in vitro micronucleus test IV. Using CHL cells. Mutat. Res. 607(1):88-124.
[https://doi.org/10.1016/j.mrgentox.2006.04.003]

-
Yao, J., Q. Gao, Q. Mi, X. Li, M. Miao, P. Cheng and Y. Luo (2013) In vitro micronucleus assay for the analysis of total particulate matter in cigarette smoke: comparison of flow cytometry and laser scanning cytometry with microscopy. Mutat. Res. 755(2):120-125.
[https://doi.org/10.1016/j.mrgentox.2013.05.017]
