
흰쥐의 뇨 중 3,5,6-Trichloro-2-Pyridinol 분석을 통한 Chloropyrifos 노출량 예측
초록
Chlorpyrifos (CPF)는 유기인계(organophosphates, OPs) 농약 중 하나로 화학적으로 생체 침투율이 높아 농작업자의 농약 노출에 대한 연구가 다수 진행되고 있다. 하지만, 농작업자의 생체시료를 이용한 대사체 분석을 통해 급성 CPF의 노출량을 예측하는 연구는 미비한 실정이다. 이에 본 연구에서는 흰쥐의 피부를 통해 CPF를 반복 노출시킨 후 뇨 중 3,5,6-Trichloro2-Pyridinol (TCP) 배설량 변화를 확인하고, 노출과 배설의 상관성을 확인하였으며, 최종적으로 뇨 중 TCP의 배설량을 통해 노출량을 예측하였다. CPF는 7일간격으로 저(1.01 mg/kg), 중(10.05 mg/kg), 고농도(100.50 mm/kg)로 경피를 통해 3회 반복 노출한 시험군의 매 노출 후 24시간 동안 뇨 시료를 채취하여 TCP 배설량를 분석하였다. 분석 결과, 노출횟수가 증가할수록 뇨 중 배설량은 유의적으로 감소하였으며, 노출농도 증가에 따라 배설량 감소폭은 증가하였다. CPF의 경피 노출과 뇨 중 TCP의 배설량과의 상관관계는 0.67~0.86으로 높은 상관성을 보였다. 또한, 우리나라 농작업자의 노출수준인 저농도로 흰쥐에 반복적으로 CPF를 처리한 경우 뇨 중 TCP 배설량에 근거한 CPF 흡수율은 4.20~18.81%를 나타내었으며, 국외 농민에서 보고된 흡수율과 유사한 수준의 예측능을 보였다. 향후 농업현장의 농민에 대한 생체시료를 이용한 TCP 분석을 통해 농작업자의 급성 농약 노출량을 예측하는데 기초자료가 될 것으로 생각된다.
Abstract
Chlorpyrifos (CPF) is one of the organophosphates (OPs) pesticides, and has been widely studied for pesticide exposure by agricultural operator due to its high chemical penetration rate. However, studies to predict the exposure of acute CPF through the analysis of its metabolites using the biomonitoring for agricultural operators are insufficient. In this study, we examined the urinary excretion of 3,5,6-Trichloro2-Pyridinol (TCP) following the repeated exposure of CPF through the skin of rats and confirmed the correlation between CPF exposure and urinary TCP excretion, and finally predicted the CPF exposure by urinary TCP excretion in rats. TCP excretion was analyzed in urine samples of rats exposed through the skin for three times at low (1.01 mg/kg), medium (10.05 mg/kg) and high concentrations (100.50 mg/kg) every 7 days. As the number of exposures increased, urinary TCP excretion decreased significantly, and the decrease in TCP excretion in urine increased with increasing exposure concentration. The correlation between dermal exposure of CPF and their excretion of TCP in urine samples were high, ranging from 0.67 to 0.86. In addition, the absorbed CPF ratio was 4.20~18.81% in rats of low-CPF exposed levels, which was selected as the realistic pesticide exposure level for the agricultural field in Korea. It would be considered to be a basic data for predicting acute pesticide exposure of agricultural operators through TCP analysis using biological samples for farmers in agricultural field.
Keywords:
3,5,6-Trichloro2-Pyridinol, Chlorpyrifos, Prediction, Urine키워드:
뇨, 예측, 클로르피리포스, 흰쥐, TCP서 론
Chlorpyrifos (CPF)는 유기인계(organophosphates, OPs) 농약 중 하나로 과수 및 채소 작물에 진딧물이나 나방류등의 방제에 주로 쓰이며, 2015년에만 34 ton이 생산되는 등(KCPA, 2015) 농업분야에서 널리 사용되고 있는 농약이다(Eaton et al., 2008).
하지만, CPF가 체내로 흡수되면 주로 간에서 cytochrome P450에 의해 CPF-oxon으로 분해되고, 이는 acetylcholinesterase (AChE)의 활성을 저해하여 Ach의 축적을 일으키고 신경독성을 유발하는 물질로 알려져 있다(ATSDR, 1997). CPF-oxon은 A-esterase에 의해 3,5,6-trichloro-2-pyridinol (TCP)과 diethyl phosphate로 대사되며, 경구 및 경피 노출시 각각 70%, 1.3%씩 소변 통해 대사체인 TCP로 배설된다(Nolan et al., 1984; Aprea et al., 2002). 체내에 노출된 CPF의 소실반감기(elimination half-life)는 26.9시간으로, 농작을 살포하는 농작업자의 TCP 배설률은 18-24시간에 최대치가 되는 것으로 보고된다(Nolan et al., 1984; Fenske and Elkner, 1990; Hines and Deddens, 2001).
화학적으로 CPF는 친지성 구조로 인해 생체 침투율이 높아 농작업자의 농약 제조 및 살포시 피부와 호흡기를 통한 노출이 주된 경로가 된다(Griffin et al., 1999; Jung et al., 2002). 농작업자의 농약 노출 평가에는 수동적 측정방법과 생물학적 측정법을 이용할 수 있는데, 수동적 측정법이 패치, 장갑, 마스크 등을 분석하는 데 반해, 생물학적 측정법은 소변, 타액, 혈액 중 대사체를 이용하여 피부 또는 복합적인 노출로 부터 내부노출량(internal dose)을 평가하므로 보다 더 적절한 방법으로 꼽힌다(Griffin et al., 1999; Kim et al., 2011).
CPF의 생물학적측정법으로 주요 대사체인 뇨 중 TCP를 biomarker로서 생체 모니터링 연구가 다수 수행되고 있으며, 미국과 멕시코에서는 역학조사로 일반 인구와 임산부를 대상으로 뇨 중 TCP수치를 모니터링 하였으며(Fortenberry et al., 2014; Morgan, 2015), 농작업자와 그 가족을 대상으로 한 연구도 수행되었다(Alexander et al., 2006).
반면, 국내에서는 일반인구 및 취약계층을 대상으로 유기인계 살충제의 뇨 중 대사체를 분석하여 모니터링 하였으며 (KFDA, 2010). Jung 등(2002)은 국내 농작업자에 대한 CPF의 피부 흡수 및 노출평가를 위해 토끼를 이용한 피부자극시험과 국내 과수 농작업자들의 수동적 측정법에 따른 노출자료를 이용하여 위해성을 평가하였다. 하지만, 농작업자 생체 시료를 이용한 농약의 급성노출에 대한 예측 등 위해성평가 연구가 미비한 실정이다.
따라서, 본 연구에서는 실제 농업현장에서 농작업자에게 노출되는 농약의 사용농도를 선정하기 위하여, 농촌진흥청에서 사용하고 있는 농작업자 노출예측모델(Korean predicted operator exposure Model, KoPOEM)을 통해 선정된 농약의 수준으로, 사과에 등록된 CPF의 안전사용기준(phostharvest interval; PHI)에 근거하여 7일 간격으로 3회선정하였다. 흰쥐의 피부를 통해 CPF를 반복 노출 시킨 후 뇨 중 TCP 배설량 변화를 확인하고, 노출과 배설의 상관성을 확인하였으며, 최종적으로 뇨 중 TCP의 배설량을 통해 노출량을 예측하고 위해성을 평가하였다.
재료 및 방법
시험물질 및 시약
Chlorpyrifos (99%)는 technical grade로 (주)한국삼공(Seoul, Korea)에서 제공 받아 사용 하였으며, TCP (99.8%), HCl (37%), N-methyl-N-(tert.-butyldimethylsilyl) trifluoroacetamide (MTBSTFA, 97%), 2,6-dibromophenol (99%) 등 모든 시약은 sigma (St. Louis, MO, USA)에서 구입하여 사용하였다.
시험동물 및 사육조건
시험에 사용된 동물은 7주령의 Sprague-Dawley 수컷 흰쥐를 Koatech (Gyeonggi-Do, Korea)로 부터 구입하여 사용하였다. 시험 전 일주일간 순화기간을 거쳤으며, 온도 23 ± 2 oC, 습도 50-60 %의 조건에서 사육하였다. 처리군별로 11마리의 실험동물을 사용하였으며, 전 시험기간 동안 자유급식 하였다.
노출 수준 설정 및 투여방법
시험 농약의 노출 수준은 우리나라 농작업자가 사과작물에 CPF 유제 20%를 살포할 때 실제 노출되는 수준으로 선정하고자, 우리나라 농작업자 농약 노출량 산출모델인 KoPOEM을 통해 계산하였다. 시험에서는 실제 노출량을 저농도군 (1.005 mg/kg bw)으로 하고 공비 10을 두어 중간농도군 (10.05 mg/kg bw)과 고농도군 (100.05 mg/kg bw)를 선정하였다. 노출 횟수는 사과 작물의 CPF 유제 20% 안전사용기준에 따라 7일간격 3회를 선정하였고, 노출 시간은 KoPOEM에서 적용하는 1일 노출시간에 따라 6시간 노출하였다.
시험물질은 corn oil에 녹여서 사용하였으며 노출농도 및 투여용량은 노출 직전 흰쥐의 체중으로 환산하여 적용하였다. 경피 투여를 위해 4×4 cm의 거즈에 시험물질을 균일하게 처리하여 비자극성 테이프로 고정하였으며, 노출시간 종료 후 멸균증류수로 피부에 남아있는 시험물질을 제거하였다. 매 노출 직후, 그리고 마지막 노출 7일 후 24시간 동안의 뇨 시료를 채취하고, 분석 전까지 -70oC에서 냉동 보관하였다.
뇨 시료의 TCP 대사체 분석
뇨 중 TCP 분석은 Chuang 등(2004)의 방법에 따라 다음과 같이 처리하였다. 뇨 시료 1 mL에 내부표준물질(2,6-Dibromophenol) 50 μL (0.5 μg/mL)와 HCl (12 N) 100 μL를 각각 첨가 한 뒤 80oC에서 1시간 동안 가수분해 하였으며, 20% NaCl 1 mL와 chlorobutane 1 mL를 각각 첨가하고 20분간 진탕 추출하였다. 추출액을 원심분리 후 상층액을 질소가스로 완전히 건조 한 후, Acetonitrile 30 μL과 MTBSTFA 10 μL 첨가한 뒤 70oC에서 45분 동안 유도체화시켰다.
분석기기는 6890 Gas chromatography에 5973 Mass spectrometry (Agilent, Santa Clara, USA)울 연결한 GC/MSD를 사용하였으며, 분석시료 1 μL를 splitless mode로 주입하였다. 컬럼은 DB-5 (30 m × 0.32 mm × 0.5 μm)을 사용하였으며 운반기체로는 He을 유속 2 mL/min으로 설정하였다. 주입기 온도는 280oC로 하였으며, 오븐 온도는 초기 60oC 이후 1단계 1분 유지 후 분당 30oC씩 180oC까지, 2단계 분당 10oC씩 220oC까지, 3단계 분당 60oC로 최종 280oC까지 상승시킨 후 1분 동안 유지하였다.
정량분석을 위해 selected ion-monitoring (SIM) mode을 이용하였으며, TCP와 IS의 머무름 시간(retention time)은 각각 8.02, 9.06 분에서 관찰되었다. 기기분석의 유효성을 확인하기 위해 무처리된 뇨 시료에 TCP를 9.38 μg/mL이 되게 첨가하여 분석법의 정확성(accuracy, %)과 정밀성(precision, %)을 확인하였다.
뇨 중 creatinene 분석
뇨 중 대사체의 정량을 위해서는 creatinine으로 보정하는 방법이 사용되고 있으며(Kim et al., 2015), 뇨 중 creatinine 분석은 Jaffe Method를 근거로 Kim 등(2017)의 방법에 따라 다음과 같이 측정하였다. Creatinine 표준용액, blank 및 희석된 뇨 시료를 96 well plate에 각각 50 μL/well씩 첨가한 후, 0.3 N NaOH과 1% picric acid을 1:1의 비율로 혼합한 반응 용액을 100 μL/well씩 첨가하였다. 15분동안 상온에 방치한 후, 480 nm 파장 조건에서 Multiskan microplate reader (Thermo Scientific, Vantaa, Finland)로 흡광도를 측정하였다. 시험은 3반복 수행하였다
뇨 중 TCP를 통한 CPF 노출량 예측 및 위해성평가
CPF의 반복 노출에 따른 흡수율(%)을 산출하고자 실제 농업현장의 노출농도인 저농도 처리군에 대해서 매 노출 후 24시간 동안의 TCP 배설량에 뇨 부피를 적용하여 누적 TCP량(μg)을 구하고, 이를 CPF/TCP의 분자량 비율을 적용하여 CPF로 환산하였으며, 실제 처리된 양과의 비율을 구하여 흡수율로 하였다(Meuling et al., 2005).
매 노출에 따른 CPF의 일일흡수용량(Absorbed daily dose, ADD)을 구하기 위하여 아래와 같이 Phung et al. (2012)의 산출식을 적용하였다. CF는 CPF의 70%가 뇨 중 TCP로 배설된다는 선행연구 결과에 근거하여 10/7에 해당하는 1.4를 적용하였다(Nolan et al., 1984).
C : 일일 TCP 배설량(μg/g creatinine), Cn : 일일 creatinine 배설량(g/day), CF : 보정 계수(correction factor 1.4), Rmw : CPF/TCP 분자량 비, BW : 체중(Body weight)
ADD 값에 대해 확률적 분포를 적용하기 위하여 Crystal ball software ver.11.1.2.4l (Oracle, Vallejo, US)를 이용하였으며, 24시간 동안의 검출치에 대한 누적 확률로 CP (cumulative probability, %)를 구하였다. 위해성평가에 적용하기 위하여 ADD의 중앙값과 극단값 산출을 위하여 분포의 중앙값(median)과 상위 5% 값(95%tile)을 채택하였다.
CPF 노출량에 따른 위해지수(hazard quotient, HQ)는 농작업자에 대한 급성 독성기준치를 근거로 하여 독성기준치 대비 노출량으로 산출하였으며, 위해도의 중앙값(median)인 HQ50와 극단노출값(95%tile)인 HQ95으로 나누어 계산하였다. 최종적으로 HQ가 1.0 이상인 경우 노출에 따른 영향이 있는 것으로 판단하였다(Atabila et al., 2018a)
통계처리
통계 처리는 SPSS ver. 20 (SPSS, Chicago, IL, USA)를 이용하였으며, 시험군 간 차이 검증을 위해 one-way ANOVA (analysis of variance)를 실시하였다. 사후 검증으로 Duncan’s test를 수행하였으며 유의수준 0.05에서 유의성을 검증하였다. CPF 노출 수준과 뇨 중 3-PBA 배설량 변화의 상관성은 회귀분석(regression analysis)을 통해 확인하였다.
결과 및 고찰
뇨 중 TCP 분석법 검증
무처리된 뇨 시료를 이용하여 TCP를 분석하여 얻은 검정곡선 y = 9.76x − 0.24(r² = 0.9962)을 통하여 CPF를 반복 노출한 흰쥐의 뇨 중 TCP 배설량을 계산하였다. GC/MSD를 통한 본 분석법의 유효성을 확인하기 위해 TCP 농도가 9.38 μg/mL가 되도록 제조하여 시험법의 정확성과 정밀도를 확인하였다.
시험결과 본 시험의 정확성(%)을 나타내는 회수율(recovery, %)은 93.4-111.9%의 범위였으며, 정밀성(%)인 coefficient of variation (CV)는 3.8-6.8로 나타나, EU 가이드라인(2011)에 따른 기준인 정확성(70-120%)과 정밀성(≤ 20%)을 충족하였다.
CPF 반복 노출에 따른 뇨 중 TCP 배설량 변화
CPF는 7일간격으로 저(1.01 mg/kg), 중(10.05 mg/kg), 고농도(100.50 mm/kg)로 경피를 통해 3회 반복 노출한 시험군의 매 노출 후 24시간 동안, 그리고 최종 노출 1주일 후의 24시간 동안 뇨를 통해 배설된 TCP 양을 creatinine으로 보정한 결과는 Table 1과 같다.

Creatinine-corrected concentrations of TCP in urines for 24 hours in rats following the repeated dermal exposure to chlorpyrifos (CPF)(Unit ; μg/g creatinine)
실제 농업현장의 CPF의 노출수준인 저농도군의 뇨 중 TCP 배설량은 1회 노출후 24시간 동안 190.12 ± 70.67 μg/g creatinine이었으며, 2회 노출 후에도 110.94 ± 28.43 μg/g creatinine으로 유의적인 차이가 없었다. 그러나, 이는 3회 노출 후 24시간 동안 48.88 ± 13.01 μg/g creatinine으로 유의 적으로 감소하였으며, 최종 노출인 3회 노출 후 7일째에 24시간동안 채취한 뇨 시료에서 2.81 ± 0.64 μg/g creatinine으로 3회 노출 직후에 비해 보다 유의적으로 감소하여 대조군과 유사한 수준에 도달하였다(p<0.01). 저농도군의 10배로 노출된 중농도 시험군의 뇨 중 TCP 배설량은 저농도 시험군의 배설량 변화와 유사한 경향을 보였다. TCP는 체내의 소실 반감기가 27시간이라는 선행연구(Nolan et al., 1984)의 보고에 근거했을 때, CPF의 노출에 따른 뇨 중 TCP가 매 노출 후 24시간동안 대부분 배출된 결과로 생각된다.
저농도군의 100배로 노출된 고농도 시험군에서는 CPF의 1회 노출 후 24시간 동안 뇨를 통한 TCP가 12,037.67 ± 6,060.38 μg/g creatinine 수준으로 배설되었으나, 2회 노출 후 5,242.18 ± 3,196.75 μg/g creatinine으로 유의적으로 감소하였다. 따라서, 노출농도가 증가할수록 노출횟수가 반복되면 뇨 중 TCP 배설량의 감소폭이 상대적으로 빨리 나타나는 것을 알 수 있다.
Table 1의 뇨 중 TCP 배설량의 변화를 매 노출에 따른 시간 추이로 도식화 한 결과(Fig. 1)에서도 CPF의 노출농도가 증가할수록 상대적인 뇨 중 TCP의 감소폭은 증가하였으며, 본 시험의 최종 노출인 3회 노출 7일 이후 뇨를 통한 TCP의 배설이 저농도군과 중농도군 모두 대조군 수준으로 감소한 것을 알 수 있다. 고농도군은 실제 농업현장의 노출농도의 100배에 해당하는 매우 높은 수준의 노출농도이며, 반복횟수를 보다 늘릴 경우 뇨 중 TCP의 배설은 대조군 수준으로 감소할 것으로 예상된다.
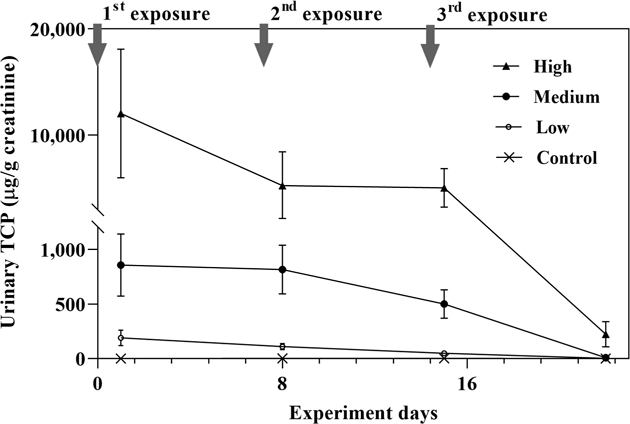
Time courses of urinary TCP excretion in rats following the repeated dermal exposure to chrorpyrifos ; Each plot represents the mean ± S.D of 11 animals.
CPF의 경피 노출농도와 뇨 중 TCP의 배설량과의 상관관계를 CPF 노출농도군별로 살펴본 결과는 Fig. 2와 같다. 저농도, 중농도 및 고농처리군에서 농도의존적 상관성(r2)이 각각 0.7627, 0.6774 및 0.8618로 높은 상관성을 보였다. 이는 뇨 중 TCP 검출결과를 이용해 CPF의 피부노출량에 대한 예측능이 높을 수 있음을 의미하는 것으로 생각된다.
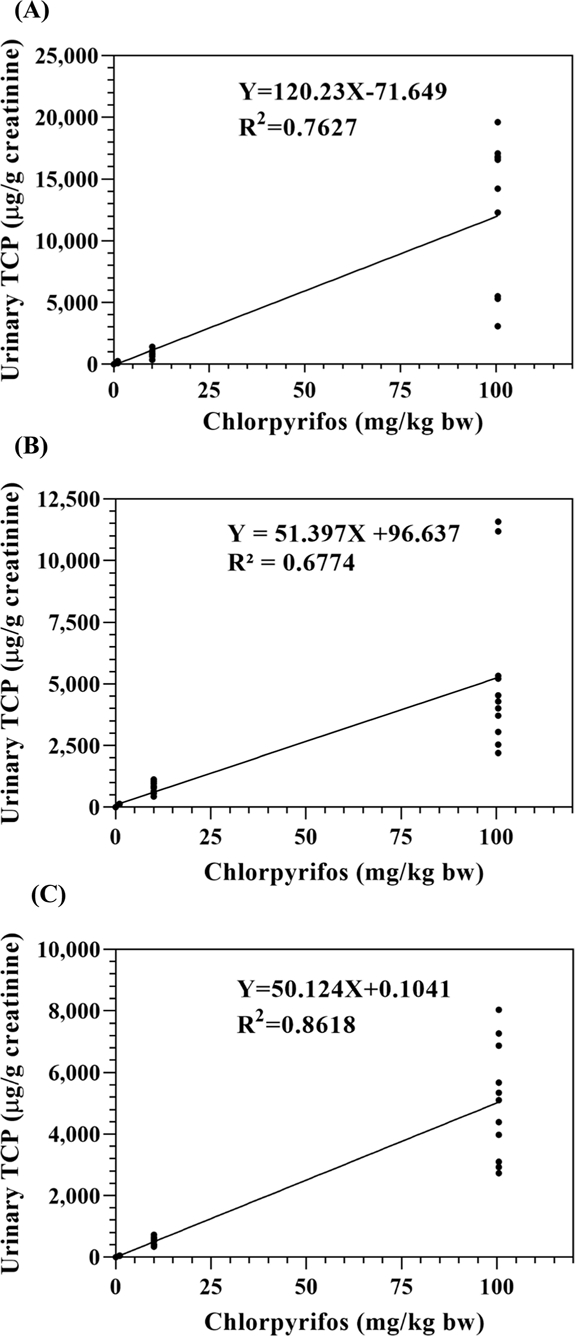
Correlation between dermal exposure to chlorpyrifos and urinary 3-PBA excretion in rats ; 1st (A), 2nd (B) and 3rd (C) exposure to chlorpyrifos.
한편, 국외 농작업자에 대한 선행연구 결과 살포 후 24시간 동안 뇨 중 TCP 배설량이 베트남(N=18)에서 평균 47.5 μg/g creatinine, 미국(N=34) 10.5 μg/g creatinine로 보고되었다(Alexander et al., 2006; Phung et al., 2012). 본 연구결과에서 국내 농작업자 노출수준인 저농도군에서 3회 노출직후 뇨를 통한 TCP 배설량이 48.88 ± 13.01 μg/g creatinine으로 감소하였으며, 10배 높게 노출된 중동도군에서도 3회 노출 7일 후 8.72 ± 6.34 μg/g creatinine으로 감소하여, 베트남 및 미국의 농작업자의 수준과 유사함을 알 수 있다.
뇨 중 TCP 배설량을 이용한 CPF 노출량 예측
CPF는 체내 흡수된 후 대부분 뇨로 배설된다는 선행연구(Tanvir et al., 2016)에 근거해 실제 농업현장의 노출농도인 저농도 처리군에 대해서 노출된 CPF의 흡수량을 환산한 결과는 Table 2와 같다. 저농도 처리군의 매 반복 노출에 따른 뇨 중 TCP의 배설량에 근거한 CPF의 흡수율이 1회 18.81%, 2회 10.10%, 3회 4.20%로 노출 횟수가 증가할수록 감소하는 것을 알 수 있다.

The Absorbed chlorpyrifos(CPF) ratio estimated from urinary TCP excretion in rats following the repeated dermal exposure to low CPF-exposured level
선행연구 결과, 인체의 뇨 중 TCP 분석을 통한 CPF 피부흡수에 관한 연구에 따르면, 50 μg/cm2 CPF를 피부에 4시간 처리시 4.3%의 흡수율을 나타내었으며(Meuling et al., 2005), 인체를 대상으로 한 CPF 피부 흡수 시험에서도 노출량의 1-1.3%가 흡수되는 것으로 보고(Nolan et al., 1984; Griffin et al., 1999)하여, 본 연구의 흡수율과 유사한 수준임을 알 수 있다.
Phung et al. (2012)의 산출식을 이용하여 CPF의 노출에 따른 일일흡수용량(Absorbed daily dose, ADD)을 산출한 결과, 1회 노출 직후 22.51 ± 8.65 μg/kg/day에서 2회 노출 직후 11.87 ± 3.1 μg/kg/day, 3회 노출직후 5.64 ± 1.63 μg/kg/day로 점차 감소하였다(Table 3). 또한, ADD 값들에 대해 확률적 분포를 적용하여 중앙값(CP50)과 상위5%인 극단값(CP95)을 선정한 결과, CP50 및 CP95가 각각 5.31~18.08 μg/kg/day 및 8.20~35.32 μg/kg/day의 범위를 보였다.

The Absorbed daily dose (ADD) of chlorpyrifos (CPF) estimated from urinary TCP excretion in rats following the repeated dermal exposure to low CPF-exposured level
본 연구에서 실제 농업현장에서 농작업자 노출되는 수준인 저농도군의 ADD를 선행연구(Alexander et al., 2006; Phung et al., 2012; Atabila et al., 2018b)와 비교한 결과를 Fig. 3에 나타내었다. 베트남, 가나 및 미국 농민의 뇨를 통한 TCP 배설량을 이용해 예측된 CPF의 ADD 중간값이 각각 9 μg/kg/day (rang : 0.4-94.2 μg/kg/day), 6 μg/kg/day (range : 0.7-74 μg/kg/day), 2.5 μg/kg/day(range : 0.7-26 μg/kg/day)이었으며, In vitro 쥐 피부모델 연구(Kim et al., 2016)에서 우리나라 농작업자 노출수준으로 CPF를 처리한 경우 노출양은 12 μg/kg/day이라고 보고하였다.
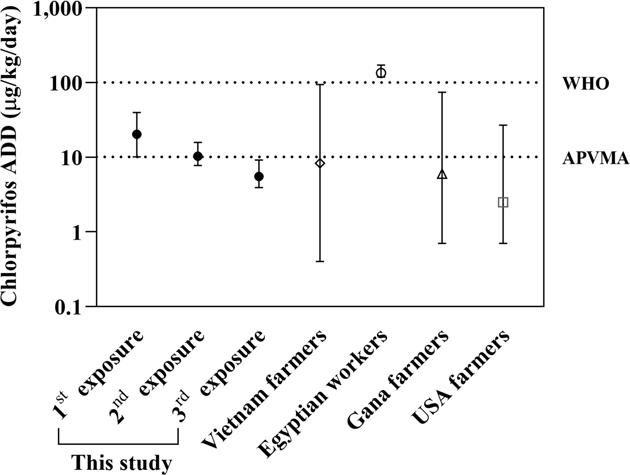
Comparison of chlorpyrifos Absorbed daily dose (ADD) among applicators in various countries and this study, adapted from Phung et al. (2012).
본 연구에서 흰쥐를 이용한 CPF에 대한 경피 노출 직후 ADD가 5.64~22.51 ug/kg/day의 범위를 보임에 따라, 개인보호장구 미착용 비율이 높아 농약 노출량이 많은 것으로 보고된 바 있는 이집트를 제외하고(Farahat et al., 2010), 베트남, 가나 및 미국 농민에 대한 결과와 유사한 수준으로 나타났다. 따라서, 본 연구에서 흰쥐를 이용한 뇨 중 TCP 검출결과를 통한 CPF 노출의 예측이 실제 인체의 생체시료를 이용한 바이오 모니터링 결과를 이용한 예측과 유사한 결과를 보임을 확인할 수 있었다.
뇨 중 TCP를 통한 CPF의 위해성평가
뇨 중 TCP 검출결과를 이용한 CPF의 위해성평가를 위해 ADD를 WHO (100 μg/kg/day) 및 호주의 APVMA (10 μg/kg/day)에서 설정한 CPF의 급성 농작업자노출허용량 기준으로 나눈 중앙값(HQ50) 및 극단값(HQ95)은 Table 4와 같다. WHO 독성기준치(WHO, 2009)에 근거한 HQ50 및 HQ95는 0.05-0.35의 범위로 모두 1 이하로 나타나나, 중간노출수준과 상위 5% 노출수준에서도 건강에 유해한 영향을 주지 않는 것으로 판단되었다. 농작업자들을 대상으로 한 선행연구결과에서도 가나는 HQ50 (0.08) 및 HQ95 (0.8) (Atabila et al., 2018b), 베트남은 HQmean (0.2) 및 HQmax (0.9) (Phung et al., 2012)으로 본 연구의 결과와 유사한 수준을 보였다.

Hazard Quotient (HQ) with median and 96%tile values of chlorpyrifos exposure in rats following the repeated dermal exposure to low CPF-exposured level
반면 APVMA (2009)은 WHO (2009)보다 10배 낮은 기준으로 권고되어 1회 노출 시 HQ50 (18.08), HQ95 (3.53)으로 기준치 이상으로 나타났으나, 노출 횟수가 증가할수록 위해도가 감소하여 3회 노출 후 HQ50 0.53, HQ95 0.82로 기준치 이하로 감소하였다. 이상의 결과를 토대로, 농약을 반복적으로 사용하게 되는 농가현실을 고려할 때 우리나라 CPF의 노출은 안전한 수준임을 확인할 수 있었다.
Kim 등(2016)에 따르면 피부에 처리된 CPF는 표피에 그대로 남으며, 각질층(stratum corneum)과 표피/진피층(epidermis/dermis)에 축적되는 것으로 보고되었다(Moore et al., 2014). 피부를 통한 농약의 노출은 주된 농작업자의 노출경로로 농작업자가 실제 농업현장에서 노출될 수 있는 저농도의 농약에 반복 노출되는 경우 인체의 생체시료의 대사체 분석을 통해 신속히 농약의 노출량을 예측함으로써 농약을 사용하는 농작업자에 따른 안전성을 확보할 수 있을 것이다. 본 연구의 결과는 농업현장의 농작업자에 대한 생체시료를 이용하여 대사체인 TCP 배설량 분석값을 통해 급성적인 농약 노출량을 예측하기 위한 기초자료가 될 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ01423701)의 지원에 의하여 이루어진 것입니다.
References
-
Alexander, B. H., C. J. Burns, M. J. Bartels, J. F. Acquavella, J. S. Mandel, C. Gustin and B. A. Baker (2006). Chlorpyrifos exposure in farm families: Results from the farm family exposure study. J. Expo. Sci. Environ.16(5):447-456.
[https://doi.org/10.1038/sj.jes.7500475]

-
Aprea, C., C. Colosio, T. Mammone, C. Minoia and M. Maroni (2002) Biological monitoring of pesticide exposure: a review of analytical methods. J. Chromatogr. B. 769(2):191-219.
[https://doi.org/10.1016/S1570-0232(02)00044-2]

-
Atabila, A., D. T. Phung, J. N. Hogarh, R. Sadler, D. Connell and C. Chu (2018a). Health risk assessment of dermal exposure to chlorpyrifos among applicators on rice farms in Ghana. Chemosphere, 203:83-89.
[https://doi.org/10.1016/j.chemosphere.2018.03.121]

-
Atabila, A., R. Sadler, D. T. Phung, J. N. Hogarh, S. Carswell, S. Turner, R. Patel, D. Connell and C. Chu (2018b) Biomonitoring of chlorpyrifos exposure and health risk assessment among applicators on rice farms in Ghana. Environ. Sci. Pollut. Res. Int. 25(21):20854-20867.
[https://doi.org/10.1007/s11356-018-2259-9]

- Agency for Toxic Substances and Disease Registry (1997) Toxicological profile for chlorpyrifos. Agency for Toxic Substances and Disease Registry. Atlanta, GA.
- Australian Pesticides and Veterinary Medicines Authority (2009) Chlorpyrifos preliminary review findings report on additional residues data. Australian Pesticides and Veterinary Medicines Authority, Canberra.
-
Chuang, J. C., J. M. Van Emon, A. W. Reed and N. Junod (2004) Comparison of immunoassay and gas chromatography/mass spectrometry methods for measuring 3, 5, 6-trichloro-2-pyridinol in multiple sample media. Anal. Chim. Acta. 517(1-2):177-185.
[https://doi.org/10.1016/j.aca.2004.04.034]

-
Eaton, D. L., R. B. Daroff, H. Autrup, J. Bridges, P. Buffler, L. G. Costa, J. Coyle, G. McKhann, W. C. Mobley, L. Nadel, D. Neubert, R. Schulte-Hermann and P. S. Spencer (2008) Review of the toxicology of chlorpyrifos with an emphasis on human exposure and neurodevelopment. Crit. Rev. Toxicol. 38(sup2):1-125.
[https://doi.org/10.1080/10408440802272158]

-
Farahat, F. M., R. A. Fenske, J. R. Olson, K. Galvin, M. R. Bonner, D. S. Rohlman, T. M. Farahat, P. J. Lein and W. K. Anger (2010) Chlorpyrifos exposures in Egyptian cotton field workers. Neurotoxicology. 31(3):297-304.
[https://doi.org/10.1016/j.neuro.2010.02.005]

-
Fenske, R. A. and K. P. Elkner (1990) Multi-route exposure assessment and biological monitoring of urban pesticide applicators during structural control treatments with chlorpyrifos. Toxicol. Ind. Health. 6(3-4):349-371.
[https://doi.org/10.1177/074823379000600301]

-
Fortenberry, G. Z., J. D. Meeker, B. N. Sánchez, D. B. Barr, P. Panuwet, D. Bellinger, L. Schnaas, M. Solano-González, A. S. Ettinger, M. Hernandez-Avila, H. Hu, M. M. Tellez-Rojo (2014) Urinary 3, 5, 6-trichloro-2-pyridinol (TCPY) in pregnant women from Mexico City: distribution, temporal variability, and relationship with child attention and hyperactivity. Int. J. Hyg. Environ. Health. 217(2-3):405-412.
[https://doi.org/10.1016/j.ijheh.2013.07.018]

-
Griffin, P., H. Mason, K. Heywood and J. Cocker (1999) Oral and dermal absorption of chlorpyrifos: a human volunteer study. Occup. Environ. Med. 56(1):10-13.
[https://doi.org/10.1136/oem.56.1.10]

-
Hines, C. J. and J. A. Deddens (2001) Determinants of chlorpyrifos exposures and urinary 3, 5, 6-trichloro-2-pyridinol levels among termiticide applicators. Ann. Occup. Hyg. 45(4):309-321.
[https://doi.org/10.1016/S0003-4878(01)00026-6]

- Jung, K. M., H. M. Lee, E. H. Lee, S. H. Lee, J. H. Kim, Y. Y. Sim and Y. W. Lee (2002) Human dermal risk assessment on chlorpyrifos of Korean farmers. Environmental Mutagens and Carcinogens, 22(3):187-198.
- Korea Crop Protection Association (2015) Agrochemicals year book.
-
Kim, A., K. Chon, K. H. Park, B. C. Moon, J. H. Ro and M. K. Paik (2017) The correlation between deltamethrin exposure and urinary 3-PBA concentrations in rats. Korean J. Environ Agric. 36(4):293-298.
[https://doi.org/10.5338/KJEA.2017.36.4.41]

- Kim, E. H., H. R. Lee, H. Choi, J. K. Moon, S. S. Hong, M. H. Jeong, K. H. Park, H. M. Lee and J. H. Kim (2011) Methodology for quantitative monitoring of agricultural worker exposure to pesticides. Korean J. Pestic. Sci. 15(4):507-528.
-
Kim, K. Y., J. G. Kim, K. N. Yoon, W. M. Park and H. H. Park (2015) Effects of Factors Associated with Urine Hippuric Acid Correction Values in Urinary Creatinine by HPLC and Jaffe Method and Specific Gravity HPLC Jaffe Method. Journal of Korean Society of Occupational and Environmental Hygiene, 25(4):493-505.
[https://doi.org/10.15269/JKSOEH.2015.25.4.493]

-
Kim, S. H., J. B. Jang, K. H. Park, M. K. Paik and S. H. Jeong (2016) Evaluation of Dermal Absorption Rate of Pesticide Chlorpyrifos Using In Vitro Rat Dermal Tissue Model and Its Health Risk Assessment. Biomed. Sci. Letters. 22(4):140-149.
[https://doi.org/10.15616/BSL.2016.22.4.140]

- Korea Food and Drug Administration (2010) Biomonitoring of organophosphorus and pyrethroid insecticides residue in general population.
-
Meuling, W. J. A., L. C. Ravensberg, L. Roza and J. J. Van Hemmen (2005) Dermal absorption of chlorpyrifos in human volunteers. Int. Arch. Occup. Environ. Health. 78(1):44-50.
[https://doi.org/10.1007/s00420-004-0558-6]

-
Moore, C. A., S. C. Wilkinson, P. G. Blain, M. Dunn, G. A. Aust and F. M. Williams (2014) Percutaneous absorption and distribution of organophosphates (chlorpyrifos and dichlorvos) following dermal exposure and decontamination scenarios using in vitro human skin model. Toxicol. Lett. 229(1):66-72.
[https://doi.org/10.1016/j.toxlet.2014.06.008]

-
Morgan, M. K. (2015) Predictors of urinary levels of 2,4-dichlorophenoxyacetic acid,3,5,6-trichloro-2-pyridinol, 3-phenoxybenzoic acid, andpentachlorophenol in 121 adults in Ohio. Int. J. Hyg. Environ. Health. 218(5):479-488.
[https://doi.org/10.1016/j.ijheh.2015.03.015]

-
Nolan, R. J., D. L. Rick, N. L. Freshour and J. H. Saunders (1984) Chlorpyrifos: pharmacokinetics in human volunteers. Toxicol. Appl. Pharmacol. 73(1):8-15.
[https://doi.org/10.1016/0041-008X(84)90046-2]

-
Phung, D. T., D. Connell, G. Miller, M. Hodge, R. Patel, R. Cheng, M. Abeyewardene and C. Chu (2012) Biological monitoring of chlorpyrifos exposure to rice farmers in Vietnam. Chemosphere. 87(4):294-300.
[https://doi.org/10.1016/j.chemosphere.2011.11.075]

- European Commission (2011) Method validation and quality control procedures for pesticide residues analysis in food and feed. In Document N° SANCO, 12495.
-
Tanvir, E. M., R. Afroz, M. A. Z. Chowdhury, S. H. Gan, N. Karim, M. N. Islam and M. I. Khalil (2016) A model of chlorpyrifos distribution and its biochemical effects on the liver and kidneys of rats. Hum. Exp. Toxicol. 35(9):991-1004.
[https://doi.org/10.1177/0960327115614384]

- World Health Organization (2009) Specifications and Evaluations for Public Health Pesticides: Chlorpyrifos. World Health Organization, Geneva.