Tebuconazole 저항성 감탄저병균의 특성 및 경합 능력
초록
전국 감 재배 지역에서 분리한 53개의 감탄저병균 Colletotrichum horii 균주를 한천희석법으로 검정한 결과, 20개 균주가 감수성 균주로, 33개 균주가 저항성 균주로 판명되었다. 두 그룹의 C. horii 균주의 PDA 상에서의 균사생장과 포자형성량을 조사한 결과, 균사생장과 포자형성량 모두 저항성 균주에 비하여 감수성 균주가 우수하였다. Tebuconazole 감수성인 C. horii 15GKYD4와 저항성인 15GKNJ3을 선발하여 경합능력을 실험한 결과, tebuconazole을 첨가하지 않은 PDA 배지에서 1세대와 2세대의 감수성 비율은 81.5%와 92.5%이었으며, 3세대에는 모든 균주가 감수성 균주이었다. Tebuconazole을 0.005 μg/mL 첨가한 PDA 배지에서는 1세대에 44.4%이었던 감수성 균주의 비율이 6세대에는 96.8%로 증가하였고, 7세대에서는 분리되는 모든 균주가 감수성으로 나타났다. 0.05 μg/mL의 tebuconazole이 첨가된 PDA 배지에서는 1세대 만에 감수성 균주는 전혀 분리되지 않고, 저항성 균주만이 100% 분리되었다. 본 연구 결과를 근거로 DMI 살균제 저항성인 감 탄저병균이 발생한 지역에서의 DMI 살균제 사용을 철저하게 관리해야 할 것으로 생각한다.
Abstract
As a result of agar dilution test, 53 isolates of Colletotrichum horii causing persimmon anthracnose obtained from persimmon fields were found to be 20 isolates as sensitive isolates and 33 isolates as resistant ones. The mycelial growth and sporulation were examined on PDA of two groups of C. horii isolates. Both mycelial growth and sporulation of sensitive isolates were better than resistant ones. Competition test was tested with C. horii 15GKYD4 sensitive to tebuconazole and 15GKNJ3 resistant to the fungicide, and the ratios of sensitive isolates at 1st and 2nd generation in PDA medium without tebuconazole were 81.5% and 92.5%. There were no resistant isolates in the 3rd generation and all isolates were sensitive. In the PDA medium containing 0.005 μg/mL of tebuconazole, the percentage of sensitive isolates (44.4% in 1st generation) increased to 96.8% in 6th generation, and all isolates in 7th generation were sensitive. In PDA medium supplemented with 0.05 μg/mL of tebuconazole, no sensitive isolates were obtained at all, but only 100% of resistant isolates. Based on the results of this study, the use of DMI fungicides in areas where C. horii resistant to tebuconazole has occurred should be thoroughly controlled.
Keywords:
Colletotrichum horii, Competition test, DMI fungicide resistance, Field fitness, Persimmon anthracnose키워드:
감 탄저병균, Colletotrichum horii, DMI 살균제 저항성, 포장 적응력, 경합능력서 론
연간 생산량 면에서 사과와 감귤 다음으로 중요한 과수작물인 감(Diospyrus kaki)은 탄저병에 의해서 생산량에 직접적으로 영향을 받을 뿐만 아니라 품질저하에도 큰 영향을 받기 때문에, 감 재배 농민들은 재배기간 중 가장 문제가 되는 병으로 탄저병을 들고 있다(Lee et al., 2001; Lim et al., 2008). 감 탄저병을 일으키는 Colletotrichum horii는 주로 열매에 발생하지만, 신초나 도장지를 침입하여 줄기를 말라 죽게 하는 원인이 되기도 하며, 심하면 나무의 생장이 감소하다가 2~3년 안에 고사될 수 있다(Kwon and Park, 2004; Xie et al., 2010). 감 재배 기간 동안에 탄저병은 신초 생성기부터 수확기까지 대부분의 생육기간 동안 발생하기 때문에 적절한 시기에 살균제를 처리하는 것이 방제 성공의 관건이 될 수 있다(Kwon and Park, 2004). 탄저병의 방제를 위해서 사용하는 살균제로는 benzimidazole계 살균제, QoI (Quinone oxidation inhibiting)계 살균제, DMI (Demethylation inhibiting)계 살균제 등이 있는데, 이중 탈메틸화 효소의 활성을 억제하는 DMI 살균제는 triazole기를 갖는 화학그룹에 속하는 cyproconazole, difenoconazole, imibenconazole, metconazole, tebuconazole과 imidazole기를 갖는 화학그룹에 속하는 prochloraz, triflumizole 등 총 7종이 등록되어 있다(Korean crop protection association, 2018).
DMI 살균제는 병원성 진균을 특이적으로 억제하기 때문에, 의학과 농학 분야 모두에서 많이 사용한다(Valsecchi et al. 2015). 또한 DMI 살균제는 특이적인 작용점을 가지고 있으며, 실험실 내에서 인위적으로 저항성인 돌연변이를 쉽게 얻을 수 있지만, 작용 스펙트럼이 넓은 살균제처럼 다양한 작물의 병 방제에 적용할 수 있다(Köller and Scheinpflug, 1987). 다양한 작물의 병 방제에 널리 사용되고 있음에도 불구하고, DMI 살균제에 대한 저항성 발현이 고위험성을 지닌 살균제처럼 나타나지 않을 뿐만 아니라, 실제 포장에서 저항성 병원균이 출현하여 benzimidazole계나 phenylamide계 살균제처럼 방제에 실패한 예도 찾아보기 어렵다. 하지만 오랜 기간 동안 DMI 살균제를 사용하면서 살균제에 대한 병원균의 감수성이 저하하거나, 저항성균이 계속적으로 출현하고 있다(Schepers, 1985; Holmes and Eckert, 1995; Karaoglanidisa et al., 2000; Frenkel et al., 2015). 국내에서도 벼키다리병균인 Fusarium fujikuroi에서 prochloraz에 대한 감수성이 저하하는 균주들이 보고되었으며(Shin et al., 2008), 병든 감에서 분리한 탄저병균도 분리한 지역에 따라서 DMI 살균제에 대한 감수성 정도가 변화되어 있는 지역이 나타나기 시작하였다(투고 중).
살균제 저항성균의 포장 적응력 측정은 포장에서 살균제 저항성 관리를 위한 효과적인 전략을 수립하는데 필요하다. 본 연구에서는 DMI 살균제에 대한 감수성균과 저항성균의 포장 적응력을 알아보기 위하여 균사생장과 포자형성 능력을 조사하였으며, DMI 살균제인 tebuconazole을 처리하지 않은 조건과 농도별로 처리한 조건에서 감수성균과 저항성균의 경합능력을 조사하였다.
재료 및 방법
실험에 사용한 병원균 및 균주 보관
2015년과 2016년에 국내 단감 주요 재배지에서 채집한 탄저병이 발생한 감 열매와 신초에서 단포자 분리한 감탄저병균을 사용하였다. 병든 조직을 표면살균 후, 습실 처리하여 병징 상에 분생포자가 형성됨을 확인하였다. 분생포자는 화염 소독한 백금이로 떼어내어 300 μg/mL의 streptomycin이 첨가된 멸균증류수에 현탁하여 포자액을 준비하였다. 포자밀도를 1×104~105개/mL로 조정한 포자현탁액 50 μL를 PDA (potato dextrose agar; Becton, Dickinson and Company, DifoTM) 배지에 도말하고 25oC의 암조건에서 2일간 배양한 후, 배지에 형성된 단균총을 분리하여 병원균의 순수배양체를 얻었다. 분리한 감탄저병균은 PDA 사면배지에 배양하여 4oC에서 보관하면서 실험에 사용하였다.
한천희석법을 이용한 살균제 감수성 조사
탈메틸화 효소 활성 저해 살균제(demethylase inhibiting fungicide, DMI fungicide)인 tebuconazole (a.i. 20%, SC)을 살균증류수에 희석하여 정해진 농도가 되도록 PDA 배지(300 μg/mL의 streptomycin 함유)에 첨가하였다. 순수분리한 병원균을 PDA 배지에 접종하여 25oC 암조건에서 7일간 배양한 후, 균총의 선단에서 직경 3 mm의 균사 조각을 떼어, 각 살균제가 농도별로 첨가된 PDA 배지에 균사가 자란 면이 밑으로 가도록 뒤집어서 접종하였다. 병원균을 25oC의 암조건에서 5일간 배양한 후 균총의 직경을 측정하여, 살균제를 첨가하지 않은 PDA 배지에서 균총과 tebuconazole을 농도별로 첨가한 PDA 배지의 직경을 비교하여 균사생장 억제효과를 구하였다.
병원균의 gDNA 추출
병원균의 gDNA를 추출하기 위하여 25oC의 암조건에서 10일 간 배양하였다. 멸균한 슬라이드글라스를 사용하여 균사체를 긁어 수확하고, glass beads (지름; 0.1 mm)가 담긴 2 mL tube에 넣고 -70oC에서 12시간 이상 동결 건조한 후 bead beater (bullet blender, NEXTADVANCE)를 이용하여 균사를 잘게 부수었다. SDS/NaCl buffer (0.2 M Tris-HCl (pH 7.5), 0.025 M EDTA (pH 8.0), 0.5% SDS, 0.25 M NaCl)를 1 mL 첨가한 후 65oC의 항온 수조에서 1시간 동안 반응시키고, 4oC에서 13,000 rpm으로 10분간 원심분리 하였다. 상징액만을 취하여 새로운 1.5 mL tube에 옮기고 동량의 phenol을 첨가하여 하얗게 될 때까지 교반하였다. 상온에서 10분간 반응시킨 후 다시 4oC에서 13,000 rpm으로 10분간 원심분리 하였다. 상징액만을 취하여 새로운 1.5 mL tube에 옮기고 1 mg/mL 농도의 RNase A (Lot No. 130183370, QI Agen Co.)를 20 μL 첨가한 후 65oC의 항온 수조에 20분간 반응시켰다. 혼합액과 동량의 chloroform을 첨가하여 50회 정도 위아래로 흔들어 주고, 상온에서 10분간 보관한 후 4oC에서 13,000 rpm으로 10분간 원심분리 하였다. 또다시 상징액만을 취하여 새로운 1.5 mL tube에 옮기고 상징액과 동량의 isopropyl alcohol을 첨가하여 50회 정도 위아래로 흔들어 주고, 4oC에서 13,000 rpm으로 10분간 원심분리 하였다. 상징액을 버리고 침전물만이 남은 1.5 mL tube에 70% ethanol 200 μL 첨가하여 세척하듯이 50회 정도 위아래로 흔들어 주고 4oC에서 13,000 rpm으로 10분간 원심분리 하였다. 상징액을 버린 후 1.5 mL tube의 뚜껑을 열어 상온에서 2시간 동안 건조시켰다. 건조가 된 침전물에 TE buffer 70 μL를 첨가한 후 -20oC에서 보관하였다. gDNA의 정량은 nano drop (Micro-p, M600)을 이용하여 순도와 gDNA의 농도를 확인하였고, TE buffer를 이용하여 50 ng/mL로 희석한 후, 실험에 사용하였다.
Internal Transcribed Spacer (ITS) 영역 염기서열 분석
ITS 영역을 증폭하기 위해 ITS5 (5'-GGA AGT AAA AGT CGT AAC AAG G-3')와 ITS4 (5'-TCC TCC GCT TAT TGA TAT GC-3')을 primer로 사용하여 PCR을 수행하였다. PCR 반응액은 gDNA 0.1 μg, 10X KAPA Taq buffer와 dye 2.5 μL, 2.0 mM의 dNTP 2.5 μL, Taq DNA polymerase (5 U/μL, Kapabiosystems) 0.1 μL, 멸균증류수 15.9 μL, 10 pmol의 ITS5와 ITS4 primer를 각각 1 μL를 첨가하여 만들었다. 반응 조건은 95oC에서 4분간 pre-denaturation 수행 후, 94oC에서 denaturation, 48oC에서 1분간 annealing, 72oC에서 1분간 extension 과정을 30회 반복하였고, 72oC에서 final extension 수행 후 종료하였다. 증폭된 PCR 산물을 확인하기 위해 1X TAE buffer로 1% agarose gel을 만들고 safe viewTM classic을 권장 사용량에 따라 첨가 하였다. 100 V에서 35~40분간 전기영동 한 후 UV-transilluminator를 이용하여 증폭산물을 확인하였다. 증폭된 PCR 산물은 ExpinTM PCR SV kit (GeneAll, Seoul, Korea)를 사용하여 정제한 후 Macrogen (Daejeon, Korea)에 염기서열 분석을 의뢰하였다.
감수성과 저항성 균주 집단의 특성 조사
감탄저병균인 C. horii의 포자 형성과 균사 생장을 조사하였다. PDA 배지에 접종한 C. horii를 25oC의 암조건에서 5일간 배양한 후, 균총의 선단부에서 지름 3 mm의 균사 조각을 떼어내어 새로운 PDA 배지 위에 접종하였다. 병원균은 다시 동일한 조건에서 2일간 배양하고, 균총의 길이를 조사하였다. C. horii의 포자 형성량을 조사하기 위해서 PDA 배지에 접종하고 25oC의 암조건에서 7일간 배양 한 후, 12시간 간격으로 근자외선을 처리하며 20oC에서 3일간 배양하였다. 배양기의 중심에서 120o 간격으로 간격마다 직경 6 mm의 균사조각을 3개씩 떼어내어 총 9개의 균사조각을 15 mL의 증류수가 담긴 50 mL tube에 넣고, 20초간 잘 흔들어 포자를 떼어냈다. 광학현미경 하에서 혈구계산기(HSU-1401, Superior Marienfeld Co.)를 이용하여 포자의 수를 조사하여 균총 면적당(mm2) 형성된 포자의 수를 계산하였다.
Tebuconazole 감수성 균주와 저항성 균주의 경합 능력 조사
감수성 균주(15GKYD4)와 저항성 균주(15GKNJ3)를 각각 1균주씩 선발하여 tebuconazole을 0.0005 μg/mL. 0.005 μg/mL, 0.05 μg/mL 농도로 첨가한 PDA 배지와 첨가하지 않은 PDA 배지 상에서 경합 능력을 확인하였다. Fig. 1에서 보는 것처럼, 감수성 균주와 저항성 균주의 포자를 동일한 비율로 혼합하여 살균제 첨가 PDA 배지 또는 무첨가 PDA 배지에 도말하였다. 도말한 배지에서 형성된 포자를 수확하여 현탁액을 만들어 다시 살균제 첨가 PDA 배지 또는 무첨가 PDA 배지에 도말하는 접종을 반복적으로 실시하면서 각 세대 당 감수성 균주와 저항성 균주의 비율을 조사하였다.
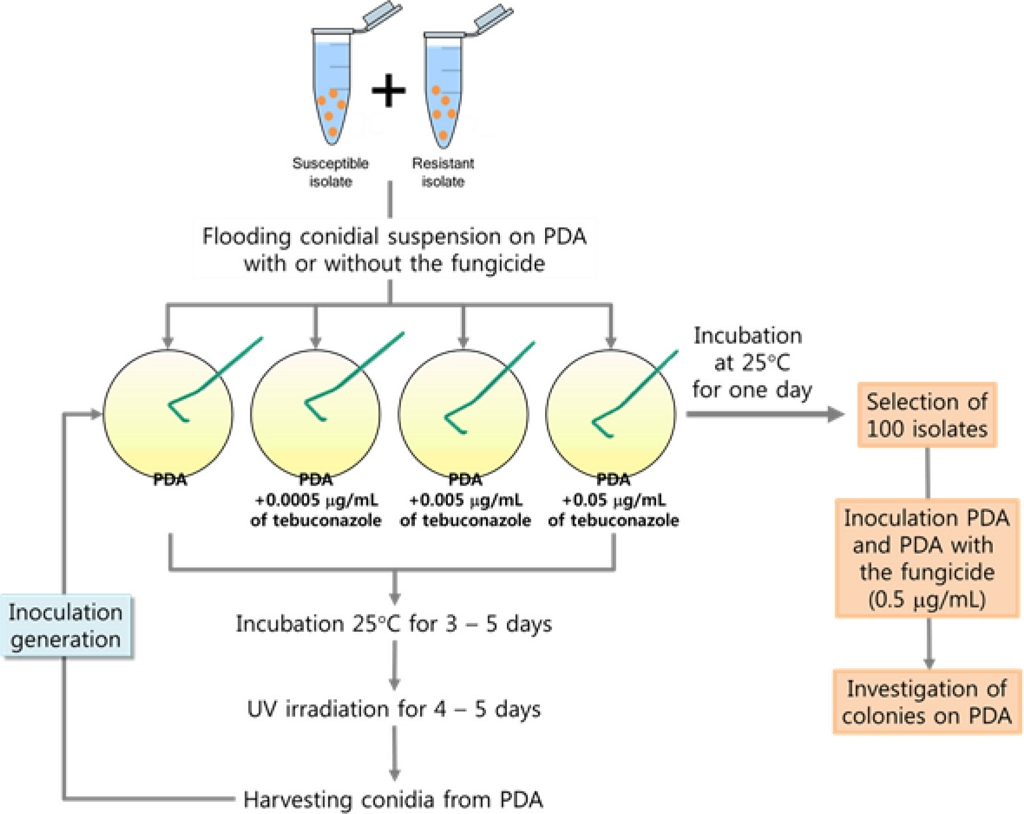
Scheme of experiment for the evaluation of competition between susceptible and resistant isolates of Colletotrichum horii.
제1차 접종은 PDA 배지에서 각각 배양한 감수성 균주(15GKYD4)와 저항성 균주(15GKNJ3)의 포자를 수확하여 밀도가 1×105개/mL가 되도록 각각의 포자현탁액을 준비하였다. 두 균주(15GKYD4와 15GKNJ3)의 포자현탁액을 1:1의 동일한 비율로 혼합하여 접종원을 준비한 다음, 정해진 농도의 tebuconazole을 첨가한 PDA 배지와 첨가하지 않은 PDA 배지에 각각 100 μL씩 도말하였다. 25oC의 암조건에서 5일간 배양한 다음, 근자외선을 12시간 간격으로 조사하며 20oC에서 5일간 더 배양하였다. 배지 상에 형성된 포자를 멸균증류수로 수확하고, 현탁액의 포자밀도를 1×105개/mL로 조정한 후, 다시 2차 접종을 실시하였다. 동일한 방법으로 여러 세대 동안 접종을 실시하며, 각 접종 단계에서 어느 정도의 감수성 균주와 저항성 균주가 분리되는 지의 비율을 조사하였다. 접종 세대 별로 감수성 균주와 저항성 균주의 분리 비율을 조사하기 위해서, 두 균주의 포자 현탁액을 tebuconazole 첨가 PDA 배지와 무첨가 PDA 배지에 도말하고 25oC에서 1일간 배양하였다. Tebuconazole 첨가 PDA 배지와 무첨가 PDA 배지에서 임의적으로 100개의 단균총을 떼어내어 0.5 μg/mL의 tebuconazole이 첨가된 PDA 배지에 접종하였다. Tebuconazole을 0.5 μg/mL 첨가한 PDA 배지에서 자라는 균총은 저항성 균주로, 자라지 못하는 균총은 감수성 균주로 구별하여 각 균주의 균총의 수를 조사하였다. 모든 접종 세대에서 동일한 방법으로 감수성 균주와 저항성 균주의 균총 수를 조사하였다.
결과 및 고찰
유전자 수준에서 병원균의 동정
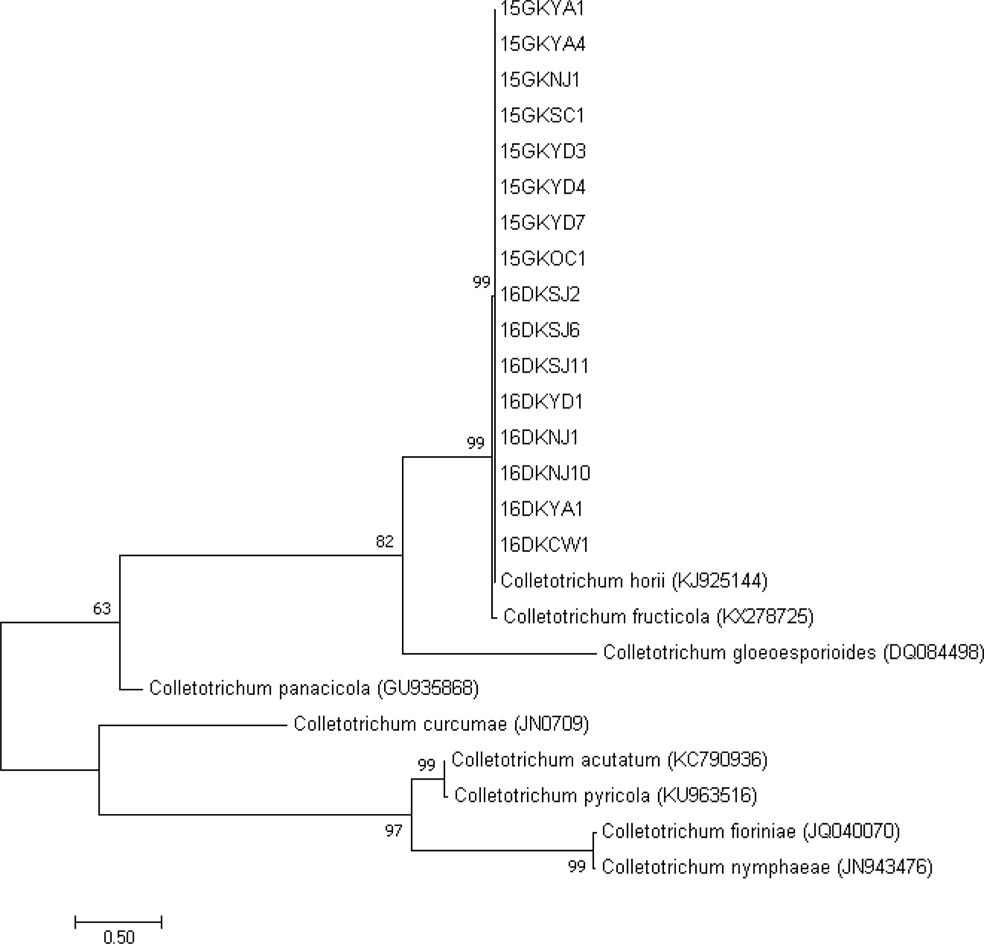
감 탄저병은 신초와 가지, 열매 등에서 발생하는데, Fig. 2에서 보는 것과 같이 검고 약간 파인 병징이 발생하며 병징 표면에는 분홍색의 포자 덩어리가 나타났다. 본 실험에서는 이런 병징이 나타난 감나무 조직을 채집하여 단포자 분리한 탄저병균 모든 균주의 동정을 실시하였다. ITS5와 ITS4 primer를 이용해 ITS 영역 유전자를 증폭하여 염기서 열을 분석하고, 계통수를 그려본 결과, 2016년에 잎에서 분리한 탄저병균인 3개 균주가 Colletotrichum spp.로 동정되었고, 이를 제외한 나머지 모든 균주는 Colletotrichum horii로 동정되었다(Fig. 3).

Symptoms of persimmon anthracnose in fruit (A) and new shoot (B), and colony of Colletotrichum horii on PDA (C), which was incubated on 25oC under the dark condition for 8~10 days.
DMI 살균제 감수성과 저항성 균의 균학적 특성 조사
2015년과 2016년에 채집한 총 53균주를 대상으로 균사생장 길이를 조사한 결과, 감수성 집단과 저항성 집단의 균사 생장 길이 평균값은 20.9 mm와 18.0 mm이었고, 최솟값과 최댓값은 감수성 집단과 저항성 집단에서 각각 13.4 mm와 25.9 mm, 18.4 mm와 24.0 mm으로 나타났다. Table 1에서 보는 것처럼 감수성 집단이 저항성 집단보다 균사 생장이 빨랐으며, 두 집단 간에는 통계적으로 유의한 차이가 있었다. 감수성 집단과 저항성 집단의 mm2 당 평균 포자 형성량은 386.8개와 106.4개이었으며, 최솟값과 최댓값은 감수성 집단과 저항성 집단에서 각각 5.5개와 1356.7개, 0.0개와 607.9개이었다. 포자 형성 역시 균사 생장과 같이 감수성 집단이 저항성 집단보다 평균 포자 형성량이 많았으며, 두 집단 간에 통계적으로 유의한 차이가 있었다.
감수성 균주와 저항성 균주의 경합능력
Tebuconazole을 처리하였을 때와 처리하지 않았을 때 감수성 균주와 저항성 균주의 경합 능력을 조사하기 위해서 tebuconazole 감수성 균주인 C. horii 15GKYD4와 저항성균주인 C. horii 15GKNJ3를 선발하였다. 감수성인 15GKYD4의 EC50값은 0.014 μg/mL이었으며, 저항성인 15GKNJ3는 0.972 μg/mL로, 저항성 균주의 EC50값이 69.4배 정도 높았다(Fig. 4). 두 균주는 tebuconazole에 대한 감수성 정도뿐만 아니라, Table 2에서 보는 것과 같이 균사생장과 포자형성량에도 차이가 있었는데, 감수성 균주인 15GKYD4가 저항성 균주인 15GKNJ3보다 균사 생장과 포자 형성이 우세하였다.
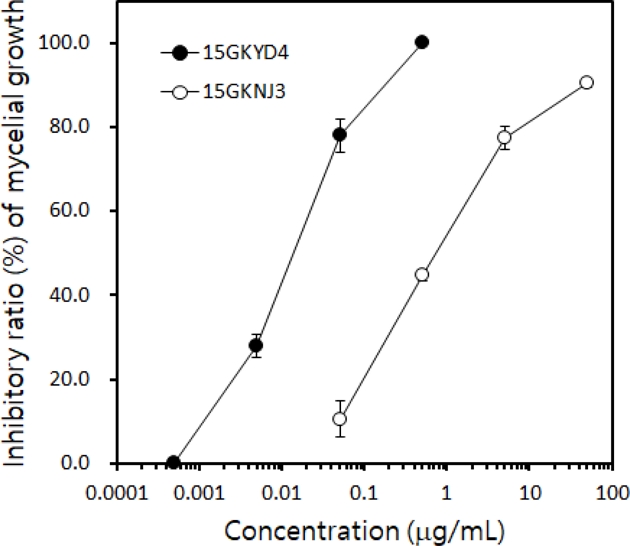
Inhibitory ratio (%) of tebuconazole against the mycelial growth of Colletotrichum horii 15GKYD4 sensitive to tebuconazole and 15GKNJ3 resistant to the fungicide. After incubating isolates of C. horii on PDA at 25oC for 5 days, their colony diameters were measured to calculate the inhibiting efficacy of tebuconazole against the mycelial growth of C. horii.

Mycological characteristics such as the mycelial growth and the spore formation of Colletotrichum horii sensitive and resistant to tebuconazole
감수성 균주인 C. horii 15GKYD4와 저항성 균주인 C. horii 15GKNJ3을 1:1 동량으로 혼합하여 PDA 배지에 연속적으로 도말하면서 각 세대마다 분리되는 감수성과 저항성 균주의 수를 조사하였다. Tebuconazole을 처리하지 않은 배지에서 경합시킨 경우에, 1세대와 2세대에 감수성 비율은 81.5%와 92.5%이었으며, 3세대에는 분리되는 균주는 모두 감수성 균주이었다(Fig. 5A). Tebuconazole을 0.0005 μg/mL의 농도로 첨가된 PDA 배지에서 동일하게 경합실험을 실시한 결과, Fig. 5B에서 보는 것과 같이 1세대와 2세대의 감수성 분리 비율은 92.6%와 99.0%이었으며, 3세대에서는 tebuconazole을 첨가하지 않은 PDA 배지에서와 동일하게 100% 감수성 균주만 분리되었다. Tebuconazole을 0.005 μg/mL 첨가한 PDA 배지에서는 1세대에 44.4%이었던 감수성 균주의 분리 비율이 6세대에는 96.8%로 증가하였고, 7세대에서는 분리되는 모든 균주가 감수성으로 나타났다(Fig. 5C). 하지만 감수성 균주의 균사생장을 80%정도 억제하고 저항성 균주를 20% 이내로 억제하는 농도인 0.05 μg/mL의 tebuconazole이 첨가된 PDA 배지에서는 배지에 감수성과 저항성 균주를 동량씩 혼합하여 접종한 1세대 만에 감수성 균주는 전혀 분리되지 않고, 저항성 균주만이 100% 분리되었다(Fig. 5D). 이러한 결과는 감귤 저장고에서 분리한 imazalil 저항성 P. digitatum의 경우에도 동일하게 나타났다(Holmes and Eckert, 1995).
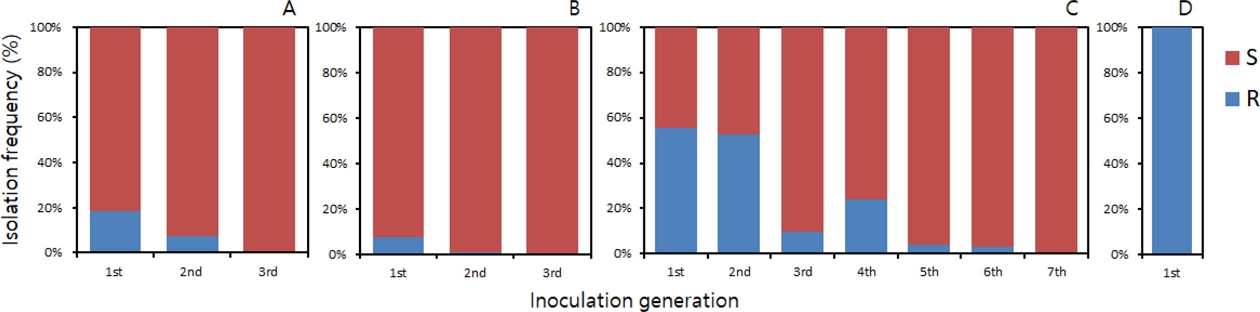
Competition ability of Colletotrichum horii 15GKYD4 sensitive to tebuconazole and C. horii 15GKNJ3 resistant to the fungicide on PDA with or without tebuconazole. Spores of C. horii 15GKYD4 and C. horii 15GKNJ3 were harvested to adjust the density of their suspensions to 1×105 spores/ mL. Spore suspensions of the two isolates were mixed in a 1:1 ratio and smeared onto PDA medium containing tebuconazole-free PDA medium (A) and PDA amended with tebuconazole at concentrations of 0.0005 (B), 0.005 (C) and 0.05 μg/mL (D). All the plates, on which spores of C. horii 15GKYD4 and 15GKNJ3 were inoculated, were kept at 25°C for 5 days, followed by incubation at 20°C for another 5 days with irradiation of fluorescent light for 12 hrs. The spores were harvested and inoculated in new PDA with the same procedure, once more. Spores were produced and harvested in the same method, and then inoculated in PDA without or with the indicated concentration of tebuconazole, which was carried out until the spore density of the isolates, whether sensitive or resistant, became 100%.
특정 살균제에 대한 저항성균이 발현되었을 경우 저항성 관리를 위해서 포장에서 저항성균의 정착을 예측할 수 있어야 하기 때문에, 감수성 균과 비교한 저항성균의 포장 적응력과 두 집단의 경합 능력 등을 조사한다. 병원균의 포장 적응력 요인은 병원균의 종류에 따라서 달라질 수 있다. 숙신산 탈수소효소 활성 억제 살균제(SDHI), strobilurin계 살균제, anilinopyrimidine계 살균제에 대해서 감수성 반응이 저하되거나, 저항성 반응을 보이는 Alternaria solani에서는 적응력을 조사를 위해서 포자발아, 균사생장, 병원력 등의 요인을 조사하였으며(Bauske and Gudmestad, 2018), 딸기에서 탄저병을 일으키는 Colletotrichum acutatum 중에서 strobilurin계 살균제에 대해 저항성인 병원균은 딸기 열매에 대한 병원성과 병반 상에 형성되는 포자량을 측정하였다(Forcelini et al., 2018). 감귤 저장고에서 분리한 imazalil 저항성 Penicillium digitatum은 저항성과 감수성인 균주를 혼합하여 감귤에 세대를 넘기면서 연속으로 접종하고, 각 세대마다 수확한 포자현탁액 중에 저항성균의 포자 비율을 조사함으로써, 저항성과 감수성균의 포장 적응력과 경합능력을 조사하였다(Holmes and Eckert, 1995). Bitertanol, fenarimol, imazalil 등과 같은 DMI 살균제에 대해서 저항성인 오이 흰가루병균 Sphaerotheca fuliginea에서는 포자발아와 균사, 침입구, 분생포자경의 형성 등을 조사하여 포장 적응력을 실험하였는데, 저항성균이 감수성균에 비하여, 포자발아뿐만 아니라, 균사와 침입구, 분생포자경 등의 형성 능력이 저조하였다(Schepers, 1985). 실험실 내에서 DMI 살균제 저항성을 분리하여 적응력 실험을 한 결과에서는 특정한 조건에서 DMI 살균제 저항성의 발현을 예측하였다(Fuchs and Drandarevski, 1976). 하지만 오이를 재배하는 시설재배지에서 발견된 저항성균의 포장 적응력이 떨어졌던 관계로, 실제 저항성균의 발현을 예측하기가 어려웠다. 이런 예는 Cercospora beticola에 의한 사탕무 잎점무늬병에서도 찾아볼 수 있다(Karaoglanidisa et al., 2000). 그리이스의 사탕무를 재배하는 일부 지역에서 잎에 점무늬병을 일으키는 Cercospora beticola 중 DMI 살균제 저항성균이 발견되어, 저항성균의 포장 적응력을 감수성균과 비교한 결과, 감수성균보다 떨어지면서 포장에서 저항성 정도도 심하지 않았다. 또한 DMI 살균제를 보호용 살균제와 혼합제로 사용하고, 병 방제를 위해서 처리하는 시기가 이미 다른 보호살균제를 예방적으로 처리한 이후의 중기가 되기 때문에 포장에서 저항성 정도가 크지 않았다. 그렇다고 하더라도, 보호살균제와 혼합제이기는 하지만 DMI 살균제 사용 빈도가 빈번하였던 지역이 적거나 사용하지 않았던 지역보다 병 발생이 더 심했던 것으로 보고되었다.
실제 특이적인 작용점을 갖는 다른 계통의 살균제와 비교해서, DMI 살균제는 포장에서 식물병의 방제에 실패한 예가 드물다(Cools et al., 2013). 저항성이 보고된 경우에도 저항성의 수준이 낮거나 다른 DMI 살균제와의 교차 저항성도 불완전하여. 동일한 살균제의 약량을 더 많이 처리할 경우 어느 정도의 병 방제가 가능하였다. 하지만 DMI 살균제는 오랜 기간 다양한 식물병 방제를 위해서 집중적으로 사용되어 오는 것이 문제이다. 본 실험의 결과에서도 보는 것과 같이 저항성균의 포장 적응력이 감수성균보다 떨어지기 때문에 DMI 살균제를 처리하지 않는 환경에서는 저항성균의 밀도가 감소할 수 있겠지만, 감수성균의 생장이 억제되는 정도로 DMI 살균제를 처리한 환경에서는 저항성균이 급속하게 포장을 점유하는 일이 발생할 수 있고, 이런 경우 포장에서는 더 많은 양의 살균제를 처리해야 하기 때문에, DMI 살균제 저항성이 발현된 지역에서는 살균제 사용과 처리 횟수 등이 관리되어야 할 것으로 생각한다.
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ0108212019)의 지원에 의하여 수행되었습니다.
References
-
Bauske, M. J. and N. C. Gudmestad (2018) Parasitic fitness of fungicide-resistant and -sensitive isolates of Alternaria solani. Plant Dis. 102(3):666-673.
[https://doi.org/10.1094/PDIS-08-17-1268-RE]

-
Cools, H. J., N. J. Hawkins and B. A. Fraaije (2013) Constraints on the evolution of azole resistance in plant pathogenic fungi. Plant Pathol. 62(Suppl. 1):36-42.
[https://doi.org/10.1111/ppa.12128]

-
Forcelini, B. B., C. S. Rebello, N-Y Wang and N. A. Peres (2018) Fitness, competitive ability, and mutation stability of isolates of Colletotrichum acutatum from strawberry resistant to QoI fungicides. Phytopathology 108(4):462-468.
[https://doi.org/10.1094/PHYTO-09-17-0296-R]

-
Frenkel, O., L. Cadle-Davidson, W. F. Wilcox and M. G. Milgroom (2015) Mechanisms of resistance to an azole fungicide in the grapevine powdery mildew fungus, Erysiphe necator. Phytopathology 105(3):370-377.
[https://doi.org/10.1094/PHYTO-07-14-0202-R]

-
Fuchs, A. and C. A. Drandarevski (1976) The likelihood of development of resistance to systemic fungicides which inhibit ergosterol biosynthesis. Neth. J. P1. Path. 82(2):85-87.
[https://doi.org/10.1007/BF01976954]

-
Henry M. J. and A. E. Trivellas (1989) Laboratory induced fungicide resistance to benzimidazoles and azoles fungicides in Cercospora beticola. Pest. Biochem. Physiol. 35(1):89-96.
[https://doi.org/10.1016/0048-3575(89)90106-5]

-
Holmes, G. J. and J. W. Eckert (1995) Relative fitness of imazalil-resistant and sensitive biotypes of Penicillium digitatum. Plant Dis. 79:1068-1073.
[https://doi.org/10.1094/PD-79-1068]

-
Karaoglanidisa, G. S., P. M. Ioannidisb and C. C. Thanassoulopoulos (2000) Reduced sensitivity of Cercospora beticola isolates to sterol demethylation inhibiting fungicides. Plant Pathol. 49(5):567-572.
[https://doi.org/10.1046/j.1365-3059.2000.00488.x]

-
Köller, W. and H. Scheinpflug (1987) Fungal resistance to sterol biosvnthesis inhibitors: A new challenge. Plant Dis. 71:1066-1074.
[https://doi.org/10.1094/PD-71-1066]

- Korean crop protection association (2018) https://www.koreacpa.org/bbs/board.php?bo_table=3_3
-
Kwon, J-H. and C-S. Park (2004) Ecology of disease outbreak of circular leaf spot of persimmon and inoculum dynamics of Mycosphaerella nawae. Res. Plant Dis. 10(4):209-216. (in Korean)
[https://doi.org/10.5423/RPD.2004.10.4.209]

- Lee, D. W., S. W. Lee, C. G. Park, H. Y. Choo, C. H. Shin and G. C. Lee (2001) Survey on pest management practice and sdheme of increasing income in sweet persimon farms in Korea. Kor. J. Pest. Sci. 5(4):45-49. (in Korean)
- Lim, T. H., Y-H. Choi, I. K. Song, K. R. Kim, D. W. Lee and S. M. Lee (2008) Survey of actual condition of management of persimon orchards in Sangju, Gyeongbuk in 2007 and 2008. Kor. J. Pest. Sci. 12(4):414-420. (in Korean)
-
Schepers, H. T. A. M. (1985) Fitness of isolates of Sphaerotheca fuliginea resistant or sensitive to fungicides which inhibit ergosterol biosynthesis. Neth. J. Pl. Path. 91(2):65-76.
[https://doi.org/10.1007/BF01974302]

- Shin, M. U., H. J. Kang, Y-H. Lee and H. T. Kim (2008) Detection for the resistance of Fusarium spp. isolated from rice seeds to prochloraz and cross-resistance to other fungicides inhibiting sterol biosynthesis. Kr. J. Pestic. Sci. 12(3):277-282.
-
Valsecchi, I., E. Mellado, R. Beau, S. Raj and J-P. Latge (2015) Fitness Studies of Azole-Resistant Strains of Aspergillus fumigatus. Antimicrob. Agents Chemother. 59(12):7866-7869.
[https://doi.org/10.1128/AAC.01594-15]

-
Xie, L., J. Z. Zhang, L. Cai and K. D. Hyde (2010). Biology of Colletotrichum horii, the causal agent of persimmon anthracnose. Mycology 1(4):242-253.
[https://doi.org/10.1080/21501203.2010.526644]