
Enterobacter asburiae ObRS-5에 의한 곰취 역병 방제 효과 및 근권 세균 군집의 변화
초록
본 연구는 Phytophthora drechsleri에 의해 발생하는 곰취 역병의 생물적 방제를 위하여 Enterobacter asburiae ObRS-5 균주의 처리 농도(106 or 107 cfu/ml), 처리 간격(7 또는 10일) 및 처리 횟수(1~3)에 따른 방제 효과를 온실과 시설하우스 포장 조건에서 검정하였다. 또한 Illumina MiSeq 플랫폼을 이용하여 시설하우스 포장 조건에서 E. asburiae ObRS-5 균주 처리에 의한 곰취 근권토양 미생물 군집 구조 변화를 비교 및 분석하였다. 처리조건별 방제효과를 검정한 결과, 온실 조건에서는 E. asburiae ObRS-5 를 처리한 모든 처리구에서 역병 방제 효과가 있었고 7일 간격 3회 또는 10일 간격 2회 처리시 방제 효과가 가장 우수하였다. 시설하우스 포장 조건에서는 1×106 cfu/ml 농도로 1회 처리 시 방제 효과는 나타나지 않았으며 7일 또는 10일 간격으로 3회 이상 처리했을 때에만 방제 효과가 나타났다. 근권미생물 군집은 21개의 문과 452개의 속으로 구성되어 있었으며 모든 근권토양에서 상대 풍부도는 Proteobacteria 문(51.46-65.32%), Bacteroidetes 문(9.21-17.15%), Actinobacteria 문(5.57-12.27%) 순으로 높게 나타났다. Proteobacteria의 상대 풍부도는 E. asburiae ObRS-5 처리한 3 DAT, 3 DAI, 13 DAI에서 유의하게 낮았는데 Bacteroidetes, Actinobacteria와 Verrucomicrobia 문의 증가에 의한 것으로 판단된다. 즉, E. asburiae ObRS-5 균주와 역병균 처리에 의해 토착 미생물 군집 구조가 변화되었음을 확인할 수 있었다. 따라서 곰취 역병 방제 효과가 있는 E. asburiae ObRS-5는 현장 조건에서 적절한 처리 방법에 의해 유용하게 사용될 가능성이 있으며 E. asburiae ObRS-5 균주 처리에 의한 근권 미생물상의 변화는 본 균주를 사용할 때 중요한 정보를 제공할 것으로 사료된다.
Abstract
In the biological control of plant diseases using microorganisms, there is always the possibility that the microorganisms selected in laboratories may not achieve the expected control effect under greenhouse field condition due to various environmental factors unexpected; such as sun light, low/high temperature and humidity. This study aimed to evaluate control effect of Enterobacter asburiae ObRS-5 by the treatment concentration (106 or 107 cfu/ml), interval (7- or 10-day) and frequency (one-three times) under two different conditions; glass- and greenhouse field. We also analyzed the rhizosphere bacterial community using 16S ribosomal RNA gene amplicon sequencing on the Illumina MiSeq platform. In the glasshouse experiments, all of ObRS-5 strain treated had an effectiveness with significant differences compared to control. On the other hands, in the greenhouse experiment, only three times treatment of either 106 cfu/ml at a 7-day interval, or 107 cfu/ml at a 7- or 10-days interval had effects on suppression of Phytophthora root rot. The rhizosphere community was composed of 21 bacterial phyla and 452 bacterial genera. The bacterial community structure was changed in resident soil bacterial community of each samples, and these changes resulted from either treatment of E. asburiae ObRS-5 and P. drechsleri. Thus, E. asburiae ObRS-5 strain influenced the relative abundances of operational taxonomic units belong to several genera. Investigation the bio-control effect of microbial treatment condition and rhizhosphere bacterial community provide important information for the development of effective application method of useful microorganisms against plant diseases.
Keywords:
Biocontrol, Enterobacter asburiae, Greenhouse condition, Phytophthora drechsleri, Rhizosphere bacterial community키워드:
근권미생물 군집, 생물방제, 시설재배, Enterobacter asburiae, Phytophthora drechsleri서 론
곰취(Ligularia fischeri)는 그늘지고 습기가 많은 높은 지대의 숲에서 자생하는 숙근성 산채로서 1990년대부터 강원도, 경상남도, 경상북도 및 전라남도 일부 지역의 시설 또는 임야에서 재배되고 있다(Ahn et al., 2012). 곰취는 생으로 먹을 수 있고, 맛과 향이 좋아 소비자 기호가 높은 산채 중 하나이다. 곰취는 고지대 산에서 자생하는 동안 병해충 발생이 거의 없는 식물로 알려졌지만, 기존의 자생지와 습도, 온도, 조도 등이 다른 환경인 시설하우스에서 밀식 연작 재배할 때 역병, 흰가루병, 흰비단병 등 병해가 다양하게 발생하여 문제가 된다고 보고된 바 있다(Kwon et al., 1999; Kim et al., 2009; Moon et al., 2015).
곰취에 발생하는 병해 중에서도 Phytophthora drechsleri 병원균에 의한 역병(Phytophthora root rot)은 한 번 발병하면 급속도로 확산하여 고사하기 때문에 방제가 매우 어려운 병이며 예방이 중요하다(Kwon et al., 1999). 생으로 섭취하는 산채인 곰취의 특성상 생산 농가나 소비자 모두 친환경 재배를 선호한다. 그러나 곰취 역병의 친환경 방제를 위한 미생물제와 같은 생물적 방제 수단이 부재하여 농가에서는 곰취 친환경 재배에 어려움을 호소하고 있다. 숙근성 산채인 곰취는 한 번 심으면 평균 3년 동안 유지·관리하면서 재배하기 때문에 연작피해로 인한 역병 발생이 심하다. 최근에 2~3년 곰취 재배 농가 중 일부에서 곰취 역병 발생이 24.1~43.1%에 달하였고 곰취 생산량이 큰 폭으로 감소하여 머위, 두릅 또는 고추 등 다른 작물로 대체하였다.
친환경 농업에서 유용미생물은 화학 농약의 대체가 가능한 대안으로서 큰 역할을 하고 있다(Fravel, 2005; Bhardwaj et al., 2014; Borriss, 2015; Gupta et al., 2015). 미생물제는 식물병 또는 해충 방제에 효과를 나타내는 세균, 진균, 바이 러스 등으로 만든 제품을 일컬으며, 병해충 방제 외에도 농업에 이용할 수 있는 영역은 토양개량, 유기물 분해촉진, 양·수분 흡수 촉진, 생육촉진 및 제초작용 등이 있다(Johansson et al., 2004; Khan et al., 2007; Chandler et al., 2008). 유용미생물이 식물의 생장을 돕는 방법으로 인산가용화, 질소고 정, 식물생장촉진 호르몬 생산 등 생물비료기작이 알려져 있으며, 그 외에도 기생작용, 공간이나 양분 경쟁을 통한 길항작용, 항생물질 생산, 병저항성 유도 등 생물적 방제기작으로 알려진 방법으로 식물 생장을 간접적으로 돕는다(Mahaffee and Backman, 1993; Szczech and Shoda, 2006; Haggag and Timmusk, 2008; Park et al., 2010).
토양에서 분리된 Streptomyces sp.는 P. drechsleri를 포함한 다양한 식물 병원균의 균사 생장을 억제하며, P. drechsleri에 의한 오이 뿌리썩음병을 효과적으로 방제하는 형광성 Pseudomonas sp.는 항생물질 pyrrolnitrin 생성을 위해 필요한 2, 4-diacetylphloroglucinol, phenazine-1-carboxylic acid와 pyoluteorin 생합성 유전자를 갖는 것으로 보고된 바 있다(Bonjar et al., 2006; Shirzad et al., 2012). 또한 Pseudomonas sp.가 생산하는 biosurfactant인 rhamnolipids와 cyclic lipopeptides (CLPs)는 Phytophthora 유주자낭막 형성을 효과적으로 억제하는 것으로 보고되었다(De Bruinjn et al., 2007; Maleki et al., 2011). P. drechsleri에 의한 곰취 역병은 현재까지 친환경 방제 수단의 보고가 없어 유용미생물을 이용한 생물학적 방제 기술의 개발이 필요하다.
한편 실험실과 온실에서 선별한 미생물을 농업생태계에 적용할 때에는 여러 가지 예상치 못한 환경적 요인에 의해 미생물의 효과를 얻지 못할 가능성이 항상 존재한다(Gerhardson and Larsson, 1991; Hornby et al., 1993; Tahvonen et al., 1995; Almaghrabi et al., 2013; Sarbadhikary et al., 2017). 이러한 미생물의 가변적 효과는 보완되어야 할 가장 중요한 부분이다. 미생물 처리의 효과를 얻기 위해서는 미생물이 해당 생태계에 정착하여 일정 밀도 이상을 유지해야 한다(Baker et al., 1968; Haggag and Timmusk, 2008; Krzyzanowska et al., 2012; Liu et al., 2014). 그러나 포장 조건에서 처리된 미생물의 생태와 작용범위를 정확히 모니터링 하는 것 또한 방법론적인 면에서 부족한 부분이 많아 이에 대한 분석과 평가가 세밀하게 이루어져야 할 필요가 있다(Singh et al., 2016). 유용미생물 처리에 의한 비근권 및 근권토양의 토착 미생물 군집분석 연구는 배양 의존적 방법 또는 비의존적 방법으로 수행될 수 있다(Amann et al., 1995). 배양 비의존적 방법에는 세균의 16S rRNA 유전자를 이용한 DGGE, TGGE, t-RFLP 등이 있다. 최근 차세대 염기서열 분석법(next-generation sequencing, NGS)의 발달로 16S rRNA 유전자의 대량분석을 통한 연구가 활발하게 이루어지고 있지만(Shokralla et al., 2012), 곰취 등 산채의 근권미생물 연구는 이루어지지 않아 이에 대한 미생물 생태학적인 접근이 필요하다.
Enterobacter asburiae ObRS-5는 본 연구실에서 곰취 역병 방제를 위해 분리 및 선발한 균주이다. 본 연구에서는 E. asburiae ObRS-5 균주를 곰취에 토양 관주 처리하여 온실 및 시설하우스에서 농도별, 처리간격별, 처리횟수별에 따른 역병 방제 효과를 구명하였으며, Illumina Miseq 플랫폼을 이용하여 E. asburiae ObRS-5 균주 처리에 따른 곰취 근권미생물의 군집 변화를 분석하였다. 온실 및 시설하우스 환경에서 미생물의 처리조건별 병 방제 효과와 그에 따른 근권미생물상의 변화를 구명함으로써 보다 효과적인 유용미생물의 현장적용 방법개발에 활용할 수 있을 것으로 기대한다.
재료 및 방법
Enterobacter asburiae ObRS-5 균주의 처리조건별 곰취 역병 방제 효과 검정
온실에서 E. asburiae ObRS-5 균주의 곰취 역병에 대한 방제 효과를 검정하기 위해 바로커상토(Seoul Bio Inc., Korea)를 이용하여 32공 트레이에 곰취(Ligularia fischeri cv. Aram)를 파종하였다. E. asburiae ObRS-5 균주는 KB (King’s B Broth, Difco) 배지에 접종하여 28oC에서 2일 간 150 rpm으로 진탕배양한 후 농도를 1×108 cfu/ml (OD600=0.25)으로 조절하였다. E. asburiae ObRS-5의 KB배양액은 10배와 100배로 희석하여 1×107 cfu/ml 또는 1×106 cfu/ml 농도로 준비하였다. 본엽이 3매 전개된 곰취에 E. asburiae ObRS-5 배양액을 주당 50 mL 1×107 cfu/ml 또는 1×106 cfu/ml 농도로, 7일 또는 10일 간격으로, 1-3회 관주 처리하였고, 무처리구에는 배지를 같은 양으로 처리하였다(n=16).
시설하우스 내 E. asburiae ObRS-5 균주의 곰취 역병 방제 효과는 국립농업과학원 농업생물부 시설하우스 시험포장(완주, 35°49'33.99''N, 127°2'39.89''E)에서 검정하였다. 위와 같은 방법으로 파종한 곰취를 5주째에 직경 10 cm의 포트에 이식하였고 파종 10주째에 10 L 용량 어상자의 2/3에 상토를 채운 후 어상자 당 8주의 곰취를 이식하였다. E. asburiae ObRS-5 배양액은 위와 같은 조건으로 곰취에 주당 100 mL씩 관주 처리하였다(n=120).
곰취 역병의 접종원으로서 P. drechsleri 균주는 멸균한 보리배지에 접종하여 7일 간 25oC에서 정치배양하였다. 보리배지는 40 g의 겉보리에 증류수 45 ml을 넣고 121oC에서 20분 간 2회 멸균하여 준비하였다. E. asburiae ObRS-5 균주의 마지막 처리일로부터 7일 후 보리배지 배양 P. drechsleri는 약수저로 토양을 1 cm 깊이로 걷어낸 후 곰취 주당 1알씩 뿌리 상단에 치상접종하였다. 역병 발병도는 Table 1을 기준으로 피해의 범위를 0~3단계로 나누어 조사하였다.
Enterobacter asburiae ObRS-5 처리에 의한 곰취 근권 미생물상의 변화 분석
E. asburiae ObRS-5 균주 처리에 의한 근권미생물 군집구조의 변화를 분석하기 위해, 시험포장의 밭토양(양토)과 상토를 1:1 (v/v) 로 혼합하여 어상자에 담은 후 상기와 같은 방법으로 곰취를 이식하였다. 이식 2주 뒤 처리 전의 곰취 근권토양 시료(병원균 비접종 대조구)를 무작위로 3반복 채취한 후, 1.0×107 cfu/ml 농도의 E. asburiae ObRS-5 배양액을 7일 간격으로 2회, 주당 100 ml씩 관주 처리하였고, 대조구에는 같은 양의 물을 처리하였다. E. asburiae ObRS-5 균주 마지막 처리일로부터 7일 후, 보리배지 배양 P. drechsleri를 E. asburiae ObRS-5 처리구와 대조구에 상기와 같은 방법으로 접종하였다. 근권토양 시료의 채취는 E. asburiae ObRS-5 균주 처리 3일 후(3 DAT; 3 days after treatment), 10일(10 DAT), 20일(20 DAT)에 3반복으로 채취하였다. 이 중에서 역병균 처리 후 채취한 시료인 10 DAT와 20 DAT는 각각 3 DAI (3 days after inoculation of P. drechsleri)와 13 DAI로 나타내었다. 근권토양 시료를 얻기 위해 곰취 뿌리가 상하지 않게 뽑은 후 약하게 흔들어 비근권 토양을 제거하였다. 뿌리에 붙어있는 약 1-2 mm 이내의 근권 토양을 취하기 위해, 멸균수를 넣은 비이커에 뿌리를 씻어낸 현탁액을 50 ml 팔콘 튜브에 옮겨 담아 원심분리하였고, 상층액을 제거한 나머지를 취하여 분석 전까지 초저온 냉동고에 보관하였다. 모든 시료 채취가 완료된 후, 근권미생물 군집 분석을 위한 Illumina MiSeq 분석을 Microgen Inc. (Daejeon)에 의뢰하였다. 분석 결과 얻어진 염기서열들은 고품질의 시퀀스 데이터를 얻기 위한 adaptertrimming 및 FLASH를 이용한 read assembly를 진행하였고, CD-HIT-EST 기반의 OUT 분석프로그램인 CD-HIT-OUT (Li et al., 2012)를 이용하여 시퀀싱 에러로 간주되는 낮은 품질의서열, 키메라 서열 등을 제거한 후 97% 이상의 서열 유사성을 갖는 서열끼리 OUT clustering을 진행하였다. 각 OUT의 대표서열은 Reference DB (UNITE 7.2)에 UCLUST ()를 수행하여, 유사성이 가장 높은 subject의 taxonomic assignment를 수행하였으며 QIIME (ver. 1.8) (Caporaso et al., 2010)을 이용하여 Shannon index와 Inversed simpson index를 구하고 Rarefaction curve와 Chao1 값을 통해 alpha diversity 정보를 확인하였다.
통계분석
통계분석은 R 통계 프로그램(ver. 3.4.1)을 이용하였으며, 처리구 내 평균 간 유의차 검증은 분산분석(analysis of variance, ANOVA) 후, α=0.05 수준에서 던칸의 다중 범위검정법(Duncan’s multiple-range test)을 실시하였다.
결과 및 고찰
온실과 포장에서 Enterobacter asburiae ObRS-5 균주의 처리조건별 곰취 역병 방제 효과
균주의 처리조건별 곰취 역병 방제 효과를 검정한 결과, 온실 조건에서는 E. asburiae ObRS-5을 처리한 모든 처리구에서 역병 방제 효과가 있었다. 균주의 처리 농도별 방제효과는 통계적으로 차이가 없었다. 온실에서 1×106 cfu/ml 농도로 처리했을 때 41.3-77.5%, 1×107 cfu/ml 농도로 처리했을 때 36.3-81.3%의 역병 방제 효과가 나타났으며 처리횟수가 많을수록 방제 효과가 높아지는 경향이었다(Fig. 1. A). 즉, 7일 간격 3회 또는 10일 간격 2회 처리했을 때 방제효과는 71.2-81.3%으로 다른 처리조건보다 우수하였다. 온실 조건에서는 E. asburiae ObRS-5 균주를 1회 처리했을 때 역병 방제 효과가 있었던 반면, 시설하우스 포장 조건에서는 1×106 cfu/ml 농도로 1회 처리 시 발병도는 대조구보다 낮은 경향이었지만 통계적으로 유의하지 않았다(Fig. 1. B). 시설하우스에서 E. asburiae ObRS-5 균주의 역병 방제효과는 3회 이상 처리했을 경우에만 유의한 효과를 보였으며, 1×106 cfu/ml 농도로 처리 시 36.3-66.3%, 1×107 cfu/ml 농도로 처리 시 25.0-65.0%으로 나타났다. 시설하우스 포장조건에서 E. asburiae ObRS-5 균주의 처리 농도별 방제 효과에 유의한 차이는 나타나지 않았다. Berger 등(1996)에 의하면 항생물질을 분비하여 병원균의 생육을 억제하는 Bacillus subtilis 균주는 처리 농도가 108 cfu/ml 이상이 될 때 적절한 병 방제 효과를 얻을 수 있다고 하였다. 그러나 E. asburiae ObRS-5 균주의 경우 처리 농도별 방제 효과에 유의한 차이가 나타나지 않은 것으로 보아, 처리 적정 농도를 구명하고 방제 기작을 구명하기 위한 추가 연구가 필요할 것으로 사료된다.
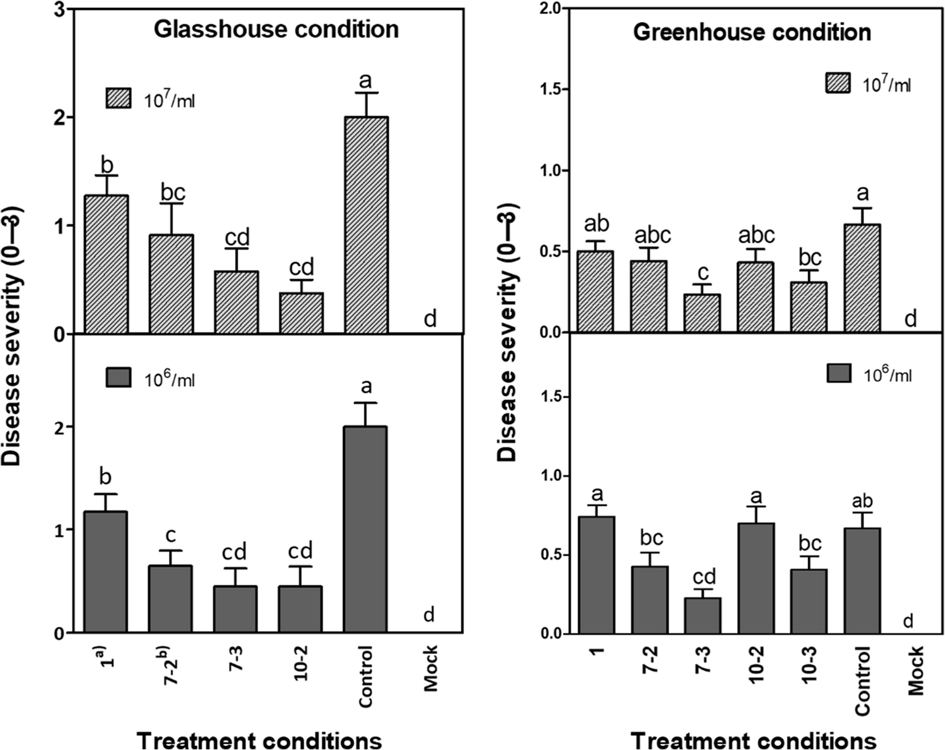
Bio-control effect of Enterobacter asburiae ObRS-5 on Phytophthora root rot under glass- and greenhouse conditions. Glasshouse (n=16) and greenhouse (n=120) potted plant efficacy. Disease severity (%); Means ± standard errors are presented as bars, which show how the data are spread. Bars with lowercase letters are significantly different between treatments, using DMRT (p < 0.05). a)once treatment, b)day intervals - number of treatments
Enterobacter 속 균주에 의한 식물 병 방제 효과는 다른 연구에서도 보고되었다. Nelson et al.에 의하면 E. cloacae 균주는 Pythium ultimum 균사에 결합하여 균사 발달을 저해하며, Pythium 잘록병의 발병을 저해한다고 하였다. 생물적 방제에 많이 이용되고 있는 진균인 Trichoderma속 균주는 2차 대사산물을 생성하여 P. drechsleri, P. cactorum, P. sojae와 P. capsici의 균사 생육을 억제하는 항생작용을 하며 식물의 방어 관련 유전자 발현을 증가시킨다고 알려져 있다(Bae et al., 2016). 이렇듯 유용미생물을 이용한 Phytophthora spp. 에 대한 방제 연구는 많이 수행되었지만, Enterobacter sp. 에 의한 Phytophthora 병원균 및 식물 병해에 대한 방제연구는 보고된 바 없다. E. asburiae ObRS-5 균주의 곰취관주 처리에 의한 역병 방제 효과는 추가적인 기작 구명이 필요하다.
Enterobacter asburiae ObRS-5 처리에 의한 곰취 근권미생물 군집 분석
E. asburiae ObRS-5 균주 처리 전과 후에 채집한 근권토양 시료는 7처리 3반복으로 구성되었으며 시료 당 최소 20,466개에서 최대 53,430개의 시퀀스를 얻었다. 이 중에서 저품질의 시퀀스를 제거하는 quality control을 통해 총 707,705개의 고품질 시퀀스를 얻었으며 총 14,900개의 OTU를 근권미생물 군집분석에 사용하였다. 분석 결과, 종 다양성 지수인 Shannon 값과 Inverse Simpson 값은 모든 처리구에서 병원균 비접종 대조구과 비교하여 높게 나타났다(Table 2). 근권 토양에서 3 DAI에 관찰된 종 다양성 지수는 E. asburiae ObRS-5처리구가 대조구보다 약간 낮았으나 통계적으로 유의하지 않았다.
Rarefaction curve를 통해 처리구 간 종 풍부도를 비교한 결과, E. asburiae ObRS-5 처리구에서 높았으며 대조구는 3 DAI와 13 DAI에서 증가한 경향이었다(Fig. 2). 병원균 비접종 대조구와 대조구 3 DAT의 상대적인 종 풍부도가 낮게 나타난 이유는 E. asburiae ObRS-5 또는 역병균을 처리하지 않았기 때문으로 판단된다. 이전의 다른 연구에서 유용미생물 처리 후 토양미생물 군집의 종 다양성이 증가한다고 보고한 바 있다(Shen et al., 2015; You et al., 2016).
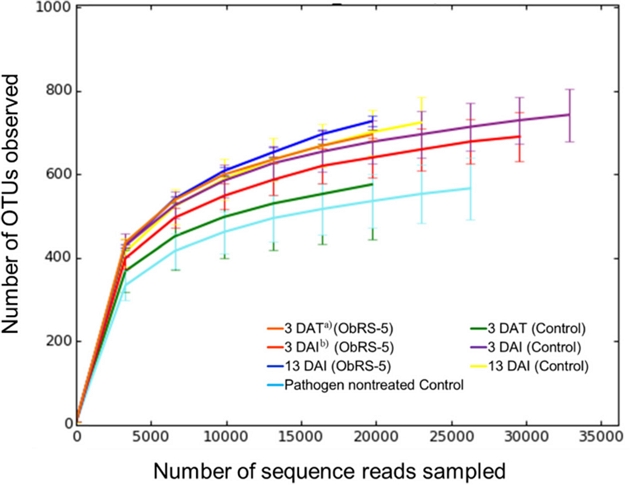
Rarefaction curves for operational taxonomic units (OTUs) clustering at 97% sequence similarity of 16S rDNA sequences for each sample. Error bars indicate standard deviation (n=3). a)days after treatment of Enterobacter asburiae ObRS-5 strain, b)days after inoculation of Phytophthora drechsleri.
E. asburiae ObRS-5 균주 및 역병균 처리에 의한 근권토양 미생물 분포 변화를 문 수준에서 비교 및 분석하였다. 곰취 근권토양의 문 수준의 분포는 Fig. 3과 같이 인정되지 않은 그룹을 포함하여 총 21개의 세균 문이 존재하였다. 분석결과 문 수준에서 근권세균 군집의 변이는 크지 않았는데, 미생물 처리에 의한 전체적인 토착 미생물 군집의 상대 풍부도 변화가 근권보다 비근권 토양에서 크게 나타났다는 이전 연구 결과와 같은 경향으로 생각된다(Lee et al., 2015). 병원균 비접종 대조구를 포함한 모든 근권토양에서 Proteobacteria 문(51.46-65.32%)의 상대풍부도가 가장 높았고, Bacteroidetes 문(9.21-17.15%), Actinobacteria 문(5.57-12.27%)순으로 낮아지는 경향이었다. 문 수준에서 가장 우점하였던 Proteobacteria의 상대 풍부도는 병원균 비접종 대조구에서 가장 높았으며 E. asburiae ObRS-5 처리한 3 DAT, 3 DAI, 13 DAI에서 유의하게 낮았다(Fig. 4). Proteobacteria는 일반적으로 근권과 비근권 토양에서 우점하고 있다고 알려져 있다(Schloss and Handelsman, 2006). E. asburiae ObRS-5 균주 처리 후 곰취 근권에서 Proteobacteria의 감소는 Bacteroidetes, Actinobacteria와 Verrucomicrobia 문의 증가에 의한 것으로 사료된다. Bacteroidetes 문은 ObRS-5 처리구에서 3 DAT (12.54 ± 0.51%)에 대조구(9.21 ± 0.81%)보다 높았고 3 DAI (17.15 ± 1.16%)에도 대조구(13.40 ± 1.8%)보다 뚜렷하게 높았다. 따라서 E. asburiae ObRS-5의 처리가 Bacteroidetes 문의 풍부도가 증가하는데 영향을 준 것으로 사료된다. 근권에서 Bacteroidetes는 양분 전환에 중요한 역할을 한다고 보고된 바 있다(Yousuf et al., 2012). 한편, Verrucomicrobia 문의 상대풍부도는 병원균 비접종 처리구(3.22 ± 0.74%)와 물을 처리한 3 DAT (3.86 ± 0.49%)에서가장 낮았고, E. asburiae ObRS-5 처리구(5.25-6.45%)에서 높은 경향이었으나 통계적으로 유의하지 않았다(Fig. 4).
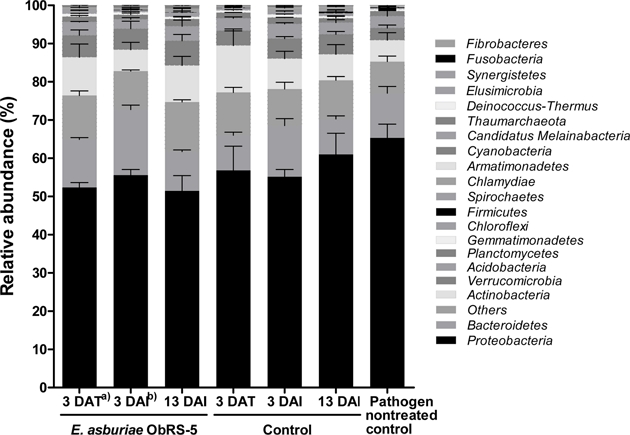
Bacterial distribution at the phylum level. Error bars indicate standard deviation (n=3). a)days after treatment of Enterobacter asburiae ObRS-5 strain, b)days after inoculation of Phytophthora drechsleri.
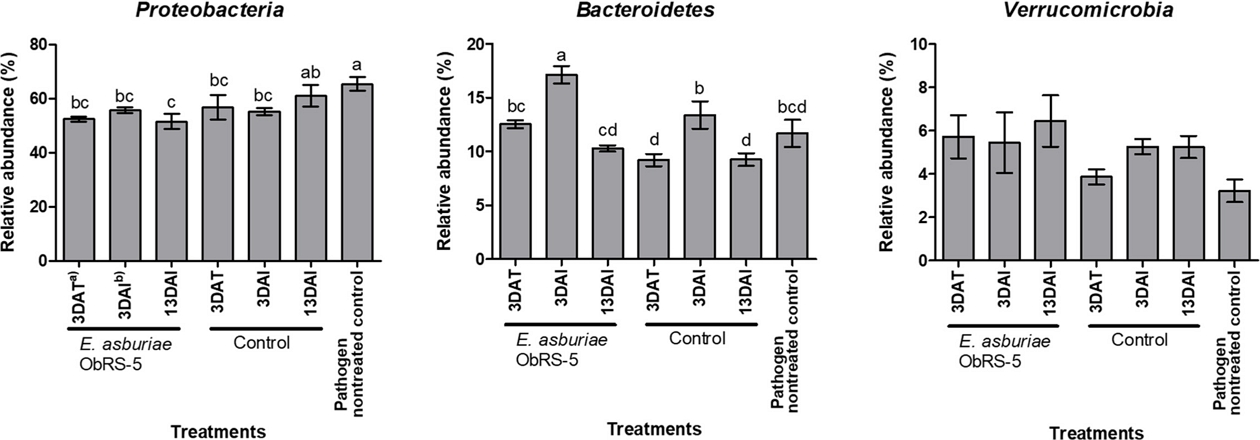
Relative abundances of bacterial phyla, Proteobacteria, Bacteroidetes and Verrucomicrobia. Error bars indicate standard deviation (n=3). Different letters above the bars indicate significant differences between samples, using DMRT (p < 0.05). a)days after treatment of Enterobacter asburiae ObRS-5 strain, b)days after inoculation of Phytophthora drechsleri.
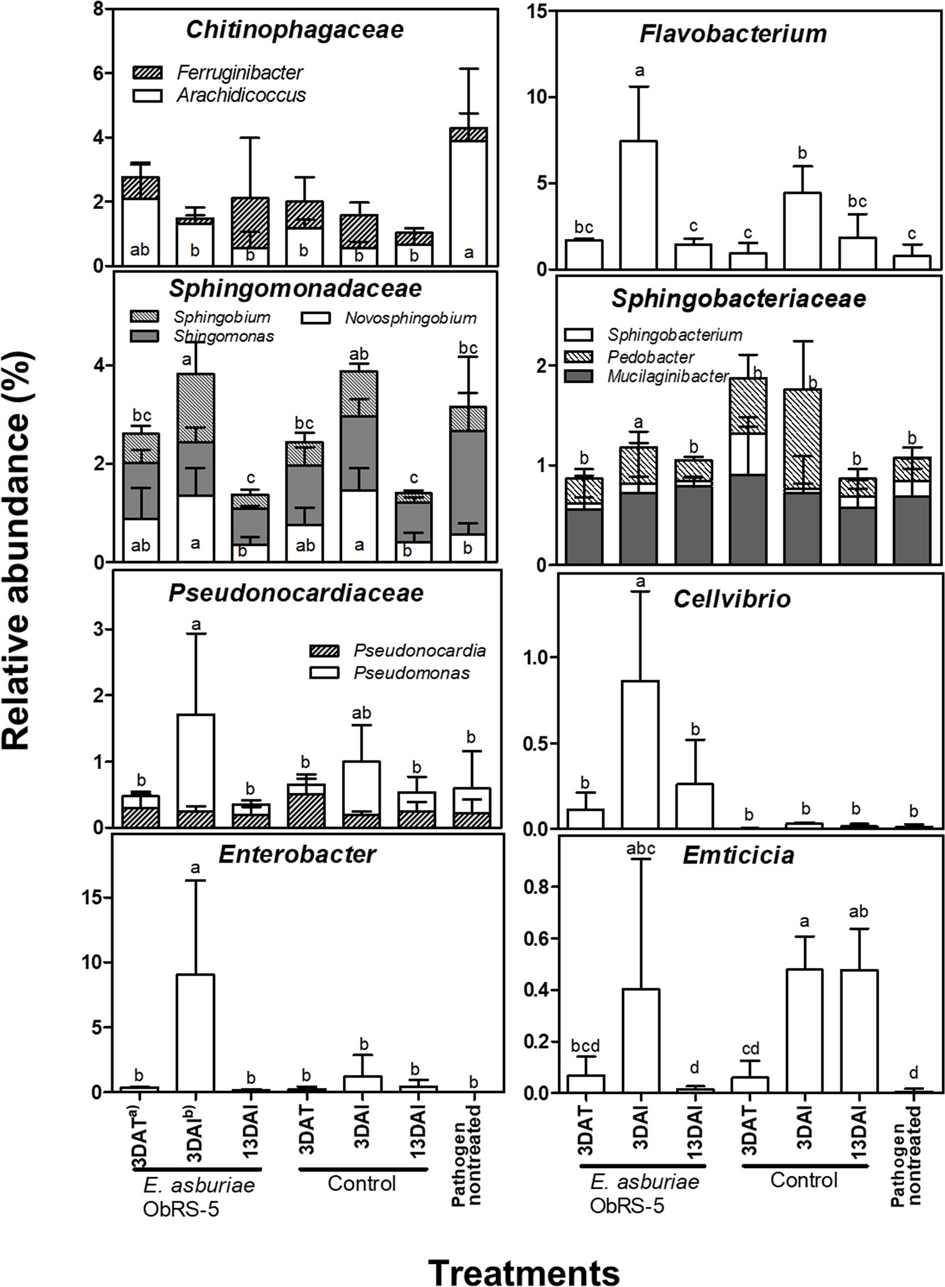
곰취 근권 토양미생물의 분포는 무작위로 선발된 시퀀스를 이용하여 얻은 OTU에 의해 총 452개의 세균 속이 존재하였다. 먼저 처리구 간 상대 풍부도 변화가 뚜렷하게 나타나는 속을 선별한 후, 통계적으로 유의한 변화가 인정되는 속의 OTU비율은 다양성의 비교분석에 이용하였다(Fig. 5). Flavobacterium 속의 OTU 비율은 E. asburiae ObRS-5 처리 전(0.8%)과 후(3 DAT, 1.7%)에 유의한 차이가 없었으나 ObRS-5 처리구와 대조구의 3 DAI (각각 7.4%, 4.4%)에서 증가하였는데 이는 역병균 접종에 의한 영향으로 생각된다. Arachidicoccus 속은 병원균 비접종 대조구에서 3.9%로 우점하였으나 E. asburiae ObRS-5 균주 처리 후 3 DAT에서 약 2%로 감소하는 경향을 보였으며, 역병균 처리한 모든 처리구에서 0.55-1.31%로 OTU 비율이 감소하였다. Emticicia 속 OTU 비율은 3 DAI에 ObRS-5 처리구(0.4%)와 대조구(0.48%)에서 증가하였으나 13 DAI에는 대조구(0.48%)에서 만 높은 수준을 유지하였고 ObRS-5 처리구(0.01%)에서는 병원균 비접종 처리구(0.01%)와 같은 수준으로 감소하였다. Flavobacterium, Arachidicoccus, Emticicia 속은 모두 Bacteroidetes 문에 속하는데 Bacteroidetes은 근권 토양에서 유기물 분해를 통한 양분 전환에 중요한 역할을 하며 질소 순환과 관련된 유전자를 갖는다고 보고된 바 있다(Van Spanning et al., 2005; Yousuf et al., 2012).
Relative abundances of bacterial phyla in each sample. Error bars indicate standard deviation (n=3). Different letters above the bars indicate significant differences between samples, using DMRT (p < 0.05). a)days after treatment of Enterobacter asburiae ObRS-5 strain, b)days after inoculation of Phytophthora drechsleri.
Pseudomonas 속은 ObRS-5 처리 전(0.4%)보다 처리 후(3 DAI, 1.5%)에 OTU비율이 약 4배 증가하였다. 한편, Cellvibrio 속의 OTU비율은 ObRS-5 처리 후(3 DAI, 0.86%)가 처리전(0.01%)보다 높았고, 대조구(0-0.03%)와 비교했을 때 뚜렷한 증가를 나타내었는데 이는 E. asburiae ObRS-5 균주처리에 의한 영향으로 판단된다. 따라서 곰취 근권에서 Cellvibrio속 OTU비율의 증가는 ObRS-5균주에 의한 곰취역병 방제에 중요한 역할을 하는 것으로 사료된다. Spingobium속의 OTU 비율은 ObRS-5균주 처리 후 3 DAI (1.38%)에서 처리 전(0.5%)보다 높았으며, Sphingomonadaceae에 속하는 Sphingomonas와 Novosphingobium 또한 처리구 간 유의한 변이가 관찰되었다. Pedobacter속의 OTU 비율 또한, ObRS-5균주 처리 후 3 DAI (1.00%)에서 처리 전(0.23%)보다 증가하였다. 그러나 Sphingobacteriaceae에 속한 Sphingobacterium과 Mucilaginibacter의 처리구 간 변이는 통계적으로 유의하지 않았다. Proteobacteria문에 속하는 Pseudomonas, Cellvibrio, Spingobium, Pedobacter 등 대부분은 처리구 간 OTU 비율의 변이가 크지 않았는데, 곰취 근권에서이러한 세균 속들이 외부 자극에 대해 상당히 안정적으로 존재하면서 양분의 전환, 양분의 경쟁, 대사물질의 활성, 병원균 유입 차단 등 중요한 역할을 하는 것으로 추측된다(Wu et al., 2016). Enterobacter 속의 경우, ObRS-5 균주 처리 후 OTU 비율은 모든 처리 전(0.02%)보다 3 DAT (0.38%)에 증가하는 경향이었고, 3 DAI (9.06%)에는 큰 폭으로 증가하였다가 13 DAI (0.16%)에 다시 감소하였다. Enterobacter 속 OTU 비율의 변화로 볼 때 E. asburiae ObRS-5 균주는 곰취에 관주 처리 후 3-10일에 걸쳐 근권토양에 많은 개체 수를 유지하다가 20일에는 다시 감소한 것으로 유추된다. E. asburiae ObRS-5 균주는 곰취 근권에 대한 정착능을 갖음으로써 여러 근권세균 속의 개체 수 증감에도 영향을 준다고 생각한다. E. asburiae ObRS-5 균주 근권 정착능의 정확한 분석을 위해서는 추가 연구가 필요하다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(과제번호: PJ01259502)의 지원에 의해 수행되었습니다.
References
- Ahn, S. Y., J. H. Kim, Y. J. Kim and S. B. Kwon (2012) Wild vegetables cultivation. Gangwondo Agricultural Research and Extension Services: Gangwondo, Republic of Korea, pp. 10-12.
-
Almaghrabi, O. A., S. I. Massoud and T. S. Abdelmoneim (2013) Influence of inoculation with plant growth promoting rhizobacteria (PGPR) on tomato plant growth and nematode reproduction under greenhouse conditions. Saudi J. Biol. Sci. 20(1):57-61.
[https://doi.org/10.1016/j.sjbs.2012.10.004]

- Amann, R. I., W. Ludwig and K. H. Schleifer, (1995) Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiol. Rev. 59:143-169.
-
Bae, S. J., T. K. Mohanta, J. Y. Chung, M. Ryu, G. Park, S. Shim, S. B. Hong, H. Seo, D. W. Bae, I. Bae, J. J. Kim and H. Bae (2016) Trichoderma metabolites as biological control agents against Phytophthora pathogens. Biol. Control 92:128-138.
[https://doi.org/10.1016/j.biocontrol.2015.10.005]

-
Baker, R. (1968) Mechanisms of biological control of soilborne pathogens. Annu. Rev. Phytopathol. 6(1):263-294.
[https://doi.org/10.1146/annurev.py.06.090168.001403]

-
Berger, F., H. Li, D. Qhite, R. Frazer and C. Leifert (1996) Effect of pathogen inoculum, antagonist density and plant species on biological control of Phytophthora and Pythium damping-off by Bacillus subtilis cot1 in high-humidity fogging glasshouses. Phytopathol. 86(5):428-433.
[https://doi.org/10.1094/Phyto-86-428]

-
Bhardwaj, D., M. W. Ansari, R. K. Sahoo and N. Tuteja (2014) Biofertilizers function as key player in sustainable agriculture by improving soil fertility, plant tolerance and crop productivity. Microb. Cell Fac. 13(1):66.
[https://doi.org/10.1186/1475-2859-13-66]

-
Bonjar, G. H., B. Barkhordar, N. Pakgohar, S. Aghighi, S. Biglary, P. Rashid Farrokhi, M. Aminaii, M. J. Mahdavi, and A. Aghelizadeh (2006) Biological control of Phytophthora drechsleri Tucker, the causal agent for pistachio gummosis, under greenhouse conditions by use of Actinomycetes. Plant Pathol. J. 5(1):20-23.
[https://doi.org/10.3923/ppj.2006.20.23]

-
De Bruijn, I., M. J. D. de Kock, M. Yang, P. de Waard, T. A. van Beek and J. M. Raaijmakers (2007) Genome-baced discovery, structure prediction and functional analysis of cyclic lipopeptide antibiotics in Pseudomonas species. Mol. Microbiol. 63(2):417-428.
[https://doi.org/10.1111/j.1365-2958.2006.05525.x]

-
Caporaso, J. G., J. Kuczynski, J. Stombaugh, K. Bittinger, F. D. Bushman, E. K. Costello, N. Fierer, A. G. Pena, J. K. Goodrich, J. I. Gordon, G. A. Huttley, S. T. Kelley, D. Knights, J. E. Koenig, R. E. Ley, C. A. Lozupone, D. McDonald, B. D. Muegge, M. Pirrung, J. Reeder, J. R. Sevinsky, P. J. Turnbaugh, W. A. Walters, J. Widmann, T. Yatsunenko, J. Zaneveld and R. Knight (2010) QIIME allows analysis of high-throughput community sequencing data. Nat. Methods. 7(5):335-336.
[https://doi.org/10.1038/nmeth.f.303]

-
Chandler, D., G. Davidson, W. P. Grant, J. Greaves and G. M. Tatchell (2008) Microbial biopesticides for integrated crop management: an assessment of environmental and regulatory sustainability. Trends Food Sci. Technol. 19(5):275-283.
[https://doi.org/10.1016/j.tifs.2007.12.009]

-
Fravel, D. (2005) Commercialization and implementation of biocontrol 1. Annu. Rev. Phytopathol. 43(1):337-359.
[https://doi.org/10.1146/annurev.phyto.43.032904.092924]

-
Gerhardson, B. and M. Larsson (1991) Effects of Trichoderma and other fungal antagonists on the incidence of fungal pathogens. Biotic Interact. Soil-borne Dis. 121-128.
[https://doi.org/10.1016/B978-0-444-88728-3.50024-X]

- Gupta, G., S. S. Parihar, N. K. Ahirwar, S. K. Snehi, and V. Singh (2015) Plant growth promoting rhizobacteria (PGPR):current and future prospects for development of sustainable agriculture. J. Microb. Biochem. Technol. 7(2):096-102.
-
Haggag, W. M. and S. Timmusk (2008) Colonization of peanut roots by biofilm-forming Paenibacillus polymyxa initiates biocontrol against crown rot disease. J. Appl. Microbiol. 104(4):961-969.
[https://doi.org/10.1111/j.1365-2672.2007.03611.x]

-
Hardoim, P. R., L. S. Van Overbeek and J. D. Van Elsas (2008) Properties of bacterial endophytes and their proposed role in plant growth. Trends Microbiol. 16(10): 463-471.
[https://doi.org/10.1016/j.tim.2008.07.008]

-
Hornby, D., G. L. Bateman, R. W. Payne, M. E. Brown, D. R. Henden and R. Campbell (1993) Field tests of bacteria and soil-applied fungicides as control agents for take-all in winter wheat. Ann. Appl. Biol. 122(2):253-270.
[https://doi.org/10.1111/j.1744-7348.1993.tb04031.x]

-
Johansson, J. F., L. R. Paul and R. D. Finlay (2004) Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. FEMS Microbiol. Ecol. 48(1):1-13.
[https://doi.org/10.1016/j.femsec.2003.11.012]

-
Khan, M. S., A. Zaidi and P. A. Wani (2007) Role of phosphatesolubilizing microorganisms in sustainable agriculture-a review. Agron. Sustain. Dev. 27(1):29-43.
[https://doi.org/10.1051/agro:2006011]

- Kim, W. G., H. M. Gu, K. H. Kim, I. W. Hyeon, S. K. Hong, J. S. Cha, Y. K. Lee, K. H. Kim, H. S. Choi, D. K. Kim and B. Y. Park (2009) List of plant diseases in Korea. The Korean Society of Plant Pathology: Suwon, Republic of Korea, pp. 80-81.
-
Krzyzanowska, D., M. Obuchowski, M. Bikowski, M. Rychlowski and S. Jafra (2012) Colonization of potato rhizosphere by GFP-tagged Bacillus subtilis MB73/2, Pseudomonas sp. P482 and Ochrobactrum sp. A44 shown on large sections of roots using enrichment sample preparation and confocal laser scanning microscopy. Sens. 12(12):17608-17619.
[https://doi.org/10.3390/s121217608]

- Kwon, S. B., H. J. Jee, S. B. Bang, K. K. Lee and C. K. Hong (1999) Phytophthora root rot of Ligularia fischeri caused by P. drechsleri. Korean Soc. Plant Pathol. 5(1):58-60.
-
Lee, Y., J. H. Ahn, Y. M. Choi, H. Y. Weon, J. H. Yoon and J. Song (2015) Bacterial core community in soybean rhizosphere. Korean J. Microbiol. 51(4)347-354.
[https://doi.org/10.7845/kjm.2015.5052]

-
Liu, W., L. Fu, B. Niu, S. Wu and J. Wooley (2012) Ultrafast clustering algorithms for metagenomics sequence analysis. Brief. Bioinform. 13(6):656-668.
[https://doi.org/10.1093/bib/bbs035]

-
Liu, Y., N. Zhang, M. Qiu, H. Feng, J. M. Vivanco, Q. Shen and R. Zhang (2014) Enhanced rhizosphere colonization of beneficial Bacillus amyloliquefaciens SQR9 by pathogen infection. FEMS Microbiol. Lett. 353(1):49-56.
[https://doi.org/10.1111/1574-6968.12406]

-
Mahaffee, W. F. and Backman, P. A. (1993) Effects of seed factors on spermosphere and rhizosphere colonization of cotton by Bacillus subtilis GB03. Phytopathol. 83(10):1120-1125.
[https://doi.org/10.1094/Phyto-83-1120]

-
Maleki M., L. Mokhtarnejad and S. Mostafaee (2011) Screening of rhizobacteria for biological control of cucumber root and crown rot caused by Phytophthora drechsleri. Plant Pathol. J. 27(1):78-84.
[https://doi.org/10.5423/PPJ.2011.27.1.078]

-
Moon, Y. G., S. W. Kim, J. K. Choi, S. B. Kwon, H. S. Shim, H. J. Ju and I. Y. Choi (2015) Stem rot on Ligularia fischeri caused by Sclerotium rolfsii in Korea. Korean Soc. Plant Pathol. 21(1):36-39.
[https://doi.org/10.5423/RPD.2015.21.1.036]

-
Nelson E. B., W. Chao, J. M. Norton, G. T. Nash and G. E. Harman (1986) Attachment of Enterobacter cloacae to Hyphae of Pythium ultimum: possible role in the biological control of Pythium preemergence damping-off. Phytopathol. 76(3):327-335.
[https://doi.org/10.1094/Phyto-76-327]

- Park, J. W., S. Jahaggirdar, Y. E. Cho, K. S. Park, S. H. Lee and K.-S. Park (2010) Evaluation of Bacillus subtilis native strains for plant growth promotion and induced systemic resistance in tomato and red-pepper. Korean J. Pestic. Sci. 14(4):407-414.
-
Sarbadhikary, S. B. and N. C. Mandal (2017) Field application of two plant growth promoting rhizobacteria with potent antifungal properties. Rhizosphere 3:170-175.
[https://doi.org/10.1016/j.rhisph.2017.04.014]

-
Schloss, P. D. and J. Handelsman (2006) Toward a census of bacteria in soil. PLoS Comput. Biol. 2(7):e92.
[https://doi.org/10.1371/journal.pcbi.0020092]

-
Shen, Z., Y. Ruan, X. Chao, J. Zhang, R. Li and Q. Shen (2015) Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with banana Fusarium wilt disease suppression. Biol. Fertil. Soil 51(5):553-562.
[https://doi.org/10.1007/s00374-015-1002-7]

-
Shirzad, A., V. F. Mamaghani and M. Pazhouhandandeh (2012) Antagonistic potential of fluorescent Pseudomonads and control of crown and root rot of cucumber caused by Phythophtora drechsleri. Plant Pathol. J. 28(1):1-9.
[https://doi.org/10.5423/PPJ.OA.05.2011.0100]

-
Shokralla, S., J. L. Spall, J. F. Gibson and M. Hajibabaei (2012) Next-generation sequencing technologies for environmental DNA research. Mol. Ecol. 21(8):1794-1805.
[https://doi.org/10.1111/j.1365-294X.2012.05538.x]

-
Singh, J. S., S. Koushal, A. Kumar, S. R. Vimal and V. K. Gupta (2016) Book review: microbial inoculants in sustainable agricultural productivity -Vol. II: functional application. Front. Microbiol. 7.
[https://doi.org/10.3389/fmicb.2016.02105]

-
Van Spanning, R., M. Delgado and D. Richardson (2005) The nitrogen cycle: Denitrification and its relationship to N2 fixation. Nitrogen fixation in agriculture, forestry, ecology, and the environment. Springer Science & Business Media:Berlin, Germany, pp. 277-342.
[https://doi.org/10.1007/1-4020-3544-6_13]

-
Sturz, A. V. and J. Nowak (2000) Endophytic communities of rhizobacteria and the strategies required to create yield enhancing associations with crops. Appl. Soil Ecol. 15(2):183-190.
[https://doi.org/10.1016/S0929-1393(00)00094-9]

-
Szczech, M. and M. Shoda (2006) The effect of mode of application of Bacillus subtilis RB14C on its efficacy as a biocontrol agent against Rhizoctonia solani. J. Phytopathol. 154(6):370-377.
[https://doi.org/10.1111/j.1439-0434.2006.01107.x]

-
Tahvonen, R., A. Hannukkala and H. Avikainen (1995) Effect of seed dressing treatment of Streptomyces griseoviridis on barley and spring wheat in field experiments. Agric. Sci. Finland 4(4):419-427.
[https://doi.org/10.23986/afsci.72619]

-
You, C., C. Zhang, F. Kong, C. Feng and J. Wang (2016) Comparison of the effects of biocontrol agent Bacillus subtilis and fungicide metalaxyl-mancozeb on bacterial communities in tobacco rhizospheric soil. Ecol. Eng. 91:119-125.
[https://doi.org/10.1016/j.ecoleng.2016.02.011]

-
Yousuf, B., J. Keshri, A. Mishra and B. Jha (2012) Application of targeted metagenomics to explore abundance and diversity of CO2-fixing bacterial community using cbbL gene from the rhizosphere of Arachis hypogaea. Gene 506(1):18-24.
[https://doi.org/10.1016/j.gene.2012.06.083]

-
Wu, B., X. Wang, H. Yang, H. Zeng, Y. Qiu, C. Wang, J. Yu, J. Li, D. Xu, Z. He, and S. Chen (2016) Effects of Bacillus amyloliquefaciens ZM9 on bacterial wilt and rhizosphere microbial communities of tabacco. Appl. Soil Ecol. 103:1-12.
[https://doi.org/10.1016/j.apsoil.2016.03.002]


