Sclerotium rolfsii에 의한 비름 흰비단병 최초 보고 및 방제 약제 선발
초록
경남 고성지역의 비름나물 시설재배지에서 흰비단병과 유사한 병징이 관찰되었다. 본 연구의 목적은 Sclerotium rolfsii 병원균에 의한 비름나물 흰비단병의 최초 보고와 비름 흰비단병을 효과적으로 방제하는 약제를 보고하고자 수행되었다. 병원균은 형태학적, 분자생물학적 특징을 바탕으로 Sclerotium rolfsii로 동정 되었다. 총 5가지의 농약을 포장 수준에서 흰비단병 방제 약효를 평가한 결과, flutolanil EC와 fluxapyroxad SC가 무처리 대비 80% 이상의 병해 방제 효과를 나타내었다. 이러한 결과는 소면적 재배작물인 비름나물의 흰비단병 방제를 위한 효과적인 약제로 등록되어 사용 가능 할 것으로 사료된다.
Abstract
Symptoms of disease related to southern blight have been observed in a greenhouses located in Goseong-gun Gyeongnamon plant species Amaranthus mangostanus (common name: Amartanth). This research was aimed at reporting on A. mangostanus the first case of southern blight disease and also to screen effective fungicides against the causal pathogen. The pathogen was described using morphological and molecular characteristics as Sclerotium rolfsii. Among the fungicides studied, to compare untreated control, flutolanil EC and fluxapyroxad SC contributed to disease prevention by more than 80%. The findings are expected to serve as fundamental data for the development of potential fungicides to register Southern blight disease on A. mangostanus.
Keywords:
Amaranthus mangostanus, Fungicide, Sclerotium rolfsii, Southern blight키워드:
비름나물, 흰비단병, 살균제, 흰비단병원균서 론
최근 국민 소득이 향상에 따라 건강식품에 대한 관심이 증가하는 추세이다. 이에 따라, 식용작물 선택에 대한 소비 기호가 변화하기 시작하였으며, 과거에 재배되지 않던 작물이 새로운 소득작물로 인식되고 있다. 이러한 작물들을 소면적 재배작물로 통칭되며, 국내 재배면적이 1,000 ha 미만이거나 대부분의 재배면적이 기록되지 않는 작물이다(Park et al., 2012). 소면적 재배작물 중 하나인 비름(Amaranthus mangostanus)은 비름과의 일년생 식물로써, 동남아시아가 원산지로 알려져 있다. 고대부터 현재까지 산채로 소비되고 있으며, 비름의 효능은 해열, 해독, 소종 뿐만 아니라, 눈을 맑게 하거나, 소화에 도움을 주는 것으로 알려져 있다(Oh and Lee, 2005; Chi et al., 2019).
비름은 대부분이 시설에서 재배가 이루어 지고 있는 추세이며, 시설 재배지에서 작물을 재배할 경우 고온 및 다습한 재배 환경이 문제가 되고 있다. 이와 같은 재배 환경으로 인하여 작물에 병해피해가 빈번이 발생하고 있는 실정이다(Park et al., 2012). 경남 고성군에 위치한 비름 재배지에서 외부 기온이 상승하기 시작하는 6월에 식물체의 지제부가 시들면서 흰색 곰팡이가 피고, 검은색 균핵이 형성되어 결국에는 식물체가 고사하는 증상을 관찰되었다. 이에 따라 비름 재배지에서 병든 식물체를 채집하고 실험실에서 병원균 순수분리 및 동정을 진행하였으며, 그 결과 Sclerotium rolfsii에 의한 비름 흰비단병으로 동정 되었다. 국내에서 비름에 대한 병해로는 흰녹가루병, 탄저병 등이 보고되어 있으며, S. rolfsii에 의한 흰비단병은 보고되어 있지 않다(The Korean Society of Plant Pathology, 2009).
소면적 재배 작물은 발생 병해에 사용할 수 있는 약제 정보 부족으로 인하여 과도한 농약의 사용 또는 오용을 야기할 수 있으며, 소비자의 경우 안전한 먹거리에 대한 문제가 야기될 수 있다(Ahn et al., 2014; Park et al., 2009). 이에 따라 본 연구에서는 비름나물에 발생한 흰비단병을 최초 보고 하고자 하며, 효율적인 방제를 위하여 살균제의 약효, 약해 시험을 수행함으로써 농약품목등록자료를 위한 기초자료 확보를 목적으로 수행하였다.
재료 및 방법
감염된 식물체로부터 병원균 분리
2018년도 6월 경상남도 고성군 거류면(N 34o58’, E 128o22’)에 위치한 비름나물 재배지에서 병해 피해 의심 증상이 발생하였다. 병원균 분리를 위하여 줄기의 건전부와 이병부의 경계조직을 5×5 mm 크기로 잘라 순수 분리를 진행 하였으며, 순수 분리 방법으로는 70% ethanol 용액으로 30초, 1% NaOCL 용액으로 30초간 표면 소독한 후 멸균수로 3회 세척하여 멸균된 여과지에서 30분간 건조시켰다. 건조가 끝난 후 물한천배지(Water agar, WA: agar 20 g per L) 위에 치상하여 27oC 항온기에서 3일간 배양 하였다. 3일 뒤 자라나온 균사 선단 부를 감자한천배지(Potato dextrose agar, PDA: potato detrose 24g, agar 20g per L)에 치상하여 27oC 항온기에서 7일간 배양 하여 병원균 특성을 조사하였다(Table 1). 또한 병원균의 분자생물학적 동정을 위하여 염기서열 분석에 사용하였다. 분리한 병원균은 농업유전자원정보센터(Korean Agricultural Culture Collection; KACC)에 기탁번호(KACC 48520)를 부여 받았으며, 염기서열 정보는 NCBI (National Center for Biotechnology Information)에서 accession number (MN258360)를 부여 받았다.
Total DNA 추출 및 internal transcribed spacer (ITS) 염기서열 분석
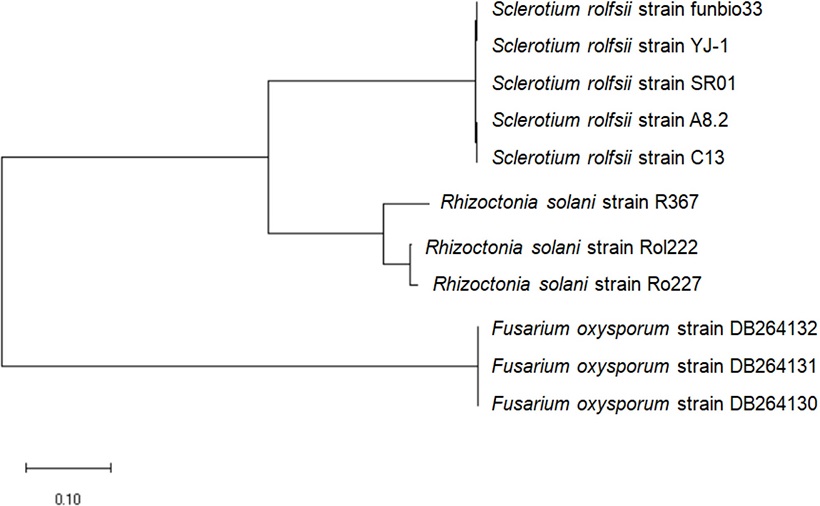
DNA 추출은 CTAB방법(Graham et al., 2003)에 의거하여 DNA를 추출 하였으며, ITS rDNA 영역을, ITS1(5’-TCCGTAGGTGAACCTGCGG-3’), ITS4(5’-TCCTCCGCTTATTGATATGC-3’) 프라이머를 이용하여 중합효소연쇄반응(Polymerase chain reaction, PCR) 과정에 준하여 해당 영역을 증폭하였다(White et al., 1990). 증폭시킨 PCR 산물은 1% agarose gel에서 전기영동하여 Amplicon을 확인한 후 염기서열을 분석하였다. 염기서열 분석은 Macrogen (Seoul, Korea)에 의뢰하여 진행하였으며, 염기서열 정보를 바탕으로 phylogenetic analysis을 실시하였다. Phylogenetic analysis은 NCBI에서 제공하는 GeneBank BLAST를 이용하여 ITS 1,4 영역의 염기를 검색한 후 MEGA7.0 program으로 maximum-likelihood 알고리즘을 사용하였다.
병원성 검증 실험
병원성 검정 실험을 위해서 플라스틱 포트(9×8.5×7 cm)에 인공상토를 채운 후 구입한 비름종자(재래종)를 심은 다음 유리온실조건에서 재배하여 진행하였다. 접종원 제작은 분리한 S. rolfsii 균주를 감자한천배지(PDA)에 27oC 조건으로 7일간 배양 후, oat-meal 모래배지(oat-meal: 모래 = 1:9)에서 균총을 잘게 잘라 접종 하였다. 접종 후 27oC 조건에서 10일간 배양하여 실험에 사용하였다. 제작한 접종원은 유리온실에서 20일간 재배한 비름나물 포트 당 5 g (106 CFU/g)을 지제부에 접종하였으며, 접종 후 25-35oC로 유지되는 유리온실에서 수분이 마르지 않도록 광이 투과되는 흰색 플라스틱을 덮어 준 다음 병의 발병 유무를 관찰 하였다. 10일 후 병발생이 관찰 되었으며, 병이 발생한 개체로부터 병원균 재순수분리를 진행 하였다.
공시약제 선정 및 야외 시험 구 조성
공시약제 선정 실험에는 flutolanil 15% 유제와 fluxapyroxad 15.3% 액상수화제 2종과 validamycin-A 10% 수용제 1종, azoxystrobin 21.7% 액상수화제와 fluazinam 50% 액상수화제 2종 등 총 5종의 살균제를 선발하여 실험을 진행하였다. 경상남도 사천시 사천읍 두량리(N35o06', E128o07')와 진주시 대곡면 단목리(N35o14’, E128o09')에 위치한 경상대학교 부속농장에서 8월 초 포장을 조성 한 후 약효와 약해 검증 실험을 실시하였다. 시험구는 1 m×20 m로 총 20개의 재배라인을 조성 후 멀칭비닐을 피복하였으며 비름 모종을 재배라인 당 30 cm 간격으로 2줄 재배를 하였다. 살균제는 처리구 별로 각각 약효는 10 m2의 면적에서, 약해는 5 m2의 면적에서 3반복으로 총 345 m2의 면적에서 진행하였으며, 난괴법에 의거하여 시험구를 배치하였다. 발아 후 30일간 재배한 비름에 흰비단병 발병을 유도하기 위해 실험실에서 제작한 흰비단병 접종원을 9월 초 포장에 처리 하여 병을 유도하였다. 시험 기간 중 시험약제 이외의 다른 살균제는 살포하지 않았으며 물 공급과 제초작업은 일주일에 2~3회 실시하였다.
약제 살포 및 약효, 약해 조사방법
약제 살포는 농약사용지침서(KCPA, 2016)에 의거하여 살포 시기 및 횟수를 적용하였으며, 병원균 접종 후 7일 이내에 약제를 관주 처리하였다. Table 2와 같이 약효시험으로 azoxystrobin 21.7% 액상수화제, flutolanil 15% 유제와 validamycin-A 10% 수용제를 각각 1,000배에 희석하였으며, fluazinam 50% 액상수화제와 fluxapyroxad 15.3% 액상수화제는 각각 2,000배에 희석하여 발병 초 10일간격으로 2회 관주 처리(2018년 9월 5일, 9월 15일) 하여 약제를 살포하였다. 최종약제 처리 10일 후 구당 전주에 대한 이병주율을 조사하였다. 약해시험으로는 21.7% 액상수화제, flutolanil 15% 유제와 validamycin-A 10% 수용제를 각각 500배에 희석하였으며, fluazinam 50% 액상수화제와 fluxapyroxad 15.3% 액상수화제는 각각 1,000배에 희석하여 1회 관주처리(2019년 9월 15일)하여 약제 처리 3, 7, 9일 후 외관상 나타나는 약해 유무를 조사하였다(Table 2). 약제 살포 및 약효, 약해 조사는 경상남도 사천시 포장과 진주시 대곡면 포장 모두 동일하게 진행하였다.
통계분석
통계분석방법은 분산분석(ANOVA)과 던컨다중검정(DMRT)이 사용된다. 분산분석은 두 개 이상 집단들 간의 평균 차이를 비교 하기 위하여 집단간 분산과 집단 내 분산을 계산하고 이들 상호간의 비를 이용하는 방법이다(Kim, 2016; Park et al., 2016). 분산분석을 통해 집단들 간의 평균들이 유의미하게 차이가 나타나는 결과를 확보하면 이후 DMRT를 사용하여 각 집단들 간의 평균차이를 비교하여 집단 간에 차이를 검정하였으며, 처리구 평균간 유의성 검정은 5% 수준에서 유의성을 실시하였다.
결과 및 고찰
병원균 분리 및 동정
2018년 6월 경상남도 고성군에 위치한 비름나물 재배지에서 비름의 지제부가 수침상의 병반이 형성되며 물러지고 줄기의 색이 갈색으로 변하면서 식물체가 시드는 이상증상이 관찰되었다. 병든 식물체의 줄기에서는 흰색의 균사체가 다량으로 형성되어, 결국 식물체 전체가 시들어 말라 죽는 증상이 관찰되었다(Fig. 1A). 병발생도는 약 25% 내외로 조사되었다. 병징을 보이는 식물체를 채집하여 병원균을 분리하였으며, 분리한 병원균으로부터 균사특징을 관찰하였다. 그 결과, PDA 배지에서 흰색 균총으로 균사는 솜털처럼 왕성하게 자라며, 최초에는 흰색의 균핵 시원체가 형성 되었고, 이후 시간이 경과된 후에는 작고 둥근 갈색의 균핵이 형성되었다(Fig. 1B). 균핵의 모양은 구형 또는 불규칙한 타원형으로 관찰되었으며, 25~30oC에서 1-3 mm 크기로 형성되었다(Table 1).
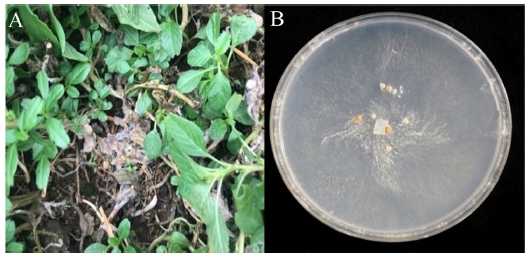
Symptoms of southern blight disease on Amaranthus mangostanus caused by Sclerotium rolfsii. (A): Southern blight symptom of A. mangostanus in field condition, (B): Colony morphology of the S. rolfsii on PDA media.
ITS 영역의 염기서열을 바탕으로 Nucleotide BLAST 분석결과 GenBank에 등록된 S. rolfsii (accession no. MH256035.1, MK024135.1, MF287635.1)와 100% 일치하는 것을 확인하였으며, S. rolfsii strain funbio33으로 명명하게 되었다. 분자계통학적 유연관계 분석에서도 S. rolfsii와 같은 계통군에 속함을 확인 할 수 있었다(Fig. 2). 최근 기후 온난화로 인하여 경남지역에서 돌발 병해 발생이 해마다 증가하고 있는 추세이며 이러한 문제점은 시설하우스에서 크게 문제가 되고 있다. 시설하우스는 작물을 밀식재배를 하기 때문에 고온다습한 환경조건으로 인하여 흰비단병이 크게 증가하고 있는 실정이며, 최근 10년간 조사 결과 경남지역에서 미기록 병해 34종이 흰비단병으로 보고 되었다(KSPP, 2009). 이러한 현상은 기후 온난화로 인하여 환경적 요인이 재배작물에 불리한 요인으로 작용하여 흰비단병의 기주 범위가 확대되고 있는 것으로 사료된다.
병원성 검정 및 병원균 재분리
제작한 병원균 접종원을 비름나물을 20일간 재배한 플라스틱 포트에 접종 후 10일이 경과 하였을 때부터 병징이 관찰되기 시작하였다. 병징은 포장에서 관찰된 병징과 유사하게 지제부에서 흰색곰팡이가 피어나기 시작하여, 수침상으로 물러지기 시작하였다. 시간이 경과됨에 따라 비름나물의 줄기가 갈색으로 갈변하면서 시들기 시작하였다. 병든 식물체로부터 병원균 재분리를 진행 한 결과 접종했던 병원균과 동일한 병원균이 재분리 되었으며(Fig. 3D, E), 반면 무처리구에서는 병이 발병 되지 않았다(Fig. 3A, B). 따라서 비름 재배지에서 분리한 S. rolfsii strain funbio34 균 주는 비름의 흰비단병의 원인균으로 확인 되었다.

Pathogenicity test of Sclerotium rolfsii on Amaranthus mangostanus. Symptom was observed 10 days after inoculation of S. rolfsii funbio33 (106 CFU/g of soil). (A): Untreated control seedling (front view), (B): Untreated control seedling (Top view), (C): Disease symptoms by artificial inoculation of S. rolfsii, (D): Re-isolation of the pathogen from the wilted plant at C.
약효 및 약해 시험
공시약제에 대한 무처리 대비 약효시험 결과 사천시 두량리 포장에서는 flutolanil 15% 유제와 fluxapyroxad 15.3% 액상수화제가 방제가 각각 88.2, 80.9%으로 방제효과가 우수하였으며, azoxystrobin 21.7% 액상수화제, validamycin-A 10% 수용제, fluazinam 50% 액상수화제는 각 각 방제가가 52.3, 64.3, 61.9%로 방제효과가 낮은 것으로 조사되었다. 진주시 대곡면 포장에서는 flutolanil 15% 유제와 fluxapyroxad 15.3% 액상수화제가 방제효과가 우수한 것으로 나타났으며 각각 방제가가 82.5, 80%으로 우수하였으며, azoxystrobin 21.7% 액상수화제, validamycin-A 10% 수용제, fluazinam 50% 액상수화제는 각각 방제가가 55, 60, 57.5%로 방제효과가 낮은 것으로 조사되었다(Table 3). Flutolanil 15% 유제와 fluxapyroxad 15.3% 액상수화제는 고추 흰비단병에 사용하는 약제로 등록되어 있으며(KCPA, 2016), 고추 흰비단병 뿐만 아니라 비름 흰비단병에도 약효 효과가 우수한 것으로 조사되었다. 약해 시험 결과 두 곳의 포장에서 모든 공시약제에 대한 기준량 및 배량에서 약해 증상은 발생하지 않았다. 이러한 시험결과를 바탕으로, flutolanil 15% 유제와 fluxapyroxad 15.3% 액상수화제는 비름 흰비단병에 대하여 80% 이상의 높은 약효를 보이며 약해는 없으므로 방제약제로 사용하기에 적합하다고 사료된다.
References
-
Ahn CH, Kim YH, Eom HS, Lee GH, Ryu GH, 2014. A study on crop group for pesticide efficacy and crop safety of minor crops. Korean J. Pestic. Sci. 18(4):364-375. (In Korean)
[https://doi.org/10.7585/kjps.2014.18.4.364]

-
Chi K, Zou R, Wang L, Huo W, Fan H, 2019. Cellular distribution of cadmium in two amaranth (Amaranthus mangostanus L.) cultivars differing in cadmium accumulation. Environ. Sci. Pollut. Res. 26(22):22147-22158.
[https://doi.org/10.1007/s11356-019-05390-w]

-
Graham J, Marshall B, Squire GR, 2003. Genetic differentiation over a spatial environmental gradient in wild Rubus idaeus populations. New Phytol. 157(3):667-675.
[https://doi.org/10.1046/j.1469-8137.2003.00693.x]

- Oh YS, Lee SH, 2005. Isolation and identification of antimicrobial compound from Amarantus lividus. Korean J. Microbiol. Biotechnol. 33(2):123-129.
- Park HR, Heo SJ, Thapa SP, Yu IH, Cho JM, et al., 2012. Residual analysis and risk assessment of Acetamiprid 5% SL in the Amaranthus (Amaranthus mangostanus L.). J. Agric. Life Environ. Sci. 24:55-61.
- Park JH, Mamun MIR, Abd El-Aty AM, Choi JH, Im GJ, et al., 2009. An extrapolation from crop classifications based on pesticide residues trial data within vegetables in minor crops. Korean J. Pestic. Sci. 13(1):28-38. (In Korean)
- Park SZ, Hahn WS, Chung NJ, 2016. Comparison of several groups in Biostatistics. KNOU Press. Seoul. Korea. pp. 230-250.
- Kim SJ, 2016. Analysis of freshness of rice depending on packing material using MANOVA. Korean J. Applied Statistics. 29(7):1421-1428.
-
White TJ, Bruns TD, Lee SB, Taylor JW, 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA, Gelfand DH, Sninsky JJ, editors. PCR protocols: a guide to methods and applications. San Diego: Academic Press. pp. 315-322.
[https://doi.org/10.1016/B978-0-12-372180-8.50042-1]

- Korea Crop Proteotion Association (KCPA), 2016. Agrochemcials use guidebook.
- The Korean Society of Plant Pathology, 2009. List of plant disease in Korea. 5th ed., Suwon, Korea. p. 853.