논 토양에서 [14C]Butachlor의 대사시험
초록
본 연구는 논 토양(양토)에서 butachlor의 대사경로와 DT50 (반감기) 및 DT90을 산출하기 위해 비멸균 토양과 멸균토양으로 구성하여 수행하였다. 호기상태를 유지하기 위해 공기흐름식 장치(flow-through system)에 연결된 시험병에 지속적으로 공기가 흐르도록 하였고 시험병 내의 pH, 용존산소 그리고 산화-환원 전위를 시험기간 동안 측정하였다. 표지된 방사성동위원소 시험물질(14C-butachlor)을 사용하여 생성된 대사산물을 검출할 수 있도록 하였다. 대사산물은 시험기간 동안 비멸균 토양에서 6개가 검출되었으며 모두 처리량(AR)의 10% 미만의 소량이었다. 검출된 대사산물 중에서 2개의 물질을 radio-HPLC와 LC-MS/MS를 사용해서 표준물질과 비교하여 각각의 대사산물이 N-(Butoxymethyl)-N-(2,6-diethylphenyl)-acetamide와 N-(2,6-Diethyl-phenyl)-N-hydroxymethyl-acetamide인 것을 확인하였다. 이 대사산물들은 토양 내의 미생물에 의해 dechlorination과 O-dealkylation의 작용에 의해서 생성된 것으로 보인다. 비멸균 토양 내에서 1차 반응식에 의해 계산된 butachlor의 DT50(반감기) 및 DT90은 각각 25.3과 84.0일이었으며 멸균토양에서는 뚜렷한 감소가 관찰되지 않아 소실속도와 반감기를 계산할 수 없었다. 비추출성 잔류물은 62일에 최대 45.6% AR이었으며 휘발성 물질과 CO2는 매우 낮은 수준으로 검출되었다(0.5% AR 이하). 비추출성 잔류물은 펄빅 (13.4% AR) 및 휴믹 분획 (8.0 % AR) 보다는 휴민 분획 (21.2% AR)에 대다수가 존재하는 것으로 확인하였다.
Abstract
This study was conducted to investigate the metabolic pathway and to calculate the DT50 (half-life) and DT90 of butachlor in the paddy soil (loam soil) which consisted of sterile and non-sterile conditions. The aerobic conditions were maintained with constant air flow in test vessels connected to the flow-through system and values for pH, dissolved oxygen, and redox potential were measured during the test period. Labelled radioactive substance (14C-butachlor) was used to detect the metabolites produced from the test substance. Six metabolites were found in the non-sterile soil, all less than 10% of applied radioactivity (AR) throughout the study. Of these, two main metabolites (N-(Butoxymethyl)-N-(2,6-diethylphenyl)-acetamide, N-(2,6-Diethyl-phenyl)-N-hydroxymethyl-acetamide) were identified by comparing to the authentic substance using radio-HPLC and LC-MS/MS, indicating that dechlorination, O-dealkylation occurred by microbes in the soil. The DT50 and DT90 values were calculated using the first-order kinetic, showing 25.3 and 84.0 days in the non-sterile soil, however those values in the sterile could not be calculated because no significant decrease was observed. Non-extractable residues increased to a maximum value of 45.6% AR at 62 days after treatment (DAT) but the volatile compounds and CO2 were much lower levels (less than 0.5% AR). A majority of the non-extractable residue (bound residue) was associated with the humin fraction (21.2% AR) than the other fulvic acid (13.4% AR) and humic acid fraction (8.0% AR).
Keywords:
14C-Butachlor, Metabolic pathway, DT50 (half-life), Non-extractable residue키워드:
14C-butachlor, 대사경로, 반감기, 비추출성 잔류물서 론
인류가 개발하여 사용하고 있는 화학물질은 농업을 포함한 모든 다양한 산업 전반에 반드시 필요한 소재로, 이 중 우리의 일상생활에서 접하게 되는 농약, 의약품, 가정용 및 산업용 화학제품은 현대 사회의 생활필수품으로 존재하고 있다. 그러나 이러한 화학물질의 기능성과 편리성으로 삶의 질이 향상된 이면에는 화학물질의 다량사용으로 인한 부작용으로 화학물질 유해성 논란이 지속되면서 화학물질 전반에 대한 국민의 사회적 불안감은 확산되고 있다(Choi, 2017). 그 중, 농업에 사용되는 농약은 작물의 성장 및 관리에 있어서 해로운 유기체를 방제하는데 사용되는 화학물질로써 농업에 이로운 반면, 사람을 포함한 다른 생물에 해롭기도 하다(McKinlay et al., 2008).
이에 따라 농약을 포함한 다양한 화학물질이 환경에 유입된 직후부터 생물체에 도달하기까지의 노출경로와 노출된 화학물질에 대한 위해성을 평가할 필요가 있다. 대부분의 화학물질은 환경에 배출되었을 때 최초로 배출된 상태로 머물지 않고 휘발, 수착, 생물농축, 침적 등의 형태로 다른 매체로 이동하거나, 각종 화학적 변환과정에 의해 다른 형태로 변형되기도 하기 때문에 화학물질의 환경거동(environmental fate)은 화학물질의 위해성을 평가하는데 매우 중요한 인자 중 하나이다(Wolff and Crossland, 1991; Mackay et al., 1996; Van Eerd et al., 2003; Darlington et al., 2009).
대부분의 농약들은 작물이나 토양에 살포 후에 토양에 잔류하거나 수계로 유입될 가능성이 높아 환경거동과 관련된 특성을 판단하기 위해서 토양 및 수중 퇴적물 대사시험을 수행하고 있다. 토양 및 수중 퇴적물에서 농약의 대사 및 환경거동에 관한 연구는 농약의 분해 및 소실패턴을 사용하여 반감기(half-life)를 산출하고 발생되는 대사산물들을 동정(identification)하며 더 나아가서는 대사산물의 생성과정을 추적하는 시험이기 때문에 농약과 같은 화학물질에 대한 환경적 거동을 평가하는 것은 매우 중요하다. 비록, 대부분의 농약성분은 미생물에 의해 토양 및 물에서 분해되어 모화합물보다 독성이 낮아지는 것으로 보고되고 있지만(Akram et al., 2018), 새롭게 개발된 농약이거나 환경 내의 독성 및 평가에 대한 자료가 부족할 경우에는 토양 및 수중 퇴적물 대사시험은 반드시 수행되어야 할 시험항목이다. 국제적인 시험지침서(OECD test guideline No. 307)에서는 다양한 특성의 토양과 시험조건을 사용하여 토양 및 수중 퇴적물에서의 반감기와 대사산물의 양 그리고 생성물질에 대한 구조 동정(identification of structure)을 요구하고 있다(Table 1).

Classification for soil and aquatic sediment metabolism studies according to the OECD test guideline (No. 307 and 308: adopted on 24th April 2002)
시험에 사용된 butachlor는 토양에 처리하여 종자의 발아를 억제하는데 사용되고 있는 제초제로 미사질 양토(silt loam)와 식양토(clay loam)를 이용한 Lee (1983)의 butachlor의 분해에 관한 연구결과에서는 토양에 따른 butachlor의 분해속도 및 분해산물의 생성을 보고하였지만, 유의한 차이는 확인되지 않았다.
본 연구에서는 국내 논토양의 토성 중 가장 많이 분포 되어있는 양토(loam)에서의 연구결과(NIAST, 1992)와 토양성분과 결합되어 추출되지 않은 비추출성 잔류물(Non-extractable residues)내의 분포현황에 대한 연구자료가 매우 미미하여 [14C]butachlor를 사용하여 담수조건의 양토 내에서 butachlor의 분해속도 및 반감기(half-life)와 분해산물을 확인하고 비추출성 토양 잔류물 내에 잔류하는 방사능(radioactivity)을 pH에 따른 용해도로 분류된 휴민(humin), 풀빅산(fulvic acid) 및 휴믹산(humic acid)으로 분획하여 각각의 잔류량을 확인하기 위해서 수행하였다.
재료 및 방법
시험물질 및 시약
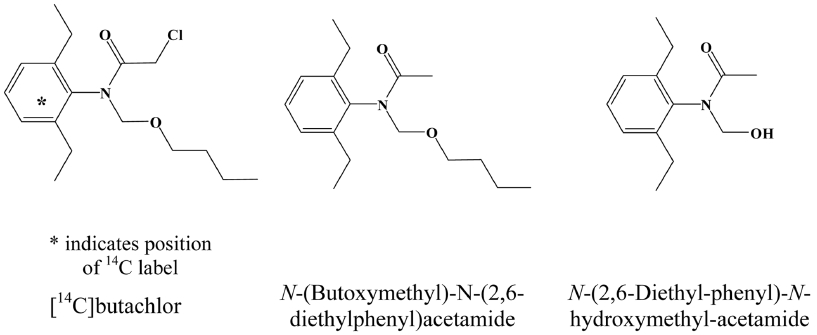
본 연구에 사용된 [14C]butachlor (specific activity: 0.65 MBq/mg)는 한국표지화합물(Korea Radio Chemicals Center; Suwon, Korea)에서 구입하였으며, 시험 전 radio-high-performance liquid chromatography (radio-HPLC)로 확인된 순도는 98.71%였다. 비표지(non-labeled) butachlor (purity: 99.0%)와 N-(Butoxymethyl)-N-(2,6-diethylphenyl)acetamide(purity: 98.81%)은 각각 AccuStandard (New Haven, CT, USA)와 Tractus (London, England)에서 구입하였다. 시험물질을 포함한 주요 대사산물에 대한 구조는 Fig. 1에 제시하였다. HPLC 등급의 acetonitrile, acetone, ethyl acetate 그리고 ethyl alcohol은 Burdick&Jackson (Muskegon, MI, USA)에서 구입하였으며, guaranteed reagent 등급의 formic acid, sodium carbonate, sodium chloride, sodium hydroxide 그리고 sodium sulfate는 Junsei Chemical co. Ltd. (Tokyo, Japan)에서 구입하였다. 방사능량 측정에 사용된 Cabo-Sorb E, Insta-gel plus, Permaflour E+, Ultima-FloTM M, Ultima-Gold의 scintillation cocktail은 PerkinElmer (Waltham, MA, US)에서 구입하여 사용하였다. 생균수 측정에 사용된 Agar는 YAKURI Pure Chemicals co. Ltd (Osaka, Japan)에서 구입하였으며, nutrient broth는 Becton Dickinson and Company (Flanklin Lakes, NJ, USA)에서 구입하여 사용하였다.
시험토양 및 시험장치
시험토양은 경상남도 사천시 사천읍 두량리 논토양으로 0–20 cm 깊이에서 채취하였으며 시험에 사용된 토양은 sand 42.5%, silty 30.0%, 그리고 clay 27.5%의 함량인 양토이며 자세한 토양의 특성은 Table 2에 나타내었다. 채취한 토양은 polyethylene bag에 넣고 통풍이 되는 상태로 운송한 후, 2 mm 체에 통과시켜 굵은 입자의 돌과 식물체 뿌리 등을 제거하였으며 시험에 사용하기 전까지 4 ± 2oC의 온도에 보관하였다.
시험에 적용된 시험장치와 구성은 다음과 같았다. 시험토양(50 g)과 증류수(15 mL, 물 층 높이 2 cm)가 담긴 시험병을 공기흐름식(flow-through) 장치에 연결하고 0.2 μm filter를 통과하는 가습공기를 유속 20–30 mL/min으로 시험기간 동안 지속적으로 공급하였다. 각 시험병에 물 층의 높이를 표시하여 시험기간 동안 증발된 증류수의 양을 채워 넣어 물 층의 높이가 일정하게 유지되도록 하였으며, 시험기간 동안 발생하는 14C-휘발성 유기화합물과 14CO2를 포집하기 위해 30 mL의 ethylene glycol과 40 mL의 1 N sodium hydroxide를 순차적으로 연결하였다. 시험물질을 처리하기 전까지 20 ± 2oC의 암조건에서 14일 동안 순화하여 토양 내에서 발아된 식물체를 제거하였다. 시험에는 비멸균 토양과 멸균토양의 조건을 사용하였으며, 토양의 멸균은 고압증기 멸균기(SX-700, TOMY SEIKO, Japan)를 이용하여 121oC에서 15분 동안 3회 멸균시켰다. 시험병의 구성은 시험물질 처리구(유기용매에 용해된 시험물질을 처리한 시험병), 대조구(시험물질과 유기용매가 처리되지 않은 시험병), 유기용매 대조구(시험물질 처리구와 동일한 양의 유기용매만 처리한 시험병)를 두었으며, 모든 시험병은 2반복으로 수행하였다.
분석방법 및 조건
방사능량의 측정은 액체섬광계수기(liquid scintillation counter: Tri-Carb 2910TR, Perkin Elmer, Waltham, MA, US)를 이용하였으며, 분석시료를 scintillation cocktail에 넣고 혼합한 후, 3분간 측정하였고 모든 시료는 3반복으로 수행하였다. 대조구 시료를 이용하여 바탕시료(background)의 방사능량을 측정하여 각 시료별 분석결과 계산시에 바탕시료의 방사능량을 보정하였다.
비추출성 잔류물(non-extractable residues)은 시료 산화장치(sample oxidizer: Model 307, Perkin Elmer, USA)를 사용하였으며, 토양 잔류물 0.2 g에 0.1 g의 cellulose 분말을 혼합한 후, 1분간 연소시켰다. 시료가 연소되는 동안 생성된 14CO2를 5 mL의 Cabo-Sorb® E로 포집시키고 10 mL의 Permaflur E+ scintillation cocktail과 혼합한 시료를 액체섬광계수기로 방사능량을 측정하였다. 시료 측정 전, 시료 산화장치의 연소효율을 측정하였으며(95% 이상) 모든 시료의 측정값은 연소효율 값을 보정한 후 계산하였다.
Radio-HPLC (Radio-High Performance Liquid Chromatography)는 Radiomatic 610TR (PerkinElmer, Waltham, MA, USA) 검출기를 연결하여 시험물질의 순도와 분석시료 내의 시험물질 및 대사산물을 분석하였다(Table 3). 또한, 대사산물은 LC-MS/MS (Liquid Chromatography-Tandem Mass spectrometry; G6460-QQQ, Agilent Technologies, CA, USA)를 사용하여 표준물질과의 머무름 시간 및 spectrum을 비교분석하여 대사산물을 동정하였다. 하지만, 표준물질의 확보가 어려운 경우에는 선행연구에서 제시하는 대사산물의 결과와 비교하여 확인하였다.
시험물질의 처리
시험물질의 처리량은 OECD (No. 307, 2002)의 시험지침서에서 제시하는 계산식에 따라 결정하였다. Acetonitrile에 용해된 시험물질(표지물질 40 μg, 비표지물질 219.5 μg)을 50 g (dry weight basis)의 토양에 처리하여 butachlor의 양이 5.19 mg/kgsoil (1.5 kg/ha) 수준이 되도록 하였다. 표지물질의 용액은 처리 전에 액체섬광계수기를 사용하여 방사능량을 확인하였고 비표지물질의 용액은 정밀전자저울(MSA225S-000-DA, Sartorius, Germany)로 무게를 칭량 한 후, 토양에 처리하였다. 시험물질은 물층에 균일하게 처리될 수 있도록 시험물질 처리후에 spatula로 토양과 물이 충분히 혼합될 수 있도록 하였으며, 혼합에 사용된 spatula의 방사능 잔류량은 처리된 양의 0.1% 미만으로 spatula에 의한 소실이 없는 것으로 확인하였다.
미생물의 생체량 및 시험환경의 측정
시험토양의 미생물 생체량은 ISO 측정방법(ISO, 1997)에 따라 훈증추출법(fumigation extraction)으로 다음과 같이 수행하였다. 데시케이터 안에 증류수에 젖은 filter paper와 토양 20 g (dry weight basis)을 넣고, chloroform (free ethanol)을 10 μL/g의 비율로 토양에 처리하였다. Chloroform (free ethanol) 25 mL을 담은 비커, 비등석 5개, 그리고 소다석회 2 g을 데시케이터에 넣고 진공을 걸어 약 2분간 훈증시켰다. 그 후, 진공마개를 닫고 25 ± 2oC의 암조건에서 24시간 배양하였다. 비훈증 토양시료는 chloroform이 없는 데시케이터에 넣어 상기와 동일한 조건으로 배양하였다(Kim et al., 2014). 이 후, 토양에 0.5 M potassium sulfate 80 mL을 넣은 후, 30분간 200 rpm으로 진탕 추출하였다. 추출 후, 감압 여과(filter paper; Whatman No.2)한 여액을 TOC 분석장비(TOC-V CPN, Simadzu, Japan)로 분석하였다. 미생물의 생체량은 25 DAT (days after treatment)와 62 DAT의 대조구와 유기용매 대조구의 시험병에서 측정하였다. 멸균 토양시료는 시험종료 지점의 대조구 시료를 평판 배지법으로 생균수를 측정하였다. 증류수 1 L 당 agar 15 g, nutrient broth 8 g을 넣고 121oC에서 15분간 멸균한 후, petri dish에 약 20 mL씩 넣어 굳혔다. 멸균시험관에 토양시료와 멸균 증류수를 넣어 추출한 후, 상등액을 상기의 영향한천배지에 넣고 glass roader로 문질러 균일하게 분포되도록 하였다. Plate를 뒤집어 약 30oC에서 48시간동안 배양한 후, 관찰되는 모든 콜로니를 계수하였다.
시험기간 동안 시험환경(산화환원 전위, 용존산소, pH)은 pH meter (Seven Compact TM pH/Ion S220, METTLER TOLEDO, USA)와 DO meter (Seven Go pro, METTLER TOLEDO, USA)를 이용하여 대조구의 시험병에서 시험환경을 측정하였다.
시료의 채취 및 전처리
시험물질 처리 후 비멸균 토양의 경우 0, 4, 7, 14, 25, 42, 53 그리고 62일에 분석시료를 시험장치에서 꺼내어 다음의 방법으로 연속적으로 추출하였고, 멸균토양의 경우 0, 7, 14, 22, 30 그리고 42일에 추출하였다. Acetonitrile 100 mL, acetonitrile:water (9:1. v/v) 100 mL, acetonitrile:water (1:1. v/v) 100 mL 그리고 acetone 100 mL을 300 rpm으로 30분간 추출하고 원심분리기(ZK380, HERMLE, Germany)로 4,000 rpm에서 10분간 추출하여 추출물과 토양을 분리하였다. 이 후, 토양은 가속용매 추출장치(Acceleration Solvent Extraction; ASE350, Thermo Fisher, USA)로 추출하였으며 각 추출액은 부피를 측정한 후, 0.2 mL을 취하여 Ultima-gold cocktail 4 mL과 혼합하여 액체섬광계수기로 방사능량을 측정하였다. 남은 모든 추출액들은 혼합하여 GF/C 여과지(Whatman, No. 2, England)로 여과한 다음 감압농축하여 유기용매를 제거하였다. 남은 잔량을 500 mL 분액여두에 옮기고 포화된 sodium chloride 10 mL과 0.5% formic acid 10 mL을 넣은 후, ethyl acetate 100 mL로 10분간 300 rpm으로 3회 반복 추출하였다. 추출액은 감압농축한 후, acetonitrile 3 mL로 정용하고 대사산물의 확인을 위해 radio-HPLC로 분석하였다.
14C-휘발성 유기화합물 및 14CO2의 포집용액인 ethylene glycol과 1N NaOH 용액들은 토양시료와 동일한 시점에 채취하였으며, mess cylinder로 부피를 측정하고 이 중에서 1 mL을 취하여 4 mL scintillation cocktail과 혼합한 후, 액체섬광계수기로 방사능량을 측정하였다. 추가적으로 포집된 14CO2는 62 DAT의 1 N NaOH 용액에서 5 mL을 취하여 sodium carbonate 0.5 g을 넣어 용해시키고 포화된 barium chloride 2.5 mL을 넣어 20분간 침전시킨 후, 원심분리(7,000 rpm, 10분) 하였다. 상징액 1 mL을 취하여 Insta-gel plus cocktail과 혼합하여 액체섬광계수기로 방사능량을 측정하여 포집된 방사능량이 14CO2 외의 추가물질 검출여부를 확인하였다.
Butachlor의 반감기 (DT50) 및 DT90의 계산
Butachlor의 분해속도는 Sigmaplot 10.0 version software(SPSS Science, IL, USA)를 사용하여 아래의 first order kinetic의 공식에 따라 산출한 후, 토양에서의 반감기와 DT90을 계산하였다.
Ct = C0 × e−kt
위 식에서, Ct는 각 시간의 분석물질의 양이고, C0는 0시 간의 분석물질의 농도이며, k는 속도상수이다.
DT50 (half-life) = ln(2) / k
DT90 = ln(10) / k
비추출성 잔류물(Non-extractable residues)의 측정
추출이 완료된 후 남은 시료는 시료산화기로 연소하여 방사능량을 측정하였으며 시험의 마지막 시료(53 DAT 채취 시료)를 다음과 같이 humin, humic acid 그리고 fulvic acid로 분획하여 비추출성 토양 잔류물의 방사능량에 대한 잔류분포경향을 확인하였다. 비추출성 토양 잔류물 시료 10 g에 0.5 N NaOH를 넣고 300 rpm으로 8시간 동안 진탕추출한 후, 원심분리(10,000 rpm)하여 상징액과 침전물을 분리하였다(3 반복). 침전물(humin fraction)은 풍건시킨 후 시료연소기와 액체섬광계수기로 방사능량을 측정하였다. 분리된 상징액은 HCl을 이용하여 pH 1.0으로 조정한 후 24시간 동안 상온에 정치시키고 다시 원심분리 하여 상징액(fulvic acid fraction)과 침전물(humic acid fraction)로 분리시켰다. 상징액과 0.5 N NaOH로 용해시킨 침전물을 액체섬광계수기로 방사능량을 측정하여 비추출성 잔류물의 분포 경향을 확인하였다.
결과 및 고찰
시험환경의 측정
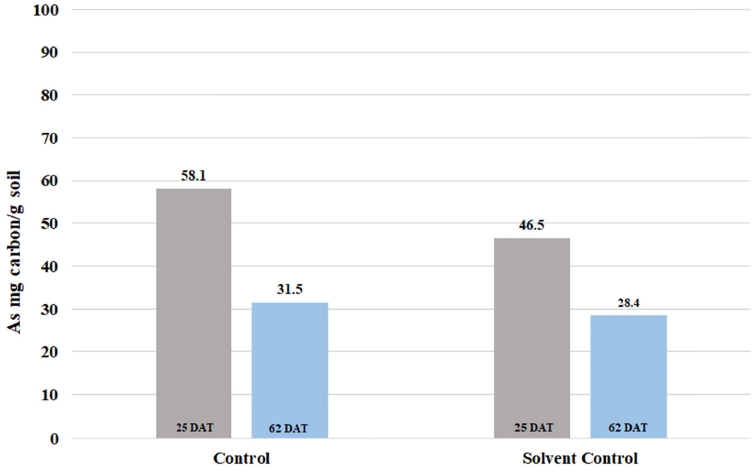
시험기간 동안 측정된 시험물질의 미생물 생체량은 대조구에서는 31.5–58.1 mgcarbon/gsoil (토양 유기탄소의 1.2–2.1%)이었고, 용매 대조구에서는 28.4–46.5 mgcarbon/gsoil (토양 유기탄소의 1.0–1.7%)이었다(Fig. 2). 측정된 값들은 국제적인 시험지침서(OECD test guideline No. 307)에서 요구하는 시험에 적용된 토양의 유기탄소 대비 1.0% 이상으로 시험에 적합하였다. 또한, 용매 대조구의 미생물 생체량이 대조구의 측정값과 비교했을 때, 큰 차이를 보이지 않아 토양에 처리된 유기용매(acetonitrile)가 미생물에 미치는 영향은 없었다. 멸균상태를 확인하기 위해 수행한 평판 배지시험에서 미생물은 육안으로 관찰되지 않아 시험에 적용된 멸균토양은 적합하였다.
시험기간 동안 비멸균 및 멸균토양에서 측정된 용존산소(DO; dissolved oxygen)와 pH는 각각 6.9–7.4과 5.5–7.3의 범위로 각각의 조건 간에 상대적인 차이가 없었지만 redox potential (mV)의 측정 값은 비멸균과 멸균 토양에서 큰 차이를 보였다. 비멸균 토양의 경우 물 층에서는 191.0–329.1 mV으로 호기성 조건으로 유지되었지만, 토양 층에서는 -141.4–7.0 mV으로 시간의 경과에 따라 혐기성 조건이 형성되었다. 반면에 멸균토양에서는 물 층과 토양 층이 모두 202.7–248.0와 41.2–248.0 mV로 호기성 조건이 유지되었다(Table 4).
물질수지(Mass Balance)
Mass balance (%)는 용매추출물, 비추출성 잔류물, 14C-휘발성 유기화합물 및 14CO2 포집용액에서 측정된 모든 방사능량의 총합을 처리된 방사능량(applied radioactivity, AR)을 기준으로 계산하였다.
비멸균 토양에서의 물질수지는 96.6–101.1% AR이였으며, 토양 및 물 시료의 용매추출물에서 검출된 방사능량은 0 DAT의 100.9% AR에서 시험종료일인 62 DAT까지 52.5% AR로 감소하는 것으로 확인하였다. 비추출성 잔류물의 경우에는 시간의 경과에 따라 계속적으로 증가하는 경향을 보였으며, 특히 7 DAT 이후부터 급격히 증가하여 62 DAT에서는 45.6% AR로 확인되었다(Fig. 3). 비추출성 잔류물의 시간에 따른 증가는 추출 잔류물의 시간에 따른 감소와 일치하는 결과로, 시간이 경과할수록 토양 내 유기물의 결합량이 증가한다는 것을 의미하였다(Tiryaki, 1997; Tiryaki and Aysal, 1999). 14C-휘발성 유기화합물과 14CO2는 시험기간 동안 최대 0.3와 0.5%의 소량이 검출되어 butachlor는 미생물에 의해서 휘발성 화합물을 거의 생성하지 않는 것으로 확인되었다. 본 연구에서는 butachlor의 휘발성이 매우 미미한 수준으로 Ok et al. (2012)의 연구와 유사한 결과를 보였다. 하지만, Chen and Chen (1978, 1979)의 연구에서는 온도의 증가 (20–40oC)에 따라 휘발성 물질이 생성되는 것으로 보고하였다.
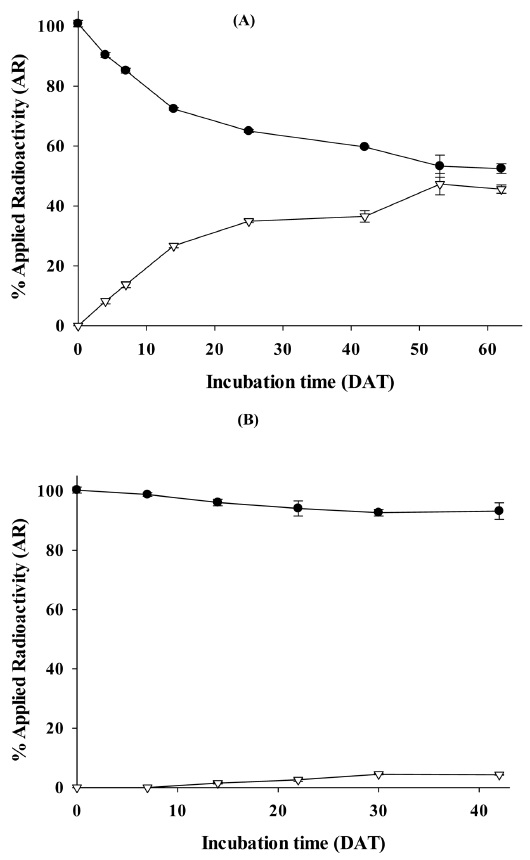
Mass balance and distribution of radioactivity in aerobic soil/water condition; (A) non-sterile soil, (B) sterile soil (● : Extractable, ▽ : Non-Extractable).
반면, 멸균토양의 물질수지는 96.6–100.3%로 휘발성 유기화합물 및 이산화탄소가 전혀 검출되지 않았으며, 비추출성 잔류물도 시험기간동안 최대 4.5% AR로 매우 낮은 수준이었다(Fig. 3). 대부분의 방사능량은 유기용매에 의한 추출물에서 검출되었으며, 멸균된 토양에서는 비멸균 토양과는 달리 butachlor가 검출되지 않아 토양 내에 흡착 및 결합이 되지 않는 것으로 보이며, 이런 결과는 토양 내의 미생물이 유기물의 형성과 유기화합물의 결합에 영향을 주었기 때문인 것으로 보인다(Kaufman and Blake, 1973; Smith and Philips 1975; Katan and Lichtenstein, 1977; Krause et al., 1985; Gevao et al., 2000; Arias-Estévez et al., 2008).
Butachlor의 분해율 및 대사산물의 분석
토양 및 물의 추출액을 radio-HPLC로 분석하여 14Cbutachlor의 분해경향과 생성된 대사산물들의 양을 확인하였다. 비멸균 토양에서 14C-butachlor는 0 DAT에 99.4% AR이었으며 시험종료일인 62 DAT에서는 19.6% AR로 감소하였다. First order kinetic model에 이용하여 토양 내 butachlor의 DT50과 DT90은 각각 25.3일과 84.0일이었다. 반면 멸균토양에서의 분해율은 0 DAT에 102.5% AR에서 시험종료일까지 89.0% AR로 시간의 경과에 따른 뚜렷한 감소경향은 보이지 않아 분해속도를 산출할 수 없었다(Fig. 4). 사양토(sandy loam)를 이용한 Raut (2008)의 연구결과에 따르면, 비멸균토양에서 butachlor의 반감기는 11일인 것으로 확인되었으며, 미사질토(silt)를 이용한 Beestman (1974)의 연구결과에서는 비멸균 토양에서 반감기는 11.4일인 반면 멸균토양에서는 640일 이상의 반감기로 멸균토양에서는 분해가 거의 일어나지 않는 것으로 확인되었다. 이러한 결과는 담수조건의 유무와 토양에 강하게 흡착된 butachlor의 추출방법에 따라서 차이가 발생된 것으로 보인다. 또한 토성은 확인되지 않지만, 논토양을 이용한 연구결과(Rao et al., 2012)에 따르면, butachlor의 반감기는 12.5–21.5일로 매우 빠르게 감소하는 것으로 보고하였으며, Chen et al. (1988)과 Yu et al. (1993)의 연구결과에서는 비멸균 담수토양에서 18.5–29.4일로 본 연구와 유사한 결과를 보였다.
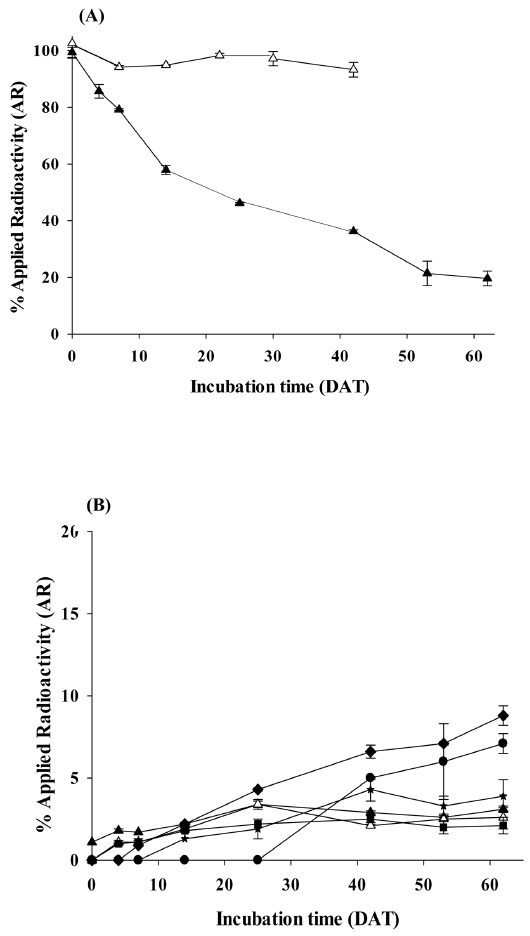
Distribution of [14C]butachlor and metabolites in aerobic soil/water condition; (A) butachlor (▲ : Non-sterile, △ : Sterile) (B) metabolites (▲ : Unknow_1, △ : Unknow_2, ■ : Unknow_3, ◆ : Unknow_4, ★ : Unknow_5, ● : Unknow_ 6).
따라서 butachlor는 미생물에 의한 분해와 토양에 강하게 결합하는 특성으로 인하여 시간에 따른 감소경향을 보이는 것으로 판단된다. Beestman and Deming (1974)에 의하면 미생물 분해는 토양 내 butachlor 분해에 가장 큰 역할을 하는 것으로 제시하였으며, Min et al. (2001)은 황산환원세균(sulfate-reducing bacteria)과 같은 혐기성 박테리아가 논 토양에서 butachlor를 효과적으로 분해할 수 있음을 확인하였다.
시험기간 동안 생성된 butachlor의 대사산물은 10% AR 이하의 6개의 대사산물이 확인되었다(Fig. 4). 이 중, Unknown_4는 시험종료일까지 최대 8.8% AR까지 증가하였으며, LC-MS/MS 분석을 통해 표준물질과 비교해서 확인한 결과, N-(Butoxymethyl)-N-(2,6-diethylphenyl)acetamide와 동일한 머무름 시간 및 spectrum을 보여 대사산물을 동정할 수 있었으며 Unknown_1은 mass spectrum을 통해 분자량이 221.0 g/mol인 것으로 확인하였고(Fig. 5), Chakraborty and Bhattacharyya (1991)와 Raut A.K. & Kulshrestha G. (2008)의 연구결과에 따라 N-(2,6-Diethyl-phenyl)-N-hydroymethyl-acetamide인 것으로 판단하였다. 그 외의 대사산물은 표준물질의 확보가 어렵거나 검출된 농도가 매우 낮아 정확한 구조를 확인하지 못하였다. LC-MS/MS분석을 통해 butachlor은 논 토양에서 dechlorination에 의해 N-(Butoxymethyl)–N-(2,6-diethyl-phenyl)acetamide를 생성하고, O-dealkylation에 의해 N-(2,6-Diethyl-phenyl)-N-hydroxymethyl-acetamide를 생성하는 것으로 예상된다. Lee (1983)의 연구에서는 butachlor은 토양 내 존재하는 미생물이나 hydroxide ion에 의한 친핵성 치환작용으로 dechlorination과 hydroxylation 작용이 빠르게 진행되는 것으로 보고 하였으며, Chakraborty (1991)는 토양 균주를 이용한 butachlor 연구에서 주요 분해경로로 hydroxylation, dehydrogenation, debutoxymethylation, C-dealkylation, N-dealkylation, cyclization와 본 연구에서 확인된 dechlorination과 O-dealkylation을 제시하였으며, 연구에 사용된 Fusarium solani와 F. oxysporum 중 F. solani가 butachlor의 분해에 영향을 주는 것으로 보고하였다.
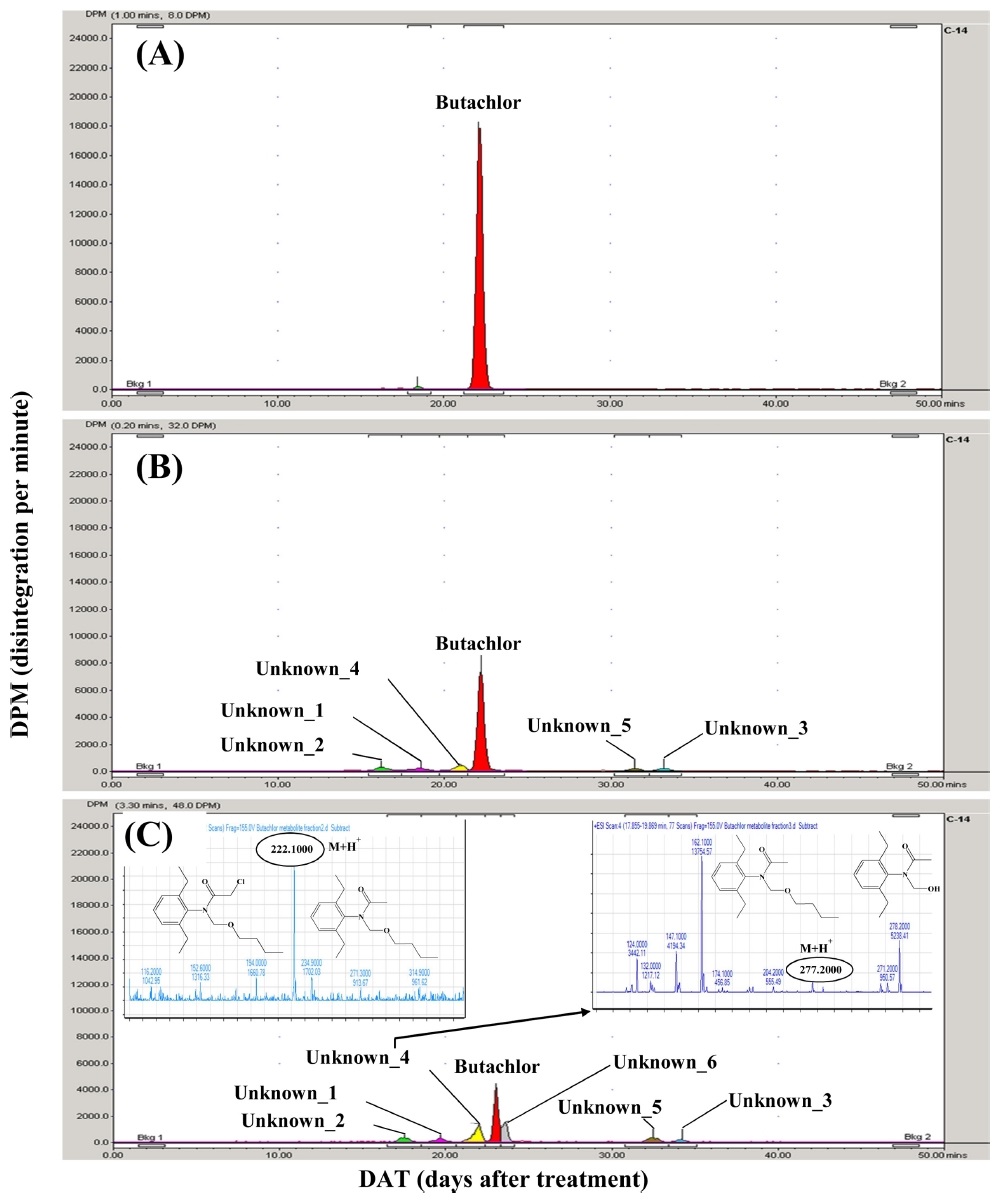
Representative radio-HPLC chromatograms and LC-MS/MS spectra of the soil extracts for non-sterile soil; (A) 0 DAT, (B) 25 DAT, (C) 62 DAT test vessels.
따라서, butachlor은 멸균토양에서는 분해가 일어나지 않았지만, 비멸균 토양에서는 뚜렷한 감소율을 보이는 것으로 보아 논 토양 내에서 butachlor은 미생물에 의해서 대부분 분해되는 것으로 보였다.
비추출성 토양(잔류물의) 방사성 잔류물의 분획
53 DAT 시료의 추출 후 남은 잔류토양을 수용해도의 특성, 산성 및 염기성 추출방법에 따라 humic acid, fulvic acid 그리고 humin으로 분류하였고 그 결과, humin 분획에서 21.2%, fulvic acid에서 13.4% 그리고 humic acid 에서 8.0% AR가 검출되었다. 토양 내 부식물질들(humic substances)은 지구 생태계의 구성요소인 동물 및 식물의 분해 과정에서 미생물에 의해 자연적으로 생성되어 토양에 분포하는 대표적인 자연유기물로, 토양 유기물의 약 60%가 부식물질들로 구성되며(Lee et al., 2004; Cooper 1999; Travisan et al., 2010), 이러한 부식물질들은 토양에 잔류하고 있는 pesticides, herbicides, polyaromatic hydrocarbons, polychlorinated biphenyls과 같은 유기화학물질과 빠르게 결합하거나, 비가역적인 반응을 일으켜 유해오염물질의 환경거동에 중요한 영향을 미치며(Aiken et al., 1986; Buffle 1988; Rice 2001) 대부분의 토양 또는 퇴적물에 유입되는 유기오염물질의 상당량이 humin에 흡착 되는 것으로 보고되고 있다(Hayes 1970; Kloskowski and Führ 1985, 1987; Kloskowski et al., 1986; Kohl and Rice 1988 and references therein). 따라서, butachlor도 토양 내 지속적으로 잔류할 경우에는 butachlor를 포함한 대사산물들이 humin 부분에 많은 양이 존재하여 미생물에 의한 분해가 잘 일어나지 않고 토양과 강하게 결합되어 환경 내에 쉽게 유출되지 않을 것으로 보인다(Hayar et al., 1997; Li et al., 2005).
Acknowledgments
본 연구는 농촌진흥청 공동연구사업(과제번호: PJ009286)의 지원으로 수행되었으며, 농촌진흥청의 연구비 지원에 감사드립니다.
References
-
Aiken GR, McKnight DM, Wershaw RL, MacCarthy P, 1986. Humic Substances in Soil, Sediment and Water : Geochemistry, Isolation, and Characterization, John Wiley and Sons, Eds; USA, pp. 323-335.
[https://doi.org/10.1097/00010694-198611000-00011]

-
Akram R, Turan V, Hammad HM, Ahmad S, Hussain S, et al., (2018) Fate of Organic and Inorganic Pollutants in Paddy Soils. Environ. Pollut. of Paddy Soils, Soil Biology 53, pp 197-214.
[https://doi.org/10.1007/978-3-319-93671-0_13]

-
Arias-Estevez M, Lopez-Periago E, Martinez-Carballo E, Simal-Gandara J, Mejuto, JC, et al., 2008. The mobility and degradation of pesticides in soil and the pollution of groundwater resources. Agric. Ecosyst. Environ. 123(4):247-260.
[https://doi.org/10.1016/j.agee.2007.07.011]

-
Beestman GB, Deming JM, 1974. Dissipation of acetanilide herbicides from soil, Agronomy J. 66(2):308-11.
[https://doi.org/10.2134/agronj1974.00021962006600020035x]

- Buffle J, 1988. Complexation Reactions in Aquatic Systems, Ellis Horwood Series in Analytical chemistry, Ellis Horwood, Chichester, England, pp. 185-210.
-
Chakraborty SK, Bhattacharyya A, 1991. Degradation of butachlor by two soil fungi. Chemosphere 23(1):99-105.
[https://doi.org/10.1016/0045-6535(91)90119-X]

-
Chen YL, Chen CC, 1978. Photodecomposition of a herbicide, butachlor, J. Pestic. Sci. 3(2):143-148.
[https://doi.org/10.1584/jpestics.3.143]

-
Chen YL, Chen JS, 1979. Degradation and dissipation of herbicide butachlor in paddy field. J. Pestic. Sci. 4(4):431-438.
[https://doi.org/10.1584/jpestics.4.431]

- Chen Z, Fan D, 1988. Leaching, persistence and degradation of the herbicide butachlor in soils. Env. Chem. 7(2):30-36.
-
Choi K, 2017. Chemical Exposure in Living Environment – Health Issues and Policy Suggestions. The Korean J. of Public Health 54(2):35-41.
[https://doi.org/10.17262/KJPH.2017.12.54.2.35]

- Cooper RJ, 1999. Humic Substances and Their Potential for Improving Turfgrass Growth. Turfgrass Trends:9-13.
-
Darlington TK, Neigh AM, Spencer MT, Nguyen OT, Oldenburg SJ, 2009. Nanoparticle characteristics affecting environmental fate and transport through soil. Environ. Toxic. and Chem. 28(6):1191-1199.
[https://doi.org/10.1897/08-341.1]

-
Gevao B, Semple KT, Jones KC, 2000. Bound pesticide residues in soils : a review. Environ. Pollut. 108(1):3-14.
[https://doi.org/10.1016/S0269-7491(99)00197-9]

-
Hayar S, Munier-lamy C, Chone T, Schiavon M, 1997. Physico-chemical versus microbial release of 14C-atrazine bound residues from a loamy clay soil incubated in laboratory microcosms. Chemosphere 34(12):2683-2697.
[https://doi.org/10.1016/S0045-6535(97)00094-5]

-
Hayes MHB, 1970. Adsorption of triazine herbicides on soil organic matter, including a short review on soil organic matter chemisty. Residue reviews, Gunther, F. A. et al, Eds; Springer:New York, pp.131-174.
[https://doi.org/10.1007/978-1-4615-8464-3_6]

- ISO 14240-2 (1997) Soil Quality – Determination of soil microbial biomass Part 2 : Fumigation-extraction method.
-
Katan J, Lichtenstein EP, 1977. Mechanisms of Production of Soil-Bound Residues of [14C] Parathion by Microorganisms. J. Agric. Food Chem. 25(6):1404-1408.
[https://doi.org/10.1021/jf60214a022]

-
Kaufman DD, Blake J, 1973. Microbial degradation of several acetamide, acylanilide, carbamate, toluidine and urea pesticides. Soil Biol. Biochem. 5(3):297-308.
[https://doi.org/10.1016/0038-0717(73)90077-1]

-
Kim JH, Kim JH, Kim D.W, Lee BJ, Kim CS, et al., 2014. Establishment Aerobic Soil Metabolism System Using [14C]Butachlor. J.Korean Agric. Chem. Soc. 18(4):258-268.
[https://doi.org/10.7585/kjps.2014.18.4.258]

-
Kloskowski R, Führ F, 1985. Behaviour of [ring-14C] hydroxylsimazine in a parabraun soil. Chemosphere 14(11-12):1913-1920.
[https://doi.org/10.1016/0045-6535(85)90132-8]

-
Kloskowski R, Führ F, 1987. Aged and bound herbicide residues in soil and their bioavailability part 2: Uptake of aged and non-extractable (bound) [carbonyl-14C] methabenzthiazuron residues by maize. J. Environ. Sci. Health B22(6):623-642.
[https://doi.org/10.1080/03601238709372577]

- Kloskowski R, Führ F, Mittelstaedt W, 1986. Formation of bound residues of [benzene ring-U-14C]-anilazine and [triazine-U-14C]-anilazine in parabraunerde (Alfisol soil) and their availability to maize. In Quantification, Nature, and Bioavailability of Bound 14C-Pesticide Residues in Soil Plants, and Food. Int. Atomic Energy Agency, Vienna, pp. 65-70.
-
Kohl SD, Rice JA, 1998. The binding of contaminants to humin : A mass balance. Chemosphere 36(2):251-261.
[https://doi.org/10.1016/S0045-6535(97)10005-4]

-
Krause A, Hancock WG, Minard RD, Freyer AJ, Honeycutt RC, et al., 1985. Microbial transformation of the herbicide metolachlor by a soil actinomycete. J. Agric. Food Chem. 33(4):584-589.
[https://doi.org/10.1021/jf00064a008]

- Lee CH, Shin HS, Kang KH, 2004. Chemical and Spectroscopic Characterization of Peat Moss and Its Different Humic Fractions (Humin, Humic Acid and Fulvic Acid). J. Soil Groundwater Environ., 9(4):42-51.
- Lee JK, 1983. Degradation of the Herbicide, Butachlor, in Soil. The Korean Society for Applied Biological Chemistry, 26(1):53-57.
-
Li ZJ, Xu JM, Muhammad A, Ma GR, 2005. Effect of bound residues of metsulfuron-methyl in soil on rice growth. Chemosphere 58(9):1177-1183.
[https://doi.org/10.1016/j.chemosphere.2004.09.056]

- National Institute of Agricultural Science and Technology, 1992, Introduction to Korean soil. Soil survey document No. 13. NIAST, RDA, Korea.
-
Mackay D, Guardo AD, Paterson S, Cowan CE, 1996. Evaluating the environmental fate of a variety of types of chemicals using the EQC model. Environ. Toxicol. Chem. 15(9):1627-1637.
[https://doi.org/10.1002/etc.5620150929]

-
McKinlay R, Plant JA, Bell JN, Voulvoulis N, 2008. Endocrine disrupting pesticides : Implications for risk assessment. Environ. Int. 34(2):168-183.
[https://doi.org/10.1016/j.envint.2007.07.013]

-
Min H, Ye YF, Chen ZY, Wu WX, Yufeng D, 2001. Effects of butachlor on microbial populations and enzyme activities in paddy soil. J.Environ. Sci. Health, B36(5):581-595.
[https://doi.org/10.1081/PFC-100106187]

- OECD, 2002. OECD guideline for the testing of chemicals section 3 Degradation and Accumulation Test No. 307 Aerobic and anaerobic transformation in soil (Adopted : 24 April 2002).
- OECD, 2002. OECD guideline for the testing of chemicals section 3 Degradation and Accumulation Test No. 308 Aerobic and anaerobic transformation in aquatic sediment systems (Adopted : 24 April 2002).
-
Ok JH, Doan NH, Watanabe H, Thuyet DQ, Boulange J, 2012. Behavior of Butachlor and Pyrazosulfuron-ethyl in Paddy Water Using Micro Paddy Lysimeters under Different Temperature Conditions in Spring and Summer. Bull. Environ. Contam. Toxicol. 89(2):306-311.
[https://doi.org/10.1007/s00128-012-0700-1]

- Rao PC, Rama Lakshmi ChS, Madhavi M, Swapna G, Sireesha A, 2012. Butachlor dissipation in rice grown soil and its residues in grain. Indian J. Weed Sci. 44(2):84-87.
-
Raut AK, Kulshrestha G, 1997. Biotransformation of butachlor by soil fungi. Toxicol. Environ. Chem. 61:109-116.
[https://doi.org/10.1080/02772249709358477]

-
Rice JA, 2001. Humin, Soil Science 166(11):848-857.
[https://doi.org/10.1097/00010694-200111000-00009]

-
Smith AE, Philips DV, 1975. Degradation of alachlor by Rhizoctonia solani. Agronomy J. 67(3):347-349.
[https://doi.org/10.2134/agronj1975.00021962006700030016x]

- Triyaki O, Aysal P, 1999. Bound pesticide residues in soil and plant and their determination. The Turkish J. of Nuclear Sci. 26(2):43-60.
-
Triyaki O, Gozek K, Khan SU, 1997. 14C-residues of triluralin in a soil and their uptake by carrots. Bull. Environ. Contam. Toxicol. 59(1):58-64.
[https://doi.org/10.1007/s001289900443]

-
Travisan S, Francioso O, Quaggiotti S, Nardi S, 2010. Humic substances biological activity at the plant-soil interface : from environmental aspects to molecular factors. Plant Signal. Behav. 5(6):635-643.
[https://doi.org/10.4161/psb.5.6.11211]

-
Van Eerd LL, Hoagland RE, Zablotowicz RM, Christoper Hall J, 2003. Pesticide metabolism in plants and microorganisms. Weed Science 51(4):472-495.
[https://doi.org/10.1614/0043-1745(2003)051[0472:PMIPAM]2.0.CO;2]

-
Wolff CJM, Crossland NO, 1991. The environmental fate of organic chemicals. Controlling Chemical Hazards : 19-46.
[https://doi.org/10.1007/978-94-011-6849-6_2]

- Yu, K. N., Qi, C.J., and Tang, K., 1993. Relationship between degradation rate of butachlor and conditions of paddy fields. Acta Sci. Circumst, 13:169-173.