SD랫드에서 벤퓨라카브의 급성 경구노출에 의한 신경행동독성
초록
대표적 카바메이트계 살충제인 벤퓨라카브 (Benfuracarb, BFC)에 대한 단회 경구노출에 의한 신경행동독성을 알아보고자 8주령 SD 수컷 랫드에 BFC 0, 1, 3 및 9 mg/kg bw의 용량으로 단회 강제 경구투여 후 1일, 5일 및 14일째 악력, 착지능 등 행동변화, 혈액학치 및 혈액화학치 변화, 뇌 조직 및 혈청 중 AChE 활성도 변화와 뇌조직 중 hsp70 및 c-fos 유전자의 발현도 및 뇌조직, 척수조직의 조직병리학적 변화를 조사하였다. 혈액학치와 혈액화학치는 BFC에 의한 특이적인 변화가 없었으나 뇌조직 및 혈액 중 AChE 활성도는 BFC 투여 1일째 용량의존적으로 감소하는 경향이었고, BFC 9mg/kg bw에 의해 혈중 ACh E는 유의하게 감소하였으며, 이후 14일째에는 대조군에 비해 모든 용량군에서 혈액 및 뇌의 AChE가 유의하게 감소하였으나, 뇌 및 척수에서 특이한 조직병리학적 병변은 관찰되지 않았다. 뇌조직 중 c-fos 유전자 발현도는 모든 용량군에서 1일, 5일 및 14일째 모두 유의하게 용량의존적으로 증가하는 경향을 보였다. 또한, 행동변화에 있어, 악력은 BFC 1, 3 및 9 mg/kg bw에 의하여 투여 직후부터 대조군에 비해 유의성은 없으나 낮은 경향이었고, 14일째에는 회복하였다. BFC 3 및 9 mg/kg bw에 의해 투여직후 진전, 느린 호흡, 유연, 비루 또는 전신 이완 등이 일부 동물에서 관찰되었으나 1일, 5일 및 14일째에는 임상증상이 관찰되지 않았다. 결론적으로 BFC는 랫드에 단회 경구투여시 뇌조직 및 혈액 중 AChE 활성도 감소, c-fos 유전자 발현 증가 및 악력 저하 등과 같은 신경독성이 일시적으로 유발되었으며, 이를 근거로 벤퓨라카브의 급성 최저독성량 (Lowest Observed Adverse Effect Level, LOAEL)은 1 mg/kg bw로 평가되었다.
Abstract
Acute neurobehavioral toxicity of benfuracarb (BFC), a representative carbamate pesticide, was investigated by single oral exposure to 8 weeks old SD male rats at 0, 1, 3 and 9 mg/kg bw. Changes of hematological and blood biochemistry values, brain and blood acetylcholinesterase (AChE) activities, behavioral patterns, gene expression of hsp70 and c-fos and histopathological lesions of brain and spinal cord were examined on 1, 5 and 14 days after the BFC treatment. As a results, hematological and biochemical values were not significantly changed by BFC. AChE activities of brain tissue and blood tended to be decreased dose-dependently and specifically blood AChE showed significant decrement by BFC 9 mg/kg bw on 1 day after treatment, and then brain and blood AChE were significantly decreased on 14 days by all doses of BFC compared to control group. However, there were no histopathological lesions found in brain and spinal tissues. Gene expression of c-fos was significantly increased on day 1 by all doses of BFC. And still increased by BFC 3 and 9 mg/kg bw on 5 and 14 days after treatment. Limb grip strength was tend to be weaken by BFC without significance on 0 to 10 days, but it was recovered on 14 days. In clinical manifestation, tremor, bradypnea, epiphora, salivary, rhinorrhea, systemic relaxation and temparary faint were observed immediately after the treatment of BFC 3 or 9 mg/kg bw. However, they were recovered after 1 day. In conclusion, single oral treatment of BFC temporarily induces acute neurobehavioral toxicity such as inhibition of brain and blood AChE acticity, increase of c-fos gene expression and weakness of limb grip strengths. The acute LOAEL of BFC was 1 mg/kg bw/day based on its acute neurobehavioral toxicity.
Keywords:
Benfuracarb, Single exposure, Neurobehavioral toxicity, Acetylcholinesterase키워드:
벤퓨라카브, 급성독성, 농약, 신경독성, 아세틸콜린에스테라제서 론
2018년 기준 국내 총 농경지면적은 2017년 대비 1.6% 감소하였으나(통계청, 2018), 농약의 사용량은 2017년 기준농지 1 ha당 12.2 kg으로 2016년 11.8kg대비 3.4% 증가하는 등 지속적으로 증가하는 추세이며(Kim et al., 2019), 농약 사용에 의한 식품소비자 및 농작업자의 안전성 확보에 대한 요구는 더욱 증가하고 있다.
벤퓨라카브(Benfuracarb, BFC)는 감귤류, 옥수수, 사탕무, 채소류 등에 사용되는 광범위 카바메이트계 살충제이다. BFC는 1차 대사과정에서 sulfur oxidation되어 benfuracarb-sulfoxide와 카보퓨란(Carbofuran, CBF)으로 변환된다(Abass et al., 2013).
랫드에서 급성 경구 반수치사량은 138 mg/kg bw으로 중간독성물질이며(Yu et al., 2003), 아세틸콜린에스테라제(Acetylcholinesterase, AChE)를 억제하여 신경세포의 축삭돌기 말단에서 방출된 아세틸콜린이 분해되지 않고 시냅스에 축적되어 신경자극이 지속되면서 유연, 설사, 호흡곤란 및 경련 등의 급성 신경증상이 유발된다(T3DB, 2009).
유럽식품안전청(European Food Safety Authority, EFSA, 2006)에서는 BFC의 인체 일일섭취허용량(Acceptable Daily Intake, ADI) 평가에 있어, 13주 개 독성시험 및 2세대 랫드생식독성시험에 근거하여 도출된 최대무작용량(No Observed Adverse Effect Level, NOAEL) 1.2 mg/kg bw/day에 불확실성계수(Uncertainty Factor, UF) 100을 적용하여 ADI를 0.01 mg/kg bw/day로 설정하였고, 랫드 28일 반복독성시험에서의 뇌 AChE 억제를 근거로 하여 NOAEL 1.8 mg/kg bw/day에 UF 100을 적용하여 급성독성참고치(Acute Reference Dose, ARfD)를 0.02mg/kg bw으로 설정하였다. 또한, 농작업자노출허용량 (Acceptable Operator Exposure Level, AOEL)은 개에서의 90일 반복투여독성시험에 근거한 NOAEL 1 mg/kg bw/day에 UF 100을 적용하여 0.01 mg/kg bw/day로 설정하였다(European Commission, 2009).
농약은 농작업자에게 단기간의 피부 접촉, 흡입에 의해 급성건강영향을 유발할 가능성이 높으나 국내에서는 아직 농작업자에 대한 급성노출허용량에 대한 평가가 이루어지지 않고 있으며, 검사항목 및 판정기준도 명확하게 제시되지 않은 실정이다.
농약에 대한 급성노출 즉, 단회 또는 24시간 이내의 노출에 의해 혈액세포 형태 또는 조성의 이상, 신경행동이상, 태아 발육이상 및 신장 또는 간독성 등이 유발될 수 있다(Solecki et al., 2005). 유럽에서는 농약노출에 의한 급성건강영향을 예방하기 위하여 농약의 안전성 평가 시 급성독성을 포함하여 평가하고 있으며, 이러한 급성건강영향에 근거하여 급성노출에 대한 식품소비자의 인체안전기준으로 급성독성참고치와 농작업자에 대한 안전기준으로 급성 농작업자노출허용량(Acute Acceptable Operator Exposure Level, aAOEL)을 설정하여 관리하고 있다(European Commission, 2017). 그러나 국내에서는 농약의 급성영향은 식품소비자의 건강보호 측면에서 ARfD 평가를 통해 이루어지고 있으나 농작업자의 급성건강영향 평가는 이루어지지 않고 있다.
본 연구에서는 국내 다량 사용되는 대표적인 농약 중 콜린에스테라제 저해 등신경행동독성이 있는 것으로 알려진 카바메이트계 농약 BFC를 랫드에 단회 경구투여한 후 혈액학치, 혈액생화학치, 조직병리학적 소견, 신경독성 관련 유전자 및 AChE 활성도 변화를 조사하고, 행동이상 및 임상증상 등 신경행동학적 변화를 조사하여 BFC의 단기노출에 의한 급성 건강영향을 평가하고자 하였다.
재료 및 방법
시험물질
BFC는 표준물질 등급 (PESTANAL®, MERCK 31544)의 물질을 사용하였다.
시험물질 조제
BFC 0.45 g을 증류수 100mL에 넣고 1일간 교반을 통해 완전 용해하여 4.5mg/mL 용액을 조제하였으며, 이를 증류수로 10배 희석하여 0.45 mg/mL 용액을 조제한 후 이를 3배씩 희석하여 0.15mg/mL 용액과 0.05 mg/mL 용액을 조제하였고, 이들을 시험용액으로 하였다.
실험동물 및 사육방법
8주령의 수컷 SD 랫드(Samtako, Korea)를 사용하였으며, 온도 22±3oC, 상대습도 50±20%, 환기횟수 10-15회/시간, 조명주기 12시간 및 조도 150-300 Lux의 환경조건으로 설정된 청정동물 사육실에서 사육하였다. 동물실험 전 동물실험윤리위원회 승인을 득하였다(IRB NO. HSIACUC-18-101(1)).
BFC 투여 및 시료 채취
BFC의 투여용량은 1, 3 및 9 mg/kg bw으로 설정하였으며, 존데를 사용하여 체중 kg당 20 mL를 위 내에 직접적으로 단회 강제경구투여 하였다. 투여 후 1일, 5일 및 14일 후에 악력 및 착지보폭을 측정하였으며, 이산화탄소 마취 후 복대 동맥에서 혈액을 채취하였고, 부검 시 0.9% NaCl 및 10% formalin 액을 관류한 후 뇌 및 척수 조직을 채취하였다.
혈액학치 및 혈액생화학치 분석
혈액 분석을 위하여 채취한 혈액 검체는 ADVIA 2120i (Siemens, Germany)를 이용하여 white blood cell (WBC), lymphocyte (LYM), MID cell (MID), granulocyte (GRAN), red blood cell (RBC), hemoglobin (HGB), hematocrit (HCT), mean cell volume (MCV), mean cell hemoglobin (MCH), mean cell hemoglobin concentration (MCHC), platelet (PLT), mean platelet volume (MPV)을 측정하였으며, 혈청을 원심분리하여 albumin (ALB), alkaline phosphatase (ALP), alanine aminotransferase (ALT), aspartate aminotransferase (AST), blood urea nitrogen (BUN), creatinine (CRT), glucose (GLU), lactate dehydrogenase (LDH), total bilirubin (TB), total cholesterol (TC), total protein (TP), triglyceride (TG)를 측정하였다.
조직병리 검사
고정된 뇌, 척수조직에 대하여 hematoxylin 및 eosin 염색(H&E staining)과 crystal violet 염색(CV staining)을 실시한 후 현미경 검경을 실시하였다.
AChE 활성도 분석
포르말린으로 고정하지 않은 뇌를 적출한 후 균질화하여 얻은 뇌조직 2 mg을 원심분리관에 넣은 후 킷트(Acetylcholinesterase Assay Kit, Abnova®) assay buffer 200 μL씩 넣고 혼합하고, 복대동맥에서 채취한 혈액은 원심분리하여 혈청을 채취한 후 혈청 5 μL에 assay buffer 195 μL씩 넣고 혼합하고, 각각의 뇌 및 혈청 혼합액을 14,000 rpm으로 5분 동안 원심분리하여 상층액을 시료로서 사용하였다.
Well plate에 뇌조직 시료 및 혈청 시료를 각각 10 μL씩 넣고, 킷트 내 working solution 190 μL를 각 well에 넣은 후 가볍게 두드려 혼합하고, 증류수 200 μL 또는 calibrator 200 μL를 넣고 plate reader를 이용하여 2분 및 10분에 OD412nm를 측정하였다.
hsp70, c-fos 유전자 발현도 검사
BFC를 1회 경구 투여 후 1, 5 및 14일째에 부검하여 채취한 뇌 조직을 PBS (pH7.4) 용액으로 세척한 후, RNeasy Mini Kit (Qiagen, Hilden, Germany)을 이용하여 RNA를 추출하였다. 각각의 투여군의 개체에서 얻어진 2 μg의 RNA을 c DNA synthesis kit (BIORED, Erkulles, CA, USA)를 사용하여 역전사한 후 first strand cDNA를 얻어 RT-PCR을 이용하여 유전자 발현도를 분석하였다. RT-PCR 분석은 QPCR Master Mix (2X GreenStar, Bioneer, Daejon, Korea)을 이용하여 최종 반응용량을 20 μL로 하여 QPCR System (Mx3000P, Agilent, Santa Clara, CA, USA)에서 SYBR Premix QPCR Master Mix (BioLabs, MA, USA)를 이용하여 진행하였다. PCR 반응의 특이도를 확인하기 위해서 매 증폭 cycle마다 melting curve 분석을 수행 하였고 β-actin유전자 발현도를 기준으로 2-ΔCt로 계산하였으며 유전자의 발현량은 대조군 대비 상대값으로 표시하였다.
각 유전자에 대한 PCR primer는 다음과 같다: hsp70 Forward: 5’-CAGGGCTGACAAGAAGAA-3’, Reverse: 5’-GGAGATGACCTCCTGGCACT-3’; c-fos Forward: 5’-AGCATGGGCTCCCCTGTCA-3’, Reverse: 5’-GGAGACCAGAGTGGGCTGCA-3’.
행동평가 및 임상증상 관찰
행동평가는 EPA에서 권장하는 방법을 이용하여 신경독성 검사항목 중 악력 및 착지보폭 측정을 실시하였다(EPA, 1996).
악력 측정은 grip strength meter (JD-A-22, ㈜정도비앤피)을 사용하여 랫드가 앞발가락으로 bar를 잡게한 후 꼬리 기시부위를 잡고 몸체를 수평으로 유지하여 일정속도로 당겨 bar를 놓는 시점에 나타나는 수치를 측정하였으며, 5번 측정하여 최고값과 최저값을 제외한 측정값의 평균을 결과값으로 하였다.
착지보폭 측정을 위해 랫드 후지 발바닥에 잉크를 바른 후 바닥에 착지보폭 측정용 기록지를 놓고 지면에서 위로 30 cm 떨어진 곳에서 수직으로 떨어뜨려 양쪽 발바닥 중심을 기준으로 하여 양쪽 발바닥 중심의 간격을 측정하였고, 5번 측정하여 최고값과 최저값을 제외한 측정값의 평균을 결과값으로 하였다.
임상증상은 꼬리들기 반응, 떨림, 경련, 입모, 피부색, 유연, 설사, 생기저하 및 사망 등을 관찰하여 기록하였다.
통계 분석
통계프로그램(Prism 7.0, Graphpad, USA)을 활용하여 two way analysis of variance test (ANOVA)를 이용하여 분석하였으며 p<0.05인 경우 통계적으로 유의성이 있는 것으로 나타냈다.
결과 및 고찰
혈액학치 변화
BFC 1, 3 및 9 mg/kg bw를 1회 경구 투여 후 1일, 5일 및 14일째 혈액학치 변화를 조사한 결과, 모든 검사항목은 정상범위 이내였다. 다만, MCV의 경우, 투여 후 5일째 모든 용량군에서 대조군에 비해 유의하게 감소하였고, MCHC의 경우에는 투여 후 5일째 BFC 1mg/kg bw에 의해 유의하게 증가하는 경향을 보이나(Table 1), 일시적이고 미약한 변화이며, 정상범위 이내로서로서 이들이 BFC에 의한 특이적인 변화는 아니었다.
BFC를 F344 랫드에 90일간 사료를 통하여 200, 400 및 800 ppm으로 급여 시 용량의존적으로 HCT, HGB이 감소하고, 적혈구와 혈소판 수치도 감소함이 보고된 바 있다(Agrochemical Research and Development Department, 1989). 그리고 이의 대사물질인 카보퓨란(Carbofuran, CBF)에 의해 MCV, MCH 및 MCHC가 증가한다고 보고된 바 있다(Gupta et al., 1982). 이러한 혈액학적 변화는 반복독성에 의한 변화이며, 급성 경구 노출시에는 혈액학적 변화가 민감하게 발현되지 않음을 알 수 있다.
혈액생화학적 수치 변화
BFC 1, 3 및 9 mg/kg bw를 1회 경구 투여 시 혈액생화학치는 모든 용량군에서유의한 변화가 없었고, 모두 정상범위 이내이었다(Table 2).
카바메이트계 농약인 thiocarb 2.9 및 5.8mg/kg bw를 28일간 랫드에 경구투여 시 혈중 GLU가 증가하며(Satpal and Punia, 2010), 카바메이트계 농약인 furadan 0.125, 0.25 및 0.5 mg/kg bw를 마우스에 2, 4 및 6주간 경구투여 시 TG가 감소하며(Gupta et al., 1986), CBF 4.2 및 10.5 mg/kg bw 경구투여 시 랫드에서 ALP가 증가한다는 보고가 있으나(Mohammed et al., 2017), 본 연구에서의 용량 및 급성 노출에서는 혈액생화학치가 민감하게 변하지 않았다. 이는 Glu, TG 등의 혈액생화학적 수치가 반복투여시에는 영향을 받으나, 본 연구와 같이 단회투여시에는 큰 영향을 받지 않는다는 것을 알 수 있다.
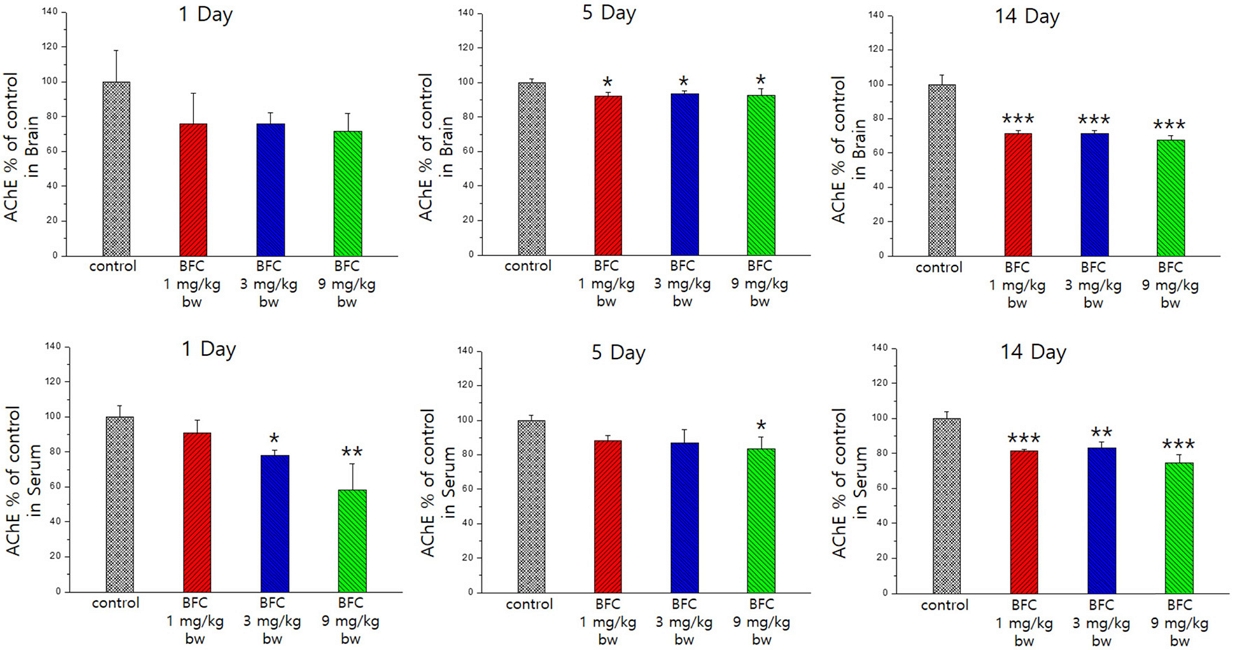
AChE 활성도 변화
BFC 투여 후 랫드로부터 적출한 뇌 조직을 균질화하여 AChE 활성도를 분석한 결과, 투여 후 1일째에는 유의성은 없으나 용량의존적으로 감소하는 경향을 보이며, 이후 5일째 및 14일째에는 모든 용량군에서 뇌 AChE가 유의하게 감소한 것을 확인할 수 있었다(Fig. 1). 이러한 결과는 BFC 1.81 및 9.4 mg/kg bw를 28일간 경구투여 시 랫드의 뇌 AChE가 억제되었다는 보고(EFSA, 2009)와도 유사한 결과이며, 이로써 BFC는 급성 투여 시와 반복 투여 시 모두 뇌의 AChE를 억제한다는 것을 알 수 있었다. 아울러, 뇌 AChE 억제는 투여 후 14일까지 지속되어 쉽게 회복되지 않는 지표라는 것도 알 수 있었다.
혈청 AChE의 경우, BFC 투여 1일째에는 3 및 9mg/kg bw에 의해 유의하게 감소하였고, 이후 5일째에는 9mg/kg bw에 의해 유의하게 감소하였으며, 14일째에는 대조군에 비해 모든 용량군에서 AChE가 유의하게 감소한 것을 확인할 수 있었다(Fig. 1).
Thiodicarb 2.9 및 5.8 mg/kg bw를 랫드에 매일 28일간 경구투여시 혈장 및 뇌의 AChE 활성도가 28일간 계속 억제된다고 보고된 바 있다(Satpal and Punia, 2010).
본 연구에서는 BFC를 1회 경구투여 후 1일째 혈중 AChE 감소가 14일째까지 지속되는 바, 혈중 AChE는 뇌의 AChE와 마찬가지로 일단 억제가 이루어지면 바로 회복되지 않는다는 것을 알 수 있었다.
유전자 발현도 변화
BFC를 1회 투여 후 뇌 조직 중 hsp70 유전자의 발현도를 분석한 결과, BFC 9 mg/kg bw 투여에 의해 투여 후 1일 및 5일째 유의하게 감소하는 것이 관찰되었다(Fig. 2). hsp70 mRNA 및 단백질은 신경세포에 대한 자극에 따라 발현의 정도가 달라진다(Rajdev and Sharp, 2000).
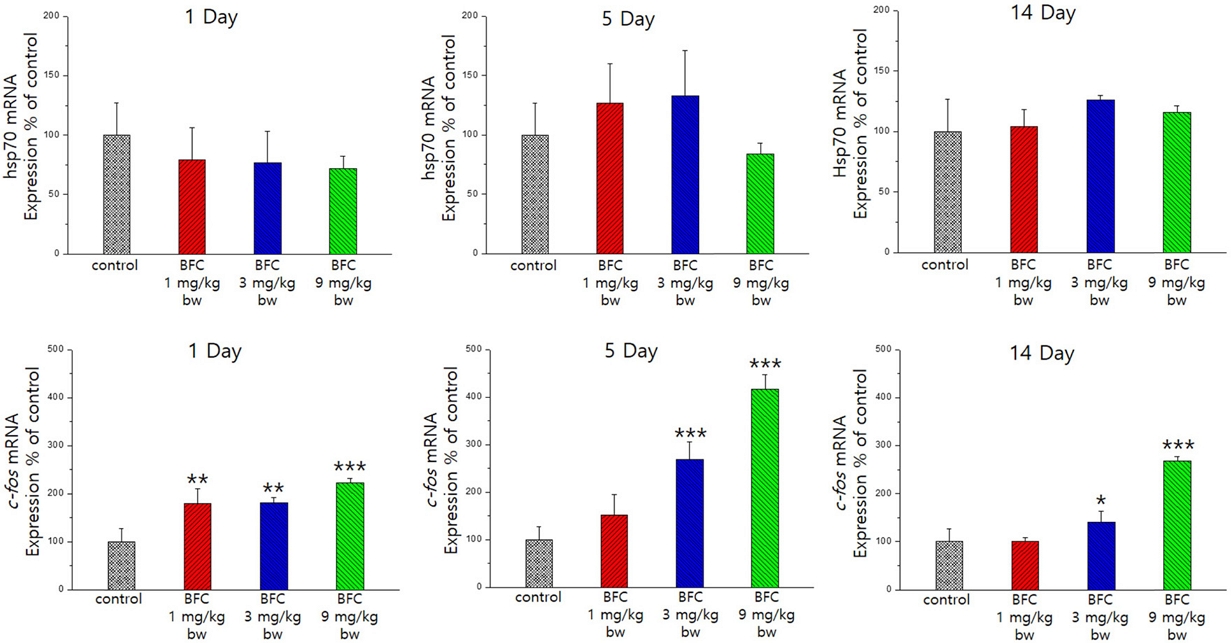
Change of gene expression ratio compare to control after single exposure to BFC in male SD rat. *, **, ***: significant changes compared to control at p<0.05, p<0.01 and p<0.001, respectively.
BFC에 의한 hsp70 유전자 발현에 대한 영향은 이번 연구에서 처음 확인한 것으로 hsp70 유전자 발현의 신경독성 지표로서의 유용성은 조금 더 연구가 필요하다.
뇌 조직 중 c-fos 유전자 발현도 분석 결과, 대조군에 비하여 BFC 투여 후 1일 및 5일째 모든 용량군에서 유의하게 증가하였으며(Fig. 2), 14일째에는 BFC 9mg/kg bw에 의해 유의하게 증가하였다.
피질 세포 중 c-fos mRNA는 신경독성 초기에 증가하므로 c-fos 발현 정도가 초기 신경독성의 정도를 예측하는데 이용될 수 있이 보고된 바 있다(Vendrell et al., 1991). 따라서, 본 연구에서 BFC 투여 후 5일째까지 뇌세포의 c-fos 유전자 발현이 증가하는 것으로 보아 신경독성에 의해 뇌 조직 내 fos 단백질 축적이 이루어지며, 이후 14일째에는 c-fos 유전자 발현이 감소되어 회복경향을 보이는 것을 알 수 있었다. BFC 투여 후 5일째까지는 증가가 지속되나, 이후 14일째 회복되는 경향인 바, 임상증상 발현시기와의 상관성도 높음을 알 수 있다.
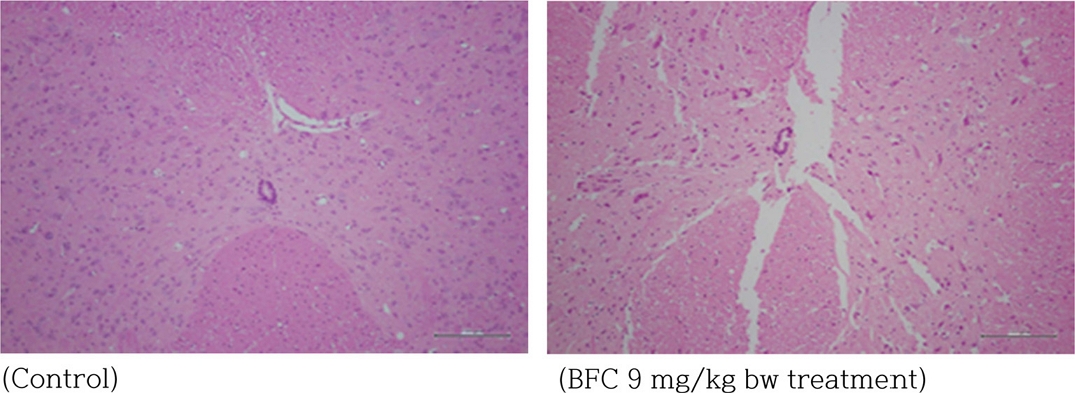
조직병리학적 변화
조직병리 검사 결과, BFC 1, 3 및 9mg/kg bw를 경구투여 후 1, 5, 14일째 뇌 및 척수에서 특이적인 병변이 관찰되지 않았다(Fig. 3, 4).
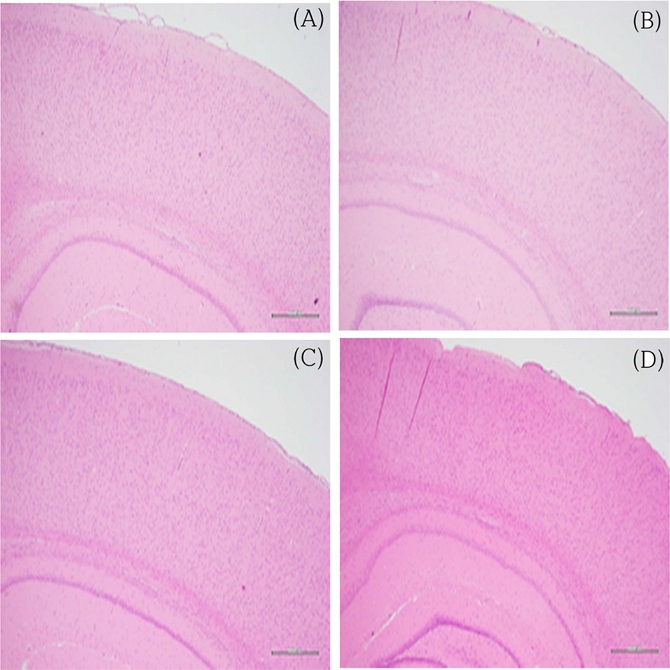
Histopathological findings in brain tissues of SD rats on 14 days after the single oral treatment of BFC 1, 3 and 9 mg/kg bw (×40). (A), (B), (C) and (D): control and BFC 1, 3 and 9 mg/kg bw, respectively.
신경독성물질을 확인하는 데 있어, 신경조직에 대한 조직병리학적 검사는 매우 중요하다. 그러나 신경조직은 매우 복잡하며, 뇌와 척수의 경우, 다른 장기에 비해 특징적으로 수 백개의 서로 다른 세포군으로 구성되어 있으며, 특이적인 기능을 발현한다(Colman et al., 2005). 따라서, 부위별 미세한 변화를 확인하기 위해서는 보다 정교하고, 보다 많은 수의 조직과 검사가 요구된다.
행동평가 및 임상증상 관찰
BFC 투여직후부터 10일째까지 악력의 변화를 조사한 결과 모든 BFC 용량군에서 대조군에 비해 낮은 경향을 보이나 유의성은 없으며, 14일째에는 대조군 수준으로 회복하는 것이 관찰되었다(Table 3).
착지보폭의 경우에는 BFC 투여에 의해 모든 용량군에서 대조군과 큰 차이를 보이지 않았으며, 용량의존적 변화도 관찰되지 않았다(Table 4).
악력(grip strength) 평가는 앞다리 근육의 기능과 힘의 이상을 측정하기 위해 고안된 것으로(Ingber and Pohl, 2016) 악력의 변화는 운동신경독성을 예측할 수 있는 지표이다. 랫드에서 악력은 생후 21일이면 완전히 발달하며, 신경독성물질에 의해 일시적으로 변화하나 매우 민감한 지표는 아니라는 한계를 가지고 있다(Alamri et al., 2018). 또한, 신경독성 물질 투여 시 용량의존적으로 악력이 감소한다고 보고된바 있으며(Meyer et al., 1979), 또한, 용량의존적으로 착지보폭이 증가하는 경향을 보이나, 특이적인 지표로 이용되기에는 민감도가 약하다고 보고된 바 있다(Edwards and Parker, 1977).
본 연구에서는 악력과 착지보폭이 유의하게 변하지 않았는데, 이는 투여용량이 변화를 유발하기에는 낮은 양이었으며, 행동변화는 생화학적 지표보다는 민감하지 않기 때문으로 사료된다.
BFC 3 mg/kg bw를 투여한 직후 일부 동물에서 진전, 느린 호흡, 유연, 비루가 관찰되었으며, BFC 9 mg/kg bw에 의해 일부동물에서 투여직후 진전, 유루, 유연, 근육 이완이 관찰되었으나, 이들은 바로 회복되어 투여 후 1일, 5일 및 14일째에는 임상증상이 관찰되지 않았다.
카바메이트계 농약 중독의 주요 임상증상은 무스카린성 증상(축동, 유연, 발한, 유루, 비루, 복부경련, 구토, 설사, 요실금, 호흡곤란 및 서맥 등)과 니코틴성 증상(속상수축, 마비, 빈맥 및 고혈압 등)이며, 드물게 중추신경계 증상이 나타나는 것으로 알려져 있다(Eren et al., 2016).
이상의 연구결과를 통하여BFC를 랫드에 단회 경구투여시 뇌와 혈청 중 AChE 활성도가 투여 후 14일째까지 억제되며, c-fos 유전자 발현도 14일째까지 증가하고, 투여직후 일부 동물에서 호흡이상 등의 임상증상이 나타나나 바로 회복되며, 악력 저하 등과 같은 신경행동독성 변화는 유의성이 없었다. 뇌 및 혈청 중 AChE의 감소를 근거로 BFC의 급성경구 LOAEL은 1 mg/kg bw로 평가되었다. 단회 투여에 의해 저하된 혈액 및 뇌조직중 AChE의 활성도는 투여 후 14일까지 회복되지 않아 회복성이 약함을 알 수 있었다.
현재 EFSA에서 설정되어 있는 BFC의 ARfD는 0.02mg/kg bw이며, 이는 신경독성시험의 NOAEL 1.81 mg/kg bw에 근거하고 있다. 본 연구에서는 급성 신경행동독성 LOAEL이 1 mg/kg bw로 평가되는 바, 1 mg/kg bw 보다 낮은 양에서의 신경행동독성시험을 추가적으로 실시하여 기존 EFSA의 ARfD의 타당성을 확인할 필요가 있다.
또한, BFC의 aAOEL은 국제적으로 설정되어 있지 않은 바, aAOEL 설정 원칙 및 평가 방법(European Commission, 2017) 등을 참고하여 본 시험을 통해 평가된 LOAEL 1 mg/kg bw 보다 낮은 양에서의 추가시험을 통한 aAOEL 평가도 필요하다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ 0128352019)의 지원에 의해 이루어진 것입니다.
Literate Cites
-
Abass K, Reponen P, Mattila S, Rautio A, Pelkonen O, et al., 2014. Comparative metabolism of benfuracarb in in vitro mammalian hepatic microsomes model and its implications for chemical risk assessment. Toxicology Letters 224(2):290-299.
[https://doi.org/10.1016/j.toxlet.2013.08.009]

-
Agrochemicals research and development department, Otsuka chemical Co. Ltd. 1989. Toxicology overview for benfuracarb. Journal of Pesticide Science, 14(4):517-521.
[https://doi.org/10.1584/jpestics.14.517]

-
Alamri FF, Shoyaib AA, Biggers A, Jayaraman S, Guindon J, et al., 2018. Applicability of the grip strength and automated von Frey tactile sensitivity tests in the mouse photothrombotic model of stroke. Behavioural Brain Research 336:250-255.
[https://doi.org/10.1016/j.bbr.2017.09.008]

-
Colman JR, Nowocin KJ, Switzer RC, Trusk TC, Ramsdell JS, 2005. Mapping and reconstruction of domoic acid-induced neurodegeneration in the mouse brain. Neurotoxicology and Teratology 27(5):753-767.
[https://doi.org/10.1016/j.ntt.2005.06.009]

-
Edwards PM, Parker VH, 1977. A simple, sensitive and objective method for early assessment of acrylamide neuropathy in rats. Toxicology and Applied Pharmacology 40(3):589-591.
[https://doi.org/10.1016/0041-008X(77)90083-7]

-
Eren Y, Erdoğmuş SF, Akyıl D, Özkara A, 2016. Mutagenic and cytotoxic activities of benfuracarb insecticide. Cytotechnology 68(4):637-643.
[https://doi.org/10.1007/s10616-014-9811-3]

- European Commission, 2009. Benfuracarb. https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=activesubstance.detail&language=EN&selectedID=1005, (Accessed Mar. 30. 2020).
- European Commission, 2017. Guidance on the assessment of exposure of operators, workers, residents and bystanders in risk assessment for plant protection products. Commission guidance document.
- European Food Safety Authority, 2009. Peer review of the pesticide risk assessment of the active substance benfuracarb. EFSA Scientific Report 239:1-107.
-
European Food Safety Authority, 2006. Conclusion regarding the peer review of the pesticide risk assessment of the active substance benfuracarb. EFSA Scientific Report 89:1-81.
[https://doi.org/10.2903/j.efsa.2006.89r]

-
Gupta M, Bagchi G, Bandyopadhyay S, Sasmal D, Chatterjee T, et al., 1982. Hematological changes produced in mice by nuvacron or furadan. Toxicology 25(2-3):255-260.
[https://doi.org/10.1016/0300-483X(82)90034-8]

-
Gupta M, Mukherjee S, Gupta SD, Dolui AK, Dey SN, et al., 1986. Changes of lipid spectrum in different tissues of furadan-treated mice. Toxicology 38(1):69-79.
[https://doi.org/10.1016/0300-483X(86)90173-3]

-
Ingber SZ, Pohl HR, 2016. Windows of sensitivity to toxic chemicals in the motor effects development. Regulatory Toxicology and Pharmacology 74:93-104.
[https://doi.org/10.1016/j.yrtph.2015.11.018]

- Kim MH, Kim CH, Park DK, 2019. Korean agriculture in the world based on statistics. Korea Rural Economic Institute p. 133.
- Meyer OA, Tilson HA, Byrd WC, Riley MT, 1979. A method for the routine assessment of for-and hindlimb grip strength of rats and mice. Neurobehavioral Toxicology 1(3):233-236.
- Mohammed K, Hanan M, Maha M, Eman Sh, 2017. Effect of Carbofuran pesticide on male reproductive organs, semen analysis and thyroid. Egypt Journal of Chemistry and Environmental Health 3(2):38-46
-
Rajdev S, Sharp FR, 2000. Stress proteins as molecular markers of neurotoxicity. Toxicologic Pathology 28(1):105-112.
[https://doi.org/10.1177/019262330002800113]

- Satpal SK, Punia JS, 2010. Studies on biochemical changes in subacute thiodicarb toxicity in rats. Toxicology International 17(1):30-32.
-
Solecki R, Davies L, Dellarco V, Dewhurst I, Raaij M, et al, 2005. Guidance on setting of acute reference dose (ARfD) for pesticides. Food and Chemical Toxicology 43(11):1569-1593.
[https://doi.org/10.1016/j.fct.2005.04.005]

- Statistics Korea, 2018. Agricultural area survey. http://kosis.kr/statHtml/statHtml.do?orgId=101&tblId=DT_1EB001&conn_path=I2, (Accessed Mar. 30. 2020).
- Toxin and Toxin-Target Database, 2014. Benfuracarb (T3D0927). http://www.t3db.ca/toxins/T3D0927, (Accessed Mar. 30. 2020).
- United States Environmental Protection Agency, 1996. Neurotoxicity screening battery. EPA 712-C-96-238.
-
Vendrell M, Zawia NM, Serratosa J, Bondy SC, 1991. c-fos and ornithine decarboxylase gene expression in brain as early markers of neurotoxicity. Brain Research 544(2):291-296.
[https://doi.org/10.1016/0006-8993(91)90067-6]

- Yu YM, Kim EH, Hur JH, 2003. Toxic action of benfuracarb via oxidative bioactivation process by cytochrome P450. The Korean Journal of Pesticide 7(1):45-50.