
국화재배지에 발생하는 꽃노랑총채벌레의 발육단계별 약제 감수성
초록
국화 등록 꽃노랑총채벌레 살충제 10종 중 유효 약제를 확인하기 위하여 약제 감수성을 조사하였다. 처리 1일 후 우수한 살충력을 보인 약제는 성충의 경우 benfuracarb, chlorfenapyr를 함유한 살충제에서 100%, 약충은 benfuracarb, chlorfenapyr, emamectin benzoate를 함유한 살충제에서 94-100%, 번데기는 benfuracarb, chlorfenapyr, spinetoram를 함유한 살충제에서 94-100%의 치사율을 보였다. 창원지역 국화 꽃노랑총채벌레의 효율적인 방제를 위해서 benfuracarb, chlorfenapyr, emamectin benzoate, spinetoram을 함유한 살충제를 교호 사용하여 작물 지상부와 지하부 모두 충분히 살포하는 것이 중요하다.
Abstract
This study was carried out to investigate insecticidal susceptibility of 10 registered insecticides to western flower thrips, Frankliniella occidentalis, which damage chrysanthemum in the Changwon area. Bioassays were conducted under laboratory by using collected thrips in chrysanthemum cultivation. Among them the insecticides containing benfuracarb and chlorfenapyr that showed 100% adults mortality 1 day after treatment. The larvae died 94-100% in insecticides containing benfuracarb, chlorfenapyr and emamectin benzoate. The pupae died 94-100% in insecticides containing benfuracarb, chlorfenapyr and spinetoram. It is important to use alternately insecticides benfuracarb, chlorfenapyr, emamectin benzoate and spinetoram to spray it sufficiently on above-ground part and subterranean of chrysanthemums for efficient control of western flower thrips that occur in Changwon area.
Keywords:
Frankliniella occidentalis, Insecticide, Susceptibility, Chrysanthemum, Changwon키워드:
꽃노랑총채벌레, 살충제, 감수성, 국화, 창원서 론
총채벌레류는 발육시기별 서식장소가 다양하고 알에서 성충까지의 발육기간이 짧고 채소, 과수, 화훼류 등 220 여종 이상의 기주식물을 가해하는 광식성 해충이다(Yudin et al., 1986; Ananthakrishan, 1993). 총채벌레류의 약충과 성충은 주로 식물의 잎 꽃, 과실 등의 틈에 서식하면서 작물을 섭식하고 산란하는 과정에서 신초와 잎 성장 저해로 작물의 생육이 저하, 위축되며 은백색의 섭식흔과 산란흔은 상처, 함몰, 반점 등을 유발하여 작물의 상품성을 떨어뜨린다(Cho et al., 2018; Kim et al., 2018). 작물 재배 초기에 생장점 부위를 집중적으로 가해하기 때문에 생육 초기 낮은 밀도로 발생하더라도 예찰 및 방제를 하지 않을 경우 작물 생육과 상품성 유지 등에 많은 피해를 준다(Cho, 2006). 또한 총채 벌레류는 세대 주기가 짧고 번식력이 높으며 각종 식물 바이러스병을 매개하여 2차 피해를 유발하므로 경제적 한계선인 꽃 당 성충 또는 약충이 0.7-2.1마리로 낮은 밀도일 때부터 방제가 필요하다(Park et al., 2007). 특히 시설 내의 꽃노랑총채벌레는 강우 등으로부터 보호를 받으며 고온상태에서 도 광선에 직접 노출되지 않기 때문에 번식 속도가 빠르다(Schmidt and Frey, 1995).
미국 서부지역에 서식하던 꽃노랑총채벌레(Frankliniella occidentalis)는 1970년대 원예작물의 국제교역이 활발해지면서 세계적으로 확산되었으며(Kirk and Terry, 2003; Demirozer et al., 2012; Minakuchi et al., 2013) 1980년대 후반에 유럽에 침입하여 광엽식물과 채소를 재배하는 온실의 높은 온도에서의 왕성한 번식력과 잎 뒷면이나 꽃잎 사이 등의 틈에 몸을 숨기기 좋아하는 습성 그리고 약제에 대한 내성을 빨리 획득하기 때문에 중요한 해충이다(Schmidt and Frey, 1995). 호주에서는 1993년, 중국에서는 2000년에 처음으로 발견되었다(Malipatil et al., 1993; Zhang et al., 2003). 일본에서는 1990년에 관동지방의 시클라멘 재배지에서 발견되었으며(Fukuda et al, 1991), 일본 관서지방에서는 1992년 국화재배지에서 발생이 확인된 후 국화, 카네이션, 꽃도라지, 과꽃, 거베라 등의 화훼류를 중심으로 확대되어 1995년 가지 등의 채소류, 감귤 등의 과수류에서도 피해가 발생하였다(Tatara and Suzuki, 1993; Negoro and Shibao, 1996; Katayama, 1997). 우리나라에서는 1993년 제주도 서귀포시 밀감 재배지에서 처음으로 발견된 이후 화훼, 채소, 과수 등 다양한 원예작물에서 피해가 발생하고 있다(Woo et al., 1994; Park et al., 2007; Lee et al., 2017; Cho et al., 2018, Kim et al., 2018).
꽃노랑총채벌레를 방제하기 위해 다양한 방법들이 이용되고 있으나 우리나라의 경우 화학적 방제가 일반적이다(Lee et al., 2017). 그러나 장기간의 화학적 방제와 무분별한 약제사용으로 유기합성농약에 대한 저항성 발현 개체의 출현이 보고되고 있다(Immaraju et al., 1992; Robb et al., 1995; Broughton and Herron, 2007; Chatzivassiliou, 2008; Funderburk, 2009; Gao et al., 2012). 해충의 한 약제에 대한 저항성 발달은 다른 약제에 대한 저항성을 유발하여 이러한 교차저항성으로 인해 사용할 수 있는 살충제 종류가 감소하고 있으며 농가 현장에서는 해충의 약제 저항성 발달로 인한 약제 효력 저하에 대한 의구심 증대와 함께 해충 방제의 어려움을 호소하고 있다(Choi et al., 2005). 유기합성살충제에 대한 꽃노랑총체벌레의 저항성은 1961년에 처음으로 보고된 이래 세계에서 유기인계, 카바메이트계, 네오니코티노이드계, 피레스로이드계, 스피노신계 등의 다양한 계열의 약제 저항성이 지속적으로 보고되었다(Jensen, 2000; Gao et al., 2012). Gao et al. (2012)은 국내 총채벌레류, 가루이류, 나방류 방제 약제로 이용되고 있는 스피노신계 spinosad의 경우 1998년 일본에서 14배, 2003년 스페인에서 13,500배 이상, 2006년 중국에서 80.8배의 고도저항성을 보고하였으며 Brødsgaard (1994)는 카바메이트계인 methiocarb 저항성 개체가 유기인계인 acephate와 dichlorvos에 고도의 저항성이 나타나 교차저항성에 대하여 언급하였다. 국내의 경우 김해와 고양의 장미 재배지에서 채집한 꽃노랑총채벌레에 대한 chlorfenapyr와 phenthoate의 LC50값이 현저히 높게 나타났고(Yu et al., 2002), 구례, 광양, 순천, 제주 지역의 시설재배지에서 채집한 꽃노랑총채벌레 개체군의 네오니코티노이드계 농약인 acetamiprid, imidacloprid, thiamethoxam의 대한 저항성을 보고하였으며(Choi et al., 2005) 경북지역의 사과원 개체에서는 imidacloprid에 대해 50% 미만의 사충률을 나타내었다(Kim et al., 2018). 꽃노랑총체벌레는 한번 획득한 약제 저항성이 해당 약제에 장기간 노출되지 않아도 상당 기간 지속되는 특성이 있고, 식물 바이러스를 매개하는 시간은 매우 짧아 상대적으로 효과가 낮은 약제로는 총채벌레류 방제는 물론 식물 바이러스병을 억제하는데 큰 효과를 기대하기 어렵다(Demirozer et al., 2012; Lee et al., 2017).
꽃노랑총채벌레는 TSWV (Tomato Spotted Wilt Virus), INSV (Impatiens Necrosis Spot Virus), CSNV (Chrysanthemum Stem Necrosis Virus) 등과 같은 식물 바이러스병을 매개하는 주요 종이다(Lee et al., 2017). 국화에 발생하는 바이러스에는 TAV (tomato aspermy virus), CVB (chrysanthemum virus B), TSWV (tomato spotted wilt virus), INSV (impatiens necrosis spot virus), CSNV (chrysanthemum stem necrosis virus) 5종과 CSVd (chrysanthemum stunt viroid), CChMVd (chrysanthemum chlorotic mottle viroid), CSNV (chrysanthemum stem necrosis virus) 2종의 바이로이드가 보고되었으나(Verhoeven et al., 1996; Daughtrey et al., 1997; Matsuura et al., 2007; Kondo et al., 2011; Okuda et al., 2013) 국내 국화재배지에서는 꽃노랑총채벌레가 매개하는 TSWV, CSNV 2종의 바이러스가 확인되었으며(Chung et al., 2006; Yoon et al., 2017) 그 피해가 확산되고 있다.
본 시험은 번식과 약제 저항성 획득이 빠른 꽃노랑총채벌레의 작물 피해 감소와 식물바이러스병 매개 확산 억제를 위해 국화에 등록된 약제들의 살충력을 검토하여 유효 약제을 확인하고 실제 농가 현장에 적용, 활용할 수 있는 약제 정보를 제공하고자 한다.
재료 및 방법
시험곤충
꽃노랑총채벌레는 2018-2019년까지 창원지역 국화 재배지 10지점에서 채집하여 현미경을 이용한 육안 분류 후 PCR을 이용한 분자생물학적 종 동정을 실시하여 확인하였다. 분류한 개체군은 수분을 공급한 여과지가 깔린 insect breeding dish (100×40 mm, SPL 310202®)에 파종한 강낭콩 떡잎을 공급하면서 온도 25oC±1, 습도 50-60%, 일장 16L8D 조건에서 사육 후 성충 개체가 산란한 알에서 부화한 약충, 번데기, 성충을 각각 시험에 이용하였다.
시험약제
시험에 사용한 살충제는 네오니코티노이드계 4종(acetamiprid, clothianidin, imidacloprid, thimethoxam), 스피노신계 1종(spinetoram), 아버멕틴계 1종(emamectin benzoate), 벤조일우레아계 1종(buprofezin), 피레스노이드계 1종(acrinathrin), 카바메이트계 1종(benfuracarb), 파이롤계 1종(chlorfenapyr)을 포함한 단제 6종과 혼합제 4종, 총 10종으로 국화의 총채벌레류 대상으로 시판되고 있는 제품(KCPA, 2019)을 사용하였으며 각 살충제에 대한 일반명, 유효성분, 제형 및 추천농도(ppm) 등의 정보는 Table 1과 같다.
실내 약제 감수성 검정
꽃노랑총채벌레의 약제 감수성 검정은 시험 살충제의 효과를 극대화하기 위해 잎 침지법과 스프레이법을 동시에 이용하였다. 각각의 살충제를 추천농도로 희석한 후 파종한 강낭콩 떡잎을 떼어 30초간 침지, 1시간 동안 음건하였다. 여과지 1장이 깔린 페트리디시[insect breeding dish (60×15 mm, SPL 11060®)]에 음건한 강낭콩 떡잎을 넣고, 미세한 붓을 이용하여 꽃노랑총채벌레의 약충, 번데기, 성충을 각각 따로 10개체씩 접종하였다. 추천농도로 희석한 국화 총채벌레 등록 살충제 10종을 미세 분무기(300 mL, airapha spray)을 이용하여 약충, 번데기, 성충에게 각각 1 m L씩 살포 후페트리디시 틈을 파라필름으로 밀봉하였으며 무처리구는 동일한 방법으로 1 mL의 증류수를 살포하였다. 꽃노랑총채벌레의 발육단계별 사충수는 미세붓으로 건드렸을 때 몸길이만큼 움직이지 못하는 것을 치사한 것으로 간주하였으며 번데기는 우화 여부까지 관찰하였다. 시험은 약충, 번데기, 성충 각각 10마리씩을 1반복으로 10반복 실시하였고 약충, 번데기, 성충 각각의 치사율(%)은 살충제 살포 1일(24시간)과, 3일(72시간) 후 각각의 (사충수/총마리수) × 100으로 산출하여 무처리의 치사율과 비교하였다. 그리고 선발된 10가지 약제에 대한 꽃노랑총채벌레의 실내검정 결과 분석은 Steel-Dwass test로 유의수준 5%에서 약제 살포 1일(24시간) 및 3일(72시간) 동안의 약제간 치사율의 차이를 각각 비교하였다.
결 과
약충의 약제 감수성
살충제 살포 1일 및 3일 후의 치사율은 Fig. 1에 나타내었다. 살포 후 1일의 치사율은 benfuracarb SG, chlorfenapyr + Imidacloprid SC에서 100%를 나타냈으며 chlorfenapyr + clothianidin SC, emamectin benzoate EC, acrinathrin SC에서 각각 96%, 94%, 92%의 치사율을 보였다. Buprofezin + thimethoxam SC는 76%, acetamiprid + spinetoram SC는 74%, thimethoxam SG는 66%였으며 acetamiprid SL과 imidacloprid WP는 각각 30%와 20%의 치사율을 보였다. 살포 후 3일의 치사율은 imidacloprid WP, acetamiprid SL 각각에서 74%와 70%를 나타냈으며 acetamiprid + spinetoram SC에서 26%, emamectin benzoate EC에서 6%, chlorfenapyr + clothianidin SC에서 4%, acrinathrin SC에서 0%의 치사율을 보였다. 살포 후 3일 동안의 총치사율은 imidacloprid WP와 acrinathrin SC에서 각각 94%와 92%를 보였으며 나머지 모든 살충제에서 100%의 치사율을 나타내었다.
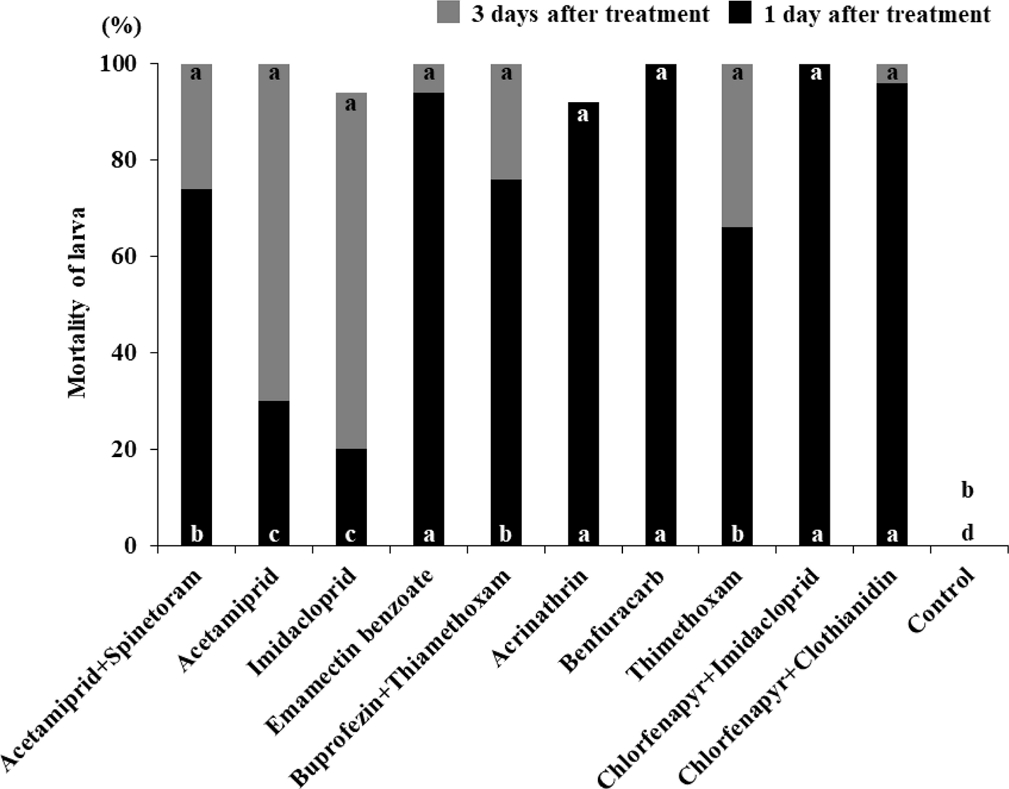
Susceptibilities of F. occidentalis larva during 1st and 3rd exposure period to 10 insecticides. Values for each mortality labeled with different letters are significantly different (p < 0.05) by the Steel-Dwass test. Different letters at the bottom of each mortality value are significantly different for 1 day after insecticidal treatments. Different letters at the top of each mortality value are significantly different for 3 days after insecticidal treatments.
번데기의 약제 감수성
번데기에 대한 살충제 살포 1일 및 3일 후의 치사율은 Fig. 2에 나타내었다. Benfuracarb SG, chlorfenapyr + Imidacloprid SC, chlorfenapyr + clothianidin SC의 살포 후 1일의 치사율은 각각 100%를 나타냈으며 acetamiprid + spinetoram SC와 thimethoxam SG에서 각각 92%와 86%의 치사율을 보였다. Buprofezin + thimethoxam SC와 acetamiprid SL는 각각 52%와 42%였으며 emamectin benzoate EC는 24%, acrinathrin SC는 22%, imidacloprid WP는 8%의 치사율을 나타내었다. 살포 후 3일의 치사율은 imidacloprid WP와 acrinathrin SC에서 82%와 78%가 나왔으며 emamectin benzoate EC에서 70%, acetamiprid SL에서 58%, buprofezin + thimethoxam SC에서 20%, acetamiprid + spinetoram SC에서 8%의 치사율을 보였다. 살포 후 3일 동안의 총치사율은 emamectin benzoate EC가 94%, imidacloprid WP가 90%, buprofezin + thimethoxam SC가 72%를 나타냈으며 나머지 모든 살충제에서 100%의 치사율을 나타내었다.
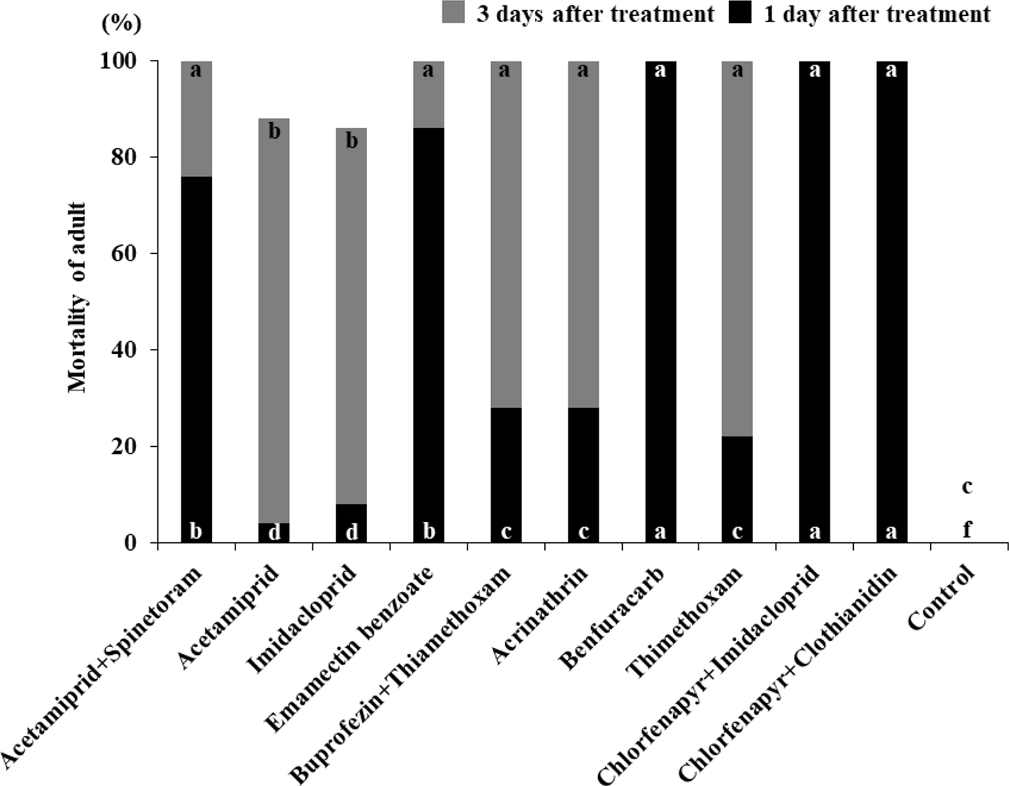
Susceptibilities of F. occidentalis pupa during 1st and 3rd exposure period to 10 insecticides. Values for each mortality labeled with different letters are significantly different (p < 0.05) by the Steel-Dwass test. Different letters at the bottom of each mortality value are significantly different for 1 day after insecticidal treatments and different letters at the top of each mortality value are significantly different for 3 days after insecticidal treatments.
성충의 약제 감수성
살충제 살포 1일 및 3일 후의 성충 치사율은 Fig. 3과 같다. Benfuracarb SG, chlorfenapyr + imidacloprid SC, chlorfenapyr + clothianidin SC의 살포 1일 후 치사율은 각각 100%를 보였다. Emamectin benzoate EC와 acetamiprid + spinetoram SC는 각각 86%와 76%를 보였으며 buprofezin + thimethoxam SC는 28%, thimethoxam SG는 22%, imidacloprid WP 8%, acetamiprid SL은 4%의 치사율을 나타냈다. 살포 3일 후의 치사율은 acetamiprid SL가 88%, imidacloprid WP가 86%였으며 나머지 모든 살충제에서 100%의 치사율을 나타내었다. 살포 후 3일의 치사율은 acetamiprid SL에서 84%, imidacloprid WP와 thimethoxam SG에서 각각 78%, buprofezin + thimethoxam SC와 acrinathrin SC에서 각각 72%를 보였으며 acetamiprid + spinetoram SC에서 24%, emamectin benzoate EC 14%의 치사율을 나타냈다. 살포 후 3일 동안의 총치사율은 emamectin benzoate EC에서 94%, imidacloprid WP 90%, buprofezin + thimethoxam SC에서 72%로 나타냈으며 나머지 모든 살충제에서 100%의 치사율을 보였다.
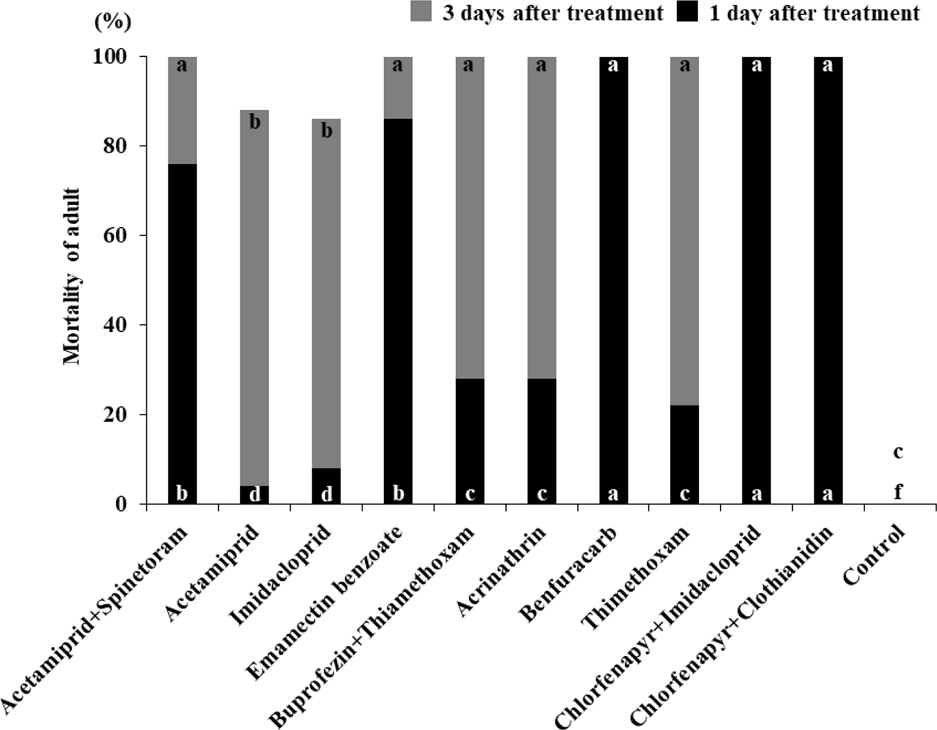
Susceptibilities of F. occidentalis adult during 1st and 3rd exposure period to 10 insecticides. Values for each mortality labeled with different letters are significantly different (p < 0.05) by the Steel-Dwass test. Different letters at the bottom of each mortality value are significantly different for 1 day after insecticidal treatments and different letters at the top of each mortality value are significantly different for 3 days after insecticidal treatments.
고 찰
국화의 총채벌레류 대상으로 시판되고 있는 등록 살충제 10종의 꽃노랑총채벌레 발육단계별 약제 감수성을 조사한 결과 약충, 번데기, 성충 별로 각각 상이한 살충효과가 나타났으나 benfuracarb, chlorfenapyr를 함유한 살충제에서는 살포 1일 후 약충, 번데기, 성충 모두 96% 이상의 살충률을 보였으며 살포 3일 후 번데기의 경우 buprofezin + thimethoxam SC를 제외한 모든 살충제에서 80% 이상의 살충률을 보였다. 특히 benfuracarb, chlorfenapyr가 함유한 살충제 처리 1일 후의 번데기에서 100%의 살충률이 나타난 결과가 흥미롭다(Fig. 2).
Yu et al. (2002)은 시판 살충제 40종의 꽃노랑총채벌레 성충에 대한 약제 감수성을 검토한 결과 chlorfenapyr, chlorpyrifos-methyl, emamectin benzoate, fenthion, fipronil, phenthoate, spinosad, chlorpyrifos + diflubenzuron, furathiocarb + diflubenzuron 살포 48시간 후 85% 이상의 살충률을 나타냈으나 acetamiprid + ethofenprox는 22% 이하의 살충률을 보였으며 살충제 종류에 따라 지역별로 채집한 꽃노랑총채벌레에서 높은 약제 감수성의 차이를 보여 교차저항성이 동일계의 살충제뿐만 아니라 도태 경험이 없는 새로운 살충제에 대해서도 나타날 수 있음을 시사했다. Choi et al. (2005)은 꽃노랑총채벌레의 방제 약제에 대한 감수성을 조사한 결과 neonicotinoid 계통의 imidacloprid, thimethoxam에 대해서 저항성을 보이고, chlorfenapyr, spinetoram, emamectin benzoate, fipronil 등에 대해서는 높은 감수성을 유지하고 있었다고 보고하였다. Lee et al (2017)은 경기지역 시설재배지에 발생하는 꽃노랑총채벌레에 대한 약제 감수성을 검정한 결과 살충제 살포 24시간 후 재배작물과 관계없이 acetamiprid (8%) SP, clothianidin (8%) SC, imidacloprid (10%) WP, thiacloprid (10%) WG와 같은 네오니코티노인드계 약제에 대한 저항성이 두드러지게 보였으며 스피노신계 spinetoram과 spinosad의 함량을 각각 4, 10% 이상 함유하거나 피롤계의 chlorfenapyr가 5% 이상 함유된 단제 또는 혼합제를 선택하여야 꽃노랑총채벌레 방제에 효과적일 것이라 보고하였다. Cho et al (2018)은 emamectin benzoate를 함유한 살충제에서 꽃노랑총채벌레 84% 이상의 살충력을 보였으며 benfuracarb WG, chlorfenapyr SC, chlorpyrifos WP, spinetoram WG, spinosad SC 5종의 단제와 abamectin + chlorfenapyr SC, abamectin + emamectin benzoate WP, buprofezin + spinetoram SC, chlorfenapyr + clothianidin SC, chlorfenapyr + imidacloprid SC, chlorpyrifos + diflubenzuron WP, clothianidin + spinetoram SC, dinotefuran + spinetoram WG, methoxyfenozide + spinetoram SC, pyridalyl + spinetoram EW 10종의 합제에서 90% 이상의 살충력을 나타냈다. 또한 10종 중 9종의 합제는 단제로서 높은 사충률을 나타낸 chlorfenapyr, chlorpyrifos, spinetoram을 포함하고 있지만 abamectin, clothianidin, imidacloprid, diflubenzuron, dinotefuran과 같이 효과가 낮은 성분이 혼합되어 오남용되고 있어 저항성 증가의 가능성을 제시하였다.
본 시험에서도 비슷한 경향이 나타났다. 국화 등록 꽃노랑총채벌레 살충제 10종 중 처리 1일 후 우수한 살충력을 보인 약제는 성충의 경우 benfuracarb, chlorfenapyr를 함유한 살충제에서 100%, 약충은 benfuracarb, chlorfenapyr, emamectin benzoate를 함유한 살충제에서 94-100%, 번데기는 benfuracarb, chlorfenapyr, spinetoram를 함유한 살충제에서 94-100%의 치사율을 보였다(Fig. 1-3). Cho et al. (2018)은 오이를 이용하여 꽃노랑총채벌레 성충 대상으로 각종 살충제의 약제 효과발현시간, 침투이행성, 잔효성을 조사한 결과 benfuracarb WG는 2시간 이내, chlorfenapyr SC는 48시간 이내에 각각 95%의 살충효과를 내었고 chlorfenapyr SC의 뿌리를 통한 침투이행성 효과는 100%, chlorfenapyr SC와 spinetoram WG의 엽면을 통한 침투이행성 효과는 각각 83.8%, 78.7%로 높게 나타났으며 잔효성 검정에서는 benfuracarb WG와 chlorfenapyr SC 처리 3일 후 각각 100%, 78.9%의 사충률을 보였다. 합제의 경우 처리 3일 후 chlorfenapyr + clothianidin SC, chlorfenapyr + imidacloprid SC 두 약제가 100%의 사충률을 보였으며, methoxyfenozide + spinetoram SC, pyridalyl + spinetoram SC에서 각각 75.4, 67.9%의 사충률을 나타내었다. 하지만 14일 후에는 chlorfenapyr + clothianidin SC와 chlorfenapyr + imidacloprid SC가 각각 97.6%, 100%의 사충률을 나타내었다.
국화에 발생하는 꽃노랑총채벌레의 밀도가 가장 높을 때는 개화 성기이며 꽃에 강하게 유인되어 직접 꽃잎을 가해하므로 주로 꽃에서 밀도가 높고 잎에서는 밀도가 낮은 경향이 있다(Pickett et al., 1988; Rosenheim et al., 1990; Park et al., 2002). Park et al (2002)에 의하면 국화에서 꽃노랑총채벌레의 발생은 노지재배지보다 시설재배지에서 약간 높은 밀도를 보였으며 무방제 포장의 경우 봄, 가을 재배 모두 전 생육기간동안 100%의 피해주율이 나타났으며 피해엽률 또한 최고 48%였다. 꽃노랑총채벌레는 국화의 표피와 유연세포를 가해하여 완전히 발육하지 않은 잎을 파괴함으로써 생육장애를 초래하고 상품성을 떨어트린다(Uiterdijk et al., 1995). 총채벌레류의 성충은 식물조직 내에 알을 산란하고 부화한 약충은 식물 지상부의 잎, 꽃, 과실 등의 틈에 서식하면서 가해하며 식물 지하부 토양에서 전용과 용의 단계를 거치는 복잡한 생활사를 갖고 있다(Ananthakrishan, 1993). 이러한 발육단계별 서식장소의 다양함, 알에서 성충까지의 빠른 발육기간, 약제 저항성 계통의 출현 등으로 방제가 어려운 총채벌레류의 효과적인 방제법으로 살충제 교차사용의 필요함을 제시하고 있다(Cho, 2006; Bielza et al., 2007). 창원지역의 국화재배지의 약제 방제는 benfuracarb, chlorfenapyr, emamectin benzoate, spinetoram을 함유한 살충제의 교호 살포가 꽃노랑총채벌레 방제에 효율적일 것이라 판단되며 꽃노랑총채벌레는 세대 주기가 짧고 번식력이 높아 발생 현장에서는 알, 약충, 번데기, 성충 모든 발육단계가 혼재하기 때문에 작물 지상부와 지하부 모두 충분히 살포하는 것이 중요하다. 향후 살충력이 우수한 약제를 중심으로 야외 개체군을 대상으로 추가적인 시험이 필요하다.
Acknowledgments
본 연구는 2020년도 농촌진흥청 기관고유사업 ‘국화 총채벌레의 방제 및 관리 매뉴얼 구축’ (PJ01359102) 연구 지원에 의하여 이루어진 것입니다.
Literate Cites
-
Ananthakrishan TN. 1993. Bionomics of thrips. Annual Review of Entomology. 38(1):71-92.
[https://doi.org/10.1146/annurev.en.38.010193.000443]

-
Bielza P, Quinto V, Contreras J, Torné M, Martín A, et al., 2007. Resistance to spinosad in the western flower thrips, Frankiniella occidentalis (Pergande), in greenhouses of south-easter spain. Pest Management Science. 63(7):682-687.
[https://doi.org/10.1002/ps.1388]

-
Brødsgaard HF, 1994. Insecticide resistance in European and African strains of western flower thrips (Thysanoptera: Thripidae) tested in a new residue-on-glass test. J. Econ. Entomol. 87(5):1141-1146.
[https://doi.org/10.1093/jee/87.5.1141]

-
Broughton S, Herron GA, 2007. Frankliniella occidentalis(Pergande) (Thysanoptera: Thripidae) chemical control: insecticide efficacy associated with the three consecutive spray strategy. Aust. J. Entomol. 46(2):140-145.
[https://doi.org/10.1111/j.1440-6055.2007.00568.x]

-
Chatzivassiliou EK, 2008. Management of the spread of tomato spotted wilt virus in tobacco crops with insecticides based on estimates of thrips infestation and virus incidence. Plant Dis. 92(7):1012-1020.
[https://doi.org/10.1094/PDIS-92-7-1012]

- Cho SR, 2006. Environmental friendly control of caterpillars occurring on leaf vegetables in greenhouse with entomopathogenci nematodes. PhD. Diss, Gyeongsang National Univ., Jinju. Korea. (In Korean)
- Cho SW, Kyung YJ, Cho SR, Shin SE, Jeong DH, et al., 2018. Evaluation of susceptibility of western flower thrips (Frankliniella occidentalis) and garden thrips (F. intonsa) to 51 insecticides. Korean J. Appl. Entomol. 57:221-231. (In Korean)
- Choi BR, Lee SW, Park HM, Yoo JK, Kim SG, et al., 2005. Monitoring on insecticide resistance of major insect pests in plastic house. Korean J. Pestic. Sci. 9(4):380-390. (In Korean)
-
Chung BN, Pak HS, Jung JA, Kim JS, 2006. Occurrence of tomato spotted wilt virus in chrysanthemum (Dendranthema grandiflorum) in Korea. Plant Pathol. J. 22(3):230-234. (In Korean)
[https://doi.org/10.5423/PPJ.2006.22.3.230]

-
Daughtrey ML, Jones RK, Moyer JW, Daub ME, Baker JR, 1997. Tospoviruses strike the greenhouse industry: INSV Has Become a Major Pathogen on Flower Crops. Plant disease 81:1220-1230.
[https://doi.org/10.1094/PDIS.1997.81.11.1220]

-
Demirozer O, Tyler‐Julian K, Funderburk J, Leppla N, Reitz S, 2012. Frankliniella occidentalis (Pergande) integrated pest management programs for fruiting vegetables in Florida. Pest Management. Sci. 68(12):1537-1545.
[https://doi.org/10.1002/ps.3389]

- Fukuda H, Kawana T, Kubota A, Hayase T, 1991. Occurrence and its chemical control of western flower thrips Frankliniella occidentalis Pergande. Annual Report of the Kanto-Tosan Plant Protection Society. 38:231-233.
-
Funderburk J, 2009. Management of the western flower thrips (Thysanoptera: Thripidae) in fruiting vegetables. Fla. Entomol. 92(1):1-6.
[https://doi.org/10.1653/024.092.0101]

-
Gao Y, Lei Z, Reitz SR, 2012. Western flower thrips resistance to insecticides: detection, mechanisms and management strategies. Pest. Manag. Sci. 68(8):1111-1121.
[https://doi.org/10.1002/ps.3305]

-
Immaraju JA, Paine TD, Bethke JA, Robb KL, Newman JP, 1992. Western flower thrips (Thysanoptera: Thripidae) resistance to insecticides in coastal California greenhouses. J. Econ. Entomol. 85(1):9-14.
[https://doi.org/10.1093/jee/85.1.9]

- Jensen SE, 2000. Insecticide resistance in the western flower thrips, Frankliniella occidentalis. Integ. Pest Manag. Rev. 5:131-146.
-
Katayama H, 1997. Occurrence of the Western flower thrips, Frankliniella occidentalis (Pergande) and damage of chrysanthemum by this species. 39:5-7.
[https://doi.org/10.4165/kapps1958.39.0_5]

-
Kim JW, Kim SJ, Lee SY, Lee DH, Do YS, et al., 2018. Seasonal occurrence and insecticide susceptibility by thrips on apple orchards in Gyeongbuk Area. Korean J. Pestic. Sci. 22(1):1-7. (In Korean)
[https://doi.org/10.7585/kjps.2018.22.1.1]

-
Kirk WD, Terry LI, 2003. The spread of the western flower thrips Frankliniella occidentalis (Pergande). Agric. For. Entomol. 5(4):301-310.
[https://doi.org/10.1046/j.1461-9563.2003.00192.x]

- Korea Crop Protection Association (KCPA), 2019. User’s guidebook of pesticides. (In Korean)
-
Kondo T, Yamashita K, Sugiyama S, 2011. First report of Iimpatiens necrotic spot virus infecting chrysanthemum (Chrysanthemum morifolium) in Japan. Journal of General Plant Pathology. 77(4):263-265.
[https://doi.org/10.1007/s10327-011-0317-y]

-
Lee YS, Lee HA, Lee HJ, Hong SS, Kang CS, et al., 2017. Insecticide susceptibility of western flower thrip, Frankliniella occidentalis (Thysanoptera: Thripidae) on horticultural crops in Gyeonggi area. Korean J. Appl. Entomol. 56(2):179-186. (In Korean)
[https://doi.org/10.5656/KSAE.2017.03.0.005]

-
Malipatil MB, Postle AC, Osmelak JA, Hill M, Moran J, 1993. First record of Frankliniella occidentalis (Pergande) in Australia (Thysanoptera: Thripidae). Aust. J. Entomol. 32:378-378.
[https://doi.org/10.1111/j.1440-6055.1993.tb00607.x]

-
Matsuura S, Kubota K, Okuda M, 2007. First Report of chrysanthemum stem necrosis virus on Chrysanthemums in Japan. Plant disease 91(4):468.
[https://doi.org/10.1094/PDIS-91-4-0468C]

-
Minakuchi C, Inano Y, Shi X, Song D, Zhang Y, et al., 2013. Neonicotinoid resistance and cDNA sequences of nicotinic acetylcholine receptor subunits of the western flower thrips Frankliniella occidentalis (Thysanoptera: Thripidae). Applied Entomology and Zoology. 48(4):507-513.
[https://doi.org/10.1007/s13355-013-0212-4]

-
Negoro M, Shibao M, 1996. Damage of eggplant by Frankliniella occidentalis and effects of insecticides on this species. Annual Report of The Kansai Plant Protection Society. 38:35-36.
[https://doi.org/10.4165/kapps1958.38.0_35]

-
Okuda S, Okuda M, Matsuura S, Okazaki S, Iwai H, 2013. Competence of Frankliniella occidentalis and Frankliniella intonsa strains as vectors for Chrysanthemum stem necrosis virus. European Journal of Plant Pathology. 136(2):355-362.
[https://doi.org/10.1007/s10658-013-0169-8]

-
Park HH, Lee JH, Uhm KB, 2007. Economic thresholds of western flower thrips (Thysanoptera: Thridae) for unripe red pepper in greenhouse. J. Asia-Pacific Entomol. 10(1):45-53. (In Korean)
[https://doi.org/10.1016/S1226-8615(08)60330-1]

- Park JD, Kim DI, Kim SG, 2002. Seasonal occurrence and damaged aspects of Frankliniella occidentalis Pergande (Thysanoptera: Thripidae) by cultural environments and varieties of chrysanthemum. Korean J. Appl. Entomol. 41:177-181. (In Korean)
-
Pickett CH, Wilson LT, Gonzalez D, 1988. Population dynamics and within plant distribution of the western flower thrips (Thysanoptera: Thripidae), an early season predator of spider mites infesting cotton. Environ. Entomol. 17(3):551-559.
[https://doi.org/10.1093/ee/17.3.551]

-
Robb KL, Newman J, Virzi, JK, Parrella P, 1995. Insecticide resistance in western flower thrips. pp. 341-346. In: Parker BL, Skinner M, Lewis T (Eds.), Thrips biology and management. Plenum Press, New York, USA
[https://doi.org/10.1007/978-1-4899-1409-5_52]

-
Rosenheim JA, Welter SC, Johnson MW, Mau RFL, Gusukuma MLR, 1990. Direct feeding damage on cucumber by mixed species infestation of Thrips palmi and Frankliniella occidentalis (Thysanoptera: Thripidae). J. Econ. Entomol. 83(4):1519-1525.
[https://doi.org/10.1093/jee/83.4.1519]

- Schmidt ME, Frey JE, 1995. Monitoring of the western flower thrips Frankliniella occidentalis in greenhouse. Mededelingen Faculteit Landbouwkundige en Toegepaste Biologische Wetenschappen Universiteit Gent. (Belgium). 60(3a):847-850.
- Tatara A, Suzuki M, 1993. Effective insecticides to the western flower thrips, Frankliniella occidentalis (Pergande). Annual Report of the Kanto-Tosan Plant Protection Society. 38:35-36.
- Uiterdijk MCE, Keijer CJ, Jager CM, 1995. Growth damage in chrysanthemum caused by Frankliniella occidentalis(PERGANDE); a cryo scanning electron microscoppic study. Mededelingen Faculteit Landbouwkundige en Toegepaste Biologische Wetenschappen Universiteit Gent. (Belgium). 60(3a):909-915.
-
Verhoeven JTJ, Roenhorst JW, Cortes I, Peters D, 1996. Detection of a novel tospovirus in chrysanthemum. Acta Hort. 432:44-53.
[https://doi.org/10.17660/ActaHortic.1996.432.4]

- Woo KS, Ahn SB, Lee SH, Kwon HM, 1994. First record of Frankliniella occidentalis and its distribution and host plants in Korea. Korean J. Appl. Entomol. 33:127. (In Korean)
-
Yoon JY, Choi GS, Choi SK, 2017. First report of Chrysanthemum stem necrosis virus on Chrysanthemum morifolium in Korea. Plant Disease. 101(1):264. (In Korean)
[https://doi.org/10.1094/PDIS-06-16-0906-PDN]

- Yu JS, Kim JI, Kim GH, 2002. Insecticide susceptibilities of rose field-collected population of western flower thrips, Frankliniella occidentalis in Korea. Korean J. Pestic. Sci. 6(2):80-86. (In Korean)
-
Yudin LS, Cho JJ, Mitchell WC, 1986. Host range western flower thrips, Frankiniella occidentalis (Thysanoptera: Thripidae), with special reference to Leucaena glauce. Environmental Entomology. 15(6):1292-1295.
[https://doi.org/10.1093/ee/15.6.1292]

- Zhang Y, Wu Q, Xu B, Zhu G, 2003. The occurrence and damage of Frankliniella occidentalis (Thysanoptera: Thripidae): a dangerous alien invasive pest in Beijing. Plant Prot. 29:58-59.

