LC-MS/MS를 이용한 식물생장조절제 동시분석법 연구
 ; Mi-Ra Jang ; Jae-Min Shin ; Young Shin ; Young-Hye Park ; Hye-Won Park ; Jin-Kyung Kim ; Mi-Sun Hong ; In-Sil Yu ; Yong-Seung Shin
; Mi-Ra Jang ; Jae-Min Shin ; Young Shin ; Young-Hye Park ; Hye-Won Park ; Jin-Kyung Kim ; Mi-Sun Hong ; In-Sil Yu ; Yong-Seung Shin
초록
본 연구는 7종의 생장조절제 2,4-dichlorophenoxyacetic acid, 6-benzylaminopurine, forchlorfenuron, gibberellin A3, paclobutrazol, thidiazuron 그리고 uniconazole에 대한 동시다성분 분석법을 확립고자 하였다. 효율적인 식물생장조절제 추출을 위해 QuEChERS법을 응용하여 전처리 후 LC-MS/MS를 이용한 유효성검증을 실시하였다. 변경된 QuEChERS법은 공인된 EN15662 방식을 따르며 5.0 g의 시료에 1% formic acid가 포함된 acetonitrile 30 mL로 추출하는 부분에서 차이가 있다. 유효성검증은 매질효과(matrix effect), 직선성(linearity), 검출한계(limit of detection, LOD), 정량한계(limit of quantification, LOQ), 정확성(accuracy) 그리고 정밀성(precision)으로 평가하였다. matrix effect는 forchlorfenuron이 겨자채에서 21.4%로 이온억제를 보였고 그 외의 성분은 ME (%) < ± 20 이내이었다. 매질을 보정한 검량선의 범위는 겨자채와 콩나물은 0.5-100 ng mL-1이며, 포도의 범위는 1-100 ng mL-1로 나타났고, 결정계수는 모두 0.99이상이었다. LOD와 LOQ는 겨자채에서 0.2-1.8 ng mL-1, 0.6-5.4 ng mL-1 포도에서 0.7-3.0 ng mL-1, 2.0-9.2 ng mL-1, 콩나물에서 0.2-2.6 ng mL-1, 0.7-7.8 ng mL-1을 나타내었다. 회수율의 범위는 겨자채 78.3-105.5%, 포도 72.3-103.8%, 콩나물 72.8-97.5% 이었다. 정밀도의 상대표준편차는 겨자채가 0.2-9.3%, 포도 0.4-8.9%, 콩나물 0.7-7.2% 이었다. 시중에 유통되는 농산물 68건을 수거하여 7종 생장조절제 동시분석법으로 잔류량을 분석하였다. 그 결과 paclobutrazol이 겨자채 등 채소류 20건에서 잔류허용기준 이내인 0.02-2.31 mg kg-1 검출되었고 그 외 농산물에서는 검출되지 않았다.
Abstract
Seven plant growth regulators applied with simultaneous determination are 2,4-dichlorophenoxyacetic acid, 6-benzylaminopurine, forchlorfenuron, gibberellin A3, paclobutrazol, thidiazuron and uniconazole. This study aimed to determine analytical method for the residual pesticide of seven plant growth regulators in agricultural products using modified QuEChERS method with ultra-performance liquid chromatography tandem mass-spectrometry (UPLC–MS/MS). The modified QuEChERS corresponds to the EN 15662 procedure and differs in the process of extracting 30 mL acetonitrile containing 1% formic acid in 5.0 g sample. As a result of method validation applied with three samples (mustard greens, grapes and bean sprouts), the matched calibration showed a good linearity within 5 concentration levels (r2 > 0.99). The limit of quantification (LOQ) ranged from 0.6 to 9.2 ng mL-1. The recovery at three spiked concentrations (10 ng mL-1, 50 ng mL-1 and 75 ng mL-1) ranged from 72.3% to 105.5% and relative standard deviations (RSD) were between 0.2% and 9.3%. As a result of applying the method to 68 samples collected from local markets, paclobutrazol was detected in 20 vegetables at the range of 0.02-2.31 mg kg-1 and other compounds were not detected.
Keywords:
LC-MS/MS, method validation, plant growth regulator, QuEChERS키워드:
LC-MS/MS, 분석법 유효성 검증, 식물생장조절제, QuEChERS서 론
식물생장조절제는 농약관리법 제2조 제1항에 의하면 농작물의 생리기능을 증진하거나 억제하는데 사용하는 약제로 농약의 범주에 속하며(KMGL, 2019), 살균제, 살충제, 제초제와 더불어 작물의 품질향상, 생력화 및 기상재해 경감 등 작물보호제로서 없어는 안될 중요한 자재로 자리 잡고 있다(Kang, 2001).
현재 국내 기준 등록된 농약은 살균제 153종, 살충제 189종, 제초제 139종, 식물생장조절제 19종이며(MFDS, 2019), 이 중 식물생장조절제는 작물보호제로 차지하는 비중이 적고 인체에 저독성이라는 평가로 인해 안전지대로 인식되어 있다. 그러나 우리나라의 경우 2017년 이후 식물생장조절제의 생산량이 증가하였으며(KCPA, 2019), 세계적으로도 식물생장조절제의 연평균 성장률이 2024년까지 8.5%로 예상되는 등 식물생장조절제의 사용은 증가되고 있다(Mordor Intelligence, 2019).
식물생장조절제는 농약의 사용목적에 따라 식물호르몬계와 비호르몬계로 구분할 수 있다. 식물호르몬계는 식물체내에 존재하는 호르몬이나 구조가 유사한 합성 호르몬으로 옥신(auxins), 시토키닌(cytokinis), 지베렐린(gibberellins) 그리고 에틸렌(ethylene) 발생제가 있다. 비호르몬계는 식물 생장에 영향을 주는 비호르몬성 합성물질로 에틸렌억제제, 생장억제제, 생장촉진제, 신장억제제로 분류된다(RDA, 2020).
식물생장조절제 중에서도 생장억제제로 사용되고 있는 paclobutrazol은 2008년 10월 소비자고발 방송 당시에 국내 사용 허가 전 농약으로 문제되었던 성분이다. 또 다른 생장억제제인 uniconazole은 현재까지 국내에 잔류허용기준이 미등록된 농약이지만 유통농산물 중에 검출되고 있다(Kim et al., 2013). 이외에도 2011년 5월 헤럴드경제신문은 중국에서 생장촉진제인 forchlorfenuron을 과도하게 사용하여 수박이 갈라짐을, 2014년 10월 먹거리X파일에서는 재배 기간이 짧은 콩나물에 시토키닌류인 6-benzylaminopurine 사용을 보도하는 등 식물생장조절제에 대한 잔류실태 및 안전성 확인이 필요하다.
또한 2,4-D 노출시 인축에 미치는 영향(Bukowska, 2006)등 식물생장조절제가 인간과 수생태에 잠정적인 위해 가능성을 언급하는 연구가 보고되고 있으므로(Erin et al., 2008; Wang et al., 2011; Wang et al., 2019) 식물생장조절제를 효율적으로 분석할 수 있는 잔류농약 동시분석법이 마련되어야 하며, 유통 중인 농산물의 잔류 실태 조사가 이루어져야 한다. 우리나라는 현재까지 잔류농약 동시다성분 분석법이 개정되고 분석 가능한 항목이 지속적으로 확대되고 있으나 식물생장조절제의 다성분분석법에 대한 연구가 부족하다.
본 연구에서는 현재까지 이슈되고 있거나 과용 우려가 높은 식물생장조절제 7종 2,4-dichlorophenoxyacetic acid, 6-benzylaminopurine, forchlorfenuron, paclobutrazol, gibberellin A3, thidiazuron 및 uniconazole을 선정하여 간편하면서도 유효성있는 동시다성분 분석을 확립하고자 하였다.
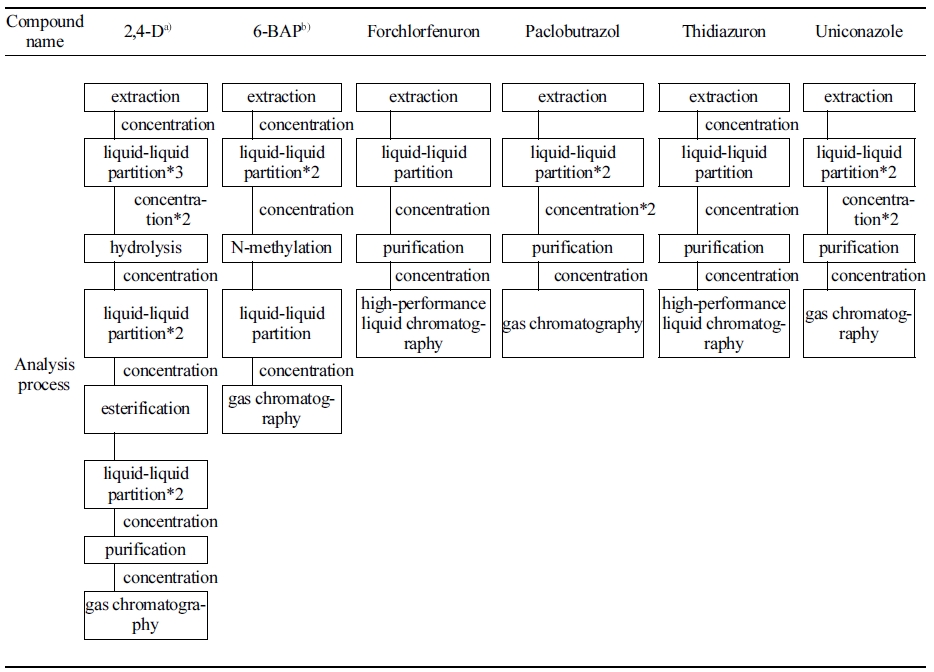
현재 식품공전 중 2,4-D 등 7종 식물생장조절제에 대한 단성분 분석법은 Table 1과 같으며 gibberellins 분석법은 고시되어 있지 않다. 6-BAP는 전처리시 유도체화 과정을 필요로 하는 등 개별 단성분 분석법은 반복적인 분배과정으로 많은 유기용매와 시간이 소요된다. 또한 단성분 분석법은 목적하는 성분 외에 다른 성분의 확인에 어려움이 있다. 이에 반해 QuEChERS (quick, easy, cheap, effective, rugged and safe) 방법은 적은 유기용매사용, 한번의 전처리로 다성분 추출이 가능하여 다성분 농약과 그 대사산물 분석에 많이 응용되고 있어 동시다성분 추출법으로 적합한 전처리법이라 할 수 있다(Kim, 2015; Kim et al., 2016; Zhang et al., 2019).
또한 전처리 후 결과확인은 gas chromatography (GC)나 liquid chromatography (LC)를 통하여 얻을 수 있는데 분석기기의 특성에 따라 별도의 전처리를 필요로 한다. 특히 2,4-D 성분은 분석능을 향상시키기 위해 가수분해 및 에스테르화 반응이 필요하므로 결과값을 확인하기까지 장시간을 필요로 한다. LC-MS/MS는 복잡한 전처리 없이 미량의 물질이라도 정량 가능하며 높은 감도와 특이성을 제공하므로 신속하고 효과적인 분석장비라 할 수 있다(Pan et al., 2010). 따라서 LC-MS/MS를 이용한 QuEChERS법 분석은 단시간 안에 동시다성분 분석이 가능하고 신뢰성과 신속성이 확보된 정량분석법이라 할 수 있으며, 미량의 성분 확인도 가능하여 식약처에서 제시한 농약 허용물질목록 관리제도 (PLS, positive list system)에 적합한 선제적인 분석 방법이라고 볼수 있다.
본 연구는 식물생장조절제 7종에 대하여 QuEChERS법을 응용하여 최적화 된 추출조건을 확인하고자 하였다. 적합한 추출조건을 확인 후 고감도 분석장비인 LC-MS/MS를 이용한 유효성 검증을 실시하여 정확성과 정밀성이 확보된 동시다성분 정량분석법을 확립하고 유통 중인 채소류와 과일류을 대상으로 식물생장조절제 잔류실태를 파악하여 국내 잔류농약 검사의 연구 자료로 제공하고자 한다.
재료 및 방법
표준품 및 시약
표준품 forchlorfenuron (순도 98.7%), 2,4-dichlorophenoxyacetic acid (순도 99.5%) 및 thidiazuron (순도 99.5%)은 Chem Service Inc. (West Chester, PA, USA)에서, paclobutrazol (순도 99.9%), gibberellin A3 (순도 98.6%)는 HPC Standard GmbH (Cunnersdorf, Germany)에서, uniconazole (순도 98.0%)은 Toronto Research Chemicals (Toronto, Ontario, Canada)에서 구입하였다. 표준원액은 잔류농약분석용 등급의 methanol (순도≥ 99.8%)(Kanto Chemical Co., Inc., Tokyo, Japan)로 희석하여 제조하였고 기기분석용 표준용액은 acetonitrile로 희석하여 0.5-100 ng mL-1 범위에서 사용하였다.
Acetonitrile (순도 ≥ 99.9%)은 농약분석용 등급으로 Carlo Erba Reagents S.A.S. (Milano, Italy) 제품을 사용하였고 formic acid (순도 ≥ 98%)는 Kanto Chemical Co., Inc. (Tokyo, Japan) 제품을 사용하였다. QuEChERS EN 1566법 적용을 위해 1차 추출시 사용한 KSO-8909 키트(4.0 g MgSO4, 1.0 g NaCl, 1.0 g sodium citrate tribasic dihydrate (SCTD), 0.5 g sodium citrate dibasic sesquihydrate (SCDS))와 1차에서 원심분리된 상등액의 방해물질을 제거하는 KSO-9508 키트(0.15 g endcapped C18 sorbent (C18E), 0.9 g MgSO4, 0.15 g primary/secondary amine (PSA))는 Phenomenex Inc. (California, USA) 제품을 사용하였다. LC/MS-MS용 이동상 용매로 증류수, methanol 그리고 formic acid는 LC/MS 등급의 Fisher Chemical (Geel, Belgium)제품을, ammonium formate (순도 > 99.0%)는 Sigma Aldrich Inc. (St. Louis, MO, USA) 제품을 사용하였다.
분석기기 및 장치
전처리과정에서 시료 블랜더(robot coupe blixer 5 plus, Vincennes, France)와 원심분리기 sorvall ST16 (Thermo Fisher Scientific Inc., Osterode, Germany)을 사용하였다.
분석장비로 ultra performance liquid chromatography (UPLC)는 Thermo Fisher Scientific사의 vanquish column compartment H (Germering, Germany)를 사용하였다. MS/MS는 전기 분무 이온화(electrospray ionization, ESI) 방식을 이용하는 TSQ 알티스 삼중 사극자 질량분석기로 Thermo Fisher Scientific사(San Jose, CA, USA)를 이용하였다. 컬럼은 Thermo Fisher Scientific사의 accucore aQ (2.1 × 100 mm, 2.1 μm, USA)로 사용하였고, 컬럼온도는 30oC를 유지하였다. 상세한 분석조건은 Table 2와 같다.
LC-MS/MS 이온화 조건
식물생장조절제 7종 성분의 LC-MS/MS 최적조건을 알아내기 위해 1 μg mL-1로 조제한 각각의 표준품을 10μL min-1 유속으로 주입하였다. 일정한 유속으로 주입된 성분이 안정화된 것을 크로마토그램으로 확인 후 분석성분의 이온화 모드 positive와 negative 조건을 확인하였다. 최적의 precusor ion을 선택한 후 스캔모드에서 collision energy값을 변경하면서 감도가 좋은 2개의 product ion을 선택하였다.
시료 전처리
시료를 블랜더로 균일하게 갈아 5.0g을 취하여 1% formic acid가 첨가된 acetonitrile 30 mL를 넣고 2분간 진탕하였다. 여기에 extraction kits 6.5 g을 넣고 2분간 격렬히 흔들어 주고 4oC, 5분 냉각 후 혼합물을 4000 rpm으로 5분간 원심분리 하였다. 상층액 6mL를 취하여 d SPE kits 1.2 g을 넣고 30초간 격렬히 혼합하고 4oC, 5분 냉각 후 4000 rpm으로 5분간 원심분리 하였다. 상등액을 0.2 μm nylon filter로 여과하여 LC-MS/MS 장비로 분석하였다.
분석법 유효성 검증
유효성 검증은 DG SANTE (2017)와 ICH (2005)를 근거로 하여 수행하였다. 매질효과(matrix effect, ME), 직선성(linearity), 검출한계(limit of detection, LOD), 정량한계(limit of quantification, LOQ), 정확성(accuracy)과 정밀성(precision)을 평가하였다(DG SANTE, 2017; ICH, 2005).
매질효과는 5단계 농도의 solvent calibration와 matrix-matched calibartion을 사용하여 확인하였다. 매질효과는 다음과 같이 계산하였다
검출한계와 정량한계는 공시료에 5단계 농도가 되도록 혼합표준용액을 첨가하여 5회 반복 실험한 회귀선 y절편의 표준편차와 검량선의 기울기를 이용하여 구하였다. LOD = 3.3SD / S로 LOQ = 10SD / S 식으로 계산하였다(SD : 회귀선 y절편의 표준편차, S : 검량선의 기울기).
정확성과 정밀성은 공시료에 3단계 농도(10 ng mL-1, 50 ng mL-1 and 75 ng mL-1) 수준이 되도록 혼합표준용액을 첨가하여 3회 반복 실험한 회수율과 상대표준편차로 평가하였다. 회수율은 첨가된 농도값에 대한 matrix matched calibration 측정값의 비율로 다음과 같이 계산하였다.
결과 및 고찰
LC-MS/MS 분석조건
표준용액을 이용하여 확인한 7종 식물생장조절제의 이온크로마토그램은 Fig. 1과 같고 MS/MS의 최적화 된 조건값은 Table 3과 같다
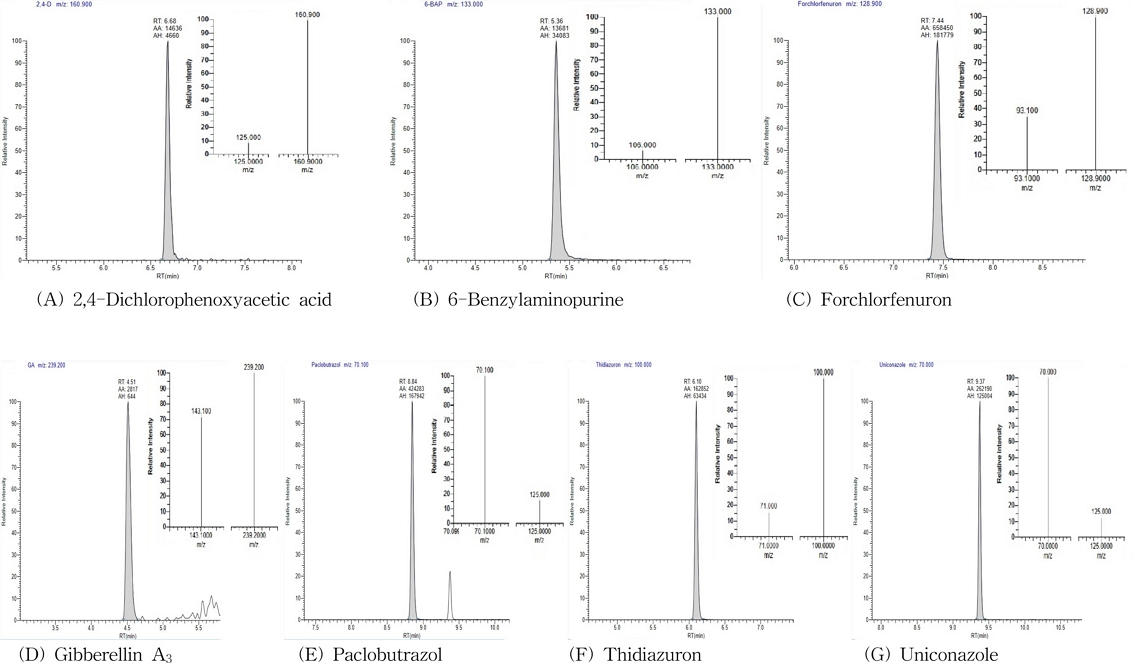
Selected reaction monitoring (SRM) analyzed with 5 ng mL-1 concentration of plant growth regulator standards.
추출용매 비교
10 g의 시료에 10 mL acetonitrile이 추출용매로 사용되는 QuEChERS법은 수분이 많은 포도 등 과일에는 적합한 시험법으로 알려져 있다(Brithish Standard, 2008). 하지만 위시험법은 상대적으로 수분함유량이 적은 엽채류의 경우 시료량에 비해 추출 용매량이 적어 효율이 떨어질 수 있다. 시료무게와 추출용매가 같은 비율인 QuEChERS법 보다 5.0 g을 30mL에 추출하는 방법으로 변경하여 추출효율을 향상시키고, 정밀성이나 정확성 오류의 원인이 되는 matrix effect 문제를 시료의 희석으로 줄이고자 하였다(Patel, 2011).
산성 농약성분의 경우 QuEChERS법에서 제시하는 acetonitrile보다 1% formic acid가 포함된 acetonitrile을 이용하여 추출하였을 경우 효율이 향상되었다는 보고가 있어(EURL-SRM, 2015) 두 가지 방법을 채소류 중에는 겨자채로, 과일류 중에는 포도로, 두채류 중에는 콩나물로 선정하여 추출효율을 비교하였다.
acetonitrile과 1% formic acid를 함유한 acetonitrile의 추출효율을 비교한 결과, 대부분 1% formic acid가 첨가된 acetonitrile 추출에서 안정된 추출효율을 나타내었다. 특히 2,4-dichlorophenoxyacetic acid는 acetonitrile을 추출용매로 사용했을 때 겨자채 3.79%, 포도 5.33%, 콩나물 1.83%로 낮은 추출효율을 나타내었다. 반면 1% formic acid가 포함된 acetonitrile로 추출하였을 경우 겨차채 102.26%, 포도 81.31%, 콩나물 100.01%의 추출효율을 나타내었다. 또한 gibberellin A3는 acetonitrile을 추출용매로 사용했을 때 모든 제품에서 추출되지 않았으나 1% formic acid가 포함된 acetonitrile로 추출하였을 때 겨자채 100.56%, 포도 85.94%, 콩나물 98.29%로 확연하게 향상된 추출률을 보였다(Table 4). 그러므로 1% formic acid를 첨가한 acetonitrile을 추출용매로 선택하고 유효성 검증을 실시하였다.
분석법 유효성 검증
시료별 식물생장조절제에 대한 매질효과는 Table 5와 같다. 매질을 보정한 검량선(matrix matched calibration)의 범위를 겨자채와 콩나물의 경우 0.5-100 ng mL-1 범위에서, 포도는 1-100 ng mL-1 범위에서 확인한 결과, 결정계수(determination coefficient, R2)는 모두 0.99 이상이었다.

Matrix-effect (ME) and determination coefficient (r2) of the seven plant growth regulators in mustard leaf, grape and bean sprout
LC-MS/MS분석은 식품 성분에 따라 matrix-effect를 받는 것으로 알려져 있다(Patel, 2011). 이는 분석물 추출시 기질에 포함된 지질, 단백질, 염 등이 동시에 용출되어 질량분석기 검출기에 도달하는 이온의 양이 감소하는 이온억제(suppression)와 반대로 증가하는 이온상승(enhancement) 현상이 나타날 수 있다(Moon et al., 2020). 본 연구방법에서는 매질효과가 겨자채에서는 forchlorfenuron이 21.4%로 이온억제효과가 크게 나타났으며 다음으로 uniconazole이 11.6%의 이온억제를 보였고 그 외 성분은 크게 영향을 받지 않는 것으로 나타났다. 반대로 포도에서는 이온상승효과가 GA3는 16.9%, 2,4-D는 15.1%로 나타났고, 콩나물에서는 이온상승이나 이온억제효과를 보이는 성분이 없는 것으로 확인되었다. 위 결과는 SANTE 가이드라인에서 제시한 ME (%) < ± 20 조건을 대부분 만족하였으나 겨자채에서 forchlorfenuron이 21.4%의 이온억제(suppression)를 보여 정량시 matrix matched calibration으로 확인하였다. Kim et al. (2016)의 결과와 비교해 볼 때 본 연구결과가 매트릭스 영향을 크게 받지 않는 이유는 추출을 위한 충분한 용매의 희석으로 인한 것으로 생각된다.
매질을 보정한 검량선(matrix matched calibration)의 직선성 범위는 겨자채와 콩나물은 0.5-100 ng mL-1이며, 포도의 범위는 1-100 ng mL-1이다. 검출한계는 겨자채에서 0.2-1.8 ng mL-1, 포도 0.7-3.0 ng mL-1, 콩나물 0.2-2.6 ng mL-1이었고, 정량한계는 겨자채가 0.6-5.4 ng mL-1, 포도 2.0-9.2 ng mL-1, 콩나물 0.7-7.8 ng mL-1을 나타내었다(Table 6).

Matrix matched linear range, LOD and LOQ of the seven plant growth regulators in mustard leaf, grape and bean sprout
정확도(accuracy)와 정밀도(repeatability)는 시료별 3단계 농도의 회수율과 상대표준편차를 통해 검증하였다. 회수율은 직선성의 범위내에서 모든 성분이 정량범위가 가능한 농도를 고려하여 3단계 농도로 선택하였다. 회수율을 3단계 농도로 3반복 분석한 결과, 저농도 10 ng mL-1는 겨자채 86.1-105.5%, 포도 73.7-103.8%, 콩나물 79.0-94.7% 이었다. 중간농도 50 ng mL-1는 겨자채 78.3-101.2%, 포도 72.3-93.6%, 콩나물 72.8-93.2% 범위였다. 고농도 75 ng mL-1는 겨자채 80.7-102.6%, 포도 78.1-96.2%, 콩나물 78.0-97.5%로 나타났다. 상대표준편차는 저농도 10 ng mL-1에서 겨자채 1.1-9.3%, 포도 2.0-7.5%, 콩나물 0.7-7.2% 범위였다. 중간농도 50 ng mL-1에서 겨자채 0.2-5.2%, 포도 1.1-8.9%, 콩나물 0.9-4.9% 이었다. 고농도 75 ng mL-1에서 겨자채 0.8-3.0%, 포도 0.4-2.2%, 콩나물 0.7-4.5% 이었다(Table 7). 이 결과는 SANTE 가이드라인에서 제시한 유효범위인 회수율 70-120%, RSD≤20%를 충족하였다.
잔류농약 실태조사
작물보호제 지침서에 따른 식물생장조절제 사용 대상 품목 중 겨자채 등 농산물 68건을 수거하여 7종 식물생장조절제 잔류량을 앞서 검토한 동시분석법으로 조사하였다. 7종중 paclobutrazol 1종만이 겨자채 등 3품목에서 잔류허용기준 이내로 검출되었다. 포도, 사과, 콩나물과 숙주나물에서는 7종 모두 검출되지 않았다(Table 8).
겨자채는 13건 중 11건에서 paclobutrazol이 0.05-2.31 mg kg-1 농도로 검출되었다. 케일은 13건 중 7건에서 0.12-1.10 mg kg-1 농도로 잔류하였다. 셀러리는 12건 중 2건에서 0.02 mg kg-1, 0.44 mg kg-1 검출되었다. 출하시기 조절이 가능하고 상품가치를 극대화하는 이점이 있는 paclobutrazol이다양한 농도범위로 검출되는 것은 살포시기나 살포량, 수확시기 그리고 기후 환경에 따른 영향으로 생각된다. Table 8의 결과에서 식물생장조절제 중 GA3나 2,4-D가 검출되지 않은 이유는 다른 농약에 비해 불안정한 특성으로 살포 후 단기일에 소실한 것으로 보이며, 잔류농약 허용기준이 없는 uniconazole은 과거 유통 전 검사로 검출된 제품의 신속한 행정 처리와 지속적인 모니터링으로 사용량이 줄어든 것으로 보인다. 또한 uniconazole의 대체제로 paclobutrazol의 사용이 증가함에 따라 uniconazole 사용이 감소된 것으로 추정된다.
이번 연구에서 paclobutrazol의 검출률이 겨자채의 약 80% 이상, 케일의 약 50% 이상으로 나타나 병충해가 상대적으로 심한 케일의 경우 농약의 잔류가 높다고 보도한 내용과 일치하는 결과를 보인다(EWG, 2019). 겨자채와 케일은 건강채소로 주목받고 있으며 착즙쥬스 원료 및 쌈채류로 소비되는 생식용 채소이다. 향후 생식용 채소류에 대한 식물생장조절제의 검사 범위를 확대하여 지속적인 모니터링을 실시하고 잔류량이 높은 경우 시민안전을 위한 관리정책이 필요하다. 특히 겨자채의 경우 농약 사용시 잎의 모양이 굴곡지고 거친 표면의 특성상 다른 채소보다 잔류량이 더 오래 지속될 가능성도 있으므로, 생산자를 대상으로 작물보호제의 적절한 살포량과 살포시기 등 정기적인 농약안전사용 교육도 실시되어야 한다.
Literate Cites
- Brithish Standard, 2008. Foods of plant origin-Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and cleanup by dispersive SPE-QuEChERS-method. BS EN 15662. London, U.K.
- Bukowska B, 2006. Toxicity of 2,4-Dichlorophenoxyacdtic acid-moleculr mechanisms. Polish J. of Environ. Stud. 15(3):365-374.
- Directorate General for Health and Food Safety (DG SANTE), 2017. Guidance document on analytical quality control and method validation procedures for pesticide residues and analysis in food and feed, SANTE/11813/2017. Fellbach, Germany.
-
Erin N, Afacan B, Ersoy Y, Ercan F, Balcı MK, 2008. Gibberellic acid, a plant growth regulator, increases mast cell recruitment and alters Substance P levels. Toxicology 254(1-2):75-81.
[https://doi.org/10.1016/j.tox.2008.09.020]

- EU Reference Laboratories for Residues of Pesticides Requiring Single Residue Methods (EURL-SRM), 2015. Analysis of Acidic Pesticides using QuEChERS (EN15662) and acidified QuEChERS method. Fellbach, Germany.
- Environmental Working Group (EWG), 2019. EWG’s 2019 Shopper’s Guide to Pesticides in Produce. https://www.ewg.org/foodnews/summary, , (Accessed Nov. 01, 2019).
- International Council for Harmonisation of Technical Requirements for Pharmaceutical for Human Use (ICH), 2005. Validation of Analytical Procedures : Text and Methodology Q2(R1).
- Ministry of Food and Drug Safety (MFDS), 2019. Standards and specifications of food No. 2019-31. Cheongju, Korea.
-
Moon SY, Choi HJ, Kim SR, Lee KH, Lee SG, et al., 2020. Recommendations for liquid chromatography-mass spectrometry in the clinical laboratory:Part II. Method validation. Leb Med Online. 10(2):95-108.
[https://doi.org/10.3343/lmo.2020.10.2.95]

- Mordor Intelligence, 2019. Plant growth regulators market growth, trends, and forecast (2019-2024). https://www.mordorintelligence.com/industry-reports/global-plant-growth-regulators-market-industry, , (Accessed Oct. 04, 2019).
- Kang CK, 2001. Current status and new trend in the development and registration of plant growth regulators. Korean J. of Hortic. Sci. Technol. 19(2):244-252.
- Korea Crop Protection Association (KCPA), 2019. Annual Pesticide Report. Seoul, Korea.
-
Kim EJ, Hong CK, Choi SJ, Lee YJ, Hwang IS, et al., 2013. Monitoring of uniconazole by using GC-ECD and GC-MSD. Korean J. Food Sci. Technol. 45(3):382-384.
[https://doi.org/10.9721/KJFST.2013.45.3.382]

- Kim KG, 2015. Optimization of simultaneous determination for Plant Growth Regulators (6-BA) and pesticides in bean sprouts by liquid chromatography-tandem mass spectrometry. MS thesis, Ghonnam National Univ., Jeollanam-do, Korea.
-
Kim KG, Park DW, Kang GR, Kim TS, Yang, YS, et al., 2016. Simultaneous determination of plant growth regulator and pesticides in bean sprouts by liquid chromatography-tandem mass spectrometry. Food Chem. 208:239-244.
[https://doi.org/10.1016/j.foodchem.2016.04.002]

- KMGL, 2019. Pesticide control act. National Law Information Center, Korea Ministry of Government Legislation. http://www.law.go.kr/lsInfoP.do?lsiSeq=206329&efYd=20190701#0000, (Accessed Oct. 04, 2019)
-
Pan X, Welti R, Wang X, 2010. Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatography-mass spectrometry. Nat. Protoc. 5(6):986-992.
[https://doi.org/10.1038/nprot.2010.37]

- Patel, D, 2011. Matrix effect in a view of LC-MS/MS: an overview. Int. J. Pharma Bio Sci. 2(1):559-546.
- Rural Development Administration (RDA), 2020. Classification by use of Pesticides, http://pis.rda.go.kr/spcltyinfo/agchmUndstand/agchm.do;jsessionid=wNcBaT1Rw34Tvh4dUJa1q8sg4o6uMff9p7r84jRdq6QXytdTybpKMYMYJ53Lt2AS.NAAS-AP2-mw1_servlet_engine7?menuCode=2_1_2, (Accessed Apr. 20. 2020).
-
Wang KS, Lu CY, Chang SH, 2011. Evaluation of acute toxicity and teratogenic effects of plant growth regulators by Daphnia magna embryo assay. J. of Hazard. Mater. 190(1-3):520-528.
[https://doi.org/10.1016/j.jhazmat.2011.03.068]

-
Wang W, Wang B, Liu Z, Xia X, 2019. Developmental toxicity and alteration of gene expression in zebrafish embryo exposed to 6-benzylaminopurine. Chemosphere 233:336-346.
[https://doi.org/10.1016/j.chemosphere.2019.05.261]

-
Zhang C, Deng Y, Zheng J, Zhang Y, Yang L, et al., 2019. The application of the QuEChERS methodology in the determination of antibiotics in food: A review. Trends Anal. Chem. 118:517-537.
[https://doi.org/10.1016/j.trac.2019.06.012]