콩씨스트선충(Heterodera glycines)과 반짝이콩씨스트선충(H. sojae)의 온도별 부화와 살선충 물질에 대한 알과 유충의 약제 반응 비교


초록
반짝이콩씨스트선충은 콩씨스트선충과 함께 우리나라 콩 재배지의 주요 식물기생선충이다. 본 연구는 두 선충의 온도별(20, 24, 28, 32°C) 부화양상을 뿌리 삼출물과 수돗물에서 비교 조사하였다. 또한 재배지 내에서 이들 두 선충이 혼재하여 발생하기 때문에 살선충 물질에 대한 약제반응을 알과 유충을 이용하여 조사하였다. 두 선충 모두 콩 뿌리 삼출물 처리에서 부화가 많이 되었다. 뿌리 삼출액 처리에서 반짝이콩씨스트는 24°C에서 가장 많은 부화가 이루어졌고, 콩씨스트선충은 32°C에서 가장 많은 부화가 이루어졌으나 수돗물 처리에서는 두 종 모두 28°C에서 부화가 가장 많이 이루어졌다. 두 씨스트선충에 대한 부화억제 활성은 살선충제(fluazaindolizine, fluopyram, fosthiazate, imicyafos)에서 높았고, 과산화수소 처리에서는 낮았으나 유충에 대한 살선충 활성은 fluazaindolizine 처리에서만 낮게 나타났다. 약제에 대한 두 선충간 약제반응 차이는 살선충 활성이 낮은 fluazaindolizine 처리에서만 차이를 보였다. 반짝이콩씨스트선충과 콩씨스트선충이 혼재하는 콩 재배지에서 한 종의 선충에 대해 부화억제와 살선충 활성이 높은 살선충 물질 처리로 두 종에 대한 동시 방제가 가능할 것으로 생각된다.
Abstract
White soybean cyst nematode, Heterodera sojae and soybean cyst nematode, H. glycines, are major plant parasitic nematodes of soybean cultivation area in Korea. In this study, the hatching patterns of two nematodes at each temperature (20, 24, 28, and 32°C) were investigated in root exudate and tap water. In addition, since these two nematodes are mixed in the cultivation area, the nematicidal activities of the 4 commercial nematicides and one hydrogen peroxide solution against eggs and juveniles were compared between the two cyst nematodes in laboratory. Both nematodes were more highly hatched in the soybean root exudate than the tap water treatment. In the soybean root exudate treatment, H. sojae and H. glycines hatched best at 24°C and 32°C, respectively. In comparison, in the tap water treatment, both species hatched best at 28°C. The 4 commercial nematocidies such as fluazaindolizine, fluopyram, fosthiazate, and imicyafos highly inhibited the egg hatching of the two nematodes, but the egg hatching inhibitory activity of hydrogen peroxide was low. In the case of juvenile mortality, all test materials except fluazaindolizine showed strong activity against the two nematodes. The nematocidal effect between the two nematodes on the tested materials was different only in fluazaindolizine treatment, which had low nematicidal activity. Therefore, it is thought that two kinds of nematodes (H. sojae and H. glycines) can be controlled at the same time by treatment with nematicides effective for one kind of nematode in soybean cultivation areas where these two nematodes are mixed.
Keywords:
Bioassay, Cyst nematode, Hatching inhibition, Nematicidal activity, Soybean키워드:
생물검정, 씨스트선충, 부화억제, 살선충, 콩서 론
전세계적으로 20,000여종 이상의 선충들 중 약 20% 정도인 4,000여종이 식물기생선충으로 알려져 있는데 이들에 의한 경제적 손실은 년간 1,180억 달러로 추산되고 있다(Weischer and Brown, 2000; Atkinson et al., 2012). 다양한 식물기생선충들 중 Heterodera와 Globodera속의 씨스트선충은 경제적 측면이나 학문적 측면에서 뿌리혹선충 다음으로 중요한 선충으로 인식되고 있다(Jones et al., 2013).
씨스트선충류들 중에서 콩씨스트선충(Heterodera glycine)과 감자씨스트선충(Globodera pallida와 G. rostochinensis), 곡물류씨스트선충(H. avenae와 H. filipjevi)이 가장 피해를 많이 주는 종으로 알려져 있다(Jones et al., 2013). 이들 중 콩씨스트선충은 1915년 일본에서 처음 기록 된 이래 우리나라, 중국, 대만, 러시아와 같은 구대륙을 비롯하여 미국, 캐나다, 아르헨티나, 브라질, 콜롬비아 등 온대와 아열대지역에 널리 분포하고 있는데(Bridge and Starr, 2010) 특히 미국의 콩 재배지에서 경제적 손실을 가장 많이 입히는 요인으로 미국 내 2 8개 주에서 콩에 발생하여 피해를 주는 병해에 의한 수량 손실 조사에서 2003년에는 전체 병에 의한 수량 손실의 30.7%인 2,906,681톤이 콩씨스트선충에 의한 피해로 추산되었고, 2004년에는 전체 수량 손실의 28.2%인 3,472,306톤의 수량 손실이 추산되었다(Wrather and Koenning, 2006).
콩씨스트선충은 우리나라 콩 재배지에서도 가장 문제시 되는 선충으로 Choi and Choi (1983)에 의하면 경북과 충북의 15개시도 71개 콩 포장에서 8과 14속 18종의 식물기생선충이 검출되었는데 콩씨스트선충의 검출율이 충북지역 70%, 경북지역 50%로 우점종으로 보고하였고, Kim et al. (2013)이 전국의 콩밭에서 274점의 토양을 채취하여 식물기생선충 밀도 조사 시 콩씨스트선충의 검출율이 3 8%로 우점 하였고, 밀도도 높아 중요도 1급으로 구분하였다. 그리고 우리나라에서도 콩씨스트선충의 발생이 많은 포장에서는 적은 발생밀도를 보이는 포장에 비해 콩 수량이 70%가 감소된다는 보고가 있어(Choi and Choi, 1983) 우리나라 콩 재배지에서도 실제적 수량 손실을 가장 많이 유발 시키는 요인으로 인식되고 있다.
한편 콩에 기생하여 피해를 주는 새로운 씨스트선충인 반짝이콩씨스트선충(H. sojae)이 2016년 우리나라의 콩밭에서 처음 발견된 이후 강원과 충북지역 콩밭 조사에서 콩씨스트선충 검출율은 각각 10.4%와 10.7%를 나타내었고(Kim and Lee, 2019), 전국단위에서는 943개소 콩밭 토양 시료들 중 27.7%인 95개소 토양에서 반짝이콩씨스트선충이 확인 되었다(Kang et al., 2020). 또한 우리나라 콩밭에서는 기존에 알려진 콩씨스트선충과 반짝이콩씨스트선충이 혼재하는 포장도 6.1%에 달하고 있어(Kang et al., 2020) 두 선충에 의한 피해가 혼재하고 있는 실정이다.
우리나라 콩밭에서는 씨스트선충은 물론이고, 뿌리혹선충과 뿌리썩이선충과 같은 방제가 필요한 식물기생선충이 발생하여 피해를 주고 있음에도 불구하고(Kim et al., 2013), 선충류를 대상으로 한 적극적인 방제를 하고 있지 않아 콩에 등록되어 있는 살선충제도 부재한 실정이다(KCPA, 2020). 그리고 반짝이콩씨스트선충은 분류적 연구만 수행되어 피해나 생태에 대한 전반적인 연구가 필요한 실정이다.
따라서 본 연구는 우리나라 콩 재배지에 콩씨스트선충과 혼재하여 발생하고 있는 반짝이콩씨스트선충의 부화 생태를 알아보기 위하여 온도에 따른 부화반응을 조사하였다. 또한 콩이라는 동일 기주에 피해를 주는 두 선충이 공존하고 있는 상황에서 기존에 살선충제로 이용되거나 살충효과를 가지는 물질의 선충간 약효를 비교하여 동일 살선충제 처리에 의한 두 선충의 동시 방제 가능성을 알아보기 위하여 알과 유충에 대한 약제 반응을 조사하였다.
재료 및 방법
씨스트선충의 분리 및 씨스트 선별
시험에 사용된 두 씨스트선충은 강원과 충북지역의 콩씨스트선충 조사 선행연구(Kim and Lee, 2019)에서 고밀도로 감염이 확인 된 포장의 토양을 채취하여 실내에서 분리 하였는데 콩씨스트선충은 충북 단양군 대강면 직티리 241-2의 콩 재배지에서 분리하여 사용하였으며 반짝이콩씨스트선충은 강원도 홍천군 서석면 구룡령로 2252의 콩 재배지에서 분리하여 사용하였다.
채취한 토양을 지퍼백 내에서 2분간 흔들어 골고루 섞은 후 3 00 cc의 토양을 덜어내어 10 L 비커에 넣고, 수돗물을 5 L 분수한 뒤 나무막대로 10초간 골고루 젓고, 20, 60mesh 체를 이용하여 걸러내었다. 씨스트는 60mesh 체를 통과하지 못하기 때문에(Doney et al., 1970) 직경 8 cm유리깔때기에 직경 150mm 여과지(ADVANTEC #2)를 부착하고, 60 mesh 체에 있는 고형물을 부은 후 해부현미경(Nicon SMZ1000, Japan) 하에서 씨스트를 분리하였다.
각 씨스트는 씨스트 내부에 있는 알이 부화되어 빈 상태로 남아있는 것과 알이 차있는 씨스트가혼재되어 있기 때문에 알이 차 있는 건전한 씨스트만을 사용하였다. 콩씨스트선충과 반짝이콩씨스트선충의 씨스트 구분은 반짝이콩씨스트선충의 미부 끝부분이 콩씨스트선충에 비해 매끈하게 보이는 차이를 이용하여 구별하였다(Kang et al., 2016).
씨스트선충의 온도별 부화 양상 조사
씨스트선충의 부화는 물과 뿌리 삼출액에서 부화 양상에 따라 네 가지 그룹으로 대별할 수 있는데 콩씨스트선충은 뿌리 삼출액에서 부화가 잘되고, 물에서는 보통 정도의 부화를 보이는 그룹에 해당된다(Perry, 2001; Moens et al., 2018). 하지만 반짝이씨스트선충의 경우 이러한 정보가 없어 두 종 모두 온도별 부화율 검정에 사용된 씨스트는 콩뿌리 침출수를 사용하여 부화시켰다. 콩 뿌리 침출수는 충북 단양에서 파종 후 60일 된 대원콩을 뿌리와 함께 채취하여 물에 씻어 흙을 제거 한 다음 물 1 L에 약 40개의 콩 뿌리가 잠기도록 하여 24시간 동안 담가두었다. 24시간 후 깔때기에 여과지를 깔고, 침출수를 부어 부유물 및 잔여물을 제거한 뒤, 냉장고에 보관하면서 시험에 사용하였다(Kim et al., 2016).
두 씨스트선충의 부화양상 조사는 15ml 코니칼튜브(Conical tube, SPL, Korea)의 뚜껑부분을 12 well multi-well plate (Multi-well plate, SPL, Korea)의 각 well에 들어 갈 수 있게 뚜껑을 포함하여 자른 후 뚜껑을 열고, 씨스트가 통과할 수 없는 미세한 망을 씌운 다음 다시 뚜껑을 닫아 작은 채를 만들어 사용하였다(Kim et al., 2016).
콩씨스트선충과 반짝이콩씨스트선충 두 종의 씨스트를 각각 5개씩 작은 채에 넣은 상태로 각 well에 넣고, 콩뿌리침 출수를 1.5ml씩 채워주었다. 대조구는 수돗물을 처리하였고, 처리한 multi-well plate는 빛이 들어가지 않게 가정용 알루미늄호일(Lotte Alminum Co., Korea)을 씌워 20, 24, 28, 32°C의 식물생장상(HB 303 DH-0, Han Baek, Korea)에 보관하였다. 부화유무는 매일 해부현미경(Nicon SM1000, Nikon) 하에서 조사하였는데 알에서 부화 된 유충의 수를 21일 동안 수행하였다. 부화가 개시되는 시점부터 매일 새로운 plate에 뿌리 침출수나 수돗물을 채우고, 씨스트가 놓여 있는 작은 체만 건져 올려 새로이 각 well에 넣고, 동일온도 조건에 두었다. 한 개의 well을 한 반복으로 4반복 처리하였다.
씨스트선충의 약제 반응 비교
두 씨스트선충의 부화와 유충 치사에 미치는 영향을 알아보기 위하여 살선충제 4종(fluazaindolizine, fluopyram, fosthiazate, imicyafos)과 선행연구에서 살선충 활성이 높았던 과산화수소수를 사용하였다(Lee et al., 2019) (Table 1). 시험물질들 중 살선충제 4종은 시중의 농약 판매점에서 구입하여 사용하거나 회사로부터 입수하여 사용하였고, 과산화수소는 온실에서 소독용으로 사용하고 있는 농자재(HUWA-SAN TR-5, Roam Technology, Belgium)를 이용하였다. 처리 농도는 선충류에 대한 추천농도에서 수행하였으며 과산화수소는 농자재로 사용 될 때의 권장 농도로 처리하였다.
부화억제 효과검정은 앞서 씨스트선충의 부화양상 조사와 동일한 방법으로 12 well multi-well plate에 15 ml 코니칼튜브를 이용하여 만든 체를 이용하여 수행하였다. 15 ml 코니칼튜브로 만든 작은 체 위에 각 5개의 씨스트를 넣은 후 12 well multi-well plate의 각 well에 삽입 하였다. 여기에 전술한 콩 뿌리 삼출액 1ml와 각 실험물질 1 ml를 넣어준 후, 빛이 들어가지 않게 가정용 알루미늄 호일을 씌워 25°C 식물생장상에 보관하면서 24시간 간격으로 조사하였다. 온도별 두 선충의 부화반응의 결과를 기반으로 콩씨스트선충은 12일동안 반짝이콩씨스트선충은 29일까지 해부현미경 하에서 부화한 유충의 수를 조사하였다. 매 조사 시 마다 체를 들어내어 새로운 plate로 옮겨 침출액과 실험물질을 새것으로 갈아주었으며 기존의 well에 담겨있는 유충수를 조사하였다. 실험은 하나의 well을 한 반복으로 4반복으로 수행 하였다.
콩 뿌리 침출액에서 부화시킨 씨스트선충의 유충을 250 ml 비이커에 담아 교반기(CORNING PC-420D, LABORATORY STIRRER, USA)에서 75 rpm으로 100마리/ml의 밀도가 되도록 만든 다음 12 well multi-well plate의 각 well에 1ml씩 넣고, 각 실험물질을 1ml씩 처리하였다. 이때 접종한 선충 현탁액과 처리 물질이 고루 섞이도록 피펫을 이용하여 섞어 주고, 빛이 들어가지 않게 가정용 알루미늄 호일을 씌운 뒤 25°C 식물생장상에 보관하면서 24, 48, 72시간 후에 해부현미경 하에서 선충의 치사여부를 조사하였다. 치사여부는 유충의 몸체를 핀으로 자극하였을 때 아무런 반응이 없는 경우를 죽은 것으로 간주하였고, 한 개의 well을 한 반복으로 4반복 수행 하였다.
통계분석
온도별 부화 유충수 조사 결과는 부화한 누적 선충수의 평균간 차이를 온도별로 Tukey’s Studentized Range (HSD) Test를 이용하여 분산분석 하였으며 동일 온도 내에서 두 선충간 부화율 차이나 뿌리 침출액과 물에서 부화율 비교는 Tukey’s Studentized Range (HSD) Test를 이용하여 분산분석 하였고(PROC ANOVA, SAS 9.3 user’s guide, 2011), 각 온도대에서 두 선충간 부화율 변화 차이는 repeated measured ANOVA(PROC GLIMMIX, SAS 9.3 user’s guide, 2011)분석하였다. 각 살선충 물질에 대한 부화억제율과 치사율 차이도 처리 평균간 차이를 Tukey’s Studentized Range (HSD) Test를 이용하여 분산분석 하였으며 동일 시험물질 처리 내 두 선충 종간 부화억제율과 치사율 차이도 Tukey’s Studentized Range (HSD) Test를 이용하여 분산분석 하였다(PROC ANOVA, SAS 9.3 user’s guide, 2011). 모든 자료는 평균 ± 표준편차로 표기하였다.
결 과
씨스트선충의 온도별 부화 양상 조사
콩뿌리 삼출물과 수돗물에서 두 씨스트선충의 온도별 부화 양상을 조사한 결과 씨스트 침지액의종류나 온도별에 따라 부화에 차이가 있었으며 선충의 종에 따라서도 차이를 보였다(Fig. 1, 2, Table 2, 3).
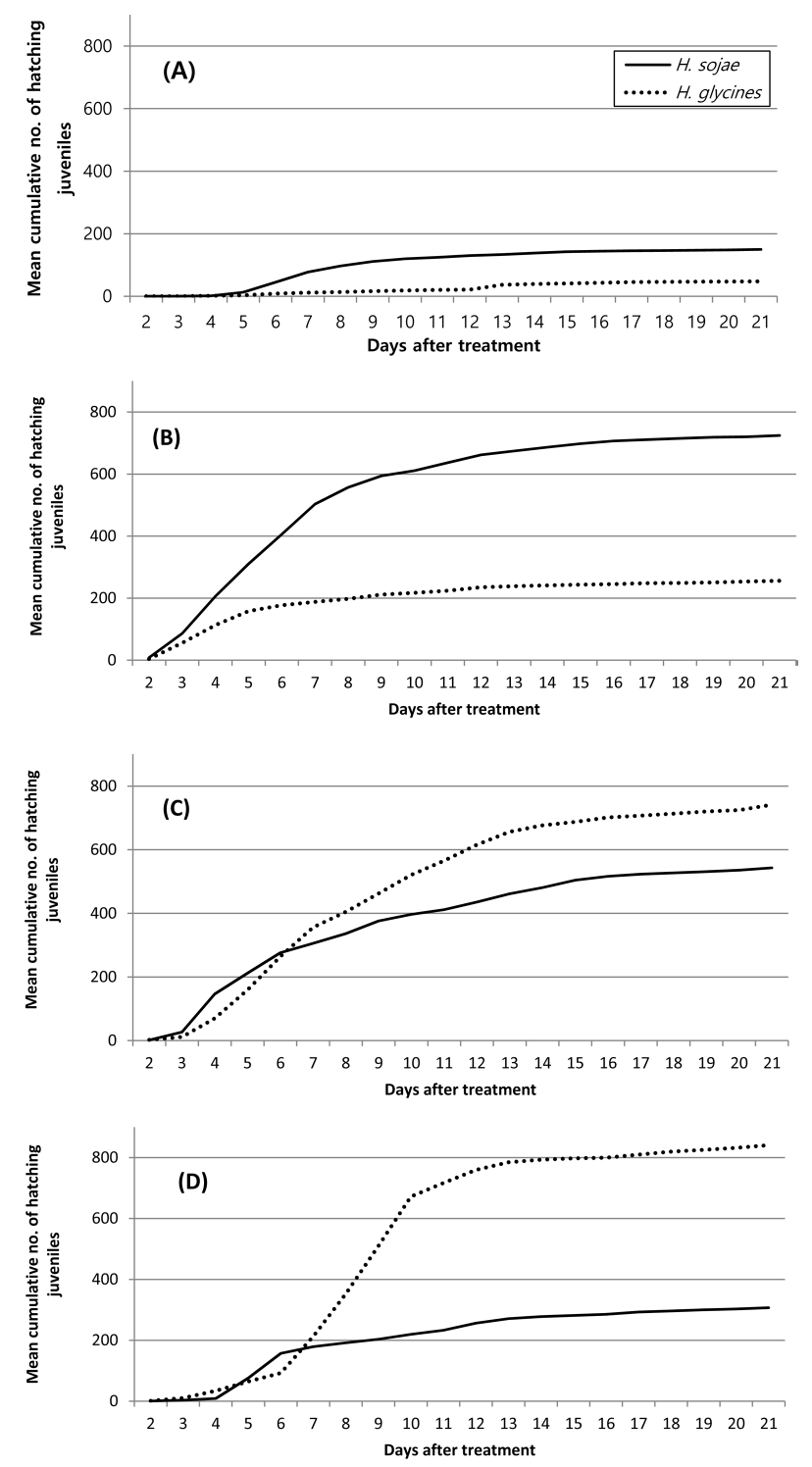
Daily cumulative number of hatching juveniles of Heterodera glycine and H. sojae according to temperature in soybean root exudate solution. (A); 20°C, (B); 24°C, (C); 28°C, (D); 32°C. Investigation of hatching juvenile was confirmed by immersing the cyst in the root exudate in a multi well plate.
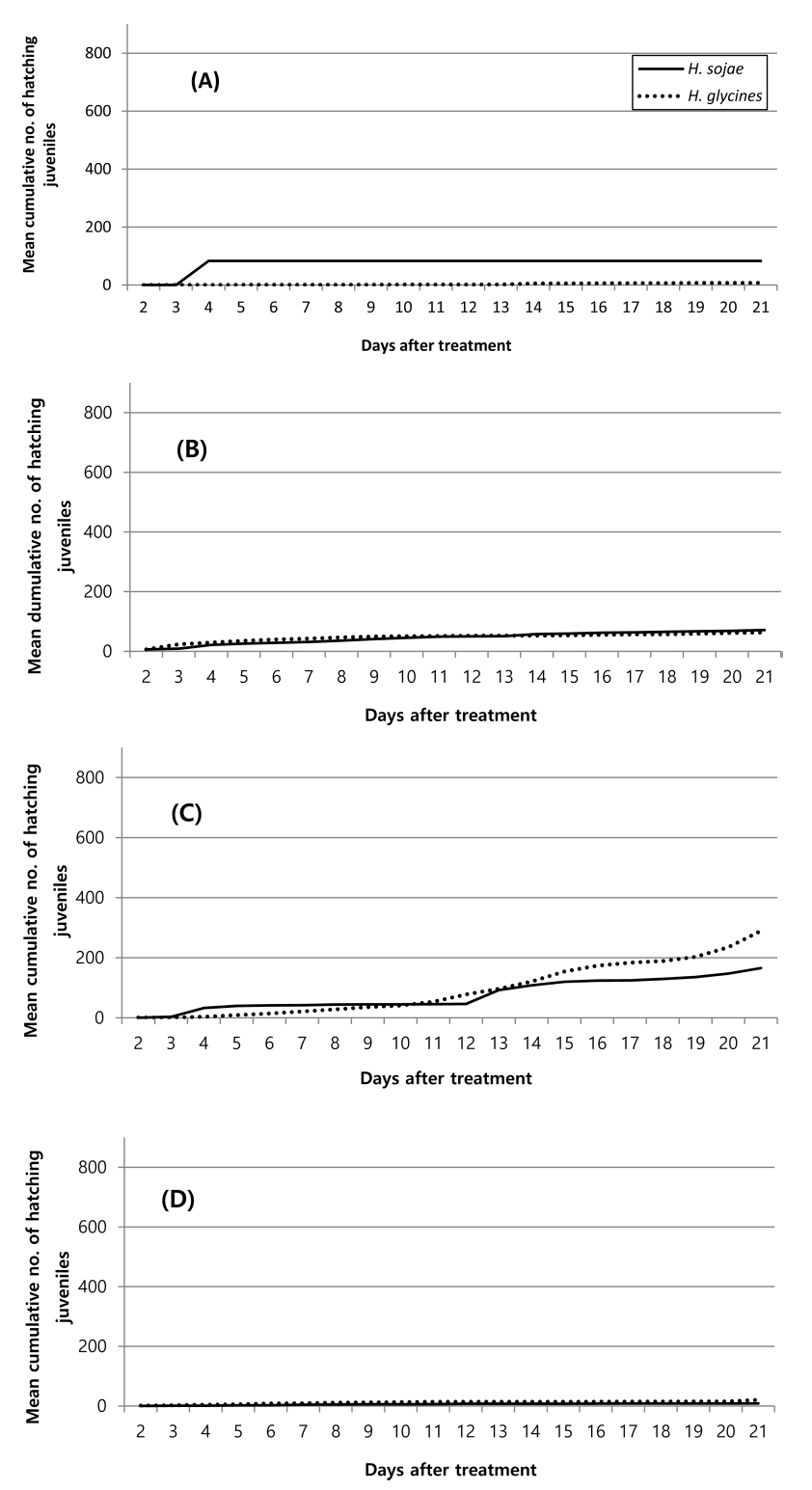
Daily cumulative number of hatching juveniles of Heterodera glycine and H. sojae according to temperature in water. (A); 20°C, (B); 24°C, (C); 18°C, (D); 32°C. Investigation of hatching juvenile was confirmed by immersing the cyst in the water in a multi well plate.

Cumulative number of hatched juveniles of Heterodera glycine and H. sojae according to temperature in soybean root exudate solution

Cumulative number of hatched juveniles of Heterodera glycine and H. sojae according to temperature in water
콩 뿌리 삼출물 침지가 수돗물 침지에 비하여 두 선충 모두 누적부화 유충수가 많았다(Fig. 1, 2). 이러한 차이는 선충의 종류나 온도별에 따라 차이를 보였는데 반짝이콩씨스트선충의 경우 20°C를 제외하고는 7일(24°C; df=1, 6, F=11.43, P<0.0148, 28°C; df=1, 6, F=13.48, P<0.0140, 32°C; df=1, 6, F=35.19, P<0.0001)과 14일(24°C; df=1, 6, F=22.61, P<0.0031, 28°C; df=1, 6, F=17.83, P<0.0055, 32°C; df=1, 6, F=31.16, P<0.0014), 20일(24°C; df=1, 6, F=26.47, P<0.0021, 28°C; df=1, 6, F=11.45, P<0.0148, 32°C; df=1, 6, F=28.51, P<0.0018) 후에 통계적으로 유의하게 뿌리 삼출물 처리에서 누적 부화유충수가 많았다(Table 2, 3). 반면 콩씨스트선충의 경우 온도별에 따라 양상에 차이가 있었는데 20°C와 24°C의 경우 뿌리 삼출물과 수돗물 침지간 누적 부화유충수에 통계적 차이가 없었으나 28°C와 3 2°C에서는 7일차(28°C; df=1, 6, F=23.37, P<0.0029, 32°C; df=1, 6, F=38.12, P<0.0008), 14일차(28°C; df=1, 6, F=95.29, P<0.0001, 32°C; df=1, 6, F=125.11, P<0.0001), 20일차(28°C; df=1, 6, F=19.5, P<0.0045, 32°C; df=1, 6, F=115.22, P<0.0001) 모두 뿌리 삼출액 침지 처리에서 누적 부화유충수가 통계적으로 유의하게 많았다(Table 2, 3).
선충 종간 누적부화 유충수도 차이를 보였는데 온도와 씨스트 침지물 종류에 따라 차이를 보였다(Table 2, 3). 수돗물침지 처리에서는 20°C의 경우 선충 종별로 부화율에 차이가 있었고(df=1, P=0.0001), 날짜별(df=19, P=0.5257)로나 두 변수간 교호작용은 없었다(df=19, P=0.6871)(Fig. 2A). 20°C의 날짜별로는 7일차(df=1, 6, F=8.12, P<0.0292), 14일차(df=1, 6, F=7.24, P<0.036), 20일차(df=1, 6, F=6.82, P<0.04) 조사에서만 반짝이콩씨스트의 누적부화 유충수가 콩씨스트선충에 비하여 통계적으로 유의하게 많았다(Table 3). 24°C에서는 날짜별로는 차이가 있었으나(df=19, P=0.0003) 선충 종별이나(df=1, P=0.7221) 두 변수간 교호작용은 없었다(df=19, P=1)(Fig. 2B). 28°C에서는 24°C처럼 날짜별로는 차이가 있었으나(df=19, P=0.0001) 선충 종별이나(df=1, P=0.2321) 두 변수간 교호작용은 없었다(df=19, P=0.9965)(Fig. 2C). 32°C에서는 선충 종별과(df=1, P=0.0001) 날짜별로 차이가 있었으나(df=19, P=0.0032) 두 변수간 교호작용은 없었다(df=19, P=0.9998)(Fig. 2D).
뿌리 삼출액 처리에서는 20°C와 24°C에서는 반짝이콩시스트선충의 누적 부화수가 콩씨스트선충에 비하여 많았으나 28°C와 3 2°C에서는 반대의 경향을 보였다(Table 2). 20°C에서는 선충 종별이나(df=1, p=0.0001) 날짜별로 차이가 있었으며(df=19, P=0.0001) 두 변수간 교호작용도 있었다(df=19, P=0.0001)(Fig. 1A). 24°C에서는 선충 종별이나(df=1, p=0.0001) 날짜별로 차이가 있었으나(df=19, P=0.0001) 두 변수간 교호작용은 없었다(df=19, P=0.4797)(Fig. 2B). 28°C에서도 24°C와 같이 선충 종별이나(df=1, p=0.0001) 날짜별로 차이가 있었으나(df=19, P=0.0001) 두 변수간 교호작용은 없었다(df=19, P=0.153)(Fig. 2CB). 32°C에서는 선충 종별이나(df=1, p=0.0001) 날짜별로 차이가 있었으며(df=19, P=0.0001) 두 변수간 교호작용도 있었다(df=19, P=0.0001)(Fig. 1D).
뿌리 삼출액 침지 처리에서는 처리 14일차에는 모든 온도에서 부화율에 통계적 차이를 보였으나(20°C; df=1, 6, F=11.17, P<0.0156, 24°C; df=1, 6, F=6.81, P<0.0402, 28°C; df=1, 6, F=6.69, P<0.0414, 32°C; df=1, 6, F=11.17, P<0.0009) 7일차에는 20°C에서만 통계적 차이를 보였고(df=1, 6, F=8.12, P<0.0292), 20일차에는 20°C(df=1, 6, F=11.56, P<0.0145), 24°C(df=1, 6, F=7.61, P<0.0329), 32°C(df=1, 6, F=31.8, P<0.0013)에서 통계적 차이를 보였다(Table 2).
온도별로는 콩씨스트선충의 경우 수돗물 침지에서는 14일차(df=3, 12, F=4.03, P<0.0338)와 20일차(df=3, 12, F=3.66, P<0.0441) 모두 28°C에서 누적 부화유충수가 가장 많았으며(Table 3) 뿌리 삼출액 처리에서는 7일차에는 24°C(df=3, 12, F=6.01, P<0.0097), 14일과(df=3, 12, F=28.14, P<0.0001), 20일차(df=3, 12, F=28.84, P<0.0001)에는 3 2°C에서 부화유충수가 가장 많았으나 두 온도간 통계적 차이는 없었다(Table 2). 반짝이콩씨스트선충의 경우 7일차에는 20°C에서 누적 부화유충수가 가장 많았고, 14일과 20일차에는 28°C에서 누적 부화유충수가 가장 많았으나 통계적 유의성은 없었다(Table 3). 뿌리 삼출액 처리에서는 7일(df=3, 12, F=5.29, P<0.0148), 14일(df=3, 12, F=9.24, P<0.0019), 20일(df=3, 12, F=9.38, P<0.0018) 모두 24°C에서 누적 부화유충수가 가장 많았다(Table 2).
씨스트선충의 약제 반응 비교
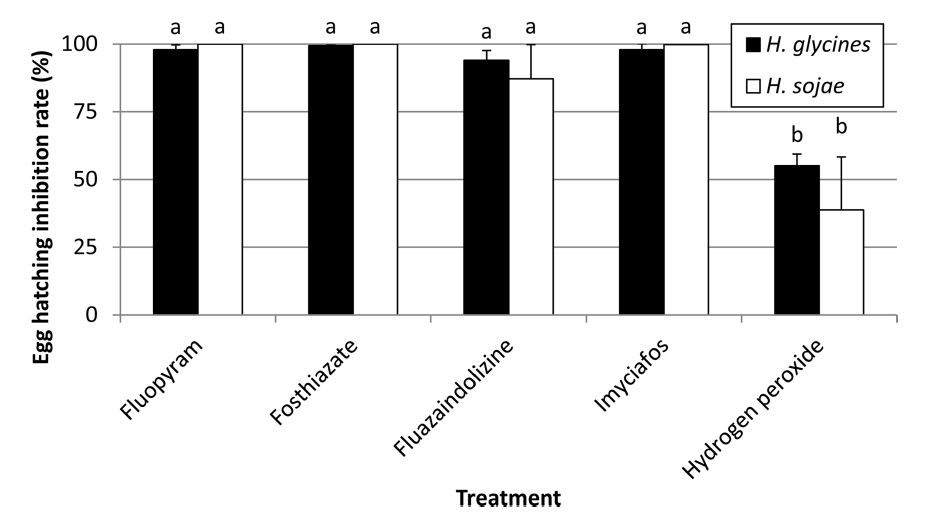
네 종류의 살선충제와 과산화소수에 대한 두 씨스트선충의 부화억제 효과검정 결과는 Fig. 3, 4와 같았다. 두 선충 모두 과산화수소 처리에서 부화억제가 낮게 나타났고, 살선충제들의 경우 fluazaindolizine처리에서 적은 수의 부화가 있었으나(Fig. 3) 처리 12일차까지 부화 유충수를 무처리구와 비교한 부화억제율은 살선충제들간에 통계적으로 차이가 없었다(Fig. 4)(df=9, 30, F=32.97, P<0.0001). 두 씨스트선충에 대한 부화억제율은 살선충제나 과산화수소 모든 처리에서 차이가 없었다(Fig. 4).
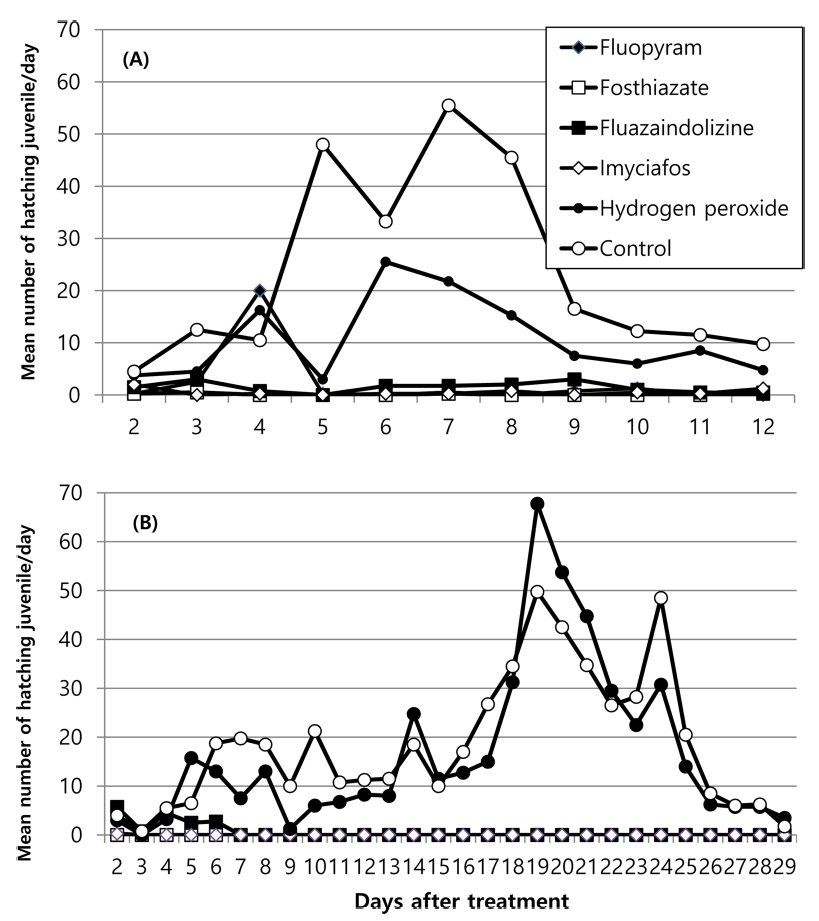
Mean number of hatching juveniles of Heterodera glycines (A) and H. sojae (B) recovered from cyst treated with nematicidal materials with soybean root exudate in multi well plate.
두 씨스트선충 부화유충에 대한 살선충제와 과산화수소의 살충율은 처리간에 차이가 있었는데 fluazaindolizine처리에서 두 선충 모두 낮은 치사율을 보였다(Table 4). 두 선충간 약제반응은 fluazaindolizine처리에서 반짝이콩씨스트선충의 보정사충율이 콩씨스트선충에 비하여 높게 나타났는데 처리 48시간 후(df=1, 6, F=58.01, P<0.0003)와 72시간 후(df=1, 6, F=74.38, P<0.0001)에는 통계적 유의성을 보였다(Table 4).
고 찰
선충의 기본적인 생활사를 이해하는 것은 학문적 부분이나 방제와 같은 실용적 측면에서 중요하다(Masler and Perry, 2018). 반짝이콩씨스트선충에 대한 생활사에 관한 연구는 전혀 이루어지지 않아 본 연구에서는 온도별에 따른 부화 생태를 우선 조사하였다. 선충은 변온동물이기 때문에 온도는 부화에 중요한 요인으로 관여한다(Masler and Perry, 2018). 콩씨스트선충은 온대지역에 서식하는 선충으로 15°C 이하나 33°C 이상에서는 발육하지 않는 것으로 알려져 있어(Moens et al., 2018) 본 연구에서도 이러한 점을 고려하여 부화에 미치는 온도를 20°C에서 32°C로 설정하여 조사하였는데 두 종간 온도반응에 큰 차이를 보였다. 반짝이콩씨스트선충은 24°C를 정점으로 이보다 낮은 온도나 높은 온도대에서는 부화가 감소하였지만 콩씨스트선충은 20°C에서 32°C로 온도가 높아짐에 따라 부화수가 온도의존적으로 높아지는 경향을 보였다. 즉 콩씨스트선충은 28°C와 32°C의 상대적으로 높은 온도대에서는 반짝이콩씨스트선충에 비하여 부화가 많이 된 반면 반짝이콩씨스트선충은 24°C에서 콩씨스트선충에 비하여 현저히 많은 부화가 이루어졌고, 20°C에서도 콩씨스트선충에 비하여 부화수가 많아 전체적으로 반짝이콩씨스트선충은 24°C에서 부화가 가장 왕성히 이루어지고, 콩씨스트선충은 32°C에서 부화가 가장 왕성하였다. 또한 부화 유충수뿐만 아니라 두 선충의 부화가 가장 많이 이루어지는 온도대에서 부화가 정점에 이르게 되기 직전까지의 부화양상도 24°C에서의 반짝이콩씨스트선충과 32°C에서 콩씨스트선충이 유사한 경향을 보였다.
콩씨스트선충의 부화온도에 관해서는 연구자들에 따라 차이를 보이고 있는데 Slack and Hamblen (1961)은 16°C나 36°C에서는 부화가 이루어지지 않는다고 하였으나 Tefft et al. (1982)은 콩씨스트선충 race 3을 증류수를 이용하여 실험한 결과 16°C부터 36°C까지 부화가 이루어졌고, Alton and Schmiti (1988)는 콩씨스트선충 race 1을 증류수를 이용한 실험에서 난 발육은 15°C부터 3 0°C까지 이루어졌으나 10°C에서는 1령충까지만 발육하였고, 36°C에서는 치사되었다고 하였으며 부화는 20°C에서 30°C까지만 이루어지고, 36°C에서는 되지 못하였다. 본 연구에서는 콩씨스트선충의 race를 구분하지 않았으나 우리나라에서는 1 , 3, 5, 6 race가 존재하고, 강원도지역에서는 1번과 3번 race가 확인되었는데(Choi et al., 1987; Kim et al., 2012) 앞에서 연구자들별로 콩씨스트선충 부화의 온도반응 차이가 race의 차이에 의한 것이지 아니면 지역적 생태형에 의한 차이인지는 추가적인 규명이 있어야 할 것으로 생각된다.
콩씨스트선충 알에서 유충 발육이나 부화가 20-30°C까지 이루어지고, 발육율이 30°C에서 최대임에도 불구하고, 콩씨스트선충 난 발육과 부화 적온은 일별 치사율 변화가 30°C에서 이전 온도대에 비해 10배정도 높아(Alston and Schmitt, 1988) Slack and Hamblen (1961)이 부화 적온으로 24°C를 제시하고 있으나 Alston and Schmitt (1988) 연구에서는 본 연구와 같이 28°C에서 연구가 수행되지 않아 이들 연구 내용을 기반으로 콩씨스트선충의 부화적온을 24-25°C로 적용하는 것은 고려가 필요할 것으로 생각된다. 따라서 씨스트선충의 부화뿐만 아니라 기주 침입, 기주 내에서 발육 속도 등 반짝이콩시스트선충의 전체적인 생활사를 고려하여 발육 최적온도를 결정하여야 하겠지만 씨스트선충의 기주 침입의 첫 단계가 부화로부터 이루어지는 것을 고려하면 반짝이콩씨스트의 생육적온은 24°C 내외이고, 콩씨스트선충은 이 보다 높은 온도대인 28°C 내외가 타당할 것으로 생각된다. 그러나 이러한 양상은 콩 뿌리 삼출액 처리에서만 나타났고, 수돗물 처리에서는 전혀 다른 양상을 보였는데 32°C에서는 두 선충 모두 매우 낮은 부화를 보였고, 20°C에서는 콩씨스트선충의 경우 거의 부화하지 않았다. 또한 24°C와 28°C에서는 두 선충 모두 뿌리 삼출액에 비하여 매우 적은 부화수를 보였는데 뿌리 삼출액 처리에서 부화 양상이 뚜렷하게 달라졌던 이 두 온도대에서 두 선충 종간 부화 수에 차이가 없었다. 뿌리 삼출액과 같은 부화 유도 물질이 없는 조건에서는 두 선충 종의 최적 부화 온도 조건이 명확하게 구분되지 않았지만 두 종 모두 28°C에서 다른 온도대에 비하여 다소 많은 알들이 부화되었다.
뿌리 삼출액과 물에서의 부화율 차이는 씨스트선충에서 일반적으로 일어나는 현상으로 Perry (2002)는 씨스트선충의 기주 뿌리 삼출액에 대한 부화반응에 따라 네 가지 그룹으로 구분하였다. 즉 물에서는 거의 부화하지 않지만 뿌리삼출액에서는 많은 부화가 일어나는 G. rostochinensis나 G. pallida, H. cruciferae와 같은 1군, 물에서는 보통의 부화가 일어나지만 뿌리 삼출액에서는 많은 부화가 일어나는 클로버씨스트선충(H. trifolii), 콩씨스트선충과 같은 2군, 물과 뿌리 삼출액에서 모두 부화가 많이 일어나는 사탕무씨스트선충(H. schachtii)이나 H. avenae와 같은 3군, 물에서는 모든 세대에서 부화가 왕성하지만 뿌리 삼출액에서는 기주의 생육기 중 마지막 세대에서만 부화가 일어나는 H. cajani와 같은 4군으로 구분하고 있는데 연구자에 따라 이들 구분과 상이한 결과를 보이는 경우도 있다. Clarke and Shepherd (1966)는 9종의 씨스트선충에 대한 물과 뿌리 삼출액에 대한 부화 반응 연구에서는 콩씨스트선충의 경우 물과 콩 뿌리 삼출액에서 부화율이나 부화 유충수가 차이가 없다고 하여 Perry (2002)의 구분이나 본 연구 결과와 상이하였는데 이는 뿌리 삼출액의 조제 방법의 차이에 의한 것으로 생각된다. 콩씨스트선충은 콩 품종이나 race에 따라 뿌리 삼출액에 대한 부화율에 차이를 보였고(Sekora and Noel, 1996), 사탕무씨스트선충은 뿌리 삼출액을 추출한 배추의 생육기간에 따라 부화에 차이를 보였다(Kabir et al., 2015).
현재 우리나라에서 뿌리혹선충 방제제로 등록되어 있는 fluopyram과 fodthiazate, imyciafos는(KCPA, 2020) 콩씨스트선충과 반짝이콩씨스트선충의 높은 부화억제 활성을 보였다. 반짝이콩씨스트선충의 경우 29일간 부화억제 활성이 유지되었는데 콩씨스트선충의 무처리구 부화가 정체되는 처리 12일 후 두 선충의 부화억제 활성은 과산화수소 처리가 다른 살선충제 처리에 비하여 낮은 억제율 보인 것을 제외하고는 선충 종간 약제별 효과 차이는 없었다. 2령 유충에 대한 약효는 살선충제들 중 fluazaindolizine에서만 낮은 활성을 보였고, 과산화수소를 비롯한 fluopyram과 fodthiazate, imyciafos는 24시간 후에 99% 이상의 보정사충율을 보였는데 선충 종간 약제 반응 차이는 fluazaindolizine 처리에서만 콩뿌리혹선충의 감수성이 더 낮게 나타났다. 전체적으로 과산화수소는 씨스트선충 유충에 대한 살충 활성은 높았으나 부화억제 효과는 낮았고, fluazaindolizine의 경우 부화 억제효과는 높았으나 유충에 대한 치사효과는 낮게 나타났다. Fluazaindolizine은 선충에 접촉독을 일으켜 선충을 치사시키는 신규 살선충제로 뿌리혹선충을 비롯하여 Rotylenchulus reniformis, 검선충, 나선선충, 썩이선충 등에 효과가 있는 것으로 알려져 있고(Lahm et al., 2017), 토마토의 고구마뿌리혹선충(Meloigogyne incognita)에 대해서 fluopyram과 유사한 효과를 나타내었으나(Silva et al., 2019) 사탕무씨스트선충이나 클로버씨스트선충의 유충에 대해서는 본 연구의 결과와 같이 낮은 살선충 활성을 보였다(Jeong and Lee, Unpublished data). 배추를 동일 기주로 하는 클로버씨스트선충이나 사탕무씨스트선충에 대하여 살선충 활성이 차이가 없었던 것처럼(Jeong and Lee, Unpublished data) 본 연구의 결과도 효과가 낮은 fluazaindolizine을 제외하고 동일 식물을 기주로 하는 동일 속의 다른 씨스트선충의 약효가 차이가 없어 두 선충이 혼재하는 재배지에 살선충제 처리 시 동시방제가 가능 할 것으로 생각된다. 아울러 실내 실험실 생물검정 때에도 이러한 점을 고려한 다면 동일 기주를 가해하는 동일 속의 다른 종 선충에 대한 생물검정은 많은 시간과 경제적 비용을 들여 전체 선충에 대한 효과를 검정하는 대신, 대표 또는 일부 종에 대한 효과 검정 후 포괄적으로 동일 속의 다른 선충에 적용이 가능할 생각된다. 아울러 이러한 점이 고려 된 동일 기주를 갖는 동일 속의 식물기생성선충 생물검정에 대한 안을 마련할 필요가 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업 “기후변화에 따른 콩의 신문제 선충 발생 실태조사 및 위험성 평가 (과제번호: PJ01342804)”의 지원에 의해 수행되었으며 씨스트선충 채집과 실내 실험에 도움을 준 Faisal Md. Kabir, Mwamula A. Okki, 정문기, 김영준, 라희빈, 김현국, 안현정, 차윤석, 최인호에 감사를 표합니다. 아울러 통계처리에 도움을 주신 경상대학교 박정준 교수님께 감사를 표합니다.
이해상충관계
저자는 이해상충 관계가 없음을 선언합니다.
Literature cited
- Alston DG, Schmiti DP, 1988. Development of Heterodera glycines life stages as influenced by temperature. J. Nematol. 20(3):366-372.
-
Atkinson HJ, Lilley CJ, Urwin PE, 2012. Strategies for transgenic nematode control in developed and developing world crops. Curr. Opin. Biotechnol. 23(2):251-256.
[https://doi.org/10.1016/j.copbio.2011.09.004]

- Bridge J, Starr JL, 2010. Plant nematodes of agricultural importance - a color handbook. Academic Press, Boston, pp. 20-22.
- Choi DR, Lee YB, Han SC, 1987. Race distribution of the soybean cyst nematode (Heterodera glycines) in Korea. Korean J. Plant Prot. 26(4):203-207. (In Korean)
- Choi YE, Choi DR, 1983. Survey on soybean parasitic nematodes. Korean J. Pl. Prot. 22(4):251-261. (In Korean)
-
Clarke AJ, Shepherd AM, 1966. Inorganic ions and the hatching of Heterodera spp. Ann. Appl. Biol. 58:497-508.
[https://doi.org/10.1111/j.1744-7348.1966.tb04409.x]

-
Doney DL, Fife JM, Whiney ED, 1970. The effect of the sugarbeet nematode Heterodera schachtii on the free amino acids in resistant and susceptible Beta species. Phytopathology 60:1727-1729.
[https://doi.org/10.1094/Phyto-60-1727]

-
Jones JT, Haegeman A, Danchin EGJ, Gaur HS, Helder J, et al., 2013. Top 10 plant-parasitic nematodes in molecular plant pathology. Mol. Plant Pathol. 14:946-961.
[https://doi.org/10.1111/mpp.12057]

- Kabir FM, Shin J, Kwon O, Lee DW, 2015. Temperature and root extract effect on egg hatching and development of sugar beet cyst nematode, Heterodera schachtii. Korean J. Soil Zoollogy 19:22-27.
-
Kang H, Eun G, Ha J, Kim Y, Park N, et al., 2016. New cyst nematode, Heterodera sojae n. sp. (Nematoda: Heteroderidae) from soybean in Korea. J. Nematol. 48(4):280-289.
[https://doi.org/10.21307/jofnem-2017-036]

-
Kang H, Ko H, Kim D, Choi I. 2020. Occurrence of the white soybean cyst nematode, Heterodera sojae, and the soybean cyst nematode, H. glycines, in Korea. Plant Dis.
[https://doi.org/10.1094/PDIS-09-19-1932-SC]

-
Kim DG, Choi IS, Ryu YH, Huh CS, Lee YS, 2013. Plant parasitic nematodes in soybean in Korea and their importance rating. Korean J. Appl Entomol. 52(4):327-333. (In Korean)
[https://doi.org/10.5656/KSAE.2013.09.0.047]

- Kim DG, Kim YC, Kim ST, Ko BG, Han WH, et al., 2012. Current researches on resistance to soybean cyst nematode and prospects. J. Agricul. Life Sci. 46:101-111. (In Korean)
-
Kim JE, Mwamula AO, Kabir F, Shin JH, Choi YH, et al., 2016. Efficacy of different nematicidal compounds on hatching and mortality of Heterodera schachtii infective juveniles. Korean J. Pestic. Sci., 20(4):293-299.
[https://doi.org/10.7585/kjps.2016.20.4.293]

- Kim Y, Lee DW, 2019. Plant parasitic nematode fauna of Heterodera glycine and H. sojae, and soil characteristics of soybean fields in Gangwon-do and Chungcheongbuk-do. Korean J. Appl. Entomol. 58(1):37-47. (In Korean)
- Korea Crop Protection Association (KCPA), 2020. Crop protection agent guidelines. Korea Crop Protection Association, Seoul. https://www.koreacpa.org, (accessed on 11 Aug. 2020).
-
Lahm GP, Desaeger J, Smith BK, Pahutski TF, Rivera MA, et al., 2017. The discovery of fluazaindolizine: a new product for the control of plant parasitic nematodes. Bioorg. Med. Chem. Lett. 27(7):1572-1575.
[https://doi.org/10.1016/j.bmcl.2017.02.029]

- Lee DW, Okki MA, Na HB, Ahn H, Kim H, et al., 2019. Efficacy of some nematicidal compounds against turfgrass parasitic nematodes. XIII International Nematological Symposium. Pweterozavodsk, Russia. 29 Jul. - 4 Aug. p.28.
- Masler EP, Perry RN, 2018. Hatch, survival and sensory perception, in: Perry RN, Moens M, Jones JT, (Eds.), Cyst nematodes. CABI, Oxfordshire, pp. 1-26.
-
Moens M, Perry RN, Jones JT, 2018. Cyst nematodes-life cycle and economic importance, in: Perry RN, Moens M, Jones JT, (Eds.), Cyst nematodes. CABI, Oxfordshire, pp. 1-26.
[https://doi.org/10.1079/9781786390837.0001]

-
Perry RN, 2002. Hatching, in: Lee DL, (Ed.), The biology of nematodes. Taylor & Francis, New York, pp. 147-169.
[https://doi.org/10.1201/b12614-7]

- SAS/STAT® 9.3 user’s guide, 2011. SAS Institute Inc., Cary, NC, USA.
- Sikora EJ, Noel GR, 1996. Hatch and emergence of Heterodera glycines in root leachate from resistant and susceptible soybean cultivar. J. Nematol. 28(4):501-509.
-
Silva JdO, Loffredo A, Rocha MRd, Becke JO, 2019. Efficacy of new nematicides for managing Meloidogyne incognita in tomato crop. J. Phytopathol. 167:295-298.
[https://doi.org/10.1111/jph.12798]

- Slack DA, Hamblen ML, 1961. The effect of various factors on larval emergence from cysts of Heterodera glycines. Phytopathology 51:350-355.
- Tefft PM, Rende JF, Bone LW, 1982. Factors influencing egg hatching of the soybean cyst nematode Heterodera glycines race 3. Proc. Helminthol. Soc. Wash. 49(2):258-265.
- Weischer B, Brown DJF, 2000. An introduction to nematodes; general nematology. Pensoft. Moscow. Pp. 37-53.
- Wrather JA, Koenning SR, 2006. Estimates of diseases effects on soybean yields in the United States 2003 to 2005. J. Nematol. 38(2):173-180.
Dong Woon Lee, Kyungpook National University, Sangju, Korea, Professor, ORCD http://orcid.org/0000-0001-9751-5390