살충제 Sulfoxaflor 및 대사체들의 토양 잔류 특성
초록
살충제 sulfoxaflor 및 대사체들의 토양 중에서의 동태를 파악하기 위하여 토양 중에서의 잔류양상 및 흡탈착 특성 그리고 저감화 정도를 조사하였다. 토양 중 sulfoxaflor의 토양 미생물 유무에 따른 잔류양상을 조사하기 위해 살균 및 비살균 토양에 대한 생물학적 분해 반감기를 조사한 결과 살균 토양에서 69.3-138.6일, 비살균 토양에서 16.5-19.3일로 나타났다. Sulfoxaflor 및 대사체의 토양 중 흡착 양상은 시험 토양에서 대부분(sulfoxaflor 및 X-1 : 99%, X-2 : 98%) 흡착되어 유기물을 제거한 토양(sulfoxaflor : 76%, X-1 : 79%, X-2 : 67%)에 비해 높은 흡착율을 보여 토양 유기물에 크게 영향을 받았다. 그러나 sulfoxaflor의 탈착율은 유기물의 유무에 관계없이 높게 나타났다. 토양에 잔류된 sulfoxaflor 및 대사체들을 저감시키기 위해 Fenton 반응을 유도한 결과 Fe2+를 처리하였을 때 분해율은 sulfoxaflor의 경우 2 .4%, 대사체들은 15.7-49.2%로 나타나 Fe3+ 처리시 sulfoxaflor가 1.3%, 대사체들이 1.9-9.8% 분해된 것에 비해 높게 나타났다. 그러나, H2O2, UV 및 persulfate를 함께 처리한 경우에는 Fe2+ 처리시 40.2-100.0%, Fe3+ 처리시 1.2-100.0%를 보여 sulfoxaflor의 가속적인 저감화 효과를 나타내었다.
Abstract
In order to understand the behavior of the insecticide sulfoxaflor and its metabolites in the soil, the residual patterns, adsorption and desorption properties, and degree of reduction in soil were investigated. To study the role of soil microbes on residual pattern of sulfoxaflor in soil, as the results of the biological half-life of sterilized and non-sterilized soil, it was calculated in the range of 69.3-138.6 days in sterilized soil and 16.5-19.3 days in non-sterilized soil. Sulfoxaflor and its metabolites were found to be higher in the soil with organic matter (sulfoxaflor and X-1 : 99%, X-2 : 98%), and lower amount of tested chemical were found in the soil without organic matter (sulfoxaflor : 76%, X-1 : 79%, X-2 : 67%). Thus, the adsorption of sulfoxaflor and metabolites was affected by soil organic matter. However, the desorption rate of sulfoxaflor was high regardless of the presence or absence of soil organic matter. The results of Fenton reaction to reduce residual sulfoxaflor and its metabolites in the soil was as followed. When Fe2+ (ferrous) was treated, the degradation rate was 2.4% for sulfoxaflor, and 15.7-49.2% for metabolites, which was higher than that of 1.3% of sulfoxaflor and 1.9-9.8% of metabolites when treated with Fe3+ (ferric). Additionally, the reaction kinetics was accelerated when H2O2, UV, and persulfate were treated together (with Fe2+ : 40.2-100.0%> with Fe3+ : 1.2-100.0%) and effective degradation has been achieved up to 100%.
Keywords:
Adsorption and Desorption, Degradation, Fenton reaction, Half-life, Sulfoxaflor키워드:
Fenton reaction, Sulfoxaflor, 분해 반감기, 저감화, 흡탈착서 론
2019년 1월 1일부터 우리나라에서 시행된 농약허용물질 목록관리제도(Positive List System, PLS)는 작물에 농약 잔류허용기준(Maximum Residue Limit, MRL)이 설정되어 있지 않은 경우에 대한 안전성 관리방법으로 농약의 작물 잔류 특성에 대한 정보를 통해 안전성을 평가하게 된다(MAFRA, 2020). 하지만 작물에 살포된 농약의 상당부분이 토양에 떨어지게 되는데 이들이 토양에 잔류되어 있다가 후작물 재배 시 뿌리를 통해 흡수이행 되면 비의도적 오염이 될 수 있게 된다(Hwang et al., 2016a; Kwak et al., 2017). 따라서 농약 PLS제도를 실시함에 있어 사용량이 많은 농약들의 토양 중 정확한 잔류양상을 파악하고 후작물에 대한 흡수이행 가능성이 있는가를 예측하는 것도 중요한 연구과제라고 할 수 있다.
현재 우리나라에서 주로 채소 및 과일에 발생하는 진딧물, 나방, 깍지벌레 및 가루이류를 방제하기 위해 neonicotinoid계 살충제 sulfoxaflor가 단제와 혼합제의 형태로 15개 품목이 등록되어 사용되고 있다(KCPA, 2020). Sulfoxaflor는 곤충의 중추신경계의 nicotinic acetylcholine receptor (nAChR)에 작용해 acetylcholine이 축적되도록 유도하여 자극의 전달을 방해하는 침투성 4세대 neonicotinoid계 살충제이다(Micheal et al., 2018; Watson et al., 2017). 또한, 곤충의 nAChR에 대한 작용기작이 다른 neonicotinoid계 농약과 다르고 이를 포함한 1-3세대 농약에 교차 저항성을 나타내는 곤충을 포함한 흡즙해충(sap-feeding pest)에 효과적으로 작용하는 것으로 알려져 있다(Kim et al., 2016; Loso et al., 2016; Nugent et al., 2015).
Sulfoxaflor는 작물 및 토양에서 분해되어 모화합물보다 독성이 높은(EFSA, 2014) 두 개의 대사체 X11719474(X-1) 및 X11721061(X-2)를 생성하는 것으로 알려져 있다. 현재 농촌진흥청에서는 작물 중 sulfoxaflor 잔류분의 정의를 모화합물과 두 대사체의 합으로 하고, 환경 중 sulfoxaflor 잔류분은 모화합물과 X-1의 합으로 정의하고 있다(RDA, 2015).
미국 Minnesota Department of Agriculture에 따르면 토양 중 sulfoxaflor의 분해 반감기는 1일 미만으로 매우 짧아 잔류성이 거의 없는 것으로 보고하였다. 그러나 대사체 X-1의 반감기는 1,000일 이상, 대사체 X-2의 반감기는 2,000일 이상으로 알려져 토양 환경 중에서 sulfoxaflor 및 대사체들이 완전히 소실 되기까지는 상당한 시간이 걸릴 수 있다. 또한, 모화합물인 sulfoxaflor는 물에 대한 용해도가 높고 토양흡착 계수 중 하나인 Freundlich 상수(Kf)가 11-72mL/g으로 흡착정도가 낮아 환경 중 높은 이동성을 가진 것으로 알려져 있다(MDA, 2013).
본 연구는 우리나라에서 작물에 대한 사용량이 늘어나고 있는 살충제 sulfoxaflor의 토양에서 후작물 흡수 이행 여부의 가능성을 파악할 수 있는 기초 자료로서 활용하기 위해 sulfoxaflor 및 대사체들의 토양 환경 중에서 잔류 양상 및 흡탈착 특성 그리고 저감화되는 정도를 조사하였다.
재료 및 방법
농약 및 시약
살충제 sulfoxaflor와 대사체 X11719474 및 X11721061은 순도 99.7, 99.7 및 94.0% 표준품을 Dow Agro Sciences(Indianapolis, IN, USA)의 제품을 분양받아 사용하였다. 시험에 사용된 acetonitrile, methanol 및 water는 Burdick & Jackson Inc. (Muskegon, MI, USA)의 HPLC grade를, ammonium formate는 Sigma Aldrich (St.Louis, MO, USA), formic acid는 ㈜덕산(Seoul, Korea)의 제품, 시료 정제를 위한 primary secondary amine (PSA)은 Agilent Technologies (Sana Clara, CA, USA)의 제품, calcium chloride (CaCl2, 95.0%) 및 sodium chloride (NaCl, 99.5%)는 Junsei Chemical Co. Ltd. (Tokyo, Japan)의 제품을 구입하여 사용하였다.
Fenton reaction 실험에 사용한 ferrous sulfate (≥99.0%) 및 ferric nitrate (≥98.0%)는 Sigma Aldrich (St.Louis, MO, USA)에서, potassium persulfate (PS, ≥95.0%)는 Yakuri Pure Chemicals Co., LTD. (Osaka, Japan)에서 hydrogen peroxide (H2O2, ≥28.0%)는 ㈜덕산(Seoul, Korea)에서 구입하여 사용하였다.
토양 시료채취 및 전처리
시험에 사용된 토양은 경북대학교 시험포장인 군위지역의 밭 토양을 표면으로부터 0-15 cm 깊이로 채취하였으며, 이를 풍건하여 2mm 체로 균질화한 후 폴리에틸렌 비닐팩에 밀봉하여 냉동보관하여 사용하였다. 토양 중 잔류양상을 확인하기 위해 2 kg의 토양에 0.2 및 1.0mg/kg 농도가 되도록 sulfoxaflor의 working solution을 처리한 후 유기용매가 모두 증발할 수 있도록 충분히 aging하여 시험에 사용하였다.
토양 중 sulfoxaflor 및 대사체 잔류분석법
토양 시료 10 g을 50mL 원심분리관에 칭량하여 acetonitrile 18 mL와 1 N HCl 2 mL를 9:1 (v/v)의 비율로 첨가한 후 vortex mixer로 20분간 2,500 rpm에서 진탕 추출하였고, 이 추출물에 NaCl을 첨가하여 혼합한 후 5분간 원심분리(4,000 rpm)하여 상등액 2 mL를 분취하였다. 추출한 상등액에 50mg PSA를 첨가하여 정제하였으며, 1분간 진탕 및 원심분리(4,000 rpm) 한 후 상등액 전량을 polyvinylidiene fluoride syringe filter (0.2 μm, 13 mm)에 여과하여 LC-MS/MS로 분석하였다.
분석 기기는 Shimadzu Nexera UFLC에 Shimadzu LC/MS 8030 plus가 장착된 LC-MS/MS로 0.1% formic acid와 5 mM ammonium formate를 함유한 HPLC용 water와 methanol을 이동상으로 사용하였다. 분석에 사용된 column은 Kinetex® C18 [100 mm (L) × 2.10 mm (i.d)., 2.6 μm]이었다. 분석의 ionization mode는 electrospray ionization(ESI) positive mode에서 multiple reaction monitoring (MRM)를 이용하여 분석하였다. Sulfoxaflor 및 대사체의 정량 분석을 위해 무처리 용액이 포함된 matrix matched 검량선을 작성하였으며, 그 농도는 sulfoxaflor 및 X-1의 경우 0.005, 0.01, 0.02, 0.05, 0.1, 0.2 및 0.5mL/L, X-2의 경우 0.01, 0.02, 0.05, 0.1, 0.2 및 0.5 mL/L로 분석하였다.
토양 중 sulfoxaflor의 잔류 시험
토양 중 sulfoxaflor의 잔류 시험은 살균 및 비살균 토양으로 나누어 진행하였다. 살균 토양 및 살균수는 121°C에서 30분간 3회 autoclaving하였으며, 살균한 토양 20 g에 4mL(포장용수량의 60%) 살균수를 첨가하여 25 ± 2°C에서 2주간 pre-incubation하여 시료로 사용하였다. 각 토양 시료 20 g에 sulfoxaflor를 0.2 및 1.0 μg/g 처리하여 암실에서 배양하고 1, 3, 7, 14, 21, 30, 60 및 90일 후 샘플링 하였다. 배양 기간 중 무게를 측정하여 증발된 수분의 양 만큼 보충하였다.
농약의 흡착 시험
Sulfoxaflor 및 대사체의 토양 흡착 시험을 위해 유기물을 제거하지 않은 토양 시료와 유기물을 제거한 토양을 시료로 구분하였다. 토양 중 유기물 제거는 토양에 6% H2O2를 첨가하여 가열하는 과정을 6회 거친 후 75°C oven에서 건조하였다. 건조된 토양은 methanol로 세척한 후 원심분리하여 토양만 건조하여 시료로 사용하였다. 각 토양 시료를 2 g씩 칭량하여 분석 농약 1mg/kg이 용해된 0.01 M calcium chloride (CaCl2) 용액 10mL와 함께 원심분리관에 넣고 토양과 수용액상의 농약이 흡착평형농도에 도달하는 시간을 확인하기 위해 shaking incubator에서 120rpm의 속도로 0.25, 0.5, 1, 3, 6, 12, 18 및 24시간 동안 진탕한 후 원심분리하여 상등액을 LC-MS/MS로 분석하였다. 이때, 첨가 농도에 상등액 중 농약의 잔류량을 뺀 값을 흡착량으로 하였다. 또한, 농약의 농도에 따른 흡착 양상을 확인하기 위해 sulfoxaflor 및 대사체를 0.1, 0.2, 0.5, 1.0 및 2.0 mg/kg 수준으로 처리하여 상기의 방법과 동일하게 진행하였다.
시험결과는 식(1)-(3)과 같이 Freundlich, Langmuir 및 Linear 흡착등온식을 이용하여 값을 산출하였다.
| (1) |
| (2) |
| (3) |
Cs는 토양에 흡착된 농약의 양(μg/g), Ce는 평형상태의 용액 중 농약의 농도(μg/mL)이다. Kf (mL/g)는 Freundlich 상수, 1/n은 heterogeneity factor을 나타낸다. 또한, b는 토양단위 질량 당 최대로 흡착 가능한 농약의 양을, K는 Langmuir 상수를, Kd는 adsorption coefficient를 의미한다.
농약의 탈착 시험
탈착 시험은 흡착 시험과 같은 방법으로 농약의 흡착평형 농도까지 도달하게 한 후 원심분리하여 상등액을 완전히 제거하였다. 상등액을 제거한 토양 잔여물에 증류수 20mL를 처리하여 12시간 동안 진탕 한 후 원심분리하여 상등액을 취하였다. 이 과정을 1회 수행한 처리구와 2회 반복수행한 처리구로 나누어 상등액을 분석하였으며 이 상등액에 잔류하는 농약의 양을 흡착량에서 뺀 값을 탈착량으로 하였다.
Fenton 시약에 의한 분해
Fenton 시약에 의한 sulfoxaflor의 분해 시험은 Arnold 등(1995)의 연구를 참고하여 pH 3의 최적 조건에서 진행하였다. 시험을 위해 sulfoxaflor 및 대사체 20 μg/mL가 용해된 0.1 M sodium phosphate에 ferrous sulfate 및 ferric nitrate를 50mg 처리하였으며, H2O2가 0.1M이 되도록 처리하여 암조건에서 200 rpm으로 24시간 shaking하였다. 이 후 용액 중 잔류량을 분석하여 Fenton reaction에 의한 분해를 확인하였다. 또한, EFSA (2014)는 수중에서 sulfoxaflor 및 대사체 X-1의 광분해가 거의 일어나지 않는다고 보고한 바 있다. 따라서 UV 단독 처리구는 따로 두지 않고 UV 조사의 영향을 확인하기 위해 254 nm 파장의 UV를 조사하였으며, 산화물의 영향을 확인하기 위해 0.1M PS를 처리하여 Fe2+/H2O2 및 Fe3+/H2O2의 분해양상을 확인하였다.
결과 및 고찰
회수율 시험
LC-MS/MS로 분석한 sulfoxaflor 및 대사체의 분석법의 정량한계는 sulfoxaflor 및 X-1은 0.005mg/kg, X-2는 0.01mg/kg로 나타났다. 정량 분석을 위해 작성한 matrix matched 검량선의 직선성 상관계수(R2) 값은 모두 0.999이상으로 양호한 직선성을 보였다. 토양 중 확립된 sulfoxaflor 및 대사체 분석법의 회수율 시험 결과 sulfoxaflor는 89.3-99.4%, X-1은 95.2-103.7%, X-2는 88.7-100.8%, 변이계수(coefficient of variation, CV)는 1.3-5.1% 수준으로 잔류농약분석법 기준(MFDS, 2017)인 70-120% 회수율과 변이계수 10% 이내를 만족하였다. LC-MS/MS로 분석 시 chromatogram상 간섭 peaks는 나타나지 않았다.
토양 중 sulfoxaflor의 잔류 특성
Sulfoxaflor 및 대사체의 토양 환경 중 미생물 유무에 따른 분해 특성을 조사하기 위해 살균처리를 한 토양과 비살균 토양으로 실험을 수행하였다. 살균 토양에 sulfoxaflor 0.2 mg/kg를 처리하였을 때 1일차 초기 잔류량은 0.20mg/kg, 90일차에서 0.12 mg/kg으로 나타나 반감기는 Fig. 1과 같이 138.6일(y = 0.1883e-0.005x, r2 = 0.938)로 산출되었으며, 1 mg/kg을 처리하였을 때 0.98mg/kg에서 0.12 mg/kg까지 감소하여 반감기가 69.3일(y = 1.0342e-0.01x, r2 = 0.9813)로 나타났다. 비살균 토양에서는 0.2mg/kg을 처리하였을 때 반감기가 19.3일(y = 0.1282e-0.036x, r2 = 0.7891), 1 mg/kg을 처리하였을 때 16.5일(y = 0.9068e-0.042x, r2= 0.9549)로 나타났다. Sulfoxaflor를 0.2mg/kg 처리한 살균토양 중 대사체 X-1은 모화합물의 분해와 함께 생성되어 90일차(0.084 mg/kg)에 가장 많이 잔류하였으며, 1 mg/kg 처리한 경우 최대 0.580 mg/kg 잔류하였다. 또한, 비살균 토양의 경우 sulfoxaflor의 처리 농도에 따라 X-1의 잔류량은 0.19 및 0.98 mg/kg으로 나타나 살균 토양과 비교하였을 때 약 2배 이상 생성되었다. 반면 대사체 X-2의 경우 두 처리구 모두 정량한계 미만으로 나타났다.
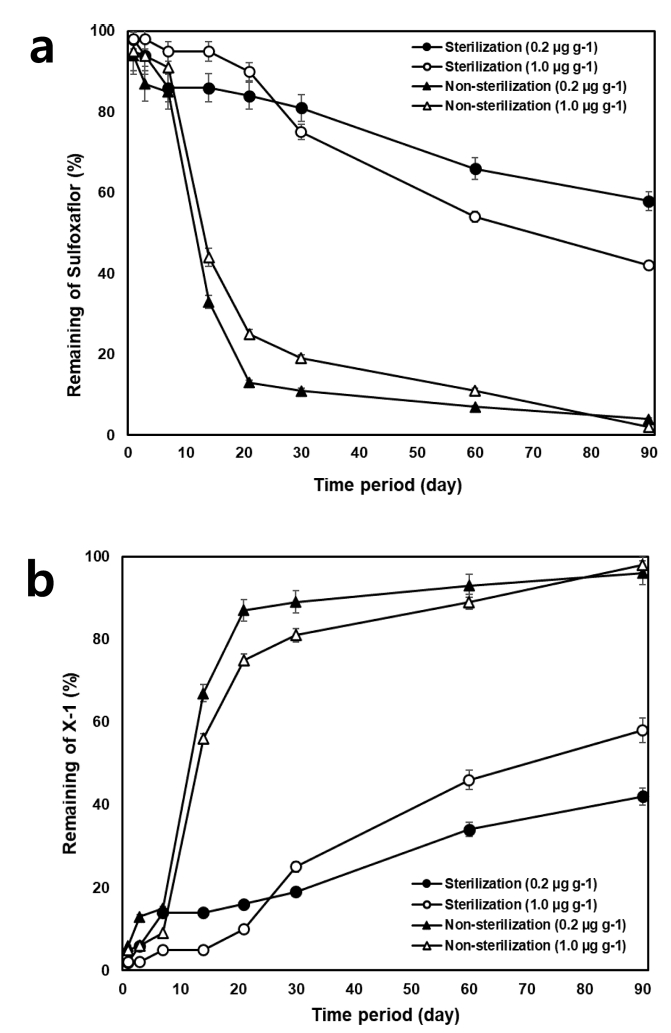
Degradation patterns of sulfoxaflor and residual patterns of metabolite on the sterilized and non-sterilized soil (a: sulfoxaflor, b: X-1).
Sulfoxaflor는 토양 및 식물 중에서 분해되어 primary metabolite인 X-1을 생성하고 식물에서는 다시 분해되어 X-2로 전환되기도 하지만 토양에서는 전환되지 않는 것으로 보고된 바 있다(JMPR, 2011; Terry et al., 2015). 본 연구의 결과에서도 토양 중 sulfoxaflor의 분해 시 X-2가 생성되지 않았거나 정량한계 미만으로 나타나 위의 Terry 등(2015)의 결과와 일치하였다. 이러한 토양 중 sulfoxaflor의 빠른 분해는 흡수이행에 따른 작물잔류 가능성이 낮다고 할 수 있으나, 모화합물이 분해됨에 따라 대사체가 생성되기 때문에 이 대사체들도 저감화시켜 후작물로의 흡수이행을 줄여야 한다고 생각된다.
토양 중 sulfoxaflor 및 대사체의 흡착 특성
흡착 시험을 수행한 토양은 pH가 5.6인 약산성의 토양으로 유기물함량이 1.7% 포함된 사질양토였다(Table 1).
토양에 존재하는 유기물이 농약의 흡착에 어느 정도 영향을 미치는 것인지를 알아 보기 위하여 토양을 유기물을 제거한 토양과 그렇지 않은 토양으로 구분하여 sulfoxaflor 및 대사체가 토양에 흡착하여 흡착평형에 도달하는 시간을 확인하였다. 그 결과 Fig. 2와 같이 유기물을 제거하지 않은 토양에서 sulfoxaflor와 X-1의 경우 약 12시간이 경과하였을 때 흡착량이 증가하지 않고 평형을 이루는 것을 확인하였으며 X-2의 경우 약 18시간 경과 후 흡착평형을 이루었다. 반면, 유기물을 제거한 토양에서 sulfoxaflor, X-1 및 X-2는 약 12시간 경과 후 흡착평형을 이루었다. 유기물의 유무에 따른 흡착량을 비교하였을 때, 유기물이 존재하는 토양에서는 거의 모든 농약과 대사물질이 토양에 흡착되었으나 유기물을 제거한 토양에서는 67-79%가 흡착되어 유기물이 있을 때 흡착이 더 잘 이루어지는 것을 알 수 있었다.
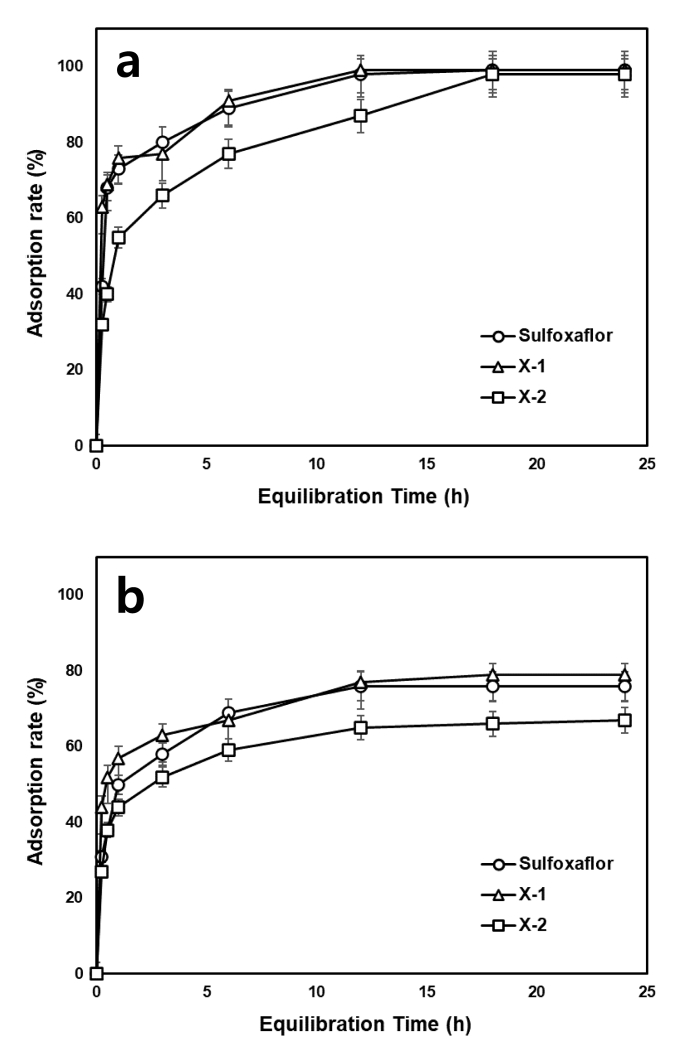
Time-dependent adsorption kinetics of sulfoxaflor and its metabolites on soils (a: raw soil, b: organic matter removed soil).
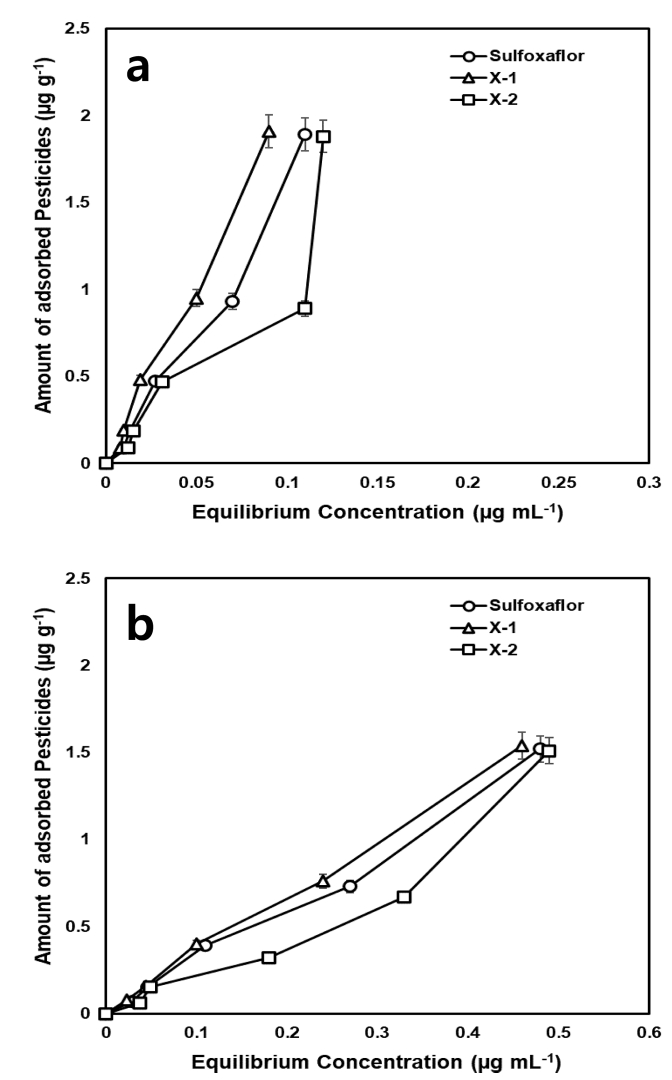
Concentration-dependent distributions of sulfoxaflor and its metabolites between soils and soil solutions (a: raw soil, b: organic matter removed soil).
Hwang 등(2016b)은 endosulfan isomers (α-, β-) 및 endosulfan sulfate를 토성이 상이한 두 지역의 토양을 대상으로 흡착시험을 수행하여 두 토양에서 모두 유기물을 제거한 토양에서 흡착량이 적은 것을 확인하였다. 또한 많은 다른 농약과 흡착에 대한 연구에서도(Alvarez et al., 2013; Bovin et al., 2005) 유기물 함량에 따라 농약의 흡착이 영향을 받는다고 하였다. 본 연구 결과도 이들 보고와 같이 sulfoxaflor 및 대사체들도 토양 중 유기물이 토양 흡착에 크게 영향을 미치는 것으로 나타났다. 토양 내 유기물 함량 외에도 농약의 토양 중 흡착에 영향을 주는 요인은 토양의 양이온교환용량(CEC), 토성, pH, 기후조건(온도, 수분함량), 농약의 물리화학적 특성에 의해 크게 달라질 수 있으며, 본 연구에서 비이온성 농약인 sulfoxaflor의 흡착률이 높게 나타난 것은 시험 토양의 유기물함량이 상당히 높을 뿐만 아니라 상기의 요인들이 복합적으로 영향을 미쳐 v an der Waals' force 및 소수성 결합 등의 물리적 흡착이 유도되었기 때문으로 사료된다(Chun et al., 2018).
Sulfoxaflor 및 대사체들의 토양 중 흡착평형농도와 흡착량과의 관계를 확인한 결과 유기물을 제거하지 않은 토양에서는 농도가 증가함에 따라 흡착량이 증가하였다. 반면, 유기물을 제거한 토양에서는 농도가 증가하여도 흡착되지 않고 용액 중에 남아 있는 것을 확인하였다(Fig. 2). 이를 Freundlich 식에 적용한 결과는 Table 2와 같다. Freundlich 흡착상수인 1/n은 비선형도를 나타내며, 값이 작을수록 흡착질의 농도가 커짐에 따라 흡착이 어려워지는 것을 의미한다(Sparks, 1995). 상수 Kf는 흡착강도를 나타내며 Freundlich 식의 기울기가 1에 가까울 때 분배계수 Kd와 유사하게 되며 Kd는 토양에 대한 토양 중 흡착량을 용액 중 잔류량으로 나누어 나타낸 값으로 Kd값이 작을수록 토양 중 농약 흡착량이 감소하는 것을 의미한다.

Freundlich isotherm parameters and concentration-dependent Kd values of sulfoxaflor and its metabolites on soils
유기물을 제거하지 않은 토양 중 sulfoxaflor, X-1 및 X-2의 1/n은 1.15, 1.15 및 1.08로 나타났으며, 유기물을 제거한 토양에서는 1.03, 0.98 및 1.06으로 나타났다. Sulfoxaflor, X-1 및 X-2의 Kf값은 유기물을 제거하지 않은 토양에서 23.69, 32.17 및 14.54, 유기물을 제거한 토양에서 3.21, 3.34 및 2.54로 나타나 토양으로 흡착되는 농약의 양이 감소하는 것은 유기물의 유무와 관련이 있음을 확인하였다.
Sulfoxaflor와 대사산물 X-1 및 X-2의 흡착 결과를 Langmuir식에 대입하여 나타낸 결과는 Table 3과 같다. 토양 단위질량당 최대 흡착량을 나타내는 qmax값은 유기물이 존재하는 토양에서 9.51, 12.33 및 8.08 μg/g으로 나타났으며, 유기물을 제거한 토양에서는 2.52, 3.35 및 1.90 μg/g으로 나타나 X-1에서 흡착량이 가장 많은 것으로 나타났다. 흡착 결과를 Freundlich 및 Langmuir 식으로 나타냈을 때 r2 값은 Freundlich식에서 상대적으로 높게 나타나 적합함을 확인하였으며, Langmuir식의 K 값이 음수를 나타내는 것을 통해 토양 중 sulfoxaflor 및 대사체의 흡착은 Langmuir식에 적합하지 않다고 판단할 수 있다(Hwang et al., 2016b).
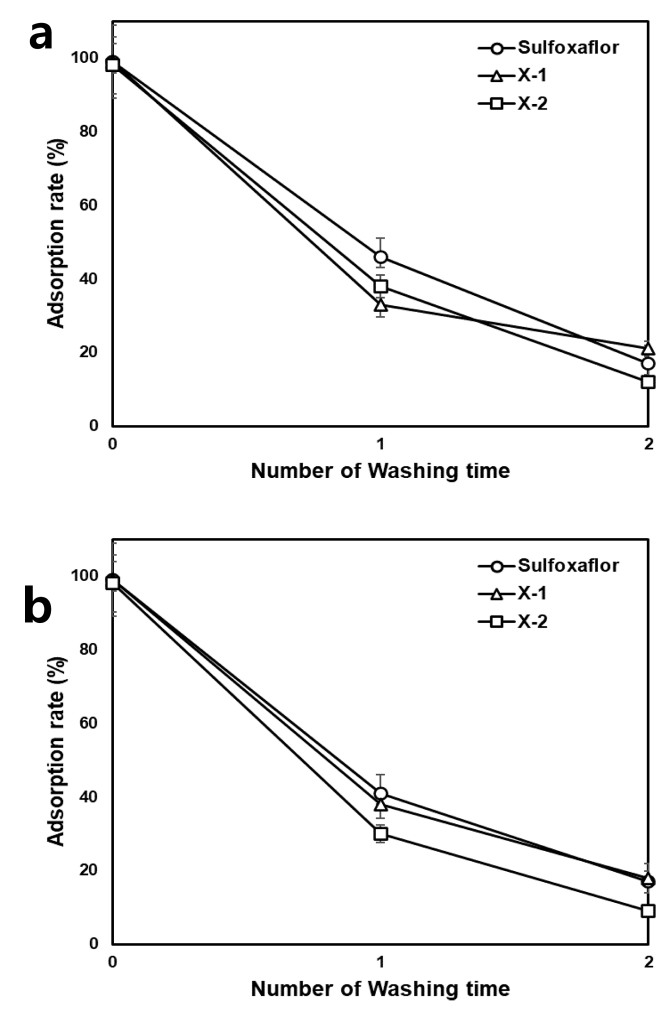
토양 중 sulfoxaflor 및 대사체의 탈착 특성
Sulfoxaflor 및 대사체가 흡착평형에 도달한 후 sulfoxaflor 및 X-1의 흡착률은 99%였으며, X-2의 흡착률은 98%였다. 유기물을 제거하지 않은 토양에서 탈착 과정을 1회 수행한 결과 sulfoxaflor는 53%, X-1은 66%, X-2는 60% 탈착되는 것으로 나타났다(Fig. 4). 탈착과정을 2회 수행하였을 때 sulfoxaflor는 82%, X-1은 78%, X-2는 86% 탈착되었다. 유기물을 제거한 토양의 경우 탈착 과정을 1회 수행하였을 때 58-68% 탈착되었으며, 2회 반복 수행하였을 때 81-89% 탈착되는 것으로 나타났다. Lee and Kim (1998)은 유기물을 제거하지 않은 토양의 결합 잔류물이 oxadiazon과 강하게 결합하기 때문에 유기물을 함유한 토양이 유기물이 제거된 토양에서보다 흡착률이 높으나 탈착률이 낮다고 보고한 바있다. 하지만 본 연구에서는 유기물의 유무에 관계없이 비슷한 수준으로 탈착되는 것으로 나타났다. 이는 oxadiazon의 경우 물에 대한 용해도가 1.0mg/L로 상대적으로 낮은 수준인 반면, sulfoxaflor는 809mg/L로 물에 대한 용해도가 상대적으로 높기 때문에 흡착률이 높음에도 불구하고 쉽게 탈착된 것으로 사료된다.
토양 중 sulfoxaflor의 Fenton 시약에 의한 분해
Fenton reaction은 전이금속과 과산화물이 반응하여 생성되는 radical에 의한 분해 반응으로, Fe2+와 H2O2가 반응하여 생성되는 hydroxyl radical (OH•)에 의한 분해반응이 주반응인 것으로 알려져 있다. 하지만 Fe3+에 의해서도 유사하게 Fen ton reaction이 일어나며, 전이금속과 반응하여 sulfate radical (SO4•-)를 생성하는 과산화물인 PS (S2O82-)에 의해서도 반응성이 달라지기 때문에 radical 반응의 가능성을 확인하였으며 결과는 Table 4에 나타냈다.

Comparison of different processes in reduction of sulfoxaflor and its metabolites in terms of degradation efficiency
Sulfoxaflor 및 대사체들과 H2O2간 반응을 확인하였을 때, H2O2가 강산화제이지만 반응속도가 낮아 반응이 거의 일어나지 않았다. 또한, Fe2+ 및 Fe3+와 반응하였을 때 최대 49.2% 분해되었으며, Fe2+가 Fe3+보다 더 높은 분해율을 보였다. Sulfoxaflor와 Fe2+/ H2O2를 반응시켰을 때 40.2%, Fe3+/ H2O2를 반응시켰을 때 1.2% 분해되어 Fe2+/ H2O2와 반응하였을 때 분해가 더 많이 되는 것을 알 수 있었다. 두대사체의 경우 Fe2+/ H2O2 및 Fe3+/ H2O2와 반응하여 각각 66.4-100.0 및 14.0-49.0% 분해되는 것으로 나타났다.
UV 조사 하에 반응시킨 결과 sulfoxaflor 및 대사체들 모두 UV/Fe2+/ H2O2 처리 시 UV/Fe3+/H2O2처리 보다 더 높은 분해율을 보였다. 이러한 결과는 낮은 pH에서 Fe2+는 hydroxyl radical을 생성하여 1차적으로 유기물을 분해하고, 이때 생성된 Fe3+도 H2O2 존재 하에 Fenton like reaction으로 hydroperoxyl radical (HO2•)을 생성하여 2차적으로 분해에 참여하기 때문에 분해율이 높은 것으로 판단된다. 반면, Fe3+의 경우 hydroxyl radical보다 반응성이 낮은 hydroperoxyl radical이 생성되기 때문에 낮은 분해율을 보인 것으로 사료 된다.
Sulfoxaflor 및 대사체들의 분해에 대한 Fe염과 PS에서 생성되는 sulfate radical의 영향을 확인한 결과, UV/Fe2+/PS 및 US/Fe3+/PS처리구 모두 최대 100% 분해되었다. 또한, H2O2와 PS의 분해율을 비교한 결과 모든 처리구에서 PS를 첨가하였을 때 더 높은 분해율을 보였으며 이는 H2O2를 첨가한 처리구에서는 sulfate radical이 생성되지 않으나 PS를 첨가한 경우 추가적으로 생성되기 때문에 가속화된 분해가 일어나는 것으로 판단된다. 즉, 아래의 반응과 같이 PS는 Fe2+와 반응하여 sulfate radical을 생성할 뿐만 아니라 PS는 UV에 의해서도 sulfate radical을 생성할 수 있다.
이렇게 생성된 sulfate radical때문에 더 많은 radical reaction이 일어나게 되며 이로 인해 sulfoxaflor의 분해가 더 활발히 일어나는 것으로 판단된다(Guan et al., 2011; Kurukutla et al., 2015; Shah et al., 2015). 본 연구에서 Fenton reation으로 유도된 토양 중 sulfoxaflor 뿐만 아니라 대사체들의 빠른 분해는 후작물 흡수이행 정도를 낮추는데 기여할 수 있을 것으로 사료된다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
Literature cited
-
Alvarez M, Mortier CD, Cirelli AF, 2013. Behavior of insecticide chlorpyrifos on soils and sediments with different organic matter content from provincia de Buenos Aires, Republica Argentina. Water Air Soil Pollut. 224:1453.
[https://doi.org/10.1007/s11270-013-1453-0]

-
Arnold SM, Hickey WJ, Harris RF, 1995. Degradation of atrazine by Fenton's reagent : condition optimization and product quantification. Environ. Sci. Technol. 29(8):2083-2089.
[https://doi.org/10.1021/es00008a030]

-
Bovin A, Cherrier R, Schiavon M, 2005. A comparison of five pesticide adsorption and desorption processes in thirteen contrasting field soil. Chemosphere. 61(5):668-676.
[https://doi.org/10.1016/j.chemosphere.2005.03.024]

-
Chun SB, Hyun IH, Lee MG, Kam SK, 2018. Adsorption and leaching characteristics of nonionic pesticides in soils of jeju island, Korea. J. Environ. Sci. Int. 27(7):561-575. (In Korean)
[https://doi.org/10.5322/JESI.2018.27.7.561]

-
EFSA (European Food Safety Authority), 2014. Conclusion on the peer review of the pesticide risk assessment of the active substance sulfoxaflor. EFSA journal. 12(5):3692. 170 pp.
[https://doi.org/10.2903/j.efsa.2014.3692]

-
Guan YH, Ma J, Li XC, Fang JY, Chen LW, 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system. Environ. Sci. Technol. 45(21):9308-9314.
[https://doi.org/10.1021/es2017363]

-
Hwang JI, Kwak SY, Lee SH, Kang MS, Ryu JS, et al, 2016a. Establishment of safe management guideline based on uptake pattern of pesticide residue from soil by radish. Korean J. Envrion. Agric. 35(4):278-285. (In Korean)
[https://doi.org/10.5338/KJEA.2016.35.4.36]

- Hwang JI, 2016b. Advanced management for plant uptake of pesticide residue in soil : soil-plant uptake modeling and enhanced remediation. PhD Diss. Kyungpook National Univ., Korea.
- JMPR (Joint FAO/WHO Meeting on Pesticide Residues), 2011. Pesticide residues in food. pp. 269-306.
- KCPA (Korea Crop Protection Association), 2020. Guidelines of crop protection; KCPA, Korea, http://www.koreacpa.org/index.php, (Accessed Sept. 11 2020).
-
Kim SW, Rahman MM, El-aty AM, Kabir MH, Na TW, et al., 2016. Simultaneous detection of sulfoxaflor and its metabolites X11719474 and X11721061, in lettuce using a modifide QuEChERS extraction method and liquid chromatography-tandem mass spectrometry. Biomed Chromatogr. 31:e3885.
[https://doi.org/10.1002/bmc.3885]

-
Kurukutla AB, Kumar PSS, Anandan S, Sivasankar T, 2015. Sonochmical degradation of rhodamine B using oxidants, hydrogen peroxide/peroxydisulfate/peroxymonosulfate with Fe2+ ion : proposed pathway and kinetics. Environ. Eng. Sci. 32(2):129-140.
[https://doi.org/10.1089/ees.2014.0328]

-
Kwak SY, Hwang JI, Lee SH, Kang MS, Ryu JS, et al, 2017. Plant uptake and residual patterns of insecticide dinotefuran by radish. Korean J. Pestic. Sci. 21(3):233-240. (In Korean)
[https://doi.org/10.7585/kjps.2017.21.3.233]

- Lee WS, Kim JE, 1998. Effects of soil organic matter and oxidoreductase on adsorption and desorption of herbicide oxadiazon in soils. Korean J. Pestic. Sci. 2(3):70-78. (In Korean)
-
Loso MR, Benko Z, Buysse A, Johnson TC, Nugent BM, et al., 2016. SAR studies directed toward the pyridine moiety of the sap-feeding insecticide sulfoxaflor (Isoclast™ active). Bioorg. Med. Chem. 24(3):378-382.
[https://doi.org/10.1016/j.bmc.2015.11.022]

- MAFRA (Ministry of Agricultural, Food and Rural Affairs) 2020. Accomplishments analysis of pesticide PLS and its future challenges. Sejong, Korea.
- MDA (Mineesota Department of Agriculture), 2013. New active ingredient review : MDA, Minnesota, USA.
- MFDS (Ministry of Food and Drug Safety), 2017. Korean food standards codex pesticide analytical manual 5th, Cheongju, Korea. (In Korean)
-
Micheal O, Lee SH, Kwak SY, Sarker A, Cho SC, et al, 2018. Dissipation patterns of insecticide sulfoxaflor in spinach and korean cabbage. Korean J. Pestic. Sci. 22(4):316-326.
[https://doi.org/10.7585/kjps.2018.22.4.316]

-
Nugent BM, Buysse A, Loso M, Babcock JM, Johnson TC, et al., 2015. Expanding the structure-activity relationship of sulfoxaflor:the synthesis and biological activity of N-heterocyclic sulfoximines. Pest Manag. Sci. 71(7):928-936.
[https://doi.org/10.1002/ps.3865]

- RDA (Rural Development Administration), 2015. Pesticide residue definitions for agricultural products, Jeonju, Korea. (In Korean)
- RDA (Rural Development Administration), 2000. Analytical method for soil and plant. pp. 103-130. Jeonju, Korea. (In Korean)
-
Shah NS, He X, Khan JA, Khan HM, Boccelli DL, et al, 2015. Comparative studies of various iron-mediated oxidative system for the phtochemical degradation of endosulfan in aqueous solution. J. Photochem. Photobiol. A Chem. 306:80-86.
[https://doi.org/10.1016/j.jphotochem.2015.03.014]

-
Sparks DL, 1995. Environmental soil chemistry. Academic press. USA. pp 99-139.
[https://doi.org/10.1016/B978-0-12-656445-7.50009-7]

-
Terry C, Rasoulpour RJ, Knowles S, Billington R, 2015. Utilizing relavtive potency factors(RPF) and threshold of toxicological concern(TTC) concepts to assess hazard and human risk assessment profiles of environmental metabolites : A case study. Regul. Toxicol. Pharmacol. 17(2):301-317.
[https://doi.org/10.1016/j.yrtph.2014.12.010]

-
Watson GB, Olson MB, Beaver KW, Loso MR, Sparks TC, 2017. Characterization of a nicotinic acetylcholine receptor binding site for sulfoxaflor, a new sulfoximine insecticide for the control of sap-feeding insect pests. Pesti. Biochem. Physiol. 143:90-94.
[https://doi.org/10.1016/j.pestbp.2017.09.003]

Se-yeon Kwak, School of Applied Biosciences, Kyungpook National University, Daegu 41566, Republic of Korea, Ph.D. student, http://orcid.org/0000-0002-5372-792X
Ja-gun Kang, Agricultural Research Center, Hankooksamgong Co. Ltd, Researcher
Sang-hyeob Lee, School of Applied Biosciences, Kyungpook National University, Daegu 41566, Republic of Korea, Ph.D. student
Ae-Ji Nam, , School of Applied Biosciences, Kyungpook National University, Daegu 41566, Republic of Korea, Master student
Dong-ju Lee, School of Applied Biosciences, Kyungpook National University, Daegu 41566, Republic of Korea, Master student
Ye-jin Heo, School of Applied Biosciences, Kyungpook National University, Daegu 41566, Republic of Korea, Master student
Jang-eok Kim, School of Applied Biosciences, Kyungpook National University, Daegu 41566, Republic of Korea, Professor, http://orcid.org/0000-0003-1412-9393
Writing manuscript-preparing, Reviewing and editing original draft, Se-yeon Kwak; Research and data ordering, Ja-gun Kan; Concept establishment and presentation of method, Sang-hyeob Lee; Data analysis, Ae-Ji Nam, Dong-ju Lee and Ye-jin Heo; Plan and supervise the entire experiment, Guide the writing of the manuscript, Jang-eok Kim