Boscalid에 대하여 저항성인 Botrytis cinerea의 유전자 변이 분석
초록
딸기에서 분리한 잿빛곰팡이병균 Botrytis cinerea의 197개 균주를 사용하여 boscalid에 대한 저항성 검정을 실시하였다. 2011년 균주에서 5균주, 2015년 균주에서 4균주, 2016년 균주에서 37개 균주 등 전체 균주 중 23.4%인 총 46개 균주가 저항성 균주로 검정되었다. Boscalid에 대해서 감수성인 1균주와 저항성인 4균주를 선발하여 sdhB 유전자 분석을 실시한 결과, 저항성 균주의 sdhB 유전자에서 아미노산 코돈 3곳의 아미노산이 치환되어있는 4종류의 돌연변이(P225F, N230I, H272L/R/Y)를 검출하였다. 딸기에서 분리한 315개의 B. cinerea 균주를 사용하여 sdhB 유전자 분석을 실시한 결과, 21.6%인 68개 균주에서 4가지의 돌연변이형이 확인되었다. 우점형은 P225F형으로 전체 변이주 중에서 50.0%를 차지하였으며, boscalid를 비롯해서 fluopyram, fluxapyroxad에 대해서 고저항성을 penthiopyrad에 대해서는 중 저항성을 보였다. H272R형은 44.1%를 차지하였으며, boscalid에 대해서만 고 저항성을 보였고 나머지 살균제에 대해서는 감수성이었다. N230I와 H272L형은 2.9%로 검출 빈도가 낮았으며, boscalid에만 고 저항성이었고 fluopyram과 fluxapyroxad에 대해서는 중 저항성을 나타내었다. Penthiopyrad에 대해서는 N230I형은 감수성을 나타내었고, H272L형은 중 저항성 반응을 보였다. Isopyrazam에 대해서는 모든 균주가 감수성이었다. 이상의 결과에서 보는 것과 같이, SDHI 살균제를 사용하여 잿빛곰팡이병을 관리하고자 할 때, boscalid와 fluopyram, fluxapyroxad, penthiopyrad를 동시에 사용하거나 연속으로 사용하는 것은 지양해야 하며, 특별한 주의를 필요로 하겠지만, isopyrazam을 SDHI 대체 살균제로 사용할 수는 있을 것으로 생각한다.
Abstract
Resistance to boscalid was evaluated using 197 isolates of Botrytis cinerea causing gray mold obtained from strawberries. Of the total isolates, 23.4% were resistant to boscalid. There were 5 isolates in 2011, 4 isolates in 2015, and 37 isolates in 2016 among 46 resistant isolates. One isolate sensitive to boscalid and 4 isolates resistant to boscalid were selected and sdhB gene analysis was performed. Mutations occurred in three amino acid codons of the sdhB gene of the 4 resistant isolates, and the mutations were detected in four types such as P225F, N230I, and H272L/R. As a result of sdhB gene analysis using 315 B. cinerea isolates obtained from infected strawberries, 4 mutant types were identified in 68 isolates (21.6%). The dominant type was P225F type, which accounted for 50.0% of all mutants, and showed high resistance to boscalid, fluopyram, and fluxapyroxad, and moderate resistance to penthiopyrad. H272R type accounted for 44.1%, and showed high resistance only to boscalid and was sensitive to the rest of the fungicides used in this experiment. Types N230I and H272L had low detection frequency (2.9%), high resistance only to boscalid, and medium resistance to fluopyram and fluxapyroxad. To penthiopyrad, N230I type showed to be sensitive and H272L type showed moderate resistance. All isolates were susceptible to isopyrazam. As shown in the above results, when trying to manage gray mold disease using SDHI fungicides, simultaneous or consecutive use of boscalid, fluopyram, fluxapyroxad and penthiopyrad should be avoided and, although special attention should be paid, isopyrazam can be used as an alternative SDHI fungicide.
Keywords:
Botrytis cinerea, Resistance to boscalid, SDHI fungicide, sdhB gene키워드:
Boscalid 저항성, 숙신산탈수소효소 억제 살균제, sdhB 유전자서 론
Carboxamide계에 속하는 boscalid는 미토콘드리아의 전자전달계를 구성하는 효소 복합체 II를 저해하는 살균제로 알려져 있다. 효소 복합체 II는 tricarboxylic acid (TCA) 회로에서 숙신산을 포말산으로 산화하는 과정 또는 전자전달계에서 퀴논의 환원 과정에 관여하는 효소로 알려져 있는데, boscalid는 효소 복합체 II의 유비퀴논 부착 위치인 Q-site에 부착하여 병원성 곰팡이의 세포 호흡을 억제한다(Cecchini, 2003). 전자전달계의 효소 복합체 II를 특이적으로 저해하는 boscalid는 cytochrome bc1 복합체 활성을 저해하는 strobilurin계 살균제, β-tubulin의 중합을 억제하는 benzimidazole계, C-14 탈메틸화효소의 활성을 저해하는 살균제(demethylase inhibiting fungicide, DMI) 등과 교차 저항성 관계를 보이지않는 특징을 가지고 있다(Leroux, 2004). 하지만 이런 특징적인 작용점을 갖는 이유 때문에 포장에서 사용된 후로 다양한 병원균에서 저항성이 나타나는 문제가 보고되었다. Boscalid에 대한 저항성 문제가 보고되어 있는 식물병원균으로 Alternaria alternata, Corynespora cassiicola, Didymella bryoniae, Podosphaera xanthii 등이 있다(Avenot and Michailides, 2007; Miyamoto et al, 2009; Miyamoto et al., 2010; Avenot et al., 2012).
Botrytis cinerea는 채소, 화훼, 과수 등에서 잿빛곰팡이병을 일으켜 많은 피해를 주고 있어, 미생물을 사용하는 생물적 방제 방법뿐만 아니라 다양한 방제 방법으로 방제를 시도하고 있지만, 일반적으로 사용하는 방법은 살균제를 처리하는 화학적 방제 방법이다(Leroux, 2004; Williamson et al., 2007). 하지만 B. cinerea는 살균제 저항성 발현 위험도가 높은 병원균으로 알려져 있으며, trifloxystrobin, iprodione, fludioxonil, fenhexamid, cyprodinil 등 기존의 특이적인 작용점을 갖는 대부분의 살균제에 대해서 저항성이 보고되어 있다(Brent and Hollomon, 2007; Weber and Hahn, 2011). 전 세계적으로 2003년부터 사용하기 시작한 SDHI 살균제인 boscalid에 대해서도 딸기와 사과 등에서 저항성 발현이 보고되고 있다(Yin et al., 2011; Konstantinou et al., 2015). 그리스에서는 2012년 Manolada와 Pieria 지역의 딸기에서 분리한 B. cinerea 중에서 boscalid 저항성인 균주의 분리 빈도가 54.9 – 77.1%로 나타났으며, boscalid와 pyraclostrobin의 합제인 Pristine이라는 살균제를 2005년부터 2009년까지 연속 사용한 미국 워싱턴 주의 사과밭에서도 저항성 균주의 분리 빈도가 19.1%로 나타났다. 스페인의 딸기에서 2014년부터 2016년까지 분리한 B. cinerea의 580 균주에서는 56.9%가 저항성균이었다(Veloukas et al., 2013). 국내에서도 2011년에 딸기, 토마토, 오이와 같은 과채류에서 채집한 B. cinerea에서 EC50값이 100 μg/mL 이상이 되는 균주들이 발견되기 시작하였으며, 2016년에 분리한 균주 중에서는 33.6%가 넘는 균주가 저항성 균주로 나타났다(투고 중).
Boscalid의 작용점인 숙신산탈수소효소(succinate dehydrogenase, SDH)는 미토콘드리아 내막에 존재하는 효소 복합체 II로 알려져 있으며, 내막 외부로 노출되어 있는 SDHA(succinate dehydrogenase subunit A)와 SDHB, 그리고 내막 내부에 내재되어 있는 SDHC와 SDHD의 4개의 소단위로 구성되어 있다(Cecchini, 2003). 그런데 숙신산탈수소효소는 TCA 회로의 다른 탈수소효소와는 다르게, 숙신산 유래의 전자를 NAD+의 중간체에 전달하지 않고 미토콘드리아 내막에 존재하는 유비퀴논 풀에 직접 전달하기 때문에, 세포 호흡의 중요한 요소가 된다(Sierotzki and Scalliet, 2013). 그런데 세포 호흡에서 중요한 역할을 하고 있는 sdh 유전자의 돌연변이가 SDHI 살균제에 대한 B. cinerea의 살균제 저항성을 유도한다(Veloukas et al., 2011; Veloukas et al., 2013; Amiri et al., 2014; Fernandez-Ortuño et al., 2017; Hu et al., 2016). B. cinerea에서 SDHI 살균제에 대한 저항성을 유발하는 sdhB 유전자의 변이형은 225번째, 230번째 그리고 272번째의 아미노산 코돈에서 발생하는 5가지가 있다(Veloukas et al., 2011). 아미노산 코돈 225번째와 230번째에서는 염기 두 개가 CC에서 TT로 변화하여 proline이 phenylalanine으로 치환되는 P225F형과, A에서 T로 변화하면서 asparagine이 isoleucine으로 치환되는 N230I형이 있다. 아미노산의 272번째 코돈에서는 3가지의 변이형이 나타나는데, C가 T로 바뀌면서 histidine이 arginine으로 치환되는 H272R형, A에서 G로 바뀌면서 histidine이 tyrosine으로 치환되는 H272Y형, A가 T로 변화하면서 아미노산이 histidine에서 leucine으로 치환되는 H272L형이 있다. Fernandez-Ortuño et al. (2017)은 SDHI 살균제에 대한 저항성 정도와 sdhB 유전자의 변이형을 가지고 스페인의 딸기에서 분리한 580개의 B. cinerea 균주를 4가지의 유형으로 분류하기도 하였다. 제1유형은 boscalid에만 저항성을 보이는 H272R과 H272Y형으로 전체의 30.0%를 차지하였으며, 전체의 13.8%를 차이하는 제2유형은 boscalid와 penthiopyrad에 대한 저항성으로 H272R과 H272Y형이었다. 제3유형은 boscalid, fluxapyroxad, penthiopyraddp 저항성이며 H272Y 변이형으로, 5.7%가 속하였으며, 제4유형은 3종의 SDHI 살균제뿐만 아니라, fluopyram에까지 저항성인 N230I 변이형으로, 7.9%가 4유형에 속하였다. 그런데 2014년부터 2016년까지 스페인에서 수집한 SDHI 살균제 저항성 B. cinerea에서는 H272L형과 P225F형의 sdhB 유전자 돌연변이는 검출되지 않았다. SDHI 살균제의 작용점인 sdhB 유전자의 특정 위치에서 발생하는 점 돌연변이에 의한 아미노산 치환은 SDHI 살균제에 대한 저항성 유발의 원인이 되지만, 유전자 변이형의 각 살균제에 대한 반응은 일관성이 떨어졌다. 특히 미국 동부의 딸기밭에서 수집한 B. cinerea 2,570균주 중에서 SDHI 살균제 저항성인 3가지의 변이형(H272Y, N230I, P225F)은 SDHI 살균제에 속하는 또 다른 benzovindiflupyr에 대해서는 모두 감수성 반응을 나타내기도 하였다(Hu et al., 2016).
본 연구에서는 딸기에서 분리한 B. cinerea 균주를 사용하여 SDHI 살균제에 속하는 boscalid, fluopyram, penthiopyram, isopyrazam, fluxapyroxad에 대한 저항성 검정을 실시하였으며, 살균제 저항성 B. cinerea의 sdhB 유전자 염기서열을 분석하여 SDHI 살균제 저항성인 균주의 유전자 변이 양식과 SDHI 살균제에 대한 저항성 정도를 비교하였다.
재료 및 방법
병원균 분리
충북, 충남, 경남의 딸기 시설 재배에서 잿빛곰팡이병이 발생한 딸기를 채집하고, 병반 위에 형성된 병원균의 분생포자를 단포자 분리하여, B. cinerea 315균주를 확보하였다. 이 중에 197개 균주는 5종의 SDHI 살균제(boscalid (a.i. 49.3%, WG), flu opyram ( a.i. 40%, SC), penthiopyrad (a.i. 20%, EC), isopyrazam (a.i. 12.57%, EC), fluxapyroxad (a.i. 15.3%, SC))에 대한 감수성 정도를 한천희석법으로 검정하였으며, sdhB 유전자를 증폭하여 돌연변이 발생 여부를 조사하였다. 한천희석법에 사용하지 않았던 나머지 118개 균주는 sdhB 유전자를 증폭하여 염기서열을 분석함으로써 sdhB 유전자 돌연변이의 발생을 조사하였다.
B. cinerea의 SDHI 살균제에 대한 반응 조사
딸기에서 분리한 B. cinerea 15BCGD3, 15BCGD5, 15BCGD7 15BCGD11, 15BCGD15를 선발하여 SDHI 살균제인 boscalid, fluopyram, penthiopyrad, isopyrazam, fluxapyroxad 등에 대한 반응을 한천희석법으로 조사하였다. PDA 배지에 각 살균제의 정해진 농도가 되도록 첨가하였으며, 세균의 오염을 방지하기 위해서 streptomycin을 300 μg/mL가 되도록 첨가하였다. B. cinerea의 접종원은 20oC의 PDA 배지에서 4일 동안 배양한 B. cinerea의 균사 선단에서 직경 3 mm의 균사조각을 떼어내어 사용하였다. 준비한 살균제 배지에 병원균의 균사 조각을 접종하고 20oC에서 3일 동안 배양한 후, 균총의 직경을 측정하였다. 살균제의 효과는 균사생장 억제율(%)을 가지고 비교하였는데, 균사생장억제율은 아래 식과 같이 살균제 배지 상에서 균총의 직경을 살균제가 첨가되지 않은 처리구에서 균총의 직경과 비교하여 계산하였다.
| (1) |
gDNA 추출
병원균의 균총 선단에서 균사 조각을 떼어 PDA 배지에 접종한 후, 20oC 암조건의 배양기에서 5일간 배양하였다. 커버글라스를 이용하여 균사체를 긁어 수확하여, glass bead (크기 0.1 mm)가 담긴 2 mL tube에 넣어 –70oC에서 12시간 이상 동결 건조한 후, bead beater (bullet blender, NEXT ADVANCE)를 이용하여 마쇄하였다. 0.5% SDS-CTAB (2.5M NaCl, 0.25 M EDTA (pH8.0), 0.5 M Tris-HCI (pH7.5), 1% hexadecyl trimethyl ammonium bromide, 0.5% sodium dodesyl sulfate)를 1 mL 첨가하여 65oC에서 1시간 동안 반응한 후, 동량의 phenol을 첨가하여 심하게 흔들어 주었다. 상온에서 15분 동안 보관한 후, 13,000 rpm에서 10분간 원심분리하였으며, 이 과정을 한 번 더 반복하였다. 상징액을 1.5 mL tube에 옮기고 동량의 chloroform을 첨가하고, 50회 정도 잘 섞이도록 흔들어 상온에서 15분 보관 후, 13,000 rpm에서 10분간 원심분리하였다. 상징액을 수거하고 동량의 isopropyl alchol을 첨가한 후, 13,000 rpm에서 10분간 원심분리하였다. 상징액을 버리고 남은 침전물에 70% ethanol 200 μL를 첨가하고 충분히 섞이도록 50회 정도 잘 흔들어 준 후, 13,000 rpm에서 10분간 원심분리하였다. 상징액을 버리고 침전물을 실온에서 충분히 건조시킨 다음, TE buffer 70 μL와 RNase A 5 μL를 첨가하였다. 37oC의 항온수조에서 30분, 65oC에서 1시간 동안 반응시킨 후, –20oC에 보관하며 실험에 사용하였다.
sdhB 유전자 증폭 및 염기서열 분석
sdhB gene 유전자를 증폭하기 위하여 IpBcBeg(5'-CCACTC CTC CAT AAT GGC TGC TCT CCG C-3')과 IpBcEnd2(5'-CTC ATC AAG CCC CCT CAT TGA TATC-3') primer를 사용하였다(Leroux 등, 2010). PCR 반응액 조성은 10X Taq buffer (1.5 mM MgCl2), dNTP mix 2.5 μL, 10 pmole의 forward primer와 reverse primer를 각각 1 μL, genomic DNA (25 ng/μL) 2 μL, Taq DNA polymerase (5 U/μL) 0.1 μL (Kapabiosystems)에 멸균수를 첨가하여 최종 25 μL의 PCR 반응액을 준비하였다. PCR 반응 조건은 95oC에서 3분간 변성 단계를 거친 후, 94oC에서 30초 동안 변성, 60oC에서 30초 동안 결합, 72oC에서 30초 동안 신장 과정을 35회 반복하였고, 마지막으로 72oC에서 5분간 반응시킨 후 종료하였다. PCR 증폭 산물을 확인하기 위하여 1X TAE buffer로 1% agarose gel을 만들고 safe viewTM classic을 첨가하여 주었다. 100 V에서 45분간 전기영동을 수행하고 UV-transilluminator에서 유전자의 증폭 여부를 확인한 후, PCR SV (GeneAll. Seoul, Korea)로 정제하였다. 정제된 PCR 산물을 (주)Macrogen에 의뢰하여 염기서열을 분석하였다. 분석된 sdhB 유전자의 염기서열은 BioEdit ver.7.0.9.0의 clustal X를 이용하여 정리하였고, MEGA ver 5.2.1에서 정렬한 후 NCBI GenBank의 염기서열을 이용하여 비교 분석하였다.
결과 및 고찰
B. cinerea의 boscalid에 대한 반응
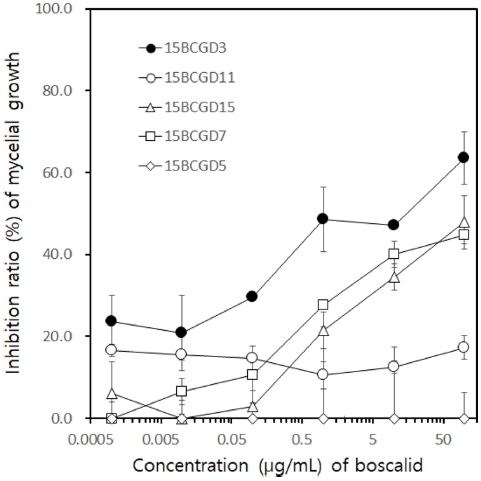
Fig. 1에서 보는 것과 같이 실험에 사용한 B. cinerea 5균주의 boscalid에 대한 반응을 저항성과 감수성으로 구별하기가 쉽지 않았지만, 국내 B. cinerea의 SDHI 살균제에 대한 저항성 기준에 따라서 5균주의 EC50값을 구하여 저항성 정도를 분류하였다. EC50값이 20 μg/mL 이하인 균주를 감수성균, 20 – 100 μg/mL인 균주를 중도저항성, 100 μg/mL 이상이 되는 균주를 저항성 균주로 분류하였다. Boscalid에 대한 각 균주의 EC50값은 B. cinerea 15BCGD3만이 6.41 μg/mL로 감수성 균주로 판명되었고, 15BCGD11, 15BCGD15, 15BCGD7, 15BCGD5는 모두 100 μg/mL 이상으로 저항성 균주로 판명되었다. 저항성 4균주 중에서 15BCGD15 균주와 15BCGD7 균주는 boscalid 10과 100 μg/mL 처리구에서 균사생장 억제율이 34.6과 40.0%, 그리고 47.9와 44.7%이었다. 반면에 15BCGD11은 모든 처리구에서 20% 이하의 억제율을 보였으며, 15BCGD5는 100 μg/mL에서조차 균사생장을 전혀 억제하지 못하였다.
SDHI 살균제의 균사생장 억제효과
선발한 5균주에 대한 fluopyram, penthiopyrad, isopyrazam, fluxapyroxad의 균사생장 억제효과를 조사하였다(Fig. 2). Penthiopyrad와 isopyrazam은 처리 농도가 증가하면서 5균주의 균사생장 억제효과도 증가하였다. 특히 isopyrazam은 100 μg/mL 처리구에서 4균주의 균사생장을 완전히 억제하였을 뿐 아니라, 15BCGD7도 99.9% 균사생장을 억제하였다. Penthiopyrad 역시 처리 농도가 증가하면서 억제율도 증가하였고, 100 μg/mL에서는 15BCGD3, 15BCGD15, 15BCGD7의 균사생장을 80.4, 79.2, 77.8% 억제하였으며, 100 μg/mL의 boscalid 처리구에서 20% 이하의 억제율을 보였던 15BCGD11과 15BCGD5에 대해서도 65.5와 64.3%의 억제효과를 보였다. Fluopyram과 fluxapyroxad의 억제효과는 boscalid와 유사하여, 15BCGD3, 15BCGD15, 15BCGD7은 감수성 반응을, 15BCGD11과 15BCGD5는 저항성 반응을 보였다. 15BCGD11과 15BCGD5 균주는 penthiopyrad에 대해서도 저항성 반응을 보였다. 각 균주의 SDHI 살균제에 대한 EC50값을 계산하면 15BCGD11과 15BCGD5는 boscalid, fluopyram, fluxapyroxad에 대해서 100 μg/mL 이상의 EC50값을 나타내어 저항성 균주로, penthiopyrad에 대해서는 29.9 μg/mL와 45.7 μg/mL를 나타내어 중도저항성 균주로 구분할 수 있었다. 하지만 두 균주도 isopyrazam에 대한 EC50값은 2.3과 0.5 μg/mL로 감수성 균주로 분류되었다. 두 균주를 제외한 15BCGD3, 15BCGD15, 15BGCD7 등 3균주는 fluopyram, penthipyrad, isopyrazam, fluxapyroxad 등 4종의 SDHI 살균제에 대한 EC50값이 15 μg/mL 이하로 나타나, 모두 감수성 균주로 구분되었다.
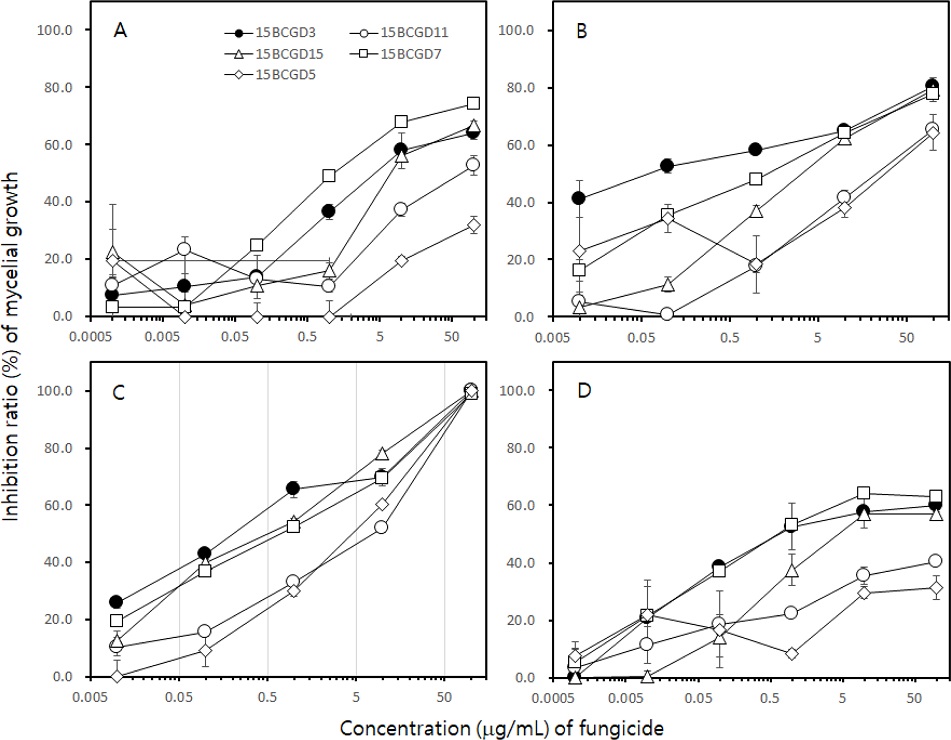
Inhibitory effect of fungicides inhibiting succinate dehydrogenase on the mycelial growth of Botrytis cinerea. Fungicides used in this experiment were fluopyram (A), penthiopyrad (B), isopyrazam (C) and fluxapyroxad (D). The assessment of fungicides against the mycelial growth of B. cinerea was performed using an agar dilution method. All isolates of B. cinerea were incubated on PDA amended with indicated concentration of each fungicide at 20oC for 3 days.
숙신산탈수소효소 유전자의 염기서열 분석
B. cinerea의 gDNA로부터 SDHI 살균제의 작용점인 숙신산탈수소효소의 sdhB 유전자를 증폭하여, 1,021 bp의 증폭산물을 얻었다. 감수성 균주 B. cinerea 15BCGD3의 sdhB 유전자 염기서열과 비교한 결과, boscalid 저항성균으로 확인된 B. cinerea 15BCGD11, 15BCGD15, 15BCGD7, 15BCGD5의 유전자에서는 225번째, 230번째, 272번째의 아미노산이 치환되어 있음을 확인하였다(Fig. 3). B. cinerea 15BCGD11은 225번째의 아미노산 코돈이 CCC (proline)에서 TTC (phenylalanine)로 치환되었으며(P225F), B. cinerea 15BCGD15는 230번째 코돈이 AAC (asparagine)에서 ATC (isoleucine)로 치환되었다(N230I). B. cinerea 15BCGD7과 15BCGD5는 272번째 코돈 위치에서 DNA의 변화가 발견되었는데, 15BCGD7은 CAC (histidine)에서 CGC (arginine)로(H272R), 15BCGD5는 CAC (histidine)에서 CTC (leucine)로 치환되었다(H272L).
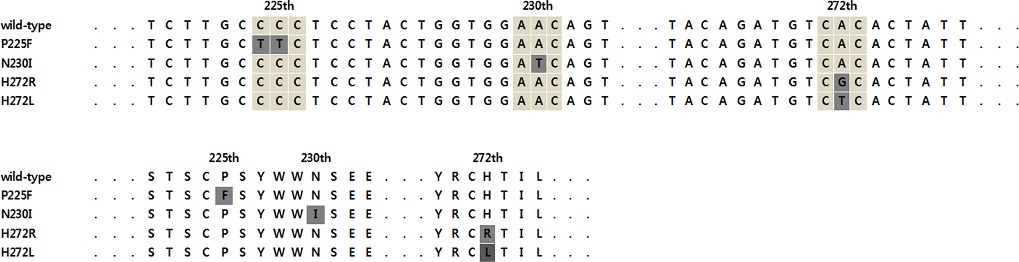
Comparison of nucleotides (upper) and amino acids (low) sequence of amplified sdhB gene, obtained with gDNA of Botrytis cinerea. The black box showed that the amino acid codon at position 225 was CCC (proline) in the B. cinerea 15BCGD3 sensitive to boscalid, but was substituted with TTC (phenylalanine) in the B. cinerea 15BCGD11 resistant to the fungicide. This genetic mutant was designated as P225F. At amino acid codon 230, AAC (asparagine) of the sensitive isolate was substituted with ATC (isoleucine) in B. cinerea 15BCGD15 resistant to the fungicide. The substitution was designated as N230I. In addition, the 272 amino acid codon of sensitive B. cinerea 15BCGD3 was substituted from CAC (histidine) to CGC (arginine) in B. cinerea 15BCGD7 or CTC (leucine) in B. cinerea 15BCGD5. These two mutations were labeled H272R and H272L, respectively.
Boscalid 저항성 B. cinerea의 유전자 변이형
딸기에서 분리한 총 315개의 B. cinerea 균주 중에서 2011년 균주 52개, 2015년 균주 38개, 2016년 균주 107개 등 총 197개 균주를 임의로 선발하여 boscalid의 균사생장 억제효과를 한천희석법으로 조사하였다. 그 결과, EC50값이 100 μg/mL/ 이상인 고 저항성 균주는 2011년에 5균주, 2015년과 2016년에는 각각 4균주와 37균주씩 분리되었다(Fig. 4). 2016년 균주 중에서는 2011년과 2015년 균주에서는 볼 수 없었던 EC50값이 20 μg/mL에서 100 μg/mL 사이인 중도 저항성 균주도 15균주 검출되었다.
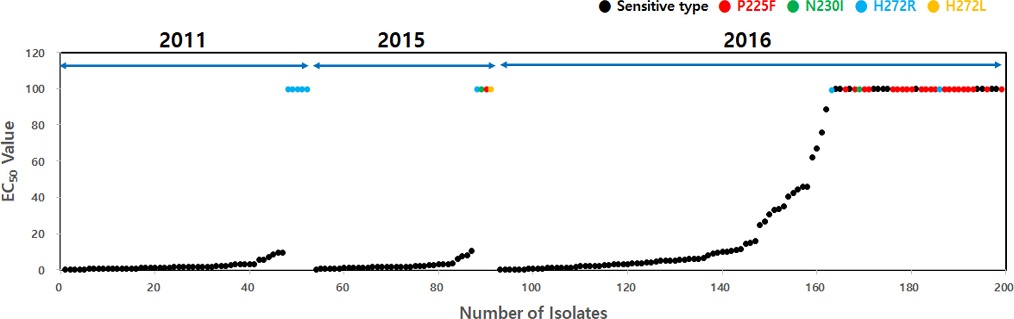
Distribution of EC50 value (μg/mL) of Botrytis cinerea isolates to boscalid and detection of genetic mutants. In this experiment, total 197 isolates of B. cinerea were used for determining EC50 value of each isolate of B. cinerea to boscalid and detecting the genetic mutant type. EC50 value of each isolate was calculated by using inhibitory ratio of boscalid obtained through an agar dilution method. Detecting the genetic mutant type was conducted by multiplex PCR using allele-specific primer of each mutant type, as described in Materials and Methods.
실험에 사용한 197개 균주에 대해서 유전자 변이형 조사를 실시한 결과, Fig. 4에서 보는 것과 같이 유전자 변이형은 EC50값이 100 μg/mL 이상인 균주에서만 확인되었다. 2011년에 분리한 52개 균주 중에서 boscalid 저항성 균주는 총 5균주이었는데, 저항성 균주 모두 272번째 아미노산 코돈에서 CAC (histidine)가 CGC (arginine)로 치환되는 H272R형이었다. 2015년의 38개 균주 중에서는 4개의 균주가 EC50값이 100 μg/mL 이상인 저항성균으로 검정되었고, 이 저항성균은 P225F형, N230I형, H272R형과 H272L형이 각각 1균주씩 확인되었다. 2016년에는 107개 균주 중에서 저항성 균주는 37개이었으며, 그 중 22개 균주가 P225F형이었고, N230I형과 H272R형이 각각 1균주와 2균주가 검출되었다. 하지만 12개의 저항성 균주에서는 sdhB 유전자에서 아미노산이 치환된 돌연변이를 검출할 수 없었다. SDHI 살균제에 대한 B. cinerea 저항성은 숙신산탈수소효소의 소단위 B에서 살균제 부착 부위의 아미노산이 치환되면서 살균제가 부착하지 못하기 때문에 발생한다. 그런데 한천희석법의 결과에서는 boscalid에 대한 반응이 저항성으로 나타났음에도 불구하고, sdhB 유전자의 염기서열 분석에서 치환된 부위가 나타나지 않았던 12개의 균주는 sdhC와 sdhD 유전자의 염기서열 분석이 추가되어야 할 것으로 본다. 왜냐하면 Alternaria alternata의 SDHI 살균제에 대한 저항성균 중에는 소단위 B뿐만 아니라 C와 D에서도 점돌연변이가 발생하기 때문이다 (Avenot and Michailide, 2007; Avenot, et al., 2009). Alternaria alternata의 소단위 C에서 134번째의 histidine이 arginine으로 치환된 H134R형과, 소단위 D의 123번째 코돈에서 asparagine이 glutamic acid로 치환된 D123E형과 133번째 코돈의 asparagine이 arginine으로 치환된 D133R형의 변이형 등도 SDHI 살균제에 대해서 저항성을 보였다. 효소 복합체 II의 소단위 C와 D의 점돌연변이에 의해서 SDHI 살균제에 저항성을 나타내는 식물병원균은 Alternaria alternata 이외에도 Corynespora cassilcola, Sclerotinia sclerotiorum, Aspergillus oryzae 등이 알려져 있다(Avenot and Michailide, 2010). 지금까지 식물병원균의 SDHI 살균제 저항성을 유도하는 숙신산탈수소효소의 돌연변이형은 병원균에 따라서 다르게 나타나는데, 27종 이상이 알려져 있다(Sierotzki and Scalliet, 2013). 따라서 본 실험 결과에서 보는 P225F, N230I, H272L/R 등과 같은 4종의 변이형 이외의 변이형 탐색을 위한 분석이 필요할 것으로 생각한다.
시기와 지역에 따른 sdhB 유전자 변이형의 변화
한천희석법으로 boscalid에 대한 효과를 검정을 실시했던 197균주와 한천희석법을 실시하지 않았던 118균주 모두를 포함하여 sdhB 유전자를 증폭하고, 유전자 변이형을 조사하였다. Table 1에서 보는 것과 같이 분리 연도뿐만 아니라 분리한 지역 간에도 유전자 변이형의 비율이 다르게 나타났다. 2011년의 52개 균주 중에서는 5균주만이 H272R형으로 나타났는데, 경남과 충남에서 각각 4균주와 1균주가 분리되었다. 2015년에는 충남 지역에서 H272R형의 변이형이 7균주 분리되었고, 충북에서 1균주가 분리되었다. 충북에서는 H272R형 뿐만 아니라 P225F, N230I, H272L형이 각각 1균주씩 분리되었다. 2016년에는 충북과 경남에서 26균주씩의 저항성 균주가 분리되었는데, 충북에서는 P225F형이 22균주로 급증하였으며, N230I, H272R, H272L형이 각각 1, 2, 1균주씩 분리되었다. 경남에서는 H272R형이 15균주로 제일 많이 분리되었고, 나머지 11균주는 모두 P225F형으로 확인되었다. 총 3년간(2011년, 2015년, 2016년) 채집하여 분리한 B. cinerea 315균주 중에서 sdhB 유전자에서 점 돌연변이가 확인된 균주는 68균주로, 전체 균주 중에서 21.6%를 차지하였다. 전체 변이주 중에서 P225F형이 34균주로 가장 높은 빈도로 검출되었고, H272R형은 30균주가 검출되었다. P225F형은 2015년 충북 지역에서만 1균주가 발견된 후에 2016년에는 충북과 경남에서 33균주가 분리되면서 빈도가 급증하였다. H272R형은 2011년에 5균주, 2015년에 8균주, 그리고 2016년에 17균주로, 계속적으로 검출되는 경향을 보였다. SDHI 살균제 저항성 B. cinerea에서는 272번째의 코돈에서 histidine이 tyrosine으로 치환되는 H272Y형의 변이형이 많이 알려져 있는데(Sierotzki and Scalliet, 2013), 본 실험에서는 검출되지 않았고, 대신 미국 동부와 스페인의 딸기에서는 검출되지 않았던 H272L형이 2015년과 2016년에 각각 1균주씩 검출되었다.
sdhB 유전자 변이형 B. cinerea의 살균제에 대한 반응 비교
잿빛곰팡이병균 315개 균주 가운데서 한천희석법을 실시한 197개 균주 중에서 sdhB 유전자 변이형인 P225F, N230I, H272R, H272L형에 속하는 B. cinerea 균주의 평균 EC50값을 구하였다(Table 2). 네 가지 변이형 모두는 boscalid에 대한 평균 EC50값이 100 μg/mL 이상으로 고 저항성을 나타냈다. P225F 변이형은 boscalid, fluopyram, fluxapyroxad에 대해서 평균 EC50값이 100 μg/mL 이상인 고 저항성이었으며, penthiopyrad에 대해서는 48.89 μg/mL으로 중 저항성, isopyrazam에 대해서는 4.08 μg/mL로 감수성이었다. N230I 변이형은 boscalid에 대해서만 고 저항성을, fluopyram과 fluxapyroxad에 대해서는 평균 EC50값이 31.21 μg/mL와 56.92 μg/mL로 중 저항성을 보였으며, penthiopyrad와 isopyrazam에 대해서는 감수성이었다. H272R형의 균주는 boscalid에 대한 평균 EC50값이 100 μg/mL 이상이었으나, 나머지 살균제에 대해서는 감수성 반응을 보였다. Boscalid에 대한 평균 EC50값이 100 μg/mL 이상으로 고 저항성인 H272L형 균주는, fluopyram와 fluxapyroxad에 대해서 80.08과 59.83 μg/mL의 평균 EC50값을 보이며 중 저항성이었으나, isopyrazam, penthiopyrad에 대해서는 감수성이었다. Amiri et al. (2014)은 2005년부터 2013년까지 Florida에 위치한 14곳의 딸기밭에서 병든 딸기를 채집하여 잿빛곰팡이병균을 분리하고, 200개의 균주에서 sdhB 유전자 돌연변이를 조사하였는데, H272R을 비롯한 5종의 변이형을 검출하였다. 본 연구에서 44.1%의 분리 빈도를 보였던 H272R형이 51.5%로 가장 높은 빈도로 검출되었으나, 가장 높은 분리비를 보였던 P225F형은 2.5%로 낮은 검출 빈도를 보였고, 본 연구에서는 검출하지 못하였던 H272Y형의 변이주가 28.0%나 분리되었다. 각 변이형의 평균 EC50값은 본 실험의 결과와 유사하였는데, P225F형 균주는 boscalid와 fluxapyroxad에 대해서 100 μg/mL 이상의 EC50값을 보였고, fluopyram에 대해서는 98.52 μg/mL의 EC50값을 보였으며, penthiopyrad에 대한 EC50값은 13.12 μg/mL로, 본 연구 결과와 유사하였다. 본 연구 결과에서 boscalid에 대해서만 100 μg/mL의 EC50값을 보였고 나머지 4종의 SDHI 살균제에 대해서는 감수성을 보였던 H272R형의 변이주에 대한 반응도, boscalid에 대해서만 저항성을, 그리고 fluopyram, fluxapyroxad, penthiopyrad에 대해서는 EC50값이 1.34, 1.34, 1.33 μg/mL로 감수성이었다. 동일한 코돈의 위치에서 다른 아미노산이 치환된 H272R과 H272L형 변이주를 비교하면, 두 변이주 모두 boscalid에 대해서만 고 저항성 반응을 보였고, fluopyram, fluxapyroxad, penthiopyrad에 대해서는 H272R형은 감수성, H272L형은 중 저항성을 보인 본 연구 결과와 유사하게, Florida 균주도 두 변이형 모두 boscalid에 대해서는 EC50값이 100 μg/mL 이상인 고 저항성을, fluopyram, fluxapyroxad, penthiopyrad에 대해서는 H272R형 변이주의 EC50값이 1.34, 1.34, 1.33 μg/mL, H272L형 변이주의 EC50값은 10.55, 10.29, 6.99 μg/mL로, H272L형이 H272R형보다 저항성 정도가 높았다. Florida에서 분리하여 SDHI 살균제 모니터링에 사용하였던 B. cinerea의 저항성 반응과 유전자 돌연변이형과의 관계는 본 연구 결과와 유사하였다. Fernandez-Ortuño et al. (2017)은 딸기에서 분리한 B. cinerea 균주를 살균제에 대한 저항성을 가지고 4가지 그룹으로 분류하면서, 각 그룹의 유전자 돌연변이형을 조사하였다. 본 연구에서 H272R형의 변이주는 boscalid에만 저항성을 보였는데, 스페인 균주에서도 제1그룹은 H272R형의 돌연변이가 발생하였고, boscalid에 대해서만 저항성을 보였는데, 30%로 제일 많이 분리되었다. 그런데 boscalid, fluopyram, fluxapyroxad, pehtiopyrad에 저항성인 제4그룹에 속하는 B. cinerea의 유전자 변이형은 N230I형으로, boscalid, fluopyram, fluxapyroxad, pehtiopyrad에 대해서는 고 또는 중 저항성을 보이던 균주의 변이형이 H272L형이었던 본 연구의 결과와는 차이가 있었다. 또한 본 연구에서는 제2와 제3그룹에 속하는 B. cinerea와 유사한 저항성 반응을 보이는 균주는 분리되지 않았다. Veloukas et al. (2013)은 SDHI 살균제 저항성인 B. cinerea의 sdhB 유전자 코돈 3곳에서 발생한 5가지의 돌연변이형(P225F, N230I, H272L/R/Y)을 보고하였는데, H272Y형을 제외한 4가지 변이형의 SDHI 살균제에 대한 반응은 본 연구 결과와 유사하였다. H272Y형은 본 연구에서 검출되지 않았다.

Mean value of EC50 (μg/mL) of Botrytis cinerea isolates to each fungicide inhibiting succinate dehydrogenase according to genetic mutant type
본 연구의 결과를 보면, P225F형의 변이주가 SDHI 살균제에 대한 저항성이 가장 높았는데, 실험에 사용한 5종의 살균제 중에서 boscalid, fluopyram, fluxapyroxad에 대해서 고 저항성을, penthiopyrad에 대해서는 중 저항성을 나타냈다. H272R형의 변이주는 boscalid에 대해서만 고 저항성이었고, 나머지 살균제에 대해서는 감수성이었다. 변이형 중에서 우점형은 isopyrazam을 제외한 4종의 살균제에 대해서 저항성 반응을 보인 P225F형으로 전체 변이주 중에서 48.5%의 검출 빈도를 보였으며, H272R형의 변이주가 44.1%로 두 번째로 높은 검출 빈도를 보였다. 특히 H272R형의 변이주는 boscalid에 대해서만 저항성이기는 했으나, 2011년, 2015년, 2016년에 각각 5균주, 8균주, 17균주가 분리되면서 지속적으로 포장에서 분리되고 있었다. 그런데 isopyrazam은 4종의 변이형 모두에 대해서 우수한 균사생장 억제효과를 보였다. Hu et al. (2016)은 미국 동부에서 채집한 B. cinerea 균주를 boscalid, fluopyram, fluxapyroxad, penthiopyrad 등의 SDHI 살균제에 대한 저항성 반응을 가지고 4가지 그룹으로 구분하였는데, 모든 균주가 또 다른 SDHI 살균제인 benzovindiflupyr에 대해서는 감수성이면서, benzovindiflupyr를 포장에서 SDHI 살균제의 효과를 지속적으로 유지하며 살균제 저항성 관리를 위해서 사용할 수 있는 대체 살균제로 보고하였다.
본 연구 결과에서도 모든 균주에 대해서 감수성 반응을 보였던 isopyrazam은 B. cinerea의 살균제 저항성 관리를 위한 대체 살균제로서의 역할을 할 수 있을 것으로 생각한다. 또한 숙신산 탈수소효소의 소단위 B에서 발생하는 점돌연변이의 발생 위치와 아미노산 치환의 종류가 SDHI 살균제에 대한 저항성 발현과 정도, 교차저항성 여부 등에 영향을 미치기 때문에, 포장에서 저항성 발생에 대한 모니터링 뿐만 아니라, 저항성을 유도하는 돌연변이의 종류도 동시에 검출할 수 있어야 할 것으로 생각한다.
Acknowledgments
이 논문은 과학기술정보통신부의 재원으로 한국연구재단 국가생명연구자원 선진화사업의 지원을 받아 수행된 연구입니다(No. 2021M3H9A1081268).
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Amiri A, Heath SM, Peres NA, 2014. Resistance to fluopyram, fluxapyroxad, and penthiopyrad in Botrytis cinerea from strawberry. Plant Dis. 98(4):532-539.
[https://doi.org/10.1094/PDIS-07-13-0753-RE]

-
Avenot HF, Michailides TJ, 2007. Resistance to boscalid fungicide in Alternaria alternata isolates from pistachio in California. Plant Dis. 91(10):1345-1350.
[https://doi.org/10.1094/PDIS-91-10-1345]

-
Avenot HF, Michailides TJ, 2010. Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi. Crop Protect. 29(7):643-651.
[https://doi.org/10.1016/j.cropro.2010.02.019]

-
Avenot H, Sellam A, Michailides T, 2009. Characterization of mutations in the membrane-anchored subunits AaSDHC and AaSDHD of succinate dehydrogenase from Alternaria alternata isolates conferring field resistance to the fungicide boscalid. Plant Pathol. 58(6):1134-1143.
[https://doi.org/10.1111/j.1365-3059.2009.02154.x]

-
Avenot HF, Thomas A, Gitaitis RD, Langston DB, Stevenson K, 2012. Molecular characterization of boscalid- and penthiopyrad-resistant isolates of Didymella bryoniae and assessment of their sensitivity to fluopyram. Pest Manag. Sci. 68(4):645-651.
[https://doi.org/10.1002/ps.2311]

- Brent KJ, Hollomon DW, 2007. Fungicide resistance: The assessment of risk. FRAC.
-
Cecchini G, 2003. Function and structure of complex II of the respiratory chain. Annu. Rev. Biochem. 72(1):77-109.
[https://doi.org/10.1146/annurev.biochem.72.121801.161700]

-
Fernandez-Ortuño D, Perez-Garcia A, Chamorro M, de la Peña E, de Vicente A, et al., 2017. Resistance to the SDHI Fungicides Boscalid, Fluopyram, Fluxapyroxad, and Penthiopyrad in Botrytis cinerea from Commercial Strawberry Fields in Spain. Plant Dis. 101(7):1306-1313.
[https://doi.org/10.1094/PDIS-01-17-0067-RE]

-
Hu MJ, Fernandez-Ortuño D, Schnabel G, 2016. Monitoring resistance to SDHI fungicides in Botrytis cinerea From Strawberry Fields. Plant Dis. 100(5):959-965.
[https://doi.org/10.1094/PDIS-10-15-1210-RE]

-
Konstantinou S, Veloukas T, Leroch M, Menexes G, Hahn M, et al., 2015. Population structure, fungicide resistance profile, and sdhB mutation frequency of Botrytis cinerea from strawberry and greenhouse-grown tomato in Greece. Plant Dis. 99(2):240-248.
[https://doi.org/10.1094/PDIS-04-14-0373-RE]

-
Leroux L, 2004. Chemical control of Botrytis and its resistance to chemical fungicides. pp. 195-222. In: Botrytis: biology, pathology and control. Elad Y, Williamson B, Tudzynski P, Delen N, (Eds.). Kluwer Academic Publishers, Dordrecht, The Netherlands.
[https://doi.org/10.1007/978-1-4020-2626-3_12]

-
Miyamoto T, Ishii H, Tomita Y, 2010. Occurrence of boscalid resistance in cucumber powdery mildew in Japan and molecular characterization of the iron-sulfur protein of succinate dehydrogenase of the causal fungus. J. Gen. Plant Pathol. 76(4):261-267.
[https://doi.org/10.1007/s10327-010-0248-z]

-
Miyamoto T, Ishii H, Seko T, Kobori S, Tomita Y, 2009. Occurrence of Corynespora cassiicola isolates resistant to boscalid on cucumber in Ibaraki Prefecture. Japan. Plant Pathol. 58(6):1144-1151.
[https://doi.org/10.1111/j.1365-3059.2009.02151.x]

-
Sierotzki H, Scalliet G, 2013. A Review of current knowledge of resistance aspects for the next-generation succinate dehydrogenase inhibitor fungicides. Phytopathology 103(9):880-887.
[https://doi.org/10.1094/PHYTO-01-13-0009-RVW]

-
Veloukas T, Leroch M, Hahn M, Karaoglanidis GS, 2011. Detection and molecular characterization of boscalid-resistant Botrytis cinerea isolates from strawberry. Plant Dis. 95(10):1302-1307.
[https://doi.org/10.1094/PDIS-04-11-0317]

-
Veloukas T., Markoglou AN, Karaoglanidis GS, 2013. Differential effect of sdhB gene mutations on the sensitivity to SDHI fungicides in Botrytis cinerea. Plant Dis. 97(1):118-122.
[https://doi.org/10.1094/PDIS-03-12-0322-RE]

-
Weber RWS, Hahn M, 2011. A rapid and simple method for determining fungicide resistance in Botrytis. J. Plant Dis. Protect. 118(1):17-25.
[https://doi.org/10.1007/BF03356376]

-
Williamson B, Tudzynski B, Tudzynski P, Kan JALV, 2007. Botrytis cinerea: the cause of grey mould disease. Mol. Plant Pathol. 8(5):561-580.
[https://doi.org/10.1111/j.1364-3703.2007.00417.x]

-
Yin YN, Kim YK, Xiao CL, 2011. Molecular characterization of boscalid resistance in field isolates of Botrytis cinerea from apple. Phytopathology 101(8):986-995.
[https://doi.org/10.1094/PHYTO-01-11-0016]

Heung Tae Kim, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Professor, https://orcid.org/0000-0001-7132-0587
Dong-min Baek, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Master student
Present address; Asan-si Agricultural Technology Center, chief officer
Establishment of experimental plan, Heung Tae Kim
Methodology proposal, Heung Tae Kim
Experimental participation, Dong-min Baek
Writing, Heung Tae Kim, Dong-min Baek