농업 토양으로부터 분리한 carbofuran 분해 세균 Bacillus amyloliquefaciens DYC2-1의 특성
초록
Carbofuran (2,3-dihydro-2,2-dimethyl-7-benzofuranyl N-methylcarbamate)은 전세계적으로 농업현장에서 가장 빈번하게 사용된 살충제의 하나이다. Carbofuran은 우수한 살충력을 보유하고 있으나 무분별한 사용으로 인해 토양 및 수질 오염의 원인으로 지목되고 있다. Carbofuran을 분해하는 여러가지 방법 가운데, 미생물을 이용한 생물정화법은 비용이 저렴하고 효율이 우수한 방법으로 알려져 있다. 본 연구에서는 농약에 오염된 농경지의 토양으로부터 carbofuran을 분해하는 균주를 순수분리하였다. 다음으로 16S rRNA 유전자 염기서열 분석을 통해 미생물의 계통 및 특이점을 파악하였으며 분리한 균주의 배양조건 최적화를 통해 최적배양 조건을 확립하였다. 최종적으로는 개별 배양을 통해 균주의 carbofuran 분해능에 대해 규명하였다. Carbofuran 분해 균주의 16S rRNA 유전자 염기서열 분석결과, Bacillus amyloliquefaciens와 99.86%의 상동성을 나타내어 본 균주를 B. amyloliquefaciens DYC2-1로 명명하였다. 배지의 종류와 배양조건을 달리하여 DYC2-1 균주를 배양했을 때 TSB배지, 30oC, 600 rpm 조건에서 세포성장이 가장 우수하였다. 이를 토대로 농약분해 개별배양결과, DYC2-1 균주는 120시간에 걸쳐 약 100 mg/L (97%)의 carbofuran을 분해하는 것으로 나타났다. B. amyloliquefaciens에 속하는 균주들이 일반적으로 식물생장 촉진 능력을 보유하고 있으므로, DYC2-1 균주는 농업분야에서 토양정화와 더불어 작물생산성을 높이는데 기여할 수 있을 것으로 예상된다.
Abstract
Carbofuran (2,3-dihydro-2,2-dimethyl-7-benzofuranyl N-methylcarbamate) is one of the most frequently used insecticides in agricultural fields worldwide. Although carbofuran has excellent pest control property, its excessive use causes soil and river pollution. To remove the pesticide from the environment, bioremediation is considered the most inexpensive and efficient method. In this study, carbofuran biodegradable strain was isolated from the agricultural land. Next, identification of the microorganism through 16S rRNA gene sequence analysis and optimization of culture condition were carried out. Finally, the carbofuran degradation capacity of the strain was investigated through individual cultivation. As the result of 16S rRNA gene sequence analysis, the strain was identified as Bacillus amyloliquefaciens with 99.86% homology and named B. amyloliquefaciens DYC2-1. Culture optimization of the DYC2-1 strain was operated using different types of medium and culture conditions. The DYC2-1 showed the highest cell growth when cultured in TSB medium at 30oC and 600 rpm. Based on these results, individual culture for carbofuran degradation was conducted. The DYC2-1 strain was found to degrade about 100 mg/L (97%) of carbofuran over 120 h. Considering B. amyloliquefaciens species commonly possess plant growth promoting ability, the DYC2-1 strain is expected to contribute both soil remediation and enhancement of crop growth in the agricultural field.
Keywords:
Carbofuran, Bioremediation, Bacillus amyloliquefaciens, culture optimization키워드:
카보퓨란, 생물정화, Bacillus amyloliquefaciens, 배양최적화서 론
Carbofuran (2,3-dihydro-2,2-dimethyl-7-benzofuranyl N-methylcarbamate)은 카바메이트(carbamate) 계열의 살충제로서 우수한 살충효과로 옥수수, 쌀, 콩, 감자 등 다양한 농작물에 광범위하게 사용되어왔으며(Trotter et al., 1991) 원예, 임업 등에서도 빈번하게 사용되어 왔다(Dias et al., 2015; Mishra et al., 2020). Carbofuran 살충제는 충체 내로 침투하여 acetylcholineesterase와 비가역적 결합 후 신경 전달을 차단하는 방식으로 해충을 방제하는 것으로 알려져 있으며(Gupta 1994; Bretaud et al., 2000), acetylcholinesterase와 butyrylcholinesterase 활성을 억제하는 anticholinesterase 활성으로 인해 포유류, 조류 및 어류에 매우 치명적인 것으로 알려져 있다(Mishra et al., 2020). 포유동물에는 비교적 높은 독성(LD50= 2 mg/kg in mice)을 가지며 특히 물에서 이동성이 높아 수질에 오염이 일어날 경우 수생자원에 막대한 피해를 미치는 것으로 보고되었다(Shin et al., 2012; Dias et al., 2015). 일반적으로 carbofuran 농약의 토양 환경 잔류성 및 생물학적 축적은 낮은 것으로 알려져 있으나(Ecobichon, 2001; Dias et al., 2015; Mishra et al., 2020), 토양 및 환경에 잔류되어 있던 carbofuran 농약의 생물학적 전이로 인해 환경에 심각한 위협을 초래하며 인간은 carbofuran의 화학적 특성과 잔류성의 특성으로 먹이사슬을 통해 간접적으로 영향을 받게 된다(Mishra et al., 2020). 이와 같은 환경잔류와 생물학적 전이 문제로 미국에서는 2009년부터 carbofuran의 잔류허용기준을 폐기하고 carbofuran의 모든 사용을 금지해오고 있다(EPA, 2016). 현재 우리나라에서는 carbofuran 농약의 잔류허용기준을 가진 식품 수는 86개로 등록되어 있다(MFDS, 2021).
최근 다양한 농약 개발로 잔류기준이 없는 농약의 사용이 증가되어 농약의 작물 전이 문제가 크게 대두되었다. 따라서 식약처에서는 잔류허용기준이 없는 작물에 일률기준(0.01 mg/L)을 적용하는 농약 허용물질목록관리제도(PLS) 제도를 도입, 시행하였다. 이를 통해 미등록 농약의 오남용을 방지하며 여러 농산물에서 점차 잔류농약 검출이 줄어들고 있는 추세에 있다(Song et al., 2021).
이러한 노력에도 불구하고 농업 토양 및 일부 작물에서 꾸준히 carbofuran이 검출되는 문제가 발생하고 있다. 식품의약품안전처에 따르면, 2020년 4월 전국에서 유통되고 있는 국내 농산물 268건을 수거하여 잔류농약을 분석한 결과 시금치, 취나물, 시래기, 방풍나물 등에서 잔류농약 부적합 판정이 나왔으며 그 중 취나물에서는 환경부 기준치인 0.01mg/kg 이하를 6배 이상 상회한 0.06 mg/kg의 carbofuran이 검출되었다고 보고하였다(MFDS, 2021). 현재 다양한 방법을 이용하여 잔류농약을 제어하는 기술들이 개발되어 있으나, 아직까지는 효과가 충분하지 않거나 오염원의 원천적인 제어가 힘든 실정이다.
미생물을 이용한 잔류농약 분해는 농약 원제를 저분자 단위로 분해할 수 있기 때문에 환경내 잔류 위험이 적다는 장점이 존재한다(Bano and Musarrat, 2004; Parte et al., 2017). 또한 별도의 기기나 처리과정없이 기존의 농업시설을 그대로 이용하여 토양에 미생물을 공급해주면 되므로 가격경쟁력이 우수하여 여러 농업 분야에서 각광을 받고 있다. Carbofuran을 분해하는 미생물로는 Achromobacter sp., Sphingomonas sp., Pseudomonas sp. 등이 대표적이며 다양한 carbofuran 분해 미생물이 보고되고 있다(Karns et al., 1985; Chaudhry et al., 2002; Kim et al., 2004). Carbofuran 분해미생물은 대부분 carbofuran hydrolase를 보유하여 carbofuran을 carbofuran phenol과 methylamine으로 일차적으로 분해하고, 분해산물을 이차로 분해하여 에너지대사에 이용한다(Chaudhry and Ali, 1988). 특히 carbofuran을 carbofuran phenol로 전환하는 carbofuran hydrolase 인 mcd(N-methylcarbamate hydrolase) 유전자는 Achromobacter 속 균주들에서 특이적으로 발견되는데, carbofuran hydrolase를 사용하여 carbonyl의 ester bond와 methylcarbamic acid의 amide bond을 끊어 carbofuran 7-phenol로 분해하는 것으로 알려져 있다(Karns et al., 1985; Tomasek and Karns, 1989). 토양세균에서 가수분해효소를 암호화하는 mcd 유전자를 발현한 재조합 대장균 균주로부터 카바메이트를 효과적으로 가수분해한 연구도 발표된 바 있다(Naqvi et al., 2009). 또한, \0 속 균주들은 carbofuran 뿐만 아니라 cadusafos, ethoprophos 등 유기인계 농약의 분해 활성 또한 우수한 균주로 알려져 있다(Karpouzas and Walker, 2000; Abo-Amer, 2012).
이러한 carbofuran 분해 미생물 가운데는 생물정화능력이 우수하면서도 다양한 식물성장물질을 분비하는 균주들도 존재한다. 농업 토양에서 분리한 Pseudomonas sp. NJ-101는 carbofuran 농약을 0.035mg/day의 속도로 40일 이내에 완전히 분해하였으며, 분해 과정에서 식물 성장을 촉진시키는 indole 3-acetic acid 및 siderophore의 생성하는 것으로 보고되었다(Bano and Musarrat, 2004). 폐기물 매립지에서 분리한 Cupriavidus sp.는 400mg/L의 carbofuran 농약을 96시간 이내에 98% 분해하였고, 분해 과정에서 carbofuran의 세포 독성을 감소시킬 수 있는 exo-polysaccharide (EPS)를 생성하였다(Gupta et al., 2019). 이와 같이 우수한 농약 분해능을 보유하면서도 농작물의 성장조절 혹은 병해 예방에 탁월한 물질을 분비하는 균주를 확보하면 농업분야에 활용도가 클 것으로 예상된다.
본 연구에서는 carbofuran의 분해능이 우수한 미생물을 토양으로부터 분리하고 균주의 유전적 특성 및 생육 최적화를 통해 균주의 생리 및 배양특징을 평가하였다. 또한 회분식 배양을 통해 분리균주의 carbofuran 분해능을 평가하였다.
재료 및 방법
시약
Carbofuran은 Sigma-Aldrich (Sigma-Aldrich, St, Louis, MO, USA)로부터 구매하였다. Carbofuran은 GC-MS grade acetone (Merck KGaA, Darmstadt, Germany)을 이용하여 10,000 mg/L 농도로 희석한 stock을 4oC로 설정된 저장고에 보관 후 실험에 사용하였다.
시료채취 및 농화 배양
본 연구에 사용된 토양시료는 전라남도 고흥군 소재의 배추밭 토양으로 다년간 지속적으로 화학농약을 처리해온 지역을 대상으로 하였다. 먼저 상토를 1~2 cm 걷어낸 뒤 5~10 cm 깊이의 토양 약 50 g을 채취하였다. 시료 채취 및 보관은 멸균된 모종삽과 채집통을 이용하였으며 시료는 4oC로 설정된 냉장시설에 보관하였다. 실험에 이용한 minimal salt media (MSM)와 trace metal solution (TMS)의 조성은 다음과 같다. MSM-L당 7.5 g potassium phosphate dibasic (Daejung Chemicals & Metals Co., Ltd., Gyeonggi-do, Korea), 2 g potassium phosphate monobasic (Sigma-Aldrich, St, Louis, MO, USA), 0.5 g magnesium chloride (Junsei Chemical Co., Ltd., Tokyo, Japan), 0.5 g sodium chloride (Daejung Chemicals & Metals Co., Ltd., Gyeonggi-do, Korea), pH 7.5; TMS - L당 0.02 g Ammonium molybdate (Samchun Chemical Co., Ltd., Seoul, Korea.), 0.003 g cobalt chloride hexahydrate (Wako Pure Chemical Industries, Ltd., Osaka, Japan), 0.05 g boric acid (Daejung Chemicals & Metals Co., Ltd., Gyeonggi-do, Korea), 0.03 g zinc chloride (Daejung Chemicals & Metals Co., Ltd., Gyeonggi-do, Korea), 0.01 g copper (II) acetate monohydrate (Sigma-Aldrich, St, Louis, MO, USA), 0.02 g iron (II) chloride (Samchun Chemical Co., Ltd., Seoul, Korea.). 농화배양을 실시하기 직전 냉장 보관된 시료를 2mm 체(2.0 mm Test Sieve; ChungGye sieve Co., Ltd., Korea)로 체질하여 큰 입자의 돌과 이물질을 제거하였다. 멸균된 250mL 유리 플라스크에 49mL의 MSM과 500 μL TMS, 10,000 mg/L carbofuran을 500 μL를 첨가하여 MSMC 배지를 제조하였고, 토양 시료 5g을 MSMC 배지에 투입한 후 농화 배양(enrichment culture)을 시작하였다. 25oC와 120 rpm으로 설정된 진탕배양기(shaking incubator, Vision Co., Korea)에서 2주 동안 진탕배양을 실시하였다. 그 후 농화배양액 5mL을 새로이 제조한 50mL의 MSMC 배지에 접종하여 앞서 기술한 배양 조건으로 2회의 추가 계대배양을 실시하였다.
미생물 순수 분리 및 동정
농화 배양 원액을 멸균 증류수(3M, USA)에 1/10씩 순차적 희석(serial dilution)한 후, 1:1000의 희석시료 100 μL를 R2A (Lab M, UK) 평판배지에 도말(spreading)하여 30oC로 설정된 배양기에서 12~15시간 동안 정치배양 하였다. 육안상 우점균으로 보이는 미생물 군집(colony)을 R2A 평판배지에 획선도말(streaking)하여 미생물을 순수 분리하였다. 분리한 carbofuran 분해균주는 5mL의 R2A 액상배지에 접종하여 15시간 배양 후 80% 글리세롤 용액과 3:1의 비율로 혼합 후 -70oC로 설정된 초저온 냉동고에 보관하였다. 16S rRNA 유전자 염기서열 분석을 통한 분리미생물의 동정을 위해 순수 분리된 균체를 마크로젠(Macrogen Inc., Seoul, Korea)에 의뢰하여 염기서열을 분석하였다. 마크로젠의 sequencing 방법은 다음과 같다. Sequencing 의 수행을 위해 BigDye (R) Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, Foster City, CA, USA)를 사용한다. PCR은 DNA Engine Tetrad 2 Peltier Thermal Cycler (BIO-RAD, Hercules, CA, USA)를 통해 진행되며, 27F와 1492R의 primer를 이용하여 sequence를 읽어낸다. 반응이 끝나면 반응에 참여하지 않은 dNTP 및 반응물을 제거하는 반응을 거친 뒤 ABI 3730xl DNA Analyzer에 로딩하여 sequencing 결과를 얻었다.
Carbofuran 분해 미생물의 배양조건 최적화
DYC2-1의 배양조건 최적화 실험은 15mL의 배양액을 포함한 50 mL tubespin bioreactor tube (Sigma-Aldrich, St, Louis, MO, USA)를 이용하여 수행하였다. 우선 R2A 한천배지로부터 DYC2-1 균주의 군집 하나를 R2A 액상배지에 접종하여 30oC, 100 rpm 조건으로 12시간 동안 전배양을 실시하였다. 배양액 20 μL를 15mL의 액상배지가 든 50mL tubespin bioreactor tube에 접종하였다. 광학밀도의 측정은 소형 생물반응기(bioreactor; Biosan, RTS-1C, Latvia)에서 동시에 이루어졌다. 실험에 적용된 모든 배양조건은 Table 1에 나타내었으며, 모든 배양은 2회에 걸쳐 반복 실험을 수행하였다. 결과값들의 평균과 표준편차를 PRISM9.0 (GraphPad Software Co., USA)를 이용하여 그래프로 도식화하였다.
농약분해 미생물 개별배양
냉동 보관된 DYC2-1 균주를 R2A 평판 배지에 획선 도말하여 12~15시간 배양을 실시하였다. 접종원은 10mL의 R2A 액상배지에 DYC2-1 균주를 접종하여 30oC, 150 rpm 조건으로 12~15시간 동안 전배양하였다. Carbofuran 분해를 위한 배양은 250mL 유리 플라스크에 담긴 50mL의 R2A 액상배지에서 수행하였다. 먼저 10,000 mg/L 농도의 carbofuran 500 μL를 R2A 액상배지 50mL에 첨가하여 최종 carbofuran 농도를 100 mg/L으로 조정한 후, 최종 부피의 2% (v/v)에 해당하는 전배양액을 접종하여 배양을 시작하였다. 배양액은 30oC와 150 rpm으로 설정된 진탕배양기에서 5일간 배양을 실시하였고, 매 24시간 마다 10mL의 배양액을 분취하여 QuEChERS 추출에 이용하였다.
QuEChERS 추출법
배양액 내 carbofuran을 추출하기 위해 QuEChERS-EN법을 이용하였다. 시간별로 분취한 배양액 10mL이 든 50mL conical tube에 acetonitrile (Duksan Fure Chemicals, Co., Ltd., Gyeonggi-do, Korea)를 10, 15 및 20mL를 넣고 30초 동안 vortexing 하였다. 다음으로 QuEChERS powder mix[Chiral Technology Korea, Pure-Sep, Daejeon, Korea (Magnesium sulfate, 4 g, Sodium chloride, 1 g, Trisodium citrate dihydrate, 4 g, Disodium hydrogencitrate sesquihydrate, 0.5 g)]를 배양액-acetonitrile 혼합액에 투입한 후 30초 동안 vortexing 한 것을 4oC 및 10,000 rpm으로 설정된 고속원심분리기에서 10분간 원심분리 하였다. 이 후 상층액(organic phase)은 각각 첨가한 acetonitrile 용매의 양의 80% (8, 12 및 16mL)를 10mL syringe (Kovax-syringe, Korea)와 syringe filter 0.2 μm (Advantec, Toyo Roshi Kaisha Ltd, Japan)을 사용하여 여과하였다. 여과된 추출액은 -70oC로 설정된 초저온냉동고에 보관하였다.
분석기기 및 분석방법
배양추출액의 용매는 냉각트랩장비(HypeCool, GYROZEN, Korea)가 연결된 원심진공농축기(HyperVac, GYROZEN, Korea)를 사용하여 완전히 제거하였다. 진공농축 후 튜브에 남은 고형 추출물을 아세톤 20 μL로 현탁하여 100배 농축액을 제조하였으며 이를 thin layer chromatography (TLC) 분석에 이용하였다. TLC silica plate (Aluminium HPTLC Silica gel 60 F254 plates, Merck, USA)는 실험목적에 따라 가로 및 세로의 길이를 각각 5 cm × 5 cm 혹은 5 cm× 10 cm로 재단하여 실험에 이용하였다. TLC 전개 용매는 배양추출액의 단순전개 목적으로는 ethylacetate와 n-hexane의 비율을 50:50으로 섞은 용매를 이용하였고, carbofuran 확인 목적으로는 두 유기용매를 각각 75:25로 섞은 용매를 제조 후 실험에 사용하였다. 배양액 내 살충제 성분의 정성 및 정량분석은 AB Sciex 5500 triple-quadrupole mass spectrometer (AB Sciex, Toronto Canada)가 장착된 Agilent 1260 series (Agilent Technologies, Wilminton, DE)를 이용하였다. 기기 사용된 컬럼은 Osaka Soda CAPCELL CORE C18 (150 mm × 2.1 mm, 2.7 μm, Shiseido, Japan)이며, 0.1% formic acid (Sigma-Aldrich, St, Louis, MO, USA)와 0.5mM ammonium formate를 포함한 수용액, 0.1% formic acid와 0.5 mM ammonium formate가 포함된 99% methanol 용액을 이동상으로 이용하였다. 이동상의 유속은 0.3mL/min의 조건을 사용하였으며, 컬럼 오븐의 온도는 40oC로 설정하였다. Liquid chromatography tandem mass spectrometry (LC-MS/MS)는 carbamate의 잔류된 양을 측정하기 위하여 electron spray ionization (ESI) positive mode를 사용하였고, 다중반응 모니터링(multiple reaction monitoring, MRM)방식으로 검출하였다. Collision cell에서 collision energy를 조절하여 최적의 precursor/product ion pair를 선정하였고, 가장 높은 감도를 보이는 product ion을 정량이온(quantification ion)으로, 다음으로 크게 검출되는 product ion을 정성이온(qualification ion)으로 설정하였다. 최적 기기분석 조건은 Table 2에 나타냈으며, 분석조건에서 선정된 특성 이온과 머무름 시간은 Table 3에 나타내었다. 또한, carbofuran 표준품을 acetonitrile로 희석하여 0.02, 0.05, 0.1 및 0.2 mg/L 농도의 시료를 제조하였다. 각각의 시료 2 μL를 LC-MS/MS에 주입하여 직선성을 확인하고 검량선을 작성하였다. 배양액 추출물 시료는 액상시료의 일정량을 취한 후 acetonitrile로 1/1000 희석하여 분석을 실시하였다. 광학현미경 이미지는 R2A 액상배지에 DYC2-1 균주를 접종하여 30oC, 150 rpm 조건으로 60시간 동안 배양한 배양액 1 mL을 100배 희석하여 Axio Scope. A1 (Carl Zeiss, Germany)으로 촬영하였다.
결과 및 고찰
Carbofuran 분해 균주의 선발 및 16S rRNA 유전자 염기서열 분석을 통한 계통분석
전라남도 고흥군 소재의 배추밭 토양과 MSMC 배지를 이용하여 농화배양을 실시하였다. 농화배양으로부터 균주동정까지의 과정 및 carbofuran 분해 배양과 분석을 포함한 전체 흐름도는 Fig. 1에 나타내었다. 1차 농화배양이 끝난 후 이주일 간격으로 동일한 배지에 두 차례의 계대배양을 실시하였고 R2A 고체배지에 평판도말하여 30oC에서 24시간 동안 배양하였다. 미생물 군집 중 육안 상 우점균을 두 차례에 걸쳐 획선도말 후 상기와 같은 조건으로 배양하였다. 2단계로 획선도말한 고체배지에서 군집의 크기가 가장 큰 균주를 최종적으로 분리하였고, 이를 D YC2-1이라고 명명하였다. 분리된 세균은 그람 양성이었으며 군집의 색은 크림빛을 띤 흰색으로 R2A 고체배지에서 12시간에 걸쳐 0.3~0.6 mm 크기의 군집을 빠르게 형성하였다(Fig. 2A). 또한 시간이 지남에 따라 분리 균주의 군집 가장자리가 다소 불규칙한 형태로 변하는 것을 관찰할 수 있었다. 다음으로 100mg/L의 carbofuran이 포함된 10mL의 R2A 액상배지에 DYC2-1 균주를 접종하여 배양을 진행하였다. 100 mg/L의 carbofuran이 포함된 배지를 대조군으로 설정하여 동시배양을 진행하였으며 배양 96시간 후 배양액 전체를 QuEChERS-EN 법을 이용하여 추출 후 TLC 분석을 실시하였다. 그 결과, DYC2-1 배양액추출물의 carbofuran 스폿의 크기가 0시간 대비 확연히 작아졌고, 색깔도 상당히 희미해진 것을 알 수 있었다(Fig. 2B). 이를 통해 DYC2-1이 carbofuran 분해능을 보유하고 있음을 정성적으로 확인할 수 있었다. 다음으로는 D YC2-1의 16S rRNA 유전자 염기서열 분석을 통해 1787 bp 길이의 염기서열을 얻어내었다. 이를 근린 결합법(neighbor-joining)에 의거하여 DYC2-1 균주의 계통학적 위치를 검토하였다. 그 결과 D YC2-1은 Bacillus amyloliquefaciens DSM7, Bacillus subtilis KCTC13613, Bacillus siamensis CR-502와 99.86%의 상동성을 나타내었으며, Bacillus nematocida B-16와 Bacillus subtilis NCIB3610 및 Bacillus nakamurai NRRL B-41091과는 각각 99.72%, 99.59%의 상동성을 나타내어 Bacillus 속 균주로 확인되었다(Fig. 2C). DYC2-1의 16S rRNA 유전자 염기서열과 가장 높은 상동성을 보인 세 개의 균주 가운데, Bacillus amyloliquefaciens DSM7 균주와 variation ratio가 가장 낮게 측정되었다. DYC2-1의 군집 형상은 일반적으로 알려져 있는 Bacillus amyloliquefaciens 균주의 군집 형상 및 변화와 일치하였고 계통학적 결과를 토대로 DYC2-1 균주는 Bacillus amyloliquefaciens로 최종적인 동정이 이루어졌다.
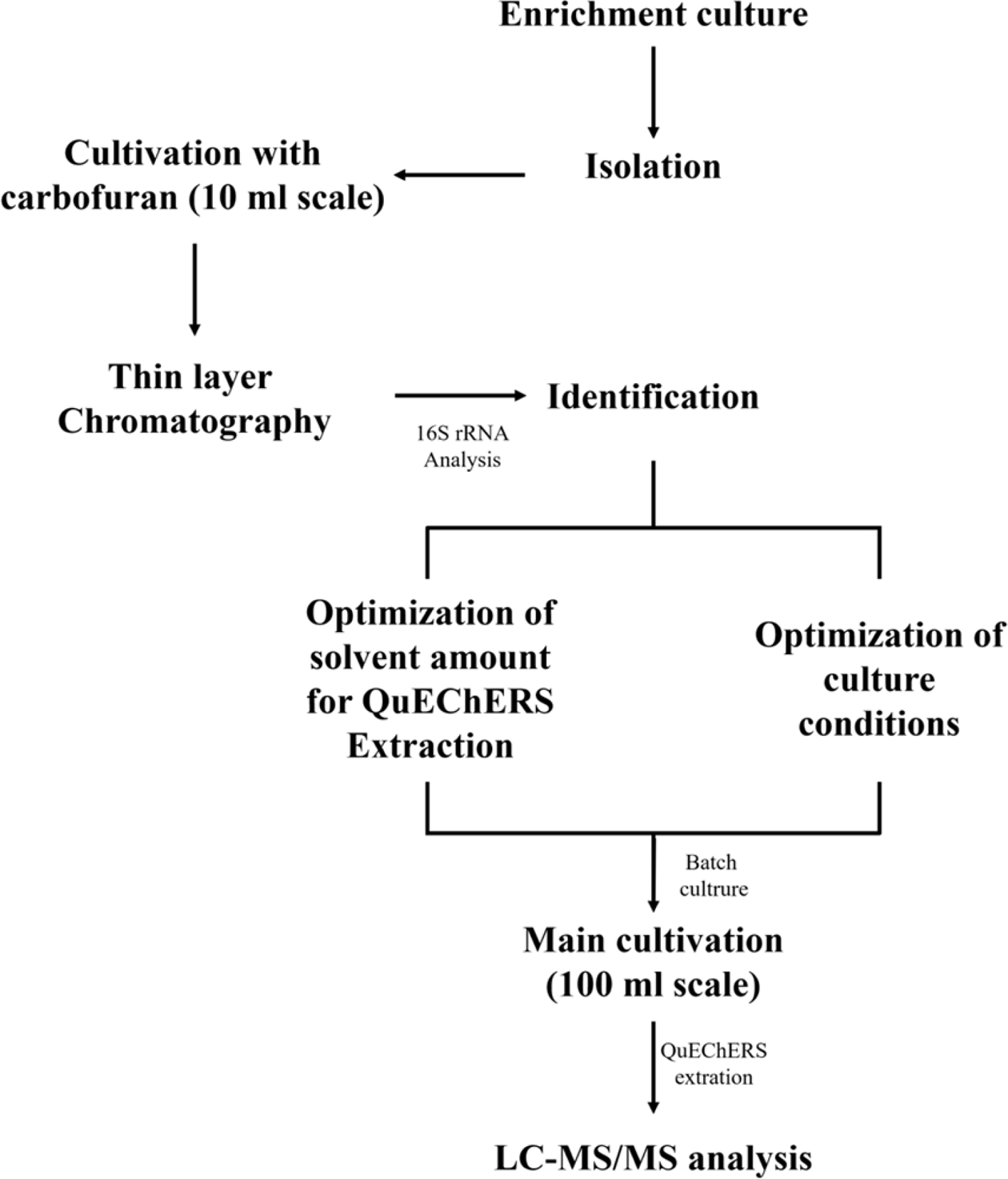
Flow chart for isolation, identification and pesticide degrading properties of carbofuran degrading bacteria from agricultural field.
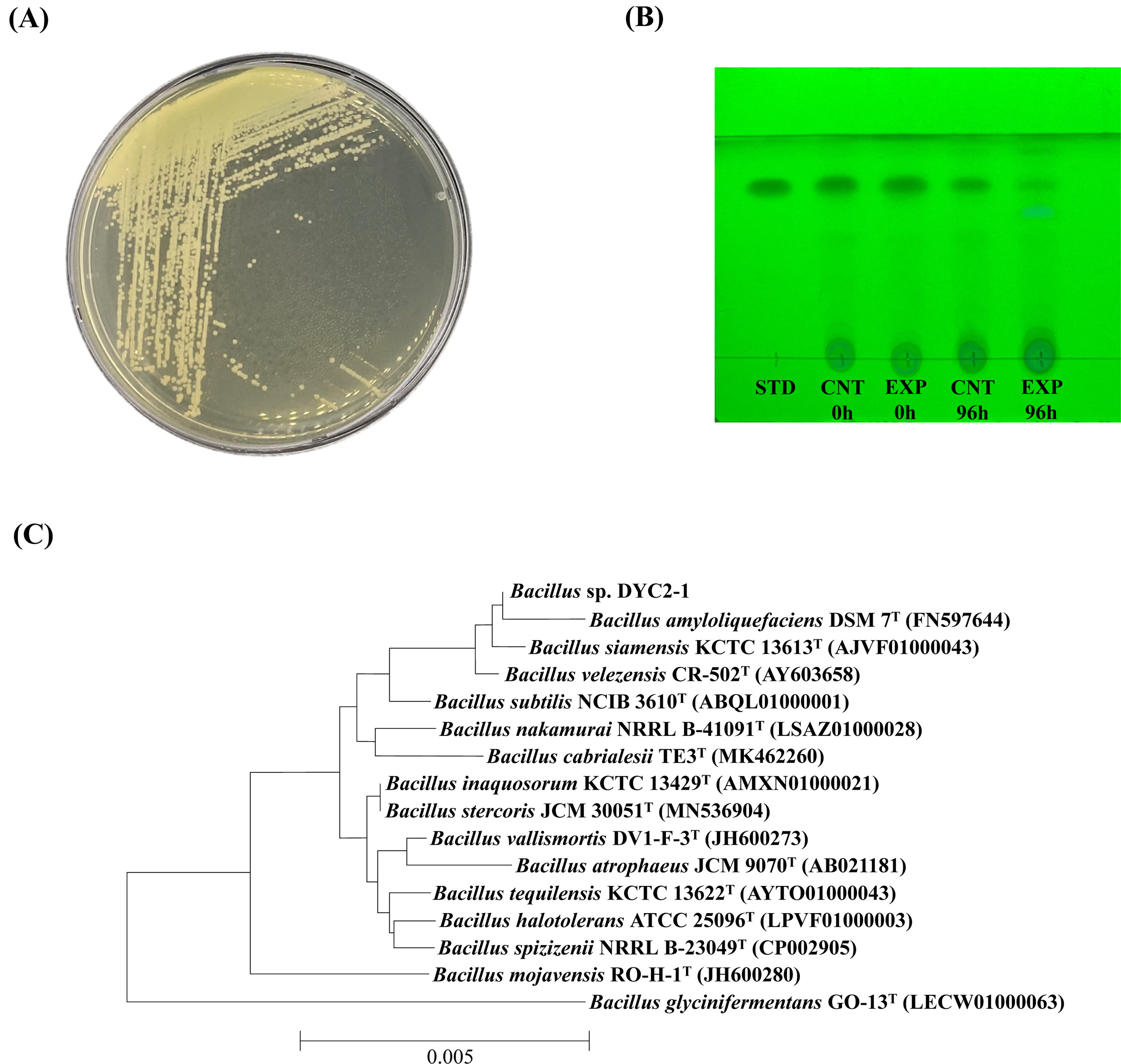
(A) Colony morphology of B. amyloliquefaciens DYC2-1 on R2A agar media. (B) HPTLC chromatograms of the separated spots on the TLC plate under UV365nm. STD, carbofuran 5000 mg/L; CNT 0 h, culture extract of R2A media with 100 mg/L of carbofuran at 0 h; EXP 0 h, culture extract of DYC2-1 strain grown in R2A media at 0 h; CNT 96 h, culture extract of R2A media with 100 mg/L of carbofuran at 96 h; EXP 96 h, culture extract of DYC2-1 strain grown in R2A media at 96 h. (C) Neighbor-joining phylogenetic tree based on 16S rRNA gene sequences, illustrating the relationships of Bacillus sp. DYC2-1 with other Bacillus species. Bootstrap values (expressed as percentages of 1000 replications) > 50% are shown at the branch points. Bar: 0.005 substitutions per nucleotide position.
B. amyloliquefaciens DYC2-1 균주의 배양조건 최적화
Carbofuran 분해 균주 DYC2-1의 최적 배양조건을 알아보기 위하여 다양한 배양 온도, 초기 pH, 생물반응기 교반속도(RPM), 배지 조건을 설정하고(Table 1), 배양을 통해 각 조건에 따른 균주의 성장을 비교해 보았다. 먼저 배양 온도에 따른 균주의 성장을 조사하기 위해 DYC2-1 균주를 15 mL의 R2A 액상배지에 접종하여 25, 30, 35 및 40oC로 설정된 소형 생물반응기에서 12시간 동안 배양을 실시하였다. 균주의 성장측정은 소형 생물반응기에 내장된 광학밀도계를 통해 이루어졌으며 매 1시간 마다 800 nm의 파장으로 세포의 탁도를 측정하였다. 그 결과, 배양 8시간 후 30oC에서 OD800 값이 0.72~0.92로 가장 높은 성장을 보였다. 반면 35oC 및 40oC 에서 DYC2-1 균주는 배양 6시간까지는 OD800이 0.64~0.70로 성장이 점차 증가하다 6시간 이후에는 0.48~0.59로 감소하는 모습을 보였다(Fig. 3A). 미생물을 이용한 생물정화 실험에서는 특히 배양온도의 설정이 가장 중요한 것으로 손꼽힌다. Fenitrothion 농약 분해 미생물 Bacillus sphaericus NFo1 균주는 30~35oC에서 배양 시 84.4~85.9%의 fenitrothion 분해율을 보여 15oC 대비 4배 정도 높은 분해율을 보였다(Choi et al., 2009). Pseudomonas putidia PC1 균주는 10, 20, 37 및 45oC에서 각각 0.3, 0.6, 0,8 및 0.4 mg/day의 cadusafos 분해율을 보였으며, 20 및 37oC에서 5~6일 이내로 투입된 cadusafos를 완전히 분해하였다(Abo-Amer, 2012). 또한 메탄영양세균인 Methylosinus trichosporium OB3b 균주는 30oC에서 메탄을 가장 효과적으로 분해할 수 있는 것으로 보고되었으며(Rodrigues et al., 2009), Bacillus 속 균주도 30oC에서 10일 이내에 100mg/L의 carbofuran을 98% 이상 분해하는 것으로 보고하였다(Onunga et al., 2015). 상기의 연구결과는 본 실험 결과와 유사한 배양온도에서 최적의 농약 분해율을 나타냈지만, 농약의 종류와 농약 분해 미생물의 종류에 따라 농약 분해 속도에 영향을 다르게 나타날 수 있는 것으로 예상된다. 다음으로 D YC2-1의 초기 pH에 따른 성장을 비교하기 위해 초기 pH를 5.0, 6.0, 7.0, 8.0, 9.0 및 10.0으로 조정한 R2A배지를 준비하였다. 마찬가지로 30oC 및 1,000 rpm 조건에서 배양을 수행한 결과 pH 7.0의 R2A 액상배지에서 OD800 값이 0.96로 DYC2-1 균주의 성장이 가장 우수한 것으로 나타났다. 일반적으로 알려져 있는 Bacillus 속 균주의 최적 pH인 7.0 및 8.0의 조건에서 생육이 가장 우수하였다(Fig. 3B). 다음으로, 생물반응기의 교반속도를 200, 400, 600, 800, 1,000 및 1,200 rpm로 설정하고 교반속도에 따른 균주의 성장을 비교해 보았다. 그 결과 DYC2-1 균주는 처음 10시간 동안 800 rpm 조건에서 OD800 값이 0.02~0.81로 높은 세포 성장을 나타내었고, 10시간 이후부터 OD800 값이 0.70~0.87인 600rpm 조건에서 가장 높은 세포성장을 보여주었다(Fig. 3C). 마지막으로 TSB, R2A, LB, MRS 및 YPD를 이용하여 균주의 성장을 비교해 본 결과, TSB 배지에서 OD800 값이 1.82로 가장 높은 세포성장을 보여주었으며 R2A 액상배지 및 MRS 배지에서는 낮은 세포 성장을 보였다(Fig. 3D). 배양최적화 결과 D YC2-1의 최적 배양조건은 30oC, pH 7.0 및 600 rpm이며 배양배지를 TSB로 사용했을 때 가장 우수한 성장을 보였다. 본 연구의 배양최적화 결과에서 알 수 있듯 배양배지로 TSB를 이용하는 것이 균주의 빠른 성장에 유리한 것으로 나타났으나, 복합배지는 이용가능한 탄소원 및 질소원이 풍부하기 때문에 미생물이 농약성분을 에너지원으로 이용하여 성장할 가능성이 낮아지게 된다. 반면 최소배지를 이용한 농약 분해 배양은 농약성분을 유일한 탄소원으로 소비하도록 유도할 수 있는 장점이 있지만(Chaudhry and Ali, 1988), 균주의 성장속도가 다소 느리다는 단점이 존재한다. 따라서 복합배지 보다 적은 영양원을 포함하면서도 최소배지에 비해서는 성장에 적절한 양의 탄소 및 질소원을 제공하는 R2A 배지를 이용하여 이 후의 실험을 진행하였다.
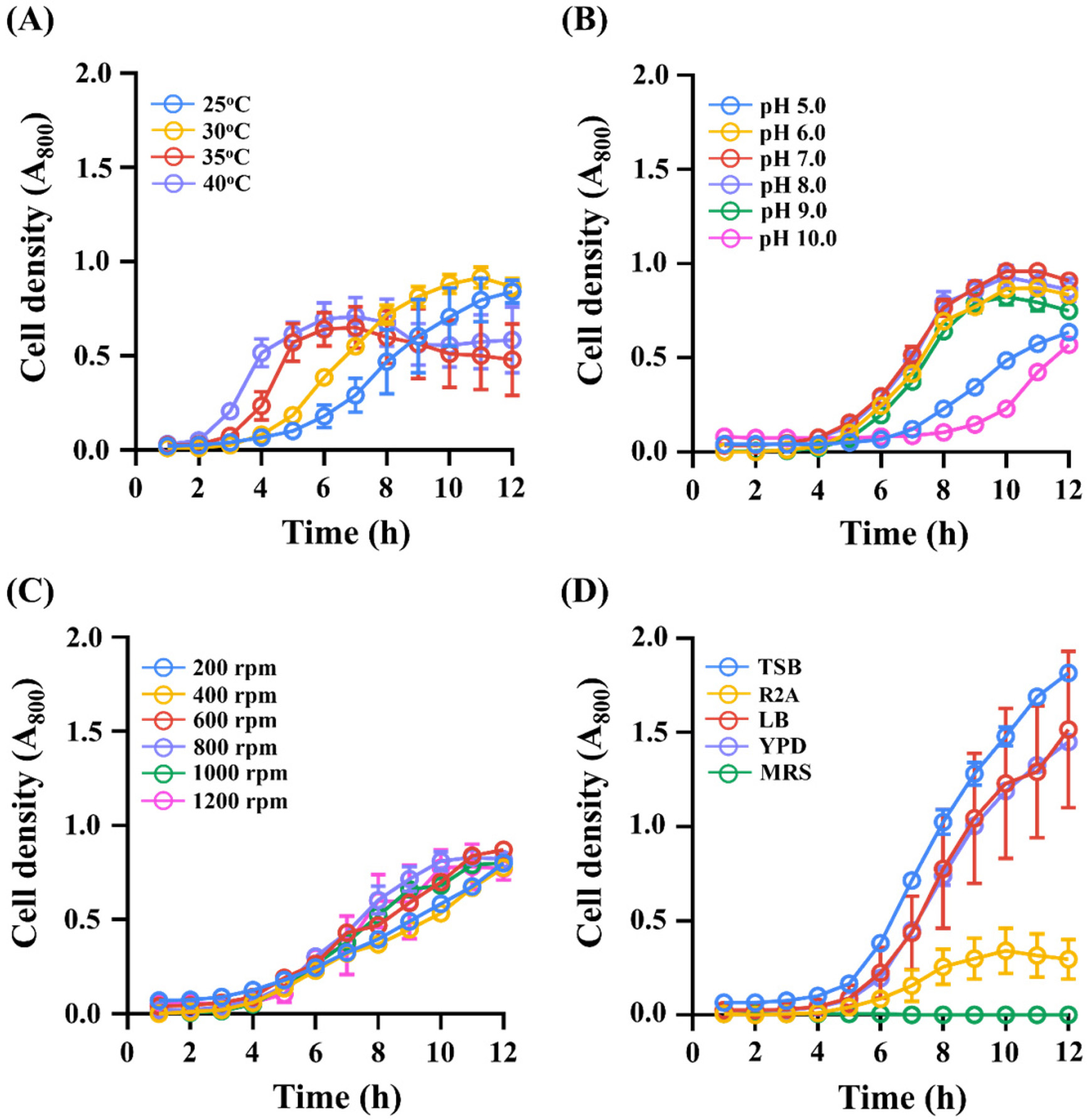
Optimization of culture conditions for maximizing cellular growth of the DYC2-1 strain. OD800 values were plotted for (A) temperature, (B) pH, (C) RPM and (D) media. Round symbols represent optical density (800nm) and each value is the mean of duplicates, and vertical bars indicate ± standard error of the mean (SEM).
QuEChERS 추출 조건의 최적화
QuEChERS 추출법은 농산물 혹은 토양에 잔류하는 농약을 신속하고 정확하게 추출하는 방법이다(Rejczak and Tuzimski, 2015). 일반적으로 QuEChERS-EN법은 시료와 추출용매를 1:1로 혼합하여 추출을 진행하지만(González-Curbelo et al., 2015), 농약의 종류에 따라 추출용매량의 조절이 필요하다. Carbofuran 분해 배양을 실시하기 전, QuEChERS 추출에 필요한 최적의 용매량을 결정하기 위해 100 mg/L의 carbofuran을 혼합한 R2A 액상배지 10mL을 acetonitrile 10 mL, 15 mL 및 20mL와 혼합하여 각각 추출을 진행하였다. 추출은 일반적인 QuEChERS-EN 추출법에 따라 진행하였으며, 상등액을 LC-MS/MS를 이용하여 정량분석을 실시하였다. 10 mL의 acetonitrile로 추출한 결과의 carbofuran 회수율을 100%로 설정하여 15mL 및 20mL의 acetonitrile을 사용한 샘플의 회수율과 비교하였다. 15 mL의 acetonitrile을 사용하였을 때, carbofuran 회수율은 99.7%로 10 mL의 용매로 추출한 결과에 비해 평균값이 0.3% 낮게 측정되었다. 20 mL의 acetonitrile로 동일한 샘플을 추출하였을 때 carbofuran의 회수율은 86.9%로 나타나 acetonitrile의 양이 늘어날수록 더 낮은 회수율을 보였다. 이 결과를 토대로 이 후의 실험은 일반적인 QuEChERS-EN법의 용매량과 동일한 10 mL의 acetonitrile을 이용하여 진행하였다.
DYC2-1의 carbofuran 분해
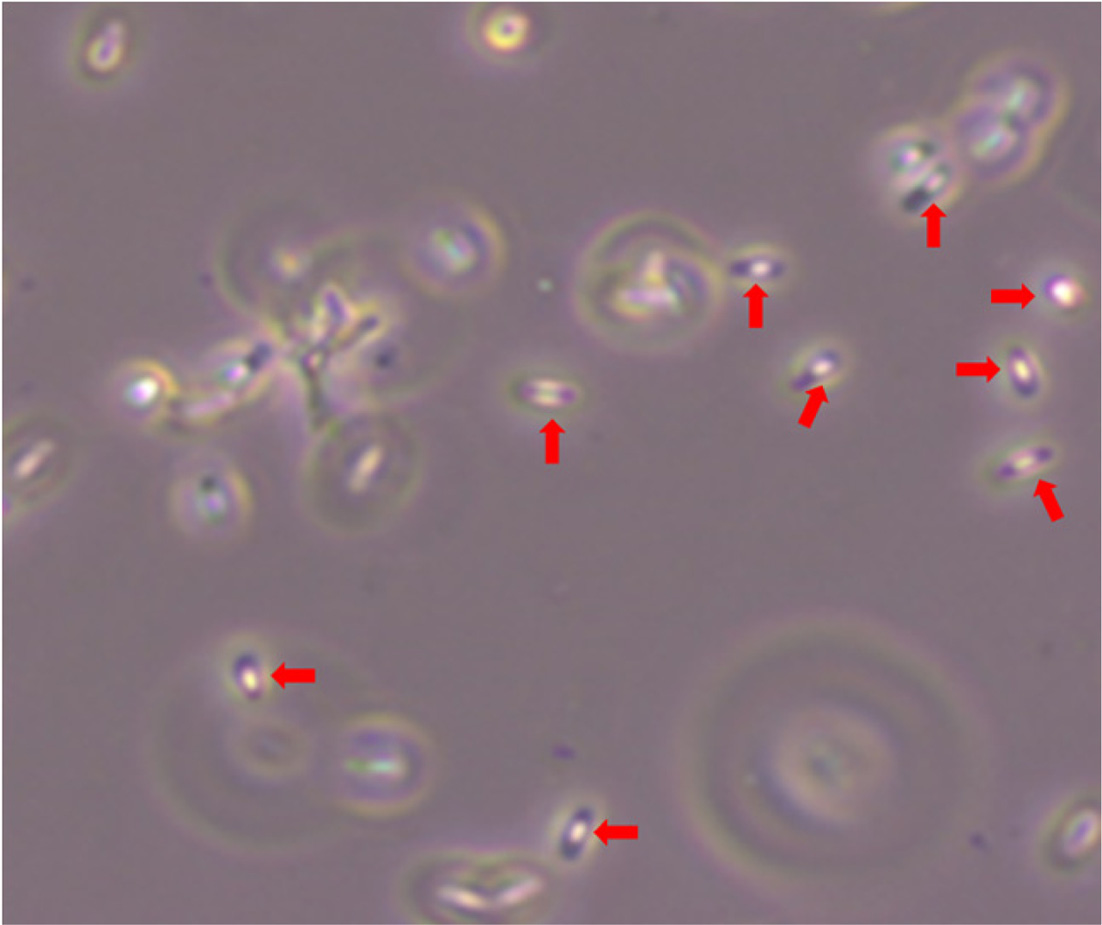
B. amyloliquefaciens DYC2-1의 carbofuran 분해능을 알아보기 위해 120시간에 걸쳐 배양을 수행하였다. 각 시간대별 배양액을 QuEChERS-EN법으로 추출하여 LC-MS/MS를 통해 carbofuran을 정량적으로 확인하였다(Fig. 4). 대조군의 carbofuran 농도는 101.4mg/L에서 120 시간 후 84.4mg/L로 약 20%의 carbofuran을 분해율을 보였으며 잔류감소가 본격적으로 발생하는 24~120시간 동안 일 평균 4.3mg/L 씩 감소하는 것으로 나타났다(Fig. 4A). 이를 통해 carbofuran의 비생물적 분해가 조금씩 일어난다는 것을 알 수 있었다. 반면 실험군의 carbofuran 농도는 배양 24 시간부터 48시간까지는 12.9 mg/L가 감소하였으나 72시간부터 배양종료시점까지는 45.6 mg/L가 감소하였다. 배지 내 carbofuran의 최종 농도는 3.02mg/L로 약 97%의 carbofuran을 분해하였으며 24~120시간 구간에서는 일 평균 25mg/L씩 빠르게 감소하는 것으로 나타났다(Fig. 4B). 또한 대조군대비 약 30배 높은 carbofuran 감소율과 4.6배 빠른 감소 속도를 보였다. 이러한 결과를 통해 D YC2-1이 carbofuran을 효과적으로 분해한다는 것을 알 수 있었다. Bacillus sp. 의 carbofuran 분해는 plasmid에 위치해 있는 mcd 유전자의 carbofuran hydrolase 에 의해 N-methylcarbamate 결합이 가수분해되어 초기 대사 산물인 carbofuran 7-phenol (2,3-dihydro-2,2-dimethyl-7-benzofuranol)로 분해가 이루어진다고 알려져 있으며(Chaundhary and Ali, 1988; Topp et al., 1993; Kim et al., 2004 ), DYC2-1 균주도 가수분해 경로를 통해 carbofuran의 분해가 이루어진 것으로 예상된다. 또한 Bacillus 속 균주는 non-ribosomal peptide synthetase (NRPS)와 polyketide synthanse (PKS)를 이용하여 여러 항생제뿐만 아니라 다양한 휘발성 물질을 생성하여 식물 생장 촉진과 병 방제에도 효과가 있는 것으로 보고되었다(Seewald, 2010; Raaijmakers et al., 2010; chowdhury et al., 2015). Kim 등 (2017), Park 등 (2019) 연구에 따르면 Bacillus velezensis GH1-13 균주에서 식물생장촉진 물질인 인돌 아세트산(Indole-3-acetic acid, IAA)을 생산하고 다양한 식물병원성 곰팡이에 대한 길항작용을 하는 물질인 bacillomycin, bacilysin, fengycin, iturin, surfactin 등의 생합성 유전자를 가지고 있음을 보고하였다. Bacillus amyloliquefaciens FZB42는 병원성 박테리아 및 진균에 대한 식물 저항성을 향상시키는 것으로 보고하였다(Kilian et al., 2000). 이처럼 DYC2-1 균주와 유전적으로 유사한 균주들이 식물성장조절 물질을 분비하는 것으로 미루어 보아 DYC2-1 균주 또한 비슷한 기능을 하는 물질을 생산할 것으로 예상되기 때문에 이에 대한 후속 연구가 필요할 것으로 보인다. 본 연구에서 선발된 Bacillus amyloliquefaciens DYC2-1 균주는 일반적으로 알려진 Bacillus 속 균주들의 특징인 내생포자를 형성하므로(Fig. 5) 미생물제제로 사용이 용이하다는 장점이 있다. 본 연구에서 얻어진 여러가지 결과를 종합해보았을 때, Bacillus amyloliquefaciens DYC2-1은 농업현장에서 다양한 목적으로 활용될 수 있을 것이라 여겨진다.
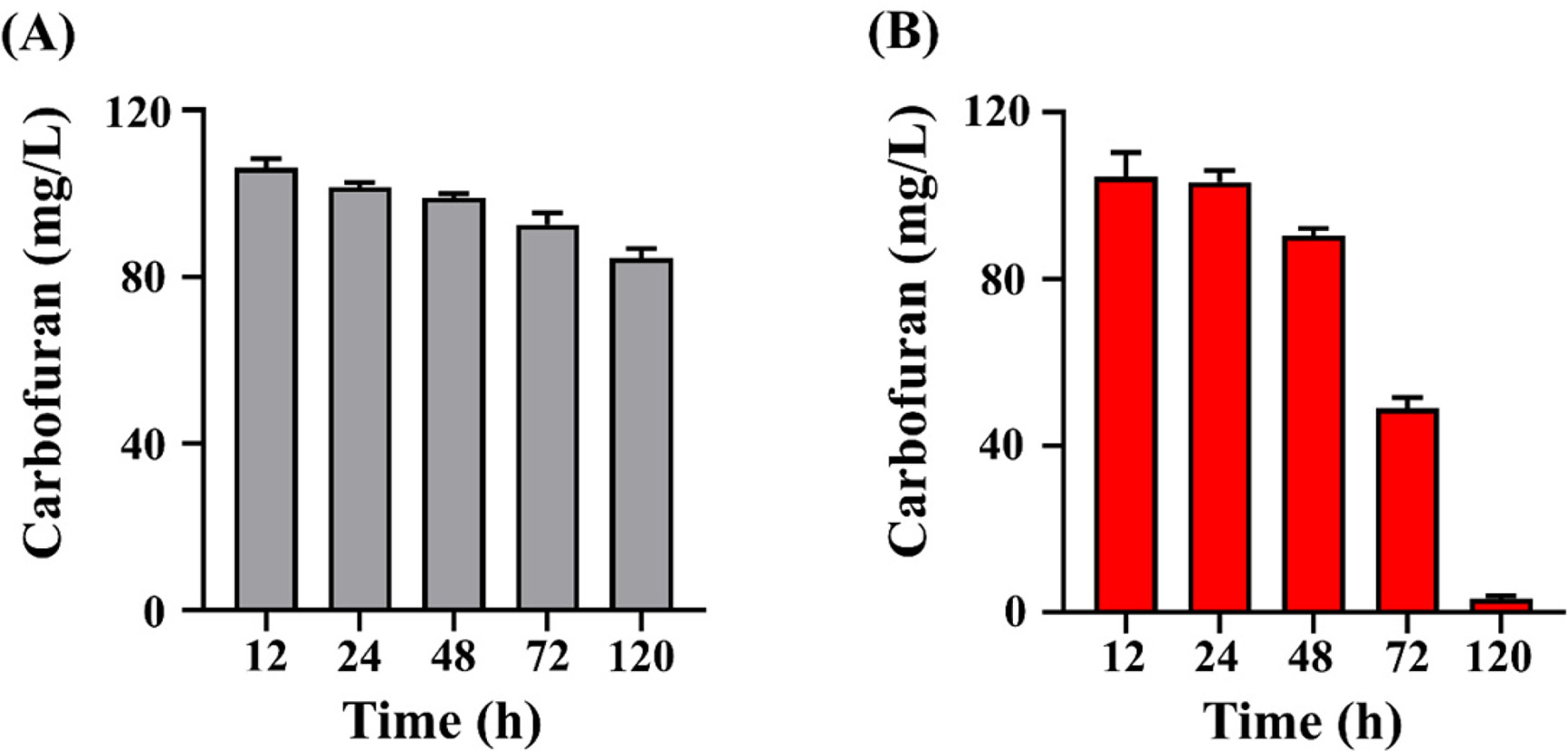
Time-course carbofuran concentration in culture media of (A) non-inoculated control and (B) with Bacillus sp. DYC2-1. The longitudinal axis indicates the concentration of carbofuran. Each value is the average of three replicates, and each bar indicates the average and SEM.
Acknowledgments
본 성과물(논문, 산업재산권, 품종보호권 등)은 농촌진흥청 연구사업(과제번호: PJ014800)의 지원에 의해 이루어진 것임.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Abo-Amer AE, 2012. Characterization of a strain of Pseudomonas putida isolated from agricultural soil that degrades cadusafos (an organophosphorus pesticide). World J. Microbiol. Biotechnol. 28(3):805-814.
[https://doi.org/10.1007/s11274-011-0873-5]

-
Bano N, Musarrat J, 2004. Characterization of a novel carbofuran degrading Pseudomonas sp. with collateral biocontrol and plant growth promoting potential. FEMS. Microbiol. Let. 231(1):13-17.
[https://doi.org/10.1016/S0378-1097(03)00894-2]

-
Bretaud S, Toutant J-P, Saglio P, 2000. Effect of carbofuran, Diuron, and Nicosulfuron on Acetylcholinesterase Activity in Goldfish (Carassius auratus). Ecotoxicol. Environ. Saf. 47(2):117-124.
[https://doi.org/10.1006/eesa.2000.1954]

-
Chaudhry GR, Ali AN, 1988. Bacterial metabolism of carbofuran. Appl. Environ. Microbiol. 54(6):1414-1419.
[https://doi.org/10.1128/aem.54.6.1414-1419.1988]

-
Chaudhry GR, Mateen A, Kaskar B, Sardessai M, Bloda M, et al., 2002. Induction of carbofuran oxidation to 4-hydroxycarbofuran by Pseudomonas sp. 50432. Fems Microbiol. Lett. 214(2):171-176.
[https://doi.org/10.1111/j.1574-6968.2002.tb11342.x]

- Choi H, Lee YD, Kang SC, 2009. Identification and Cultural Optimization of the Fenitrothion-degrading Microorganism, Bacillus sphaericus NFo1. Korean J. Pesic. Sci. 13(1):21-27.
-
Das AC, Mukherjee D, 2000. Influence of insecticides on microbial transformation of nitrogen and phosphorus in typic orchragualf soil. J. Agric. Food Chem. 48(8):3728-3732.
[https://doi.org/10.1021/jf990811q]

-
Das AC, Chakravary A, Sukul P, Mukherjee D, 2003. Influence and persistence of phorate and carbofuran insecticides on microorganisms in rice field. Chemosphere. 53(8):1033-1037.
[https://doi.org/10.1016/S0045-6535(03)00713-6]

-
Dias E, Gracia-Costa F, Morais S, Pereira ML, 2015. A review on the assessment of the potential adverse health impacts of carbamate pesticides. Topics in Public Health, Claborn, InTechOpen
[https://doi.org/10.5772/59613]

-
Ecobichon DJ, 2001. Carbamate insecticides, in: Krieger, R.I., (Ed), Handbook of pesticide toxicology. 2nd edition Academic Press. San Diego CA, pp. 1087-1106.
[https://doi.org/10.1016/B978-012426260-7/50055-0]

- Environmental Protection Agency, 2016. Pesticides: Reregistration; Carbofuran Cancellation Process. https://archive.epa.gov/pesticides/reregistration/web/html/carbofuran_noic.html, (Accessed Oct. 14. 2021).
-
González-Curbelo MÁ, Socas-Rodríguez B, Herrera-Herrera AV, González-Sálamo J, Hernández-Borges J, et al., 2015. Evolution and applications of the QuEChERS method. TrAC-Trends Anal. Chem. 71:169-185.
[https://doi.org/10.1016/j.trac.2015.04.012]

-
Gupta RC, 1994. Carbofuran toxicity. J. Toxicol. Environ. Health. 43(4):383-418.
[https://doi.org/10.1080/15287399409531931]

-
Idris EE, Iglesias DJ, Talon M, Borriss R., 2007. Tryptophandependent production of indole-3-acetic acid (IAA) affects level of plant growth promotion by Bacillus amyloliquefaciens FZB42. Mol Plant Microbe. Interact. 20(6):619-626.
[https://doi.org/10.1094/MPMI-20-6-0619]

-
Karns JS, Mulbry WW, Nelson JO, Kearney PC, 1986. Metabolism of carbofuran by a pure bacterial culture. Pestic. Biochem. Physiol. 25(2):211-217.
[https://doi.org/10.1016/0048-3575(86)90048-9]

-
Karpouzas DG, Walker A, 2000. Factors influencing the ability of Pseudomonas putida strains epI and II to degrade the organophosphate ethoprophos. J. Appl. Microbiol. 89(1):40-48.
[https://doi.org/10.1046/j.1365-2672.2000.01080.x]

- Kilian M, Steiner U, Krebs B, Junge H, Schmiedeknecht G, et al., 2000. FZB24® Bacillus subtilis–mode of action of a microbial agent enhancing plant vitality. Pflanzenschutz-Nachr. Bayer. 1:72-93.
-
Kim IS, Ryu JY, Hur HG, Gu MB, Kim SD, et al., 2004. Sphingomonas sp. Strain SB5 degrades carbofuran to a new metabolite by hydrolysis at the furanyl ring. J. Agric. Food Chem. 52(8):2309-2314.
[https://doi.org/10.1021/jf035502l]

-
Kim YH, Park SK, Hur JY, Kim YC, 2017. Purification and characterization of a major extracellular chitinase from a biocontrol bacterium, Paenibacillus elgii HOA 73. Plant Pathol J. 33(3):318-328.
[https://doi.org/10.5423/PPJ.FT.01.2017.0022]

- Korea Crop Protection Association (KCPA), 2014. Agrochemicals Use Guide Book, 1440 p.
- Ministry of Food and Drug Safety (MFDS), 2021. Exceeding the pesticide residue standards for a total of 4 cases including butterbur and chwinamul. https://www.mfds.go.kr/brd/m_99/view.do?seq=45255, (Accessed on Sep. 10. 2021).
-
Naqvi T, Cheesman, MJ, Williams MR, Campbell PM, Ahmed S, et al., 2009. Heterologous expression of the methyl carbamate-degrading hydrolase MCD. J. Biotechnol. 144(2):89-95.
[https://doi.org/10.1016/j.jbiotec.2009.09.009]

-
Onunga DO, Kowino IO, Ngigi AN, Osogo A, Orata F, et al., 2015. Biodegradation of carbofuran in soils within Nzoia River Basin, Kenya. J. Environ. Sci. Health B. 50(6):387-397.
[https://doi.org/10.1080/03601234.2015.1011965]

-
Park JK, Kim JE, Lee CW, Song JK, Seo SI, et al., 2019. Mass cultivation and characterization of multifunctional Bacillus velezensis GH1-13. Korean J. Org. Agric. 27(1):65-76.
[https://doi.org/10.11625/KJOA.2019.27.1.65]

-
Parte SG, Mohekar AD, Kharat AS, 2017. Microbial degradation of pesticide: a review. Afr. J. Microbiol. Res. 11(24):992-1012.
[https://doi.org/10.5897/AJMR2016.8402]

-
Raaijmakers JM, Bruijn ID, Nybroe O, Ongena M, 2010. Natural functions of lipopeptides from Bacillus and Pseudomonas: more than surfactants and antibiotics. FEMS Microbiol. Rev. 34(6):1037-1062.
[https://doi.org/10.1111/j.1574-6976.2010.00221.x]

-
Rejczak T, Tuzimski T., 2015. A review of recent developments and trends in the QuEChERS sample preparation approach. Open Chem. 13:980-1010.
[https://doi.org/10.1515/chem-2015-0109]

-
Rodrigues AS, Valdman B, Salgado AM., 2009. Analysis of methane biodegradation by Methylosinus trichosporium OB3b. Braz. J. Microbiol. 40(2):301-307.
[https://doi.org/10.1590/S1517-83822009000200017]

-
Shin DH, Kim DU, Seong CN, Song HG, Ka JO, 2012. Genetic and phenotypic diversity of carbofuran-degrading bacteria isolated from agricultural soils. J. Microbiol. Biotechnol. 22(4):448-456.
[https://doi.org/10.4014/jmb.1108.08087]

-
Song SH, Kim KY, Kim YS, Ryu KS, Kang MS, et al., 2021. Comparative anlaysis of pesticide residues in agricultural products in circulation in gyeonggi-do before and after positive list system enforcement. J. Food Hyg. Saf. 36(3):239-247.
[https://doi.org/10.13103/JFHS.2021.36.3.239]

-
Tomasek PH, Karns JS, 1989. Cloning of a carbofuran hydrolase gene from Achromobacter sp. strain WM111 and its expression in gram-negative bacteria. J. Bacteriol. 171(7):4038-4044.
[https://doi.org/10.1128/jb.171.7.4038-4044.1989]

-
Topp E, Hanson RS, Ringelberg DB, White DC, Wheatcroft R., 1993. Isolation of and characterization of an N-methyl-carbamate insecticide-degrading methylotrophic bacterium. Appl. Environ. Microbiol. 59(10):3339-3349.
[https://doi.org/10.1128/aem.59.10.3339-3349.1993]

-
Trotter DM, Kent RA, Wong MP, 1991. Aquatic fate and effect of carbofuran. Crit. Rev. Environ. Sci. Technol. 21(2):137-176.
[https://doi.org/10.1080/10643389109388412]

Jihwan Lim, Center for Industrialization of Agricultural and Livestock Microorganisms, Researcher, https://orcid.org/0000-0001-6130-1315.
Haeseong Park, Center for Industrialization of Agricultural and Livestock Microorganisms, Postdoctoral researcher.
Sun il Seo, Center for Industrialization of Agricultural and Livestock Microorganisms, Researcher.
Ju-eun Kim, Department of Chemistry, Chonnam National University, Postdoctoral researcher.
Jung-eun Kim, Department of Chemistry, Chonnam National University, Researcher.
Chul-won Lee, Department of Chemistry, Chonnam National University, Professor.
Pyoung il Kim, Center for Industrialization of Agricultural and Livestock Microorganisms, Doctor of Philosophy, https://orcid.org/0000-0001-6853-5210.