갯기름나물 중 살균제 Azoxystrobin, Fluxapyroxad, Penthiopyrad의 잔류 특성
초록
본 연구는 갯기름나물(Peucedanum japonicum Thunb)에서 azoxystrobin, fluxapyroxad, penthiopyrad 및 이들의 대사체 R230310, M700F048, M700F002, 753-A-OH, PAM의 경시적 잔류변화잔류량 변화를 통해 생물학적 반감기를 산출하여 안전성 평가를 위한 자료로 활용하고자 수행되었다. 각 농약의 모화합물 및 대사체는 QuEChERS법으로 전처리 한 후 LC-MS/MS를 이용하여 정량분석하였고, 분석은 기기의 정량한계, 분석방법의 정량한계, 직선성, 정확성 및 정밀도 측정을 통해 검증되었다. 분석방법의 정량한계는 0.01 mg/kg이었으며, 정확성과 정밀도는 각각 73.8-113.7%와 8.4%이하였다. 시험은 시설재배에서 수행하였으며, 수확 전 3회에 걸쳐 azoxystrobin 21.7% SC와 fluxapyroxad 15.3% SC, penthiopyrad 20% EC을 살포한 후, 시료를 채취하여 분석하였다. 잔류농약 분석결과 azoxystrobin의 경우 최종 살포 후, 당일 채취한 시료에서의 초기 잔류량은 18.06-19.79 mg/kg으로 검출되었으며, 최종 살포 후 21일이 경과한 시료에서는 초기 잔류농도 대비 87.2%가 감소하였다. Fluxapyroxad에서는 초기 잔류농도가 8.13-9.19 mg/kg이었고 21일 후의 시료에서는 89.1%까지 감소하는 경향을 보였으며, penthiopyrad의 초기 잔류농도는 3.09-3.49 mg/kg이었지만, 최종 살포 21일 후의 시료에서는 84.6%가 감소된 것으로 확인되었다. 잔류분석 결과를 바탕으로 산출된 갯기름나물에서의 각 농약의 생물학적 반감기는 azoxystrobin은 10.7일, fluxapyroxad 8.2일 그리고 penthiopyrad은 10.2일이었다. 본 연구를 통해 갯기름나물 중 흰가루병 방제를 위한 살균제 3종의 잔류특성을 구명한 결과, 시간 경과에 따라 순차적인 감소가 나타나는 비슷한 경향을 나타내었다.
Abstract
This study was conducted to evaluate the residual characteristics and biological half-life values of three fungicides: azoxystrobin, fluxapyroxad, and penthiopyrad and their metabolites: R230310, M700F048, M700F002, 753-A-OH, and PAM on Peucedanum japonicum Thunb. The LC-MS/MS analysis for the pesticides and metabolites was validated in terms of the limits of quantification, linearity, accuracy, and precision using the QuEChERS method. The method limit of quantification (MLOQ) was 0.01 mg/kg and the accuracy and precision ranged 73.8 to 113.7% and less than 8.4%, respectively. The study was carried out in a greenhouse and azoxystrobin 21.7% SC, fluxapyroxad 15.3% SC, and penthiopyrad 20% EC were sprayed three times on different application days before harvest. As a result, the initial residual concentration of azoxystrobin in the sample collected on the day of the final application was 18.06–19.79 mg/kg, then decreased to 87.2% in the harvested sample at 21 days after the final application compared to the initial concentration. The initial concentrations of fluxapyroxad and penthiopyrad were detected as 8.13–9.19 and 3.09–3.49 mg/kg, which decreased to 89.1 and 84.6% after 21 days, respectively. The biological half-lives of each pesticide based on the results of this experiment were 10.7 days for azoxystrobin, 8.2 days for fluxapyroxad, and 10.2 days for penthiopyrad. Three pesticides used for the control of powdery mildew in Peucedanum japonicum Thunb showed a similar decrease over time.
Keywords:
Azoxystrobin, Fluxapyroxad, Penthiopyrad, Peucedanum japonicum Thunb, Residual pesticide키워드:
Azoxystrobin, Fluxapyroxad, Penthiopyrad, 갯기름나물, 잔류농약서 론
소비자들에게 식품에 대한 불안요소를 제거하고, 생산자에게는 안전한 먹거리 생산과 농가소득 증대를 위해 식품의약품안전처, 농촌진흥청, 농산물품질관리원, 보건환경연구원 등의 정부기관 및 여러 민간위탁기관에서는 농산물에 대한 잔류농약의 안전성을 체계적으로 관리하고 생산자인 농가를 대상으로 안전성 교육과 홍보를 하고 있다(Park et al., 2018). 이러한 노력에도 불구하고 봄철 다소비 나물 종류에 대한 집중 점검을 통해 전국의 시장, 마트 등에서 유통·판매 중인 농산물 268건을 수거·검사한 결과, 시금치, 취나물, 시래기, 갯기름나물(방풍나물)에서 5건의 농약 잔류허용 기준을 초과하였다고 발표하는 등 나물로 소비되는 엽경채류 농산물에서의 잔류농약 허용기준의 초과가 빈번히 발생하고 있다(MFDS, 2020). 또한 국립농산물 품질관리원에서 농민들에게 교육하고 있는 허용물질목록관리제도(Positive List System, PLS)에서 잔류농약 부적합 발생비율이 높은 상위 10개 농산물 중 갯기름나물이 포함되어 있어 재배 시 농민들의 농약 사용에 주의를 요구하는 품목으로 지정하고 있다(NAQS, 2020).
본 연구의 시험작물인 갯기름나물(Peucedamm japonicum Thunb)은 미나리과(Umbelliferae)에 속하는 다년생 초본으로 일본, 대만, 중국, 한국 등의 아시아 국가에서 많이 재배되고 있으며, 특히 우리나라에서는 해안지대를 중심으로 소면적으로 재배되고 있는 식물이다(Kim et al., 2007). 갯기름나물의 뿌리에는 peucedanol, umbelliferone 등의 주요성분이 함유되어 있어(Kim, 2015), 한방에서는 고협압, 뇌졸중에 의한 중풍병 예방과 몸속의 해독작용으로 기침, 두통, 해열 및 신경통 완화에 이용되거나 피부진균과 비만억제 작용에 활용성이 높은 약용작물로 보고되고 있다(Lee et al., 2008; Kim, 2015).
갯기름나물은 대부분 시설에서 재배되고 있으며, 재배되는 과정에서 모잘록병, 녹병, 회색점무늬병, 그리고 흰가루병과 같은 주요 질병이 발생하고 있다(Kwon, et al., 2020). 그 중 흰가루병은 6월 중·하순부터 발병하기 시작하여 9월까지 발생하는 병으로 시설재배의 경우에는 7-8월경에 잎에서 가장 많이 발생하여 잎 전체에 하얀 균사체가 작은 원형으로 분산되는 증상을 보이며 감염이 되면 잎이 누렇게 되면서 말라 죽는 것으로 보고되고 있다(NCPMS, 2021). 국내에서는 갯기름나물에서 발생하는 흰가루병을 방제하기 위해서 azoxystrobin, fluxapyroxad, penthiopyrad 등의 농약 성분들이 이용되고 있으며, 이들 농약들은 살균제로 세포 내 mitochondria의 내막에서 일어나는 에너지 생성과정의 세포 내 호흡에서 단백질 복합체(complex II or III) 전자 수송을 저해함으로써 질병을 억제하고 있다(Turner, 2018). 이들 농약 성분이 농작물에 살포되었을 때, azoxystrobin에 대해서는 포도, 매실, 인삼 등(Lee et al., 2011; Lee et al., 2013; Lee et al., 2015), fluxapyroxad은 맥문동, 수박, 밀, 옥수수 및 면실 등(Lee et al., 2017; Park et al., 2017; Cho et al., 2021) 그리고 penthiopyrad에서는 참외, 오이 등(Kim et al., 2014; Leem et al., 2017)에서 잔류소실연구가 보고되고 있지만, 이 농약들이 갯기름나물에 처리된 이후의 잔류특성 및 소실경향에 대해서는 현재까지 보고되지 않고 있다. 따라서, 본 연구는 소면적 재배작물인 갯기름나물 중 흰가루병 방제를 위해 사용되는 살균제 azoxystrobin, fluxapyroxad, penthiopyrad의 잔류특성을 구명하여, 농약등록 확대 및 안전사용 기준 설정을 위한 기초자료로 사용하고자 수행되었다.
재료 및 방법
시험농약 및 시약
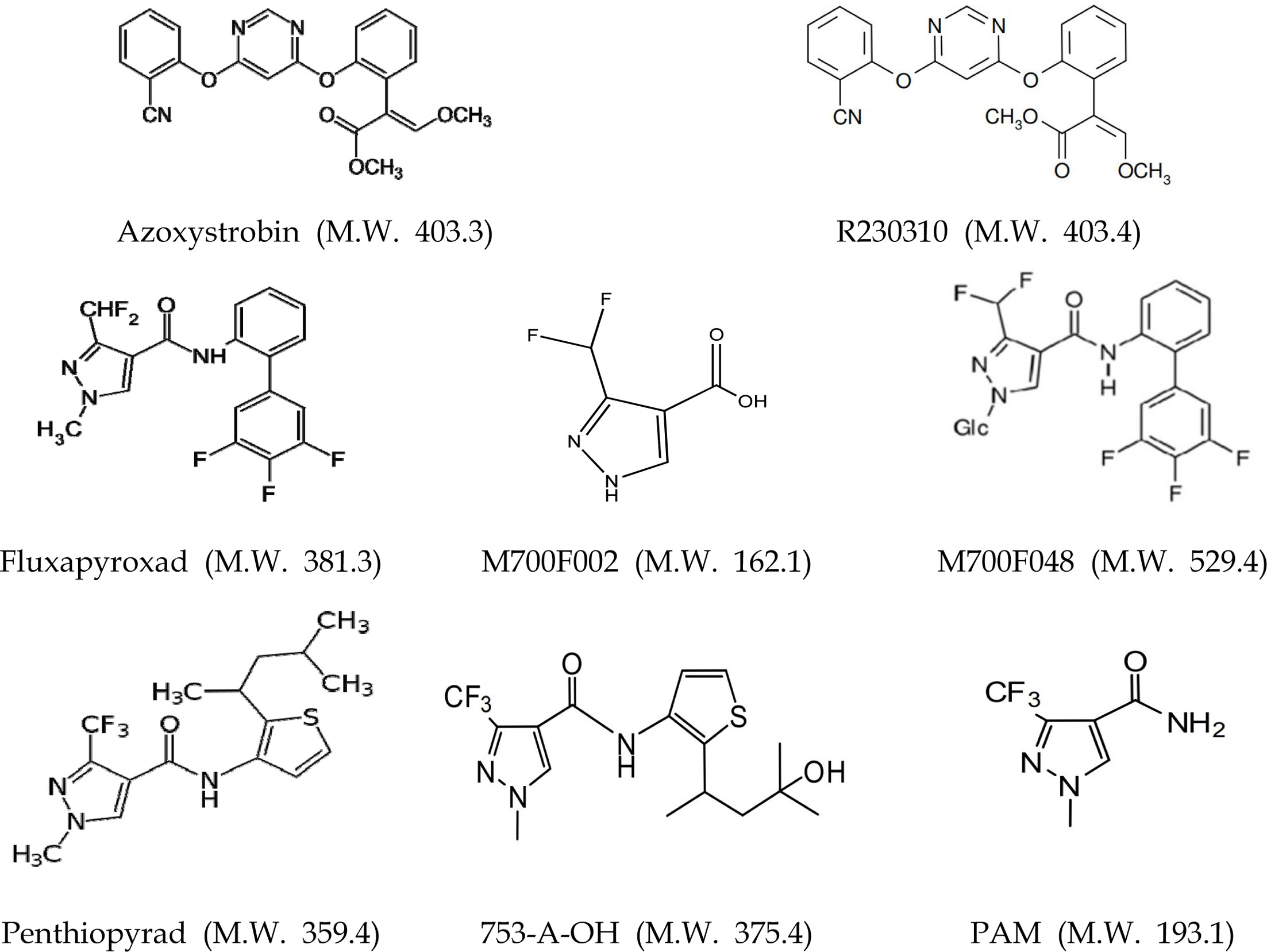
갯기름나물에 처리한 시험약제는 azoxystrobin 21.7% 액상수화제(2,000배 희석, ㈜한국마간), fluxapyroxad 15.3% 액상수화제(4,000배 희석, ㈜농협케미컬), penthiopyrad 20% 유제(2,000배 희석, ㈜경농)를 사용하였다. 표준물질은 azoxystrobin (99.9%) fluxapyroxad (99.9%), penthiopyrad (98.0%) 분석용 표준품을 HPC Standards GmbH (Borsdorf, Germany)에서 구입하여 사용하였으며, 각 표준품의 대사체 R230310 (98.0%), M700F048 (94.0%), M700F002 (98.5%), 753-A-OH (94.3%), PAM (99.94%)는 각 농약의 제조사에서 제공받아 사용하였다 (Fig. 1). 시험에 이용한 유기용매 acetonitrile, methanol, 물은 Burdick & Jackson (Muskegon, MI, USA)의 high-performance liquid chromatography (HPLC) 급의 제품을 사용하였고, formic acid (98%)는 Junsei Chemical (Tokyo, Japan), ammonium formate (99.995%)는 Sigma-Aldrich (Steinheim, Germany) 제품을 사용하였다. 갯기름나물 중 잔류농약분석을 위한 QuEChERS법 추출을 위해 roQTM QuEChERS extract kit (magnesium sulfate, sodium chloride, sodium citrate dibasic sesquihydrate, sodium citrate tribasic dihydrate)와 정제를 위해 사용된 roQTM QuEChERS dispersive SPE 2 mL (primary secondary amine (PSA), octadecylsilane end-capped, magnesium sulfate)은 phenomenex Inc. (Torrance, CA, USA)로부터 구입하여 사용하였다.
시험포장 및 약제살포
시험포장은 경상북도 포항시 남구 연일읍 중명리에 위치한 갯기름나물 시설재배 하우스에서 수행하였으며, 품종은 식방풍을 사용하였다. 시험기간 동안(2017. 04. 28-2017. 06. 21) 시설재배지의 최저기온은 10.0oC, 최고기온은 32.8o C, 평균 기온은 20.8oC, 평균 상대 습도는 60.2%였다. 약제처리구의 면적은 각 농약마다 10m2/1 처리구로 3반복 배치하였고, 시험약제간의 간섭을 피하고자 1.0 m 이상의 완충구를 확보하였다. 농약을 처리하지 않는 무처리구도 10m2의 면적으로 3반복 배치하였다.
시험농약의 약제처리는 수확 전 약제 처리일을 다르게 설계하여 수행하였으며, 시험약제는 각 농약별 희석배수에 맞춰 물로 희석하였다. 시험약제 살포 전 살포장비 충전식 분무기(한일에스피, HP-2010, 80 PSI)의 일정한 살포압력, 분사량(mL/min)을 3반복으로 점검한 후, 시험구 전체에 약액이 충분히 흐를 정도로 균일하게 살포하였다. Table 1에 따라 각 농약마다 4개의 구역을 설정하였고 수확 전 약제처리일은 40-30-21일전, 30-21-14일전, 21-14-7일전, 14-7-0일로 각 구역마다 3회 살포하였다.
시료의 수확 및 시료 전처리
잔류분석을 위한 시료는 최종 약제살포 후 0일(약액이 충분히 건조된 후)에 모든 처리구에서 약 1 kg 이상씩 채취하여 아이스박스에 넣어 냉장상태(8~12oC, 1-2시간 운송)에서 실험실로 옮긴 후 변질된 잎과 줄기를 제거하고 세절한 뒤 드라이아이스를 넣어 믹서기로 균질화 하였다.
균질화 한 갯기름나물 시료 10.0 g에 acetonitrile 10.0 mL를 가한 후 2분간 (1,100 rpm) 진탕 추출하였다. 진탕 추출한 시료에 6.0 g magnesium sulfate, 1.0 g sodium chloride, 1.0 g sodium citrate tribasic dihydrate, 0.5 g sodium citrate dibasic sesquihydrate를 첨가하여 3분간 진탕 추출 후 4oC에서 4,500 rpm에서 6분간 원심분리(Z383K, HERMLE Labortechnik, Germany)하였다. 원심분리한 시료에서 상등액 1.0 mL를 취한 뒤 EN method d-SPE kit (150 mg end-capped C18 sorbent, 900 mg magnesium sulfate, 150 mg primary secondary amine)에 넣고, 2분간 vortexing 후 12,000 rpm에서 2분간 원심분리하였다. 상등액을 0.22 μm syringe filter (PTFE membrane, 17 mm, GVS, USA)로 여과하여 acetonitrile로 희석한 시료를 분석에 사용하였다.
기기분석조건
갯기름나물 중 azoxystrobin, fluxapyroxad, penthiopyrad 및 이들의 대사체 R230310, M700F048, M700F002, 753-A-OH, PAM의 분석은 LC-MS/MS(Agilent Technologies 6460 Triple Quad, Santa Clara, CA, USA)를 사용하였고 electro-spray ionization (ESI)의 positive ion mode를 적용하였다. 이동상은 5mM ammonium formate과 0.1% formic acid가 포함된 물과 methanol을 사용하였다. 정량 및 정성분석을 위한 최적의 multiple reaction monitoring(MRM) 조건은 각 물질의 표준용액(1 μg/mL)을 사용하여 MS/MS에서 설정한 뒤, 분석에 적용하였다(Table 2).
시험농약 및 대사체들의 분석법 검증
각 시험농약 및 대사체의 분석법은 기기의 정량한계(Instrumental limit of quantification, ILOQ), 분석법상의 정량한계(Method limit of quantification, MLOQ), 검량선의 직선성 및 회수율 시험으로 검증하였다. Matrix-matched standard로 조제한 일정한 농도를 분석장비에 주입하여 signal-to-noise ratio가 10보다 높은 가장 낮은 농도를 기기의 ILOQ로 설정하였으며, 정확도와 정밀도는 회수율 시험을 통해 확인하였다. 농약이 처리되지 않은 갯기름나물 대조구 시료 10.0 g에 azoxystrobin, fluxapyroxad, penthiopyrad 및 이들의 대사체 R230310, M700F048, M700F002, 753-A-OH, PAM의 작업표준용액을 첨가하여 농도가 0.1 및 0.5 mg/kg (n=3)이 되도록 하였다. 시험농약 및 대사체가 처리된 시료와 상기의 약제가 처리되지 않은 대조구 시료를 본문의 시료 전처리방법과 동일하게 수행하고 분석한 후, 검출된 농도와 처리된 농도를 비교하여 회수율(%)을 산출하였다. 정확성과 정밀도는 회수율의 평균값과 상대표준편차(Relative standard deviation, RSD%)로 평가하였으며, 각각의 시험물질 직선성은 matrix-matched standard를 이용하였다. 분석법상 정량한계는 최소검출량, 추출용매량, 최종희석용매량, 시료량, 추출용매 분취량, 기기주입량 등을 이용하여 다음과 같이 산출하였다(Eq. 1).
| (Eq. 1) |
Azoxystrobin과 fluxapyroxad, penthiopyrad의 총 환산잔류량 및 생물학적 반감기 산출
본 시험에 사용된 살균제 3종의 잔류량은 모화합물과 그 대사산물의 합으로 농촌진흥청 국립농업과학원의 “농약의 잔류분 정의”에 명시된 지침에 따라(NAS, 2018) 다음 식에 의해 환산계수를 활용하여 산출하였다(Eq. 2, 3, 4).
| (Eq. 2) |
| (Eq. 3) |
| (Eq. 4) |
갯기름나물 중 azoxystrobin과 fluxapyroxad, penthiopyrad의 생물학적 반감기는 다음과 같이 시간경과에 따른 잔류량을 감소식 Ct = C0 × e-kt (Ct: 잔류량, C0: 초기농도, k: 감소상수, t: 시간)으로 계산하고 k값을 이용하여 반감기를 0.693/k 식으로 계산하였다(Chang et al., 2011).
결과 및 고찰
분석법의 확립
2003년 Anastassiades et al.에 의해 처음 도입된 이래 QuEChERS 분석법은 질량분석기기의 발달과 보급이 많이 이루어지면서 현재 많은 농약분석에 널리 사용되고 있다. QuEChERS는 크게 original, AOAC, EN 15662로 3가지 추출 및 정제방법이 보고되어 있으며, 본 연구에서는 Kim et al., (2016)에서 확립된 다성분 농약 동시분석법의 확립에 근거하여 EN 15662 방법으로 azoxystrobin, fluxapyroxad, penthiopyrad 및 이들의 대사체 R230310, M700F048, M700F002, 753-A-OH, PAM을 갯기름나물에서 추출 및 정제하였다.
Azoxystrobin, fluxapyroxad, penthiopyrad 및 이들의 대사체 R230310, M700F048, M700F002, 753-A-OH, PAM의 ILOQ는 matrix-matched standard로 확인한 결과 0.0005 μg/mL였다. 시험농약의 모화합물 및 대사체 MLOQ는 전처리 방법과 기기주입량, 희석계수를 계산하여 0.01 mg/kg으로 설정하였다.
시험농약의 matrix-matched standard를 분석하여 얻은 크로마토그램상의 면적을 기준으로 작성된 검량선의 직선성은 0.999 이상으로 모두 양호하였으며, 2 수준의 처리농도(0.1 및 0.5mg/kg)에서 3반복으로 수행한 회수율 시험에서 확인된 시험농약 및 대사체들의 평균 회수율은 azoxystrobin; 107.0–114.7%, R230310; 103.9–113.7%, fluxapyroxad; 98.6–111.4%, M700F048; 98.4–110.6%, M700F002; 84.0–100.9%, penthiopyrad; 101.3–106.9%, 753-A-OH; 101.9–107.6%, PAM; 73.8–88.7% 였으며, 정밀도(상대표준편차, RSD%)는 전체적으로 0.7-8.4%로 European Commission Regulation (2020) 및 Codex Guideline (2010)에서 요구하는 회수율 및 상대표준편차의 기준에 만족한 결과인 회수율 70–120%, 상대표준편차 ± 20%를 만족하는 것으로 확인되었다. 또한 갯기름나물 대조구 시료에서 시험물질 및 대사체의 머무름 시간에 용출되는 간섭물질은 확인되지 않았다(Fig. 2).

Representative HPLC-MS/MS chromatograms of untreated (A), recovery samples fortified at 0.1 mg/kg (B), recovery samples fortified at 0.5 mg/kg (C).
따라서 본 연구에 적용된 분석법은 갯기름나물 내에 잔류하는 azoxystrobin, fluxapyroxad, penthiopyrad 및 대사체 R230310, M700F048, M700F002, 753-A-OH, PAM의 잔류농도를 분석하는데 적합한 것으로 판단된다.
갯기름나물 중 azoxystrobin, fluxapyroxad, penthiopyrad의 잔류소실 특성
본 연구에서는 azoxystrobin 21.7% 액상수화제 2,000배, fluxapyroxad 15.3% 액상수화제 4,000배, penthiopyrad 20% 유제 2,000배 희석액을 수확 전 약제 살포일을 달리하여 3회 살포 후, 갯기름나물에서 잔류량을 조사하였다. 농약을 처리하지 않은 무처리구 시료에서는 잔류농약이 검출되지 않았다. 대사체 R230310은 시험기간동안 0.09–0.93 mg/kg으로 검출되었으며 환산잔류량을 적용한 azoxystrobin의 잔류농도는 살포 당일의 초기 잔류량은 18.06–19.79 mg/kg이었고, 수확 7일 전 살포에서는 12.30–18.53 mg/kg으로 초기 잔류농도대비 21.2%가 감소하였다. 수확 14일 전에는 6.51–12.86 mg/kg으로 52.6%, 수확 21일 전에는 1.61–3.06 mg/kg으로 87.2%까지 감소하는 경향을 보여 azoxystrobin은 갯기름나물에서 시간의 경과에 따라 잔류농도가 감소하는 것으로 확인되었다. 갯기름나물과 유사한 시금치 작물에서도 azoxystrobin은 초기 잔류량대비 20일이 경과한 후에 약 95.3–97.6%까지 감소되는 비슷한 결과를 확인할 수 있었다(Seo et al. 2010). 이 연구의 감소 결과들을 Lee et al., (2019)의 적용방법으로 계산된 azoxystrobin의 생물학적 반감기는 10.7일이었으며, 시금치의 경우 3.2–3.8일(Seo et al. 2010), 과실인 매실에서는 5.2일 이었고(Lee et al., 2013), 비가림 재배 시 포도에서의 15.5일보다는 생물학적 반감기가 짧은 것을 확인하였다(Lee et al., 2011).
대사체 M700F048과 M700F002은 시험기간동안 MLOQ 이하(<0.01 mg/kg)로 검출되지 않았으며 fluxapyroxad의 잔류농도는 살포 당일 초기 8.13–9.19 mg/kg이었고, 수확 7일 전 살포에서는 3.98–5.39 mg/kg으로 초기 잔류농도대비 48.5%가 감소했으며, 수확 14일 전에는 3.08–3.79 mg/kg으로 61.7%, 수확 21일 전에는 0.59–1.25 mg/kg으로 89.1%까지 감소하였다. Fluxapyroxad의 농도 또한, 앞서의 azoxystrobin과 유사하게 시간의 경과에 따라 지속적으로 감소하는 경향을 보였다. Nam et al. (2019)에서 보고된 배추에서의 fluxapyroxad의 잔류특성을 보면 초기 잔류량대비 14일이 경과한 시료에서 약 91.7%까지 감소되는 결과를 보였고, Noh et al. (2018)에 의한 들깻잎에서 fluxapyroxad는 7일이 경과한 후에 약 50.0%까지 감소되는 것으로 보고되었다. 갯기름나물에서 fluxapyroxad의 생물학적 반감기는 8.2일 이었다.
대사체 753-A-OH은 시험기간동안 검출되지 않았으며(<0.01 mg/kg), PAM은 0.12–0.47 mg/kg이 검출되었다. 대사체 환산잔류량을 적용한 penthiopyrad 잔류농도는 살포 당일 초기 3.09–3.49 mg/kg이었고, 수확 7일 전 살포에서는 2.29–2.91 mg/kg으로 초기 잔류농도대비 23.5%가 감소했으며, 수확 14일 전에는 1.27–1.48 mg/kg으로 59.6% 감소, 수확 21일 전에는 0.39–0.64 mg/kg으로 84.6%까지 감소하였다. 모화합물 penthiopyrad의 잔류량은 약제살포 후 시간이 경과됨에 따라 경시적으로 감소하는 경향을 나타내었다. 이러한 결과들은 소면적 재배작물 녹두 중 penthiopyrad 및 대사산물의 잔류 경향과 유사한 것으로 확인할 수 있었다(Lee et al., 2016). Penthiopyrad의 생물학적 반감기는 10.2일로 시험에 적용된 다른 2종의 농약과 유사한 결과를 보였으며, 시험에 적용된 살균제 3종(azoxystrobin fluxapyroxad, penthiopyrad) 및 대사체의 잔류농도와 반감기는 Table 3에 나타내었다.

Residual concentrations, dissipation patterns, and half-lives of the test pesticides and metabolites
갯기름나물에 적용된 azoxystrobin, fluxapyroxad, penthiopyrad의 감소경향과 반감기는 모두 유사한 결과를 보였지만, 대상 작물에 따라 차이가 보이는 것은 재배의 형태(노지재배, 시설재배 등), 농약의 살포방법, 농산물의 표면적, 표적의 형태 및 생육 특성, 작물의 증량 및 비대에 의한 희석효과, 신진대사에 의한 효소작용 등의 여러 요인으로 인해 잔류특성 및 반감기의 차이가 나타나는 것으로 보인다(Lee et. al., 2003; Lee et al., 2005; Hwang et al., 2012; Han et al., 2013). 본 연구를 통해 갯기름나물 중 흰가루병 방제 살균제 azoxystrobin, fluxapyroxad, penthiopyrad의 소실양상 등 잔류특성은 안전한 농산물의 생산과 농약의 안전사용기준의 설정에 사용될 수 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 공동연구과제사업(Project No. PJ01285607) 지원에 의해 수행되었으며, 감사드립니다.
이해상충관계
저자는 이해 상충관계가 없음을 선언합니다.
References
-
Anastassiades M, Lehotay SJ, štajnbaher D, Schenck FJ, 2003. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce. Journal of AOAC International 86(2):412-431.
[https://doi.org/10.1093/jaoac/86.2.412]

- Chang HS, Bae HR, Son YB, Song IH, Lee CH, et al., 2011. Developing a webbased system for computing pre-harvest residue limits(PHRLs). Agribusiness and Information Management. 3(1):11-37.
-
Cho MH, Lee HS, Im MH, 2021. Studies on the residual properties of pesticides during processing of wheat, corn and cottonseed. Korean J. Food Preserv. 28(5):551-568.
[https://doi.org/10.11002/kjfp.2021.28.5.551]

- Codex Alimentarius Commission, 2010. Guidelines on good laboratory practice in residue analysis. CAC/GL 40-1993, Revision 2003. Amendment 2010
- European Commission Regulation, 2020. Analytical quality control and method validation procedures for pesticide residues analysis in food and feed (Supersedes Document No. SANTE/2017/11813. Implemented by 01/01/2020)
-
Hwang KW, Kim TW, Yoo JH, Park BS, Moon JK, 2012. Dissipation pattern of amisulbrom in cucumber under greenhouse condition for establishing pre-harvest residue limit. Korean J. Pestic. Sci. 16(4):288-293
[https://doi.org/10.7585/kjps.2012.16.4.288]

-
Han YH, Lee CY, Park KD, Park KW, Lee KS, 2013. Residues of new fungicide, isopyrazam on cucumber and oriental melon. Korean J. Pestic. Sci. 17(1):13-19.
[https://doi.org/10.7585/kjps.2013.17.1.13]

- Kim SM, Shin DI, Yoon ST, Song HS, 2007. Distribution Pattern of Peucedanum japonicum Thunb. Community by Ordination Method in Southern Coast of Korea. J. Korean Soc. Int. Agric. 19(4):285-290.
-
Kim HN, Kim SB, Choi E, Woo MJ, Kim JY, et al., 2014. Establishment of Pre-Harvest Limit for Buprofezin and Penthiopyrad during Cultivation of Oriental melon(Cucumis melon var. makuwa). Korean J. Pestic. Sci. 18(3):123-129
[https://doi.org/10.7585/kjps.2014.18.3.123]

- Kim MJ, 2015. Effects of Intake of Peucedanum japonicum Thunb Extract and its Application to the Skin on Changes in Body Composition and Skin Conditions. Ph. D. Thesis. Konkuk University.
-
Kim JH, Kim YJ, Kwon YS, Seo JS, 2016. Development of Multi-residue Analysis of 320 Pesticides in Apple and Rice Using LC-MS/MS and GC-MS/MS. Korean J. Pestic. Sci. 20(2):104-127.
[https://doi.org/10.7585/kjps.2016.20.2.104]

-
Kwon SK, Jeon CW, Kwak YS, 2020. First Report of Wilt Disease on Peucedanum japonicum and Selection of Fungicides. Korean J. Pestic. Sci. 24(1):7-13.
[https://doi.org/10.7585/kjps.2020.24.1.7]

-
Lee YJ, Ko KY, Won DJ, Gil GH, Lee KS, 2003. Residue Patterns of Procymidone, Chlorpyrifos and Cypermethrin in Peaches During Cultivation and Storage Period. Korean J. Environ Agric. 22(3):220-226.
[https://doi.org/10.5338/KJEA.2003.22.3.220]

- Lee MG, Hwang JM, Lee SR, 2005. The usage status of pesticides for vegetables under greenhouse cultivation in the southern area of Korea. Korean J. Pestic. Sci. 9(4):391-400.
- Lee SM, Oh AR, Ahn HS, 2008. Major dietary patterns and their associations with socio-demographic, psychological and physical factors among generally healthy Korean middle-aged women. Korean. J. Community. Nutr. 13(3):439-452.
- Lee CR, Hong JH, Lim JS, Lee KS, 2011. Residual Patterns of Azoxystrobin and Cyenopyrafen in Grape between Rainshield and Plastic House Conditions. Korean J. Pestic. Sci. 15(2):97-103.
-
Lee DY, Kim YJ, Park MH, Lee SH, Kim SG, et al., 2013. Establishment of Pre-Harvest Residue Limit (PHRL) of Fungicides Azoxystrobin and Difenoconazole on Prunus mume fruits. Korean J. Pestic. Sci. 17(4):307-313.
[https://doi.org/10.7585/kjps.2013.17.4.307]

-
Lee JY, Noh HH, Park HK, Kim JC, Jeong HR, et al., 2015. Residual Characteristics and Behavior of Azoxystrobin in Ginseng by Cultivation Conditions. Korean J. Pestic. Sci. 19(1):14-21.
[https://doi.org/10.7585/kjps.2015.19.1.14]

- Lee JH, Lee JH, Kim EH, Shin YH, Lee JH, et al., 2016. 2016 Annual Meeting on The Korean Society of Pesticide Science. Goseong, Korea. 27-28 Oct. p. 141.
- Lee JW, Noh HH, Park HK, Jin MJ, Choi H, et al., 2017. 2017 Annual Meeting on The Korean Society of Environmental Agriculture. Yongpyeong, Korea. 6-7 Jul. p. 116.
-
Leem SB, Kim JY, Hur KJ, Kim HG, Hur JH, 2017. Establishment of Pre-Harvest Residue Limits and Residue Characteristics of Penthiopyrad and Pyriofenone in Cucumber (Cucumis sativus L.) Under Greenhouse Condition. Korean J. Environ Agric. 36(1):43-49.
[https://doi.org/10.5338/KJEA.2017.36.1.07]

-
Lee JH, Jung MW, Lee JH, Lee JH, Shin YH, Kim JH, 2019. Dissipation of the Insrcticide Cyantraniliprole and Its Metabolite IN-J9Z38 in Proso Millet during Cultivation. Sci. Rep. 9(1)
[https://doi.org/10.1038/s41598-019-48206-0]

- MFDS (Ministry of food and drug safety) (2020) Press reference report. https://www.mfds.go.kr>brd>down
- Nam AJ, Lee SH, Kwak SY, Sarker A, Kim HJ, et al., Kim JE, 2019. Simultaneous Determination of Fungicide Fluxapyroxad and Two Metabolites Using the LC-MS/MS in Korean cabbage. Korean J. Pestic. Sci. 2019(10):148-148.
- NAS (National Institute of Agricultural Sciences) (2018) Pesticide Residue Definitions for Agricultural Products.
- NAQS (National Agricultural Products Quality Management Service) (2020) Nonconforming 10 pesticide ingredients. Gimcheon, Korea.
- NCPMS (National crop pest management system) (2021)https://ncpms.rda.go.kr/npms/SicknsInfoDtlR.np?sicknsListNo=D00004262&totalSearchYn=Y
- Noh HH, Lee JW, Cho SH, Leem JB, Shin HG, et al., 2018. 2018 Annual Meeting on The Korean Society of Pesticide Science. Yangyang, Korea. 5-6 Apr. p. 157.
-
Park JS, Yang SH, Choi H, 2017. Residue Patterns and Biological Half-lives of Pyridalyl and Fluopicolide in Watermelon. Korean J. Environ Agric. 36(1):50-56.
[https://doi.org/10.5338/KJEA.2017.36.1.08]

-
Park HK, Noh HH, Lee JY, Jeong HR, Lee JW, et al., 2018. Residual Characteristics of Dimethomorph and Fludioxonil in Water Dropwort and Shallot of Minor Crop. Korean J. Pestic. Sci. 22(3):192-198.
[https://doi.org/10.7585/kjps.2018.22.3.192]

- Seo JM, Ha DR, Lee HH, Oh MS, Park JJ, et al., 2010. The Degradation Patterns of Two Pesticides in Spinach by Cultivation, Storage and Washing. J. Food Hyg. Saf. 25(2):91-99.
- Turner JA, 2018. The Pesticide Manual. Eighteenth Edition. British Crop Production Council (BCPC).
Yeong-Jin Kim, Environmental Safety-Assessment Center Gyeongnam Branch Institute, Korea Institute of Toxicology, Researcher, https://orcid.org/0000-0002-3926-9387
Jong-Wook Song, Environmental Safety-Assessment Center Gyeongnam Branch Institute, Korea Institute of Toxicology, Researcher, https://orcid.org/0000-0001-7958-5889
Sung-Gil Choi, Environmental Safety-Assessment Center Gyeongnam Branch Institute, Korea Institute of Toxicology, Researcher, https://orcid.org/0000-0002-8445-3108
Jong-Hwan Kim, Environmental Safety-Assessment Center Gyeongnam Branch Institute, Korea Institute of Toxicology, Senior researcher, https://orcid.org/0000-0003-4966-154X