
청양 지역 고추와 구기자에서 분리한 탄저병균의 기주 교차 감염과 유전적 다양성
초록
탄저병이 발생한 구기자와 고추에서 단포자 분리하여 얻은 34균주와 11균주를 사용하여, 구기자와 고추 열매에 대한 병원성 실험과 병원균의 유전적 다양성을 조사하였다. 구기자에서 분리한 34개 균주 중에서 14균주는 C. gloeosporioides로, 20균주는 C. acutatum으로 동정되었으며, 고추에서 분리한 11균주는 모두 C. acutatum으로 동정되었다. 구기자에서 분리한 C. gloeosporioides와 C. acutatum 균주를 구기자 열매에 상처 또는 무상처 접종하였을때, 모든 균주가 병원성을 나타내었지만, 고추 열매에 접종하였을 때는 병원성이 나타나지 않거나, 아주 약한 병원성을 나타내었다. 하지만 고추에서 분리한 C. acutatum 균주는 상처 접종 시 고추와 구기자 열매 모두에서 강한 병원성을 보였다. 하지만 구기자 열매에 무상처 접종하였을 때에는 대부분의 균주가 병원성을 나타내지 않았다. PCR-RAPD법으로 병원균 집단의 유전적 다양성을 분석한 결과, 구기자와 고추에서 분리된 C. acutatum은 서로 다른 그룹으로 구분되었다.
Abstract
Using 45 isolates obtained by a single spore isolation from diseased boxthorn and red pepper, the pathogenicity and genetic diversity of them were investigated. Of the 34 isolates obtained from boxthorn, 14 isolates were identified as C. gloeosporioides, 20 isolates were identified as C. acutatum, and all 11 isolates obtained from red pepper were identified as C. acutatum. When the C. gloeosporioides and C. acutatum isolates from boxthorn were inoculated to the fruits of boxthorn by the wound or non-wound inoculation method, all the isolates showed a strong pathogenicity. However, when inoculated to red pepper fruit, almost of them did not show the pathogenicity or a few isolates showed very weak pathogenicity. The C. acutatum isolate obtained from red pepper showed strong pathogenicity in both the red pepper and the boxthorn fruit by the wound inoculation, but most isolates did not show pathogenicity on boxthorn fruits when inoculated by the non-wound inoculation. As a result of analyzing the genetic diversity of the pathogen population by the PCR-RAPD method, C. acutatum isolates obtained from boxthorn and red pepper, respectively, were divided into different groups.
Keywords:
Colletotrichum acutatum, Boxthorn anthracnose, Pepper anthracnose, Pathogenicity, Genetic diversity키워드:
구기자 탄저병, 고추 탄저병, 병원성, 유전적 다양성서 론
Colletotrichum 속은 주로 열대, 아열대와 온대 지역에서 곡류, 두류, 채소류, 과수 등 넓은 기주에 침입하여 탄저병을 일으키며, 약 900여 종이 존재할 것이라고 알려져 있다(Freeman et al., 1996). 특히 C. acutatum은 아보카도, 아몬드, 딸기, 사과, 복숭아 등 다양한 과실류를 침입한다(Adaskaveg and Hartin, 1997; Bernstein et al., 1995). 국내에서도 고추, 구기자, 사과, 복숭아, 감 등 다양한 작물의 열매에 탄저병이 발생하기 때문에, 직접적인 수량의 감소와 품질의 저하로 이어진다. 이런 탄저병균은 한 종류의 기주 식물을 서로 다른 Colletotrichum 종이 침입하거나, Colletotrichum의 한 종이 여러 기주 식물을 침입하기도 한다. C. acutatum은 미국 캘리포니아에서 아몬드와 복숭아를 침입하여 탄저병을 일으키고(Adaskaveg and Hartin, 1997), 감귤류 탄저병에는 서로 다른 4종의 Colletotrichum이 관여한다(Zulfiqar et al., 1996).
구기자 탄저병 역시 C. gloeosporioides와 C. dematium 등이 일으키는데, C. gloeosporioides가 C. dematium보다 발생빈도가 많고 병원성도 강한 것으로 보고되어 있었다(Lee et al., 1986). 하지만 Lee (2003)는 구기자 탄저병 병반에서 분리한 Colletotrichum spp. 균주의 형태적, 배양적, 분자생물학적 특징을 조사하여 동정한 결과, 우점종이 C. acutatum으로 변화되었음을 보고하였다. 구기자와 동일한 가지과에 속하는 고추 역시 탄저병에 대한 피해가 심한 작물로서, 탄저병을 일으키는 병원균으로 C. gloeosporioides, C. dematium, C. coccodes, C. acutatum, Glomerella cingulata 등 5종이 보고되어 있었으나(Park and Kim, 1992), 2000년 이후 포장의 우점종이 C. gloeosporioides에서 C. acutatum으로 변화하였다(Kim et al., 2008). C. acutatum은 유전적인 다양성이 매우 큰 병원균이다(Talhinhas et al., 2002; Johnson and Jones, 1997; Lardner et al., 1999; Sreenivasaprasad and Talhinhas, 2005). Johnson and Jones (1997)는 C. acutatum을 형태적 특징 및 28S nuclear ribosomal large subunit rRNA (LSU)의 분석으로 A형부터 C형까지, 그리고 Glomerella myabeana 등 4가지 그룹으로 분류하였다. Lardner et al. (1999)은 C. acutatum을 Random Amplified Polymorphic DNA (RAPD) PCR 결과와 형태적, 생리적 특징의 결과를 조합하여 7개의 그룹으로 구분하였고, Sreenivasaprasad와 Talhinhas (2005)는 rDNA-ITS 영역과 β-tubulin (tub2) 유전자를 분석하여 A1부터 A8까지 구분하였다.
병원균의 유전적 다양성은 동일한 지역에서 재배하는 여러 종류의 작물에 대한 병원성의 변화를 가져올 수 있을 뿐만 아니라, 탄저병 방제에 사용하는 살균제 선택에도 새로운 변화를 가져올 수 있기 때문에, 병원균 집단에 대한 정확한 동정과 더불어 집단의 유전적 다양성 분석이 필요하다.
본 연구에서는 청양 지역의 구기자와 고추에서 분리한 탄저병균의 기주 교차 감염 여부를 조사하고, 구기자와 고추의 열매 표면에서 병원균의 침입 구조가 만들어지는 과정을 조사하였다. 또한 RAPD 분석을 통하여 구기자와 고추에서 분리한 탄저병균의 유전적 다양성을 조사하였다.
재료 및 방법
병원균의 채집 및 분리
2011년 8월에 충청남도 청양군의 구기자와 고추 포장에서 탄저병의 전형적인 병반을 보이는 구기자와 고추의 열매를 채집하여, 포자가 형성된 조직을 적당한 크기(5×5 mm)로 잘라 멸균수에 넣고 교반하였다. 포자현탁액은 streptomycin이 300 μg/mL 첨가되어 있는 멸균수에 희석하여 PDA (potato starch; 4.0 g, dextrose; 20 g, agar; 15 g, 증류수; 1 L, DifcoTM) 배지에 약 100-300개가 접종되도록 도말하였다. PDA 배지는 25oC에서 배양하면서 생장하는 단균총을 분리하여 300 μg/mL의 streptomycin이 첨가된 PDA 배지에 접종하여 순수배양체를 확보하였다. 분리한 병원균 균주는 새로운 PDA에 옮겨서 25oC 항온기에서 10일간 배양하고 균총의 균사 선단부에서 지름 5mm의 균사 조각을 떼어내어 PDA 사면 배지에 접종하여 4oC에서 보관하면서 실험에 사용하였으며, 장기 저장을 위하여 균총 선단에서 떼어낸 균사조 각(직경; 5 mm)을 20% glycerol 용액이 들어있는 CryotubeTM vial (직경; 12 mm, 높이; 48 mm, Nunc Co. Ltd)에 5조각씩 넣어 -70oC에 보관하였다.
고추와 구기자에 대한 병원성 조사
고추와 구기자탄저병균의 분생포자 현탁액(포자 밀도; 1×106 개/mL)을 준비하여 접종원으로 사용하였다. 고추(품종; 녹광)와 구기자(품종; 청양 재래종) 열매는 1% NaClO 용액을 사용하여 표면을 세척하고 멸균 증류수로 씻은 후, 실험실 내에서 풍건하고, 병원균을 상처와 무상처 접종 하였다. 상처 접종의 경우 열매 표면에 혈당측정계(ACCU-CHEK, softclix®)를 이용하여 상처 내고 상처 부위에 포자 현탁액을 떨어뜨렸으며, 무상처 접종은 상처를 유발하지 않은 열매의 표면에 동일한 포자 현탁액을 떨어뜨려 접종하였는데, 두 가지 접종법 모두 접종하는 포자 현탁액의 양은 3 μL로 동일하게 조절하였다. 접종한 고추와 구기자 열매는 플라스틱 용기에 넣고, 7일간 습실 상태로 25oC에서 보관한 다음, 뚜껑을 열고 3일간 더 보관하며 발병을 유도하였다. 모든 처리는 3반복으로 실시하였다. 병 발생 정도는 열매 표면적에 대한 병반 면적의 비율을 발병 지수로 조사하였다. 분석은 SAS ver. 9.3 (SAS Institute Inc., Cary, NC, USA) 통계프로그램을 사용하여 Duncan’s multiple range test로 통계처리를 하였다. 각 균주의 병원성 정도는 무발병 시 -, 25% 이하일 경우 +, 25-50%일 경우 ++, 50% 이상일 경우 +++으로 표시하였다.
고추 열매 표면에서 탄저병균 분생 포자의 발아와 부착기 형성 조사
구기자에서 분리한 C. acutatum과 C. gloeosporioides에서 각각 5개의 균주를 그리고 청양지역의 고추에서 분리한 4개의 C. acutatum 균주 및 충북 진천의 고추에서 분리한 C. acutatum JC24 균주를 사용하여 고추 열매 표면에서 포자 발아와 부착기 형성을 조사하였다. 모든 균주는 PDA배지에서 배양한 균총으로부터 분생포자를 수확하여, 포자 밀도를 1×106 개/mL로 조절한 포자현탁액을 준비하였다. 모든 균주의 포자 현탁액은 고추 열매에 무상처 분무 접종하였고, 접종한 열매는 플라스틱 상자에 넣어 3일간 습실처리 하였다. 습실처리를 위해서 플라스틱 상자에 2겹의 종이 타올을 깔고 100mL의 증류수를 부은 후, 뚜껑을 덮어 상자 안의 습도가 100%로 유지될 수 있도록 관리하였다. 습실처리 후, 열매 표면에서 분생포자의 발아율과 부착기 형성율을 조사하기 위해서, 투명한 테이프를 이용하여 고추 열매표면에 붙어있는 포자를 떼어내어 현미경으로 관찰하였다. 모든 처리는 3반복으로 실험하였으며, 각 반복당 100개의 포자를 조사하였다. 통계분석은 SAS ver. 9.3 (SAS Institute Inc., Cary, NC, USA) 통계프로그램을 사용하여 Duncan's multiple range test로 통계처리를 하였다.
병원균의 gDNA 분리
병원균을 25oC의 PDA 배지에서 1주일간 배양한 후, 공중균사를 긁어 수확하였으며, -70oC에서 12시간 동안 동결건조한 후, 유리봉으로 마쇄하였다. 마쇄한 균사체에 0.5% SDS-CTAB (2.5 M NaCl, 0.25 M EDTA (pH8.0), 0.5 M Tris-HCl (pH7.5), 1% polyvinylpyrrolidone-10, 1% hexadecyl trimethyl ammonium bromide, 0.5% sodium dodesyl sulfate)를 1.5mL씩 첨가하여 65oC에서 1시간 동안 반응시켰다. 반응액은 12,000 g에서 10분간 원심분리한 후, 상징액에 500 μL의 phenol을 처리하여 교반하고 12,000 g에서 10분간 원심분리를 하였다. 다시 상징액에 500 μL의 phenol을 처리하고 동일한 과정을 1회 더 반복하였다. 상징액에 동량의 chloroform을 처리하고 12,000 g에서 원심분리한 후, 4oC에서 상징액에 70% ethanol을 500 μL 첨가하였다. 상징액에 형성된 침전물을 세척한 후 ethanol을 충분히 건조시키고, 멸균수에 용해시켜 -20oC에서 보관하며 실험에 사용하였다.
Random Amplified Polymorphic DNA (RAPD) 분석
RAPD법을 위한 primer는 OPC-5 (5’-GAT GAC CGC C-3’)를 사용하였다. DNA 2 μL에 10X KAPA Taq buffer with dye 3 μL, dNTP 3 μL, OPC-5 primer (10 pmoles/μL) 3 μL, Taq polymerase (5 units/μL, KAPA BIOSYSTEMS) 0.12 μL, 100X BSA (10 mg/mL) 0.12 μL, 멸균수 19 μL를 첨가하여, 5분간 94oC에서 pre-denaturation 수행 후, 94oC에서 30초간 denaturation, 35oC에서 1분간 annealing, 72oC에서 2분간의 extension을 38회 반복한 후 72oC에서 7분 동안 반응시켰다. RAPD-PCR은 3회 실시하여 분석하였다. 각 균주의 primer에 의한 증폭 pattern의 비교는 동일한 크기의 band 존재 여부로 행하였고, 같은 크기의 band는 동일한 것으로 취급하였다. 균주간의 유사도(similarity coefficient)는 다음의 공식으로 계산하였다.
F = 2NXY / (NX + NY)
F: Similarity coefficient.
NXY: The number of PCR products shared by isolates X and Y.
NX + NY: Total number of PCR products in isolates X and Y, respectively.
Dendrogram은 위의 유사도 값을 근거로 UPGMA (Unweighted Paired Group Methods with Arithmetic Average) 법으로 작성하였으며 유사도와 dendrogram의 작성은 Gelcompa II program Ver. 4.5를 이용하였다.
결과 및 고찰
병원균 확보
Table 1에서 보는 것과 같이 청양군의 운곡면, 비봉면, 청양읍, 그리고 청남면의 구기자와 고추를 각각 재배하는 근접한 포장에서 병든 열매를 채집하였다. 단포자 분리를 통하여 구기자에서 34균주, 고추에서 11균주를 분리하여 총 45개 균주를 분리하였다.
ITS 유전자의 염기서열을 분석한 결과, 구기자에서 분리한 34개 균주 중에서 14균주는 C. gloeosporioides, 20균주는 C. acutatum으로 동정되었으며, 특이하게도 C. gloeosporioides 균주는 운곡면에 위치한 구기자시험장에서만 분리되었다. 고추에서 분리한 11개의 균주는 모두 C. acutatum으로 동정되었다. 이런 결과는 Lee (2003)와 Kim et al. (2008)의 결과와 같이 구기자와 고추의 주된 병원균은 C. acutatum임을 보여주었다.
고추와 구기자 열매에서 분리한 탄저병균의 병원성
Fig. 1에서 보는 것과 같이 구기자에서 분리한 C. gloeosporioides 10CMCT14와 C. acutatum 10CMCC3의 병원성 반응과 고추에서 분리한 C. acutatum 10PPCCN3의 반응에는 확연한 차이가 있었다. 구기자에서 분리한 C. gloeosporioides 10CMCT14와 C. acutatum 10CMCC3은 구기자 열매에서 상처와 무상처 접종을 하였을 경우, 모두 탄저병이 발생하였다. 하지만 고추 열매에 상처와 무상처 접종하였을 경우, 전혀 병이 발생하지 않았다. 고추에서 분리한 C. acutatum 10PPCCN3을 고추 열매에 상처와 무상처 접종한 경우, 전형적인 탄저병의 병반이 나타났을 뿐만 아니라, 구기자 열매에 상처 접종하였을 때에도 구기자에서 분리한 균주를 접종하였을 때와 동일한 병반을 형성하였다. 하지만 구기자 열매에 무상처 접종하였을 때에는 병이 발생하지 않았다.
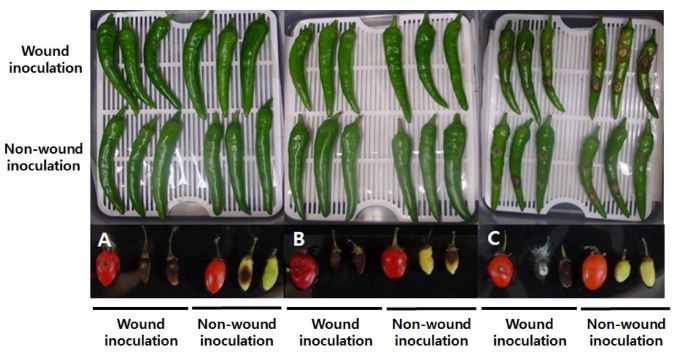
Pathogenicity of Colletotrichum gloeosporioides 10CMCT-14 (A), C. acutatum 10CMCC3 (B) and C. acutatum 10PPCCN3 (C) on fruits of pepper and boxthorn. Each isolate was inoculated with conidial suspension adjusted to 1 × 106 conidia/ml by wound or non-wound inoculation. Conidial suspension was dropped on the surface of fruit, such as pepper and boxthorn, with a wound or not. In order to induce anthracnose disease, fruits inoculated with conidial suspension of each isolate were kept in a humidity chamber for 7 days, subsequently keeping them in plastic box removing the lid for 3 days. C. gloeosporioides 10CMCT-14 and C. acutatum 10CMCC3 were isolated from boxthorn, while C. acutatum 10PPCCN3 was isolated from pepper.
Table 2에서 보는 것과 같이, 고추 분리 균주를 고추 열매에 상처 접종하였을 때, 모든 균주들이 탄저병을 일으켰으며, 무상처 접종을 하였을 때에는 10PPCU1, 10PPCU2, 10PPCB2 균주를 제외한 나머지 균주에서 전형적인 탄저병이 발생하였다. 구기자 열매에서는 상처 접종을 하였을 때 강한 병원성을 나타내었지만, 무상처 접종에서는 10PPCU1, 10PPCCN1, 10PPCCN2, 10PPCCN3 균주만 미미한 발병이 확인되었다. 구기자에서 분리한 C. gloeosporioides 14개 균주와 C. acutatum 20개 균주는 구기자 열매에 상처 접종하였을 때 강한 병원성을 보였고, 무상처 접종을 하였을 때는 상처 접종에 비하여 병원성이 다소 감소하였다. 하지만 고추 열매에서는 상처와 무상처 접종 모두에서 병원성이 없거나 매우 미미한 정도이었다.

Pathogenecity of each isolate of Colletotrichum gloeosporioides and C. acutatum on fruits of pepper and boxthorn
탄저병균의 기주 범위는 넓은 것으로 알려져 있다. 그러다 보니 동일 지역에서 재배하는 서로 다른 작물에 탄저병이 동시에 발생하는 경우가 있다. 따라서 작물에 대한 방제 전략을 수립하기 위해서 각 작물을 침입하는 탄저병균의 정확한 동정뿐만 아니라, 각 작물에 대한 교차 감염 여부 등이 규명되어야 한다. 실제로 여러 작물에서 탄저병균의 교차감염이 보고되어 있다. C. gloeosporioides와 C. acutatum은 아몬드, 사과, 망고, 아보카도를 침입하는데, 병든 열매의 조직에서 분리한 C. gloeosporioides와 C. acutatum 균주를 아몬드, 사과, 망고, 아보카도, 복숭아 등의 열매에 각각 접종하였을 때, 포장에서와 같은 병이 발생하였다(Freeman and Shabi, 1996). Peres 등(2002)은 딸기에서 분리한 C. acutatum을 아보카토, 구아바, 파파야, 망고 등의 열매에 상처 접종하여 병이 발생하는 것을 확인하였지만, 바나나에서는 병이 발생하지 않았다. 딸기에서 분리한 C. acutatum은 배, 복숭아, 사과 등에 상처와 무상처 접종하였을 때에도 병이 발생하였다(Freeman et al., 2001). 이처럼 C. gloeosporioides와 C. acutatum과 같이 넓은 기주 범위를 갖는 식물병원균은 다양한 작물을 교차 감염하여 병을 일으킨다. 경북 상주에서는 감 재배 과수원에서 고추를 혼작하는 경우가 있는데, 감과 고추에서 모두 탄저병이 발생한다. 감과 고추를 혼작하는 과원과 감만을 재배하는 과원에서 병든 감과 고추를 채집하여 분리한 탄저병균을 동정한 결과, 감에서는 C. gloeosporioides s. lat.가 고추에서는 C. acutatum s. lat.이 분리되었다(Kim et al., 2009). 각각의 균주로 감과 고추에 접종한 결과, 감에서 분리한 C. gloeosporioides s. lat. 균주중 2균주를 제외한 모든 균주가 감에서 병원성을 보인 반면에, 고추에는 혼작 지역에서 분리한 44개 균주 중에서는 6개만, 단작 지역에서 분리한 45개 균주 중에서는 4개만이 병원성을 나타내고 나머지 균주는 전혀 병을 일으키지 못하였다. 그런데 혼작 지역의 고추에서 분리한 C. acutatum s. lat.는 고추와 감 모두에서 병원성을 보였다. 본 연구에서도 구기자에서 분리한 C. gloeosporioides와 C. acutatum은 구기자에서만 병원성을 보였을 뿐, 고추에는 병원성이 없거나 매우 미미하였다. 반면에 고추에서 분리한 C. acutatum은 고추와 구기자 모두에 대해서 병원성을 보였다. 구기자와 고추 모두에서 C. acutatum이 분리되었지만, 기주 식물에 대한 병원성에는 차이가 있었다.
고추 열매 표면에서 탄저병균의 포자 발아와 부착기 형성
청양 지역의 고추에서 분리한 C. acutatum 10PPCC1, 10PPCU2, 10PPCCN1, 10PPCB3은 고추 열매 표면에서 각각 72, 56, 54, 46%의 포자 발아율과 45, 14, 21, 35%의 부착기 형성률을 보여, 68%와 26%의 포자 발아율과 부착기 형성률을 보인 C. acutatum JC24와 유의성 있는 차이가 없었다(Fig. 2와 3). 그런데 구기자에서 분리한 C. acutatum과 C. gloeosporioides의 균주는 고추 열매에서 전혀 병이 발생하지 않았음에도 불구하고, 고추 열매의 표면에서 각각 13-86%와 16-89%의 포자 발아율과, 5-69%와 34-75%의 부착기 형성률을 보였다. 탄저병균의 포자는 구기자나 고추의 열매에 부착한 후, 발아와 부착기 형성 과정을 거쳐 침입하고, 병을 일으킨다(Wharton and Diéguez-Uribeondo, 2004). 그런데 고추 열매에 대한 병원성이 없거나 매우 낮았던 구기자탄저병균이 고추 열매 표면에서 포자 발아와 부착기 형성이 정상적으로 일어나는 것을 보면, 포자 발아와 부착기 형성과 같은 기주식물 표면에서 발생하는 병원균의 침입 과정이 병 발생과 직접적인 관련성이 없는 경우도 있음을 보여주고 있다.
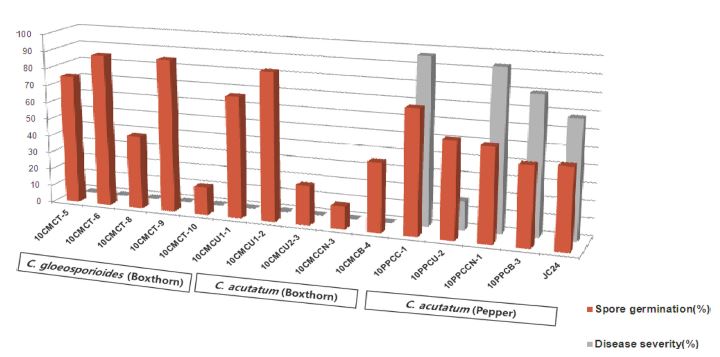
Spore germination and disease severity (%) of Colletotrichum acutatum and C. gloeosporioides isolates collected from boxthorn, C. acutatum isolates from pepper. Spore germination on the surface of pepper fruit was observed under a light microscope. Disease severity of all isolates of Colletotrichum spp. was investigated on pepper fruits.
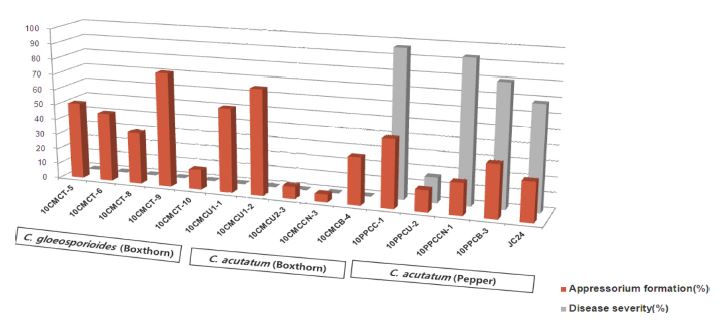
Appressorium formation and disease severity (%) of Colletotrichum acutatum and C. gloeosporioides isolates collected from boxthorn, C. acutatum isolates from pepper. Appressorium formation on the surface of pepper fruit was observed under a light microscope. Disease severity of all isolates of Colletotrichum spp. was investigated on pepper fruits.
RAPD-PCR에 의한 탄저병균의 유전적 다양성
단일 프라이머 OPC-5 primer를 사용하여 RAPD를 수행한 결과, 0.6-2.0 kb 사이에 존재하는 밴드들을 얻을 수 있었고, 47개 균주는 구기자에서 분리한 C. gloeosporioides와 C. acutatum, 그리고 고추에서 분리한 C. acutatum 등 총 3개의 그룹으로 구분하였다(Fig. 4). RAPD-PCR법의 결과는 구기자와 고추에 대한 병원성 실험 결과와도 부합하였는데, 고추에서 분리한 C. acutatum은 고추와 구기자에 대해서 병원성을 보인 반면에, 구기자에서 분리한 C. acutatum은 구기자에서만 병원성이 나타나고, 고추에서는 병원성이 없거나 매우 미미하였다.

Dendrogram of 45 Colletotrichum spp. isolates from infected fruits of boxthorn and pepper constructed from the RAPD similarity matrix obtained by the similarity coefficient, using the Unweighted Pair Group Method with Arithmetic Averages (UPGMA).
Kim et al. (2015)은 본 실험에서 사용한 C. acutatum을 ITS 염기서열을 분석하여, 구기자의 C. acutatum을 A1과 A3 그룹으로, 고추의 C. acutatum을 A2 그룹으로 구분하고, 살균제인 carbendazim에 대한 반응을 조사하였다. A2 그룹에 속하는 고추에서 분리한 C. acutatum 균주의 carbendazim에 대한 EC50값의 범위는 0.21-1.39 μg/ml이었으며, 저항성 요인값은 6.6이었다. 이에 비해서 A1 그룹에 속하는 구기자에서 분리한 C. acutatum 균주의 EC50값의 범위는 0.01-1.75 μg/ml이었고, A3 그룹에 속하는 균주는 0.01-1.85 μg/ml이었다. 그런데 A1과 A3 그룹의 저항성 요인값을 계산하면 각각 175와 185로, A2 그룹의 저항성 요인값보다 26.5배와 28.0배 더 큰 것으로 나타났다. 이는 구기자의 C. acutatum 집단이 고추의 집단과 비교하여 carbendazim에 대한 반응의 다양성이 크다는 것을 보여주고 있다. 이처럼 C. acutatum 복합종은 유전적인 다양성으로 구분한 종간에 기주식물에 대한 병원성과 carbendazim과 같은 살균제에 반응 등이 다를 수 있음을 보여주고 있어서, C. acutatum 복합종을 더 세부적으로 동정할 필요성이 대두된다.
최근에는 탄저병균의 재동정을 위해서 다중 유전자 염기서열 분석법이 사용된다. Damn et al. (2012)은 C. acutatum 복합종을 ITS, GAPDH, CHS-1, HIS3, ACT, TUB2 등 6개 유전자의 염기서열을 가지고 분석하여, 이전에 인정되지 않았던 21종을 포함한 31개 종으로 재분류하였다. 중국 남부지역의 망고에서 발생하는 탄저병의 병원균으로 C. asianum, C. fructicola, C. scovillei, C. siamense 등이 보고되어 있었는데, ACT, CHS-1, GAPDH, ITS 영역, TUB2 유전자의 염기서열을 분석하여, C. asianum, C. cliviicola, C. cordylinicola, C. endophytica, C. fructicola, C. gigasporum, C. gloeosporioides, C. karstii, C. liaoningense, C. musae, C. scovillei, C. siamense, C. tropicale 등 13종으로 세분화되었으며, 이 모든 종은 망고의 잎과 열매 모두에 병원성을 나타내었다(Li et al., 2019). 이처럼 복합종인 C. acutatum의 분류를 다중 유전자 염기서열 분석법을 사용하면서 여러 가지의 종으로 나누어지거나, 새로운 종이 포함되기도 한다. 따라서 국내에서 발생하는 탄저병의 병원균에 대해서도 다중유전자 염기서열 분석법을 이용한 재동정과, 재분류된 종의 병원성 및 생리적인 특성에 대한 연구가 진행되어야 할 것으로 생각한다.
Acknowledgments
이 논문은 과학기술정보통신부의 재원으로 한국연구재단 국가생명연구자원 선진화사업의 지원을 받아 수행된 연구입니다(No. 320042-5).
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Adaskaveg JE, Hartin RJ, 1997. Characterization of Colletotrichum acutatum isolates causing anthracnose of almond and peach in California. Phytopathology 87(9):979-987.
[https://doi.org/10.1094/PHYTO.1997.87.9.979]

-
Bernstein B, Zehr EI, Dean RA, 1995. Characteristics of Colletotrichum from peach, apple, pecan, and other hosts. Plant Dis. 79(5):478-482.
[https://doi.org/10.1094/PD-79-0478]

-
Damm U, Cannon PF, Woudenberg JHC, Crous PW, 2012. The Colletotrichum acutatum species complex. Studies in Mycol. 73:37-113.
[https://doi.org/10.3114/sim0010]

-
Freeman S, Katan T, Shabi E, 1996. Characterization of Colletotrichum gloeosporioides isolates from avocado and almond fruits with molecular and pathogenicity tests. Appl. Environ. Microbiol. 62:1014-1020.
[https://doi.org/10.1128/aem.62.3.1014-1020.1996]

-
Freeman S, Shabi E, 1996. Cross-infection of subtropical and temperate fruits by Colletotrichum species from various hosts. Physiol. Mol. Plant Pathol. 49(6):395-404.
[https://doi.org/10.1006/pmpp.1996.0062]

-
Johnston PR, Jones D, 1997. Relationships among Colletotrichum isolates from fruit-rots assessed using rDNA sequences. Mycologia 89:420-430.
[https://doi.org/10.1080/00275514.1997.12026801]

-
Li Q, Bu J, Shu J, Yu Z, Tang L, et al., 2019. Colletotrichum species associated with mango in southern China. Scientific Reports 9:18891.
[https://doi.org/10.1038/s41598-019-54809-4]

-
Kim G, Kim J, Kim HT, 2015. Identification, mycological characteristics and response to fungicides of anthracnose pathogen isolated from pepper and boxthorn in Cheongyang. Korean J. Pestic. Sci. 19(3):335-344. (In Korean)
[https://doi.org/10.7585/kjps.2015.19.3.335]

-
Kim HR, Lim TH, Kim JH, Kim YH, Kim HT, 2009. Potential of cross-infection of Colletotrichum species causing anthracnose in persimmon and pepper. Plant Pathol. J. 25(1):13-20.
[https://doi.org/10.5423/PPJ.2009.25.1.013]

-
Kim JT, Park SY, Choi WB, Lee YH, Kim HT, 2008. Characterization of Colletotrichum Isolates causing anthracnose of pepper in Korea. Plant Pathol. J. 24(1):17-23
[https://doi.org/10.5423/PPJ.2008.24.1.017]

-
Lardner R, Johnston PR, Plummer KM, Pearson MN, 1999. Morphological and molecular analysis of Colletotrichum acutatum sensu lato. Mycol. Res. 103(3):275-285.
[https://doi.org/10.1017/S0953756298007023]

- Lee BH, 2003. Morphology, pathogenicity and molecular phylogenetic analysis of Colletotrichum spp. associated with anthracnose of Chinese matrimony (Lycium chinense Mill.). MS degree. Chungnam National Univ. Daejeon. Korea.
- Lee JH, Yu SH, Back MK, Kim KS, 1986. Two species of Colletotrichum associated with anthracnose of Lycium chinense. Korean J. Plant Pathol. 2(1):31-36.
- Park KS, Kim CH, 1992. Identification, distribution and etiological characteristics of anthracnose fungi of red pepper in Korea. Korean J. Plant Pathol. 8(1):61-69. (In Korean)
-
Sreenivasaprasad S, Talhinhas P, 2005. Genotypic and phenotypic diversity in Colletotrichum acutatum, a cosmopolitan pathogen causing anthracnose on a wide range of hosts. Mol. Plant Pathol. 6(4):361-378.
[https://doi.org/10.1111/j.1364-3703.2005.00291.x]

-
Talhinhas P, Sreenivasaprasad S, Neves-Martins J, Oliveira H 2002. Genetic and morphological characterization of Colletotrichum acutatum causing anthracnose of lupin. Phytopathology 92(9):986-996.
[https://doi.org/10.1094/PHYTO.2002.92.9.986]

-
Wharton PS, Diéguez-Uribeondo J, 2004. The biology of Colletotrichum acutatum. Anales del Jardín Botánico de Madrid 61(1):3-22.
[https://doi.org/10.3989/ajbm.2004.v61.i1.61]

-
Zulfiqar M, Brlansky RH, Timmer LW, 1996. Infection of flower and vegetative tissues of citrus by Colletotrichum acutatum and C. gloeosporioides. Mycologia 88:121-128.
[https://doi.org/10.1080/00275514.1996.12026631]

Heung Tae Kim, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, Professor, https://orcid.org/0000-0001-7132-0587
Dalha Abdulkadir Isa, Department of Plant Medicine, College of Agriculture, Life and Environment Science, Chungbuk National University, PhD. student
Gahye Kim, Jungbu Regional Office, Animal and Plnat Quarantine Agency, Quarantine officer
Seungwan Son, Goji Berry Research Institute, Chungnam Agricultural Research and Extension Services, Cheongyang-gun, Researcher
Establishment of experimental plan and methodology proposal, Heung Tae Kim
Experimental participation, Dalha Abdulkadir Isa, Gahye Kim, and Seungwan Son
Writing, Heung Tae Kim, Dalha Abdulkadir Isa, and Gaye Kim
