
Stemphylium vesicarium에 의한 양파 잎마름병 생물검정법 개발
초록
Stemphylium vesicarium에 의한 잎마름병은 Allium 속에서 발생하는 중요한 곰팡이병으로, 양파의 품질을 저하시키고 생산량을 감소하는 등 큰 피해를 주고 있다. 본 연구는 양파 잎마름병에 대한 효과적인 유묘 검정법 확립에 앞서, 접종원인 S. vesicarium의 포자 대량생산과 양파 잎마름병 발생 실험 최적 조건을 확립하기 위한 것이다. 상처 및 광 조사 유무 그리고 배지 종류에 따른 S. vesicarium의 포자 생산량을 조사한 결과, S. vesicarium 균주의 포자 형성을 위해서는 rice bran agar 배지에 접종하고 25oC에서 배양한 후, 멸균한 붓으로 균총을 긁어내고 항온항습실(온도 25oC, 상대습도 80%)에서 하루 12시간씩 48시간 동안 광을 조사하는 것이 효과적이었다. 또한 양파의 잎마름병 발생 조건 확립을 위해 발육 시기, 접종 농도, 포자현탁액 내 영양원 그리고 접종 후 배양 시간 등은 다음과 같은 실험과정이 적합하였다. 먼저, 원예용상토에 파종 후 약 100일이 지난 4엽기 양파에 비흡수성 재질로 구성된 솜으로 문지른 후에 1/2 potato dextrose broth (1/2 PDB) 용액내 포자현탁액(1.0 × 10⁵ spores/mL)을 분무하여 접종한다. 그 다음, 대상 식물체를 20oC 습실상에 48시간 동안 처리하고, 항온항습실(온도 25oC, 상대습도 80%)로 옮겨서 하루에 12시간씩 광을 조사한다. 마지막으로 접종 7일 후에 잎에 발생한 잎마름병의 병반면적율(%)을 산출한다. 이와 같이 확립한 양파 잎마름병 실험은 약제의 in vivo 살균 활성 검정 및 병저항성 검정에 유용하게 사용될 것으로 생각된다.
Abstract
Leaf blight caused by Stemphylium vesicarium has become an important fungal disease of Allium genus, which leads to decrease quality and seed production of onion. To establish in vivo bioassay methods on leaf blight of onion (A. cepa) by S. vesicarium, we conducted to determine optimum conditions for spore production of S. vesicarium and development of leaf blight on onion plants by the fungus. From the results of spore production of S. vesicarium according to wound, light, and medium, we suggest a method to produce spores of S. vesicarium that the fungus are grown on rice bran agar medium at 25oC. And fungal masses are scratched with a brush and then the plate is incubated for 48 hours in a growth chamber at 25oC and 80% RH under 12-hour light per day. In addition, development of leaf blight on onion plants caused by S. vesicarium according to growth stage of plants, inoculum concentration, nutrient source added in spore suspension, and incubation conditions was tested. To efficiently develop leaf blight on onion seedlings, seeds have to be sow on horticultural soil and cultivate up to four-leaf stage in a greenhouse (25 ± 5oC). Seedlings are rubbed with bleached, nonabsorbent cotton and inoculated with spore suspension (1.0 × 10⁵ spores/mL) made of 1/2 potato dextrose broth, by spray method. The inoculated plants are incubated in a dew chamber at 20oC for 48 hours, and then the infected seedlings are cultured in a growth chamber at 25oC and 80% RH with 12-hour light per day. Infected leaf area (%) is measured 7 days after inoculation. The established method is considered to be useful for in vivo antifungal activity assay and disease resistance assay.
Keywords:
Disease development, Environmental condition, Screening, Spore production, Virulence키워드:
병 발생, 환경 조건, 스크리닝, 포자 생산, 병원력서 론
백합과 파속(Allium spp.)에 속하는 양파(Allium cepa L.)는 세계적으로 많이 생산되는 경제 작물로 2018년 기준으로 세계 연간 생산량이 96,773,819톤에 이른다(FAO, 2020). 국내 양파의 재배면적은 18,461 ha이며, 생산량은 1,576,756톤이다(KOSTAT, 2021). 각 지역의 양파 생산량을 살펴보면, 전라남도 지역이 579,042톤으로 가장 많이 생산하였는데, 이는 전체 양파 생산량의 36.7%를 차지하는 양이다. 그 다음으로는 경상남도 지역으로 생산량은 338,877톤(21.5%)이었고, 경상북도 지역은 307,653톤(19.5%) 이었다. 양파는 양념 채소 뿐만 아니라 양파 음료, 양파즙 등 다양한 가공식품으로 개발되어 소비가 증가하고 있는 추세이다. 그리고 양파는 노지 월동 작물로 농가의 소득 작물로 중요한 위치를 차지하고 있다(Kim et al., 2014). 이처럼 많이 소비되는 채소인 양파 구근은 쿼세틴, 알리신, 플라보노이드 등 기능성 물질을 풍부하게 함유하고 있다(Ryu et al., 2021). 그리고 양파는 항염증, 항콜레스테롤 및 항암작용을 한다고 보고되었다(Slimestad et al., 2007). 또한 살균 및 살충 활성도 알려져 있다(Mishra et al., 2014).
양파는 재배 지역, 시기, 품종에 따라 곰팡이, 세균, 바이러스, 선충 등에 의해 다양한 식물 병이 발생한다(Mishra and Gupta, 2012; Paibomesai et al., 2012). Chowdhury et al. (2015)은 양파 작물에는 66가지 식물병이 발생하며, 이들 중 Botrytis 잎마름병(Botrytis squamosa), 검은무늬병(Alternaria porri), Stemphylium 잎마름병(Stemphylium vesicarium) 그리고 노균병(Peronospora destructor) 등은 양파 생산량에 크게 영향을 미치는 병해라고 하였다. 특히 S. vesicarium에 의한 잎마름병은 포장 내에서 가장 큰 병 발생률을 나타내었다(Chowdhury et al., 2015; Hay et al., 2019; Stricker et al., 2021).
S. vesicarium에 의하여 발생하는 양파 잎마름병은 잎과 꽃에서 발생하여 구근과 종자의 품질을 저하시키고 생산량을 감소시키는 중요한 병해이다(Leach et al., 2020). 특히, 양파 종자 작물의 잎과 종자 줄기에 S. vesicarium이 침입하여 잎마름병이 발생하게 되면 약 80~85%의 손실을 일으킨다(Hassan et al., 2020). 잎마름병은 따듯하고, 습한 환경에서 병원균이 잘 자라서 발생하는데(Basallote-Ureba et al., 1999; Prados-Ligero et al., 2003), 병원균의 자낭각으로부터 나온 자낭포자가 잎마름병 감염에서 중요한 역할을 한다(Misawa and Yasuoka, 2012). 양파의 잎마름병 발생의 초기에는 병반이 작고, 연노란색부터 갈색을 띠는 수침상 병징이 나타나게 되며, 병반이 점차 커질수록, 잎마름병 병징이 확장되어 나타난다. 포자가 형성될 때 병반의 정중앙에는 갈색에서 마침내 검정색을 띠게 된다(Mishra et al., 2014).
양파 잎마름병을 방제하기 위한 방법으로는 살균제를 이용한 화학적인 방제 방법을 주로 사용하여 왔으나, 최근에는 화학합성농약에 대한 저항성균 출현으로 인한 방제효과 저하와 과다 사용으로 인한 인축 및 환경에 대한 독성 문제가 부각되고 있다(Aveling e t al., 1993b; Hay et al., 2019; Stricker et al., 2021). 이에 대한 대안으로 저독성 살균제 사용과 길항미생물을 이용한 생물학적 방제(Abo-Elyousr et al., 2017; Hussein et al., 2007; Mishra and Gupta, 2012), 그리고 가축 분뇨와 같은 동물성 유기물과 질소, 인산, 칼륨과 같은 무기질 비료를 적절하게 이용한 경종적 방법(Acharya and Shrestha, 2018; Gupta and Gupta, 2013) 등이 알려져 있다. 이와 같이 양파 잎마름병용 방제 소재 개발을 위해서는 효율적인 생물검정법이 필요하다.
그리고 저항성 품종의 재배는 오늘날 친환경적으로 식물병을 방제하는 효과적인 방법으로 인식되고 있다(Carolan et al., 2017; Huang et al., 2018). Dangi et al. (2019)은 59가지 Allium 속 자원의 잎마름병에 대한 저항성을 스크리닝하여 ‘Pusa Soumya’ (Allium fistulosum L.)와 ‘Red Creole 2’ (A. cepa L.) 품종이 중도저항성 이었다고 보고하였다. 하지만 현재까지 잎마름병에 대한 강한 저항성을 나타내는 상업용 양파 품종은 거의 알려져 있지않다. S. vesicarium이 일으키는 잎마름병에 대한 저항성 양파 품종을 개발하기 위해서는 저항성 유전자원을 선발하고, 이를 일반 양파 품종과 교배하여 얻은 후대 종자들 중 저항성 개체를 선발하는 과정을 여러 세대에 걸쳐 수행하여 저항성 계통을 얻을 수 있다. 이를 위해서도 효율적이고 정확한 저항성 결과를 얻을 수 있는 검정 방법의 확립이 필요하다.
하지만 양파 잎마름병에 대한 대부분의 소재 개발을 위한 살균 활성(약효) 및 유전자원들의 저항성 검정은 주로 자연감염에 의한 포장 실험이 많았으며, 효율적인 유묘 검정 방법 개발에 관한 연구는 거의 없다. 그리고 효율적인 유묘 검정을 위해서는 접종원의 대량 생산 방법 및 양파의 잎마름병 발생을 위한 조건을 확립하는 것이 필요하다.
본 연구에서는 양파의 잎마름병에 대한 생물검정법을 확립하기 위하여, S. vesicarium 의 포자 대량생산 방법 및 발병 조건에 관하여 실험하였다. 접종원 대량 생산 방법을 확립하기 위해서는 상처 및 광 조사 유무 그리고 배지 종류에 따른 S. vesicarium 포자 생산량을 조사하였고, 양파 잎마름병 발생을 위한 조건을 확립하기 위하여 양파의 생육 시기, 접종원 농도, 접종원의 탄소원 종류 및 발병 환경에 따른 잎마름병 발생을 조사하였다.
재료 및 방법
Stemphylium vesicarium 균주
양파잎마름병균인 S. vesicarium는 농촌진흥청 농업유전자원센터(KACC, Rural Development Administration, Jeonju, Korea)로부터 6개 균주(KACC 40924, KACC 40925, KACC 40926, KACC 40927, KACC 44528 및 KACC 44530)를 분양 받아 실험에 사용하였다. S. vesicarium 균주들은 potat odextrose agar (PDA; Becton, Dickinson and Co.) 배지에 접종하고 25oC에서 10일 동안 배양한 후에, 각 균주의 균사조각을 멸균한 20% glycerol에 넣고 -80oC deep freezer에 저장하면서 실험에 사용하였다.
배양 조건에 따른 포자 생산량
양파잎마름병원균의 포자를 대량 생산하기 위한 조건을 확립하기 위하여, S. vesicarium 균주를 배양한 후에 균총에 상처를 주거나 광을 처리한 후에 포자 형성량을 조사하였다. S. vesicarium 2개 균주(KACC 44528과 KACC 44530)를 rice bran agar [RA; rice bran 32 g, glucose (Junsei Chemical Co., Ltd.) 10 g, agar (Junsei Chemical Co., Ltd.) 12 g, distilled water 1 L] 배지의 중앙에 균사 조각을 접종하고, 25oC에서 14일 동안 배양하였다. 그 후에 멸균된 붓으로 공중 균사를 긁어서 상처를 내거나 혹은 상처를 내지않거나 하고, 이들을 항온항습실(25oC, 상대습도 80%)에서 Petri dish 뚜껑을 열어둔 채 하루에 12시간씩 광(55 μmol/m2.s)을 처리하거나 암상태로 48시간 동안 배양한 후에 포자형성량을 조사하였다.
양파잎마름병균 포자를 대량 생산하기 위한 최적의 배지를 선발하기 위하여, RA, PDA, V8 juice agar [V8 juice (Campbell Soup Co.) 200 mL, CaCO3 (Samchun Chem. Co., Ltd.) 3 g, agar (Junsei Chemical Co., Ltd.) 15 g, distilled water 800 mL], oatmeal agar (OA; Becton, Dickinson and Co.), malt extract agar (MEA; Becton, Dickinson and Co.), Czapek solution agar (CA; Becton, Dickinson and Co.) 배지를 멸균하고, 이를 직경 8.5 cm Petri dish에 분주하여 배지를 준비하였다. S. vesicarium 2개 균주(KACC 44528과 KACC 44530) 균주의 균사 조각을 각 배지의 중앙에 1조각씩 접종하여 25oC에서 14일 동안 배양하였다. 그리고 형성된 균총을 멸균된 붓으로 긁어 공중 균사를 제거하고, 25oC 항온항습실(상대습도 80%)에서 Petri dish 뚜껑을 열어놓은 상태로 하루에 12시간씩 광(55 μmol/m2.s)을 조사하면서 48시간 동안 배양한 후에 포자형성량을 조사하였다.
포자형성량이 가장 많은 균주를 선발하기 위하여 S. vesicarium 균주에 따른 포자 생산량을 조사하였다. S. vesicarium 6개 균주(KACC 40924, KACC 40925, KACC 40926, KACC 40927, KACC 44528, KACC 44530)를 RA 배지 중앙에 균사 조각을 접종하고 25oC에서 12~14일 동안 배양하였다. 그리고 앞과 동일한 방법으로 포자 형성량을 조사하였다.
배지에 형성된 포자의 수을 조사하기 위하여, 포자가 형성된 배지에 plate당 10mL의 멸균수를 붓고 멸균된 붓과 4겹 가제를 이용하여 포자를 수확하고, hemocytometer (Paul Marienfeld GmbH & Co.KG, Lauda-Konighofen, Germany)를 이용하여 광학현미경(BX53F; Olympus, Tokyo, Japan)하에서 포자 농도를 조사한 후에 plate 당 포자 형성량을 계산하였다. 모든 실험은 3반복씩 2회 수행하였으며, 처리 평균간 비교를 위하여 Duncan’s multiple range test (p=0.05)를 실시하였다.
식물체 준비
양파 잎마름병 발병 조건 확립을 위한 모든 실험에서 양파 품종은 ‘레드원볼 1115’(아시아 종묘)을 시중에서 구입하여 사용하였으며, 8 × 16 육묘용 연결포트(포트당 토양 15 mL, Bumnong, Jeongup, Korea)에 원예용상토 2호(Punong, Gyeongju, Korea)를 채우고, 양파 종자를 포트당 1립씩 파종하고 온실(25 ± 5oC)에서 재배하였다. 지지대와 철사를 이용하여 줄기와 잎을 고정하였으며, 양파의 생장에 맞추어 새로운 포트로 이식하면서 재배한 4엽기 양파 식물체를 실험에 사용하였다.
그리고 양파의 생육 시기에 따른 잎마름병 발생 실험을 위해서, 8 × 16 육묘용 연결포트에 양파 종자를 파종하고 온실(25 ± 5oC)에서 일정 기간 재배한 후에 3엽기 식물체는 플라스틱 포트(직경 6.8 cm, 토양 160mL)로 이식하여 재배하였고, 4엽기와 5엽기 식물체는 더 큰 플라스틱 포트(직경 9.0 cm, 토양 270mL)로 한 번 더 이식하여 재배하였다. 3엽기 양파 식물체는 파종 후에 80일 내외, 4엽기 양파는 100일 내외 그리고 5엽기 양파 식물체는 120일 내외 재배하여 실험에 사용하였다.
접종원 준비
양파 잎마름병 발병 조건을 확립하기 위한 접종원 준비는, KACC 44528와 KACC 44530 균주를 사용하여 앞의 포자 형성량 조사와 동일한 방법으로 포자를 형성시키고, 형성된 포자를 1/2 PDB로 수확하였다.
S. vesicarium 6개 균주의 병원성과 접종원 농도에 따른 잎마름병 발생 실험을 제외한 모든 실험은 포자현탁액의 포자 농도를 1.0 × 105 spores/mL로 조정하여 실험에 사용하였다. S. vesicarium 6개 균주의 병원성 실험은 포자 농도를 3.0 × 104 spores/mL로 하였고, 접종원 농도에 따른 잎마름병 발생 실험을 위해서는 포자현탁액의 포자 농도를 각각 1.0 × 104, 3.0 × 104, 1.0 × 105, 3.0 × 105 spores/mL가 되도록 준비하여 실험에 사용하였다.
발병 환경에 따른 잎마름병 발생 실험에서 포자현탁액을 제조할 때 영양원(1/2 PDB)을 첨가하거나, 포자의 부착력을 증가시키기 위한 계면활성제 Tween 20을 250 μg/mL 첨가하여 준비하였다. 그리고 접종원 제조에 사용하는 탄소원 종류에 따른 잎마름병 발생 실험을 위해서는 멸균한 6가지 탄소원(glucose, fructose, galactose, sucrose, maltose, lactose)의 1% 용액을 사용하여 접종원을 준비하였다. 이 때 대조군으로 1/2 PDB와 Tween 20 250 μg/mL 용액도 함께 실험하였다.
병원균 접종 및 발병 환경
Mehta (1998)은 양파 식물체에 S. vesicarium 균주를 접종하기 전에 부드러운 붓으로 문질러주어 상처를 내고 접종하였는데, 본 연구에서는 이 방법을 참고하여 접종하기 직전에 탈색된, 비흡수성 재질의 솜으로 양파의 잎을 문지른 후에 스프레이를 사용하여 준비한 S. vesicarium 균주들의 포자현탁액을 흘러내리기 직전까지 분무하여 접종하였다. 접종 후 발병 환경에 따른 잎마름병 발생 실험을 제외한 모든 실험은, 접종한 양파 유묘를 20oC 습실상에서 48시간 습실처리한 후에 항온항습실(25oC, 상대습도 80%)로 이동하여 하루에 12시간씩 광(55 μmol/m2.s)을 조사하면서 재배하였다.
접종 후 발병 환경에 따른 양파의 잎마름병 발생 실험을 위해서는 접종한 식물체를 20oC 혹은 25oC 습실상에서 48시간 습실처리한 후에 20oC 혹은 25oC의 항온항습실(상대습도 80%)로 이동하여 하루에 12시간씩 광(55 μmol/m2.s)을 조사하면서 재배하였다.
병 조사 및 통계 분석
양파의 생육 시기에 따른 잎마름병 발생 실험을 제외한 모든 실험에서 병 조사는 접종 7일 후에, 접종한 잎의 1, 2, 3엽을 대상으로 각 엽의 병반면적율(%)을 조사하고 이를 평균하여 주당 병반면적율(%)을 계산하였다. 양파의 생육 시기에 따른 잎마름병 발생 실험은 3엽기 양파는 1엽과 2엽을 대상으로, 4엽기 양파는 1엽, 2엽 및 3엽을 대상으로 그리고 5엽기 양파는 1엽부터 4엽까지를 대상으로 조사하고 이들의 평균 값을 계산하여 주 당 잎마름병 병반면적율(%) 결과를 얻었다.
발병 조건 확립을 위한 모든 실험은 5반복씩 2회 수행하였으며, 처리 평균간 비교를 위하여 Duncan’s multiple range test (p = 0.05)를 실시하였다.
결과 및 고찰
상처 및 광 조사에 따른 포자 생산량
S. vesicarium KACC 44528과 KACC 44530 균주를 RA 배지에서 배양한 후에 상처와 광 처리에 따른 각 균주의 포자 형성량을 조사한 결과, 두 균주 모두 균총에 상처도 주지않고 광도 처리하지않았을 때에는 각각 plate 당 2.7 × 104개와 2.0 × 104개의 포자가 형성되었다(Table 1). 이와 달리 균총에 상처를 주지않고 하루에 12시간씩 광을 조사하였을 때에는 포자 형성량이 약 10배 증가하여 plate 당 1.7~2.7 × 105개 이었다. 그리고 두 균주 모두 멸균된 붓으로 배지 위의 균사를 긁어 상처를 주고, 하루에 12시간씩 광을 조사하였을 때에는 포자 형성량이 약 100배 증가하여 KACC 44528 균주는 plate 당 3.0×106개, KACC 44530 균주는 2.8×106개의 포자가 형성되었다(Table 1).
저항성 품종 개발을 위한 식물병 저항성 대량검정은 일반논문 실험과 달리 대량의 접종원이 소요되며, 재현성이 높은 포자형성 방법이 요구된다. 따라서 S. vesicarium의 포자 생산을 위한 효율적인 방법 개발이 필요하다. Sproston (1971)는 곰팡이는 무성생식 또는 유성생식을 생산할 때 자외선이나 가시광선에 반응을 하며, 암 상태에서 배양하였을 때에는 분생포자, 포자낭, 난포자, 접합포자, 자낭과 그리고 담자과 등이 거의 생산되지 않았으며, 적당한 광 조사가 이루어져야 포자가 형성된다고 하였다. 또한, Basallote-Ureba et al. (1999)와 Falloon et al. (1987)은 S. vesicarium의 포자 형성을 위한 최적 조건은 포화 습도를 유지하고, 18~25oC에서 하루에 12~18시간씩 광을 조사하는 것이라고 보고하였다. 그리고 Gedefaw et al. (2019)는 14일간 배양한 S. vesicarium 균주를 rubber spatula로 문질러주어 포자를 생산하였다.
본 연구에서는 상처와 광을 처리하지 않았을 때보다 광만 조사하여도 포자 형성량이10배 증가하였으며, 균총에 상처도 주고 광 조사를 하게 되면 포자 형성량이 100배 증가하는 것을 알 수 있었다(Table 1). 따라서 S. vesicarium의 포자 형성을 위해서는 S. vesicarium 균주를 배양한 후에 멸균한 붓으로 균총을 긁어주어 상처를 내고 25oC, 상대습도 80% 조건에서 하루에 12시간 씩 광을 처리하는 것이 가장 효과적임을 알 수 있었다.
배지 종류에 따른 포자 생산량
KACC 44528과 KACC 44530 균주를 6가지 배지에서 배양한 후에 포자 형성량을 조사한 결과, KACC 44528 균주는 OA와 RA 배지에서 가장 많은 포자를 생산하였으며, 둘간에는 통계적으로 유의성 있는 차이가 없었다(Table 2), 그 다음은 MEA, V8 juice agar, PDA, CA 배지 순서대로 포자가 많이 형성되었다. 그리고 KACC 44530 균주는 RA 배지에서 가장 많은 포자가 형성되었고, 그 다음은 OA, PDA, V8 juice agar, MEA, CA 배지 순서대로 포자가 많이 형성되었다. 두 균주 모두 CA 배지에서 가장 적은 양의 포자를 생산하였고, RA 배지에서 가장 많은 포자가 형성되었다. 따라서 S. vesicarium의 포자 형성을 위해서는 균주를 RA 배지에서 배양하는 것이 가장 효과적임을 알 수 있었다.
하지만 다른 연구자들은 S. vesicarium의 포자 형성을 위하여 RA 배지를 거의 사용하지않았다. Suheri and Price (2000)와 Cho and Yu (1998)는 V8 juice agar 배지를 사용하였으며, Kamal et al. (2008)는 PDA 배지를 사용하였다. 이는 본 연구의 목적인 대량 검정을 위한 S. vesicarium 포자 생산이 아니고, 소규모 논문 실험이기 때문으로 생각되었다.
S. vesicarium 6개 균주의 포자 생산량과 병원력
확립한 접종원 대량생산 방법을 이용하여 S. vesicarium 6개 균주(KACC 40924, KACC 40925, KACC 40926, KACC 40927, KACC 44528, KACC 44530)의 포자 형성량을 조사한 결과, 6개 균주 중 KACC 44528과 KACC 44530 균주는 plate 당 4.4~4.5 × 106개로 가장 많은 포자가 형성되었다(Table 3). 그 다음은 KACC 40924 균주로 plate 당 1.3 × 105 spores/mL를 생산하였다. 그리고 KACC 40925, KACC 40926, KACC 40927 균주는 2.0~4.5 × 104 spores/mL로 포자 형성량이 가장 적었다. 이들은 포자 형성량이 가장 많았던 KACC 44528과 KACC 44530 균주에 비하여 100배 낮은 포자를 생산하였다.
KACC로부터 분양받은 S. vesicarium 6개 균주의 병원성(pathogenicity) 유무 및 병원력(virulence)을 비교하기 위하여 각 균주의 포자현탁액을 양파 유묘에 접종하고 잎마름병 발생을 조사한 결과, 실험한 6개 균주는 모두 양파에 대하여 병원성이 있었으며, 실험한 균주 중 KACC 44528과 KACC 44530 균주는 양파 잎에 가장 많은 잎마름병을 발생시켰는데, 접종 7일 후에 각각 58%과 55%의 병반면적율을 보였다(Fig. 1). 둘 간에는 통계적으로 유의성 있는 차이는 없었다. 그 다음은 KACC 40924 균주로 42%의 병반면적율을 나타냈으며, 나머지 3개 균주(KACC 40925, 40926, 40927)는 31~32%의 가장 낮은 병반면적율을 보였다. 따라서 S. vesicarium 6개 균주들의 병원력은 KACC 44528과 KACC 44530 균주가 가장 높았으며, 그 다음은 KACC 40924 균주이었다. 그리고 나머지 3개 균주는 가장 낮은 병원력을 나타내는 균주임을 알 수 있었다.
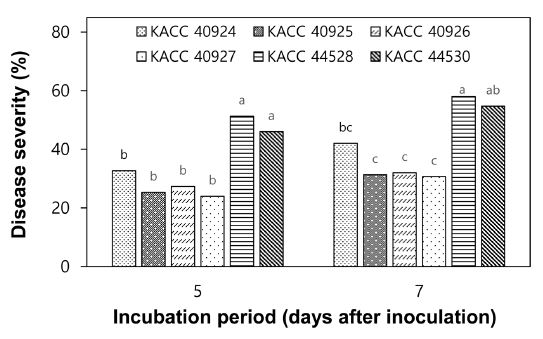
Pathogenicity of Stemphylium vesicarium 6 isolates. Onion seedlings at four-leaf stage were inoculated with S. vesicarium by spraying spore suspension of the fungus at a concentration of 3.0 × 104 spores/mL. The plants were incubated in a humidity chamber at 20oC for 48 hours and then transferred to a growth chamber at 25oC and 80% RH with a 12-h light/dark cycle. Disease severity was measured 7 days after inoculation and represented as percentage of diseased leaf area. The data were obtained from two runs with five replicates each. Values labeled with the same letter are not significantly different based on Duncan’s multiple range test at p=0.05.
이상의 결과로부터, S. vesicarium KACC 44528과 KACC 44530 균주는 실험한 6개 균주 중 포자 생산량도 많았으며, 양파에 대한 병원력도 높아 이들 균주를 선발하여 in vivo 병 저항성 검정 실험에 사용하기로 하였다. 식물병원균들은 균주 간에 병원력(virulence)의 차이가 존재한다고 알려져 있다. 고추역병균 Phytophthora capsici의 경우에는 4개 균주를 감수성 고추 품종에 접종하였을 때, KPC-7, JHAI1-7, KPC-1 그리고 MY-1 균주 순으로 역병이 심하게 발생하였다고 보고하였다(Jo et al., 2014). 그리고 잿빛곰팡이병균 Botrytis cinerea 16개 균주를 장미 품종에 접종하고 균주 간의 차이를 확인한 결과, WNG6_3의 경우 가장 발병 정도가 심하였으며, WNG6_5의 경우가 가장 약해 균주에 따른 병원력 차이가 있었다(Hwang et al., 2019). 또한, 시들음병원균 Fusarium oxysporum f. sp. lycopersici (Fol) 7개 균주를 감수성 토마토 품종인 ‘heinz’에 접종하였을 때, Fol40038과 Fol40044 균주는 가장 강한 병원력을, Fol40043, Fol40045, Fol40046 및 Fol40047 균주는 중간 정도의 병원력을 나타내었다. 그리고 실험한 균주 중 Fol40048 균주는 가장 약한 병원력을 보였다(Kim et al., 2021).
생육 시기에 따른 양파의 잎마름병 발생
양파의 생육 시기에 따른 잎마름병 발생 정도를 조사하기 위하여 3, 4, 5엽기 양파 식물체에 S. vesicarium KACC 44528과 KACC 44530 균주의 포자현탁액을 접종하고 잎마름병 발생을 조사한 결과, 실험한 양파의 생육 시기 중 5엽기 양파에서 두 균주 모두 85% 이상의 병반면적율을 보여 잎마름병이 가장 많이 발생했다는 것을 알 수 있었으며, 그 다음은 4엽기 양파로 KACC 44528과 KACC 44530 균주에 의해 각각 83%와 81%의 병반면적율을 나타냈다(Fig. 2). 하지만 양파의 두 생육 시기(4엽기와 5엽기) 간에는 통계적으로 유의성 있는 차이는 없었다. 그리고 3엽기 양파는 KACC 44528과 KACC 44530 균주에 의해 각각 71%와 62%의 병반면적율을 보였으며, 실험한 세 가지 생육 시기 중 잎마름병 발생이 가장 적었다. 그리고 각 생육 시기 내에서는 하위엽이 상위엽보다 더 높은 병반면적율(%)을 보였다. 따라서 양파 잎마름병 저항성 검정은 4엽기 혹은 5엽기 식물체를 실험에 사용하는 것이 바람직할 것으로 생각되었다.
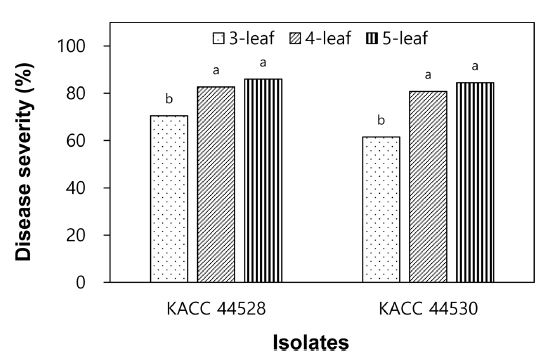
Development of leaf blight on onion plants caused by Stemphylium vesicarium KACC 44528 and KACC 44530 according to growth stage of plant. Seedlings (3-, 4-, and 5-leaf stages) were inoculated with S. vesicarium by spraying spore suspension of each isolate at a concentration of 1.0 × 10⁵ spores/mL. The plants were incubated in a humidity chamber at 20oC for 48 hours and then transferred to a growth chamber at 25oC and 80% RH with a 12-h light/dark cycle. Disease severity was measured 7 days after inoculation and represented as percentage of infected leaf area. The data were obtained from two runs with five replicates each. Values labeled with the same letter within each isolate are not significantly different based on Duncan’s multiple range test at p=0.05.
기주 식물의 생육 시기에 따른 식물병 발생은 크게 두 가지로 나뉘게 되는데, 식물이 생장함에 따라 감수성이 떨어지는 경우와 감수성이 증가하는 경우가 있다. 본 연구의 양파 잎마름은 양파가 생장함에 따라 감수성이 증가하였는데, Plurivorosphaerella nawae에 의한 감나무 둥근무늬낙엽병 발생의 경우에도 양파 잎마름병과 마찬가지로 어린 잎보다 오래된 잎에서 둥근무늬낙엽병 발생이 더 많았으며, 오래된 잎에서 병 진전 속도가 훨씬 더 빠르고 병이 더 심각하게 발생하였다(Hassan et al., 2020). 또한, Alternaria solani에 의한 토마토 잎마름병에서도 식물체의 엽기가 증가할수록 감수성이었다(Vloutoglou and Kalogerakis, 2000). 이와 달리, Farber and Mundt (2017)는 Puccinia striiformis f. sp. tritici에 의한 밀 줄무늬녹병은 오래된 잎보다 어린 잎에서 병반면적율이 훨씬 더 높다고 보고하였다. 그리고 무 검은 무늬병의 경우에도 감수성 무 품종 4개를 10, 13, 16, 19일 동안 재배하고 Alternaria brassicicola KACC 40036 균주를 접종하여 검은무늬병 발생을 조사한 결과, 각각 99, 96, 89, 74%의 병반면적율을 보여, 무가 성장할수록 검은무늬병 발생은 감소하였다. 즉, 어린 유묘일수록 검은무늬병에 대한 감수성이 증가하였다(Lee et al., 2017).
접종원 농도에 따른 양파의 잎마름병 발생
S. vesicarium KACC 44528과 KACC 44530 균주의 포자농도가 1.0 × 104, 3.0 × 104, 1.0 × 10⁵, 3.0 × 10⁵ spores/mL인 포자현탁액을 양파 식물체에 접종하여 접종원의 농도에 따른 양파의 잎마름병 발생을 조사한 결과, 두 균주 모두 접종한 포자현탁액의 포자 농도가 높을수록 잎마름병 발생은 증가하였다(Fig. 3). KACC 44528 균주를 가장 높은 포자농도인 3.0 × 10⁵ spores/mL 농도로 접종하였을 때에는 접종 7일 후에는 86%의 병반면적율을 보였다. 그리고 1.0 × 10⁵ spores/mL 농도로 접종하였을 때에는 81%를, 3.0 × 104 spores/mL 농도로 접종하였을 때에는 57% 그리고 1.0 × 104 spores/mL 농도로 접종하였을 때에는 42%의 병반면적율을 보였다. 한편, KACC 44530 균주는 3.0 × 10⁵ spores/mL 농도로 포자현탁액을 접종하였을 때에는 접종 7일 후에는 93%의 병반면적율을 보였으며, 1.0 × 10⁵ spores/mL 농도로 접종하였을 때에는 88%의 병반면적율을 보였다.
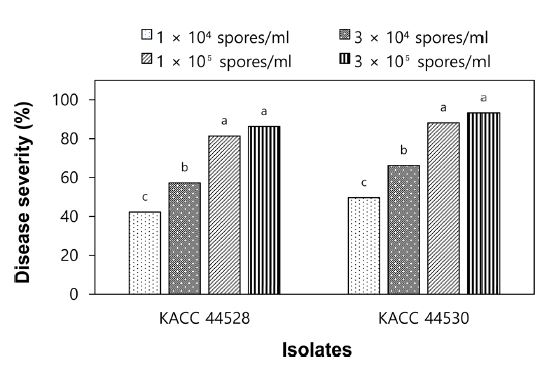
Development of leaf blight on onion plants caused by Stemphylium vesicarium KACC 44528 and KACC 44530 according to concentration of spore suspension. Seedlings at four-leaf stage were inoculated with S. vesicarium by spraying spore suspension of each isolate at concentrations of 1.0 × 104, 3.0 × 104, 1.0 × 10⁵, and 3.0 × 10⁵ spores/mL. The plants were incubated in a humidity chamber at 20oC for 48 hours and then transferred to a growth chamber at 25oC and 80% RH with a 12-h light/dark cycle. Disease severity was measured 7 days after inoculation and represented as percentage of infected leaf area. The data were obtained from two runs with five replicates each. Values labeled with the same letter within each isolate are not significantly different based on Duncan’s multiple range test at p=0.05.
KACC 44528과 KACC 44530 두 균주 모두 실험한 4가지 포자 농도 중 3.0 × 10⁵ spores/mL 농도로 접종하였을 때 양파 잎마름병 발생이 가장 많았지만, 1.0 × 10⁵ spores/mL 농도로 접종하였을 때와 통계적으로 유의성 있는 차이를 보이지 않았다(Fig. 3). 따라서 대량 검정에서 접종원 준비의 효율성을 고려할 때 S. vesicarium의 접종 농도를 1.0 × 10⁵ spores/mL로 하는 것이 효과적이라고 생각되었다.
문헌과 마찬가지로 S. vesicarium에 의한 양파 잎마름병도 접종원의 농도가 증가할수록 병 발생이 증가하는 결과를 보였다(Lee et al., 2016; Lee et al., 2017; Jo et al., 2017; Lee et al., 2018; Lee et al., 2020a, 2020b). 그리고 저항성 품종은 저항성 종류에 따라 다른데, 질적 저항성을 나타내는 품종의 경우에는 발병 정도에 따라 저항성 차이가 거의 없었다(Lee et al., 2015; Park et al., 2012). 이와 달리 양적저항성 품종의 경우에는 저항성 품종도 접종원 농도가 증가함에 따라 병 발생이 증가하였다(Chungu et al., 2001; Jo et al., 2014; Jo et al., 2016; Lee et al., 2020c; Vloutoglou and Kalogerakis, 2000). 따라서 병리검정 대상의 저항성이 질적 저항성인지 양적 저항성인지 확실하지 않을 경우에는 저항성 검정에서 접종하는 접종원 농도(양)은 매우 중요한 요인으로 생각되었다.
발병 환경에 따른 양파의 잎마름병 발생
양파 식물체(4엽기)에 S. vesicarium 균주(KACC 44528과 KACC 44530)의 포자현탁액을 접종하고 습실처리하는 온도(20oC, 25oC)와 항온항습실에서 재배하는 온도(20oC, 25oC)에 따른 잎마름병 발생을 조사한 결과, 잎마름병균의 포자현탁액을 1/2 PDB 용액으로 제조하였을 때에는 20oC에서 48시간 동안 습실처리하고, 25oC 항온항습실(RH 80%)에서 재배한 처리구에서 각각 89%와 90%의 병반면적율을 보여 잎마름병이 가장 많이 발생하였으며, 그 다음은 25oC에서 습실처리하고 25oC 항온항습실(RH 80%)에서 재배하였을 때에는 균주에 따라 잎마름병 발생이 약간 감소하여 84~86%의 병반면적율을 보였고, 20oC에서 습실처리하고 20oC 항온항습실(RH 80%)에서 재배하였을 때는 잎마름병 발생이 83~85%로 거의 차이가 없었다. 통계적인 유의성을 살펴보면으로 1/2 PDB 용액으로 제조하였을 때에는 S. vesicarium 두 균주 모두 3가지 종류의 발병 환경에 의한 잎마름병 발생에 차이는 존재하지 않았다(Fig. 4).
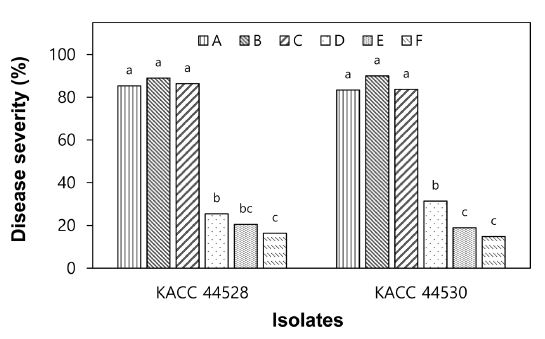
Development of leaf blight on onion plants caused by Stemphylium vesicarium KACC 44528 and KACC 44530 according to environmental conditions. Seedlings at four-leaf stage were inoculated with S. vesicarium by spraying spore suspension (1.0 × 10⁵ spores/mL) of each isolate made of 1/2 potato dextrose broth (A, B, C) or Tween 20 250 μg/mL (D, E, F). The inoculated plants were incubated in a humidity chamber at 20oC (A, B, D, E) or 25oC (C, F) for 48 hours and then transferred to a growth chamber at 20oC (A, D) or 25oC (B, C, E, F) and 80% RH with a 12-h light/dark cycle. Disease severity was measured 7 days after inoculation and represented as percentage of infected leaf area. The data were obtained from two runs with five replicates each. Values labeled with the same letter within each isolate are not significantly different based on Duncan’s multiple range test at p=0.05.
한편, 계면활성제인 Tween 20 250 μg/mL 용액으로 S. vesicarium의 포자현탁액을 준비하고 접종하고 잎마름병 발생을 조사한 결과, 3가지 발병 환경 중 20oC에서 48시간 동안 습실처리하고, 20oC 항온항습실(RH 80%)에서 재배하였을 때 잎마름병이 가장 많이 발생하여 균주에 따라 26~31%의 병반면적율을 보였다(Fig. 4). 그 다음은 20oC에서 습실처리하고 25oC 항온항습실(RH 80%)에서 재배하는 것이었는데 19~21%의 병반면적율을 나타냈고, 25oC에서 습실처리하고 25oC 항온항습실(RH 80%) 재배하였을 때에는 15~ 16%의 병반면적율을 보여 잎마름병 발생이 가장 적었다(Fig. 4).
Hussein et al. (2007)은 잎마름병의 발생 요인은 높은 습도를 유지하기 위하여 48시간 동안 비닐봉투(polyethylene bag)로 식물체를 덮어주어 관리하고, 48시간 이후, 일반적인 환경 하에서 식물체를 재배한다고 보고하였다. 그리고 Mwakutuya and Banniza (2010)는 콩 잎마름병의 경우에 25~30oC에서 48시간 동안 80% 이상의 습도를 유지하였을 때 병 발생이 심하였다고 보고하였다. 그리고 Gedefaw et al. (2019)는 접종한 양파 유묘를 27oC 온실에서 75% 이상 상대습도를 유지한 채 약 45일간 재배하였을 때 잎마름병이 발생하였다고 하였다. 본 연구에서도 양파에 잎마름병균을 접종하고 습실처리를 48시간 보다 짧은 24시간하였을 때에는 잎마름병이 거의 발생하지않았다.
1/2 PDB 용액으로 S. vesicarium의 포자현탁액을 준비하여 접종한 경우에는 Tween 20 250 μg/mL 용액에 비하여 잎마름병 발생이 약 3배로 크게 증가하였다(Fig. 4). 이들 결과로부터 접종 후 습실 처리 등 실험한 조건 내에서는 발병 환경(온도)에 따른 차이보다 S. vesicarium 포자현탁액에 첨가하는 물질에 따른 차이가 더 크다는 것을 알 수 있었다. 따라서 양파의 잎마름병 발생을 위해서는 멸균한 1/2 PDB 용액을 사용하여 S. vesicarium 포자현탁액을 준비하여 이를 양파 식물체에 접종하고 20oC에서 48시간 습실처리한 후에 25oC 항온항습실(RH 80%)에서 재배하는 것이 효과적이라고 생각되었다.
접종원의 탄소원 종류에 따른 양파의 잎마름병 발생
양파 식물체(4엽기)에 S. vesicarium KACC 44528과 KACC 44530의 포자현탁액을 제조할때 첨가하는 탄소원 종류에 따른 잎마름병 발생을 조사하기 위하여 6가지 탄소원(glucose, fructose, galactose, sucrose, maltose, lactose)을 1% 첨가하여 실험한 결과, 6가지 탄소원들은 종류에 큰 차이없이 Tween 20 250 μg/mL 용액으로 포자현탁액을 제조하였을 때에 비하여 KACC 44528 균주는 1.9~2.8배로 병반면적율이 증가하였다(Fig. 5). 하지만 이들 탄소원(1%) 첨가는 1/2 PDB 용액으로 포자현탁액을 제조하였을 때에 비하여 약 36~55%의 병반면적율을 보일 뿐이었다. 그리고 KACC 44530 균주도 탄소원 종류에 관계없이 Tween 20 250 μg/mL 용액으로 포자현탁액을 제조하였을 때에 비하여 1.4~2.2배로 잎마름병 발생이 증가하였으며, 1/2 PDB 용액에 비해서는 KACC 44528 균주와 마찬가지로 36~56%의 잎마름병 발생을 보였다. 따라서 양파의 잎마름병 발생을 위해서는 1/2 PDB 용액으로 제조한 S. vesicarium의 포자현탁액을 접종하고 20oC 습실상에서 48시간 습실처리하고 25oC 항온 실(상대습도 80%)로 이동하여 재배하는 것이 가장 효과적이라고 생각되었다.
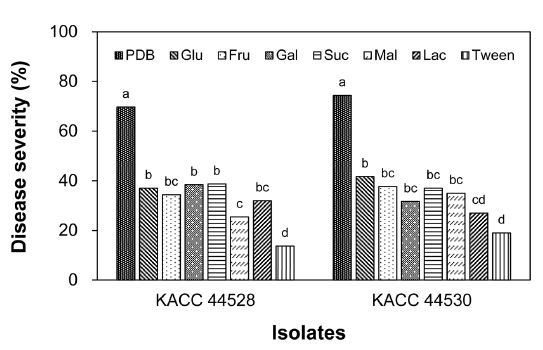
Development of leaf blight on onion plants caused by Stemphylium vesicarium KACC 44528 and KACC 44530 according to carbon source contained in spore suspension. Seedlings at four-leaf stage were inoculated with S. vesicarium by spraying spore suspension (1.0 × 10⁵ spores/mL) made of each carbon source (1% glucose, 1% fructose, 1% galactose, 1% sucrose, 1% maltose, 1% lactose). Spore suspensions made of 1/2 potato dextrose broth and Tween 20 250 μg/mL were also included. The plants were incubated in a humidity chamber at 20oC for 48 hours and then transferred to a growth chamber at 25oC and 80% RH with a 12-h light/dark cycle. Disease severity was measured 7 days after inoculation and represented as percentage of infected leaf area. The data were obtained from two runs with five replicates each. Values labeled with the same letter within each isolate are not significantly different based on Duncan’s multiple range test at p=0.05.
잿빛곰팡이병균 Botrytis cinerea는 식물을 감염하기 위해서는 분생포자가 발아한 후 형성된 부착기를 통해 침입하는데, 이 부착기 형성을 위해서는 외부 영양원이 필요하다고 알려져 있다(Clark and Lorbeer, 1977; Katsumi et al., 1981a, 1981b; Noboru and Yoshiha, 1985). 그리고 glucose 혹은 sucrose 단독 첨가보다 glucose와 purine 물질인 inosine을 함께 첨가하거나 KH2PO4를 함께 처리하였을 때 잿빛곰팡이병 발생이 증가하였다(Katsumi et al., 1981a, 1981b, 1987). Hong and Kim (1992)는 glucose는 포자 발아 및 발아관 신장에 기여하고 질소원은 부착기 형성에 관여하여 감염을 촉진한다고 보고하였다. 본 연구의 양파잎마름병균도 포자가 발아한 후에 부착기를 형성하여 침입한다고 알려져 있으므로(Aveiling and Snyman, 1993a), B. cinerea와 마찬가지로 PDB에 포함된 탄소원과 질소원이 부착기 형성을 촉진하여 잎마름병 발생이 증가된 것일 수도 있다고 생각되었다. 이는 향후에 실험을 통해 규명하는 것이 필요할 것이다.
이상의 결과로부터 양파의 잎마름병의 생물 검정을 위해 다음과 같은 방법을 제안하고자 한다. 양파 종자를 원예용 상토에 파종하고 4엽기가 될 때까지 온실(25 ± 5oC)에서 약 100일 동안 재배한다. 그리고 접종 직전에 비흡수성 재질인 솜으로 양파 잎을 문지른 후에 1/2 potato dextrose broth (1/2 PDB) 용액으로 제조한 S. vesicarium의 포자현탁액(1.0 × 10⁵ spores/mL)을 분무하여 접종한다. 접종한 식물체는 20oC의 습실상에 넣고 48시간 동안 습실 처리한 후에, 항온항습실(25oC, 상대습도 80%)로 이동하여 하루에 12시간씩 광을 조사하면서 재배한다. 그리고 접종 7일 후에 잎에 발생한 잎마름병의 병반면적율(%)을 조사한다. 본 연구에서 제안하는 이 방법은 양파 잎마름병에 대한 방제효과가 우수한 소재 개발 및 저항성 양파 품종 개발에 효과적으로 사용될 수 있을 것으로 생각된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업 신농업기후변화대응체계 구축사업(세부과제번호: PJ01481604)의 지원에 의해 이루어진 것임.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Abo-Elyousr KAM, Abdel-Hafez SII, Abdel-Ranhim IR, 2017. Control of Stemphylium leaf blight disease of onion and elevation of seed production using certain bioagents. Int. J. Plant Pathol. 8:1-7.
[https://doi.org/10.3923/ijpp.2017.1.7]

-
Acharya B, Shrestha RK, 2018. Nitrogen level and irrigation interval on mitigating Stemphylium blight and downy mildew in onion. Int. J. Appl. Sci. Biotechnol. 6(1):17-22.
[https://doi.org/10.3126/ijasbt.v6i1.18795]

-
Aveling TAS, Snyman HG, 1993a. Infection studies of Stemphylium vesicarium on onion leaves. Mycol. Res. 97(8):984-988.
[https://doi.org/10.1016/S0953-7562(09)80866-6]

-
Aveling TAS, Snyman HG, Naude SP, 1993b. Evaluation of seed treatments for reducing Alternaria porri and Stemphylium vesicarium on onion seed. Plant Dis. 77(10): 1009-1011.
[https://doi.org/10.1094/PD-77-1009]

-
Basallote-Ureba MJ, Prados-Ligero AM, Melero-Vara JM, 1999. Aetiology of leaf spot of garlic and onion caused by Stemphylium vesicarium in Spain. Plant Pathol. 48(1):139-145.
[https://doi.org/10.1046/j.1365-3059.1999.00313.x]

-
Carolan K, Helps J, Van den berg F, Bain R, Paveley N, et al., 2017. Extending the durability of cultivar resistance by limiting epidemic growth rates. Proc. R. Soc. B.: Biol. Sci. 284:1863.
[https://doi.org/10.1098/rspb.2017.0828]

- Cho HS, Yu SH, 1998. Stemphylium vesicarium on garlic and other Allium spp. in Korea. Korean J. Plant Pathol. 14(6): 567-570. (In Korean)
-
Chowdhury HA, Islam N, Hossain B, Ahmed M, Mohsin S, Islam R, 2015. A comparative analysis of culture media for optimizing the mycelial growth and sporulation of Stemphylium vesicarium cause of white blotch of onion. J. Agric. Sci. Technol. 5:440-448.
[https://doi.org/10.17265/2161-6256/2015.06.006]

-
Chungu C, Gilbert J, Townley-Smith F, 2001. Septoria tritici blotch development as affected by temperature, duration of leaf wetness, inoculum concentration and host. Plant Dis. 85(4):430-435.
[https://doi.org/10.1094/PDIS.2001.85.4.430]

-
Clark CA, Lorbeer JW, 1977. Comparative nutrient dependency of Botrytis squamosa and B. cinerea for germination of conidia and pathogenicity on onion leaves. Phytopathology 67:212-218.
[https://doi.org/10.1094/Phyto-67-212]

-
Dangi R, Sinha P, Islam S, Gupta A, Kumar A, et al., 2019. Screening of onion accessions for Stemphylium blight resistance under artificially inoculated field experiments. Australas Plant Pathol. 48:375-384.
[https://doi.org/10.1007/s13313-019-00639-x]

-
Falloon PG, Fallon LM, Grogan RG, 1987. Etiology and epidemiology of Stemphylium leaf spot and purple spot of asparagus in California. Phytopathology 77:407-413.
[https://doi.org/10.1094/Phyto-77-407]

- FAO, 2020. Food and agriculture data. http://www.fao.org/faostat/en, .
-
Farber DH, Mundt CC, 2017. Effect of plant age and leaf position on susceptibility to wheat stripe rust. Phytopathology 107(4):412-417.
[https://doi.org/10.1094/PHYTO-07-16-0284-R]

-
Gedefaw Y, Gezahegn A, Fekadu A, Mehari Z, 2019. First report of Stemphylium vesicarium causing onion Stemphylium leaf blight in Ethiopia. Agric. Sci. 10(8):1104-1112.
[https://doi.org/10.4236/as.2019.108083]

-
Gupta RC, Gupta RP, 2013. Effect of integrated disease management packages on diseases incidence and bulb yield of onion (Allium cepa L.). SAARC J. Agri. 11(2):49-59.
[https://doi.org/10.3329/sja.v11i2.18401]

-
Hassan M, Yousuf V, Shah TA, Bhat NA, Bhat ZA, et al., 2020. Stemphylium blight of onion: a review. Agric. Rev. 41(1): 51-58.
[https://doi.org/10.18805/ag.R-1902]

-
Hassan O, Chang T, Hossain A, 2020. Changes in the secondary compounds of permission leaves as a defense against circular leaf spot caused by Plurivorosphaerella nawae. PLoS ONE 15:e0230286.
[https://doi.org/10.1371/journal.pone.0230286]

-
Hay FS, Sharma S, Hoepting C, Strickland D, Luong K, et al., 2019. Emergence of Stemphylium leaf blight of onion in New York associated with fungicide resistance. Plant Dis. 103(12):3083-3092.
[https://doi.org/10.1094/PDIS-03-19-0676-RE]

- Hong SK, Kim HG, 1992. Stimulative effects of various carbon and nitrogen sources on infection of Botrytis cinerea on the cucumber leaves. Korean J. Plant Pathol. 8(2):107-111. (In Korean)
-
Huang Y-J, Mitrousia GK, Sidique SNM, Qi A, Fitt BDL, 2018. Combining R gene and quantitative resistance increases effectiveness of cultivar resistance against Leptosphaeria maculans in Brassica napus in different environments. PLoS ONE 13:e0197752.
[https://doi.org/10.1371/journal.pone.0197752]

- Hussein MAM, Hassan MHA, Allam ADA, Abo-Elyousr KAM, 2007. Management of Stemphylium blight of onion by using biological agents and resistance inducers. Egypt. J. Phytopathol. 35(1):49-60.
-
Hwang K-H, Hong S-M, Lee Y-S, Lee H-J, Seo M-W, 2019. Difference of gray mold severity at roses caused by Botrytis cinerea strains. Res. Plant Dis. 25(1):16-21. (In Korean)
[https://doi.org/10.5423/RPD.2019.25.1.16]

-
Jo EJ, Choi YH, Jang KS, Kim H, Choi GJ, 2017. Development of a simple and effective bioassay method to evaluate resistance of watermelon plants to Fusarium oxysporum f. sp. niveum. Res. Plant Dis. 23(2):168-176. (In Korean)
[https://doi.org/10.5423/RPD.2017.23.2.168]

-
Jo EJ, Jang KS, Choi YH, Ahn KG, Choi GJ, 2016. Resistance of cabbage plants to isolates of Plasmodiophora brassicae. Hortic. Sci. Technol. 34(3):442-452. (In Korean)
[https://doi.org/10.12972/kjhst.20160045]

-
Jo S-J, Shim S-A, Jang KS, Choi YH, Kim J-C, et al., 2014. Resistance of chili pepper cultivars to isolates of Phytophthora capsici. Hortic. Sci. Technol. 32(1):66-76. (In Korean)
[https://doi.org/10.7235/hort.2014.13079]

-
Kamal AAM, Mohamed HMA, Aly AAD, Mohamed HAH, 2008. Enhanced onion resistance against Stemphylium leaf blight disease, caused by Stemphylium vesicarium, by di-potassium phosphate and benzothiadiazole treatements. Plant Pathol. J. 24(2):171-177.
[https://doi.org/10.5423/PPJ.2008.24.2.171]

-
Katsumi A, Keido K, Tomomasa M, 1981a. Role of conidial fusion in infection by Botrytis cinerea on cucumber leaves. Ann. Phytopath. Soc. Japan 47(1):15-23.
[https://doi.org/10.3186/jjphytopath.47.15]

-
Katsumi A, Yasumasa T, Hajime S, Satoshi O, 1987. Stimulative effect of potassium phosphate on infection of cucumber leaves by conidia of Botrytis cinerea. Ann. Phytopath. Soc. Japan 53(2):175-181.
[https://doi.org/10.3186/jjphytopath.53.175]

-
Katsumi A, Yumiko K, Yasuhide M, Tadakazu W, Keido K, et al., 1981. Morphological studies on infection process of cucumber leaves by conidia of Botrytis cinerea stimulated with various purine-related compounds. Ann. Phytopath. Soc. Japan 47(2):234-243.
[https://doi.org/10.3186/jjphytopath.47.234]

-
Kim CW, Lee ET, Choi IH, Jang YS, Bae S, et al., 2014. Mid-late male sterile line ‘Wonye 30006’ for F1 seed production of onion (Allium cepa L.). Korean J. Breed. Sci. 46(4):428-432. (In Korean)
[https://doi.org/10.9787/KJBS.2014.46.4.428]

- Kim MR, Lee JJ, Min J, Kim SH, Kim DG, et al., 2021. Screening assay for tomato plants resistant to Fusarium oxysporum f. sp. lycopersici race 2 using the expression of the avr2 gene as a selection marker. Korean J. Agric. Sci. 48(1):151-161. (In Korean)
- KOSTAT. 2021. Statistics Korea. http://kostat.go.kr/portal/eng/pressReleases, /. Accessed 19 July 2021.
-
Leach A, Hay F, Harding R, Damann KC, Nault B, 2020. Relationship between onion thrips (Thrips tabaci) and Stemphylium vesicarium in the development of Stemphylium leaf blight in onion. Ann. Appl. Biol. 176(1):55-64.
[https://doi.org/10.1111/aab.12558]

-
Lee JH, Jang KS, Choi YH, Kim H, Choi GJ, 2016. Development of an efficient screening system for resistance of watermelon plants to Didymella bryoniae. Res. Plant Dis. 22(2):72-80. (In Korean)
[https://doi.org/10.5423/RPD.2016.22.2.72]

-
Lee JH, Jang KS, Choi YH, Kim H, Choi GJ, 2017. Development of an effective method for testing resistance to black spot of radish caused by Alternaria brassicicola. Hortic. Sci. Technol. 35(2):210-219. (In Korean)
[https://doi.org/10.12972/kjhst.20170024]

-
Lee SM, Choi YH, Jang KS, Kim H, Lee SW, et al., 2018. Development of an efficient bioassay method for testing resistance to bacterial soft rot of radish. Res. Plant Dis. 24(3):193-201. (In Korean)
[https://doi.org/10.5423/RPD.2018.24.3.193]

-
Lee SM, Choi YH, Kim H, Kim HT, Choi GJ, 2020a. Development of an efficient bioassay method for testing resistance to bacterial soft rot of Chinese cabbage. Res. Plant Dis. 26(3):159-169. (In Korean)
[https://doi.org/10.5423/RPD.2020.26.3.159]

- Lee SM, Choi YH, Kim HT, Choi GJ, 2020b. Development of an efficient screening method for resistance of Chinese cabbage cultivars to black rot disease caused by Xanthomonas campestris pv. campestris. Hortic. Sci. Technol. 38:547-558. (In Korean)
- Lee SM, Lee JH, Jang KS, Choi YH, Kim H, et al., 2020c. Resistance of commercial radish cultivars to isolates of Fusarium oxysporum f. sp. raphani. Hortic. Sci. Technol. 38:97-106. (In Korean)
-
Lee WJ, Lee JH, Jang KS, Choi YH, Kim HT, et al., 2015. Development of efficient screening methods for melon plants resistant to Fusarium oxysporum f. sp. melonis. Hortic. Sci. Technol. 33(1):70-82.
[https://doi.org/10.7235/hort.2015.14101]

-
Mehta YR, 1998. Severe outbreak of Stemphylium leaf blight, a new disease of cotton in Brazil. Plant Dis. 82(3):333-336.
[https://doi.org/10.1094/PDIS.1998.82.3.333]

-
Misawa T, Yasuoka S, 2012. The life cycle of Stemphylium vesicarium, the causal agent of Welsh onion leaf blight. J. Gen. Plant Pathol. 78:18-29.
[https://doi.org/10.1007/s10327-011-0352-8]

- Mishra RK, Gupta RP, 2012. In vitro evaluation of plant extracts, bio-agents and fungicides against purple blotch and Stemphylium blight of onion. J. Med. Plant Res. 6(45):5658-5661.
-
Mishra RK, Jaiswal RK, Kumar D, Saabale PR, Singh A, 2014. Management of major diseases and insect pests of onion and garlic: A comprehensive review. J. Plant Breed. Crop Sci. 6(11):160-170.
[https://doi.org/10.5897/JPBCS2014.0467]

-
Mwakutuya F, Banniza S, 2010. Influence of temperature and wetness periods on the development of Stemphylium blight on lentil. Plant Dis. 94(10):1219-1224.
[https://doi.org/10.1094/PDIS-12-09-0804]

-
Noboru S, Yoshiha W, 1985. Comparison of infection process of Botrytis cinerea on cucumber cotyledon and strawberry petal. Ann. Phytopath. Soc. Japan 51(4):501-505.
[https://doi.org/10.3186/jjphytopath.51.501]

- Paibomesai M, Celetti M, Tesfaendrias M, 2012. Update on Stemphylium leaf blight in onions in Ontario. Hort. Matters. 12:11-12.
-
Park MS, Jeong B, Jang KS, Choi YH, Kim J-C, et al., 2012. Development of efficient screening methods for resistance of tomato to Fusarium oxysporum f. sp. lycopersici. Hortic. Sci. Technol. 30(4):426-431. (In Korean)
[https://doi.org/10.7235/hort.2012.12083]

- Prados-Ligero AM, Melero-Vara JM, Corpas-Hervías C, Basallote-Ureba MJ, 2003. Relationships between weather variables, airborne spore concentrations and severity of leaf blight of garlic caused by Stemphylium vesicarium in Spain. Eur. J. Plant Pathol. 109:301-310.
-
Ryu H, Kim S, Lee H-E, Han JW, Lee J, 2021. Development of single nucleotide polymorphism markers linked to quantitative trait loci controlling anthocyanin content in red bulb onion (Allium cepa L.). Korean J. Breed. Sci. 53(2): 116-126. (In Korean)
[https://doi.org/10.9787/KJBS.2021.53.2.116]

-
Slimestad R, Fossen T, Vangen IM, 2007. Onions. A source of unique dietary flavonoids. J. Agric. Food Chem. 55(25): 10067-10080.
[https://doi.org/10.1021/jf0712503]

-
Sproston T, 1971. An action spectrum for ultraviolet-induced sporulation in the fungus Stemphylium solani Weber. Photochem. Photobiol. 14(5):571-576.
[https://doi.org/10.1111/j.1751-1097.1971.tb06196.x]

-
Stricker SM, Tayviah CS, Gossen BD, Mcdonald MR, 2021. Fungicide efficacy and timing for the management of Stemphylium vesicarium on onion. Can. J. Plant Pathol. 43(2):275-287.
[https://doi.org/10.1080/07060661.2020.1804461]

-
Suheri H, Price TV, 2000. Infection of onion leaves by Alternaria porri and Stemphylium vesicarium and disease development in controlled environments. Plant Pathol. 49(3):375-382.
[https://doi.org/10.1046/j.1365-3059.2000.00458.x]

-
Vloutoglou I, Kalogerakis SN, 2000. Effects of inoculum concentration, wetness duration and plant age on development of early blight (Alternaria solani) and on shedding of leaves in tomato plants. Plant Pathol. 49(3): 339-345.
[https://doi.org/10.1046/j.1365-3059.2000.00462.x]

Jin Ju Lee, Chonnam National University, Ph.D. student, ORICD http;//oricd.org/0000-0002-7100-7053.
Yong Ho Choi, KRICT, Researcher
Hun Kim, KRICT, PhD.
Gyung Ja Choi, KRICT, PhD., ORICD http;//oricd.org/0000-0003-1564-1487.
Jin-Cheol Kim, Chonnam National University, Professor.
Research design: Choi GJ; Investigation: Lee JJ, Choi YH; Data analysis: Choi GJ, Kim H; Writing – original draft preparation: Lee JJ; Writing –review and editing: Choi GJ, Kim JC.

