
Streptomyces globisporus SP6C4 미생물 제형의 딸기 흰가루병과 꽃곰팡이병의 방제효과 검증
초록
딸기는 전 세계적으로 중요한 경제 작물이며 주로 스페인, 중국, 미국, 멕시코, 한국에서 재배되고 있다. 한국에서 딸기의 경제적 가치는 연간 6억 6700만 달러에 육박한다. 최근 딸기의 안정적인 생산에 가장 문제가 되는 병해는 흰가루병과 꽃곰팡이병이다. 현재 흰가루병, 꽃곰팡이병 등에 대한 효과적인 방제법은 드물고, 농약의 효과는 미미하다. 따라서, 새로운 항진균 화합물 또는 생물화합물을 이용한 질병 제어 방법의 개발이 상업적 수준에서 요구되고 있다. Streptomyces globisporus SP6C4는 강력한 항진균 미생물로 보고되었으며 지속 가능한 딸기 생산을 위한 실용적 개발에 관심을 모으고 있다. 따라서, 본 연구에서는 흰가루병과 꽃곰팡이병에 대해 S. globisporus SP6C4의 제형의 병해 방제력을 평가했다. S. globisporus SP6C4 균주의 미생물 제형은 액상형과 분말형으로 진행되었으며, 딸기 재배 포장에서 분말형 미생물 제제는 흰가루병과 꽃곰팡이병의 발생을 효과적으로 억제하였다. 본 연구결과는 생물살균제로 제조된 SP6C4의 사용 범위가 상업적인 수준까지 확장될 수 있음을 보여주었다.
Abstract
Strawberry is a crucial cash crop worldwide and is mainly growing in Spain, China, the United States, Mexico, and Korea. The economic value of strawberries is nearly $ 667 million annually in Korea. Powdery mildew (Sphaerotheca aphanis) and blossom blight (Cladosporium cladosporioides) are the most problematic diseases in the strawberry anthosphere and phyllosphere. Currently, effective control treatments for powdery mildew and blossom blight diseases are rare, and the pesticides have only minimal effects. Therefore, the development of disease control methods with novel antifungal compounds or other biocompounds is demanded commercially. Streptomyces globisporus SP6C4 was reported as a powerful antifungal microbial agent and has gotten attention to developing for commercial proposes for sustainable strawberry production. Therefore, we evaluated formulated S. globisporus SP6C4 against powdery mildew and blossom blight diseases. The microbial formulations of the S. globisporus SP6C4 strain were performed into types A (liquid) and type B (powder). The powder type showed effectively suppressed both powdery mildew and blossom blight diseases in commercial strawberry fields. Our result demonstrated that the range of use of SP6C4 manufactured as a biopesticide can be extended to commercial levels.
Keywords:
Biocontrol, Blossom blight, Eco-friendly, Organic farming, Powdery mildew키워드:
생물적방제, 꽃곰팡이병, 친환경, 유기농, 흰가루병서 론
딸기(Fragaria x ananassa Duch.)는 전세계적으로 널리 재배되는 작물이며 국내 재배면적은 6,462 ha, 생산량은 234,225톤, 생산액이 1조 5,090억 원으로 과채류 생산액의 28.9%로 1위를 차지하여 농가 소득의 매우 중요한 작물이다(KOSIS, 2019). 현재 국내에 지배되고 있는 딸기 주요 품종으로는 설향, 매향, 죽향, 싼타로 전체 국내 딸기 재배의 96%를 차지하고 있으며, 그 중 설향 품종이 87.7%로 가장 많은 비중을 차지하고 있다. 시설재배 딸기의 주요 지상부 병해로서는 탄저병(Collectotrichum gloesporioides), 흰가루병(Sphaerotheca aphanis), 잿빛곰팡이병(Botrytis cinerea), 꽃곰팡이병(Cladosporium cladosporioides) (Kim et al., 2015; Kahramanoğlu et al., 2022; Jacobs et al., 2019; Nam et al., 2015a) 등이 있으며, 지하부의 주요 병해로서는 Phytophthora fragariae에 의해서 발생하는 역병, Fusarium oxysporum f. sp. fragariae에 의해 발생하는 시들음병(위황병) 등이 딸기 생산에 큰 피해를 끼치고 있다(Kim et al., 2015; Kwon et al., 2020).
딸기 꽃곰팡이병은 미국 캘리포니아에서 처음 보고되었으며(Gubler et al., 1999), 한국에서는 2015년에 보고가 되었다(Nam et al., 2015b). 꽃곰팡이병은 병의 확산이 빨라 방제가 어려우며, 꽃의 수정 불량을 야기하여 기형과 발생의 한 원인으로 알려져 있다(Nam et al., 2015b). 꽃곰팡이병은 주로 암술과 꽃받침에서 발생하며 암술머리 부분에 회색 곰팡이가 발생하고 감염이 심한 경우 꽃 전체가 검게 마르면서 썩게 된다(Santos et al., 2020). 꽃곰팡이병을 방제하기 위해 흰가루병과 탄저병에 등록된 약제를 예방차원 살포하여 대체하는 경우가 대부분이다(Nam et al., 2015b). 딸기꽃곰팡이병에 대하여서는 뚜렷한 방제법이 확립되어 있지 않아, 딸기 생산에 어려움을 겪고 있는 실정이다.
딸기 품종 중 ‘설향’은 다른 품종에 비해 비교적 내병성으로 알려져 있지만 육묘 초기와 수확 후기에 잎과 과실에서 흰가루병의 발생이 지속적으로 증가하고 있다(Nam et al., 2009). 흰가루병은 활물기생균으로 다양한 작물에 발생하며, 잎과 과실에서 주로 발병한다(Shin et al., 2020). 과실에서는 표면에 하얀 이슬 같은 균총을 형성하며, 미숙과에서 발생하였을 때 균총이 있는 부위에서는 생육을 저하시키며 과실 모양이 비뚤어져 상품가치를 현저하게 저하시킨다(Pertot et al., 2008). 딸기 흰가루병은 주로 화학농약으로 방제하고 있지만 약제에 대한 내성병원균의 출현으로 방제에 어려움을 겪고 있다(Shin et al., 2020). 화학적 방제의 경우 재배환경에 따라 약해가 발생하기도 하며, 농약 잔류 문제로 인해 소비자들의 친환경 농산물에 대한 선호도가 증가하면서 인축 독성이 낮고 잔류 문제가 적은 생물농약의 개발이 요구되고 있다(Sharma and Singhvi, 2017). 이러한 문제점을 해결하기 최근 자연계에 존재하는 미생물을 이용한 미생물제 제 개발 및 연구가 이루어지고 있다(Park et al., 2018).
유용 미생물은 작물의 생장 촉진, 품질향상 및 병해충 방제 등과 같은 다양한 목적으로 활용이 시도되고 있으며, 농업현장에서 사용될 수 있도록 실용화 기술 개발이 진행되고 있다(Naik et al., 2020). 미생물제제로 활용되는 주요 균주는 고초균(Bacillus spp.), 녹농균(Pseudomonas spp.), 방선균(Streptomyces spp.) 등이 있으며, 최근 다양한 2차 대사산물을 생산하는 것으로 알려져 있는 방선균의 농업적 활용연구가 활발히 이루어지고 있다(Ramakrishnan et al., 2011; Zamoum et al., 2017). 방선균은 다양한 항균 물질생산, 분비를 통해 병원균의 성장 억제 및 살균 작용을 나타내며 기주의 병해에 대한 피해를 경감시키는 효능이 알려져 있다(Horinouchi and Beppu, 1992).
본 연구는 선행연구를 통해 딸기 꽃곰팡이병에 대해 우수한 항진균력을 가지는 S. globisporus SP6C4(Kim et al., 2021)의 제형화를 통해 딸기 꽃곰팡이병과 흰가루병을 대상으로 딸기 재배 현장에서의 방제 효과를 평가하기 위해 수행되었다.
재료 및 방법
S. globisporus SP6C4의 항균 활성 검증
상업용 배지조성(기업비밀유지로 인해 배지조성 및 공법 미공개)에서 배양된 Streptomyces globisporus SP6C4를 이용하여 딸기의 주요 병원균 4종(B. cinerea, C. gloeosporioides, F. oxysporum, P. cactorum)에 대한 항균 활성 검정을 검증하였다(Ahn et al., 2009). 72종의 산업용 배지 조합에서 배양된 SP6C4 균주를 병원균과 대치 배양을 진행하였다. 대치배양은 PDK (Potato Dextrose Broth 10 g, Peptone 10 g, Agar, 20 g per L)를 사용하였으며, 배양기 중앙으로부터 3 cm 떨어진 위치에 네 방향으로 paper disc (8-mm, Advantech, Taipei City, Taiwan)을 고정한 후 106 cfu/mL로 희석된 미생물 제제를 20 μL 분주 후 28oC 조건으로 5일간 배양하였다. 네 방향으로 5일간 배양된 미생물 제제의 중심부분에 B. cinerea, C. gloeosporioides, F. oxysporum, P. cactorum 균사가 성장된 0.4 cm 크기의 균총을 접종하였다. 항균력 검증은 대조구의 균사가 paper disc에 닿을 때까지 28oC에서 배양하여 생성된 생육 저지대(growth inhibition clear zone)의 길이를 통해 검증하였다(Yilmaz et al., 2016; Lee et al., 2008; Perumal et al., 2016; Redda et al., 2018).
총 72 종의 배지조성에서 최종적으로 선발된 배지를 사용하여 S. globisporus SP6C균주를 배양하였으며, 배양된 SP6C4는 액상(AS), 분말(SM) 제형으로 생산하였다. 액상(AS)과 분말(SM)의 제형별 항균활성 검증은 위의 방법과 동일하게 진행하였다. 대조구로는 살균수를 20 μL 분주한 paper disc (8 mm, Advantech, Taipei City, Taiwan)를 사용하였다.
미생물 제형의 온도별 경시 변화 조사
액상(AS)과 분말(SM) 미생물 제형의 보관 온도에 따른 균주의 보존 안정성을 조사를 하고자 생물농약의 경시 변화시험기준에 따라 안정성을 평가하였다. Conical tube (50 mL)에 액상제형 25 mL, 분말제형 25 g을 각각 담아 저온(0 ± 2oC), 상온(24 ± 2oC), 고온(54 ± 2oC)에 각각 보관 후 1주 간격으로 총 4주 동안 PDK 배지에 희석평판법을 이용하여 생균수를 측정하였다. 생균수 측정 후, 미생물 제제의 제형 형태와 온도의 유의성 분석으로 Welch’s t-test를 진행하였으며 분석이 완료된 결과 값은 R program (version 4.0.3)의 ggplot2 package를 사용하여 분석 및 시각화를 수행하였다.
SP6C4 분말 제형을 이용한 작물의 약해 시험
미생물 제형의 현장 적용을 위해 분말 제형에 대하여 약해 시험을 딸기에 경엽 살포 평가를 수행하였다. 본 시험에는 설향 품종에 SP6C4 제제를 처리하였다. 처리구별 15개체의 딸기를 대상으로 진행되었으며, 처리 방법으로는 S. globisporus SP6C4의 분말 제형을 109 cfu/mL으로 희석한 약제를 약제 분무기를 이용하여 경엽에 약제가 흐를 정도로 살포하였다. 경엽 살포 후 7일 간격으로 잎의 붉은색 반점, 괴사 증상 및 생육 저해에 따른 약해 지수 조사를 2회 진행하였다. 약해지수는 약해가 없을 때 0, 작은 반점이 보였을 때 1, 처리된 잎의 10% 이하 부분으로 약해가 인정되었을 때 2, 처리된 잎의 30% 정도 약해가 인정되었을 때 3, 잎의 50% 이상 상당한 피해를 받았을 때 4, 심한 약해 및 고사상태 일 때를 5로 설정하여 진행하였다.
분말 제형의 딸기 꽃곰팡이병과 흰가루병 약효 검증을 위한 포장 실험
분말 제형의 꽃곰팡이병과 흰가루병 방제 효과는 2022년도에 경남 사천시 용현면에 위치한 딸기 농가(설향 품종)에서 검증하였다. 대조구로는 동일한 량의 희석액만을 처리하였다. 처리 방법으로는 분말 제형을 106 cfu/mL으로 희석하여 처리하였으며, 처리구의 경우 1회 처리와 3일 간격으로 3회 경엽처리 하였다. 각 처리구 별 3개의 무작위 시험구(Length = 5 meter)을 지정하였고, 각 시험구 당 30주의 딸기를 대상으로 진행하였다. 최종 약제처리 후 3일, 5일, 7일 경과 후 발병도를 조사하여 분말 제형의 병방제 약효를 평가하였다. 약효 검정 시 흰가루병에 대해서는 발병도(Disease index, DI)를 조사하여 검증하였다. 잎에서 발생하는 흰가루병의 발병도를 기준으로 하여 병이 발생하지 않았을 때 0, 옆당 발병률이 2에서 10%의 발병도를 1, 발병률이 11에서 25% 일 때의 발병도를 2, 26에서 50% 일 경우 3, 51%에서 75% 일 때 4, 76% 이상일 때를 5로 결정하였다(Tapia et al., 2022).
꽃곰팡이병의 발병률(%)은 한 기주의 전체 꽃 중 암술과 수술에서 회색 곰팡이가 자라며 일그러지거나 기형의 과실을 나타나는 꽃의 개수로 결정하였다(Kim et al., 2021). 조사 후 병 방제 효과의 유의성 분석으로 Kruskal-Wallis Rank Sum Test를 진행하였으며 사후 분석으로 Tukey’s honestly significant difference test를 진행하였다. 분석이 완료된 값은 R program (version 4.0.3)의 ggplot2 package를 사용하여 시각화를 수행하였다.
Disease index calculation
*a, b, c, d, e: number of leaves
결과 및 고찰
배지별 SP6C4 제제의 항균 활성 검증
72종의 배양 배지별 시료 모두 B. cinerea, C. gloeosporioides, F. oxysporum, P. cactorum에 대하여 일정 수준이상의 항균활성 효과를 보였다(data not shown). 또한 S. globisporus SP6C4는 선행 연구된 결과와 유사한 항균활성을 띄는 것을 확인하였다. SP6C4 균주는 F. oxysporum과 B. cinerea에 대해 강력한 항진균력을 가진 것으로 보고가 되어 있기에(Cha et al., 2016; Kim et al., 2019), F. oxysporum에서 가장 높은 항진균력을 가진 시료를 선발하여 그 중 상위 10개의 시료는 J5-1, J5-2, J6-2, M1-2, M3-2, P2-1, S2-1, T1-1, T2-1, T3-2으로 선발하였다(Table 1).
SP6C4미생물 제형 형태에 따른 항균활성 검증
액상과 분말 형태로 제작된 미생물의 항균활성 능력을 검증하고자 4종의 식물 진균성 병원균과 대치 배양을 진행하였다(Fig. 1). 액상제형의 SP6C4는 각 병원균에 대하여 다음과 같은 항진균력을 나타내었다: B. cinerea (44.5%), C. gloeosporioides (66.6%), F. oxysporum (56.6%), P. cactorum (72.7%). 분말제형은 B. cinerea (55.1%), C. gloeosporioides (69.2%), F. oxysporum (54.9%), P. cactorum (78.45%) 병원균의 생장을 효과적으로 억제하였다. 이를 통하여 두 가지 제형으로 제작된 S. globisporus SP6C4 미생물은 4종의 식물 병원균에 대하여 생장 억제 효과를 보였으며 액상 형태와 분말 형태 간에 유의미한 차이는 보이지 않음을 확인하였다. 두 가지 제형에서 뚜렷한 항균활성이 확인되었기에 S. globisporus SP6C4의 액상 제형과 분말 제형은 미생물 제제 연구개발에 활용 가능성을 확인하였다.
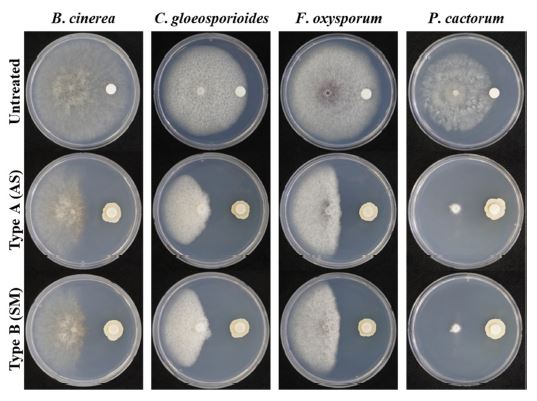
Antifungal activity test of Type A (AS, liquid) and Type B (SM, powder) S. globisporus SP6C4 formulations against the B. cinerea, C. gloeosporioides, F. oxysporum, and P. cactorum by disk diffusion assay. Formulations (106 cfu/mL) were pre-inoculated with 20 μL of PDK media and incubated for 5 days at 28 ºC. After 10 days, a pathogen (0.4-cm diam.) was inoculated at the center of the plate and incubated at 28ºC for 10 days (n = 3).
SP6C4미생물 제제의 온도별 경시 변화 조사
제형 형태에 따라 S. globisporus SP6C4의 경시 변화 조사하기 위해 저온(0 ± 2oC), 상온(24 ± 2oC), 고온(54 ± 2oC)를 보관 온도로 하여 4주간 보존율을 확인하였다. 액상 제형은 저온(0 ± 2oC) 보관에서 평균 109 cfu/g으로 유지가 되었으며, 상온(24 ± 2oC)에서는 1주차 까지 생균수가 평균 109 cfu/g 유지되었다. 액상 제형의 보관은 저온(0 ± 2oC)에서 4주 경과 후에도 90%이상의 보존율을 확인하였다(Fig. 2). 하지만 2주차부터 SP6C4의 밀도가 급격히 저하되었다. 또한 고온(54 ± 2oC)에서는 1주차부터 생균수가 유지되지 않았다(Fig. 2).
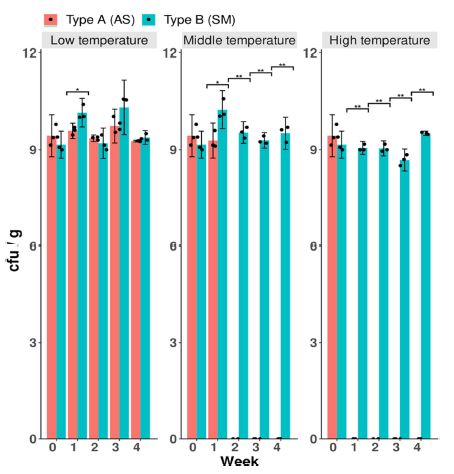
Stability and conservativeness of Streptomyces globisporus SP6C4 liquid (Type A) and powder (Type B) formulations under different storage conditions. The formulations were incubated at different temperatures for 4 weeks. Low temperature, 4 ± 2ºC; Middle temperature, 24 ± 2ºC; High temperature, 52 ± 2ºC. Welch’s t-Test and bar graph were calculated with the ggplot2 package of the R (4.0.3).
분말 제형은 액상 제형과 동일한 온도에서 미생물제형의 안정성 평가를 진행하였다. 저온(0 ± 2oC), 상온(24 ± 2oC), 고온(54 ± 2oC)에서 각각 평균 109 cfu/g의 생균수가 조사되었으며, 초기 분말 제형은 4주 경과 후에도 모든 온도에서 90%이상의 보존율을 나타냈다(Fig. 2). 분말 제형은 모든 온도에서 90% 이상 보존율을 확인하였지만 액상 제형은 상온과 고온에서 생균수가 유지되지 않는 것을 확인하였다. 두가지 제형 형태의 온도에 따른 차이를 확인하기 위해 Welch’s t-Test를 통해 분석하였을 때, 상온과 고온에서 제형의 형태별 생균수의 차이가 유의한 것을 확인하였다. 이러한 결과는 액상 제형이 고온에서 제형의 색상의 변화로 인해 발생한 결과라고 여길 수 있으며, 본 결과를 통해 분말 제형이 이후 실험에 사용이 적합하다고 판단하였다(Fig. 3).

Effect of temperature on the storage stability of two microbial formulations. (A): Condition of before application, (B): Condition of after application, (C): Concentration of after application, colony-forming units in PDK media. The formulations were incubated at different temperatures for 4 weeks. Low temperature, 4 ± 2ºC; Middle temperature, 24 ± 2ºC; High temperature, 52 ± 2ºC.
분말 제형을 이용한 작물의 약해 시험
제작된 S. globisporus SP6C4의 분말 제형의 경엽 살포에 따른 딸기에 대한 약해 유무를 확인하였다. 경엽 살포 후 7일 경과 뒤 작물의 경엽의 외관상 약해 유무를 조사한 결과, 옆의 붉은색 반점 여부, 경엽의 고사여부 및 기타 발육 생육상태 불량과 같은 약해 증상은 나타나지 않았다(Fig. 4). 또한 처리를 하지 않은 무처리구와 비교를 하였을 때 차이가 나지 않음을 확인하였다. 이를 통해 미생물 제형을 현장적용 하는데 있어 작물에 대한 약해가 발생하지 않음을 확인하였다.
분말 제형의 딸기 흰가루병, 꽃곰팡이병 약효 검증을 위한 포장실험
딸기에서 발생되는 흰가루병은 기주식물을 고사시키지 않지만, 생장의 불균일, 양분 탈취 등을 통해 품질 및 생산량을 감소시키는 것으로 여겨진다(Lee et al., 2018). 그리고 꽃곰팡이병은 발생된 꽃의 80% 이상의 기형과 발생율을 보이는 것으로 알려져 있다(Nam et al., 2015a). 이에 S. globisporus SP6C4균주의 분말 제형을 이용한 흰가루병과 꽃곰팡이병 방제 효과 시험을 통해 딸기의 주요 병해에 대한 미생물제제로서 가능성을 확인하고자 하였다. 먼저, 흰가루병의 병징이 확인된 딸기에 처리하였을 때, 3일차에서는 두 처리구 모두 대조구 대비 유사하게 보였지만, 7일차, 10일차에서는 1회 처리구와 3회 처리구 모두에서 처리를 하지 않은 대조구에 비해 높은 효과를 나타내었다(Fig. 5. A - C). 3회 처리구에서 10일차에 약제처리구에서는 발병도가 1 이하였으나, 무처리구에서는 발병도 4가 관찰되었다. 꽃곰팡이병 또한 처리구에서 대조구 보다 높은 방제 효과를 보였다(Fig 5. D - F). 3회 처리구에서 10일후 꽃곰팡이병의 발병도는 무처리구에서 50% 이상 발병하였으나, 처리구에서는 7% 미만으로 발병되었다. 각 처리구별 유의성을 확인하기 위해 Kruskal-Wallis Rank Sum Test를 진행하였고, 결과 값으로 P 값이 두 병해에서 0으로 0.05보다 낮은 값을 나타내 처리구별 차이를 가진다고 확인하였다. 그리고 사후 분석으로 Tukey HSD (Tukey’s honestly significant difference test)를 통해 분석하였을 때 미생물 제제를 처리 유무에서 P 값이 0.001보다 낮은 것으로 확인하여 미생물 제제를 사용한 처리구와 처리하지 않은 처리구가 차이가 유의미한 것을 확인하였다(Fig. 5. C and F). 이를 통해 S. globisporus SP6C4 미생물 제제의 적용대상 작물병의 확장 가능성을 넓힐 가능성을 확립하였다.
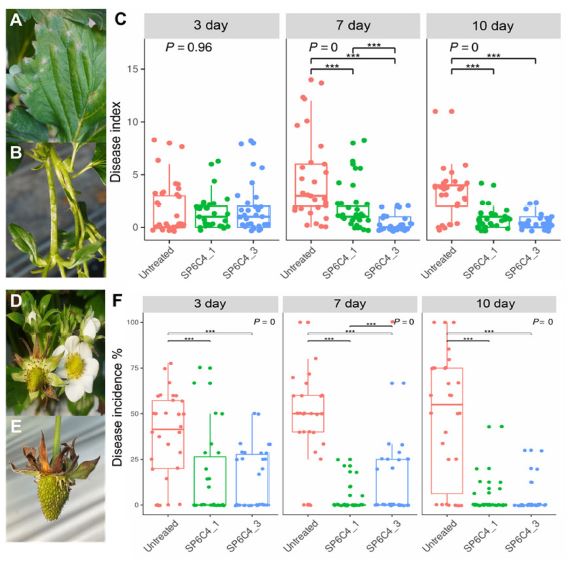
Biological control effect by Type B (MS) formulations against Powdery mildew and Blossom blight in the field. (A): Powdery mildew on leaves, (B): Powdery mildew symptom on the stem, (C): Effect of formulations on powdery mildew, (D): Blossom blight on flower, (E): Blossom blight symptom on fruit, (F): Effect of formulations on blossom blight (n = 30 in each block, three randomly designed). The low incidence of blossom blight was < 20%, and the high incidence was 21 to 30%. And Powdery mildew disease was translated into disease index levels from 0 to 5 as follows: 0 for 0%, 1 for 2-10%, 2 for 11-25%, 3 for 26-50%, 4 for 51-75% and 5 for up to 76%. Boxplot with Kruskal-Wallis Rank Sum Test and Tukey’s honestly significant difference test were calculated with the ggplot2 package of the R (4.0.3).
첫 번째 포장실험을 통해 미생물 제제 무처리구 보다 처리구에서 두 병에 대해 억제하는 효과를 확인하였다. 이러한 효과를 재검증하기 위해 재진행하였고, 꽃곰팡이병에서 첫 번째 실험과 유사한 결과값을 확인하였지만(Fig. 6), 재검증 기간동안 흰가루병에 대해서는 병 발생 시기와 맞지 않아 흰가루병의 병징을 포장에서 확인하지 못하였다. 이로인해 흰가루병에 대한 재검증은 불가능하였지만 Fig. 5의 A - C의 흰가루병에 대한 in vivo 실험을 통해 친환경적인 농업 미생물제제로의 가능성을 확립하였고, 향후 지속적인 연구개발 및 농가 현장 적용을 통해 친환경 미생물 농약으로 가치를 구축할 예정이다.
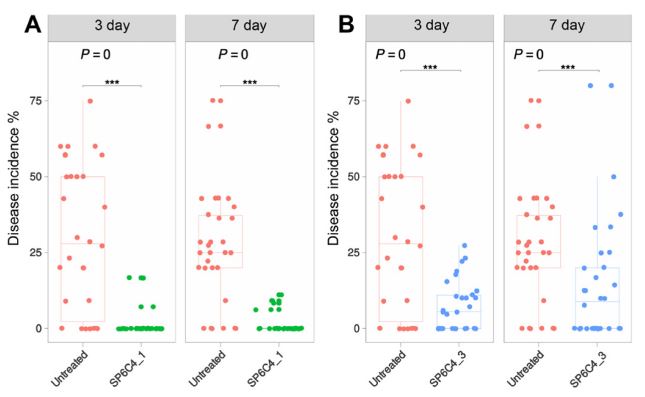
Biological control effect by Type B (MS) formulation against blossom blight in the fields. (A): Result of blossom blight one time treated, (B): Result of blossom blight triple times treated (n = 30 in each block, three randomly designed). The low incidence of blossom blight was < 20%, and the high incidence was 21 to 30%. Boxplot with Student’s t-test and Tukey’s honestly significant difference test were calculated with the ggplot2 package of the R (4.0.3).
Acknowledgments
본 연구는 농촌진흥청의 연구과제(PJ016437)의 지원으로 수행되었습니다.
References
-
Ahn SJ, Lee SJ, Kook JK, Lim BS, 2009. Experimental antimicrobial orthodontic adhesives using nanofillers and silver nanoparticles. Dent. Mater. 25(2):206-213.
[https://doi.org/10.1016/j.dental.2008.06.002]

-
Cha JY, Han SJ, Hong HJ, Cho HJ, Kim DR, et al., 2016. Microbial and biochemical basis of a Fusarium wilt-suppressive soil. ISME J. 10(1):119-129.
[https://doi.org/10.1038/ismej.2015.95]

-
Gubler WD, Feliciano AJ, Bordas AC, Civerolo EC, Melvin JA, et al., 1999. First report of blossom blight of strawberry caused by Xanthomonas fragariae and Cladosporium cladospioides in California. Plant Dis. 83(4):400-400.
[https://doi.org/10.1094/PDIS.1999.83.4.400A]

-
Horinouchi S, Beppu T, 1992. Autoregulatory and communication in actinomycetes. Annu. Rev. Microbiol. 46(1):337-392.
[https://doi.org/10.1146/annurev.mi.46.100192.002113]

-
Lee DY, Jo HJ, Jeong DK, Goo YM, Hwang MR, et al., 2018. Residual characteristics of pesticides used for powdery mildew control of greenhouse strawberry. J. Agric. Life Sci. 52(2):99-106.
[https://doi.org/10.14397/jals.2018.52.2.99]

-
Lee YS, Kim J, Shin SC, Lee SG, Park IK, 2008. Antifungal activity of Myrtaceae essential oils and their components against three phytopathogenic fungi. Flavour. Fragr. J. 23(1):23-28.
[https://doi.org/10.1002/ffj.1850]

-
Naik K, Mishra S, Srichandan H, Singh PK, Choudhary A, 2020. Microbial formulation and growth of cereals, pulses, oilseeds and vegetable crops. Sustain. Environ. Res. 30(10).
[https://doi.org/10.1186/s42834-020-00051-x]

- Nam MH, Kim HS, Kim TI, Lee EM, Kim HG, 2015a. Influence of malformed fruits formation by blossom blight disease and fungicide formulations on strawberry plants. Kor. J. Hort. Sci. 110-110.
- Nam MH, Nam YG, Kim TI, Kim HS, Jang WS, et al., 2009. Compendium of strawberry diseases and pests. Chungnam strawberry association, Nonsan, Korea. pp. 204.
-
Nam MH, Park MS, Kim HS, Kim TI, Kim HG, 2015b. Cladosporium cladosporioides and C. tenuissimum cause blossom blight in strawberry in Korea. Mycobiology 43(3):354-359.
[https://doi.org/10.5941/MYCO.2015.43.3.354]

-
Park JK, Seo SI, Han GH, Kim KM, Kim DH, et al., 2018. Development of microbial formulation and biological properties using Bacillus velezensis GH1-13. KSBB J. 33(4):237-246.
[https://doi.org/10.7841/ksbbj.2018.33.4.237]

-
Pertot I, Zasso R, Amsalem L, Baldessari M, Angeli G, et al., 2008. Integrating biocontrol agents in strawberry powdery mildew control strategies in high tunnel growing systems. Crop Prot. 27(3-5):622-631.
[https://doi.org/10.1016/j.cropro.2007.09.004]

-
Perumal AB, Sellamuthu PS, Nambiar RB, Sadiku ER, 2016. Antifungal activity of five different essential oils in vapour phase for the control of Colletotrichum gloeosporioides and Lasiodiplodia theobromae in vitro and on mango. Int. J. Food Sci., 51(2):411-418.
[https://doi.org/10.1111/ijfs.12991]

-
Ramakrishnan J, Balakrishnan H, Raja STK, Sundararamakrishnan N, Renganathan S, et al., 2011. Formulation of economical microbial feed using degraded chicken feathers by a novel Streptomyces sp.: mitigation of environmental pollution. Braz. J. Microbiol. 42(3):825-834.
[https://doi.org/10.1590/S1517-83822011000300001]

- Redda ET, Ma J, Mei J, Li M, Wu B, et al., 2018. Antagonistic potential of different isolates of Trichoderma against Fusarium oxysporum, Rhizoctonia solani, and Botrytis cinerea. Eur. J. Exp. Biol. 8(2):1-8.
-
Santos A, Rocha Sobrinho GG, Mesquita NLS, Novaes QS, de Oliveira RJV, et al., 2020. First report of Cladosporium tenuissimum causing blossom blight on strawberry in Brazil. Plant Dis. 104(9):2519.
[https://doi.org/10.1094/PDIS-11-19-2499-PDN]

-
Sharma N and Singhvi R, 2017. Effects of chemical fertilizers and pesticides on human health and environment: a review. Int. J. Agric. Environ. Biotechnol. 10(6):675-680.
[https://doi.org/10.5958/2230-732X.2017.00083.3]

-
Shin J, Chang YK, Heung B, Nguyen-Quang T, Price GW, et al., 2020. Effect of directional augmentation using supervised machine learning technologies: A case study of strawberry powdery mildew detection. Biosyst. Eng. 194:49-60.
[https://doi.org/10.1016/j.biosystemseng.2020.03.016]

-
Jacobs RL, Adhikari TB, Pattison J, Yencho GC, Femandez GE, et al., 2019. Inheritance of resistance to Colletorichum gloeosporioides and C. acutatum in strawberry. Phytopathology 109(3):428-435.
[https://doi.org/10.1094/PHYTO-08-18-0283-R]

-
Kahramanoğlu I, Panfilova O, Kesimci TG, Bozhüyük AU, Gürbüz R, et al., 2022. Control of postharvest gray mold at strawberry fruits caused by Botrytis cinerea and improving fruit storability through Origanum onites L. and Ziziphora clinopodioides L. volatile essential oils. Agronomy 12(2):389.
[https://doi.org/10.3390/agronomy12020389]

-
Kim DR, Cho GJ, Jeon CW, Weller DM, Thomashow LS, et al., 2019. A mutualistic interaction between Streptomyces bacteria, strawberry plants and pollinating bees. Nat. Commun. 10(4802).
[https://doi.org/10.1038/s41467-019-12785-3]

-
Kim DR, Gang GH, Cho HJ, Yoon HS, Kwak YS, 2015. Evaluation of antimicrobial activity and disease control efficacy of sodium dichloroisocyanurate (NaDCC) against major strawberry disease. Korean. J. Pestic. Sci. 19(1):47-53.
[https://doi.org/10.7585/kjps.2015.19.1.47]

-
Kim DR, Jeon CW, Cho GJ, Thomashow LS, Weller DM, et al 2021. Glutamic acid reshapes the plant microbiota to protect plants against pathogens. Microbiome 9(244).
[https://doi.org/10.1186/s40168-021-01186-8]

-
Kwon SK, Jeon CW, Nam MH, Kwak YS, 2020. Evaluation of fungicides sensitivities of strawberry wilt disease pathogen, Fusarium oxysporum f. sp. fragariae. Korean J. Pestic. Sci. 24(1):34-42.
[https://doi.org/10.7585/kjps.2020.24.1.34]

-
Tapia R, Abd-Elrahman A, Osorio L, Whitaker VM, Lee SH, 2022. Combining canopy reflectance spectrometry and genome-wide prediction to increase response to selection for powdery mildew resistance in cultivated strawberry. J. Exp. Bot.
[https://doi.org/10.1093/jxb/erac136]

- Yilmaz A, Ermis E, Boyraz N, 2016. Investigation of in vitro and in vivo anti-fungal activities of different plant essential oils against postharvest apple rot diseases-Colletotrichum gloeosporioides, Botrytis cinerea and Penicillium expansum. J. Food Saf. 67(5):122-131.
-
Zamoum M, Goudjal Y, Sabaou N, Mathieu F, Zitouni A, 2017. Development of formulation based on Stretpoymces rochei strain PTL2 spores for biocontrol of Rhizoctonia solani damping-off of tomato seedings. Biocontrol Sci. Technol. 27(6):723-738.
[https://doi.org/10.1080/09583157.2017.1334257]

- Korea Statistical Information Service (KOSIS). 2019. 2018 the production of vegetable. http://kosis.kr, .
Su In Lee, Division of Applied Life Science (BK21Plus), Gyeongsang National University, Graduate student
Gun Young Han, Research Institute of Life Science, Gyeongsang National University, Researcher
Da-Ran Kim, Research Institute of Life Science, Gyeongsang National University, Researcher Professor, http://orcid.org/0000-0003-3460-901X
Youn-Sig Kwak, Research Institute of Life Science, Gyeongsang National University, Professor, http://orcid.org/0000-0003-2139-1808


