2종 모기를 이용한 공간형 기피제 평가 시험법 개발
 ; Yu No Lee ; Yeol Gyu Kang ; Seung-Ju Seok ; Jong Chan Jeon ; Hyun Kyung Kim ; Gil-Hah Kim*
; Yu No Lee ; Yeol Gyu Kang ; Seung-Ju Seok ; Jong Chan Jeon ; Hyun Kyung Kim ; Gil-Hah Kim*
초록
공간형 기피제의 효율적인 평가를 위한 실내시험법(in vitro method)과 실외시험법(semi-field method)을 개발하고자 하였다. 기본적으로 모기와 인체의 접촉을 차단하여 안전성을 확보하고 실질적으로 물질의 효과를 확인할 수 있도록 하였다. 실내시험법은 기존의 시험법을 변형하고 직접적인 인체접촉을 피하여 단시간안에 물질의 활성을 평가할 수 있는 방법으로 개발하였다. 실외시험법의 경우, 공간형 기피제의 특성상 야외에서 사용이 되므로 공간적인 요인과 시간적인 요인을 고려하여 실험할 수 있도록 하였다. 특히, 인체접촉을 피하기 위하여 유인요인으로 쥐와 드라이아이스, 젖산 등을 이용하여 안전하며 효과적으로 평가할 수 있도록 개발하고자 하였다. 따라서 본 실험은 흰줄숲모기(Aedes albopictus)와 빨간집모기(Culex pipiens)를 이용하여 개발된 평가방법의 이용가능성을 탐색하고자 하였다.
Abstract
This study was to develop an indoor method and a semi-field method for the efficient evaluation of spatial repellents. The test methods were designed to secure safety by protecting contact between mosquitoes and the human body and to confirm the effect of repellents. The indoor test method was modified from prior test method to avoid direct human contact and to should evaluate the activity of repellent in a short time. The semi-field test method is a characteristic of spatial repellents used outdoors, so that the experiment could be carried out in consideration of spatial and temporal factors. In particular, we tried to develop a safe and effective way to evaluate repellency using mouse, dry ice and lactic acid instead of human as attractants. Therefore, this experiment researched the applicability of the evaluation method developed using Aedes albopictus and Culex pipiens.
Keywords:
Aedes albopictus, Culex pipiens, Spatial repellent, Indoor method, Semi-field method키워드:
흰줄숲모기, 빨간집모기, 공간형 기피제, 실내시험법, 실외시험법서 론
모기는 인간에게 다양한 질병을 전파하는 가장 중요한 매개체 중 하나로 전세계적으로 널리 분포하고 있다(Gubler, 2002; McGraw and O’Neill, 2013). 이들을 방제하기위한 가장 기본적인 방제전략은 살충제를 이용하여 모기의 밀도를 감소시키는 것이나 야외활동을 위해서는 모기의 접근을 차단하여 모기의 흡혈을 막는 기피제의 사용을 권고하기도 한다(Goodyer et al., 2010; Durncz and Cooscmans, 2013; Debboun and Strickman, 2013). DEET (N,N-diethyl-m-toluamide)가 가장 일반적으로 사용되는 기피제품의 성분이며, IR3535, picaridin, citronella oil 등이 사용되고 있다(Moore and Debbounm, 2007; Van Roey et al., 2014).
기피제품 중에서도 피부에 직접처리하는 것과 공간형 기피제가 사용되고 있다(EPA, 2022). 공간형 기피제의 효과는 실내시험법과 실외시험법 등을 이용하여 숙주에 대한 유인억제효과 즉 기피효과의 평가가 이루어진다(WHO, 2013). 실내실험법은 짧은시간 내에 화합물의 효과를 검정할 수 있다는 장점이 있으나 야외 환경조건과 공간에 대한 요소가 부족한 것이 단점이 될 수 있다. 그러나, 실내시험법 중 실린더를 이용한 high-throughput screening system (HITSS)은 10분정도 처리시간으로 기피평가를 수행하였고, Y-tube olfactometer를 이용한 기피실험은 화합물을 30초처리 후 기피활성을 평가하여 짧은 시간에 활성평가가 이루어질 수 있다는 장점이 있다(Geier, 1995; Grieco et al., 2005; WHO, 2013). 공간적인 요소를 포함한 실내실험으로는 release-in-cage bioassay와 skin test, patch test 등으로 일반적인 기피활성뿐만 아니라 모기 붙음(landing), 흡혈(blood sucking) 등을 조사할 수 있으나 이들 역시 유인원(attractant)으로 직접적인 신체의 접촉 및 유사 접촉을 통한 시험법으로 질병감염의 위험성이 있다(Schreck et al., 1977; Frances et al., 1996; Kim et al., 2004). 실외시험법 중 semi-field test는 보다 환경적 요인과 공간적 요소를 포함하여 기피활성을 측정하는 방법으로 최대한 외부 환경과 유사한 조건에서 유인원으로 인간 또는 동물을 이용하여 직접적으로 human-landing catch methods와 같은 방법으로 기피활성을 조사하는 것이다(Ferguson et al., 2008; Kitau et al., 2010; WHO, 2013). 그러나 이들 역시 유인원으로 인간 또는 동물을 이용하여 직접적인 접촉을 해야한다는 단점과 정확한 모기 수 측정이 어렵다는 단점이 있다. 따라서 공간형기피물질 및 제품의 효율적인 평가를 위해서는 공간적인 요소와 시간적인 요인, 환경적 요인, 안전성 등을 고려한 실내 및 실외시험법이 필요한 실정이다.
본 실험은 흰줄숲모기(Aedes albopictus)와 빨간집모기(Culex pipiens)를 이용하여 안전하고 효과적인 공간형 기피제품의 기피효과평가법을 개발하고자 하였다.
재료 및 방법
모기
흰줄숲모기와 빨간집모기는 충북대학교 곤충생태독성학 실험실에서 8년간 어떤 살충제의 처리없이 계대사육하였다. 사육용기벽에 필터페이퍼를 붙여 고정하여 알을 받았고, 유충은 치어사료를 먹이로 공급하였다. 성충은 사육상(30 × 30 × 30 cm)에서 5%의 설탕물과 흡혈을 위해 쥐를 공급해 주었다. 실험에 사용된 모기는 우화한 후 1-2주된 암컷 모기만을 선별하여 12시간동안 설탕물을 제거한 후 실험을 진행하였다. 모기의 사육과 실험은 온도 28 ± 1oC, 광주기 12L: 12D, 습도 70 ± 10%의 조건에서 수행되었다.
화합물과 유인원
기피물질로서 DEET (97%)는 Sigma-Aldrich (St. Louis, MO)에서 구매하였고, 시트로넬라오일(citronella oil)은 French Korean Aromatics Co. (㈜한불화농)에서 구입하였다. IR3535 (ethyl butylacetylaminopropionate, 95%)는 Combi-Blocks Inc. (San Diego, USA)에서 구입하였다.
유인원으로 쥐(mouse, Rattus norvegicus)와 드라이아이스(dry ice), 젖산(lactic acid, Sigma-Aldrich)을 구입하여 사용하였다.
공간형 기피제 평가법
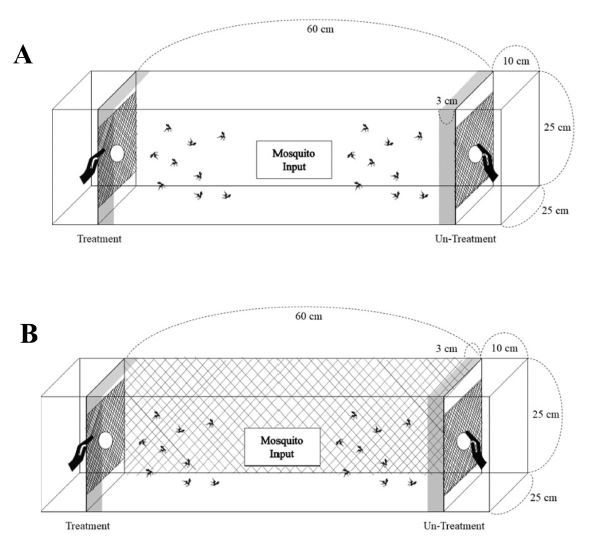
실내시험법은 기존의 피부 및 패치실험(skin and patch test) 방법을 참고하여 시험법을 수정하였다(Kim et al., 2004). 간략히 설명하면, 아크릴케이지(60 × 25 × 25 cm)를 이용하여 손을 유인원으로 사용하였으나 케이지의 양쪽 끝부분(10 × 25 × 25 cm)을 망(mesh)으로 막아 모기의 직접적인 접촉을 피하였다. 효율적인 기피효과 검정법 개발을 위하여 선 실험 후 공기의 원활한 순환을 돕고 피실험자의 날숨에 영향을 받지 않는 면을 망처리하여 시험법을 개선하고자 하였다(Fig. 1).
우화한지 1-2주된 암컷모기 60마리를 선별하여 아크릴케이지에 넣고, 시험전 양쪽 끝부분에 손을 넣고 3분동안 유인율이 10%가 넘으면 실험을 진행하였다. 한쪽 손은 각 시료를 에탄올에 농도별로 희석 후 500 μl 처리한 55 mm의 필터페이퍼를 처리구로 하였고 대조구로는 필터페이퍼에 에탄올만을 처리하였다. 기피율은 실험 15분 후 양쪽 끝 3 cm안에 있는 모기의 개체수를 조사하였다. 기피율은 Schreck et al. (1977)의 계산법을 참고하였다.
기피율(%) = {(대조구 모기수 – 처리구 모기수) / 대조구 모기수} × 100.
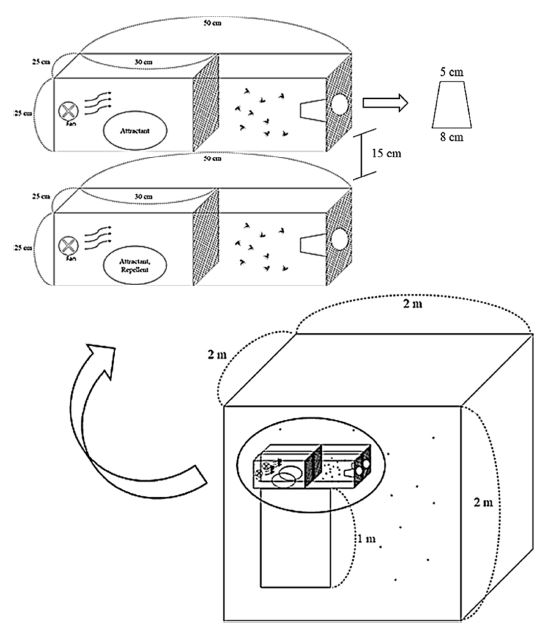
기존실험법인 human-baited double net trap 방법을 수정하여 유인원으로 사람을 사용하지 않고 모기와의 직접적인 접촉에 영향을 받지 않는 유인원을 사용하였다(Tangena et al., 2015).
본 실험에 사용된 실외시험법(semi-field test)의 기본적인 구성은 모기망(2 × 2 × 2 m)과 모기의 포집을 확인할 수 있도록 아크릴케이지(30 × 25 × 25 cm) 2개로 구성되어있으며, 벽면에 팬(풍속 2 m/s)을 설치하여 유인원이 퍼져나갈 수 있도록 하였다. 다른 한쪽은 모기가 유인되는 트랩으로 깔대기형태의 입구로 지름을 최종적으로 5 cm로 조정하여 실험에 사용하였다(Fig. 2)
실험조건은 모기망에 암컷 모기 200마리 이상을 처리하고, 실험 전 2시간동안 유인율이 20 - 30% 이상으로 나타나면 실험을 진행하였다. 두개의 아크릴케이지 중 하나는 유인원만을 처리하여 대조구로 하였고 다른 하나는 유인원과 기피제를 함께 처리한 처리구로하여 기피율을 비교하였다. 유인요소는 기존의 연구를 참고하여 젖산과 쥐, 드라이아이스를 단독 또는 혼합처리하여 가장 효과적인 유인원을 찾고자 하였다(Geier et al., 1999). 처리구에는 원제의 경우 에탄올에 희석하여 총 1 ml을 필터페이퍼(90 mm, Hyundai micro)에 처리하였고, 제품의 경우 제품을 직접 사용하였다. 기피율은 시료 처리 30분과 60분, 120분, 240분, 360분 후에 케이지에 유인된 모기의 개체수를 측정하여 계산했다.
자료분석
실내시험법의 수정 전과 후의 시간별 기피활성과 모기 유인입구 크기에 따른 유인원의 유인활성을 Tukey’s studentized range test를 이용하여 비교 분석하였다(SAS Institute, 2010).
결 과
실내시험법을 이용한 기피활성
공간형 기피제의 실내시험법에 대한 수정 전과 후의 기피율을 조사하였다(Fig. 3).
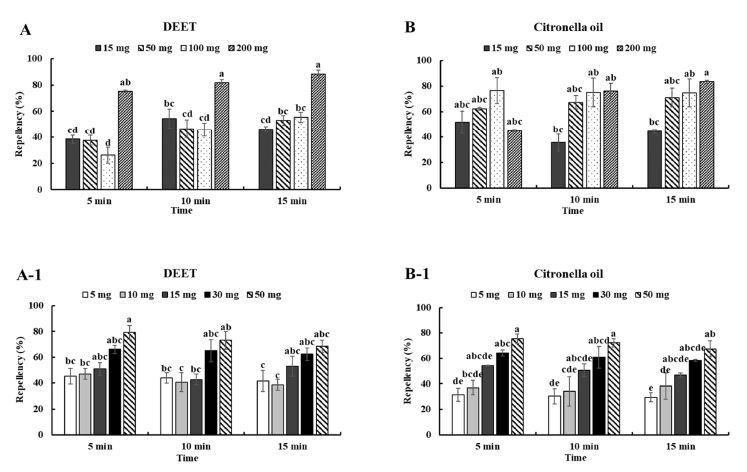
Repellency of Ae. albopictus between before and after modification of in vitro method. A and B: before, non-mesh cage; A-1 and B-1: after, meshed cage.
수정 전 실내시험법을 이용한 DEET의 기피활성반응은 고농도인 50 mg을 처리시 가장 높은 기피활성을 보였으나 그 외 농도에서는 농도와 시간에 따른 차이가 일관되게 나타나지 않았다(Fig. 3(A)). 그러나 수정된 시험법을 이용한 실험에서는 더 낮은 농도에서도 기피반응이 확인되었고, 30 mg이상부터는 처리 시간에 따른 기피활성이 일정하게 유지되는 것으로 나타났다(Fig. 3(A)-1).
시트로넬라오일의 경우에서는 수정 전 시험법에서는 처리 농도와 시간에 따른 기피율의 반응이 일관되지 않았으나 수정 후에는 낮은 농도에서도 정비례의 기피활성을 보였고 시간에 따라서도 큰 차이를 보이지 않는 안정된 반응을 나타냈다(Fig. 3(B), B-1).
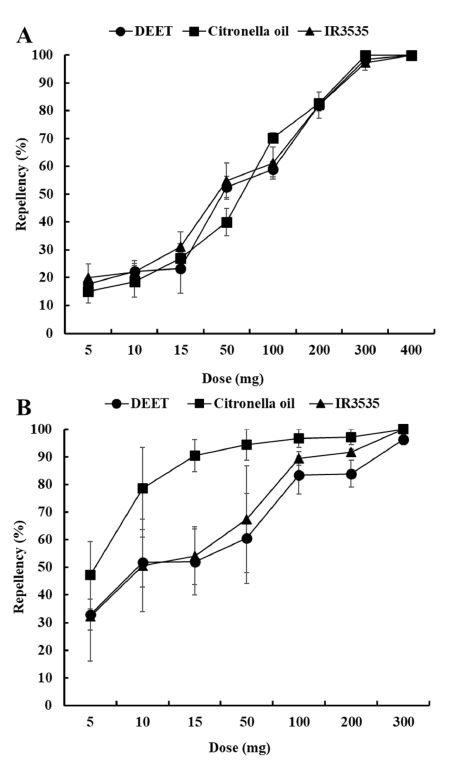
개선된 실내시험법을 이용하여 15분동안 DEET와 시트로넬라오일, IR3535의 농도별 기피율을 확인한 결과 2종의 기피제에서 모두 농도가 증가함에 따라 기피율도 증가하였다(Fig. 4). 흰줄숲모기에 대한 3종 기피물질의 기피활성은 유사하게 관찰되었으나, 빨간집모기는 처리 약량에 따른 기피성분의 활성차이를 보였다. 시트로넬라오일은 10 mg 처리에서 78.6%의 기피활성을 보였고 15 mg 처리에서도 90% 이상의 기피율을 보였으나 DEET와 IR3535는 100 mg 처리에서 80% 이상의 기피율이 관찰되었다.
실외시험법에서의 유인효과실험
공간형 기피활성을 평가하기위한 실외시험법의 다양한 유인원(lactic acid, mouse, dry ice, 혼합 유인원)을 이용하여 흰줄숲모기에 대한 기피활성을 조사하였다(Table 1).

Attraction effects of various attractants according to entrance hole size of device in semi-field experiments against Ae. albopictus
흰줄숲모기의 유인율이 30%이상 조사된 유인원은 lactic acid (500 μl) + mouse + dry ice를 혼합한 처리구에서 6시간 후 35.0%로 나타났다. 유인활성의 효율을 높이고 시간을 단축하기위하여 유인장치의 모기 유입구의 크기를 2 cm에서 5 cm로 변경 후 흰줄숲모기의 유인율을 확인한 결과, 단일의 유인원을 처리한 처리구는 유인효과의 변화가 없었으나 혼합 유인원(lactic acid (500 μl) + mouse + dry ice)에서 2시간 후에 31.7%의 유인효과가 나타났다.
실외시험법을 이용한 기피활성
실외시험법을 이용하여 DEET와 시트로넬라오일, IR3535의 농도와 시간에 따른 2종의 모기에 대한 기피 잔효성을 평가하였다(Fig. 5).
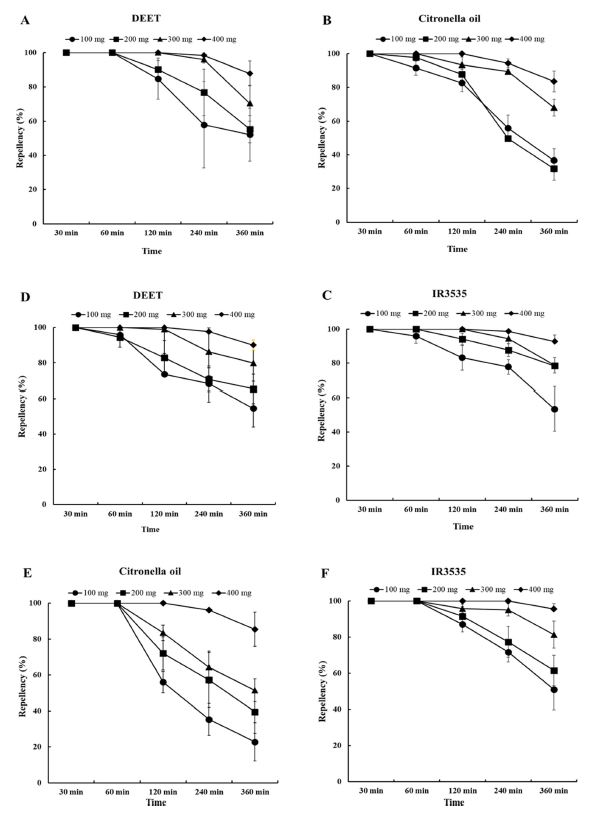
Residual repellency of Ae. albopictus and Cx. pipiens using semi-field method. A, B, C: Ae. albopictus; D, E, F: Cx. pipiens.
흰줄숲모기와 빨간집모기에 대한 3종의 기피물질들의 기피활성은 농도에 따라 증가하였고 처리 시간에 따라 기피활성이 감소하였다.
흰줄숲모기의 경우 DEET는 400 mg 처리시 240분까지 98.3%의 높은 기피율을 보였으나 처리 360분후에는 87.9%로 감소하였다. 120분을 기준으로 DEET와 IR3535는 200 mg 처리시에 90% 이상의 기피율이 나타났으나 시트로넬라 오일처리구에서는 87.7%의 기피율을 보였다. 그러나 처리 360분 후에는 31.8%로 IR3535 (78.4%)에 비해 급격한 기피효과 감소를 보였다.
빨간집모기에서는 시트로넬라오일과 IR3535를 100 mg 처리 후 60분까지 100%의 기피율을 보였으나 DEET에서는 95.8%의 기피율을 보였다. 각 기피물질 처리 120분 후에 90% 이상의 기피율은 300 mg DEET (98.9%)와 200 mg IR3535 (91.6%)이었고, 시트로넬라오일은 300 mg 처리에서도 83.49%의 기피율을 보였다. DEET와 IR3535는 360분 후에 200 mg처리에서 각각 65.3%와 61.5%의 기피율을 보였으나 시트로넬라오일은 39.6%로 매우 낮은 기피율이 나타났다. 특히 시트로넬라오일은 300 mg 이하의 처리구부터 시간에 따라서 기피율이 급격히 감소하였다.
고 찰
본 연구는 기존의 공간형 기피제에 대한 평가법을 개선하여 안전하고 효율적인 시험법을 개발하고자 하였다. 기존에 실내기피시험법으로 이용된 실린더를 사용한 시험법이나 Y-tube olfactometer, skin test와 같은 방법은 인체의 직접적인 접촉으로 인한 피실험자의 안전성에 대한 문제점 뿐만 아니라 공간형 기피제의 평가를 위해 필수적인 모기 활동공간의 제약이 있어 공간형 기피제의 효능평가에는 적절치 않았다(Schreck and McGovern, 1989; Thavara et al., 2001; Lee et al., 2004; Kim et al., 2004; Rodriguez et al., 2015). 따라서 실내시험법은 공간형 기피제의 신속한 효과 평가를 위한 시험법으로 개선하고자 하였다. 본 연구에서는 개선된 실내시험법을 통하여 기피물질들의 흰줄숲모기와 빨간집모기에 대한 기피활성이 처리시간과 처리량에 따라서 기피활성의 차이를 확인할 수 있었다. 기존 실내시험법과 유사하나 15분이라는 짧은 시간을 기준으로 적용한 것은 공간형 기피제의 평가를 위한 실내시험법의 한계 즉, 공간적 요인과 시간적인 요인을 고려한 평가에 적합하지 않기 때문으로 짧은 시간 동안, 한정된 공간에서 모기의 반응을 신속하게 평가하여 물질의 기피활성 탐색을 위한 선실험법으로 효율적인 것으로 생각된다. 또한 시험법과 환경조건에 따라 모기 종류별로 기피반응의 차이를 보이기도 하는데, Y-tube를 이용한 실험에서는 이집트숲모기와 흰줄숲모기의 제품에 따른 기피반응의 차이가 나타났으며, 숲모기속과 집모기속의 CPT (complete protection time) 비교실험에서도 평균적으로 집모기속의 모기에서 더 긴시간 동안 기피효과가 유지되는 것으로 나타났다(Amer and Mehlhorn, 2006; Lupi et al., 2013; Rodriguez et al., 2015). 본 실험에서도 실내 기피활성실험에서 물질에 따른 빨간집모기의 기피반응이 흰줄숲모기보다 확연한 차이가 관찰되었다. 이는 실내시험법은 짧은 시간안에 기피물질의 활성평가를 위한 것으로 실내환경에서 더 잘 반응하는 빨간집모기를 이용하는 것이 기피물질평가에 흰줄숲모기보다 더 효율적이라 생각된다.
공간형 기피제의 효능 평가를 위해서 실내시험법의 한계를 보완할 수 있는 실외시험법(semi-field test)을 개발하였다. 기존의 실외시험법은 human-landing catch methods나 taxis box 등 다양하게 연구되었으나, 인축을 이용한 시험법으로 안전성문제와 실외실험의 특성상 대규모의 실험공간을 필요로 한다는 단점이 있다(WHO, 2013; Lorenz et al., 2013). 안전성을 확보할 수 있는 유인원으로 대체하기위하여 기존에 연구된 유인원인 젖산과 드라이아이스, 쥐 등을 이용하여 유인율이 약 30% 정도를 기준으로 실험을 진행하였다(Acree et al., 1968; Shirai et al., 2001; Steib et al., 2001; van Loon et al., 2015; McPhatter and Gerry, 2017). 유인율 30%는 기존 시험법을 이용한 실험결과에서 직접적인 인체의 유인으로도 약 30%의 유인율을 보였다는 결과를 참고하였다(Kang et al., 2005). 젖산은 많은 연구결과에서 모기에 대하여 유인효과가 관찰된 유인물질로 숲모기속과 집모기속(Aedes aegypti, Culex nigripalpus, Culex quinquefasciatus, Culex tarsalis)등에서 보고되었다(Acree et al., 1968; Shirai et al., 2001; Steib et al., 2001). 또한 CO2 (carbon dioxide)는 모기의 기주탐색활동에 영향을 준다는 연구결과를 토대로 트랩에도 널리 이용되고 있는 유인원 중에 하나이다(Gillies, 1980; Reisen et al., 2000; van Loon et al., 2015; McPhatter and Gerry, 2017). 실외시험법(semi-field test)에 이용될 유인원 개발을 위해 이들을 이용한 3종 유인원의 혼합이 가장 유인효과가 높은 것을 확인하여 이용하였고, 효과적인 기피활성 결과조사를 위해서 모기 유입구의 크기 변경으로 유인효과의 시간을 단축시켰다. 개선된 실외시험법을 이용한 기피물질의 효과평가에서도 모기의 종류와 기피물질, 물질 처리시간에 따라서 기피율의 차이를 보였다. 이집트숲모기를 이용한 실험에서도 DEET보다 시트로넬라오일의 기피효과시간이 감소하는 것으로 나타났다(Kim et al., 2004). 본 실험에서도 실외시험법을 이용한 기피활성평가결과는 실내시험법을 이용한 결과와 유사하게 흰줄숲모기보다 빨간집모기에서 시간과 약량에 따른 기피율의 차이가 더 크게 나타났고, 특히 citronella oil에서 기피반응의 차이가 크게 나타났다. 그러나 실외시험법을 이용한 실험의 기피율은 흰줄숲모기에서 더 오래 지속되는 것을 알 수 있었다. IR3535와 DEET를 비교한 실내시험에서는 Cx. tritaeniorhynchus (14.8과 14.5 h), Cx. quinquefasciatus (13.7과 12.7 h), Ae. aegypti (9.8과 9.7 h)순으로 기피지속시간을 보이며 두 기피물질의 효과는 큰 차이를 보이지 않았으나, Anopheles dirus에서는 DEET (5.8 h)보다 IR3535 (3.8 h)에서 기피효과시간이 감소하는 것으로 조사되었으나, 실외실험에서는 2종의 기피물질에 대하여 다양한 모기종(Cx. gelidus, Cx. tritaeniorhynchus, Cx. quinquefasciatus, Mansonia dives, Ma. uniformis, Ma. annulata, Ma. annuliftra, Anopheles minimus, An. maculatus)에서 물질간의 유사한 기피활성을 보였다(Thavara et al., 2001). 본 실험에서도 시험법에 따라 모기종과 기피물질간의 활성 차이를 보임에 따라 공간형 기피제의 효과평가를 위해서는 실내시험법보다는 공간적인 요인이 포함된 실외시험법을 이용하는 것이 적합할 것이라 생각된다.
공간형 기피제의 평가를 위해서는 시험공간의 크기, 시험시간, 시험 모기종, 모기의 유인원 등 다양한 조건을 충족해야만 효율적인 공간형 기피제의 평가가 이루어질 수 있기에 본 연구결과가 도움이 될 수 있기를 기대한다.
Acknowledgments
본 논문은 환경부의 한국환경산업기술원의 안심살생물제 관리기반기술개발사업의 지원을 받아 연구되었습니다(2019002490002).
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Acree Jr F, Turner RB, Gouck HK, Beroza M, Smith N, et al., 1968. L-Lactic acid: a mosquito attractant isolated from humans. Science. 161(3848):1346-1347.
[https://doi.org/10.1126/science.161.3848.1346]

-
Amer A, Mehlhorn H, 2006. Repellency effect of forty-one essential oils against Aedes, Anopheles, and Culex mosquitoes. Parasitol. Res. 99(4):478-490.
[https://doi.org/10.1007/s00436-006-0184-1]

-
Debboun M, Strickman D, 2013. Insect repellents and associated personal protection for a reduction in human disease. Med. Vet. Entomol. 27(1):1-9.
[https://doi.org/10.1111/j.1365-2915.2012.01020.x]

-
Durnez L, Coosemans M, 2013. Residual transmission of malaria: an old issue for new approaches. In Manguin, S. (Ed.) Anopheles mosquitoes: new insights into malaria vectors. InTech. Ryeka, Croatia. pp. 671-704.
[https://doi.org/10.5772/55925]

-
Ferguson HM, Ng'habi KR, Walder T, Kadungula D, Moore SJ, et al., 2008. Establishment of a large semi-field system for experimental study of African malaria vector ecology and control in Tanzania. Malar. J. 7(158).
[https://doi.org/10.1186/1475-2875-7-158]

-
Frances C, Mouquet C, Marcelin AG, Barete S, Agher R, et al., 2000. Outcome of kidney transplant recipients with previous human herpesvirus-8 infection. Transplantation. 69(9):1776-1779.
[https://doi.org/10.1097/00007890-200005150-00008]

-
Geier M, Bosch OJ, Boeckh J, 1999. Ammonia as an attractive component of host odour for the yellow fever mosquito, Aedes aegypti. Chem. Senses. 24(6):647-653.
[https://doi.org/10.1093/chemse/24.6.647]

-
Geier SA, Libera S, Klauss V, Goebel FD, 1995. Sicca syndrome in patients infected with the human immunodeficiency virus. Ophthalmol. 102(9):1319-1324.
[https://doi.org/10.1016/S0161-6420(95)30868-8]

-
Gillies MT, 1980. The role of carbon dioxide in host-finding by mosquitoes (Diptera: Culicidae): a review. Bull. Entomol. Res. 70(4):525-532.
[https://doi.org/10.1017/S0007485300007811]

-
Goodyer LI, Croft AM, Frances SP, Hill N, Moore SJ, et al., 2010. Expert review of the evidence base for arthropod bite avoidance. J. Travel. Med, 17(3):182-192.
[https://doi.org/10.1111/j.1708-8305.2010.00402.x]

-
Grieco JP, Achee NL, Sardelis MR, Chauhan KR, Roberts DR, et al., 2005. A novel high-throughput screening system to evaluate the behavioral response of adult mosquitoes to chemicals. J. Am. Mosq. Control. Assoc. 21(4):404-411.
[https://doi.org/10.2987/8756-971X(2006)21[404:ANHSST]2.0.CO;2]

-
Gubler DJ, 2002. Epidemic dengue/dengue hemorrhagic fever as a public health, social and economic problem in the 21st century. Trends. Microbiol. 10(2):100-103.
[https://doi.org/10.1016/S0966-842X(01)02288-0]

-
Kim JK, Kang CS, Lee JK, Kim YR, Han HY, et al., 2005. Evaluation of repellency effect of two natural aroma mosquito repellent compounds, citronella and citronellal. Entomol. Res. 35(2):117-120.
[https://doi.org/10.1111/j.1748-5967.2005.tb00146.x]

-
Kim SI, Chang KS, Yang YC, Kim BS, Ahn YJ, 2004. Repellency of aerosol and cream products containing fennel oil to mosquitoes under laboratory and field conditions. Pest Manag. Sci. 60(11):1125-1130.
[https://doi.org/10.1002/ps.921]

-
Kitau J, Pates H, Rwegoshora TR, Rwegoshora D, Matowo J, et al., 2010. The effect of Mosquito Magnet® Liberty Plus trap on the human mosquito biting rate under semi-field conditions. J. Am. Mosq. Control. Assoc. 26(3):287-294.
[https://doi.org/10.2987/09-5979.1]

-
Lee WJ, Lee HS, Ahn YJ, Lee DK., 2004. Laboratory evaluation of controlled‐release repellent treated pulp fabric on human volunteers against mosquito vectors. Entomol. Res. 34(1):37-42.
[https://doi.org/10.1111/j.1748-5967.2004.tb00088.x]

-
Lorenz S, Pusch MT, 2013 Filtration activity of invasive mussel species under wave disturbance conditions. Biol. Invasions. 15(12):2681-2690.
[https://doi.org/10.1007/s10530-013-0483-2]

-
Lupi E, Hatz C, Schlagenhauf P, 2013. The efficacy of repellents against Aedes, Anopheles, Culex and Ixodes spp.–A literature review. Travel. Med. Infect Dis. 11(6):374-411.
[https://doi.org/10.1016/j.tmaid.2013.10.005]

-
McGraw EA, O'neill SL, 2013. Beyond insecticides: new thinking on an ancient problem. Nat. Rev. Microbiol. 11(3):181-193.
[https://doi.org/10.1038/nrmicro2968]

-
McPhatter LP, Su T, Williams G, Cheng ML, Dhillon M, et al., 2017. Host-feeding patterns of Culex stigmatosoma (Diptera: Culicidae) in southern California. Med. Vet. Entomol. 54(6):1750-1757.
[https://doi.org/10.1093/jme/tjx154]

-
McPhatter L, Gerry AC, 2017. Effect of CO2 concentration on mosquito collection rate using odor‐baited suction traps. J. Vector. Ecol. 42(1):44-50.
[https://doi.org/10.1111/jvec.12238]

-
Moore SJ, Debboun M, 2007. History of insect repellents. pp. 3-30. In: Debboun M, Frances SP, Strickman D (Eds.). Insect repellents: principles, methods and uses. CRC Press, Boca Raton, USA.
[https://doi.org/10.1201/9781420006650.ch1]

- Reisen WK, Meyer RP, Cummings RF, Delgado O, 2000. Effects of trap design and CO2 presentation on the measurement of adult mosquito abundance using Centers for Disease Control-style miniature light traps. J. Am. Mosq. Control. Assoc. 16(1):13-18.
-
Rodríguez-Morales AJ, 2015. Zika: the new arbovirus threat for Latin America. J. Infect. Dev. Ctries. 9(6):684-685.
[https://doi.org/10.3855/jidc.7230]

-
Schreck CE, 1977. Techniques for the evaluation of insect repellents: a critical review. Annu. Rev. Entomol. 22(1):101-119.
[https://doi.org/10.1146/annurev.en.22.010177.000533]

- Schreck CE, McGovern TP, 1989. Repellents and other personal protection strategies against Aedes albopictus. J. Am. Mosq. Control. Assoc. 5(2):247-250.
-
Shirai Y, Kamimura K, Seki T, Morohashi M, 2001. L-lactic acid as a mosquito (Diptera: Culicidae) repellent on human and mouse skin. J. Med. Entomol. 38(1):51-54.
[https://doi.org/10.1603/0022-2585-38.1.51]

-
Steib BM, Geier M, Boeckh J, 2001. The effect of lactic acid on odour-related host preference of yellow fever mosquitoes. Chem. Senses. 26(5):523-528.
[https://doi.org/10.1093/chemse/26.5.523]

-
Tangena JA, Thammavong P, Hiscox A, Linsay S, Brey P, 2015. The human-baited double net trap: an alternative to human landing catches for collecting outdoor biting mosquitoes in Lao PDR. PLoS ONE. 10(9):e0138735.
[https://doi.org/10.1371/journal.pone.0138735]

- Thavara U, Tawatsin A, Chompoosri J, Suwonkerd W, Chansang UR, et al., 2001. Laboratory and field evaluations of the insect repellent 3535 (ethyl butylacetylaminopropionate) and deet against mosquito vectors in Thailand. J. Am. Mosq. Control Assoc-Mosquito News. 17(3):190-195.
-
van Loon JJ, Smallegange RC, Bukovinszkiné-Kiss G, Jacobs F, De Rijk M, et al., 2015. Mosquito attraction: crucial role of carbon dioxide in formulation of a five-component blend of human-derived volatiles. J. Chem. Ecol. 41(6):567-573.
[https://doi.org/10.1007/s10886-015-0587-5]

-
Van Roey K, Sokny M, Denis L, Van den Broeck N, Heng S, et al., 2014. Field evaluation of picaridin repellents reveals differences in repellent sensitivity between Southeast Asian vectors of malaria and arboviruses. PLoS. Negl. Trop. Dis. 8(12):e3326.
[https://doi.org/10.1371/journal.pntd.0003326]

Tae Il Eom, Department of Plant Medicine, Chungbuk National University, Master degree, http://orcid.org/0000-0002-6573-748X
Yu No Lee, Department of Plant Medicine, Chungbuk National University, Student
Yeol Gyu Kang, Department of Plant Medicine, Chungbuk National University, Master student
Seung-Ju Seok, Department of Plant Medicine, Chungbuk National University, Master student
Jong Chan Jeon, Department of Plant Medicine, Chungbuk National University, Master student
Hyun Kyung Kim, Department of Plant Medicine, Chungbuk National University, Doctor of Philosophy
Gil-Hah Kim, Department of Plant Medicine, Chungbuk National University, Professor, http://orcid.org/0000-0001-6256-8759
Research design; Kim G-H, Kim HK, Investigation; Eom TI, Kang YG, Seok SJ, Data analysis; Jeon JC, Writing – original draft preparation; Eom TI, Kim HK, Lee YN, Writing – review & editing; Kim G-H, Kim HK.