
꿀벌 유충 독성시험 사육 plate 배치 및 유충 배설물 흡수에 따른 우화율 및 기형률 비교
 ; Kyongmi Chon1, *
; Kyongmi Chon1, * ; Bo-Seon Kim1
; Bo-Seon Kim1 ; Chang-Young Yoon1
; Chang-Young Yoon1 ; Jin-A Oh1
; Jin-A Oh1 ; Hong-Hyun Park1
; Hong-Hyun Park1 ; Yong-Soo Choi2
; Yong-Soo Choi2
초록
최근 꿀벌 개체 수 감소의 주요 원인 중 하나로 농약이 지목되고 있으며, 이와 관련하여 꿀벌 봉군 건강 및 생존에 기반이 되는 꿀벌 유충에 대한 독성 영향평가의 중요성이 대두되고 있다. 이에 꿀벌 유충독성시험법이 OECD 시험법에 게재되었으며, 시험 유효기준을 충족시키기 위해서는 무처리군에서 꿀벌 성체의 우화율이 70% 이상 되어야 한다. 최근 선행연구에서 꿀벌 성체 우화율을 향상시키고 기형률을 줄이기 위하여 Kimwipes가 배치된 새로운 plate로 유충을 이동시키거나 48-well culture plate를 수직으로 세우는 방법들이 제안된 바 있지만, 이에 대한 구체적인 우화율 및 기형률에 대한 데이터가 없는 상황이다. 따라서 본 연구에서는 번데기 단계에서 Kimwipes를 이용한 유충의 배설물 흡수 및 plate의 수평 또는 수직적 배치가 꿀벌 우화율 및 기형률에 어떤 영향을 미치는지 확인하고자 하였다. 시험군은 수평으로 배치한 그룹(NHG)과 Kimwipes를 이용하여 유충 배설물을 흡수하고 plate를 수평으로 배치한 그룹(NHK), plate를 수직으로 배치한 그룹(CVG), 그리고 Kimwipes를 이용하여 유충 배설물을 흡수하고 plate를 수직으로 배치한 그룹(CVK) 등 4개의 그룹으로 나누었다. 각 시험군 당 36 마리씩 6 반복으로 시험을 수행하였다. 시험결과 모든 시험군의 꿀벌 성체 우화율은 약 90%로 통계적으로 유의한 차이가 관찰되지 않았다. NHG, NHK, CVG, 및 CVK의 성체 기형률은 각각 21.2 ± 3.3%, 18.6 ± 3.0%, 8.7 ± 0.9%, 2.1 ± 1.0% 이었다. 따라서 번데기 단계에서 Kimwipes가 배치된 새로운 plate로 유충을 이동시키고 plate를 수직으로 세워 놓는 경우 성체 기형률을 최소화할 수 있었다. 향후 본 꿀벌 유충 사육방법은 농약이 꿀벌 유충단계에 노출되었을 때 미치는 치사 및 기형 등과 같은 아치사 영향에 대한 연구를 수행하는데 유용하게 활용될 수 있을 것으로 생각된다.
Abstract
Recently, pesticide is considered to be one of the major factors in the decline of the honey bee colonies. In this regard, it is important to evaluate the toxic effects on bee larvae that underlie honey bee colony health and survival. The honey bee larval toxicity test is presented in the OECD guidelines, and in order to satisfy the validity of the test, the adult emergence rate should be 70% or more in controls. Recent studies have proposed the methods to transfer the larvae to a new plate lined with Kimwipes in the pupal stage or to set a 48-well culture plate vertically. However, the specific data on the emergence and deformation rates has not yet been reported. Therefore, in this study, we examined the effect of absorption of larval feces using Kimwipes and/or rearing plate position (vertical and horizontal) in the pupal stage on the adult emergence and deformation rates. The test group consisted of four groups as follows: 1) the non-covered and horizontally oriented groups (NHG), 2) the non-covered and horizontally oriented groups using Kimwipes tissues to absorb larval feces (NHK), 3) the covered and vertically oriented groups (CVG), 4) the covered and vertically oriented groups using Kimwipes tissues to absorb larval feces (CVK). Each test group was performed with 6 replicates (36 larvae per replicate). As a result, the adult emergence rates of all groups were approximately 90%, and there were no significant differences. The adult deformation rates of NHG, NHK, CVG, and CVK were 21.2 ± 3.3%, 18.6 ± 3.0%, 8.7 ± 0.9%, and 2.1 ± 1.0%, respectively. Therefore, when the larvae were transferred to a new plate lined with Kimwipes and the plate was set vertically in the pupal stage, the adult deformation rate could be minimized. In the future, this rearing method can be useful for conducting studies of lethal effects, and sub-lethal effects such as deformations when pesticides are exposed to the honey bee larval stage.
Keywords:
Honey bee larval toxicity tests, Emergence rate, Deformation rate키워드:
꿀벌 유충독성시험, 우화율, 기형률서 론
최근 전 세계적으로 꿀벌(Apis mellifera L.)을 비롯한 화분매개곤충의 개체 수 감소 현상이 나타나고 있다(Neumann and Carreck 2010; Van der Zee et al., 2012). 이러한 감소 원인에는 바이러스를 포함한 병원체, 질병, 농약, 기후 변화, 기생충, 서식지 파괴, 영양부족 등이 있으며(Neumann and Carreck, 2010; VanEngelsdorp et al., 2010; Vanbergen et al., 2013; Goulson et al., 2015), 그 중 농약은 꿀벌 개체 수 감소에 영향을 주는 주요 원인 중 하나로 지목되고 있다(Blacquiere et al., 2012; Singla et al., 2021). 최근 선행연구에 의하면 농약은 꿀벌의 치사영향(lethal effect)뿐만 아니라 먹이활동 및 기억력을 저해시키고(Decourtye et al., 2005), 여왕벌의 생식력 및 봉군 발달(Wu-Smart and Spivak, 2016) 등에 대한 아치사 영향(sub-lethal effect)을 주는 것으로 보고되고 있다. 꿀벌 유충은 꿀벌이 외부 먹이활동을 통해 저장해 놓은 오염된 먹이를 섭취함으로써 농약 및 화학 물질에 노출될 수 있으며 이는 꿀벌 봉군 전체의 건강 및 생존에 영향을 미칠 수 있다(Sanchez-Bayo and Goka, 2014). 따라서 미국 및 유럽국가에서는 꿀벌 성체뿐만 아니라 꿀벌 유충에 대한 농약의 독성 및 위해성평가를 수행하고 있다. 이에 최근 꿀벌 유충에 대한 농약의 독성을 평가하기 위해 꿀벌 유충 단회노출 시험법(OECD No. 237, 2013)과 반복 노출 시험법(OECD No. 239, 2016)이 OECD 시험법에 게재되었다. OECD에서 제시한 시험 유효 기준을 충족시키기 위해서는 무처리군의 유충 치사율이 15% 미만이고 성체 우화율이 70% 이상이어야 한다. 그러나 실제 2005년과 2008년에 5개국의 7개 연구기관에서 진행된 in vitro 꿀벌 유충 독성시험 ring test에서 총 30개 중 20개의 시험은 무처리군의 성체 우화율이 70% 이상이었지만, 10개의 시험에서는 50% 이하의 낮은 우화율을 나타냈다(Aupinel et al., 2009). 따라서 이를 극복하기 위한 실험실 내 꿀벌 유충 사육방법 개선 연구가 필요하다.
In vitro 꿀벌 유충 사육방법은 1933년에 최초로 보고된 후 꿀벌 유충 치사율 및 우화율 개선을 위해 후속 연구들이 진행되었다(Rhein, 1993; Aupinel et al., 2005; Aupinel et al., 2009; Crailsheim et al., 2013). Schmehl et al. (2016)은 유충 먹이의 구성, 로열젤리의 품질, 실험실 사육조건(온도 및 상대습도)에 따라 유충의 생존율을 향상시키거나 Kimwipes와 같은 흡수제를 이용하여 유충과 배설물의 접촉을 감소시켜 95% 이상의 높은 꿀벌 생존율을 보고하였다. 또한 일부 연구에서는 OECD 시험법과 같이 48-well culture plate를 수평으로 배치하는 것이 아닌 plate를 얇은 밀랍 막으로 밀봉하고 일반 벌통과 같이 수직으로 세워 배치하는 방법을 제안하였다(Riessberger-Gallé et al., 2008; Brodschneider et al., 2009; Crailsheim et al., 2013). Riessberger-Gallé et al. (2008)는 유충이나 번데기가 비정상적인 수직 자세를 취하게 되면 발달 단계에서 꿀벌의 날개와 복부를 변형시킬 수 있다고 보고하였다. Kim et al. (2021)은 실험실 내 꿀벌 유충 사육조건에서 plate 배치 방법에 따라 꿀벌 우화율 및 기형률에 미치는 영향을 평가하였으며, 그 결과 plate의 수직적 배치가 우화한 꿀벌의 기형률을 감소시키는데에 더 효과적인 것을 발견하였다.
기존 선행연구들은 실험실 내 유충 사육방법 절차에 대해서는 자세히 설명하고 있지만, plate 배치 및 Kimwipes 이용 방법을 활용하였을 때 꿀벌의 우화율 및 기형률에 대한 구체적인 데이터를 제공하지 않고 있다. 본 연구는 앞서 설명한 두 가지 방법을 활용하였다는 점에서 plate 배치만을 고려한 선행연구(Kim et al. 2021)와 차별성이 있다. 따라서 본 연구에서는 번데기 발달단계에서 Kimwipes가 배치된 새로운 plate로 유충을 이동시키거나 plate를 수평 또는 수직으로 배치하였을 때 꿀벌의 우화율과 기형률을 비교분석하고자 하였다.
재료 및 방법
꿀벌 유충 준비
전라북도 국립농업과학원 양봉생태과 양봉장에 위치한 세 봉군에서 건강한 1일령 꿀벌 유충을 무작위 선발하여 사용하였다. 시험 3일 전에 격왕판을 사용하여 여왕벌을 격리시키고 공소비판에 산란을 유도하였으며, 다음 날 새로 산란된 알을 확인하였다. 3일 후 시험 1일차(D1)에 부화한 1일령 유충을 실험실로 옮겨와 48-well culture plate (SPL, Korea)에 이충하였다. 이충하기 전에 48-well culture plate에 grafting cell cup (Nicotplast, France)을 넣고 유충먹이 A 20 μL를 주입하였다. Grafting cell cup은 70% 에탄올로 소독하였고 laminar-flow hood에서 30분간 UV 살균시킨 후 사용하였다.
유충먹이
꿀벌 유충먹이는 꿀벌 유충 독성시험법 OECD No. 239을 따라 제조하고 급여하였다. 유충먹이는 총 3종류로 구성 및 비율은 다음과 같이 제조하였다: diet A (50% royal jelly, 37.0% distilled water, 6.0% glucose, 6.0% fructose, 1.0% yeast extract); diet B (50% royal jelly, 33.5% distilled water, 7.5% glucose, 7.5% fructose, 1.5% yeast extract); diet C (50% royal jelly, 30.0% distilled water, 9.0% glucose, 9.0% fructose, 2.0% yeast extract). 유충 단계의 6일 동안(D2 제외) 총 160 μL의 유충먹이를 급여하였으며, D1에 유충먹이 A를 20 μL, D3에 유충먹이 B를 20 μL, 이후 D4, D5, 및 D6에 유충먹이 C를 각각 30, 40, 50 μL씩 급여하였다.
균일한 유충먹이를 준비하기 위해 0.20 μm 필터(Sartorius, Germany)로 여과한 증류수에 d-glucose (Difco, Sparks, USA)와 d-fructose (Junsei, Japan)를 먼저 혼합한 다음 yeast extract(Bacto, Sparks, USA)를 첨가하였고, 마지막으로 로열젤리를 혼합하였다(해찬골벌꿀농원, 대한민국). 유충먹이는 제조 후 3일 이내로 냉장보관(4oC 이하)하였으며 그 이상이 지나면 폐기하였다. 35oC로 유지되는 인큐베이터(DAIHAN Scientific Co., Korea)에 유충먹이를 예열한 후 유충에게 급여하였다.
꿀벌 유충 사육조건
꿀벌 유충은 OECD No. 239 가이드라인에 따라 사육하였다. 이충이 완료된 48-well culture plate를 K2SO4 (Junsei, Tokyo, Japan) 포화 용액을 사용하여 95±5% 상대습도(RH, Relative Humidity)로 유지되는 데시케이터(Nalgene, Rochester, USA) 안에 넣고 유충 단계(D1-D8) 동안 사육하였다. 시험 8일차(D8)에 48-well culture plate를 NaCl (Sigma-Aldrich, St. Louis, MO, USA) 포화 용액을 사용하여 80 ± 5% RH로 유지되는 데시케이터로 이동하였고 번데기 단계(D8-D15) 동안 사육하였다. 유충 및 번데기 단계 사육기간 동안 필요한 데시케이터는 35oC로 유지되는 인큐베이터에 보관하였다. 시험 15일차(D15)에 48-well culture plate를 50% 자당용액을 공급할 수 있는 개별 우화박스(emergence box)에 옮기고 우화 단계(D15-D21) 동안 50% RH 및 35°C로 유지된 인큐베이터에서 사육하였다. 시험기간 동안 48-well culture plate가 데시케이터 및 인큐베이터내 온도 및 습도를 이탈한 시간이 15분을 넘기지 않도록 하였다.
시험군
시험군은 총 4 그룹으로 나누어 번데기 단계에서 Kimwipes 이용 및 plate 배치에 따라 다음과 같이 구성하였다. OECD No. 239 시험법과 같이 48-well culture plate를 수평으로 배치한 그룹(the non-covered and horizontally oriented groups, NHG)과 Kimwipes를 이용하여 유충 배설물을 흡수하고 plate를 수평으로 배치한 그룹(the non-covered and horizontally oriented groups using Kimwipes tissues to absorb larval feces, NHK), plate를 수직으로 배치한 그룹(the covered and vertically oriented groups, CVG), 그리고 Kimwipes를 이용하여 유충 배설물을 흡수하고 plate를 수직으로 배치한 그룹(the covered and vertically oriented groups using Kimwipes tissues to absorb larval feces, CVK)으로 시험군을 나누었다. 모든 시험군은 무처리군으로 농약처리를 하지 않았다. 시험은 48-well culture plate에 유충 36마리를 이충하여 6반복으로 진행하였다(36 larvae × 6 plates = 216 larvae). Kimwipes는 유충의 배설물을 흡수하기 위하여 2 cm× 1 cm 크기로 잘라 UV 소독 후 사용하였다. 48-well culture plate를 우화박스 안에 수직으로 세워놓을 때 밀랍 막을 제조하여 plate 윗면에 덮었다. 밀랍 막은 Kim et al. (2021)의 방법을 따라 제조하였다. 한 장의 밀랍막의 크기는 가로 15 cm×세로 10 cm× 두께 0.4 mm 이었으며, 무게는 3.68 g이었다.
유충단계동안 모든 시험군은 동일한 조건에서 사육되었으며 유충 1일차부터 6일차까지 발달단계 사진을 Fig. 1에 나타내었다. 시험 7일차에 NHK 및 CVK의 유충을 이충침을 사용하여 Kimwipes가 배치된 새로운 번데기 plate로 이동시켰고(Fig. 2), 이 중 유충먹이를 모두 소비하지 못한 유충은 시험 8일차에 새 plate로 이동시켰다. NHG와 CVG는 새로운 plate로 이동시키지 않았다. 시험 8일차에 모든 plate는 80 ± 5% RH인 데시케이터로 이동하였으며 번데기단계 동안 치사율 및 이상증상을 관찰하였다. 시험 15일차에 NHG와 NHK는 48-well culture plate를 수평으로 배치하였고, CVG와 CVK는 plate에 밀랍 막을 씌우고 수직으로 세워 배치하여 우화단계 동안 꿀벌의 우화율을 관찰하였다. 번데기에서 우화단계까지 일자별 사진과 우화박스에 48-well culture plate를 배치한 4개 그룹의 사진을 Fig. 3과 Fig. 4에 나타내었다.
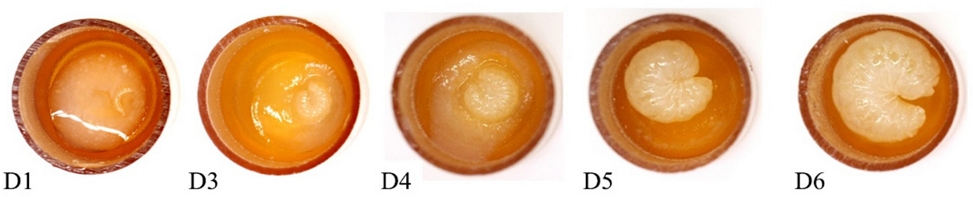
Photos of the development of honey bee larvae until the day 6 after grafting (D1). The prepupa completely consumed the diets and was transferred to a new pupal plate on day 7.
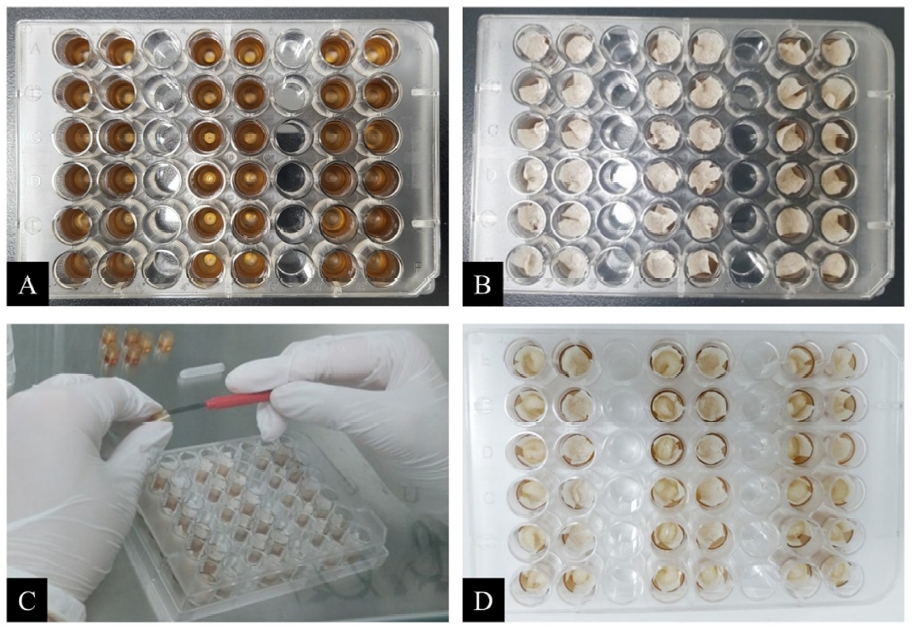
Photos of test materials and procedure: The 48-well culture plate with a plastic cell cup used in larval stage (A), the 48-well culture plate lined with Kimwipes tissues at each cell cup used in pupal stage (B), transferring the larvae to the new pupal plate using a grafting tool on day 7 (C), and the pupal plate with the transferred larvae (D).
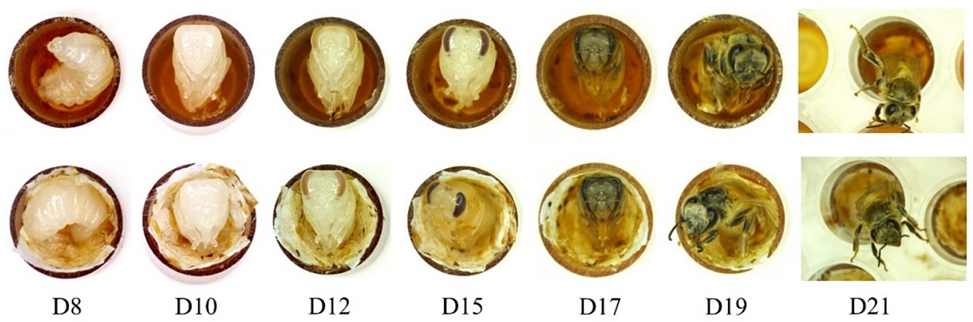
Photos of the development of honey bee pupae until the emergence of adult bees (D21). The pupae of an unaltered plate without Kimwipes (above), and of the new pupal plate with Kimwipes tissues at the bottom of each cell cup (below).

Photos of emergence boxes: NHG, the non-covered and horizontally oriented groups (A); NHK, the non-covered and horizontally oriented groups using Kimwipes tissues to absorb larval feces (B); CVG, the covered and vertically oriented groups (C); CVK, the covered and vertically oriented groups using Kimwipes tissues to absorb larval feces (D).
치사개체, 우화개체 및 이상증상 확인
시험기간 동안 매일 치사개체 및 이상증상을 관찰하고 기록하였다. 시험 3일차에 유충의 생존율을 100%로 설정한 후 유충단계 동안 움직이지 않거나 검게 변한 유충은 죽은 것으로 간주하고 시험 plate에서 제거하였다. 번데기단계 동안 탈피에 실패하여 꿀벌 성체로 우화하지 못한 개체는 죽은 것으로 간주하여 제거되었다. 우화단계에서 매일 새로 우화한 꿀벌의 개체 수 및 이상증상을 관찰하고 기록하였다. 우화 직후 치사한 꿀벌 성체는 즉시 기형 증상을 확인하고 무게 및 길이를 측정하였으며, 우화 후 살아있는 성체는 시험 21일차(실험 종료일)에 관찰하였다. 새로 우화한 꿀벌 성체의 증상은 Table 1과 같이 번데기가 정상적인 성체로 우화한 경우(SN), 비정상적인 복부 모양을 가진 성체로 우화한 경우(AAS), 날개 기형을 가진 성체로 우화한 경우(DW), 더듬이 기형을 가진 성체로 우화한 경우(DA)로 분류하여 관찰 기록하였다. Kim et al. (2021) 방법을 따라 각 시험군에 대한 유충 및 번데기 치사율, 성체 우화율 및 기형률을 계산하고, 우화한 꿀벌 성체의 기형 증상을 분석하였다.
통계처리
본 시험의 통계 분석은 IBM SPSS ver. 27.0 프로그램을 사용하여 수행되었으며, p-값이 0.05 미만일 경우 통계적 유의성을 나타내는 것으로 판단하였다. 각 시험군의 치사율 및 성체 우화율 차이는 Pearson’s chi–quare test를 사용하였고, 성체 기형률의 차이는 Fisher’s exact test로 분석되었다. 꿀벌 성체의 체중 및 길이 데이터는 정규분포를 따르지 않았기 때문에 비모수 검정인 Kruskal-Wallis tests를 사용하였고, 사후검정으로 Mann–Whitney U tests를 사용하여 각 시험군 간의 통계적 유의성을 비교하였다. 치사율, 우화율 및 기형률은 평균 ± 표준오차로 표시하였으며 우화한 성체의 체중 및 길이는 평균 ± 표준편차로 표시하였다.
결과 및 고찰
사육조건
시험기간 동안 평균 온도 및 상대 습도는 유충단계에서 각각 35.1±0.2oC, 93.7 ± 7.6% 이었으며 번데기단계에서 35.2 ± 0.1oC, 80.4 ± 5.2% 이었고 우화단계에서 35.1 ± 0.1oC, 55.2 ± 1.4% 이었다(Table 2). 본 시험의 평균 온도와 상대습도는 OECD No.239 (2016)에서 제시한 사육조건을 충족하였다.
유충 및 번데기 치사율, 성체 우화율
Table 3은 Kimwipes 이용 및 plate 배치에 따른 꿀벌 유충 치사율과 번데기 치사율 및 성체 우화율을 나타낸다. 모든 시험군의 유충 치사율은 5% 미만이었고 번데기 치사율은 10% 미만이었으며 성체 우화율은 85% 이상이었다. 본 시험의 4개 시험군은 성체 우화율이 70% 이상이어야 한다는 OECD No.239 (2016) 시험 유효 기준을 모두 충족하였다. 본 시험에서 시험군 간의 유충 치사율, 번데기 치사율 및 성체 우화율은 통계적으로 유의한 차이가 관찰되지 않았다.

Larval mortality, pupal mortality, and adult emergence rate. No significant differences were observed in mortalities and emergence rates among the four groups (chi-square test, p > 0.05)
Peng et al. (1992)은 꿀벌 유충의 배변활동이 이충 후 7일(본 시험에서 시험 8일차에 해당)에 가장 왕성하다고 보고하였다. Schmehl et al. (2016)은 실험실 내(in vitro) 꿀벌 유충 사육방법에 대한 연구를 수행하였으며 이충 후 6일(본 시험에서 시험 7일차에 해당)에 유충을 Kimwipes가 있는 새로운 번데기 plate로 이동시킨 결과 95% 이상의 일관된 높은 우화율을 달성하였다고 보고하였다. 저자는 꿀벌 유충의 배설물이 유충의 치사율을 증가시킬 수 있기 때문에 유충이 먹이를 완전히 섭취한 후 배변하기 전에 prepupae를 이동시킬 것을 강조하였다. 그러나 본시험에서 유충을 새로운 plate로 옮기는 과정에서 유충의 머리가 cell cup 바닥으로 향하는 경우가 많았으며, 또한 이러한 작업은 기계적 스트레스를 유발시키고 유충을 오염시킬 수 있기 때문에 매우 조심히 다루어야 하는 한계점이 있다.
또한 본 시험 결과는 Riessberger-Gallé et al. (2008)가 제안한 방법을 이용하여 plate에 밀랍 막을 씌우고 수직으로 세워 배치한 그룹과 수평적으로 배치한 그룹을 비교한 결과 모든 시험군의 꿀벌 우화율이 약 80%이었고 통계적으로 유의한 차이가 없다는 이전 선행연구 결과와 일치하였다(Kim et al., 2021).
결과적으로 본 시험에서 모든 시험군은 10% 미만의 낮은 유충/번데기 치사율과 85% 이상의 높은 성체 우화율을 나타냈다. 따라서 Kimwipes가 배치된 새로운 번데기 plate로의 이동 및 plate 배치(수평 및 수직)에 관계없이 각 시험군은 유사한 꿀벌 우화율을 나타내었다.
성체 기형률 및 기형증상
꿀벌 성체 기형률은 NHG에서 21.2 ± 3.3%, NHK에서 18.6 ± 3.0%, CVG에서 8.7 ± 0.9%, CVK에서 2.1 ± 1.0% 이었다(Fig. 5). NHG와 NHK의 기형률은 CVG와 CVK보다 유의하게 높았다. 정상적으로 우화한 꿀벌과 기형을 가지고 우화한 꿀벌의 예시를 Fig. 6에 나타내었다. SN은 정상적인 꿀벌 성체이고, AAS는 비정상적인 복부모양으로 복부가 축소되었거나 몸이 굽혀져 있고, DW는 날개가 짧거나 없거나 끝이 엉켜지었고, DA는 더듬이 끝이 비정상적으로 휘어진 모양이었다. 각 시험군의 SN, AAS, DW 및 DA의 비율은 NHG에서 각각 78.5%, 6.9%, 11.9% 및 2.7% 이었고, NHK에서 각각 81.1%, 3.7%, 13.4% 및 1.7%이었고, CVG에서 각각 91.3%, 1.5%, 3.8% 및 3.3% 이었으며, CVK에서 각각 97.9%, 0.5%, 1.3% 및 0.3% 이었다(Fig. 7). NHG에서는 AAS와 DW가 가장 많이 관찰되었고, NHK에서는 DW가 가장 많이 관찰되었으며, CVG와 CVK에서는 거의 성체 기형이 관찰되지 않았다.
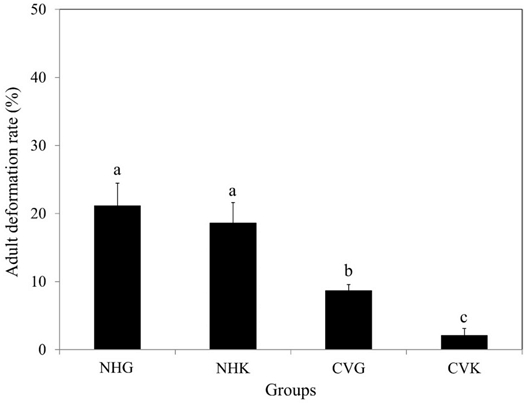
Deformation rates of newly emerged adult bees. Different letters above the bar graphs indicate significant differences among the groups (Fisher's exact test, p < 0.05).

The observed symptoms of newly emerged adult bees. SN means surviving normal; DW means deformed wings; AAS means abnormal abdomen shape (below) and surviving normal (above); DA means deformed antennae.
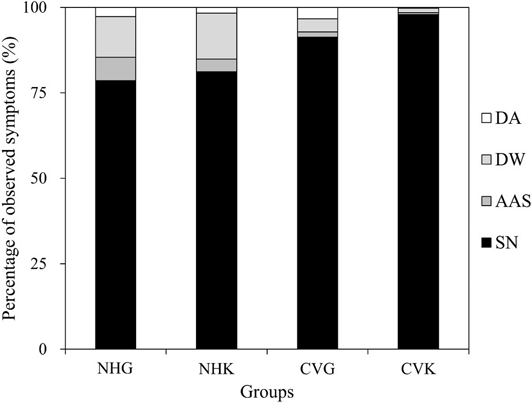
Percentage of observed symptoms of emerged bees. SN means surviving normal; AAS means abnormal abdomen shape; DW means deformed wings; DA means deformed antennae.
본 시험 결과와 비슷하게 이전의 선행연구에서도 수평적인 plate에서 우화한 꿀벌 성체의 기형률은 27.8%로 수직적 plate (11.9%)보다 약 2배 가량 높았으며, 날개기형과 복부 기형이 가장 많이 관찰되었다(Kim et al., 2021). 꿀벌의 날개는 번데기 단계에서 형성되고(Oertel, 1930), 번데기단계에서 plate가 수평일 때 번데기는 자연상태와 다르게 수직적 상태를 유지하면서 중력에 의해 아래로 당겨져 날개와 복부 발달에 영향을 받을 수 있다. 따라서 이러한 결과는 일부 연구에서 plate를 수평으로 배치하면 발달단계 동안 유충 및 번데기가 비정상적인 수직적 자세를 취하기 때문에 이 후 우화한 꿀벌에서 날개 및 복부 기형을 유발할 수 있다는 가정을 뒷받침해주는 결과로 해석될 수 있다(Brodschneider et al., 2009; Crailsheim et al., 2013).
Grillone et al. (2017)은 실험실 내에서 thiamethoxam이 꿀벌 유충에 반복 노출되었을 때 미치는 영향에 대한 연구를 수행하였으며, 그 결과 갈변된 유충, 번데기 발달 지연 및 기형을 가진 꿀벌 성체와 같은 다양한 독성 증상을 관찰하였다. Simon-Delso et al. (2017)은 꿀벌 유충단계에서 boscalid 57.5 mg/mL에 반복 노출되었을 때 비정상적인 복부 모양을 가진 우화한 꿀벌 성체를 관찰하였다. 또한 Desai et al. (2012)는 꿀벌 유충 단계에서 꿀벌 날개불구병바이러스(Deformed wing virus, DWV) 감염에 대한 영향을 평가하기 위하여 실험실 내에서 사육한 유충에 DWV를 인위적으로 주입하여 감염시켰으며, 그 결과 우화 후 날개 기형을 가진 꿀벌의 비율은 무처리군에서 약 9%이었고, DWV에 감염된 유충 처리군에서는 32 ± 0.8%로 상당히 높은 비율을 보였다. DWV는 꿀벌에 영향을 미치는 흔한 바이러스 중 하나이며 꿀벌응애류(varroa mites) 감염과 양의 상관 관계가 있고 감염된 꿀벌은 날개가 줄어들거나 구겨지고, 개체 크기가 줄어드는 증상이 나타난다(Ball and Bailey, 1997; Martin et al., 2012). 본 시험에서는 DWV 감염여부를 판단하기 위하여 시험을 진행하기 전에 DWV에 대한 PCR 검사를 진행하였으며 그 결과 시험에 사용된 모든 봉군에서 DWV가 검출되지 않았다.
우화한 꿀벌 성체의 기형은 꿀벌 성체의 비행 활동이나 먹이활동에 부작용을 미칠 수 있고, 더 나아가 꿀벌 봉군 전체의 생존에도 큰 영향을 미칠 수 있다. 따라서 이러한 꿀벌 성체의 기형 증상은 아치사 영향으로 평가될 수 있으며(Barbosa et al., 2015), 이를 위해서는 시험의 유효성 검증을 위해 무처리군의 기형률을 고려해야 할 필요가 있다. 결과적으로 본 시험에서 plate를 수평적으로 배치한 NHG와 NHK는 성체 기형률이 약 20%로 가장 높았다. 반면 수직적 배치(CVG와 CVK)의 기형률은 10% 미만으로 plate의 수평적 배치(NHG와 NHK)보다 성체 기형률이 유의적으로 감소하였다. 또한 번데기 단계에서 Kimwipes를 배치한 plate로 유충을 이동시키고 plate를 수직으로 배치한 CVK의 성체 기형률은 약 2%로 시험군 중에서 가장 낮은 기형률을 나타내었다.
성체 무게 및 길이
Table 4는 각 시험군의 우화한 꿀벌 성체의 평균 무게와 길이를 나타낸다. NHK를 제외한 각 시험군의 꿀벌 성체의 체중은 약 80 mg으로 통계적으로 유의한 차이가 없었다. 다른 선행연구에서도 실험실 내에서 우화한 꿀벌 성체의 무게가 약 70 ~ 75 mg 정도로 관찰되었다(Brodschneider et al., 2009; Kim et al., 2021).

Mean weight (mg) and length (mm) of the newly emerged adult bees. Means followed by a different letter in the same row are significantly different (Mann–Whitney U tests, p < 0.05)
꿀벌 성체의 길이는 NHG가 가장 작았으며, CVK가 가장 컸다. 이러한 길이 차이는 NHG에서 가장 많이 관찰된 비정상적인 복부 모양(AAS)으로 인해 성체 크기가 감소한 것에서 비롯된 것으로 보인다.
본 연구에서는 번데기 발달 단계에서 유충을 Kimwipes가 있는 새로운 plate로 이동시키거나 plate를 수평 또는 수직으로 배치하였을 때 꿀벌의 우화율과 기형률에 미치는 영향을 관찰하였다. 결과적으로 각 사육방법에 따른 꿀벌의 우화율에는 통계적으로 유의한 차이가 없었으나, 번데기 단계에서 Kimwipes를 배치한 새 plate로 유충을 이동시키고 plate를 수직으로 세워 놓을 경우 성체 기형률을 최소화할 수 있었다. 기존 선행연구에서 농약에 대한 꿀벌 유충 독성시험을 위한 실험실 내 꿀벌 유충 사육방법의 중요성을 강조하고 있다. 앞으로 실험실 조건에서 꿀벌 유충단계에 노출시킨 농약의 치사 영향뿐만 아니라 기형 등 아치사 영향을 평가할 때에 본 연구에서 제시한 사육방법이 유용하게 활용될 수 있을 것으로 기대된다.
Acknowledgments
본 연구는 국립농업과학원 기관고유 연구사업(과제번호: PJ01579701)에 의해 수행되었습니다. 이에 감사드립니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다
References
- Aupinel P, Fortini D, Dufour H, Tasei J, Michaud B, et al., 2005. Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae. Bull. Insectol. 58(2):107-111.
- Aupinel P, Fortini D, Michaud B, Medrzycki P, Padovani E, et al., 2009. Honey bee brood ring-test: method for testing pesticide toxicity on honeybee brood in laboratory conditions. Julius-Kühn-Archiv, 423:96-102.
- Ball BV, Bailey L, 1997. Viruses. In: R.A.Morse, F. (Ed.), Honey bee pests, predators and diseases, third ed. A. I. Root Company, Medina, Ohio, USA, pp. 11-31.
-
Barbosa WF, Tome HVV, Bernardes RC, Siqueira MAL, Smagghe G, et al., 2015. Biopesticide-induced be-havioral and morphological alterations in the stingless bee Melipona quadrifasciata. Environ. Toxicol. Chem. 34(9):2149-2158.
[https://doi.org/10.1002/etc.3053]

-
Blacquiere T, Smagghe G, Van Gestel CA, Mommaerts V, 2012. Neonicotinoids in bees: a review on concentrations, side-effects and risk assessment. Ecotoxicology, 21:973-992.
[https://doi.org/10.1007/s10646-012-0863-x]

-
Brodschneider R, Riessberger-Gallé U, Crailsheim K, 2009. Flight performance of artificially reared honeybees (Apis mellifera). Apidologie, 40:441-449.
[https://doi.org/10.1051/apido/2009006]

-
Crailsheim K, Brodschneider R, Aupinel P, Behrens D, Genersch E, et al., 2013. Standard methods for artificial rearing of Apis mellifera larvae. J. Apic. Res. 52(1):1-16.
[https://doi.org/10.3896/IBRA.1.52.1.05]

-
Decourtye A, Devillers J, Genecque E, Le Menach K, Budzinski H, et al., 2005. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Arch Environ Contam Toxicol 48:242-250.
[https://doi.org/10.1007/s00244-003-0262-7]

-
Desai SD, Eu YJ, Whyard S, Currie RW, 2012. Reduction in deformed wing virus infection in larval and adult honey bees (Apis mellifera L.) by double-stranded RNA ingestion. Insect Mol Biol 21(4):446-455.
[https://doi.org/10.1111/j.1365-2583.2012.01150.x]

-
Goulson D, Nicholls E, Botías C, Rotheray EL, 2015. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science 347(6229):1255957.
[https://doi.org/10.1126/science.1255957]

-
Grillone G, Laurino D, Manino A, Porporato M, 2017. Toxicity of thiametoxam on in vitro reared honey bee brood. Apidologie, 48(5):635-643.
[https://doi.org/10.1007/s13592-017-0506-6]

-
Kim J, Chon K, Kim BS, Oh JA, Yoon CY, et al., 2021. Horizontal honey-bee larvae rearing plates can increase the deformation rate of newly emerged adult honey bees. Insects, 12(7):603.
[https://doi.org/10.3390/insects12070603]

-
Martin SJ, Highfield AC, Brettell L, Villalobos EM, Budge GE, et al., 2012. Global honey bee viral landscape altered by a parasitic mite. Science, 336(6086):1304-1306.
[https://doi.org/10.1126/science.1220941]

-
Neumann P, Carreck NL, 2010. Honey bee colony losses. J. Apic. Res. 49:1-6.
[https://doi.org/10.3896/IBRA.1.49.1.01]

- OECD (Organization for Economic Cooperation and Development), 2013. Test No. 237: Honey Bee (Apis mellifera) Larval Toxicity Test, Single Exposure. OECD Guidance for the Testing of Chemicals, Section 2, No. 237; OECD Publishing: Paris, France.
- OECD (Organization for Economic Cooperation and Development), 2016. Test No. 239: Honey Bee (Apis mellifera) Larval Toxicity Test, Repeated Exposure. OECD Environment, Health and Safety Publications, Series on Testing and Assessment, No.239; OECD Publishing: Paris, France.
-
Oertel E, 1930. Metamorphosis in the honeybee. J. Morphol. 50(2):295-339.
[https://doi.org/10.1002/jmor.1050500202]

-
Peng YSC, Mussen E, Fong A, Montague MA, Tyler T, 1992. Effects of chlortetracycline on honey bee worker larvae reared in vitro. J. Invertebr. Pathol. 60(2):127-133.
[https://doi.org/10.1016/0022-2011(92)90085-I]

- Riessberger-Gallé U, Vollmann J, Brodschneider R, Aupinel P, Crailsheim K, 2008. Improvement in the pupal development of artificially reared honeybee larvae. Apidologie, 39:595.
-
Rhein WV, 1993. Über die Entstehung des weiblichen Dimorphismus im Bienenstaate. Wilhelm Roux Arch. Entwickl. Mech. Org. 129:601-665.
[https://doi.org/10.1007/BF00656581]

-
Sanchez-Bayo F, Goka K, 2014. Pesticide residues and bees–a risk assessment. PloS ONE, 9(4):e94482.
[https://doi.org/10.1371/journal.pone.0094482]

-
Schmehl DR, Tome HV, Mortensen AN, Martins GF, Ellis JD, 2016. Protocol for the in vitro rearing of honey bee (Apis mellifera L.) workers. Journal of Apicultural Research, 55(2):113-129.
[https://doi.org/10.1080/00218839.2016.1203530]

- Simon-Delso N, San Martin G, Bruneau E, Hautier L, Medrzycki P, 2017. Toxicity assessment on honey bee larvae of a repeated exposition of a systemic fungicide, boscalid. Bull. Insectology, 70(1):83-89.
-
Singla A, Barmota H, Kumar Sahoo S, Kaur Kang B, 2021. Influence of neonicotinoids on pollinators: A review. Journal of Apicultural Research, 60(1):19-32.
[https://doi.org/10.1080/00218839.2020.1825044]

-
Vanbergen AJ, the Insect Pollinators Initiative, 2013. Threats to an ecosystem service: Pressures on pollinators. Front. Ecol. Environ. 11(5):251-259.
[https://doi.org/10.1890/120126]

-
Van der Zee R, Pisa L, Andonov S, Brodschneider R, Charriere JD, et al., 2012. Managed honey bee colony losses in Canada, China, Europe, Israel and Turkey, for the winters of 2008-9 and 2009-10. J. Apic. Res. 51(1):100-114.
[https://doi.org/10.3896/IBRA.1.51.1.12]

-
VanEngelsdorp D, Speybroeck N, Evans JD, Nguyen BK, Mullin C, et al., 2010. Weighing risk factors associated with bee colony collapse disorder by classification and regression tree analysis. J. Econ. Entomol. 103(5):1517-1523.
[https://doi.org/10.1603/EC09429]

-
Wu-Smart J, Spivak M, 2016. Sub-lethal effects of dietary neonicotinoid insecticide exposure on honey bee queen fecundity and colony development. Scientific Reports, 6:32108.
[https://doi.org/10.1038/srep32108]

Juyeong Kim, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Sciences, RDA, Research assistant, Conceptualization; Methodology; Investigation; Data Curation; Writing-Original Draft preparation, https://orcid.org/0000-0002-6413-1822
Kyongmi Chon, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Sciences, RDA, Doctor of Philosophy, Conceptualization; Methodology; Investigation; Data Curation; Writing-review and editing; Funding Acquisition; Project Administration, https://orcid.org/0000-0003-2143-2614
Bo-Seon Kim, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Sciences, RDA, Research assistant, Investigation, https://orcid.org/0000-0001-6053-6366
Chang-Young Yoon, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Sciences, RDA, Researcher, Investigation, https://orcid.org/0000-0001-7220-5425
Jin-A Oh, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Sciences, RDA, Doctor of Philosophy, Supervision, https://orcid.org/0000-0002-1166-4377
Hong-Hyun Park, Department of Agro-food Safety and Crop Protection, National Institute of Agricultural Sciences, RDA, Doctor of Philosophy, Supervision, https://orcid.org/0000-0003-1213-0665
Yong-Soo Choi, Department of Agricultural Biology, National Institute of Agricultural Sciences, RDA, Doctor of Philosophy, Resources, https://orcid.org/000-0001-8453-5165