고단백질 함유 팥(Vigna angularis Willd.) 중 dithiocarbamate 살균제 mancozeb와 metiram 잔류분석법 개선
초록
Dithiocarbamate계 살균제인 mancozeb와 metiram은 수용액과 유기용매에 난용성인 특징으로 잔류분석 시 추출, 정제 방법이 매우 제한적인 화합물이다. 최근 이 계열 농약의 잔류분석을 위하여 EDTA 수용액으로 추출한 후 methyl iodide로 유도체화하여 전처리하는 방법이 보편화되고 있다. 그러나 이 분석법은 고함유 단백질을 포함하는 두류 시료의 경우 과량의 단백질에 의하여 methylation 유도체화 과정이 심하게 방해를 받아 분석 회수율이 매우 낮은 문제점이 있다. 본 연구는 고단백 함유 팥 시료에 대하여 단백질을 제거 과정을 적용한 후 dithiocarbamate계 살균제인 mancozeb와 metiram에 대한 회수율 개선을 확인하고자 수행되었다. 팥 시료에 대한 제단백 과정은 chlorformgel method를 적용하였으며, mancozeb의 회수율은 53.2 ± 10.0%(0회), 71.4 ± 4.7%(1회), 78.5 ± 9.0%(2회), 92.3 ± 2.4%(3회), 100.8 ± 3.3%(4회)이며, metiram의 회수율은 51.3 ± 4.3%(0회), 71.7 ± 2.9%(1회), 80.4 ± 2.0%(2회), 92.3 ± 4.6%(3회), 101.5 ± 3.5%(4회)이었다. 연구 결과 mancozeb와 metiram 잔류분석을 위한 팥 시료 중 제단백 과정은 3회가 적합한 것으로 판단하였다. 제단백 과정을 적용한 개선된 잔류분석법은 정량한계(LOQ) 0.01 mg kg-1, 회수율 85.3~92.7%, 변동계수 2~10%로 유효성 검증기준을 충족하였다. 본 분석법을 팥을 포함하는 두류 또는 단백질 함량이 높은 농산물 등에 적용한다면 난분석 dithiocarbamate계 살균제의 잔류분석법 개선에 일조할 것으로 판단된다.
Abstract
Mancozeb and metiram are a group of dithiocarbamate fungicides, poorly soluble in water and organic solvents, the methods used for extraction and purification during residue analysis are limited. Recently, a derivatization method in which extraction is performed using EDTA aqueous solution and methylated with methyl iodide for residue analysis of dithiocarbamates has become common. In addition, pulses samples, which are known with high protein content, could interfere with the methylation of dithiocarbamates and significantly reduce their recovery rates. Therefore, this study was conducted to improve the analytical method for mancozeb and metiram in red bean using HPLC/DAD and LC-MS/MS. To improve the accuracy of residue analysis, deproteinization was done followed by methylation. Deproteinization was performed multiple-times for each sample extract, and the recovery rates were observed. The recoveries obtained after deproteinization process were 53.2 ± 10.0% (no deproteinization), 71.4 ± 4.7% (1 time), 78.5 ± 9.0% (2 times), 92.3 ± 2.4% (3 times), and 100.8 ± 3.3% (4 times) for mancozeb. Whereas for metiram were 51.3 ± 4.3% (no deproteinization), 71.7 ± 2.9% (1 time), 80.4 ± 2.0% (2 times), 92.3 ± 4.6% (3 times), and 101.5 ± 3.5% (4 times). It was determined that the deproteinization process was suitable three times among red bean samples for residue analysis of mancozeb and metiram. The limit of quantitation (LOQ) for both compounds was 0.01 mg kg-1. The recovery yield of dithiocarbamates ranged from 85.3 to 92.7% with coefficient of variation 2.0~10.0%. Based on the finding, the current method could be applied to other dithiocarbamate groups in agricultural products containing high protein content and could contribute to the management system of pesticide safety.
Keywords:
Deproteinization, dithiocarbamate, red bean, methylation, residue analysis키워드:
제단백, dithiocarbamate계, 팥, 유도체화, 잔류분석서 론
Dithiocarbamate계 농약은 곰팡이성 병해에 효과적인 보호용 비침투성 살균제로 현재 국내외 농업분야에서 광범위하게 사용되고 있다(Malik AK et al., 1999; Kim et al., 2010; Leem et al., 2019). Dithiocarbamate계 살균제는 분자구조 내에 Fe (철), Mn (망간), Zn (아연) 등의 금속이온 및 유황을 함유하는 유기화합물로 dialkyl dithiocarbamate (DDC)계 농약 3종(thiram, ferbam, ziram), ethylene bis dithiocarbamate (EBDC)계 농약 5종(mancozeb, maneb, zineb, metiram, nabam), propylene bis dithiocarbamate (PBDC)계 농약 1종(propineb)으로 9종이 상용화되어 있다(Jagn et al., 2010; Leem et al., 2019). 특히 mancozeb, metiram, propineb, thiram 등 4종의 농약은 국내에서 과일류, 채소류, 두류 등 76종 농산물 중 발생하는 탄저병, 갈색무늬병 등 46종의 병해를 방제하기 위하여 보호 살균제 용도로 사용하고 있다(KCPA, 2022). 이 중 mancozeb는 2021년 출하량 기준 1,448 톤으로 국내에서 살균제로 사용량이 가장 많은 대표적인 농약이지만, 독성 측면에서 분해대사산물인 ethylenethiourea (ETU)를 생성함으로써 갑상선 및 간에 발암 독성을 유발하는 것으로 보고되어 이에 대한 안전성 관리와 조사 방안 마련이 필요하다(IARC, 1974; Ruddick et al., 1977; Park et al., 2021). 국내 식품의약품안전처는 감, 감귤 등 82종의 농산물에 대해 dithiocarbamate계 농약의 개별 농약에 대한 정성적 구분 없이 이황화탄소(CS2) 총합의 잔류물로 정의하고 있다. Dithiocarbamate계 농약에 대한 잔류허용기준은 0.05~20 mg kg-1으로 설정되어 있다(MFDS, 2022). 이는 국제적으로 공인된 잔류분석방법이 dithiocarbamate계 농약에서 발생된 CS2를 측정하는 발색분광법을 사용하고 있기 때문이다(Cullen, 1964; MFDS, 2022). 이러한 CS2에 대한 발색분광법의 정량한계는 0.1 mg kg-1 수준으로 현재 시행 중인 positive list system (PLS) 제도의 정량한계인 0.01 mg kg-1 수준을 만족하지 못하며, 전처리를 위한 전용 포집 장치가 필수적으로 필요하고 소요 시간, 정밀성이 떨어지는 단점이 지적되고 있다(Park, 2010; Leem et al., 2019). 이로 인해 dithiocarbamate계 농약의 안전성과 관련된 잔류 조사 실적은 매우 미흡한 실정이며, 잔류농약 안전관리를 위한 효율적이고 개선된 분석법이 요구되고 있다. 최근에는 ethylene diamine tetra acetic acid (EDTA) 수용액을 이용한 추출과 methyl iodide를 이용한 유도체화 방법으로 메틸화된 화합물을 크로마토그래프 분석기기를 이용한 잔류분석 방법이 개발되어 현장에서 실태조사 및 연구 분야에 주로 활용되고 있다(Jang et al., 2010; Park, 2010; L. zhou et al., 2013; Leem et al., 2019). 이 유도체화 방법은 과채류 및 과실류에 적용하였을 때 분석 재현성과 개별성분에 대한 정성분석이 가능하였지만, 본 연구에서 사용된 고지방, 고단백질을 함유하는 두류에 적용 시 회수율이 급격하게 떨어지는 문제가 발생하였다(Choi, 2019; Leem, 2019). 두류 중 함유된 단백질은 pH에 따라 용해도가 크게 달라지며, 이는 추출효율을 떨어뜨리거나 유도체화를 방해하는 간섭요인을 작용하였을 것으로 판단된다(Sohn et al., 1990; Choi, 2019). 단백질을 제거하는 방법으로 분자량의 크기에 따라 분리하는 물리적 방법과 chloroform 등 화학물질을 첨가하여 침전시키는 화학적 방법이 보고되어 있다(Naktinis VI et al., 1977). 단백질을 제거하는 물리적 방법은 분석장치 및 소요 시간이 긴 단점이 있는 반면, 화학적 방법은 조작이 단순하고 단백질 제거 효율이 높다는 장점이 있다(Naktinis VI et al., 1977; Leem et al., 2019). 따라서 본 연구에서는 임 등(2019)의 팥 중 propineb 분석에서 제안한 화학적 제단백 전처리방법을 토대로 고단백 함유 팥(Vigna angularis Willd.) 시료 내 대표적인 dithiocarbamate계 살균제인 mancozeb와 metiram을 분석하여 잔류분석법의 적합성을 검증하고자 수행되었다.
재료 및 방법
시료 선정 및 준비
분석 시료는 대표적인 두류 중 하나인 팥(Vigna angularis Willd.)(단백질 함량 21.59%)을 선정하였다(RDA, 2022). 잔류농약 분석을 위한 무처리 팥 시료는 시중 대형마트에서 유기농산물을 구매하여 –24oC에서 냉동보관 하였으며, 분석 시점에 일정량을 취하여 분석용 시료로 사용하였다.
시약 및 기구
추출용 수용액의 조제에 사용된 ethylenediaminetetraacetic acid-disodium (EDTA-2Na)은 Dae Jung (Siheung, Gyeonggi-do, Korea)의 guaranteed reagents (GR) grade를 사용하였고, sodium hydroxide (NaOH) (Yakuri Pure Chemicals Co., Ltd., Uji, Kyoto, Japan) 및 L-cysteine, 1,2-propanediol (Tokyo Chemical Industry Co., Ltd, Kashiai, Fukaya, Japan)은 순도 >98%를 사용하였다. 유도체화를 위한 methyl iodide는 Kanto Chemical (Soka, Saitama, Japan)에서 구입하여 사용하였다. pH 조절을 위해 사용된 tetrabutylammonium hydrogen sulfate (TBAH) (Sigma Aldrich, Inc., St. Louis, MO, USA)와 hydrochloric acid (HCl) (Merck KGaA, Darmstadt, Germany)는 모두 GR grade를 사용하였다. 이 밖에 sodium sulfate anhydrous, sodium chloride anhydrous는 Dae Jung (Korea), amyl alcohol은 Junsei Chemical (Koshigaya, Saitama, Japan), n-hexane, methanol, dichloromethane, chloroform, d-water는 Merck KGaA (Darmstadt, Germany)에서 GR grade를 구입하여 사용하였다. 전처리과정에서 사용된 기구 중 진탕기는 Jeio Tech (Korea)의 Lab. Companion IS-971R 및 Benchmark Scientific (Sayrevile, NJ, USA)의 BV1010 제품을 사용하였으며, 감압농축기는 Tokyo Rikakikai (Koishikawa, Tokyo, Japan)의 Eyela NE-1001, 원심분리기는 Beckman Culter Life Sciences (Brea, CA, USA)의 Allegra X-15R를 사용하였다.
검량 표준용액 조제
본 연구에 사용된 mancozeb (purity 97.5%)와 metiram (purity 90.0%)의 분석용 표준품은 AccuStandard (USA)에서 구입하여 사용하였다(Table 1). 검량용 표준용액 조제를 위해 mancozeb 101.0 3mg, metiram 101.11 mg을 L-cysteine 0.5 g와 0.25 M ethylenediaminetetraacetic acid-disodium (EDTA-2Na) 수용액(0.45 M NaOH 수용액, pH 9.5~9.6)에 녹여 100 mg kg-1가 되도록 하여 stock solution을 조제하였다. 이를 0.01, 0.02, 0.05, 0.1, 0.2, 0.5, 1.0, 2.0, 2.5 mg kg-1의 농도가 되도록 조제한 working solution을 methyl iodide를 이용하여 유도체화 과정 후 HPLC/DAD에 20 μL 주입하여 peak의 면적을 기준으로 표준검량선을 작성하였다.
분석기기 조건
유도체화된 농약 2종(macozeb, metiram)의 정량분석을 위한 분석기기는 HPLC/DAD (Dionex ultimate 3000, Thermo Fisher Scientific, Germany)를 사용하여 Table 2의 조건에 따라 분석하였다. 순수한 이동상 d-water 및 acetonitrile과 분석컬럼 CAPCELL PAK C18 UG 120 (4.6 mm id. × 250 mm L., 5.0 μm, Shiseido, Japan)을 사용하여 무처리 peak로부터 선택성이 확보된 분석조건을 설정하였다. 정성분석을 위한 분석기기는 LC-MS/MS (TSQ Quantum Access Max, Thermo Fisher Scientific, San Jose, CA, USA)를 사용하여 Table 3의 조건에 따라 분석하였다. 이동상 용매는 0.1% formic acid를 포함한 d-water 및 acetonitrile과 CAPCELL CORE C18 (2.1 mm id. × 150 mm L., 2.7 μm, Shiseido, Japan)을 사용하여 분리하였다. 전기분무이온화(electrospray ionization, ESI)의 ion source에서 negative mode로 SRM (selected reaction monitoring) 조건을 확립하여 분석하였다.
제단백 전처리 및 유도체화
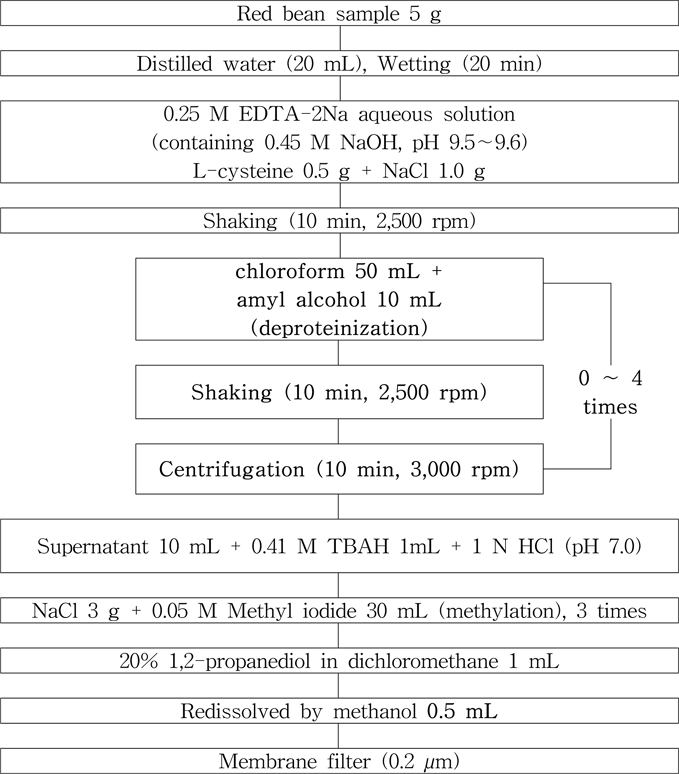
팥에 대한 추출과 유도체화 과정은 임 등(2019)의 방법을 따라 다음과 같이 수행하였다. 시료는 건조상태 팥 5 g을 polyethylene tube에 담아 측량하여 사용하였으며, 습윤화를 위해 d-water 20 mL를 첨가하여 20분간 침지하였다. 습윤화된 팥 시료는 0.25 M ethylenediaminetetraacetic acid-disodium (EDTA-2Na) 수용액(0.45M NaOH 수용액, pH 9.5~9.6) 80 mL과 L-cysteine 0.5 g 및 sodium chloride 1.0 g를 첨가한 후 균질기로 10분간 진탕·추출하였다. 추출액에 chloroform 50 mL와 amyl alcohol 10 mL를 첨가하여 2,500 rpm으로 10분간 진탕한 후, 3,000 rpm으로 10분간 원심분리하였다. 원심분리가 완료된 후, 추출 상등액 모두를 다른 PE tube로 옮겨 동일한 방법으로 반복하여 진행하였다. 이후, 상등액 10 mL를 취하여 0.41 M tetrabutylammonium hydrogen sulfate 수용액 1 mL와 1M HCl를 첨가하여 pH 7.5로 신속하게 조절한 후 분석을 위한 유도체화 시료로 사용하였다. 추출과정 중 발생하는 단백질은 chloroform-gel법을 적용하여 제거하였으며, 처리 횟수에 따른 최적의 제단백 효과를 확인하고자 하였다(Zumbo et al., 2012). 제단백을 위한 chloroform-gel 법의 처리 횟수는 0회(대조구), 1회, 2회, 3회, 4회까지 반복하여 시험하였다. 이후 상등액 10 mL를 취하여 0.41M tetrabutylammonium hydrogen sulfate 수용액 1 mL를 첨가하였으며, 1 M HCl 수용액을 첨가하여 pH 7.0으로 신속 조절한 후 유도체화 시료로 사용하였다. 용액이 담겨 있는 분액여두에 sodium chloride 3 g을 넣고 0.05 M methyl iodide가 함유된 n-hexane:dichloromethane(1:4, v/v) 용액 30 mL로 3회 methylation한 후, sodium sulfate anhydrous 층을 통과 탈수시키고 약 10분간 실온에서 방치하였다. 여기에 20% 1,2-propanediol을 함유한 dichloromethane 1 mL를 넣고 rotary vacuum evaporator를 이용하여 30oC 이하의 수욕 상에서 감압·농축하였으며 정량 한계를 고려하여 최종 희석량을 0.5 mL로 재용해한 후 HPLC/DAD로 회수율을 측정하였다(Fig. 1).
유효성 검증
팥 시료 중 제단백을 위한 chloroform-gel 법을 적용하였을 때 dithiocarbamate계 농약 2종(mancozeb, metiram)에 대한 시험 적합성을 판단하기 위하여 유효성 검증을 수행하였다. CODEX 가이드라인(codex alimentarius commission, CAC/GL-71)에 따라 검량선의 직선성(linearity), 정량한계(limit of quantitation, LOQ), 회수율(recovery), 정밀성(precision), 정확성(accuracy) 등을 산출하였다(MFDS, 2016).
결과 및 고찰
정량 분석조건 확립
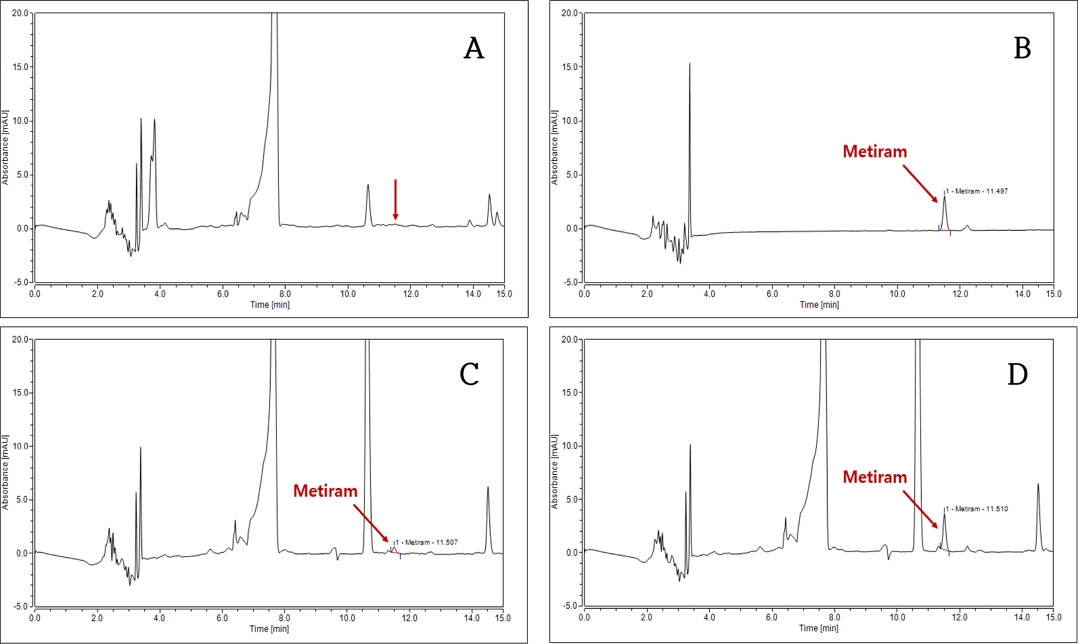
본 연구에 대상 성분인 dithiocarbamate계 농약 2종(mancozeb, metiram)은 망간(Mn) 및 아연(Zn) 등 금속이온을 포함하며, 물 또는 각종 유기용매에 매우 낮은 용해도를 가지고 있어 일반적인 방법으로 용해 및 추출의 적용이 제한적인 화합물이다(Park, 2010; Leem et al., 2019). 본 연구에서 표준용액 조제 및 추출용매로 사용된 EDTA-2Na 킬레이트제(chelate) 수용액은 농약 2종(mancozeb, metiram)의 화학구조 내 금속이온과 결합함으로써 리간드를 형성하여 수용액에 용해될 수 있게 하는 역할을 수행한다(Park, 2010; Choi, 2019). 또한 수용액으로 전이된 농약 2종(mancozeb, metiram)은 methyl iodide (CH3I)로 유도체화되어 유기용매층으로 전이됨에 따라 기기분석 과정에서 시료 주입, peak 머무름 및 검출이 가능하였다(Park, 2010; Choi, 2019; Leem et al., 2019). 유도체화된 mancozeb, metiram 등 2종의 표준물질은 흡광도 272 nm 영역에서 가장 우수한 감도를 나타내었으며, 이를 HPLC/DAD 분석을 위한 파장으로 선정하였다(Choi, 2019; Leem et al., 2019). 무처리의 간섭 peak와 구별되는 조건을 확립하기 위해 C18 컬럼을 이용한 gradient로 분리조건을 설정하였으며, 시료 20 μL를 주입하였을 때 용매와 팥 시료 중에 함유된 유도체화 mancozeb와 metiram의 peak를 확인하였다(Fig. 2, 3).
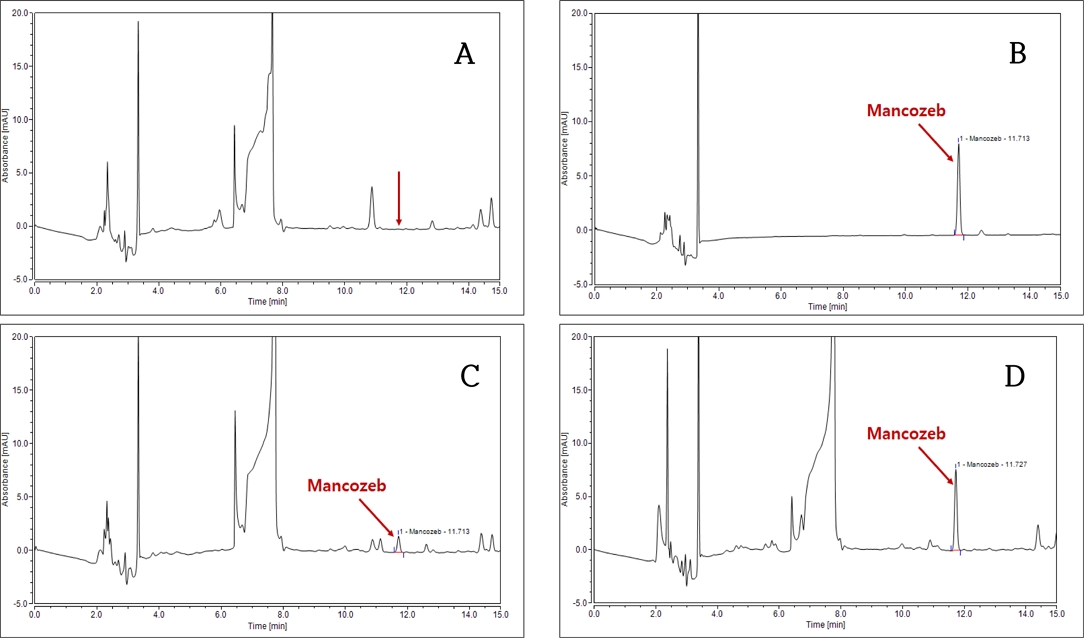
Chromatograms of mancozeb in red bean (Vigna angularis Willd.) using HPLC/DAD (272 nm). A: Control, B: Standard (0.5 mg kg-1), C: Fortification (0.1 mg kg-1), D: Fortification (0.5 mg kg-1).
Chloroform-gel 법을 적용한 제단백(deproteinization)
추출용매로 사용된 EDTA-2Na 수용액은 팥 시료 중 함유된 다량의 단백질을 용해하여 농약 2종(mancozeb, metiram)과 동시에 추출됨에 따라 유도체화 과정을 방해하는 요인으로 작용한다(Sohn et al., 1990; Choi, 2019; Leem et al., 2019). 이에 추출 수용액에 중 포함된 단백질을 제거하기 위해 chloroform-gel 법을 적용하였으며, 이에 따른 제단백 효율을 평가하였다. Chloroform-gel 법을 이용한 제단백은 단백질 변성에서 의한 침전을 유도하는 과정으로 서로 다른 용해도를 가진 용매를 첨가하는 액-액 추출법(liquid-liquid extraction)을 이용하였다(Sevag et al., 1938; Oswald, 2021). 변성된 단백질은 EDTA-2Na 수용액과 chloroform 유기용매 사이에 emulsion 형태로 존재하였으며, 제단백 과정을 0회부터 4회까지 반복하면서 추출물 중 단백질층이 감소하는 경향이 뚜렷하게 확인되었다(Fig. 4).
제단백에 따른 mancozeb와 metiram의 회수율 변화 및 최적 횟수 선정
팥 시료 중 제단백 과정의 반복 횟수를 0~4회까지 증가하였을 때 mancozeb 및 metiram 성분에 대한 회수율 변화를 측정하였으며, 효율성을 고려한 최적 횟수를 선정하였다. 제단백 횟수에 따른 회수율 변화는 mancozeb 53.2~100.8%, metiram 51.3~101.5%을 나타내었다(Table 4). 2성분 모두 제단백을 진행하지 않은 시료에서 유효한 회수율 70% 미만이었지만, 4회까지 제단백 횟수를 증가함에 따라 증가율 89.7~91.0%로 유의미한 회수율의 상승을 확인하였다. 이 결과를 토대로 제단백의 반복 횟수는 3회로 최종 선정하였으며, 전처리과정에서 소모되는 용매사용량, 소요 시간 등을 고려하여 판단하였다.
유효성 검증
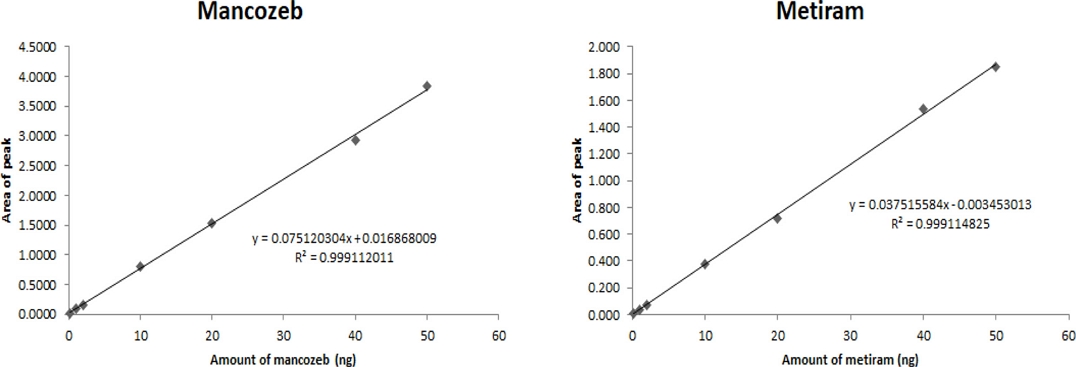
팥 시료 중 dithiocarbamate계 농약 2종(mancozeb, metiram)에 대한 정량한계(LOQ)는 S/N ratio 3 이상을 만족하는 검출한계(LOD)를 산출한 후 전처리과정에서 사용된 시료량(g), 용매량(mL), 최종 희석배수 등을 고려하여 산출하였다. 무처리시료 peak가 겹치지 않는 머무름시간의 기기적 검출한계는 mancozeb과 metiram 모두 0.2 ng (0.01 mg kg-1) 수준에서 S/N ratio 3 이상을 만족하였으며, 정량한계는 산출식(1)에 따라 0.01 mg kg-1이었다. 유도체화된 mancozeb과 metiram의 표준용액을 9 농도 (0.01~2.5 mg kg-1) 범위에서 분석하였을 때 검량선은 0.999 이상의 매우 우수한 직선성(R2)을 만족하였다(Fig. 5). 정량한계 수준의 10배, 50배를 처리하여 3반복 분석하였으며, 이에 대한 회수율 및 편차를 이용하여 정확도 및 정밀도를 산출하였다. Mancozeb과 metiram의 회수율은 각각 85.3~92.7%, 91.3~91.5%이며, 상대표준편차(RSD)는 1.1~2.7로 정확도 70~120%와 정밀도 20% 이내로 유효성 검증 항목을 모두 만족하였다(Table 5).
산출식(1)
| (1) |
A: 최소검출량 B: 시료의 부피 C: 시료의 양 G: 기기주입량
D: 최종 부피 E: 시료의 부피 F: 희석배수
LC-MS/MS를 활용한 유도체화 mancozeb와 metiram 정성 확인
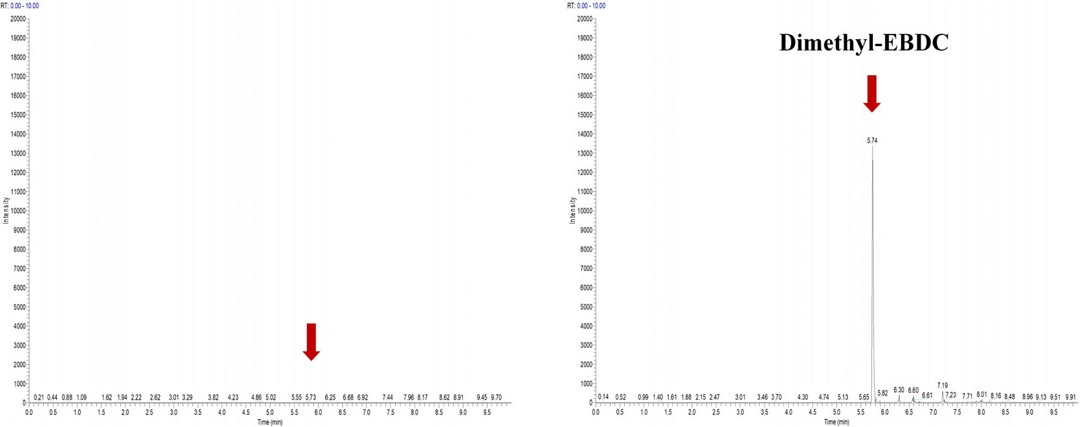
팥 시료에 대한 농약 2종(mancozeb, metiram)의 정성적 확인을 위하여 LC-MS/MS를 이용하였다. Mancozeb과 metiram은 pH 9.5~9.6 상태의 EDTA-2Na 수용액에서 아연(Zn) 및 망간(Mn) 등 금속이온이 제거된 후 ethylenebisdithiocarbamic acid (EBDC)로 분해되며, methyl iodide로 유도체화 되어 dimethyl ethylenebisdithiocarbamate (dimethyl-EBDC)로 형성된다(Fig. 6) (Guofeng Xu et al., 2017). 유도체화 된 dimethyl-EBDC의 formula는 C6H12N2S4 (240.44 g mol-1)이며, mancozeb과 metiram은 LC-MS/MS의 분석에서 동일한 화학구조와 분자량을 나타내어 정성적으로 구분되지 않는다. LC-MS/MS 분석을 위해 ESI ion source의 negative ion mode를 사용하였으며, precusor ion은 [M-H]- adduct, m/z 239.3과 product ion은 m/z 58.4, 223.5를 선정하여 정성분석을 수행하였다(Fig. 7). LC-MS/MS 분석 결과 팥 시료 중 mancozeb와 metiram의 제단백과 유도체화 과정을 거친 후 생성된 dimethyl-EBDC 화합물을 정성적으로 확인할 수 있었다. 본 연구는 임 등(2019)의 보고에서 제안되었던 제단백 과정을 dithiocarbamate계 살균제 mancozeb와 metiram에 대하여 확대 적용하여 분석법의 적합성을 검증할 수 있었다.
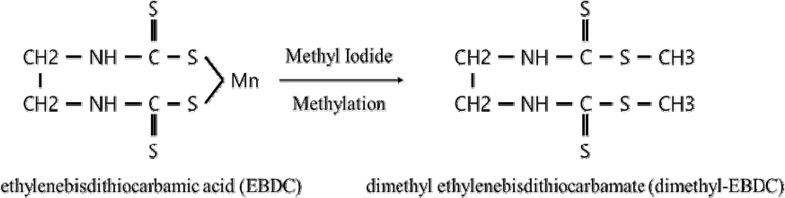
Formation of dimethyl ethylenebisdithiocarbamate (dimethyl-EBDC) through methylation reaction with methyl iodide for mancozeb and metiram.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
- Choi JY, 2019. Analytical efficiency of propineb residue in Glycine max Merrill and Pisum sativum L. containing high protein content using deproteinization process. Master, Kangwon national Univ., Chuncheon. Korea.
-
Cullen TE, 1964. Spectrophotometric determination of dithiocarbamate residues in food crops. Anal. Chem. 36(1):221-224.
[https://doi.org/10.1021/ac60207a067]

- Han, JH, Lee SH, 1995. Removal of complexed metals from the solution by Use of Gibbsite and Clay. Electronic Resource, Pp. 323-326. (In Koeran)
- Jang MR, Hwang KH, Lee ES, Kim EH, Yuk DH, et al., 2010. Characteristics on the conversion of EBDCs fungicides to ETU for mancozeb and metiram. Korean J. Pestic. Sci. 14(1):30-36. (In Koeran)
-
Jeon CW, Kwon Yh, Lee JH, Kwak YS, 2015. Improvement and effectiveness for chemical control protocol of sweet persimmon anthracnose disease. Korean J. Pestic. Sci. 19(3):312-316. (In Koeran)
[https://doi.org/10.7585/kjps.2015.19.3.312]

- Kim HY, Choi HJ, Eom JY, Seo EC, Choi SH, et al., 2010. Determination of dithiocarbamates in agricultural products circulated in Korea. Korean J. of Food Sci. Technol. 42(1):1-7. (In Koeran)
- Korea Crop Protection Association (KCPA), 2022. Korea Crop Protection. Seoul, Korea. (In Korean)
-
Leem SB, Lee JW, Choi JW, Choi JY, Ham HJ, et al., 2019. Improvement on analytical method of residual propineb in red bean (Vigna angularis Willd.) rich in protein. Korean J. Pestic. Sci. 23(1):17-25. (In Koeran)
[https://doi.org/10.7585/kjps.2018.23.1.17]

-
Malik AK, Faubel W, 1999. Methods of analysis of dithiocarbamate pesticides: a review. Pesticide Science. 55(10):965-970.
[https://doi.org/10.1002/(SICI)1096-9063(199910)55:10<965::AID-PS59>3.0.CO;2-7]

- Ministry of Food and Drug Safety, 2016. Standard Procedure for Preparing Testing Methods for Food, etc. Test Guidelines. Cheongwon-gun. Korea.
- Ministry of Food and Drug Safety, 2022. Appendex 4. Food standard and specifications. https://www.law.go.kr, (Accessed Sep. 02. 2022).
- Naktinis VI, Maleeva NE, San'ko DF, Mirzabekov AD, 1977. Two simple methods for isolation of DNA from various sources using cetavlon. Biokhimiia 42(10):1783-1790.
- Oswald N, 2021. The basics: How phenol extraction of DNA works. Bitesize Bio, UK.
- Park ES, 2010. Improvement and application of HPLC analysis method for determination of dithiocarbamates. Master, Konkuk Univ., Seoul, Korea.
-
Park ES, An YJ, Han U, Lee YJ, Kim HY, 2021. Removal effect of dithiocarbamates pesticide (Mancozeb) residues in agricultural products by washing methods. Korean J. Pestic. Sci. 25(4):407-414. (In Koeran)
[https://doi.org/10.7585/kjps.2021.25.4.407]

- Park SW, Song SO, Kim JS, 2001. Comparative analysis of carbamate pesticide residues in beef and fat using gelpermeation chromatography (GPC) and liquid-liquid partitioning (LLP). Journal of Preventive Veterinary Medicine, 25(2):107-112.
-
Ruddick JA, Newsome WH, Iverson F, 1977. A comparison of the distribution, metabolism and excretion of ethylenethiourea in the pregnant mouse and rat. Teratology. 16(2):159-162.
[https://doi.org/10.1002/tera.1420160208]

- Rural Development Administration, 2022. Standard food composition table. http://koreanfood.rda.go.kr/kfi/fct/fctFoodSrch/list, (Accessed Sep. 02. 2022).
-
Sevag MG, Lackman DB, Smolens J, 1938. The isolation of the components of streptococcal nucleoproteins in serologigally active form. The Journal of Biological Chemistry. 124(2):425-436.
[https://doi.org/10.1016/S0021-9258(18)74048-9]

- Sohn KH, Min SH, Chung HJ, 1990. Comparison of functional properties of various bean protein isolates. Yonsei Journal of Euthenics, 4:61-74. (In Koeran)
- Turner JA, 2018. The Pesticide Manual: A World Compendium. British Crop Protection Council, UK. Pp.707-1141.
- World Health Organization, 1974. Some anti-thyroid and related substances, Nitrofurans and Industrial Chemicals. Lyon, France.
-
Xu, G, Nie J, Li H, Yan Z, Cheng Y, 2017. Determination of mancozeb residue in fruit by derivatization and a modified QuEChERS method using ultraperformance liquid chromatography–tandem mass spectrometry. Analytical and Bioanalytical Chemistry. 409(21):5057-5063.
[https://doi.org/10.1007/s00216-017-0451-2]

-
Zhou L, Xu J, Luan L, Ma J, Gong Y, et al., 2013. Optimization and validation of a method based on derivatization with methylating agent followed by HPLC-DAD for determining dithiocarbamates residues. Acta Chromatographica. 25(4):613-625.
[https://doi.org/10.1556/AChrom.25.2013.4.2]

- Zumbo P, Mason E, 2012. Phenol-chloroform extraction. Weill Cornell Medical college Laboratory of Christopher Department of Physiology & Biophysics, USA. Pp. 1-7.
Hunju Ham, Environment Friendly Agricultural Products Safety Center, Doctor of Philosophy, https://orcid.org/0000-0001-9816-019X
Subin Leem, Department of Biological Environment, Kangwon National University, Master, https://orcid.org/0000-0002-9807-597X
Janghyun Hur, Department of Biological Environment, Kangwon National University, Professor https://orcid.org/0000-0003-2592-7147
Work and designed the experiment, Jang Hyun Hur
Experiments and analyzed the results, Hun Ju Ham and Su Bin Leem
Writing, Jang Hyun Hur, Hun Ju Ham and Su Bin Leem