
메틸브로마이드 대체 훈증제 포스핀을 이용한 수입 묘목류에 대한 약효 및 약해 연구
초록
최근 웰빙에 대한 국민의 관심이 높아짐에 따라 공기 정화, 관상용 등의 묘목류 수입이 증가하고 있다. 묘목류에 대한 소독은 주로 메틸브로마이드를 사용하고 있지만, 메틸브로마이드는 오존층 파괴물질로 지정되어 그 사용이 제한되고 있는 실정이다. 본 연구에서는 메틸브로마이드를 대체할 수 있는 훈증제 포스핀 훈증제를 이용하여 수입 묘목류와 깍지벌레류에 대한 약효 및 약해 평가를 하였다. 훈증제 포스핀을 이용한 수입 묘목류의 귤가루깍지벌레에 대한 24시간 훈증 약효의 경우 알과 성충의 LCt99값은 각각 25.2, 1.1 g h/m3이 확인되었으며, 총 13종의 수입 묘목류에 대한 포스핀 농도는 2 g/m3로 24시간 훈증처리 실내 실험 결과 호야 카노사(Hoya carnosa)의 흡착률이 69%로 가장 높았으며, 스투키(Sansevieria stuckyi)의 흡착률은 40%로 가장 낮았다. 그리고 13종 수입 묘목류에 대한 약해 평가의 경우 측정된 Ct값은 모두 귤가루깍지벌레 알의 LCt99값 이상으로 13종 모두 약해 증상은 발견되지 않았다. 수입 묘목류에 대한 포스핀의 중규모 및 대규모 실증실험으로 측정된 Ct값은 각각 40.2, 34.2 g h/m3으로 귤가루깍지벌레 알은 검역적 방제가 확인되었으며, 13종의 수입 묘목류에 대한 약해 평가 중 호야 카노사(Hoya carnosa)와 아이비(Hedera helix)등 2종에 1 이하의 약해 지수가 확인되었으나 약해 정도가 경미 하였고 나머지 11종의 수입 묘목은 약해 증상이 없었다.
Abstract
As a growing number of people is getting more interested in well-being and healthier lifestyles, the quantity of nursery plants imported is increasing. Currently, they are disinfected with methyl bromide, but the use of methyl bromide is being limited as it is designated as an ozone-depleting substance, Therefore, this study was aimed to develop an alternative disinfection substance and technology suitable for nursery plants. In the case of 24 h fumigation for Planococcus citri of imported nursery plants using fumigant phosphine in laboratory experiment, the LCt99 values of eggs and adult were 25.2 and 1.1 g/m3, respectively. Hoya carnosa is showed the lowest sorption rate of phosphine at 69%. In addition, in the case of phytotoxicity of 13 imported nursery plants, the Ct values measured were over the Lct99 value of Planococcus citri eggs and all nursery plants were no phytotoxic damage. In these two scaled-up experiments, the efficacy of Planococcus citri eggs was 100% completely controlled. In the case of phytotoxicity for 13 imported nursery plants, Hoya carnosa and Hedera helix showed mild phytotoxic symptoms of index 1, but the others were not confirmed phytotoxic damage.
Keywords:
LCt99 value, methyl bromide, nursery plants, Planococcus citri, phosphine키워드:
귤가루깍지벌레, 수입 묘목, 메틸브로마이드, 포스핀서 론
전 세계가 FTA 체결 등 국가 간 교역 증대로 과일, 채소류뿐만 아니라 묘목류, 절화류, 구근류 같은 생식물의 수입이 해마다 증가하고 있다(APQA, 2020). 특히 묘목류는 120개국에서 2,150종류 이상이 수입되고 있으며, 그 중 드라세나와 고무나무가 50% 이상을 차지하고 있다. 그리고 2014년 묘목류의 수입은 295건에 1,771,860개가 수입되었고 검역해충에 의한 묘목류의 검사 건수는 54건에 23톤으로 이중 39건을 폐기 처분하였다(APQA, 2014). 또한 2016년 상반기 묘목류 수입 검역 건수는 선인장 등 4품목이 931건에 7,307개, 검역처분 건수로는 340건에 소독 42건, 폐기 처분이 12건으로 많은 양의 묘목류가 폐기 처분되고 있다(APQA, 2016).
수입 묘목류는 깍지벌레류, 달팽이류, 개미류가 많이 발견되어 소독처리 되고 있으며, 이 중 깍지벌레류는 현재 수입 묘목류에 많이 발견되는 검역 해충이다(Hong et al., 2012, Prado et al., 2008). 귤가루깍지벌레는 전세계적으로 분포하고 있고 식물을 흡즙하여 생장 장애를 주며(Demirci et al., 2011), 암컷 성충은 솜 덩어리 같은 물질의 알주머니를 형성하여 기주식물을 지저분하게 만들어 관상용 식물 재배에 문제가 되는 해충이며 1년에 수세대 발생하는 온실 해충으로 알려져 있다(Park et al., 2012). 기주식물은 관상용 식물인 묘목, 난, 선인장류를 포함하여 온실에서 재배되는 과일나무와 장미, 포인세티아와 같은 화훼 식물 등 여러 종류의 관엽식물 등이 있다(Bivins and Deal, 1973). 이러한 수입 묘목류의 깍지벌레류에 대한 국내 소독처리기준은 온도에 따라 methyl bromide 농도를 설정하여 2시간 훈증처리하고 있으나, methyl bromide는 수출입 농산물의 검역 방제를 위해 전세계적으로 많이 사용되고 있으나 1989년 몬트리올 의정서를 통해 오존층 파괴물질로 지정돼 지난 2015년부터 세계적으로 생산 및 수입이 중단되었고(Park et al., 2020) methyl bromide의 농업용 사용이 제한됐으며 검역용으로는 예외를 두고 있으나 2008년 국제식물보호기구(IPPC)가 검역용 methyl bromide의 사용 감축 또는 대체를 권장하고 있다(Holmes et al., 2020, Park et al., 2011). 또한 인축에 대한 만성 독성이 있으며, 피훈증물에 대한 약해가 심하고 잔류가 문제가 되는 물질이다(Hansen et al., 2000, Weller et al., 1998). 따라서 농림축산검역본부 식품검역부를 중심으로 훈증제 소독기법을 연구 개발 추진하고 있으며 현재 ethyl formate, phosphine (인화늄, 마그톡신, 포스핀 가스) 등이 농약으로 등록되어 사용되고 있다.
특히 피훈증물에 대한 잔류와 약해 피해가 심하여(Yang and Liu, 2017) methyl bromide 소독 처리한 묘목류 중 약해 피해가 심한 것은 시설하우스에서 따로 정식하여 재배한 후 일부 회복된 묘목을 다시 판매하고 있다. 따라서 수입 묘목류 소독에 대한 대체 훈증물질이 필요한데 현재 국내 수입 농산물에 대한 소독처리방법은 methyl bromide 훈증제외 phosphine, ethyl formate, HCN 등이 등록되어 사용되고 있다(Kim et al., 2016, Lee et al., 2019, Rambeau et al., 2000).
훈증제 phosphine은 독성이 매우 강하여 살충 활성이 매우 높고(Sen et al., 2009) 공기 중에서 산화되어 오존층 파괴 등 환경에 부작용이 없으며, 진딧물류, 응애류, 선충류, 하늘소류 등의 검역 해충에 대한 다양한 국내외 기초 연구결과(Finkelman et al., 2012, Lee et al., 2018, Liu 2012, Zuryn et al., 2008)를 통해 methyl bromide 대체제로 효능이 검증되었지만 수입 묘목류 중 야자나무, 드라세나, 행복나무, 폴리시아스, 크로톤에 대한 phosphine 소독처리 기준 설정을 제외하고는 수많은 수입 묘목류에 대한 소독기준이 설정되어 있지 않아 추가 확대연구가 필요하다.
결론적으로 현재 묘목류에 대한 소독처리는 methyl bromide와 phosphine을 사용하지만 methyl bromide는 오존층 파괴 물질로 지정되어 잠정적으로 사용에 제한하고 있으며, 피훈증물에 대한 심각한 약해 유발 등의 문제가 있고 phosphine는 일부 품목한에서 적용이 되어있는 상황이다.
따라서 우리는 훈증물질 phosphine을 이용하여 수입 묘목류의 깍지벌레류에 대한 약효 평가와 약해 평가를 통해 수입 묘목류의 methyl bromide 소독처리를 대체할 수 있는 대체물질 개발 연구를 하였다. 해당 연구의 결과는 다양한 품목에 대한 확대 연구를 통해 깍지벌레류 외 수입 묘목류의 나무좀류, 달팽이류, 개미류 등과 같은 다른 검역 해충에 대한 methyl bromide 소독처리를 대체할 수 있는 자료가 될 수 있을 것이며, 묘목류와 같은 생식물류의 해충 방제에 대한 또 다른 방제 연구를 마련할 수 있을 것이다.
재료 및 방법
훈증제와 실험 해충 및 수입 묘목
실험에 사용된 훈증제 phosphine은 비바킬(㈜팜한농)이라는 제품으로 98%의 CO2에 2%의 phosphine이 가스화된 제형으로 농림축산검역본부(김천, 한국)에서 제공받아 깍지벌레류에 대한 약효 평가 및 13종 수입 묘목류에 대한 약해 평가하였다. 수입 묘목류의 검역 해충 깍지벌레류 약효 평가는 귤가루깍지벌레(Planococcus citri)를 사용하였고 농림축산검역본부에서 분양 받아 경상대학교 식물의학과 사육실에서 온도 25 ± 1oC, 광주기 16L:8D, 상대습도 60~70%의 조건으로 감자 절편 위에서 사육하였다. 실험에 사용된 수입 묘목류는 최근 5년간 수입량이 많은 13품목을 선정하였고 13개 품목으로 알로카시아(Alocasia cardlien), 백단 선인장(Echinopsis chamaecereus), 산세베리아(Sansevieria trifasciata), 크로톤(Codiaeum variegatum), 청페페(Peperomia obtusifolia), 줄페페(Peperomia puteolata), 호야 카노사(Hoya carnosa), 산호수(Viburnum dooratissimum), 스파티필름(Spathiphyllum wallisii), 관음죽(Rhapis excelsa), 아이비(Hedera helix), 팔손이(Fatsia japonica), 스투키(Sansevieria stuckyi)를 경남 진주시 수입 묘목류 원예 판매장에서 유묘 상태로 구매하였다. 구매한 수입 묘목류는 화분으로 옮겨 심고 경상대학교 식물의학과 식물 재배실에서 온도 27±1oC, 광주기 16L:8D, 상대습도 60~70%의 조건에서 재배하였다.
Phosphine 훈증제의 검출량 조사 및 CT값 산출
가스 제형의 훈증제 phosphine은 데시케이터(6.8 L)에 뚜껑을 덮어 진공 구리즈로 밀폐를 하고 입구 주둥이 부분에 고무 격막을 끼워 넣었고 그 곳에 주사기를 꽂아 가스를 주입하였다. 데시케이터 내부의 phosphine 농도를 확인하기 위하여 훈증 10분, 1, 2, 4, 24시간에 GC (GC-17 A, Shimadzu, Japan)와 N PD d etector로 분석하였다. GC의 분석조건은 oven 100oC, injector와 detector 각각 250, 280oC에서 캐리어 가스는 헬륨으로 flow rate 1.5 ml/min 상태에서 흘려주고, 칼럼은 DB5-MS (30 m × 0.25 mm i.d., 0.25 μm film thickness; J&W Scientific, Folsom CA)을 사용하였다. 처리량 확인을 위하여 tedlar gas bag에 1L 공기를 넣고 phosphine의 standard 농도 값으로 처리 후 분석된 GC peak area 값으로 회귀선을 만들어 시간별 조사된 phosphine의 GC peak area 값을 대입하였다. Phosphine의 훈증처리를 위한 농도는 Ren et al. (2011)을 통해 산출되었다.
Vf = 훈증제 가스 처리량(mL), T = 온도(oC), C = 처리하고자 하는 농도 (mg/L), V = 훈증 용기의 부피 (L), P = 기압(mm Hg), M = 훈증제의 몰 질량, N = 훈증제 순도(%).
분석된 모든 훈증제의 농도는 Ren et al. (2006)을 참고하여 CT 값으로 산출되었다.
귤가루깍지벌레 성충과 알에 대한 약효 실내 평가
귤가루깍지벌레 알과 성충을 대상으로 실험을 하였으며, 알과 성충은 붓으로 감자 절편에 각각 30마리씩 옮기고 이를 메쉬가 있는 페트리디쉬(SPL, 100 mm × 40 mm)에 접종하여 데시케이터에 마그네틱 바와 같이 넣고 밀폐시켰다. 성충과 알에 대한 처리 농도는 0.05, 0.1, 0.3, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0 g/m3로 드라세나 묘목에 대한 기존의 소독처리 규정 T201-17를 참고하여 20±1oC에서 24시간 훈증처리하였다. 훈증 10분, 1, 2, 4, 24시간에 데시케이터 내부 phosphine 농도를 GC-NPD로 분석하고 이를 CT값으로 산출하였다. 훈증이 끝난 데시케이터는 fume-hood로 옮겨 뚜껑을 개방한 후 2시간 동안 배기를 하였다. 배기가 끝나고 성충과 알은 사육실로 옮기고 각각 2일, 28일 후 사충 조사를 하였고 Lct(Lethal Concentration × Time)값으로 나타내었다. 실험은 무처리를 포함하여 모두 3반복 처리하였다.
수입 묘목류에 대한 phosphine 훈증 흡착 및 약해 실내 평가
13종 수입 묘목에 대한 phosphine 훈증처리에 대한 흡착 및 약해 평가는 13종의 수입 묘목을 화분에서 꺼낸 후 뿌리의 흙을 털어 6.8 L의 데시케이터에 5%의 용적률(w/v)로 채우고 밀폐시켰다. 처리 방법은 앞의 훈증 약효 평가 실험방법과 같았으며, 처리 농도는 2 g/m3로 20 ± 1oC에서 24시간 훈증처리 하였다. 13종 수입 묘목 각각의 흡착률을 확인하기 위하여 훈증 10분, 1, 2, 4, 24시간 데시케이터 내부 phosphine 농도를 GC-NPD로 분석하였다. 13종 수입 묘목의 흡착률은 Cn/C0 (n시간 분석된 농도/초기 분석된 농도)로 나타내었고 분석된 농도는 CT값으로 산출하였다. 훈증처리가 끝난 데시케이터는 hume-hood로 옮겨 2시간 동안 배기한 뒤 수입 묘목을 식물 재배실로 옮기고 14일 후 약해 평가되었다. 묘목류에 대한 약해 평가는 엽록소 측정기(SPAD-502 Plus, Spectrum Technologies Inc., Bridgend, UK)를 이용하여 잎의 신초에 대한 엽록소 함량을 측정하였고, 색차계(TES 135A, Electrical & Electronic Corp., Taipei, Taiwan)를 이용하여 잎의 신초에 대한 색차를 Hue value(빨강, 녹색, 파랑의 3색의 밝기 값)로 측정하였으며, 육안으로 작물 약해 지수를 사용하여 작물 전체에 대한 약해 증상을 관찰하였다. 이 때 약해 지수는 5단계로 (0: 약해 없음, 1: 아주 가벼운 약해로서 작은 약반이 약간 인정됨, 2: 처리된 잎의 적은 부분이 약해가 인정됨, 3: 처리된 잎의 50% 정도 약해가 인정됨, 4: 상당한 피해를 받고 있으나 아직 건전한 부분이 남아있음, 5: 심한 약해를 받고 고사 상태임) 구분하였다. 약해 측정이 완료된 수입 묘목들은 다시 작물 재배실에서 3개월 동안 재배하여 피해 받은 잎이 회복되거나 작물이 생장하는지에 대해 관찰하였다. 모든 실험은 무처리구를 포함하여 3반복으로 처리하였다.
수입 묘목류에 대한 phosphine 중규모 훈증 실험
13종 수입 묘목에 대한 phosphine 훈증 중규모 실험은 경북 김천시 농림축산검역본부 식물검역센터 내 1.0 m3 훈증 챔버에서 실험을 진행하였으며, 13종 수입 묘목은 뿌리의 흙을 제거하여 무게를 측정하고 엽록소 함량, 색도, 약해 지수를 조사하였다. 조사가 끝난 묘목들은 5%의 용적률(w/v)로 훈증 챔버에 각각 채워 넣고 공시충 귤가루깍지벌레 알 500여개를 감자 절편에 접종하여 훈증처리 하였다. 중규모 실험에 사용한 phosphine 훈증제는 비바킬(phosphine 2% + CO2 98%)이며 20 ± 1oC에서 각각 2.0 g/m3 농도로 24시간 훈증처리 하였다. 훈증 10분, 1, 2, 4, 24시간에 챔버와 컨테이너 내부의 phosphine 가스를 샘플링 하여 GC-NPD로 분석하였고 이를 Ct값으로 산출하였다. 24시간 훈증처리가 끝나고 챔버를 개방한 후 2시간 동안 배기를 하였다. 배기가 끝난 챔버에서 귤가루깍지벌레 알과 13종의 수입 묘목을 각각 실내 사육실과 식물 재배실로 옮기고 약효 평가는 28일 후, 약해 평가는 14일 후 조사하였다. Phosphine 중규모 실험에서 귤가루깍지벌레 알에 대한 약효 평가는 무처리를 포함하여 5반복, 13종 수입 묘목에 대한 약해 평가는 무처리를 포함하여 5반복으로 조사하였다.
수입 묘목류에 대한 phosphine 대규모 훈증 실험
13종 수입 묘목에 대한 phosphine 훈증 대규모 실험은 경북 김천시 농림축산검역본부 식물검역센터 내 10.0 m3 훈증 컨테이너에서 실험을 진행하였으며, 13종 수입 묘목은 뿌리의 흙을 제거하여 무게를 측정하고 처리 전 엽록소 함량, 색도, 약해 지수를 조사한 후 컨테이너에 5%의 용적률(w/v)로 채워 넣고 공시충 귤가루깍지벌레 알을 감자 절편에 접종하여 1,000개를 훈증처리 하였다. 대규모 실험에 사용한 phosphine 훈증제와 훈증 처리 조건은 중규모 실험 방법과 동일하였으며, 훈증 10분, 1, 2, 4, 24시간에 컨테이너 내부의 phosphine 가스를 대형 주사기로 샘플링 하여 GC-NPD로 분석하였고 이를 Ct값으로 산출하였다. 24시간 훈증처리가 끝난 컨테이너는 개방한 후 2시간 동안 배기를 하였다. 배기가 끝나고 귤가루깍지벌레 알과 13종의 수입 묘목은 컨테이너에서 실내 사육실과 식물 재배실로 옮기고 약효 평가는 28일 후, 약해 평가는 14일 후 조사하였다. Phosphine 대규모 실험에서 귤가루깍지벌레 알에 대한 약효 평가는 무처리를 포함하여 5반복, 13종 수입 묘목에 대한 약해 평가는 무처리를 포함하여 5반복으로 조사하였다.
통계 분석
훈증제 phosphine의 귤가루깍지벌레에 대한 실내 약효 평가 값은 SAS 프로그램(ver. 9.4; SAS Institute Inc., 1998)을 이용하여 Probit Regression (프로빗 회귀분석)법으로 분석하였다.
실험 결과
귤가루깍지벌레 성충과 알에 대한 약효 실내 평가
귤가루깍지벌레 성충을 phosphine 24시간 훈증처리 시 최대한 낮은 농도에서 70% 이상의 사충률이 확인되어 LCt50값은 구할 수가 없었지만, Lct99값은 1.1 g h/m3을 확인하였다. 알의 LCt50값과 LCt99값은 각각 13.8, 25.2 g h/m3으로 성충이 알에 비해 훨씬 감수성이 높았다(Table 1).
수입 묘목류에 대한 phosphine 훈증 흡착 및 약해 실내 평가
13종의 수입 묘목에 대한 2.0 g/m3로 24시간 훈증처리 했을 때 모든 수입 묘목의 흡착량은 훈증 10분 초기 농도의 10%였으며, 훈증 24시간의 흡착률은 스파티필름, 관음죽, 아이비, 팔손이, 스투키 등 5종이 50%였으며, 나머지 8종은 70%의 흡착률을 확인하였다(Fig. 1). 13종의 수입 묘목류에 대한 Phosphine 24시간 처리 Ct값은 스투키가 31 g h/m3로 가장 높게 확인되었고 호야 카노사가 20 g h/m3로 가장 낮게 측정되었으며, 13종의 수입 묘목에 대한 약해는 무처리구와 비교 시 약해 지수, 엽록소 함량, 색도 등 차이가 없었다(Table 2).
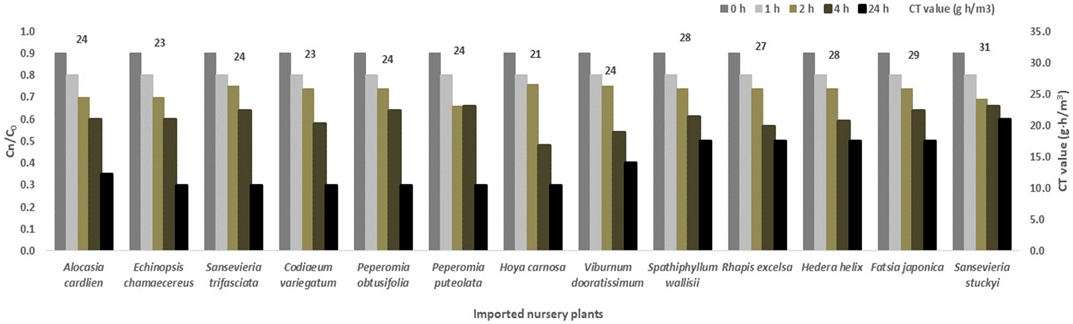
Sorption of phosphine by fumigation times after exposure of 2 g/m3 phosphine to 13 nursery plants in 12 L desiccator with 2.0% loading ratio (w/v) at 20oC for 24 hours. (Cn: concentration of n-time, C0: initial concentration).
수입 묘목류에 대한 Phosphine 중규모 훈증 실험
Phosphine 농도 2 g/m3로 귤가루깍지벌레 알과 13종 수입 묘목을 대상으로 중규모(1.0 m3) 훈증챔버에서 24시간 훈증처리 한 결과 최종 Ct값은 40.2 g h/m3이었고 귤가루깍지벌레 알의 사충률은 100%로 확인되었다(Table 3). 13종 수입 묘목류에 대한 약해 평가는 알로카시아, 백단 선인장, 산세베리아, 크로톤, 줄페페, 청페페, 산호수, 스파티필름, 관음죽, 팔손이, 스투키 등 11종은 중규모 및 대규모 실험에서 phosphine에 대한 약해 증상이 없었고 호야 카노사와 아이비 등 2종은 phosphine에 대한 각각 약해 지수 1.0, 0.7로 부분적으로 잎이 갈변되는 증상이 확인되었으나 3개월 후 모두 회복되는 것을 확인하였다(Table 4).

Mortality of Planococcus citri eggs fumigated with 2 g/m3 phosphine for 24 hours in a 1 m3 fumigation chamber at 20 ± 1oC
수입 묘목류에 대한 Phosphine 대규모 훈증 실험
13종 수입 묘목류와 귤가루깍지벌레 알에 대한 phosphine 대규모(10.0 m3) 컨테이너에서의 농도 2 g/m3로 24시간 훈증처리 한 결과 최종 Ct값은 34.2 g h/m3로 중규모 실험에 비해 낮게 나왔으나 귤가루깍지벌레 알은 100% 방제가 되었다(Table 5). 13종 수입 묘목류에 대한 약해 평가는 중규모 실험의 결과와 같이 호야 카노사와 아이비 등 2종을 제외한 나머지 11종은 phosphine에 대한 약해 증상이 없었으나 호야 카노사와 아이비는 모두 약해 지수 1.0으로 경미한 약해 증상이 확인되었으나 3개월 후 모두 회복되는 것을 확인하였다(Table 6).

Mortality of Planococcus citri eggs fumigated with 2 g/m3 phosphine for 24 hours in a 10 m3 fumigation chamber at 20 ± 1oC
고 찰
수입 묘목류의 검역 해충에 대한 검역적 방제는 현재 국내에서 methyl bromide 훈증제를 이용하고 있다. 그러나 훈증제 methyl bromide는 만성 독성과 오존층 파괴물질로 지정 되어있고 같은 초본 식물 카네이션, 국화 등과 같은 생식물류에 대하여 심각한 약해 영향을 주는 것으로 알려져 있어(Kempton and Maw, 1974, Zhang et al., 2012) 수입 묘목류에 대한 대체 훈증제 연구가 필요하다. 최근 methyl bromide 대체 훈증물질로 ethyl formate와 phosphine 훈증제 등이 다양한 연구들을 통해 대체 물질로 사용되고 있다. Ethyl formate 훈증제는 짧은 시간 노출에도 해충에 대한 살충력이 뛰어나지만(Kim et al., 2021) 흡착이 심하고(Haritos et al., 2006) 제초 특성이 있어 일부 초본식물에 약해가 발생한다(Deewatthanawong et al., 2017, Jeong et al, 2020, Kyung et al., 2019). 그러나 phosphine 훈증제의 경우 높은 사충률을 얻기 위해 훈증 노출 시간이 길어야 하는 반면 phosphine 훈증제는 수입 묘목류(Cho et al., 2019)와 절화류와 같은 장미(Kim et al., 2016)에 대한 약해 반응이 없었다.
수입 묘목류의 귤가루깍지벌레 알과 성충에 대한 24시간 phosphine 훈증 시 확인된 Lct99값은 각각 25.2, 1.1 g h/m3로 알이 더 방제 값이 높은 것을 확인하였으며, 이는 훈증제에 대한 해충 충태 별 약제 반응이 다르다는 것을 알 수 있었으며, 저곡해충 Trogodema inclusum와 Dermestes maculatus와 아스파라거스 가해 해충 꽃노랑총채벌레 등의 해충은 성충에 비해 알에 대한 phosphine Lct99값이 높았고(Athanssiou et al., 2020, Kyung et al., 2018) 훈증제 ethyl formate 또한 벗초파리, 점박이응애 등은 해충에 대한 Lct99값이 성충보다 알이 높았다(Kwon et al., 2021, Lee et al., 2018).
13종 수입 묘목류에 대한 phosphine의 24시간 훈증 흡착 평가 결과 스파티필름, 관음죽, 아이비, 팔손이, 스투키 등 잎이 작거나 개수가 적은 품종의 흡착률은 50%였고 반면 잎이 크거나 개수가 많은 알로카시아, 산세베리아, 백단 선인장, 크로톤, 청페페, 줄페페, 호야 카노사, 산호수 등 8종에 대한 흡착률은 70%로 높게 확인되었다. 국화, 카네이션, 장미 등과 같은 절화류에 대한 12시간 phosphine 훈증 시 흡착량은 20-40%로 품종에 따라 달랐다(Zhang et al., 2013). 또한 수입 묘목류에 대한 phosphine 24시간 훈증시 호야 카노사, 아이비 등 2종이 실내 및 중·대규모 평가에서 경미한 약해가 발생되었으며, 이는 훈증 처리 3개월 후 생장에 문제가 없음을 확인하였다. 앞서 선행연구에서 다른 품종의 수입 묘목류에 대한 긴꼬리가루깍지벌레 유충과 성충의 phosphine Lct99값은 각각 3.95, 5.29 g h/m3로 본 연구의 귤가루깍지벌레의 Lct99값보다 낮았으며, 수입 묘목류에 대한 약해 증상은 발견할 수 없었다(Kyung et al., 2019).
따라서 본 연구결과를 바탕으로 훈증제 phosphine은 현재 국내에서 수입 묘목류의 깍지벌레에 대한 methyl bromide 소독을 대체할 수 있는 물질임을 확인할 수 있었다. 그러나 해충의 검역적 방제를 위해 장시간 노출이 필요하다는 한계점 또한 확인이 되었으나 앞서 phosphine 훈증제와 CO2, 저온 처리, 다른 훈증제 간의 혼합 처리를 통해 해충의 약효를 증대하여 처리 시간에 대한 단축과 처리량의 감소로 인해 경제적이면서 효과적인 소독처리 기법을 통해 한계점을 보완할 수 있어 본 연구는 이러한 연구들의 선행 연구자료로 가치가 있다 생각한다.
Acknowledgments
본 연구는 농림축산검역본부 공동연구사업(과제번호: PQ20170B017)의 연구지원에 의해 수행되었다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
- Animal and Plant Quarantine Agency. 2014. Year book of plant quarantine statistics. pp. 2-54.
- Animal and Plant Quarantine Agency. 2016. Year book of plant quarantine statistics. pp. 7-11.
- Animal and Plant Quarantine Agency. 2020. Year book of plant quarnatine statistics. pp. 6.
-
Athanssiou CG, Phillips TW, Arthur FH, Aikins MJ, Agrafioti P, et al., 2020. Efficacy of phosphine fumigation for different life stages of Trogoderma inclusum and Dermestes maculatus (Coleoptera: Dermestidae). J. Stored Prod. Res. 86:101556.
[https://doi.org/10.1016/j.jspr.2019.101556]

- Bivins JL, Deal AS, 1973. Systemic insecticides for control of citrus mealybug in gardenias. Calif. Agric. 27(8):5-6.
-
Cho SW, Kim HK, Kim, BS, Yang JO, Kim GH, 2020. Combinatory effect of ethyl formate and phosphine fumigation on Pseudococcus longispinus and P. orchidicola (Hemiptera: Pseudococcidae) mortality and phytotoxicity to 13 foliage nursery plants. J. Asia Pac. Entomol. 23(1):152-158.
[https://doi.org/10.1016/j.aspen.2019.11.005]

-
Deewatthanawong R, Chanapan S, Suwanagul A, 2017. Evaluation of methyl bromide alternatives to control thrips in orchid cut-flowers. Acta Hortic.
[https://doi.org/10.17660/ActaHortic.2017.1167.57]

-
Demirci, F, Mustu M, Kaydan B, Ulgentuk S, 2011. Laboratory evaluation of the effectiveness of the entomopathogen; Isaira farinosa, on citrus mealy bug, Planococcus citri. J. Pest. Sci. 84:337-342.
[https://doi.org/10.1007/s10340-011-0350-9]

- Finkelman S, Navarro S, Navarro H, Ashbell G, Glaser U, 2012. Fumigation of fresh herbs with phosphine as a new quarantine treatment. IOBC/WRPS Bull. 81:193-197.
-
Hansen JD, Sell CR, Moffit HR, Leesch JG, Hartsell PL, 2000. Residues on apples and sweet cherries after methyl bromide fumigation. Pest Manag. Sci. 56(6):555-559.
[https://doi.org/10.1002/(SICI)1526-4998(200006)56:6<555::AID-PS167>3.0.CO;2-E]

-
Haritos VS, Damcevski KA, Dojchinov G, 2006. Improved efficacy of ethyl formtae against stored grain insects by combination with carbon dioxide in a ‘dynamic’ application. Pest Manag. Sci. 62(4):325-333.
[https://doi.org/10.1002/ps.1167]

-
Holmes GH, Mansouripour SM, Hewavitharana SS, 2020. Strawberry at the crossroads: management of soilborne disease in California without methyl bromide. Phytopathology. 110(5):956-968.
[https://doi.org/10.1094/PHYTO-11-19-0406-IA]

-
Hong KJ, Lee JH, Lee GS, Lee SH, 2012. The status quo of invasive alien insect species and plant quarantine in Korea. J. Asia Pac. Entomol. 15(4):521-532.
[https://doi.org/10.1016/j.aspen.2012.06.003]

-
Jeong IH, Lee GS, Park BY, Seo BY, Cho JR, et al., 2020. Phytotoxic damage of fumigant, ethyl formate, to vegetable crops and solanaceae plants by different temperature and humidity conditions. Korean J. Pestic. Sci. 24(4):403-409.
[https://doi.org/10.7585/kjps.2020.24.4.403]

-
Kempton RJ, Maw GA, 1974. Soil fumigation with methyl bromide: the phytotoxicity of inorganic bromide to carnation plants. Ann. Appl. Bio. 76(2):217-229.
[https://doi.org/10.1111/j.1744-7348.1974.tb07975.x]

-
Kim BS, Park CG, Moon YM, Sung BK, Ren YL, et al., 2016. Quarantine treatments of imported nursery plants and exported cut flowers by phosphine gas (PH3) as methyl bromide alternative. J. Econ. Entomol. 109(6):2334-2340.
[https://doi.org/10.1093/jee/tow200]

-
Kim HK, Park HC, Seok SJ, Kyung YJ, Kim GH, 2021. Effectiveness of ethyl formate as a fumigant of Blattella germanica and Periplaneta americana (Blattodea: Ectobiidae, Blattidae) in cross-border trade transportation. Insects. 12(11):1010.
[https://doi.org/10.3390/insects12111010]

-
Kwon TH, Park CG, Lee BH, Zarders DR, Roh GH, et al., 2021. Ethyl formate fumigation and ethyl formate plus cold treatment combination as potential phytosanitary quarantine treatments of Drosophila suzukii in blueberries. J. Asia-Pac. Entomol. 24(1):129-135.
[https://doi.org/10.1016/j.aspen.2020.11.008]

-
Kyung YJ, Kim HK, Cho SW, Kim BS, Yang JO, et al., 2019. Comparison of the efficacy and phytotoxicity of phosphine and ethyl formate for controlling Pseudococcus longispinus (Hemiptera: Pseudococcidae) and Pseudococcus orchidicola on imported foliage nursery plants. J. Econ. Entomol. 112(5):2149-2156.
[https://doi.org/10.1093/jee/toz125]

-
Kyung YJ, Kim HK, Lee JS, Kim BS, Yang JO, et al., 2018. Efficacy and phytotoxicity of phosphine as fumigants for Frankliniella occidentalis (Thysanoptera: Thripidae) on asparagus. J. Econ. Entomol. 111(6):2644-2651.
[https://doi.org/10.1093/jee/toy218]

-
Lee BH, Park CG, Park MG, Roh GH, Kim DB, et al., 2019. Ethyl formate fumigation for the disinfestation of red imported fire ants Solenopsis invicta Buren. J. Asia Pac. Entomol. 22(3):838-840.
[https://doi.org/10.1016/j.aspen.2019.06.013]

-
Lee JS, Kim HK, Kyung YJ, Park GH, Lee BH, et al., 2018. Fumigation activity of ethyl formate and phosphine against Tetranychus urticae (Acari: Tetranychidae) on imported sweet pumpkins. J. Econ. Entomol. 111(4):1625-1632.
[https://doi.org/10.1093/jee/toy090]

-
Liu YB, 2012. Oxygenated phosphine fumigation for control of Nasonovia ribisnigri (Homoptera: Aphididae) on harvested lettuce. J. Econ. Entomol. 105(3):810-816.
[https://doi.org/10.1603/EC11328]

-
Park MG, Sung BK, Cho JY, 2011. Residual characteristic of methyl bromide and hydrogen cyanide in banana, and pineapple. J. Appl. Biol. Chem. 54(3):214-217.
[https://doi.org/10.3839/jabc.2011.035]

-
Park MG, Choi JM, Hong YS, Park CG, Kim BG, et al., 2020. Negative effect of methyl bromide fumigation work on the central nervous system. PLoS ONE. 15(8):e0236694.
[https://doi.org/10.1371/journal.pone.0236694]

-
Park YU, Park JW, Lee SY, Yun SH, Koo HN, et al., 2012. Insecticidal activity of mixed formulation with buprofezin and single formulation without buprofezin against citrus mealybug, Planococcus citri Risso (Hemiptera: Pseudococcidae). Korean J. Pestic. Sci. 16(2):163-170.
[https://doi.org/10.7585/kjps.2012.16.2.163]

-
Prado J, Casanoves F, Hildago E, Benjamin T, Sadof C, 2008. Effects of production practices on the abundance of quarantine pests in Dracaena marginta in Costa Rican production fields. J. Econ. Entomol. 101(6):1779-1785.
[https://doi.org/10.1603/0022-0493-101.6.1779]

- Rambeau M, Benitez D, Dupuis S, Ducom P, 2000. Hydrogen cyanide as an immediate alternative to methyl bromide for structural fumigations. pp. 101-111. In: Donahaye EJ, Navarro S, Leesch JG. [Eds.] Proc. Int. Conf. Controlled Atmosphere and Fumigation in Stored Products, Fresno, CA, U.S.A.
-
Ren YL, Mahon D, 2006. Fumigation trials on the application of ethyl formate to wheat, spilt faba beans and sorghum in small metal bins. J. Stored Prod. Res. 42(3):277-289.
[https://doi.org/10.1016/j.jspr.2005.04.002]

-
Ren YL, Lee BH, Padovan B, 2011. Penetration of methyl bromide, sulfuryl fluoride, ethanedinitrile and phosphine into timber blocks and the sorption rate of the fumigants. J. Stored Prod. Res. 47(2):63-68.
[https://doi.org/10.1016/j.jspr.2010.04.006]

- SAS Institute Inc. (1998) SAS user’s guide, version 9.4, 6th edition. SAS Institute, Cary, NC.
-
Sen F, Meyvaci KB, Aksoy U, Emekci M, Ferizli AG, 2009. Effects of the post-harvest application of methyl bromide alternatives on storage pests and quality of dried fig. Turk. J. Agric. For. 33(4):403-412.
[https://doi.org/10.3906/tar-0809-11]

-
Weller GL, Van JE, Graver S, 1998. Cut flower disinfestation: assessment of replacement fumigants for methyl bromide. Postharvest Biol. Technol. 14(3):325-333.
[https://doi.org/10.1016/S0925-5214(98)00054-4]

-
Yang XB, Liu YB, 2017. Residual analysis of nitric oxide fumigation on fresh fruits and vegetables. Postharvest Biol. Technol. 132:105-108.
[https://doi.org/10.1016/j.postharvbio.2017.06.006]

-
Zhang F, Wang Y, Li L, Liu T, 2013. Effects of phosphine fumigation on postharvest quality of four Chinese cut flower species. Postharvest Biol. Technol. 86:66-72.
[https://doi.org/10.1016/j.postharvbio.2013.06.016]

-
Zuryn S, Kuang J, Ebert P, 2008. Mitochondrial modulation of phosphine toxicity and resistance in Caenorhabditis elegans. J. Toxicol. Sci. 102(1):179-186.
[https://doi.org/10.1093/toxsci/kfm278]

Tae Hyung Kwon, Institute of life science, Crop Protection Institute of Quality & Safety Evaluation of Agricultural Products, Kyungpook National University, Ph.D, http://orcid.org/0000-0002-8300-4028.
Dong Bin Kim, Institute of life science, Crop Protection Institute of Quality & Safety Evaluation of Agricultural Products, Kyungpook National University, Researcher. Chung Gyoo Park, Institute of life science, Gyeongsang university, Professor, http://orcid.org/0000-0003-3027-3520.
Sang Myeong Lee, SM BioVision Co., PhD. Byung Ho Lee, Crop Protection Institute of Quality & Safety Evaluation of Agricultural Products, Kyungpook National University, Research professor, http://orcid.org/0000-0003-4180-8076
Dong Bin Kim reared P.citri grown on potato in laboratory.
Method of control against P. citri with phosphine fumigation to imported orchids was suggested by Prof. Chung Gyoo Park and Dr. Byung Ho Lee.
Efficacy to P.citri and phytotoxicity to orchids with phosphine fumigation was investigated by Dr. Tae Hyung Kwon and Dr. Sang Myeong Lee.
