다배열생물검정방법을 이용한 과채류에 발생하는 점박이응애 정밀 관리용 약제 선발 기술
초록
시설 재배지에서 발생하는 점박이응애는 약제 저항성 발달이 빠르므로 정밀 방제를 위해 약효가 우수한 약제를 선발하여 사용하는 것이 필요하다. 본 연구는 다배열생물검정방법을 개발하여 점박이응애 관리에 적합한 화학합성 살충제와 유기농업자재를 선발하는데 초점을 두고 있다. 다배열생물검정방법의 적합성 평가에서 엽절편상에 잔류하는 화학합성 살충제는 인접한 엽절편 상에 접종한 점박이응애의 사충율에 영향을 미치지 않았으며, 기존 생물검정방법 대비 약효 평가 준비 시간을 약 21.7% 단축시킬 수 있었다. 26종의 화학합성 살충제와 38종의 유기농업자재를 대상으로 4일 동안 24시간 간격으로 사충율을 관찰한 결과, 9종의 시험대상 약제(P_Test_15, P_Test_19, P_Test_25, O_Test_01, O_Test_06, O_Test_13, O_Test16, O_Test_23, O_Test_32등)에서 평균적으로 높은 약효를 보였다. 화학합성 살충제의 경우 노출빈도가 낮고 신규등록약제에서 약효가 높은 특징이 있었다. 일부 유기농업자재의 경우 예방 뿐만 아니라 방제에도 활용이 가능한 것으로 판단된다. 약제 별 약효 발현 속도를 반영할 수 있는 가중산술평균사충율을 산출하였으며, 다섯 단계의 약효등급지수를 적용하여 야외 계통별 우수 약제를 선발하였다. 계통 별로 전체 64종의 약제 중에서 5에서 14종의 약제가 60%이상 사충율을 보였으며, 해당 약제는 대상 계통의 방제에 우선적으로 활용할 수 있을 것으로 판단된다. 요약하면, 다배열생물검정방법을 이용한 점박이응애 약효 평가 방법과 가중산술평균사충율을 이용한 약효등급지수는 시설재배지 점박이응애의 정밀 방제를 위한 우수 약제 선발에 기여할 것으로 기대된다.
Abstract
It is necessary to develop an appropriate selection technology for the precise management against two-spotted spider mite (TSSM) in glass houses due to the rapid development of resistance characters against various chemicals. This study focuses on the development of a multi array leaf dipping bioassay method (MLDB) and selection technology from synthetic pesticides and organic agricultural materials. In the suitability evaluation test of MLDB, residual synthetic insecticides of leaf disc were not affected on the mortality of TSSM on adjacent leaf discs, and the preparation time could be reduced about 21.7% compared to the conventional bioassay methods. As a result of mortality observation at 24h intervals for 4 days from 26 synthetic insecticides and 38 organic agricultural materials, 9 tested materials (P_Test_15, P_Test_19, P_Test_25, O_Test_01, O_Test_06, O_Test_13, O_Test16, O_Test_23 and O_Test_32) revealed the relatively high efficacy on averages. The low exposure frequency and newly registered synthetic insecticide revealed relatively high acaricidal efficacy. Some organic agricultural materials might be considered as control agent well as prevention. The weighted arithmetic mean mortality rate that can reflect the efficacy expression rate for each agricultural materials was employed, and five levels of efficacy rank index were applied to select appropriate agricultural materials for each field strain. Among of the total 64 candidate materials, 5 to 14 of the test materials revealed a mortality of 60% or more, and those might be preferentially utilized for the control of TSSM strains in respectively. In summary, the efficacy evaluation by MLDB and efficacy rank index by the weighed arithmetic mean mortality would contribute to the appropriate agricultural materials selection for the precise control of TSSM in glass houses.
Keywords:
Tetranychus urticae, Multi array leaf dipping bioassay, Organic agricultural materials, Synthetic pesticide, Efficacy rank index키워드:
점박이응애, 다배열생물검정, 유기농업자재, 화학합성 살충제, 약효등급지수서 론
4차산업혁명은 농업 분야에서 ‘스마트 팜’이란 이름으로 확산되어(MAFRA, 2016), 재배환경의 복합환경제어를 통해 다양한 작물의 품질 향상과 생산량 유지에 실질적인 기여를 하고 있다(Rogotis and Marianos, 2021). 병해충 관리에 있어서도 이미지 정보의 자동 수집을 통해 병징 및 가해 부위 자동 인식(Fuentes et al., 2017), 해충의 종동정 및 밀도 측정(Yao et al., 2014; Yao et al., 2017), 유인트랩상의 해충 밀도 파악(Ding and Taylor, 2016)등을 통해 자동 예찰을 가능하게 하며, 특히, 드론을 이용한 자동 예찰 및 방제 기술과 접목되어 활용되고 있다(Botta et al., 2022). 예찰을 통해 수집된 정보는 방제로 직결되는데, 주로 화학적 방제 기법을 토대로 수행되고 있다(Park et al., 2020). 대상 병해충이 특정 약제 저항성 개체군이어서 약효가 낮게 나타날 경우, 병해충 밀도가 증가할 수 있는 시간을 제공하여 약제의 과다 사용과 방제비용의 증대를 초래하기도 한다. 따라서 효과적인 화학적 방제를 위해 우수한 약효를 지닌 약제를 사용하는 것은 정밀 관리를 위해 반드시 필요하다.
점박이응애는 충체 길이 0.5 mm 미소 해충으로서 웅성단위 생식을 하며 세대 기간이 짧아 다양한 농작물에 적응능력이 높은 범세계적인 주요 해충이다(Gould, 1979). 국내에서는 약 100여종의 원예작물(채소, 과수, 화훼 그리고 특용 작물)을 가해하는 것으로 알려져 있으며(NCPMS, 2022), 점박이응애 방제를 위해 천적(Lee et al., 1997; Kwon et al., 1998)과 병원성 곰팡이(Shin et al., 2017)를 활용한 생물학적 방제 기법, 난황유(Park et al., 2008)와 식물추출물(Kim et al., 2009)을 이용한 친환경방제법 등이 개발되었다. 점박이응애에 가장 활발하게 사용되는 방법은 화학적 방제 기법으로서, 약 3,800 여종의 화학합성 살충제(단제기준)(PSIS, 2022)가 다양한 작물에 발생하는 점박이응애 방제를 위해 상용화되었으며, 살충기작의 특성은 신경근육계, 호흡계, 발육 및 생장계 등의 주요 기관계의 기능을 교란시켜 생장 및 밀도 증식을 억제시킨다(PSIS, 2022).
화학합성 살충제 등이 점박이응애 방제를 위해 연속적으로 살포될 경우 점박이응애 고유의 생태적 및 생리적 적응 특성에 의해 약제 저항성 기작이 발달하는 것으로 알려져 있다(Van Leeuwen et al., 2010). 국내에서는 1971년도부터 점박이응애 약제 저항성 연구가 시작된 이후로, 사과(Lee and Yoo, 1971; Cho et al., 1995; Song et al., 1995; Kim et al., 2007; Koh et al., 2009; Lee et al., 2010), 딸기(Choi et al., 2005; Shin et al., 2021), 그리고 장미(Lee et al., 2003; Kwon et al., 2015)등에서 야외 점박이응애 저항성 개체군이 존재하는 것으로 보고된 바 있다. 저항성 개체군의 출현은 대상 작물의 생산량을 감소시키고 농가의 방제 비용 증대를 유도한다.
효과적인 점박이응애 약제 저항성 개체군 관리를 위해서는 신속한 진단을 통한 야외 집단의 약제에 대한 저항성 판별이 선행되어야 한다(Kwon et al., 2015). 이를 위해 다양한 생물검정 방법, 생화학적 및 분자생물학적 기법을 토대로 개발되어 왔다. 생물검정법으로는 스프레이법, 엽침지법, 슬라이드침지법 등이 개발되어 감수성 계통 대비 반수치사 농도, 반수치사약량 또는 반수치사시간 등을 도출하는데 활용되었다(Lee and Harrison, 1969; Koh et al., 2009). 생화학적 진단기법은 점박이응애 계통으로부터 단백질 추출 후 주요 해독효소의 활성량 평가 및 특정 약제에 대한 작용점 단백질의 민감도를 통하여 평가할 수 있으며, esterase, cytochrome-P450, glutathion S-transferase, UGT 등의 해독효소의 과발현에 의해 발달하는 것으로 알려져 있다(Kim et al., 2004; Kim et al., 2007). 국내에서는 METI 계열의 살비제와 유기인계 약제의 작용점인 acetylcholinesterase 단백질을 추출하여 monocrotophos에 대한 약제 민감도 평가를 수행한 바 있으며, 야외 계통에서 저항성 돌연변이가 발생하였음을 추정하였다. 또한 분자생물학적 진단을 위하여 살비제 특이적인 돌연변이 마커가 발굴되었으며(Kwon et al., 2014; Kwon et al., 2015), 이는 다양한 진단기술과 접목되어 야외 개체군의 저항성 개체군의 돌연변이 진단을 가능하게 하였다. 국내 점박이응애 개체군은 이미 다양한 약제에 대해서 저항성 기작을 보유하고 있는 것으로 밝혀졌다.
점박이응애 야외 개체군의 저항성 발달 및 진단 기법 개발 연구는 국내 지역 계통의 저항성 분포 양상을 파악하고 초기 저항성 발달 확산을 이해하는데 중요한 정보를 제공할 수 있다. 하지만, 영농 현장에 필요한 우수 약제 선발을 위한 실질적 자료로 활용하는데 한계가 있다. 특정 약제에 대한 저항성 발달에 대한 개념은 약제 감수성 계통 대비 반수치사농도(혹은 약량)의 비율이 2-5배 이상인 것을 의미하는데(Tabashnik et al., 2014), 저항성 계통임에도 불구하고 상용 약제의 추천 농도에 방제가 가능하기 때문이다. 또한 생화학적 및 분자생물학적 저항성 관련 형질 정보는 특정 약제에 국한되어 있으므로 현장에 가용되는 다양한 약제에 대한 적합성을 평가하는데 한계가 있다. 따라서 영농 현장에 필요한 우수 약제 선발을 위해 ‘저항성’ 개념을 토대로 한 해충군 관리 보다 상용화되는 약제에 대한 '약효'를 기준으로 한 선발 가이드라인을 제시하는 것이 필요하다.
Kwon et al. (2020)은 엽침지기법을 기반으로 다양한 약제에 대한 약효를 평가한 바 있다. 본 연구는 과채류 시설재배지 주요 해충인 점박이응애 방제에 활용되는 화학합성농약과 유기농업자재의 우수 약제 선발 전략을 제시하기 위해 다배열생물검정기법을 개발하여 적합성을 평가하였고, 7종의 점박이응애 야외 계통을 대상으로 26종의 대표적인 화학합성 살충제와 38종의 유기농업자재에 대한 약효 반응 정보를 제시하였다. 또한 가중산술 평균 개념을 도입하여 4일 동안 수집된 사충율 정보를 통합하여 원예작물재배 현장에필요한 우수 약제를 합리적으로 선발하여 정밀 방제를 위한 기초자료를 제공하고자 하였다.
재료 및 방법
대상 계통
본 연구에 사용된 점박이응애 계통은 모두 8개 계통으로서, 다배열생물검정법의 적합성 검정에는 TU000계통을 사용하였고 화학합성 살충제와 유기농업자재에 대한 야외 계통의 약효 평가에는 딸기와 파프리카에서 채집한 7개 계통(TU002-TU008)계통을 사용하였다(Table 1). 채집 대상 계통은 파종 후 15-20일이 지난 강낭콩을 기주로 이용하여 아크릴케이지(400 × 400 × 500 mm)에서 온도 25 ± 2°C, 습도 60 ± 20% 조건에서 화학합성 살충제의 노출없이 증식하였다. 다배열생물검정법의 적합성 평가 및 약효 평가에 사용한 점박이응애는 우화 후 3-5일 사이의 암컷성충을 다음과 같은 방법으로 확보하여 이용하였다. 간략하게 요약하자면, 먼저 암컷 점박이응애 50마리를 강낭콩 엽절편(지름 7-8 cm)에 접종 후 24일 동안 28°C 조건에서 산란을 받은 후 암컷 성충을 모두 제거하였다. 24시간 동안 산란한 알은 7일차에 15일이 지난 강낭콩 포트가 있는 아크릴케이지에 옮겨 기주식물을 충분하게 공급하여 발육시킨 후, 산란 후 13-15일에 도달한 암컷개체를 실험에 사용하였다.
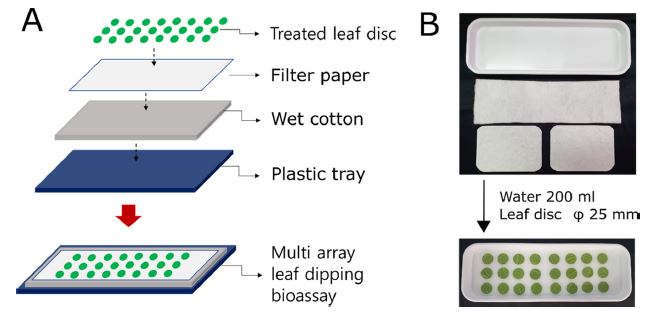
다배열생물검정법의 모식도
다배열생물검정법의 모식도는 Fig. 1과 같다. 플라스틱 트레이(440 × 150 × 400 mm, 청운)에 탈지면(410 × 150 mm, 동아위생재료, 경기)을 올린 후 물 200 mL을 첨가하고 필터 페이퍼(195 × 145 mm, 아리랑과학, 대구)를 2매를 이어서 올린다. 약제 평가를 위한 강낭콩엽절편(지름 30 mm)은 실험 대상 화학합성살비제와 유기농업자재에 추천농도에서 약 10초 침지 후 후드안에서 20-30분 음건한 후 다배열생물검정 용기에 12 × 3의 배열로 치상하였으며, 산란 후 13-15일 지난 암컷 점박이응애 성충을 15마리씩 접종하였다. 약효평가를 위해 약제 별 3반복 실험이 수행하였으며, 무처리구의 점박이응애 사충수를 이용하여 보정사충율을 산출하였다(Abbott, 1925).
다배열생물검정 적합성 평가
다배열생물검정 실험에서 인접하고 있는 엽절편에 잔류하는 약제 영향을 미치는지 평가하는 것이 필요하며, 이를 확인하기 위해 TU000계통을 이용하여 다음과 같은 과정의 실험을 수행하였다. 강낭콩 엽절편(지름 25 mm)을 3 × 3의 형태로 배열 후, 정중앙에는 물에 10초 동안 침지 후 음건한 엽절편을 치상하였고, 이를 둘러싸고 있는 나머지 8개의 엽절편은 P_Test_25 약제의 추천약량에 10초 동안 침지한 후 음건한 약제 침지 엽절편을 배치하였다(Fig. 2). 또한 엽절편 사이의 간격에 따른 엽절편에 잔류하고 있는 약액의 거리에 따른 간섭효과를 확인하기 위해 엽절편 사이의 간격을 0.5 cm, 1.0 cm 그리고 2.0 cm 별로 구별하여 배치하였다. 다배열생물검정법 상의 약제 처리에 대한 무처리구 실험으로는 약제 대신에 물에 침지한 엽절편을 3 × 3의 형태로 배열로 배치하였다. 기존의 페트리디쉬를 이용한 생물검정 방법과 비교하기 위해 Fig. 2와 같이 독립적으로 3 × 3의 형태로 분리한 엽절편상에 점박이응애 상치 후 무처리 사충율의 변화를 다배열생물검정방법과 비교하여 관찰하였다. 페트리디쉬를 이용한 생물검정방법은 페트리디쉬(지름 55 mm, SPL Life Science)에 사각탈지면(40 × 40 mm, ㈜두원사이언스, 경기) 4장을 올린 후 물을 추가하였고 강낭콩 엽절편을 치상하였다(Fig. 2). 부화 후 13-15일이 지난 암컷 점박이응애를 정중앙 엽절편에 15마리씩 접종하였으며, 96시간 동안 24시간 간격으로 사충율을 관찰하였다. 모든 실험은 3반복으로 수행되었으며 통계적 유의성은 다배열생물검정방법 상의 처리 및 무처리 조건의 시간 및 거리별 처리에 따른 사충율을 t-test를 이용하여 비교하였다(SigmaPlot software, Systat Software, Inc.).
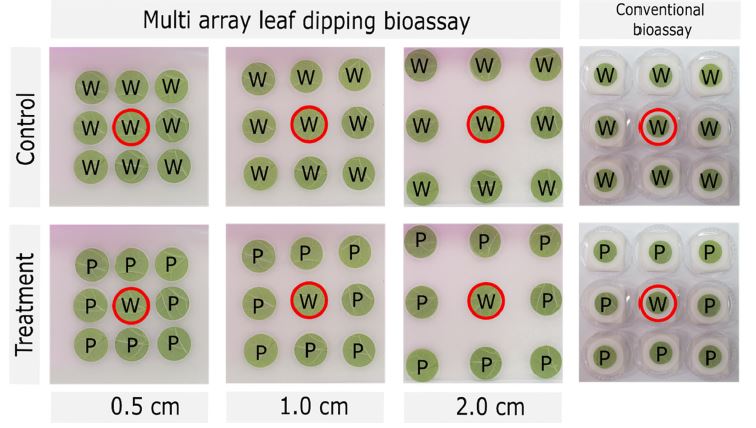
Images to approve the proficiency of multi array leaf dipping bioassay method comparing to conventional bioassay. In the middle of leaf disc (designated as open red circle), 15 female mites were inoculated and determined its mortality by 0.5 cm, 1.0 cm and 2.0 cm distance among leaf discs, respectively.
다배열생물검정법과 페트리디쉬를 이용한 엽침지 생물검정법 간의 효율성 평가
다배열생물검정법의 효율성을 페트리디쉬를 이용한 엽침지 생물검정법과 비교하였다. 24개 엽절편에 점박이응애 15마리 접종을 기준으로 두 종류의 단계 별로 각 단계(공통단계: 엽절편 침지 및 음건, 점박이응애 접종; 개별단계: 플라스틱 트레이 혹은 페트리디쉬 준비, 물보충, 사충율 관찰)별 소요 시간을 1개 엽절편상에 점박이응애를 접종하는 시간으로 산출하였다. 해당 실험은 3반복 수행되었으며, t-test를 이용하여 각 단계별 소요시간에 대한 통계적 유의성을 평가하였다(SigmaPlot software).
화학합성 살충제와 유기농업자재의 점박이응애에 대한 약효 평가
화학합성 살충제 26종(Table 2)과 유기농업자재 38종(Table 3)을 대상으로 다배열생물검정기법을 적용하여 약효 평가를 수행하였다. 강낭콩 엽절편(지름 30 mm)을 해당 약제의 추천 약량에 10초 동안 침지한 후 20-30분 동안 후드 안에서 음건한 후, 다배열생물검정용 용기에 치상하였으며, 딸기와 파프리카에서 채집한 점박이응애 7 계통을 대상으로 평가하였다. 실험에 사용한 점박이응애는 산란 후 13-15일이 지난 암컷 성충으로서 각 엽절편 상에 15마리씩 접종하였으며, 96시간 동안 24시간 간격으로 사충율을 관찰하였다. 사충 판별 기준은 붓으로 점박이응애를 자극한 후 3초 안에 충체길이 만큼 이동하지 못하는 개체를 죽은 개체로 간주하였다. 해당 계통에 대한 각 약제별 실험은 3반복으로 수행하였으며, 약제 처리 후 온도 25 ± 2°C, 습도 60 ± 20% 조건의 실내에서 이루어졌다. 약효의 통계분석은 R을 이용하여 이원배치분산분석을 수행하였다. 통계분석 과정에서 각각의 무처리구에 해당하는 P_Test_00와 O_Test_00에 해당하는 값은 보정사충율에 사용하였으므로 통계분석에 포함하지 않았다. 또한 시간 별 사후 검정은 Tukey’s HSD 검정을 통해 이뤄졌고, 각 처리 그룹간 유의성은 R library내의 multicomp를 이용하였다(R Development Core Team, 2020).
가중산술평균사충율을 이용한 점박이응애 계통별 우수 약제 선발
약효 우수성 평가는 가중산술평균사충율을 산출한 후 각 계통별 우수약제 선발에 활용하였다. 가중산술평균사충율은 사충율의 변화량을 가중치로 이용하여 관찰 초기 약효 발현 속도와 비례하여 평균사충율이 도출되는 특징이 있으며 다음과 같은 과정을 거쳐 도출하였다. 먼저, 각 약제별 0일에서 4일 동안 가중치에 해당하는 일일 사충율의 변화량을 산출한 다음, 약제별 일일 가중치를 각 일자별 사충율에 곱한 후, 마지막으로 각 기간별 가중치의 합으로 나누어 구하였다. 4일차 사충율과 가중산술평균사충율의 평균 비교에서는 무처리구를 포함한 사충율 정보를 토대로 R을 이용하여 약제별 일원배치분산분석을 화학합성 살충제와 유기농업자재 종류별로 분석하였다. 우수 약제 선발은 7개 지역 계통 점박이응애의 가중평균사충율을 다섯 등급(1등급, 81-100%; 2등급, 61-80%; 3등급, 41-60%; 4등급, 21-40%; 5등급, 0-20%)으로 구분한 후 2등급이상(60% 이상 사충율) 약효를 구분하여 선정하였다.
결 과
다배열생물검정 적합성 평가
다배열엽침지법은 엽침지기법을 기반으로 배열하므로(Fig. 1), 인접한 엽절편에 치상된 점박이응애의 생존에 미치는 영향을 평가하여야 한다. 약제가 잔류하고 있는 강낭콩 엽절편을 Fig. 2와 같이 배치한 후, 사충율의 변화를 각각 관찰하였다(Table 4). 먼저, P_Test_25가 처리된 엽상의 점박이응애는 24시간 안에 추천농도에서 100% 치사하는 것을 확인하였으며, P_Test_25처리구와 무처리구 엽상의 점박이응애 사충율을 비교하였다. 무처리구 사충율은 24시간 간격으로 96시간 동안 2.2~6.7%, 8.9~15.6%, 22.2~24.4%, 31.1~35.6%로 변화하였고, 처리구 사충율은 0~6.7%, 8.9~13.3%, 8.9~13.3%, 22.2~28.9%로서, 처리구와 무처리 구간의 통계적인 유의성은 발견되지 않았다(Table 4). 즉, 다배열엽침지법은 주변 약제 처리 엽절편의 잔류하는 농약에 영향을 받지 않으므로, 엽침지기법을 이용한 다배열생물검정이 다양한 농약을 대상으로 적용 가능한 것으로 확인되었다.

Mortality comparisons of middle leaf which was surrounded by water or insecticide treatment in multi array leaf dipping bioassay. In the conventional bioassay, the mortality evaluation of middle leaf in pesticide treatment could not be conducted because each leaf disc was independently separated by petri dish
다배열엽침지법과 페트리디쉬 독립평가 방법간의 생물검정 시간 비교
다배열생물검정법과 독립생물검정법 간의 초기 준비에서부터 점박이응애접종까지 소요시간을 비교하였다(Table 5). 실험 단계에서 엽절편 준비와 응애 접종 시간은 공통단계로 구분하였고, 생물검정용기준비 및 엽절편 배열, 사충율관찰, 그리고 물추가 부분은 개별단계로 구분하였다. 한개의 엽절편에 디스크 준비에서부터 점박이응애 접종까지 소요되는 시간은 다배열생물검정 방법은 1.23분이 소요되었고, 독립생물검정법에서는 1.57분 소요되어 다배열생물검정법이 19.5% 시간을 줄이는 것을 확인하였다(Table 5). 생물검정에서 시간이 가장 많이 소요되는 부분은 점박이응애 접종과 엽절편 준비 부분이였다(Table 5). 전체 생물검정에서 약 65-84% 차지하는 것으로 나타났다. 흥미롭게도 다배열생물검정법은 독립생물검정법에 비해 생물검정용기준비 및 엽절편 배열 부분과 사충율 관찰 부분에서 독립생물검정법 보다 83%와 34% 시간을 각각 절약하며, 다배열생물검정방법은 기존의 페트리디쉬를 활용한 독립생물검정법 보다 시간을 절약하는 것으로 나타났다.
화학합성 살충제에 대한 약효 평가 결과
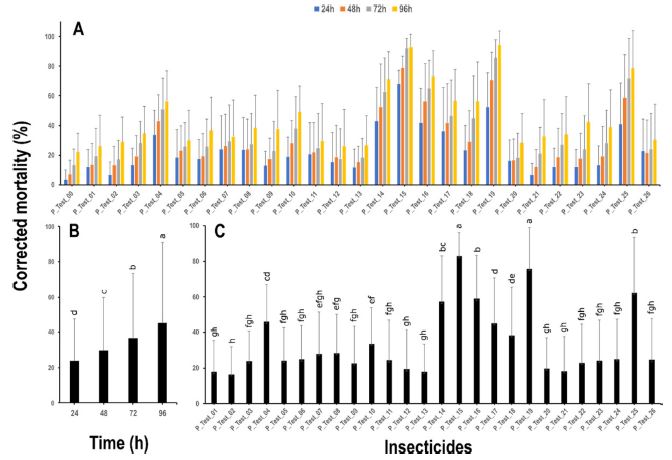
다배열생물검정기법을 이용하여 26종 화학합성 살충제에 대한 약효를 평가하였다. 대조구(P_Test_00)상의 점박이응애 사충율은 결과는 24시간 간격으로 3.3%, 7.2%, 13%, 22%로 사충율이 변동되는 것을 확인하였다(Fig. 3A). 7개 계통의 26종 약제에 대한 사충율은 8.9% - 96.8%로 다양하였으며(Fig. 3A), 시간이 경과함에 따라 시험 약제의 산술평균사충율이 통계적으로 유의하게 증가하는 것으로 나타났다(F3,2180 = 116.7, P < 0.001; Fig. 3B). 또한 대상 약제별 산술평균사충율에서도 통계적으로 유의한 차이가 있었다(F25,2158 = 73.1, P < 0.001; Fig. 3C). 다만, 산술평균사충율을 기준으로 시간 및 대상 약제에 대한 교호 작용은 통계적 유의성이 없는 것으로 확인되었다(F75,2080= 1.1, P = 0.309). 대상 약제별 산술평균사충율을 중심으로 50% 이상 사충율을 나타내는 약제를 선발하자면, P_Test_15, P_Test_19, P_Test_25, P_Test_14가 약 82%, 76%, 62%, 57%로 높게 나타났으며, P_Test_02, P_Test_01, P_Test_13은 약 16.5%, 17.6%, 18%로낮은 사충율이 관찰되었다(Fig. 3C).
유기농업자재에 대한 약효 평가 결과
유기농업자재 38종에 대하여 다배열생물검정 기법을 이용하여 약효를 비교하였다. 대조구(O_Test_00)의 결과는 96시간동안 24시간 간격으로 5.7%, 9.7%, 14.8%, 21.9%로 사충율 변화가 관찰되었다(Fig. 4A). 38종 약제에 대한 산술평균사충율은 4.4% - 89%로 다양하였으며(Fig. 4A), 화학합성 살충제와 마찬가지로 시간 경과에 따라 산술평균사충율이 통계적으로 유의하게 증가하는 것으로 나타났다(F3,3188 = 104, P < 0.001; Fig. 4B). 또한 유기농업자재별 산술평균사충율은 통계적으로 유의하게 차이가 있는 것으로 확인되었다(F37,3154= 69.3, P < 0.001; Fig. 4C). 다만, 시간 및 대상약제별 교호 작용은 화학합성 살충제와 마찬가지로 유의성이 없었다(F111,3040= 5.5, P = 0.99). 점박이응애 7 계통을 대상으로 약제별 산술평균사충율 50% 이상 약제를 중심으로 정리하면, O_Test_06, O_Test_23, O_Test_16, O_Test_32에서 76.9%, 73.1%, 69.5%, 63.3%로 높은 사충율이 나타났으며, O_Test_20, O_Test_21, O_Test_04는 약 9.4%, 11.6%, 14.5%의 낮은 사충율이 관찰되었다(Fig. 4C).
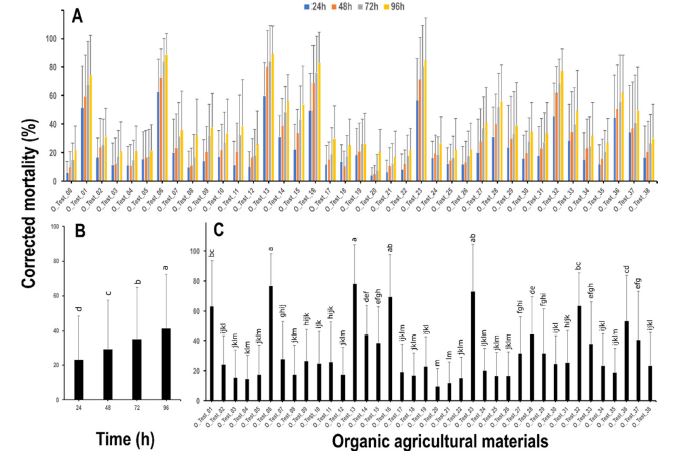
Mean corrected mortality with standard deviation by organic agriculturl materials by 24 h interval observation time during four days (A), observation time (B), and 26 organic agricultural materials (C). The small alphabetical characters on Fig. 3B and 3C represents the statistical difference determined by Tukey’s HSD test.
가중산술평균을 이용한 약효 평가약효등급지수를 이용한 우수 약제 선발
약제의 발현 속도와 약효를 동시에 반영할 수 있도록 각 일자별 사충율 차이를 가중치로 활용한 가중산술평균사충율을 구하였다. 각 약제별 산술평균사충율의 경우, 4일차 사충율보다 약 10-20%정도 낮게 나타나, 실제 약효값이 반영되지 않는 것을 확인하였다(Fig. 3C, Fig. 4C, Fig. 5). 또한 4일차 산술평균사충율을 사용할 경우에는 전체적인 사충율 값을 낮게 산출하여 원래의 약효를 판단하는데 어려움이 있었다(Fig. 5). 반면에 가중산출평균사충율을 적용할 경우, 4일차 결과값을 사충율의 속도를 반영한 것으로 일관적인 기준으로 약효 판단이 가능하였다.
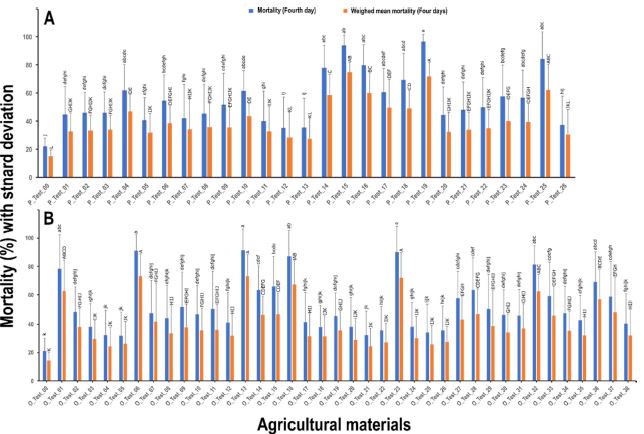
Mortality comparison between fourth day mortality and weighed mean mortality during four days by insecticides (A) and organic agricultural materials (B), respectively. Small alphabet of lowercase and uppercase represent the statistical significance for the fourth day mortality and the weighed mean mortality, respectively, which was determined by Tukey’s HSD test.
가중산술평균사충율의 값을 1등급에서 5등급의 다섯단계로 지정한 후, 7개 계통의 지역 계통 점박이응애를 대상으로 전체 64개 실험대상 약제 별로 등급을 산출하였다. 계통별 무처리구의 약효 등급은 대부분 5등급으로 나타났다(Fig. 6). 반면에, 각 계통의 전체 64개 실험대상 약제에 대한 약효는 계통별로 다양한 패턴을 보였다(Fig. 6). TU002계통에서부터 TU008계통까지 각각 12, 6, 15, 5, 10, 14, 7종 약제가 2등급 이상(60% 이상)의 약효를 보이는 것으로서, TU004계통이 15개로 가장 많았고, TU005계통이 5개로서 가장 적었다. 해당 우수 약제는 해당 계통의 방제 프로그램에 활용이 가능할 것으로 판단된다.
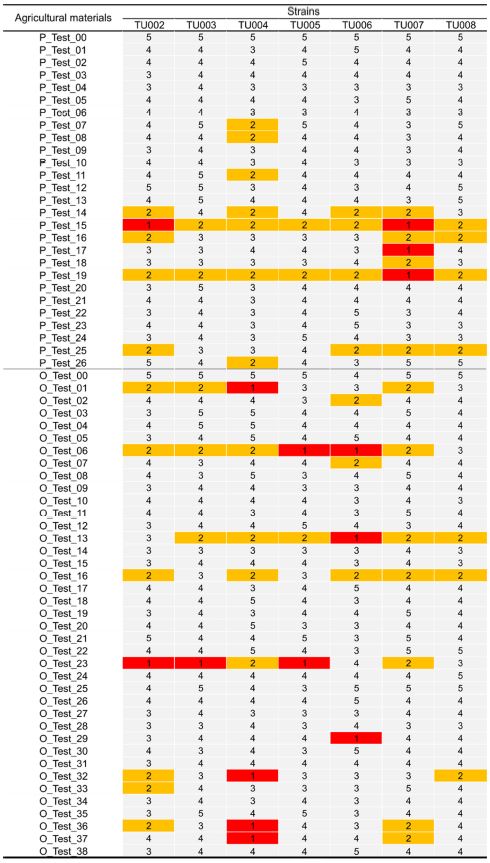
Efficacy rank index determined by weighted mean mortality from 64 agricultural materials in seven field strains. Number ‘1’ to ‘5’ represent the efficacy rank index ranged in the mortality of 81-100%, 61-80%, 41-60%, 21-40%, and 0-20%, respectively. Red and yellow filled color boxes represent the efficacy rank index of number ‘1’ and ‘2’, respectively.
고 찰
화학합성 살충제와 유기농업자재의 적절한 사용은 신속하고 간편하게 과채류 점박이응애 방제 효율을 극대화시킬 수 있다. 하지만, 야외 점박이응애 개체군은 이미 다양한 약제에 노출되어 복합저항성 개체군이 존재할 수 있으므로(Lee et al., 2003; Choi et al., 2005; Kwon et al., 2014; Shin et al., 2021), 약효가 우수한 약제를 토대로 방제를 수행할 수 있는 관리 기술이 필요하다. 일반적인 약제 저항성 개체군에 대한 관리 기준은 작용기작을 달리하여 약제를 선발하여 사용할 것을 제안하지만(IRAC, 2022), 대상 농장에 발생하는 해충에 대한 약제별 사전 약효 정보가 부재할 경우 방제 실패를 유발할 수 있다. 본 연구에서는 영농 현장에 우수한 사전 약효 정보 제공을 위해, 점박이응애를 모델 해충으로 다배열생물검정법의 적합성을 평가한 후 64종의 약효 정보를 도출하였다. 7개 지역계통 점박이응애를 대상으로 약효 반응 평가 결과 대상 계통별로 다양하였으며 이러한 이유는기존 약제의 노출 빈도와 농도에 기인한 것으로 판단된다. 가중산술평균사충율을 기준으로 다섯 등급으로 나눈 결과에서는 각 계통별로 2등급 이상의 약제의 수가 5종에서 14종으로 서로 다르게 나타나, 우수 약제 정보는 대상 농가에 발생한 점박이응애의 정밀 관리에 기여할 것으로 판단된다(Fig. 6).
기존의 점박이응애의 약효 평가는 주로 슬라이드침지법, 엽침지법, 관주침지법, 그리고 관주침지법 등으로 수행되어 왔다(Dittrich, 1962; Dennehy et al., 1983; Koh et al., 2009). 대부분의 약효 평가는 약제별 반수치사농도 혹은 약량을 산출하기 위한 것이며, 영농 현장적응성을 위해 슬라이드침지법을 기준으로 기술 개발이 고려된바 있다(Dennehy et al., 1987). 본 연구에서는 현장에서 활용하는 다양한 약제에 대한 신속한 정보 확보를 위해 처리 방법과 시간을 단축하기 위해 다배열생물검정법을 토대로 구현하였다(Fig. 1). 한 개 엽절편당 준비시간은 1.23분으로서 다양한 약제에 대한 평가 속도를 확대시킬 수 있을 것으로 판단되며, 기존의 페트리디쉬를 이용한 독립생물검정법과 비교하였을 때 18% 단축한 것을 확인하였다(Table 5). 특히, 엽절편 준비와 관찰에서 3%와 17%로서 통계적으로 유의하게 차이가 있는 것을 확인하였다(Table 5).
다배열생물검정법을 이용한 각 계통별 우수 약제가 선발 결과, 화학합성 살충제 평가 결과에서는 P_Test_15, P_Test_19, P_Test_25, P_Test14에서 공통적으로 우수한 약효가 있는 것으로 나타났다(Fig. 3). P_Test_15는 propargite가 주성분으로서 사과, 감귤, 포도등의 응애류를 방제하는데 사용되고 있다. 과채류에는 살포 후 잔류기간이 높고 화분매개충에 대한 독성이 높아서 광범위하게 사용하는데 어려움이 있다. 본 연구 결과는 딸기와 파프리카에서 채집한 점박이응애를 대상으로 하였으므로 독성이 높게 나타난 것으로 판단된다. P_Test_19의 주성분은 bifenazate로서 가지, 수박, 셀러리, 참외, 수박, 장미, 사과를 가해하는 다양한 응애류 방제에 등록되어 있다. 딸기에서는 spiromesifen과 fenbutain oxide와 합제로 제품화되어 있다. P_Test_25는 acynonapyr가 주성분으로서 일본에서 2019년 봄에 등록되었으며(Umetsu and Shirai, 2020), calcium‐activated potassium channel (KCa2)에 작용하며(Jeschke, 2021), 최근 살충제저항성위원회는 해당 약제를 33번으로 새로운 작용기작그룹으로 선정하였다((IRAC), 2022). P_Test_14는 fluxametamide가 주성분으로서 isooxazoline 계열로서 곤충신경계의 γ-aminobutyric acid (GABA)-gated chloride channels (GABACls)과 glutamate-gated chloride channels (GluCls)에 작용하는 것으로 보고되었다(Asahi et al., 2018). 해당 살충제 또한 2019년 등록되었으며, 응애류 해충을 포함하여 나비목, 총채벌레목, 딱정벌레목 해충에 효과가 우수한 것으로 보고되었다(Umetsu and Shirai, 2020). 딸기 재배지에서 채집한 점박이응애에서 약제 스크리닝 결과에서는 acynonapyr와 fluxametamide가 점박이응애 방제에 가장 우수한 효과를 보이는 것으로 보고된 바 있다(Shin et al., 2021). 본 연구에서도 다배열생물검정법을 적용하여 스크리닝되어 해당 기법이 우수 약제 선발에 적합한 것으로 평가된다. 또한 과채류 뿐만 아니라 과수와 화훼에 채집한 점박이응애에서도 약제 스크리닝이 가능할 것으로 판단된다.
유기농업자재 평가 결과에서는 O_Test_06, O_Test_23, O_Test_16, O_Test_32에서 공통적으로 우수한 약효가 있는 것으로 나타났다(Fig. 4). O_Test_06는 azadirachtin을 주성분으로 하는 유기농업자재로서 님추출물에서 유래한 것이다. 님(Neem)은 해충의 기피 및 탈피억제를 유도하는 것으로 다양한 해충에 효과가 있는 것으로 밝혀져 있다. O_Test_23은 karanja oil과 조사포닌이 구성된 것으로 karanja oil은 콩과 식물인 Millettia pinnata의 씨앗추출에서 주로 생성되며, 다양한 농업 및 위생해충에 직간접적으로 효과가 있는 것으로 알려져 있다(Shanmugasundaram et al., 2007; Das et al., 2015; Kovaříková and Pavela, 2019). O_Test_16은 종자추출물로서 불포화지방산인 올레산과 리놀레산으로 구성되어 있다. O_Test_32는 고삼추출물, 계피추출물, 파라핀오일이 복합적으로 구성된 제품이다. 특히, 고삼추출물은 마트린을 주성분으로 하여 다양한 해충에 광범위한 살충 효과가 있는 것으로 알려져 있다(Kim et al., 2013; Zanardi et al., 2015). 최근 친환경농업의 관심이 고조되면서, 유기농업자재의 제품화가 다양해지면서 농업 현장에서 활발하게 사용되고 있다. 유기농업자재는 친환경육성법에 의해 관리하고 있으며 충해관리용 방제제로는 약 311종의 제품이 유통되고 있다(Kwon et al., 2021). 이 중에서 식물체에서 추출한 식물 이차대사산물을 중심으로 정리될 수 있는데, 고삼 추출물 등이 중심을 이루고 있었다. 대부분 유기농업자재는 예방으로 사용할 것을 추천하고 있는데, 본 연구에서 발굴된 우수유기농업자재는 화학합성 살충제와 더불어 방제 프로그램에 활용될 것으로 판단된다. 또한 화학합성 살충제의 연용에 의해 유발되는 저항성 개체군의 발달을 지연하는데 기여할 수 있을 것으로 판단된다. 이미 영농현장에서는 유기농업자재와 화합합 성살충제의 복합 활용이 일반화되고 있다.
약제의 작용기작에 의해 약효의 발현 특성이 신경근육계에 작용하여 속효성인 것과 생장발달계에 작용하여 지효성인 것이 존재한다. 따라서, 다양한 약제의 약효 판단 기준은 일반적으로 3-4일차 사충율을 기준으로 판단된다. 하지만, 특정 일자의 사충율은 생물검정시 먹이가 부족하고 배설물의 증가로 인한 생육 환경의 열악함으로 기본적으로 사충율이 증가하는 경향이 있으며, 대상 약제의 약효 속도를 산출하는데 한계가 있다. 일반적으로 약효의 속도는 반수치사시간으로 산출하여 도출하지만, 그럴 경우에는 약효를 반영하지 못하므로 해당 시간의 값이 약효와 어떤 연관성이 있는지에 대해서 파악하는데 한계가 있다. 이를 고려하여 본 연구에서는 일별 사충율의 변화량을 적용한 가중산술평균 개념을 도입하여 사충율을 산출하였다. 가중산술평균사충율 적용시, 초기에 높은 사충율을 나타낸 약제에 높은 가중값이 부여되어 속효성 농약을 선발하는데 기여할 수 있다. 이것은 영농 현장에서 농업인이 필요로 하는 후보 약제 선발에 적합할 것으로 판단된다. 다배열생물검정법을 이용하여 지역계통의 우수 약제를 약효의 속도가 반영된 가중산술평균사충율을 산출하여 선발한 결과, 7개 지역 계통의 64개 약제에 대한 약효 반응은 다양한 패턴을 나타내 보였다. 2등급 이상의 약효를 보이는 약제는 해당 계통마다 패턴이 다양하였으며, 우수 약제의 사용은 방제 효율을 높이는데 활용할 수 있을 것이다(Fig. 6). 다만, 향후 연구로서 각각의 등급으로 구성된 약제를 이용하여 방제 효과의 현장 적합성을 평가하는 연구가 필요하다.
정밀 농업을 위한 병해충 관리를 위해서는 정보 공유의 장과 신속한 정보 제공이 선행되어야 한다. 유럽에서는 약제에 대한 저항성 정보를 말라리아 매개 모기의 유기인계와 피레스로이드계약제에 대한 저항성 수준을 파악하기 위해 구축되어 아프리카에서 발생하는 모기의 약제 저항성 발달 수준을 이해하는데 기여하고 있다(Knox et al., 2014). 영농 현장에서 농민들의 약제 선발 근거는 농민 자신의 과거 경험이나 농약 판매상의 추천을 통해 주로 선발되는데, 다양한 약제에 대한 약효 정보는 방제 효율을 증대시킬 수 있을 것으로 판단된다. 특히, 다양한 약제에 대한 복합저항성 해충이 존재하는 영농 현장에서 약효가 입증된 후보 약제를 정밀하게 사용하는 것이 필요하다. 다배열생물검정방법을 기반으로 한 점박이응애 약효 평가 기법은 기존의 약효 진단법과 비교하였을 때, 준비시간을 단축시킬 수 있을 뿐만 아니라 화학합성 살충제 뿐만 아니라 유기농업자재 선발도 가능하게 한다. 또한 가중산술평균사충율을 기반으로 한 약효등급지수는 다양한 농가별 맞춤형 관리를 가능하도록 기여하여 재배 현장에서 방제 비용을 절약하고 효율을 극대화할 수 있을 것으로 판단된다.
Acknowledgments
본 연구는 농림축산식품부의 재원으로 농림식품기술기획평가원의 핵심농자재 국산화기술개발사업(321054-05)의 지원을 받아 수행되었음.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
- IRAC. (2022). The IRAC mode of action classification online. Retrieved 2022-08-29 https://irac-online.org/mode-of-action/classification-online/
-
Abbott WS, 1925. A method of computing the effectiveness of an insecticide. J. Econ. Entomol. 18(2):265-267.
[https://doi.org/10.1093/jee/18.2.265a]

-
Asahi M, Kobayashi M, Kagami T, Nakahira K, Furukawa Y, et al., 2018. Fluxametamide: A novel isoxazoline insecticide that acts via distinctive antagonism of insect ligand-gated chloride channels. Pestic. Biochem. Physiol. 151:67-72.
[https://doi.org/10.1016/j.pestbp.2018.02.002]

-
Botta A, Cavallone P, Baglieri L, Colucci G, Tagliavini L, et al., 2022. A review of robots, perception, and tasks in precision agriculture. Appl. Mech. 3(3):830-854.
[https://doi.org/10.3390/applmech3030049]

- Cho JR, Kim YJ, Ahn YJ, Yoo JK, Lee JO, 1995. Monitoring of acaricide resistance in field-collected populations of Tetranychus urticae (Acari: Tetranychidae) in Korea. Korean J. Appl. Entomol. 34(1):40-45.
- Choi B-R, Park H-M, Yoo J-K, Kim S-G, Baik C-H, et al., 2005. Monitoring on insecticide resistance of major insect pests in plastic house. Korean J. Pestic. Sci. 9(4):380-390.
- Das S, Dolai A, Chakrabortty SK, Metya A, Mondal S, 2015. Insecticidal/Acaricidal efficacy of different formulation of plant oil against coconut eriophyid mite, Aceria guerreronis. Int. J. Zool. Res. 5(5):27-32.
-
Dennehy T, Grafton-Cardwell E, Granett J, Barbour K, 1987. Practitioner-assessable bioassay for detection of dicofol resistance in spider mites (Acari: Tetranychidae). J. Econ. Entomol. 80(5):998-1003.
[https://doi.org/10.1093/jee/80.5.998]

-
Dennehy TJ, Granett J, Leigh TF, 1983. Relevance of slide-dip and residual bioassay comparisons to detection of resistance in spider mites. J. Econ. Entomol. 76(6):1225-1230.
[https://doi.org/10.1093/jee/76.6.1225]

-
Ding W, Taylor G, 2016. Automatic moth detection from trap images for pest management. Comput. Electron. Agric. 123:17-28.
[https://doi.org/10.1016/j.compag.2016.02.003]

-
Dittrich V, 1962. A comparative study of toxicological test methods on a population of the two-spotted spider mite (Tetranychus telarius). J. Econ. Entomol. 55(5):644-648.
[https://doi.org/10.1093/jee/55.5.644]

-
Fuentes A, Yoon S, Kim SC, Park DS, 2017. A robust deep-learning-based detector for real-time tomato plant diseases and pests recognition. Sensors 17(9):2022.
[https://doi.org/10.3390/s17092022]

-
Gould F, 1979. Rapid host range evolution in a population of the phytophagous mite Tetranychus urticae Koch. Evolution 33(3):791-802.
[https://doi.org/10.1111/j.1558-5646.1979.tb04735.x]

-
Jeschke P, 2021. Status and outlook for acaricide and insecticide discovery. Pest Manage. Sci. 77(1):64-76.
[https://doi.org/10.1002/ps.6084]

- Kim D-I, Kim S-G, Kang B-R, Ko S-J, Kim J-S, et al., 2009. Management of two spotted spider mite, Tetranychus urticae, on organic strawberry field in Jeonnam area and toxicity of natural enemies against crude extract of Chrysanthimum cinerariefolium and Melia azedarach. Korean J. Org. Agric. 17(2):211-226.
-
Kim M-J, Shim C-K, Kim Y-K, Jee H-J, Yun J-C, et al., 2013. Insecticidal effect of organic materials of BT, neem and matrine alone and its mixture against major insect pests of organic chinese cabbage. Korean J. Pestic. Sci. 17(3):213-219.
[https://doi.org/10.7585/kjps.2013.17.3.213]

-
Kim Y-J, Lee S-W, Cho J-R, Park H-M, Ahn Y-J, 2007. Multiple resistance and biochemical mechanisms of dicofol resistance in Tetranychus urticae (Acari: Tetranychidae). J. Asia Pac. Entomol. 10(2):165-170.
[https://doi.org/10.1016/S1226-8615(08)60348-9]

-
Kim YJ, Lee SH, Lee SW, Ahn YJ, 2004. Fenpyroximate resistance in Tetranychus urticae (Acari: Tetranychidae): cross‐resistance and biochemical resistance mechanisms. Pest Manage. Sci. 60(10):1001-1006.
[https://doi.org/10.1002/ps.909]

-
Knox TB, Juma EO, Ochomo EO, Pates Jamet H, Ndungo L, et al., 2014. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasites & vectors 7(76).
[https://doi.org/10.1186/1756-3305-7-76]

-
Koh S-H, Ahn JJ, Im J-S, Jung C, Lee SH, et al., 2009. Monitoring of acaricide resistance of Tetranychus urticae (Acari: Tetranychidae) from Korean apple orchards. J. Asia Pac. Entomol. 12(1):15-21.
[https://doi.org/10.1016/j.aspen.2008.10.004]

-
Kovaříková K, Pavela R, 2019. United forces of botanical oils: Efficacy of neem and karanja oil against colorado potato beetle under laboratory conditions. Plants 8(12):608.
[https://doi.org/10.3390/plants8120608]

- Kwon DH, Ahn YK, Hong KH, 2020. Evaluation of acaricidal effect against two-spotted spider mite collected from strawberry in greenhouse. J. Prac. Agri. Fish. Res. 22(2):135-146.
-
Kwon DH, Kang T-J, Kim YH, Lee SH, 2015. Phenotypic-and genotypic-resistance detection for adaptive resistance management in Tetranychus urticae Koch. PloS one 10(11): e0139934.
[https://doi.org/10.1371/journal.pone.0139934]

-
Kwon DH, Kwack G-Y, Won SM, Kim MH, Choi HJ, et al., 2021. Establishment of classification system of major ingredients in organic agricultural materials associated with insect pest control. Korean J. Pestic. Sci. 25(4):287-304.
[https://doi.org/10.7585/kjps.2021.25.4.287]

-
Kwon DH, Lee SW, Ahn JJ, Lee SH, 2014. Determination of acaricide resistance allele frequencies in field populations of Tetranychus urticae using quantitative sequencing. J. Asia Pac. Entomol. 17(1):99-103.
[https://doi.org/10.1016/j.aspen.2013.11.001]

- Kwon G, Lee Y, Lee S, Choi K, 1998. Development and prey consumption of phytoseiid mites, Amblyseius womersleyi, A. fallacis, and Typhlodromus occidentalis under controlled environments. Korean J. Appl. Entomol. 37(1):53-58.
- Lee S-W, Kim K-H, Park C-G, Park H-H, Lee K-S, et al., 2010. Comparison and analysis of insecticide resistance of two spotted spider mite (Tetranychus urticae) among apple orchards. Korean J. Pestic. Sci. 14(3):266-271.
- Lee S, Yoo J, 1971. Studies on chemical resistance of mites. II. Orchard mite control and their resistance to metasystox, folidol and C-8514 in Korea. Korean J. Appl. Entomol. 10(2):109-116.
- Lee SC, Harrison R, 1969. An investigation of the control of wo-spotted spider mites (Tetranychus urticae Koch) resistant to organo-phosphates. Korean J. Appl. Entomol. 7:39-51.
-
Lee Y-S, Song M-H, Ahn K-S, Lee K-Y, Kim J-W, et al., 2003. Monitoring of acaricide resistance in two-spotted spider mite (Tetranychus urticae) populations from rose greenhouses in Korea. J. Asia Pac. Entomol. 6(1):91-96.
[https://doi.org/10.1016/S1226-8615(08)60173-9]

- Lee Y, Kwon G, Ryu H, Lee S, Ryu O, 1997. Density fluctuation of Tetranychus urticae and three predatory mite species (Phytoseiidae) by the differently infested levels. Korean J. Appl. Entomol. 36(3):237-242.
- Ministry of Agriculture, Food and Rural Affairs (MAFRA). (2016). Convergence of agriculture and ICT, spread of Korean smart farm. Sejong.
- NCPMS. (2022). National Crop Pest Management System (NCPMS). Retrieved 14 Aug. 2022 https://NCPMS.rda.go.kr/
-
Park J-H, Ryu K-Y, Lee B-M, Jee H-J, 2008. Effect of COY (cooking oil and yolk mixture) on control of Tetranychus urticae. Korean J. Appl. Entomol. 47(3):249-254.
[https://doi.org/10.5656/KSAE.2008.47.3.249]

- Park Y-g, Baek S, Im JS, Kim M-J, Lee J-H, 2020. Present status of smart greenhouses growing fruit vegetables in Korea: Focusing management of environmental conditions and pests in greenhouses. Korean J. Appl. Entomol. 59(1):55-64.
- PSIS. (2022). Pesticide Safety Information System (PSIS). Retrieved 14 Aug. 2022 https://psis.rda.go.kr/
- R Development Core Team. (2020). R: A language and environment for statistical computing. Vienna, Austria. : R Foundation for Statistical Computing. Retrieved from https://www.R-project.org/
-
Rogotis S, Marianos N. (2021). Smart farming for sustainable agricultural production. In Big Data in Bioeconomy (pp. 191-205): Springer, Cham.
[https://doi.org/10.1007/978-3-030-71069-9_15]

- Shanmugasundaram R, Jeyalakshmi T, Dutt MS, Murthy PB, 2008. Larvicidal activity of neem and karanja oil cakes against mosquito vectors, Culex quinquefasciatus (Say), Aedes aegypti (L.) and Anopheles stephensi (L.). J. Environ. Biol. 29(1):43-45.
-
Shin E, Cho S-R, Kang Y-G, Kim HK, Koo H-N, et al., 2021. Analysis of point mutations associated with resistance and acaricides selection for control of field-collected populations in two-spotted mites, Tetranychus urticae (Acari: Tetranychidae). Korean J. Pestic. Sci. 25(3):177-187.
[https://doi.org/10.7585/kjps.2021.25.3.177]

-
Shin TY, Bae SM, Kim DJ, Yun HG, Woo SD, 2017. Evaluation of virulence, tolerance to environmental factors and antimicrobial activities of entomopathogenic fungi against two-spotted spider mite, Tetranychus urticae. Mycoscience 58(3):204-212.
[https://doi.org/10.1016/j.myc.2017.02.002]

- Song C, Kim G-H, Ahn S-J, Park N-J, Cho K-Y, 1995. Acaricide susceptibilities of field-collected populations of two-spotted spider mite, Tetranychus urticae (Acari: Tetranychidae) from apple orchards. Korean J. Appl. Entomol. 34(4):328-333.
-
Tabashnik BE, Mota-Sanchez D, Whalon ME, Hollingworth RM, Carrière Y, 2014. Defining terms for proactive management of resistance to Bt crops and pesticides. J. Econ. Entomol. 107(2):496-507.
[https://doi.org/10.1603/EC13458]

-
Umetsu N, Shirai Y, 2020. Development of novel pesticides in the 21st century. J. Pestic. Sci. 45(2):54-74.
[https://doi.org/10.1584/jpestics.D20-201]

-
Van Leeuwen T, Vontas J, Tsagkarakou A, Dermauw W, Tirry L, 2010. Acaricide resistance mechanisms in the two-spotted spider mite Tetranychus urticae and other important Acari: A review. Insect Biochem. Mol. Biol. 40(8):563-572.
[https://doi.org/10.1016/j.ibmb.2010.05.008]

-
Yao Q, Chen G-t, Wang Z, Zhang C, Yang B-j, et al., 2017. Automated detection and identification of white-backed planthoppers in paddy fields using image processing. J. Integr. Agric. 16(7):1547-1557.
[https://doi.org/10.1016/S2095-3119(16)61497-1]

-
Yao Q, Xian D-x, Liu Q-j, Yang B-j, Diao G-q, et al., 2014. Automated counting of rice planthoppers in paddy fields based on image processing. J. Integr. Agric. 13(8):1736-1745.
[https://doi.org/10.1016/S2095-3119(14)60799-1]

-
Zanardi OZ, do Prado Ribeiro L, Ansante TF, Santos MS, Bordini GP, et al., 2015. Bioactivity of a matrine-based biopesticide against four pest species of agricultural importance. Crop Protect. 67:160-167.
[https://doi.org/10.1016/j.cropro.2014.10.010]

Deok Ho Kwon: Draft review, Data analysis, Writing, https://orcid.org/0000-0003-2162-4771
Ga-Yeon Gwack: Bioassay experiment, Data analysisIn-Hwa Kim: Bioassay experiment, Data analysis
Yul Gyun Ahn: Draft review, Information collection, Writing
Kue Hyon Hong: Draft review, Information collection, Writing