생물학적 방제제로서 곤충병원성 진균의 자두수염잎벌(Monocellicampa pruni Wei)에 대한 살충 활성 검정
초록
자두수염잎벌(Monocellicampa pruni)은 자두에 피해를 주는 해충으로 2018년 국내에서는 처음으로 보고되었다. 자두수염잎벌은 자두의 어린 과실을 가해하며 유기농업 자두 과수원 생산량에 큰 피해를 주고 있다. 본 연구에서는 곤충병원성 진균을 이용하여 자두수염잎벌을 방제할 수 있는 가능성을 확인하였다. 먼저, 사육을 통해 곤충병원성 진균에 감염된 자두수염잎벌 치사체를 확보하였으며, 6종의 진균(Beavueria bassiana 1종, B. brongniartii 1종, Cordyceps sp. 1종, C. fumosorosea 3종)을 분리하였다. 분리된 진균을 분무법을 이용하여 유충에 대한 살충활성을 검정하였으며, 처리 3일 후 C. fumosorosea SIF-007와 B. bassiana SIF-014 처리구에서 각각 63.3 ± 3.3, 63.3 ± 6.7%의 누적사충률이 확인되었다. 치사된 자두수염잎벌은 고습조건으로 유지한 결과, 곤충 표면에서 mycosis가 확인되었다. 또한 petri dish 조건에서 곤충병원성 진균의 분생포자를 토양에 처리한 결과, 곤충병원성 진균을 처리한 모든 처리구에서 70% 이상의 높은 감염률이 확인되었다. 결론적으로 친환경 방제제인 곤충병원성 진균을 이용하여 자두수염잎벌에 대한 방제가 가능할 것으로 판단된다.
Abstract
Japanese plum sawfly, Monocellicampa pruni is a pest that damages plums and was first reported in South Korea in 2018. These pests attacked the fruitlet of plums and caused severe damage, especially serious production losses in organic orchards. Herein, we confirmed the possibility of controlling M. pruni using entomopathogenic fungi. First, we isolated 6 fungi from infected M. pruni and conducted a bioassay to the larvae by the spraying method. After 3 days, the cumulative mortality of Cordyceps fumosorosea SIF-007 and Beauveria bassiana SIF-014 were 63.3 ± 3.3 and 63.3 ± 6.7%, respectively. Mycosis was observed on the insect cuticles under high humidity conditions. In addition, as a result of spraying the fungal conidia on the soil in a petri dish trial, a high infection rate of >70% was confirmed. These results suggest that Japanese plum sawfly can be effectively controlled by entomopathogenic fungi as an eco-friendly pesticide.
Keywords:
Beauveria spp., Cordyceps spp., Entomopathogenic fungi, Japanese plum sawfly, Pest management키워드:
Beauveria 속, Cordyceps 속, 곤충병원성 진균, 자두수염잎벌, 해충 방제서 론
자두수염잎벌(Monocellicampa pruni Wei)은 자두 과실에 심각한 피해를 주는 해충으로, 2018년 전남 광양 지역의 자두 과수원에서 발생되어 국내에 처음 보고되었으며, 이로 인한 자두 생산량에 심각한 피해를 주었다(Park et al., 2019). 자두수염잎벌은 1998년 중국에서 처음 보고되어 중국 내의 고유종으로 알려져 있었으며, 자두나무(Prunus salicina Lindl.)에만 기생하는 것으로 알려져 있다(Liu et al., 2017; Park et al., 2019; Wei, 1998).
자두수염잎벌은 자두나무 개화 시기인 4월 초순에 토양에서 성충으로 우화하기 시작하여 자두 과실 표면에 산란하는 것으로 추정되고 있다. 부화한 유충은 어린 과실의 과육을 섭식하면서 자두 과실 내부로 들어가며 종자를 섭식하여 자두 생산에 큰 피해를 주고 있다(Nguyen et al., 2021; Park et al., 2019). 유충 한 마리는 오직 하나의 과실을 가해하며, 자실체 내에서 섭식하면서 4번의 탈피를 걸쳐 생장한다(Nguyen et al., 2020). 5월이 되면 자두수염잎벌 종령 유충은 과실 밖으로 뚫고 나와 땅에 떨어지며 토양속에서 고치를 형성한 후 이듬해 봄에 다시 성충으로 우화한다(Nguyen et al., 2021). 자두수염잎벌에 의한 피해 과실은 발육이 늦어지고 조기 탈락이 발생하며, 국내에서는 전라남도 소재의 유기농 자두 과수원 지역에서 자두수염잎벌에 의한 피해로 인하여 일부 과수원에서는 자두를 전혀 수확할 수 없었다(Nguyen et al., 2021; Park et al., 2019). 그러나 현재까지 국내에서는 자두수염잎벌을 방제하기 위한 등록된 약제가 없는 상태이며, 특히 유기농 재배 과수원을 중심으로 이 해충이 빠르게 확산되고 있어 친환경적인 방제제 개발이 필요한 실정이다.
생물학적 방제제 중 하나인 곤충병원성 진균은 곤충에게 특이적으로 병원성을 가지는 미생물로서, 다양한 농업 해충을 방제하는 수단으로 사용되고 있다(Hajek,1997; Lacey et al., 2015; Lee et al., 2022; St Leger et al., 2001). 특히 화학 살충제의 환경오염, 잔류농약, 약제 저항성 등의 문제에 대한 대안책으로 곤충병원성 진균이 사용되고 있으며, Botanigard, Beauverin, Green Muscle, 총채싹 등 국내외에서 해충을 방제하기 위해 170개 이상의 미생물제제가 개발되어 판매되고 있다(Lee et al., 2017a; Lee et al., 2022). 곤충병원성진균은 다른 미생물과 달리 접촉을 통해 감염될 수 있으며, 진딧물, 총채벌레, 딱정벌레 등 다양한 해충을 방제하는 데 사용되고 있다(Boucias et al., 1988; Gao et al., 2012; Kim et al., 2020; Wraight et al., 2000). 곤충병원성 진균은 감염충 뿐만 아니라 토양 등 다양한 환경에서 서식한다고 알려져 있으며, 이러한 특성을 통해 국내 미생물 자원을 확보하는데 어려움이 없다. 특히 다양한 환경에서 분리된 진균은 많은 해충을 방제하는데 적용할 수 있어 친환경 농업에 큰 가치를 제공할 수 있다. 곤충병원성 진균은 현재까지 700여 종이 보고되었으며, 대표적으로 Beauveria bassiana, Metarhizium anisopliae, Cordyceps 속, Isaria 속, Lecanicillium 속 등이 있으며 이들을 이용하여 다양한 해충을 방제하기 위한 시도가 지속적으로 이뤄지고 있다(Humber, 2016; Lee et al., 2022; Ortiz-Urquiza et al., 2010).
본 연구에서는 자두수염잎벌에 대한 친환경적 방제 소재를 개발하기 위해 국내 자생하고 있는 곤충병원성 진균을 분리 및 동정하였으며, 자두수염잎벌 유충과 토양에 곤충병원성 진균의 분생포자를 처리하여 자두수염잎벌에 대한 살충 활성을 검정하였다. 이를 통해 자두수염잎벌에 대한 곤충병원성 진균 소재의 방제 가능성을 평가하고자 하였다.
재료 및 방법
시험 곤충
자두수염잎벌 유충과 치사체는 자두과실과 함께 순천대학교 일반곤충학 실험실에서 제공받았으며, 원예용 토양을 담은 아크릴케이지(70 × 50 × 60 cm)에서 사육하였다. 사육은 온도 25 ± 2°C, 습도 40~60%, 광주기 L:D=16:8 조건에서 진행되었다. 본 실험에서는 자두수염잎벌의 4-5령 유충을 사용하였다.
곤충병원성 진균 분리
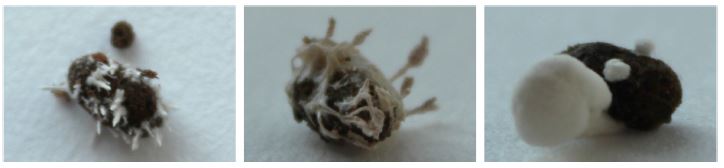
곤충병원성 진균에 의해 치사된 자두수염잎벌은 filter paper (90 mm, Whatman, USA)가 깔린 90 × 15 mm petri dish에 옮긴 후 25 ± 2°C 조건으로 7일간 유지하였으며 수분 공급을 위해 매일 1ml의 멸균수를 petri dish에 깔린 filter paper에 제공하였다. 7일 후 곤충 표피에 생성된 진균 포자를 1/4 SDA (Sabouraud Dextrose Agar, Difco, Sparks, MD, USA) 배지에 재 분리하여 단일 콜로니를 확보하였다(Fig. 1). 분리된 균주들은 genomic DNA extraction buffer[0.2 M Tris-HCl (pH 7.5), 0.5 M NaCl, 10 mM EDTA (pH 8.0), 1% SDS (w/v)]를 이용하여 gDNA를 추출하였다. 정제된 gDNA는 분자생물학적 위치를 확인하기 위해 internal transcribed spacer (ITS) 영역을 ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′), ITS4 (5′-TCCTCCGCTTATTGATATGC-3′) primer를 이용하여 PCR 하였으며, 증폭된 PCR 산물은 0.8% agarose gel을 이용하여 전기영동으로 확인하였으며, QIAquick® PCR Purification Kit (Qiagen)을 사용하여 정제 후 Bioneer (Daejeon, South Korea)를 통해 DNA 염기서열을 분석하였다. 염기 상동성은 NCBI의 BLAST search 프로그램을 이용하여 비교하였다.
자두수염잎벌 유충에 대한 균주의 살충활성 스크리닝
분리된 곤충병원성 진균은 1/4 SDA 배지에 접종한 후 25 ± 1°C 조건으로 14일간 배양되었으며, 배양된 균주는 Siloxane 30% 전착제(제품명: 실루엣, Farmhannong, South Korea)을 사용하여 제조된 0.03% solution을 이용하여 포자가 수확되었다. 포자는 hemocytometer를 이용하여 포자수를 계수한 후 제조된 0.03% solution을 이용하여 1.0 × 107 conidia ml-1 농도로 포자 현탁액을 제조하였다. 자두 피해과에서 수집한 4령 유충 10 마리를 멸균된 filter paper가 깔린 90 × 15 mm petri dish에 옮긴 후 진균 포자 현탁액을 1 ml 씩 분무 처리하였으며, 자두 과실 조각을 먹이로 공급하였다. 분무 처리는 자두수염잎벌 유충에게 골고루 처리될 수 있도록 10 cm 떨어진 거리에서 분무기로 분무 처리하였다. 모든 처리는 온도 25 ± 2°C, 광주기 L:D=16:8의 조건을 유지하였으며 매일 치사충 수를 조사하였다. 치사충은 멸균된 filter paper가 깔린 petri dish에 옮겨 mycosis 유무를 확인하였으며, 습도를 유지하기 위해 매일 1 ml의 멸균수를 공급하였다. 대조구에는 멸균수를 분무 처리하였으며, 모든 실험은 3반복으로 수행되었다.
Petri dish 조건에서 토양을 통한 감염률 평가
100 × 40 mm Insect breeding dish (SPL Life Science Co., Pocheon, South Korea)에 멸균한 원예용 토양 30 g을 넣은 후 병원성이 확인된 곤충병원성 진균의 포자 현탁액을 1.0 × 107 conidia ml-1 농도로 3 ml 분무 처리하였으며, 토양의 수분 공급을 위하여 3일 마다 멸균수를 10 ml/dish 처리하였다. 포자 현탁액이 처리된 토양에 자두수염잎벌 피해과를 10-12개씩 치상하였으며, 온도 25 ± 2°C, 40~60% RH, 광주기 L:D=16:8 실험실 조건으로 15일 간 유지하였다. 처리별 감염충 수는 15일 후에 토양에 있는 자두수염잎벌의 유충과 고치를 모두 확보한 후 mycosis된 개체수를 조사하였다. 대조구에는 멸균수를 분무 처리하였으며, 실험은 3반복으로 진행하였다.
통계 분석
자두수염잎벌 유충에 대한 균주의 살충활성과 petri dish 조건에서 토양을 통한 감염률 평가 자료는 arcsine % 변환하여 일원분산분석(ANOVA)을 진행하였으며, Tukey’s HSD test를 이용하여 처리 간의 유의성 차이를 검정하였다(SPSS statistics ver. 27; IBM Corp., Armonk. NY, USA).
결 과
곤충병원성 진균의 동정
치사된 자두수염잎벌에서 6종의 진균이 순수 분리되었으며, ITS 영역을 증폭한 결과 ~550 bp의 PCR 산물을 확보하였다. 확보된 PCR 산물의 염기서열을 분석한 결과, Cordyceps sp. 1종(SIF-015), C. fumosorosea 3종(SIF-007, 009, 010), B. bassiana 1종(SIF-014), B. brongniartii 1 종(SIF-011)로 확인되었으며, GenBank에 등록된 해당 균주들과 99% 이상의 유사성이 확인되었다(Table 1).
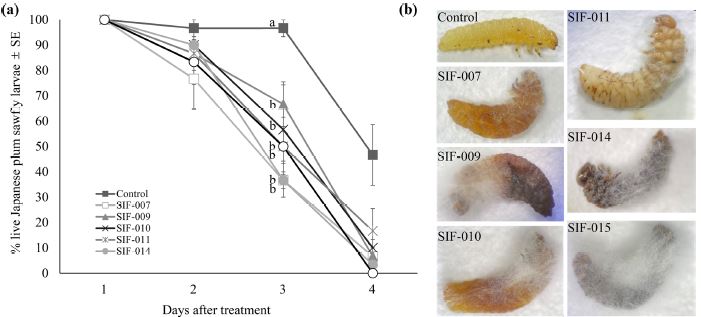
자두수염잎벌 유충에 대한 곤충병원성 진균 병원성
자두수염잎벌 유충에 대한 곤충병원성 진균의 병원성을 확인한 결과(Fig. 2), 곤충병원성 진균을 처리한 모든 처리구에서 처리 2일차부터 치사가 확인되었다. 처리 후 3일차의 누적사충률은 C. fumosorosea SIF-007와 B. bassiana SIF-014를 처리한 처리구에서 각각 63.3 ± 3.3, 63.3 ± 6.7%였으며, C. fumosorosea SIF-009, 010, B. brongniartii SIF-011, Cordyceps sp. SIF-015 처리구에서는 각각 33.3 ± 8.8, 43.3 ± 17.6, 50.0 ± 11.5, 50.0 ± 5.8% 였다. 균주간의 통계적인 유의차는 없었다(F6, 56= 6.74, p<0.001). 처리 3일 차의 무처리구의 사충률을 반영한 처리구의 보정 사충률은 C. fumosorosea SIF-007와 B. bassiana SIF-014를 처리한 처리구에서 각각 62.0 ± 3.4, 62.0 ± 6.9% 였으며, C. fumosorosea SIF-009, 010, B. brongniartii SIF-011, Cordyceps sp. SIF-015 처리구에서는 각각 31.0 ± 9.1, 41.3 ± 18.2, 48.2 ± 11.9, 48.2 ± 6.0% 였다. 또한 무처리구를 제외한 모든 치사체의 표피에서 흰색의 균사 생장이 확인되었다.
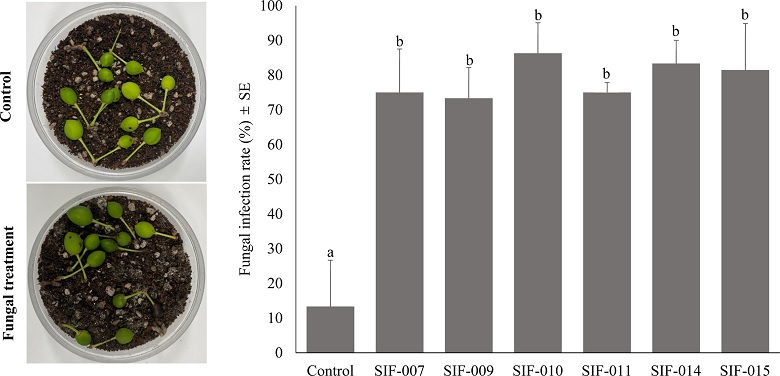
Petri dish 조건에서 토양을 통한 감염률 평가
곤충병원성 진균의 포자를 토양에 처리하였을 때 자두수염잎벌의 유충 방제 가능성을 확인하기 위하여 진균 포자 현탁액을 처리한 토양에 피해과를 치상한 결과(Fig. 3), 처리 15일 후 모든 진균 처리구에서는 치사된 자두수염잎벌 표면에서 mycosis 증상이 관찰되었으며, 대조군에서는 13%의 치사율이 확인되었으나 고치를 형성하지 못하고 유충 상태로 자연 치사된 것으로 확인되었다. 자두 과실 밖으로 나와 토양 속에서 확인된 자두수염잎벌을 기준으로 모든 처리구에서 70% 이상 감염률이 확인되었으며, C. fumosorosea SIF-007, 009, B. brongniartii SIF-011에서는 각각 75 ± 12.5, 73.3 ± 8.8, 75 ± 2.9%의 감염률이 확인되었으며, C. fumosorosea SIF-010, B. bassiana SIF-014, Cordyceps sp. SIF-015에서는 86.2 ± 8.8, 83.3 ± 6.7, 81.4 ± 13.4%의 감염률이 확인되었으며, 균주간의 통계적인 유의차는 없었다(F6, 14= 5.28, p<0.005).
고 찰
자두수염잎벌 피해과를 토양에 치상하여 자두수염잎벌의 고치형성을 유도하는 중 곤충병원성 진균에 감염된 것으로 추정되는 치사충을 확보하였으며, 이 치사충들을 통해 6종의 곤충병원성 진균을 분리하였다. 곤충병원성 진균은 곤충에서 분리하기 좋은 미생물 중 하나로, 특히 곤충이 약한 상태일 때 감염을 일으킬 수 있다. 하지만 감염충은 쉽게 확보할 수 없어 분리를 위해 곤충병원성 진균이 서식하기 좋은 환경으로 알려진 토양을 이용한다. 대표적인 곤충병원성 진균은 B. bassiana와 M. anisopliae이며 그 중 B. bassiana는 과수원과 산림의 토양에서 많이 분리된다(Jarmuł-Pietraszczyk et al., 2011; Keyser et al., 2015; Medo and Cagáň, 2011; Qayyum et al., 2021). 토양과 감염충에서 곤충병원성 진균을 분리하기 위해 chloramphenicol, streptomycin과 같은 항생물질과 dodine이 함유된 선택배지를 사용하였으나, 분리된 진균의 80-90%는 낮은 살충 활성을 보였다. 이를 보완하기 위해 토양에 곤충을 직접 처리하여 감염 개체를 확보하는 방법으로 높은 살충활성을 가지는 진균을 확보하고 있다(Kim et al., 2018). 자두수염잎벌 치사체는 토양에 서식하고 있었던 곤충병원성 진균에 감염된 것으로 추정되었으며, 자두수염잎벌 방제용 소재 라이브러리를 구축하기 위해 곤충병원성 진균을 분리하였다.
자두수염잎벌은 최근 국내에서 발생이 확인된 종으로 방제에 대한 연구가 부족하여 자두수염잎벌에 대한 피해로 어려움을 호소하고 있다. 현재 자두수염잎벌을 방제하기 위해 등록된 살충제는 없으며, 기존 자두 해충용 화학 살충제를 이용하여 자두수염잎벌을 방제하는 실정이다. 특히, 화학합성 살충제를 사용하지 않는 유기농 재배 농가에서는 자두수염잎벌을 방제할 수 있는 수단이 없어 피해가 심각한 상태로, 친환경 소재의 방제제가 필요하다(Nguyen et al., 2021; Park et al., 2019). 본 연구에서 확보한 6종의 곤충병원성 진균 소재는 실험실 조건 내에서 자두수염잎벌 유충에 높은 살충 활성이 확인되었고, 진균을 처리한 토양에서도 진균의 높은 살충 활성이 확인되어 자두수염잎벌을 방제하기 위한 친환경 미생물 소재로 개발할 수 있는 가능성이 있다고 판단된다.
특히, 토양에 진균을 처리한 방법은 자두수염잎벌의 생태적인 특성을 활용하고자 하였다. 자두수염잎벌은 알에서 부화한 후 자두의 어린 과실 속으로 들어가 생장하기 때문에 살충제가 직접적으로 유충에 도달하지 못하여 방제 효과가 낮을 수 있다. 하지만, 종령 유충은 토양으로 이동하여 번데기를 형성하기 때문에 진균의 토양 처리는 유충과의 접촉 가능성을 크게 향상시킬 수 있다. 최근 해충을 방제하기 위해 곤충병원성 진균 입제를 토양 표면에 처리하고 있으며, 높은 살충 효과를 보이고 있다. 이는 이전 꽃노랑총채벌레를 방제하기 위한 곤충병원성 진균 처리 방식을 응용할 수 있다. 꽃노랑총채벌레는 대부분의 생활사를 식물의 잎과 꽃 속에서 보내지만 용화가 일어나기 전 토양으로 떨어져 전용 단계를 보내고 있으며, 이러한 생태적인 특성을 이용하여 곤충병원성 진균을 토양 표면에 처리함으로써 방제 효과를 크게 증가시켰다(Lee et al., 2017b; Lee et al., 2022). 또한, 곤충병원성 진균의 분생포자를 식물의 잎과 꽃에 처리하는 것보다 토양에 처리함으로써 자외선과 높은 온도에 노출되는 것을 방지할 수 있으며, 상대적으로 높은 습도를 유지할 수 있어 발아 및 생존에 유리한 환경을 갖추고 있어 높은 방제효과를 보이고 있다. Lee et al. (2017b)에 따르면 형광을 발현하는 진균을 토양에 처리했을 때 꽃노랑총채벌레가 토양 내부 또는 표면을 이동하면서 균류에 노출된다는 것이 확인되었다. 자두수염잎벌 종령유충도 과실 밖으로 나와 토양 내부 또는 주변을 이동하는 행동이 관찰되었으며, 실제 토양에 곤충병원성 진균의 분생포자를 처리하였을 때 자두수염잎벌이 토양 내부를 이동하면서 곤충병원성 진균 포자에 접촉되어 치사 되었을 가능성이 높다고 판단되었다. 이 결과를 바탕으로 곤충병원성 진균 포자를 입제 형태로 토양 표면에 처리한다면 고치를 형성하기 위해 땅에 떨어지는 자두수염잎벌을 방제할 수 있는 가능성이 확인되었다. 하지만, 자두수염잎벌을 방제하기 위해 추가적으로 곤충병원성 진균 입제를 토양에 처리 후 유충과의 접촉 가능성을 확인해야 하며, 실내 실험 결과를 바탕으로 포장에서의 추가적인 연구가 필요하다.
본 연구에서는 자두수염잎벌을 방제하기 위한 곤충병원성 진균 소재를 확보하였으며, 토양 내에 진균 포자를 처리하는 방법을 통해서 자두수염잎벌에 대한 높은 살충활성을 확인하였다. 이는 곤충병원성 진균 소재를 활용한 자두수염잎벌 방제의 가능성을 확인하였으며, 이 소재를 활용한 방제 전략을 구축함으로써 친환경적인 자두 생산에 기여할 수 있음을 시사한다.
Acknowledgments
본 연구를 위해 자두수염잎벌 유충과 치사체를 제공해주신 홍기정 교수님께 감사드립니다. 본 연구 성과물은 농촌진흥청 국립농업과학원 연구사업 (세부과제번호: PJ016387)의 지원에 의해 수행되었으며 이에 감사드립니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Boucias DG, Pendland JC, Latge J, 1988. Nonspecific factors involved in attachment of entomopathogenic deuteromycetes to host insect cuticle. Appl. Environ. Microbiol. 54(7):1795-1805.
[https://doi.org/10.1128/aem.54.7.1795-1805.1988]

-
Gao Y, Reitz SR, Wang J, Xu X, Lei Z, 2012. Potential of a strain of the entomopathogenic fungus Beauveria bassiana (Hypocreales: Cordycipitaceae) as a biological control agent against western flower thrips, Frankliniella occidentalis (Thysanoptera: Thripidae). Biocontrol Sci.Technol. 22(4):491-495.
[https://doi.org/10.1080/09583157.2012.662478]

-
Hajek AE, 1997. Ecology of terrestrial fungal entomopathogens. In: Advances in microbial ecology. Springer, pp. 193-249.
[https://doi.org/10.1007/978-1-4757-9074-0_5]

-
Humber RA, 2016. Seeking stability for research and applied uses of entomopathogenic fungi as biological control agents. J. Asia Pac. Entomol. 19(4):1019-1025.
[https://doi.org/10.1016/j.aspen.2016.09.006]

- Jarmuł-Pietraszczyk J, Kamionek M, Kania I, 2011. Occurrence of entomopathogenic fungi in selected parks and urban forests of the Warsaw District Ursynow. Ecol. Chem. Eng. A. 18(11):1571-1574.
-
Keyser CA, De Fine Licht HH, Steinwender BM, Meyling NV, 2015. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiol. 15(249).
[https://doi.org/10.1186/s12866-015-0589-z]

-
Kim JC, Baek S, Park SE, Kim S, Lee MR, et al., 2020. Colonization of Metarhizium anisopliae on the surface of pine tree logs: A promising biocontrol strategy for the Japanese pine sawyer, Monochamus alternatus. Fungal Biol. 124(2):125-134.
[https://doi.org/10.1016/j.funbio.2019.12.006]

-
Kim JC, Lee MR, Kim S, Lee SJ, Park SE, et al., 2019. Long-term storage stability of Beauveria bassiana ERL836 granules as fungal biopesticide. J. Asia Pac. Entomol. 22(2):537-542.
[https://doi.org/10.1016/j.aspen.2019.04.001]

-
Kim JC, Lee MR, Kim S, Lee SJ, Park SE, et al., 2018. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. J. Asia Pac. Entomol. 21(1):196-204.
[https://doi.org/10.1016/j.aspen.2017.11.018]

-
Lacey LA, Grzywacz D, Shapiro-Ilan DI, Frutos R, Brownbridge M, et al., 2015. Insect pathogens as biological control agents: back to the future. J. Invertebr. Pathol. 132:1-41.
[https://doi.org/10.1016/j.jip.2015.07.009]

-
Lee MR, Kim JC, Lee SJ, Kim S, Lee SJ, et al., 2017a. Assessment of physiological activity of entomopathogenic fungi with insecticidal activity against locusts. Korean J. Appl. Entomol. 56(3):301-308.
[https://doi.org/10.5656/KSAE.2017.08.0.019]

-
Lee SJ, Kim S, Kim JC, Lee MR, Hossain MS, et al., 2017b. Entomopathogenic Beauveria bassiana granules to control soil-dwelling stage of western flower thrips, Frankliniella occidentalis (Thysanoptera: Thripidae). Biocon. 62(5):639-648.
[https://doi.org/10.1007/s10526-017-9818-8]

- Lee SJ, Shin TY, Kim J, Kim JS, 2022. Entomopathogenic Fungi-mediated Pest Management and R&D Strategy. Korean J. Appl. Entomol. 61(1):197-210.
-
Liu T, Liu L, Wei M, 2017. Review of Monocellicampa wei (Hymenoptera: Tenthredinidae), with description of a new species from China. Proc. Entomol. Soc. Wash. 119(1):70-77.
[https://doi.org/10.4289/0013-8797.119.1.70]

-
Medo J, Cagáň Ľ, 2011. Factors affecting the occurrence of entomopathogenic fungi in soils of Slovakia as revealed using two methods. Biol. Con. 59(2):200-208.
[https://doi.org/10.1016/j.biocontrol.2011.07.020]

- Nguyen HN, Im M, Hong K, 2020. Description of the Japanese plum sawfly larva Monocellicampa pruni (Hymenoptera: Tenthredinidae) in South Korea. J. Appl. Entomol. 59(4):443-449.
- Nguyen NH, Ki W, Im M, Hong K, 2021. Some Biological Characteristics of Plum Sawfly Monocellicampa pruni (Hymenoptera: Tenthredinidae). J. Appl. Entomol. 60(4):479-487.
-
Ortiz-Urquiza A, Riveiro-Miranda L, Santiago-Álvarez C, Quesada-Moraga E, 2010. Insect-toxic secreted proteins and virulence of the entomopathogenic fungus Beauveria bassiana. J. Invertebr. Pathol. 105(3):270-278.
[https://doi.org/10.1016/j.jip.2010.07.003]

- Park B, Nguyen NH, Lee J, Hong K, 2019. A new sawfly pest, Monocellicampa pruni Wei (Hymenoptera, Tenthredinidae) attacking fruitlets of Japanese plum in South Korea. Korean J. Appl. Entomol. 58(4):329-333.
-
Qayyum MA, Saeed S, Wakil W, Nawaz A, Iqbal N, et al., 2021. Diversity and correlation of entomopathogenic and associated fungi with soil factors. J. King Saud Univ.-Sci. 33(6):101520.
[https://doi.org/10.1016/j.jksus.2021.101520]

-
St Leger R, Screen S, 2001. Prospects for strain improvement of fungal pathogens of insects and weeds. Fungi as Biocontrol Agents. CABI, Wallingford, pp. 219-237.
[https://doi.org/10.1079/9780851993560.0219]

- Wei M, 1998. Two new genera of Hoplocampinae from China with a key to known genera of the subfamily in the world (Hymenoptera: Nematidae). J. Cent. South Univ. 18:12-18.
-
Wraight SP, Carruthers RI, Jaronski ST, Bradley CA, Garza CJ, et al., 2000. Evaluation of the entomopathogenic fungi Beauveria bassiana and Paecilomyces fumosoroseus for microbial control of the silverleaf whitefly, Bemisia argentifolii. Biol. Cont. 17(3):203-217.
[https://doi.org/10.1006/bcon.1999.0799]

Hyunwook Jung, Department of Plant Medicine, Sunchon National University, Undergraduate student, https://orcid.org/0000-0002-4520-7166, Investigation, Writing-review
Hoe Ri Kim, Department of Plant Medicine, Sunchon National University, Undergraduate student, Data curation
Jae Su Kim, Department of Agricultural Biology, Jeonbuk National University, Professor, Writing-review
Se Jin Lee, Department of Agricultural Life Science, Sunchon National University, Professor, https://orcid.org/0000-0002-2334-4346, Writing original draft preparation, Project administration