
잿빛무늬병균 Monilinia fructicola 균주의 항진균 방선균에 대한 민감도 평가
초록
핵과류 살구, 체리, 복숭아 등의 과일은 나무열매의 내부 조직이 연약하며, 물기가 많은 과육과 얇고 부서지기 쉬운 상피를 가지 있다. 핵과류 과일의 생산은 증가하고 있으며, 생산량 증대를 위한 다양한 연구가 수행되고 있다. 그러나 진균성 병원균인 Monilinia는 핵과류 나무열매에서 갈색 썩음 질병을 유발하여 생산량 감소를 일으키고 있다. 이러한 문제를 해결하기 위해 오염을 유발하지 않는 환경 친화적이고 비독성의 생물학적 방제법 개발이 요구되고 있다. 본 연구에서는 Streptomyces globisporus SP6C4와 Streptomyces sp. S8의 항균 특성에 대한 Monilinia 병원균의 민감도를 비교하여 각 지역의 Monilinia 균주 간 민감도를 평가하고자 수행되었다. 상주에서 분리된 균주는 SP6C4와 S8 모두에 대해 높은 민감도를 보였으며, 충청남도 홍성, 전북 임실, 전주에서 분리된 일부 균주는 SP6C4에 대해 민감하지 않았다. 본 연구 결과는 Monilinia 균주의 항균제에 대한 지역간 민감도 차이를 강조하며, 환경 친화적인 생물학적 방제책 개발에 중요한 정보를 제공한다. 이러한 결과는 다른 핵과류 생산지에서 Monilinia 감염 효과적인 항균제의 선택과 최적화에 도움이 될 것으로 기대된다. 또한 본 연구 결과는 건강하고 환경 친화적인 작물생산을 촉진하는 지속 가능한 농업 관행 개발에 중요한 한 걸음을 제공한다.
Abstract
Stone fruits, such as apricots, cherries, and peaches, are characterized by a ligninized internal skin, watery mesenchymal fruit, and thin and fragile epidermis. The production of these fruits has been increasing, and various studies are being conducted to increase their production. However, Monilinia genus of fungi, belonging to the family Sclerotiniaceae, is known to cause brown rot diseases in rose and stone fruits, resulting in significant crop production losses. To address this issue, there is a need for environmentally friendly and non-toxic biological control measures that do not cause pollution. In this study, we aimed to evaluate the sensitivity total of 54 strains of Monilinia to the antifungal Streptomyces, specifically S. globisporus SP6C4 and Streptomyces sp. S8. by comparing the sensitivity of Monilinia strains from different regions. We found that those isolated from Sangju, Gyeongsangbuk-do, were highly sensitive to both SP6C4 and S8. In contrast, some strains from Hongseong, Chungcheongnam-do, Jeonju, and Imsil, Jeollabuk-do, were less sensitive to SP6C4. Our findings highlight regional differences in the sensitivity of Monilinia strains to antifungal agents and provide valuable information for the development of eco-friendly biological control measures against peach brown rot diseases. These results may also aid in selecting and optimizing antifungal agents for effectively controlling Monilinia infections in other stone fruit-producing regions. Ultimately, this research provides an important step toward the development of sustainable agricultural practices that promote healthy and environmentally friendly crop production.
Keywords:
Antifungal, Monilinia, Stone fruit, Streptomyces키워드:
항균제, 잿빛무늬병, 핵과류, 방선균서 론
국내에서 핵과류에 발생하는 주요 진균성 병원균으로는 Alternaria spp., Botrytis cinerea, Colletotrichum spp., Monilinia fructicola, Phomopsis vexans, Phyllosticta circumscissa, Podosphaera tridactyla, Septoria cerasina 등이 있다(The Korean Society of Plant Pathology, 2020). Monilinia는 Sclerotiniaceae 진균의 한속(Genus)이며, Monilinia는 다양한 장미과 식물과 핵과류 과수에 큰 손실을 초래하는 것으로 알려져 있다(Oh et al., 2017). Monilinia 속 진균에 의한 잿빛무늬병은 수확 전, 후 저장 및 수송 중에 많이 발생하여 경제적으로 큰 피해를 입히며(Rural Development Administration, 2008), 전 세계적으로 M. fructicola, M. fructigena, M. laxa 등 3종이 주요 병원균으로 알려져 있다(Shim et al., 2007; De Miccolis Angelini et al., 2018). 그 중 M. fructicola는 매실, 복숭아, 자두, 살구 등에서 잿빛무늬병을 발생시키는 것으로 알려져 있다(The Korean Society of Plant Pathology, 2009; Zhu et al., 2005). 잿빛무늬병은 발생초기 과실 표면에 작은 갈색 반점이 생기고 병이 진전됨에 따라 반점이 점차 수침상으로 확대되어 과실의 생산량이 감소되고, 상품성을 저하시킨다(Choi et al., 2016; Hu et al.,2011).
M. fructicola에 의해 국내에서 발생하는 핵과류 잿빛무늬병은 병원균의 형태 및 배양학적 특징만 보고되어 있다(Oh et al., 2017). 최근 2015년과 2017년 6~7월에 전라북도 전주와 임실에서 매실, 복숭아, 살구, 자두, 체리 등 핵과류에 Monilinia속 병원균에 의한 잿빛무늬병이 2~5% 정도 발생했다는 조사 결과가 있다(Choi et al., 2014; Oh et al., 2017). 현재까지 알려진 Monilinia속으로는 약 30여 종이 병원균으로 알려져 있으며 주로 잿빛무늬병과 미라병을 일으켜 경제 손실을 유발시키는 것으로 알려져 있다(Choi et al., 2014; Oh et al., 2017; Gell et al., 2008). 해당 병을 유발시키는 병원균을 억제하기 위해 수확 후 benzimidazole계 살균제 사용에 크게 의존하고 있다(Martini and Mari, 2014). 하지만 화학 살균제의 남용은 환경 오염, 인간의 건강에 해를 끼치고 농약에 대한 저항성을 가지는 병원균의 출현을 유발한다(Rani et al., 2021). 최근 심각한 환경오염 문제로 화학농약의 사용의 감소가 지향되면서 인체에 무해하고 친환경적으로 식물병 방제를 하기 연구에 관심이 집중되고 있다(Carmona-Hernandez et al., 2019).
생물학적 방제에는 유용 곤충, 미세조류, 유용 미생물 등을 이용하여 식물에 병을 유발시키는 병원체 인자들을 억제하는 방법이 주요한 접근법이며, 최근에 생물적 방제를 위한 미생물로 방선균이 주목받고 있다. 방선균은 Actinomyces에 속하는 원핵 생물로 균사상으로 생육하는 특성을 지닌 그람 양성 세균이다(Shimazu et al., 1993). 방선균은 다양한 이차대사산물을 생산하며, 효과적인 항생물질을 만들어내는 것으로 알려져 현재까지 다양한 방선균의 항진균력을 확인한 많은 연구들이 진행되고 있다(Harir et al., 2018). Streptomyces globisporus SP6C4는 딸기 화분에서 분리되어 딸기에 잿빛곰팡이병을 유발시키는 Botrytis cinerea의 생장을 효과적으로 억제할 뿐만 아니라 다양한 진균성 병원균에 대한 항진균력을 가지는 것으로 알려져 있다(Kim et al., 2019; Kim et al., 2021; Cho et al., 2017). SP6C4 균주는 lanM, tsrD 유전자가 lantipeptide계열의 항생물질을 만들어는 기작으로 밝혀져 있어 생물학적 방제제로 이용하기 위한 다양한 연구들이 현재 진행되고 있다. Streptomyces sp. S8은 갈색퍼짐병을 유발시키는 Rhizoctonia solani의 생장을 억제하여 해당병의 발병을 효과적으로 방제하는 특징을 가지고 있다(Jeon et al., 2019). S8 균주는 다양한 이차대사산물 생산 중 Nrps (Non-ribosomal peptide) 계열의 valinomycin 항생물질을 분비하여 R. solani를 억제한다고 밝혀졌다(Jeon et al., 2019).
본 연구에선 다양한 연구들을 통해 많은 작물에 병을 일으키는 진균성 병원체를 효과적으로 억제하는 능력이 있는 것으로 알려진 S. globisporus SP6C4와 Streptomyces sp. S8을 핵과류잿빛무늬병의 생물학적 방제에 이용하고자 수행되었다. 해당 방선균 2종을 국내 각 지역에서 분리된 M. fructicola 균주와 대치배양을 통하여, 잿빛무늬병원균의 방선균에 대한 민감도 차이 및 균주의 지역별 특성 차이를 구명하였다. 또한 환경적 위험을 줄이고 안전한 작물에 대한 소비자들의 수요를 충족시키기 위해서 생물학적으로 식물병을 예방할 수 있는 미생물 자원을 확보하는 자료를 마련하고자 하였다.
재료 및 방법
잿빛무늬병원균 확보 및 배양 조건
복숭아 잿빛무늬병원균, M. fructicola는 글로벌 농업 컨설팅(Global Agriculture Company), 국립 원예특작과학원(National Institute of Horticultural & Herbal Science), 경북대(Kyungpook National University)에서 분리, 동정된 균주를 제공받아 V8 배지(V8 juice, 200 mL; CaCO3, 2 g; Agar, 20 g per L)를 이용하여 25oC에서 5일간 배양하였다. 글로벌 농업 컨설팅(Global Agriculture Company; G)에서 총14 균주(G1 ~ G14), 국립 원예특작과학원(National Institute of Horticultural & Herbal Science; O)에서 총 19 균주(O1~ O19), 경북대(Kyungpook National University; K)에서 총20 균주(K1 ~ K20), 그리고 표준균주로써 Korean Agricultural Culture Collection (KACC)에서 1 균주(KACC No. 44711), 총 54 종의 Monilinia 균주을 본 실험에서 사용하였다(Table 1).
잿빛무늬병원균 DNA 추출 및 분자생물학적 동정
제공받은 잿빛무늬병원균 균주는 분자생물학적 동정을 위하여 Cytochrome B (cyt B) 영역의 염기서열을 이용해 동정하였다(Hily et al., 2010). 병원균의 DNA 추출은 CTAB(Cetyltrimethylammonium bromide buffer) 기법을 이용하여 진행하였다. Monilinia 균의 DNA 추출을 진행하기 위해 1.7 mL E-tube에 Cetyltrimethylammonium bromide buffer[20 g of cetyltrimethylammonium bromide, 40 mL of 0.5 M ethylene diamine tetra-acetic acid, 280 mL of 5 M NaCl, 100 mM Tris, pH 8.0] 500 μL와 배양한 균주를 넣은 후 Proteinase K solution (20 mg/mL)을 8 μL 첨가하였다(Kim et al., 2017; Mohammadzadeh et al 2019). Proteinase K를 넣은 E-tube를 grinder로 분쇄하여 65oC Heating block에서 30분간 반응하였다. 반응 후 상온에서 10분간 식힌 다음 PCI (Phenol:Chloroform:Isoamyl alcohol, 24:25:1) 500 μL를 넣고 10회 좌우로 흔들어 혼합 후 14,000 rpm로 10분간 원심분리기를 작동하였으며, 상층액 400μL를 새로운 E-tube에 옮겨 Isopropanol 400 μL 첨가하였다. 첨가된 tube를 10회 좌우로 흔들어 혼합 후 14,000 rpm으로 5분간 원심 분리하여 DNA를 침전시켰다. 마지막으로 70% Ethanol 500 μL 첨가하여 원심분리기에서 5분간 반응을 시켰으며 이후 상층액을 버리고 2시간 상온에서 건조를 진행하였다. 건조된 tube에 20 μL의 TE-buffer를 첨가하여 DNA를 녹인 후 농도를 검정하기 위해 1μL를 이용해 NanoDrop 2000C spectrophotometer (Thermo Scientific, Waltham, MA, USA)로 추출된 DNA의 농도를 측정하였다.
정제된 잿빛무늬병원균의 DNA는 cyt B영역을 증폭하기 위해 cyt B 유전자에 대하여 colaexon3-fwd (5’-TTTACCTTACGGTCAAATGAGCCT-3’)/colaexon4-rev (5’-AACTCAACAATATCACCTCCAATTCAT-3’) primer를 사용하여 PCR을 진행하였다(Hily et al., 2010; Fulton and Brown, 1997). PCR은 primer forward/reverse 1 μL씩, DNA 1 μL, 10X reaction buffer 2 μL, dNTP 1 μL, Taq polymerase(TOP, Bioneer, Seoul, Korea) 0.5 μL을 넣고 멸균수를 이용하여 Total volume 20 μL으로 PCR (Bio-Rad T100 thermocycler, USA)을 진행하였다. PCR 조건은 initial denaturation 94oC에서 3분, 94oC에서 30초, 50oC에서 30초, 68oC 2분간 30 cycles로 진행하였고, final extension step에서 68oC에 4분으로 진행하였다(Hily et al., 2010). PCR이 완료된 산물은 1% agarose gel을 이용하여 ethidium bromide(EtBr)로 염색 후 전기영동(Mupid-exU, TaKaRa, Japan)을 통해 증폭된 DNA 산물을 확인하였다. DNA 산물의 정제는 Gel purification [Expin Gel SV (GeneAll, Seoul, Korea)]을 진행하였다. PCR 산물에 5배 부피의 GB buffer를 혼합하여 Column type D의 filter 넣고 30초간 원심분리 후 필터 아래에 떨어진 용액을 버리고 NW buffer 500 μL를 넣었다. 다시 30초간 원심분리 후 필터 아래에 떨어진 에탄올을 제거하였다. Column type D의 밑부분을 E-tube의 뚜껑을 자른새 tube로 바꾸고 20분 동안 무균대에서 건조하였다. 건조 후 EB buffer 20 μL를 넣고 3분간 활성화시킨 후 3분간 원심분리 진행하였다. 원심분리 후 purification한 PCR 산물의 Quality를 1% agarose gel을 이용하여 확인하였다. DNA 염기서열 분석은 Cosmogenetech (Seoul, Korea)에서 진행하여 염기서열 library를 확보하였다. 확보된 염기서열은 NCBI nucleotide blast search program (http://blast.ncbi.nih.gov/Blast.cgi)를 통해 동정하였다. 동정 후 maximum likelihood method를 사용하여 MEGA 10 program (Molecular Evolution Genetic Analysis) 유사성 검증을 통해 계통수를 확인하였다.
잿빛무늬병원균 Monilinia의 항진균 방선균에 대한 민감도 평가
복숭아 잿빛무늬병원균 Monilinia 균주에 대한 항진균력을 가진 방선균에 대한 병원균의 민감도를 평가하였다. 잿빛곰팡이병을 일으키는 Botrytis cinerea를 억제하는 것으로 알려진 S. globisporus SP6C4(Kim et al., 2019)와 잔디 갈 색퍼짐병을 일으키는 R. solani를 억제하는 것으로 알려진 Streptomyces sp. S8 (Jeon et al., 2019), 두 균주와 Monilinia 균주와의 대치배양을 진행하였다. 각 Monilinia 균주와 대치배양을 진행하기 위해 방선균 균주인 SP6C4와 S8 균주를 MS media (Mannitol, 20 g; Soya, 20 g; Agar, 20 g; per L)에 전면 획선도말 진행 후 28oC 배양기에서 7일간 포자형성(sporulation)을 진행하였다. 7일간 sporulation 진행한 배지에 멸균한 솜을 올리고 멸균수를 2 mL 분주하여 멸균솜으로 포자를 채취하여 주사기를 이용하여 E-tube에 포자 현탁액을 제작하였다. 먼저 Monilinia 균주가 두 방선균에 민감성을 보이는지 확인하기 위한 평가를 진행하였다. MS media에 획선도말하여 28oC 배양기에서 7일간 배양시킨 SP6C4 균주를 균된 솜과 멸균수를 이용하여 포자 현탁액을 제작하였다. 제작한 포자 현탁액을 Microplate reader (BioTek, Synergy H1, Nederland)를 통해 흡광도 OD600에서 0.6으로 맞추어 균주를 준비하였다. 그 다음 1/5 PDK media (Potato dextrose, 2 g; Peptone, 2 g; Agar, 20 g per L) 배지 중앙 부분에서부터 3 cm 떨어진 위치에 멸균된 8 mm paper disc를 치상하고 그 위에 제작한 SP6C4 포자 현탁액을 20 μL씩 분주하여 총 3 반복으로 실험을 진행하였다. 포자 현탁액을 분주한 배지를 28oC 배양기에서 5일간 sporulation 후 배지 중앙에 1/5 PDA media (Potato dextrose, 4.8 g; Agar, 20 g per L)에 full plate로 배양한 Monilinia 균주들을 0.4 mm diam. cork-borer을 이용하여 크기를 일정하게 만든 후 5일간 SP6C4를 28oC 배양기에서 배양시킨 1/5 PDK media 중앙에 치상 후 10일 동안 25oC에서 배양하였다. 배양 10일 후 Monilinia 균주 균사 길이의 끝부분과 SP6C4 균주의 균사 끝부분 사이의 길이를 방선균 균주의 억제력에 민감하게 반응하여 성장이 억제된 정도를 나타내는 생장억제구역(Sensitive zone)으로 길이를 측정하였다.
잿빛무늬병원균 Monilinia 분리 지역간 방선균에 따른 민감도 차이 비교
국내에서 분리된 M. fructicola 균주들의 항진균력을 가진 방선균에 대한 민감도가 지역 별 차이가 있는지 확인하고자 하였다. 방선균 SP6C4와 S8과의 대치 배양 진행을 통해 얻어진 Sensitive zone 길이를 각 Monilinia 균주를 항진균 방선균에 보이는 민감도로 설정하여 Sensitive zone 길이를 기준으로 Sensitive (Sensitive zone ≥ 10 mm), Less sensitive (7 mm < Sensitive zone < 10 mm), Insensitive (Sensitive zone ≤ 7 mm) (Chae et al., 2021) 그룹으로 나누고 Monilinia 균주들의 분리 지역 정보와 대치배양 결과를 비교하여 항진균력을 가진 방선균에 따른 각 Monilinia 균주들의 분리 지역 간의 민감도 차이를 평가한 후 지역별 Monilinia 균주들의 민감도를 지도상에 표시하였다.
통계분석처리
항진균력을 가진 방선균 SP6C4와 S8 균주에 대한 Monilinia 민감도 결과값을 유의성 분석으로 Kruskal-Wallis Rank Sum Test를 통해 진행하였으며(Kruskal and Wallis, 1952), 분리된 Monilinia 균주 간 민감도 차이를 확인하기 위해 Conover Test 분석을(Conover et al., 2018) 통해 처리구간 유의한 차이를 그룹별로 표시하였다. 분석이 완료된 결과값은 R program (version 4.0.3)의 ggplot2 package를 사용하여 분석 및 시각화를 수행하였다.
결과 및 고찰
잿빛무늬병원균 Monilinia 균주의 분자생물학적 동정
글로벌 농업 컨설팅(G), 국립 원예 특작 과학원(O), 경북대(K), 3 기관으로부터 분리된 복숭아 잿빛무늬병원균들을 cyt B 영역으로 증폭하여 각 균주들이 가지는 염기서열을 분석하여 DNA를 동정한 결과, M. fructigena와 M. laxa와는 같은 Monilinia 속에 속하는 것을 확인되었다. M. fructigena, M. laxa와는 달리 확보된 균주는 모두 Monilinia fructicola로 확인되었다(Fig. 1).
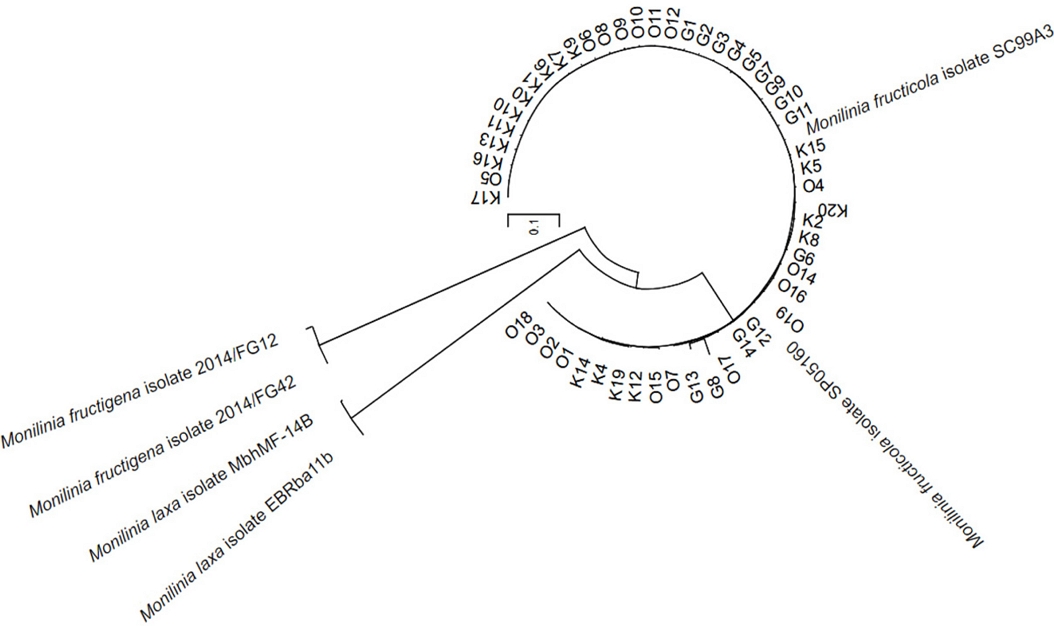
Phylogenetic tree of isolated Monilinia fruticola 54 strains. The phylogenetic tree constructed based on cyt B. Sequences were compared by multiple alignment analyses using the Maximum Likelihood of MEGA. The sequences of reference species were obtained from NCBI Genbank (http://blast.ncbi.nih.gov/Blast.cgi).
쟃빛무늬병원균 Monilinia 균주의 방선균 SP6C4와 S8에 대한 민감도 평가
전국에서 채집된 M. fructicola 균주들의 SP6C4에 대한 민감도를 확인하기 위해 대치배양을 진행하였다(Kim et al., 2019). SP6C4 포자 현탁액을 5일간 배양한 1/5 PDK에 Monilinia 균을 중앙에 치상한 후 10일간 배양하며 M. fructicola 균사가 항진균 방선균의 항진균력에 민감한 정도를 나타내는 Sensitive zone 길이를 통해 각 M. fructicola의 방선균 SP6C4 균주에 대한 민감도를 확인하였다. Sensitive zone의 길이가 길수록 M. fructicola 균주의 균사가 SP6C4 균주의 대사물질에 의해 민감하게 반응하여, 민감도가 높은 것으로 평가하였다. Sensitive zone의 길이 순으로 각 M. fructicola 균주의 방선균 SP6C4에 대한 민감도를 확인한 결과, 강원도 횡성 지역 복숭아 재배지에서 분리된 M. fructicola 균인 G14에서 Sensitive zone 길이가 평균 7 mm로 분리된 균주 중 가장 낮은 민감도를 확인하였다. 전북 전주 지역 복숭아 재배지에서 분리된 M. fructicola G12, K3, O19은 Sensitive 그룹의 균주들 중 가장 높은 민감도를 확인하였다. 전체 M. fructicola 54개 균주들 중 Sensitive 그룹은 전체그룹 중 57.4%, Less sensitive 그룹은 전체 그룹 중 37.6%, Insensitive 그룹은 전체 그룹 중 5%로 확인되었다. 이를 통해 M. fructicola 54개의 균주들 중 50% 이상의 균주들이 Sensitive 그룹에 속하며 O16, K1, G14를 제외한 51개의 균주이 SP6C4에 민감도를 보이는 것이 확인되었다(Fig. 2A).
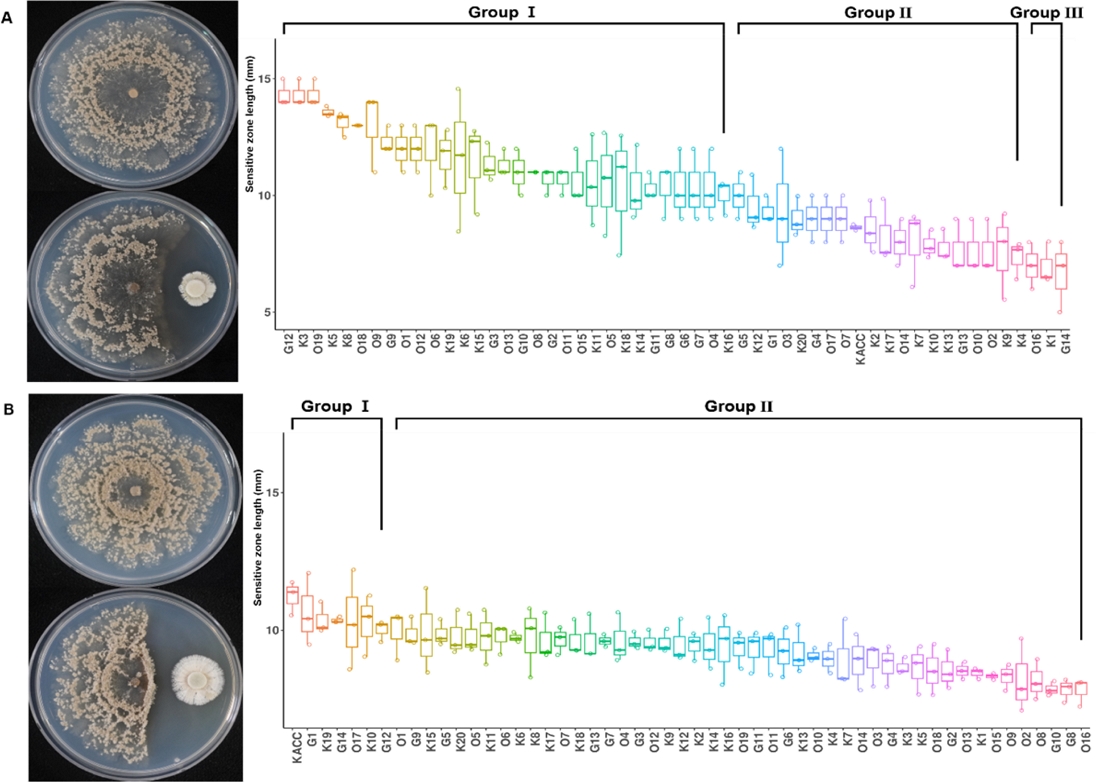
Antagonism test of Streptomyces globisporus SP6C4 and Streptomyces sp. S8 to M. fructicola 54 strains. Each Bacterial spore stock (OD600 0.6) was incubated in a 25oC incubator, and after 5 days a fungi block was positioned. A: Streptomyces globisporus SP6C4, B: Streptomyces sp. S8. Sensitive zone length of co-culture with SP6C4 and S8 were measured. Boxplots represent the standard deviation of the mean. The group letters indicate significant differences based on sensitive zone length, Group I (Sensitive): Sensitive zone ≥ 10 mm, Group II (Less sensitive): 7 mm < Sensitive zone < 10 mm, Group III (Insensitive): Sensitive zone ≤ 7 mm. M. fructicola strains with SP6C4 (p-value = 0), and with S8 (p-value = 0.002) results analyzed by Kruskal-Wallis test were indicated with the R program (version 4.0.3).

Grouping the sensitivity of 54 strains of Monilinia fructicola to Streptomyces globisporus SP6C4, Sensitivity was determined by the length of the sensitive zone
전국에서 분리된 M. fructicola 균주들의 S8 (Jeon et al., 2019)에 대한 민감도를 확인하였다. 각 M. fructicola 균주들이 S8 균주에 보인 민감도를 확인한 결과, 54개의 균주 중 Sensitive 그룹에 속한 6개의 균주(KACC, G1, K19, G14, O17, K10)을 제외한 48개의 균주이 낮은 민감도를 보이는 Less sensitive 그룹에 속하는 것을 확인하였다. S8 균주에 높은 민감도를 보인 6개의 균주 중 가장 높은 민감도를 보인 균주는 충남 세종 지역의 복숭아 재배지에서 분리된 M. fructicola 표준 균주인 KACC No. 44711로 평균 12 mm로 가장 Sensitive zone이 긴 것을 확인하였다. 각 M. fructicola 균주의 S8 균주에 대한 Sensitive 그룹은 전체 그룹의 11%, Less sensitive 그룹은 전체 그룹의 88.9%인 것으로 확인되었고, Insensitive 그룹에 해당하는 균주는 확인되지 않았다. 이 결과들을 통해 대부분의 M. fructicola 균주가 S8 균주에 대해 낮은 민감도를 보이는 것이 확인되었다. M. fructicola 균주가 보인 SP6C4 균주와 S8 균주에 대한 민감도를 비교한 결과, S8 균주보다 SP6C4 균주에서 각 M. fructicola 균주 간의 민감도가 높은 것을 확인하였다(Fig. 2B).
잿빛무늬병원균 Monilinia fruticola 균주의 지역별 방선균 민감도 차이 비교
복숭아 잿빛무늬병을 분리한 15개 지역간 두 방선균에 대한 M. fructicola 균주가 보인 민감도를 대치배양을 통해 확인한 Sensitive zone 길이를 이용하여 3가지 그룹으로 나누었다. 국내의 각 지역에서 분리된 M. fructicola 균주의 민감도에 따라 나눈 그룹을 지도 상에 표시하여 지역간 차이를 확인하였다. M. fructicola 균주들의 지역으론 연천, 양양, 춘천, 홍성, 여주, 용인, 세종, 상주, 완주, 전주, 임실, 거창, 영천, 양산, 화순 총 15개의 지역이 있었다. 분리 지역간 민감도 분포 차이를 확인한 결과, 먼저 SP6C4 균주에 대한 M. fructicola 균주은 7개 지역(연천, 양양, 용인, 여주, 상주, 완주, 양산)에서 분리된 균주는 모두 SP6C4에 Sensitive한 결과를 보였다. 2개 지역(거창, 화순)에서는 분리된 M. fructicola 균주는 모두 Less sensitive하였다. 그러나 춘천은 Sensitive 그룹 33.3%와 Less sensitive 그룹 66.7%로 확인되었고, 세종에서 Sensitive 그룹 20%와 Less sensitive 그룹 80%, 영천에서 Sensitive 그룹 66.7%와 Less sensitive 그룹 33.3%인 것을 확인하였다. 그러나, 홍성에서 Sensitive 그룹 50%, Less sensitive 그룹 25%, Insensitive 그룹 25%로, 전주에서 Sensitive 그룹 50%, Less sensitive 그룹 41.7%, Insensitive 그룹 8.3%로, 임실에서 Sensitive 그룹 66.7%, Less sensitive 그룹 22.2%, Insensitive 그룹 11.1%으로 분포하고 있는 것을 확인하였다(Fig. 3A).
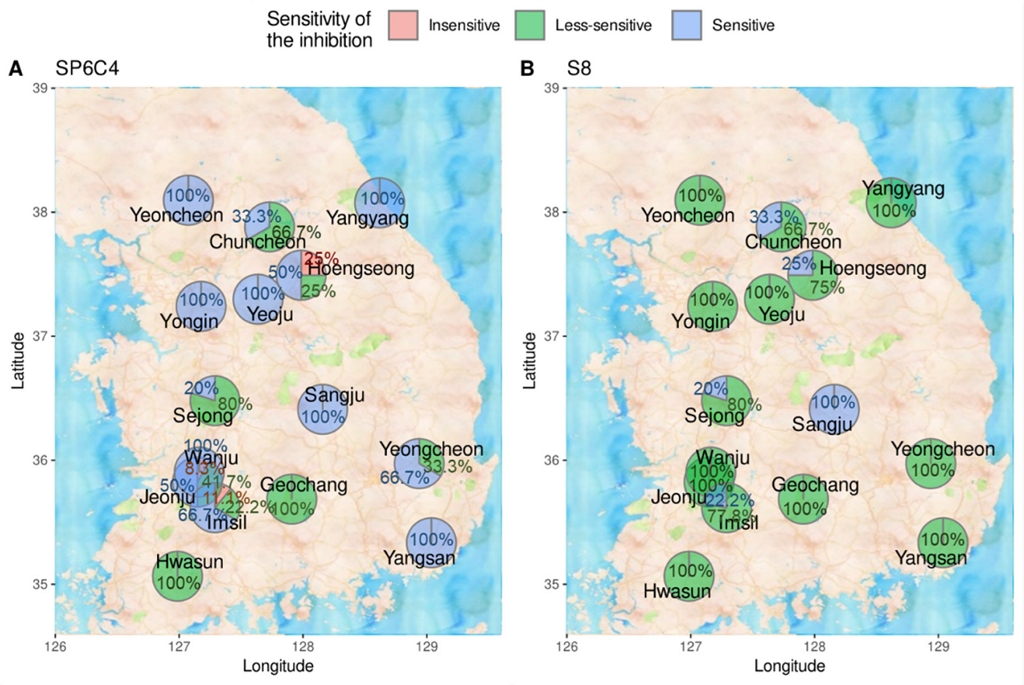
Geographic distribution of Monilinia fructicola sensitivity against Streptomyces. A: Streptomyces globisporus SP6C4, B: Streptomyces sp. S8. Pie plots are the percentage of distribution on isolated sites. Categorical criteria defined: Insensitive: Sensitive zone ≤ 7 mm, Less sensitive: 7 mm < Sensitive zone < 10 mm, Sensitive: Sensitive zone ≥ 10 mm. The result was visualized by R program (version 4.0.3).
방선균 S8에 대한 M. fructicola 균주 간의 지역별 민감도 차이는 상주에서 Sensitive 그룹이 100%였고, 10개 지역(연천, 양양, 용인, 여주, 영천, 완주, 전주, 거창, 양산, 화순)에서 less sensitive 그룹으로 100% 분포되었다. 그 중 춘천은 Sensitive 그룹 33.3%, Less sensitive 그룹 66.7%로 확인되었고, 홍성은 Sensitive 그룹 25%, Less sensitive 그룹 75%로 확인되었고, 세종과 임실은 Sensitive 그룹 20%, Less sensitive 그룹 80%로 확인되었다. 방선균에 대한 M. fructicola 균주의 민감도 결과를 지도 상의 표시를 통해 상주 지역에서 분리된 M. fructicola가 SP6C4 균주와 S8 균주 모두 높은 Sensitive한 민감도를 보였지만, SP6C4 균주에 대해 연천, 양양, 용인, 여주, 상주, 완주, 양산 등 다양한 지역에서 분리된 M. fructicola 균주들이 높은 민감도를 보인 것에 비해 M. fructicola 균주들이 S8 균주에선 다른 지역에 비해 주로 상주에서 높은 민감도를 나타내는 것으로 보인다. 이러한 결과들로 국내에서 분리된 M. fructicola 균주는 S8 균주에 비해 SP6C4 균주에서 Sensitive한 민감도를 보이는 것을 확인하였다. 이를 통해 국내의 다양한 지역에서 분리된 M. fructicola가 같은 species 임에도 불구하고 방선균의 종마다 다른 민감도를 나타내는 것으로 보이며 분리된 지역에 따라 다른 민감도를 보이는 것으로 사료된다(Fig. 3B). 방선균은 다양한 2차 대사산물을 생산하며, 약 7,000여 종의 물질이 항생물질로 알려져 있다 (Kim and Kwak, 2021). 본 연구에서 사용된 SP6C4와 S8은 각각 Lantipeptide와 Valinomycin계열의 항생물질을 분비하여 진균의 생장을 억제하는 것으로 알려져 있다. 전국에서 채집된 잿빛무늬병원균이 두 방선균에 대한 민감도의 차이를 나타내는 것은 균주 간 detoxification능력의 차이에 기인하는 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청의 연구과제(PJ016906)의 지원으로 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Carmona-Hernandez S, Reyes-Pérez JJ, Chiquito-Contreras RG, Rincon-Enriquez G, Cerdan-Cabrera CR, et al., 2019. Biocontrol of postharvest fruit fungal diseases by bacterial antagonists: a review. Agrion J, 9(3):121.
[https://doi.org/10.3390/agronomy9030121]

-
Conover WJ, Guerrero-Serrano AJ, Tercero-Gómez VG, 2018. An update on a comparative study of tests for homogeneity of variance. J Stat Comput Simul. 88(8):1454-1469.
[https://doi.org/10.1080/00949655.2018.1438437]

-
Chae DH, Kim DR, Kwak YS, 2021. Sensitivity Variation of Fusarium oxysporum f. sp. fragariae, strawberry wilt pathogen against biocontrol agent. J. Agric. Life Sci. 55(3):33-42.
[https://doi.org/10.14397/jals.2021.55.3.33]

-
Cho GJ, Kim JH, Park CG, Nislow C., Weller DM, et al., 2017. Caryolan-1-ol, an antifungal volatile produced by Streptomyces spp., inhibits the endomembrane system of fungi. Open Biol. 7:170075.
[https://doi.org/10.1098/rsob.170075]

-
Choi IY, Kim J, Seo KW, Oh HT, Cho JH et al., 2016. Occurrence of brown rot on apricot caused by Monilinia fructicola in Korea. Res. Plant Dis. 22(2):122-126. (In Korean)
[https://doi.org/10.5423/RPD.2016.22.2.122]

-
Choi HW, Hong SK, Lee YK, Nam YJ, Lee JG, et al., 2014. Characterization of Monilinia fructicola associated with brown rot of cherry fruit in Korea. Kor. J. Mycol. 42(4):353-356. (In Korean)
[https://doi.org/10.4489/KJM.2014.42.4.353]

-
Fulton CE, Brown AE, 1997. Use of SSU rDNA group-I intron to distinguish Monilinia fructicola from M. laxa and M. fructigena. FEMS Microbiol. Lett. 157(2):307-312.
[https://doi.org/10.1111/j.1574-6968.1997.tb12790.x]

-
Gell I, De Cal A, Torres R, Usall J, Melgarejo P, 2008. Relationship between the incidence of latent infections caused by Monilinia spp. and the incidence of brown rot of peach fruit: factors affecting latent infection. Eur. J. Plant Pathol. 121:487-498.
[https://doi.org/10.1007/s10658-008-9268-3]

-
Harir M, Bendif H, Bellahcene M, Fortas Z, Pogni R et al., 2018. Streptomyces secondary metabolites. Basic biology and applications of Actinobacteria. IntechOpen. 6:99-122
[https://doi.org/10.5772/intechopen.79890]

-
Hily JM, Singer SD, Villani SM, Cox KD, 2010. Characterization of the cytochrome b (cyt B) gene from Monilinia species causing brown rot of stone and pome fruit and its significance in the development of QoI resistance. Pest Manag. Sci. 67(4):385-396.
[https://doi.org/10.1002/ps.2074]

-
Hu MJ, Cox KD, Schnabel G, Luo CX, 2011. Monilinia species causing brown rot of peach in China. PLoS One 6(9):e24990.
[https://doi.org/10.1371/journal.pone.0024990]

-
Jeon CW, Kim DR, Kwak YS, 2019. Valinomycin, produced by Streptomyces sp. S8, a key antifungal metabolite in large patch disease suppressiveness. World J. Microbiol. Biotechnol. 35(128).
[https://doi.org/10.1007/s11274-019-2704-z]

-
Kim DR, Cho GJ, Jeon CW, Weller DM, Thomashow LS et al., 2019. A mutualistic interaction between Streptomyces bacteria, strawberry plants and pollinating bees. Nat. Commun, 10(4802).
[https://doi.org/10.1038/s41467-019-12785-3]

-
Kim DR, Kwak YS, 2021. A genome-wide analysis of antibioitc producing genes in Streptomyces globisporus SP6C4. Plant Pathol J. 37(4):389-395.
[https://doi.org/10.5423/PPJ.NT.03.2021.0047]

-
Kruskal WH, Wallis WA, 1952. Use of ranks in one-criterion variance analysis. J Am Stat Assoc. 47(260):583-621
[https://doi.org/10.1080/01621459.1952.10483441]

-
Martini C, Mari M., 2014. Monilinia fructicola, Monilinia laxa (Monilinia Rot, Brown Rot). Postharvest Decay. 233-265.
[https://doi.org/10.1016/B978-0-12-411552-1.00007-7]

-
Mohammadzadeh R, Baradaran B, Yousefi B, Valizadeh H, Zakeri-Milani P, 2019. Attenuation of intestinal efflux pump thru polymers and preservatives. J Res Pharm Pract. 23(4):632-641.
[https://doi.org/10.12991/jrp.2019.171]

-
Oh HT, Choi IY, Kim Ju, Na YE, Lee WH et al., 2017. Characteristics of Brown Rot Caused by Monilinia fructicola on Stone Fruit in Korea. Res. Plant Dis. 23(4):322-333. (In Korean).
[https://doi.org/10.5423/RPD.2017.23.4.322]

-
Rani L., Thapa K, Kanojia N, Sharma N, Singh S, et al., 2021. An extensive review on the consequences of chemical pesticides on human health and environment. J. Clean. Prod. 283:124657.
[https://doi.org/10.1016/j.jclepro.2020.124657]

- Rural Development Administration. 2007. Monography of Stone Fruit Cultivars. p:252. (In Korean).
-
De Miccolis Angelini RM, Abate D, Rotolo C, Gerin D, Pollastro S, et al., 2018. De novo assembly and comparative transcriptome analysis of Monilinia fructicola, Monilinia laxa and Monilinia fructigena, the causal agents of brown rot on stone fruits. BMC Genomics 19(436).
[https://doi.org/10.1186/s12864-018-4817-4]

- Shim MY, Jeon YJ, Kim SH, 2007. Characterization of a brown rot fungus isolated from dwarf flowering almond in Korea. Mycobiology. 35(1):30-35.
- Shimazu, Akira, Kim CJ, Yoo ID, 1993. Diversity of Actinomyces - species, morphology and life cycle. Kor. J. Appl. Microbiol. Biotechnol. 21(1):88-94.
- The Korean Society of Plant Pathology. 2009. List of Plant Disease in Korea. 5th ed. The Korean Society of Plant Pathology, p:853. (In Korean)
-
Zhu XQ, Chen XY, Luo Y, Guo LY, 2005. First report of Monilinia fructicola on peach and nectarine in China. Plant Pathol. 54:575.
[https://doi.org/10.1111/j.1365-3059.2005.01199.x]

Hwa-Jung Lee, Division of Applied Life Science (BK21Plus), Gyeongsang National University, Graduate student, http://orcid.org/0009-0008-2899-244X
Su In Lee, Division of Applied Life Science (BK21Plus), Gyeongsang National University, Graduate student
Youn-Sig Kwak, Research Institute of Life Science, Gyeongsang National University, Professor, http://orcid.org/0000-0003-2139-1808
