복숭아 잿빛무늬병균 Monilinia fructicola의 살균제에 대한 감수성 검정
초록
Monilinia fructicola로 인한 잿빛무늬병은 사과와 핵과류 생산에서 전 세계적으로 큰 위협이 되는 병해이다. 잿빛무늬병의 방제는 주로 합성 농약 살균제의 살포를 통해서 병해를 관리하고 있다. 본 연구에서는 한국의 복숭아 재배지에서 분리된 39개 잿빛무늬병균 균주에 대해 네 가지 살균제(bitertanol (a.i. 25%, WP), fluxapyroxad (a.i. 15.3%, SC), procymidone (a.i. 50%, WP), pyraclostrobin (a.i. 20%, WG)의 감수성을 평가하였다. 병원균의 생장 측정값은 살균제의 반수영향농도(EC50)를 계산하고 R 패키지에서 로그-로그 모델을 사용하여 용량반응곡선을 분석하였다. 연구결과 SDHI계열 살균제인 fluxapyroxad에 대해 두 개의 잿빛무늬병균 균주만이 약제에 대한 불감성을 보였고, 다른 균주들은 평가된 살균제에 대한 내성 또는 불감성의 증거를 보이지 않았습니다. 이러한 연구 결과는 핵과류에서의 잿빛무늬병 예방 및 관리를 위한 기본 지식을 제공할 것으로 사료된다.
Abstract
Brown rot disease caused by Monilinia fructicola is a major threat to stone and pome fruit production worldwide. The pathogen is listed as a quarantine organism and is primarily controlled by synthetic fungicides. This study evaluated the effectiveness of four fungicides (bitertanol, fluxapyroxad, procymidone, and pyraclostrobin) against 39 isolates of M. fructicola from peach cultivation sites in Korea. Raw measurements calculated half maximal effective concentration (EC50) of the fungicides and analyzed the dose-response curves using the log-logistic model in the R package. Our results indicate that only two isolates of M. fructicola were insensitive to SDHI fluxapyroxad, while other isolates showed no evidence of insensitivity to the tested fungicides. These findings provide fundamental knowledge for preventing and managing brown rot disease in stone fruits.
Keywords:
Brown rot, Fungicide resistance, Peach, Stone fruit키워드:
잿빛무늬병, 살균제 내성, 복숭아, 핵과류서 론
복숭아는 (Prunus persica L.)는 장미과 벚나무 속에 속하는 복사 나무의 과수로써, 중국이 원산지로 알려져 있으며 전 세계적으로 소비되는 주요 과실 중 하나이다(Kim et al., 2021). 국내에서는 감, 사과, 배에 이어 가장 많이 생산되고 있는 과일 중 하나이며, 2020년 기준 재배면적은 15,657 ha로 우리나라 과수 중 사과, 밤에 이어 재배면적이 넓은 작물 중 하나이다. 또한, 경상북도, 전라북도, 충청북도 등에서 주로 재배되고 있다(KOSIS, 2020).
국내 복숭아에 발생하는 병해는 진균, 세균, 바이러스 등에 의해서 다양하게 발생한다. 그 중 대표적인 진균병으로는 Taphrina deformans에 의한 잎오갈병(Leaf curl), Monilinia fructicola에 의한 잿빛무늬병(Brown rot), Colletotrichum spp.에 의한 탄저병(Anthracnose) 등 10여종이 알려져 있다(Martini C and Mari M. 2014; Oh et al., 2017). 특히, Monilinia 속에 의한 잿빛무늬병은 복숭아를 포함한 자두, 살구 등 핵과류에서 개화기와 과실 성숙기에 충분한 강우량으로 인하여 습한 조건이 조성되면 어디서든 발병한다(Rungjindamai et al., 2014). 전세계적으로 여러 핵과류에 잿빛무늬병을 일으키는 원인균은 M. fructicola, M. fructigena, M. laxa 등이 알려져 있다(Choi et al., 2016). 그 중, M. fructicola는 미국, 호주, 뉴질랜드와 일부 유럽, 일본에서 주로 보고가 되었고, M. fructigena는 유럽과 일본, M. laxa는 미국, 호주, 유럽, 일본에 분포하는 것으로 보고되었다(Fulton and Brown, 1997; Hu et al., 2011; Shim et al., 2007). 국내에서는 M. fructicola는 복숭아, 자두, 살구, 매실, 체리 등에 보고가 되어 있으며, M. fructigena는 배와 사과에서 발생이 보고되었다(Oh et al., 2017). 이러한 잿빛무늬병은 7월 중하순부터 병징이 나타나기 시작하며 8월에 발병이 최대치로 증가한다(Choi et al., 2017). 또한, 1차적으로 과실의 부패를 일으키지만, 수확 전, 후 저장 및 수송 중에도 흔히 발생하는데 발병이 심하면 50~70%의 피해를 입으며, 경제적으로 큰 손실을 일으키므로 핵과류에 있어 중요한 병으로 여겨지고 있다(Carmona-Hernandez et al., 2019). 복숭아 잿빛무늬병은 화학적 방제와 경종적 방제에 의존하여 방제하고 있으며, 그 중 경종적 방제로는 도장지를 제거하여 통풍 관리를 하거나 병에 걸린 나뭇가지나 열매를 일찍 제거하여 태우고, 이른 봄까지 발병지의 토양을 경운하여 지표면에 있는 병원균이 토양 속 깊숙이 매몰하는 방법이 있다. 화학적 방제로는 병의 발병 적기에 다양한 살균제를 이용하는 방법으로, 현재 국내에서는 복숭아 잿빛무늬병 방제에 사용되는 살균제는 총 103가지의 품목이 등록되어 있다(KCPA, 2023).
살균제로 사용되는 약제는 전세계적으로 MBC (Methyl benzimidazole carbamates) 계열의 benomyl, thiophanatemethyl, DMI (Demethylation inhibitor)계의 tebuconazole, bitertanol과 QoI (Quinine outer binding site inhibitors)계 pyraclostrobin, SDHI (Succinate dehydrogenase inhibitor)계의 boscalid 등이 있다(Hrustićet al., 2018; Lesniak et al., 2021; Jones and Ehret, 1976; Usman et al., 2021). 그러나 살균제의 반복사용은 약제에 대한 병원균의 감수성을 저감시켜 약제의 효과를 감소시키며, 이러한 결과로 인해 살균제에 대한 저항성 병원균주들이 출현하게 되었다(Kim, 2000). 국외에서는 1978년도에 최초로 dicarboximide계와 benzimidazole계 살균제에 대해 저항성 잿빛무늬병균이 보고되었다(Sztejnberg and Jones 1978). 잿빛무늬병 방제를 위해 DMI 계열의 살균제가는 30년 넘게 사용되면서, DMI 계통의 살균제에 저항성인 잿빛무늬병의 변이주와 관련 유전자인 ‘Mon a’가 보고되었다(Schnabel et al., 2004; Luo et al., 2008). 국내의 경우 잿빛무늬병균의 살균제 저항성은 1970년대부터 시작하여 현재까지 benzimidazole계열 carbendazim, benomyl, thiophanate-methyl과 dicarboximide계열 iprodione, procymidone 살균제에 대한 저항성이 보고되었다(Lim et al. 1998).
본 연구에서는 국내 주요 복숭아 재배 지역에서 분리되었고 종 동정을 통해 복숭아 잿빛무늬병균으로 확인된 39균주를 대상으로 bitertanol (a.i. 25%, WP), fluxapyroxad (a.i. 15.3%, SC), procymidone (a.i. 50%, WP), pyraclostrobin (a.i. 20%, WG)에 대한 감수성 검정을 실시하였다. 살균제에 대해 저항성을 보이는 M. fructicola 균주의 약제저항성과 관련된 유전자 염기서열을 분석하여 저항성 균주의 유전자 변이를 구명하였다.
재료 및 방법
복숭아 잿빛무늬병균의 배양 조건
복숭아 잿빛무늬병균은 국립농업과학원 농업미생물은행(Korea Agricultural Culture Collection, KACC)에서 1 균주(KACC 44711: 본 연구에서 표준 균주로 사용함), 국립원예특작과학원(National Institute of Horticultural and Herbal Science)에서 19 균주(O1 - O19) 그리고 경북대학교(Kyungpook National University)에서 19 균주(K1 – K20), 총 39개의 복숭아 잿빛무늬병균을 사용하였다(Table 1). 병원균의 배양 조건은 PDA 배지(potato starch, 4 g; dextrose, 20 g; agar, 15 g per L)를 제조하여 25oC 정치배양기에서 배양하였다.
복숭아 잿빛무늬병균의 분자생물학적 동정
국내 6개 시˙군에서 분리된 복숭아 잿빛무늬병균의 분자생물학적 동정을 위해 DNA 추출 및 정제를 진행하였다. 분리된 잿빛무늬병균을 PDA 배지에 접종하여 25oC에서 10일간 배양하였다. 배지에서 병원균의 포자와 균사를 500 μL CTAB (cetyltrimethylammonium bromide 2.0% (w/v), 100 mM Tris-HCl, pH 8.0, 20 mM EDTA pH 8.0, 1.4 M NaCl)가 담긴 1.7 mL E-tube에 넣은 후, proteinase K solution (20 mg/mL) 8 μL를 첨가한 후 분쇄하고 65oC에서 30분간 반응하였다. 반응 후 상온에서 10분간 정치 후 PCI (phenol: chloroform: isoamyl alcohol, 24:25:1) 500 μL를 넣고 5~7회 좌우로 흔들어 혼합하였다. 다시 12,470 × g으로 10분간 원심 분리하여 단백질을 제거하였다. 상층액을 새로운 E-tube로 옮긴 후 400 μL의 Isopropanol을 첨가하여 4oC에서 12,470 × g로 5분간 원심 분리한 후, 상층액을 제거하였다. 마지막으로 70% ethanol 500 μL를 첨가하여 5분간 원심분리한 후 상층액을 제거하고 1~2시간 동안 완전히 건조시켰다. DNA 농도는 E-tube에 20 μL의 TE-buffer를 첨가하여 Nano Drop 2000C spectrophotometer (Thermo Scientific, Waltham, MA, USA)로 측정하였다. 추출된 DNA를 병원균 동정을 위해 ITS, TEF1-α, β-tubulin, 그리고 cytB 영역을 증폭하였다. 사용한 프라이머는 ITS 영역의 경우 ITS1 (5’-TCC GTA GGT GAA CCT GCG G-3’)/ITS4 (5’-TCCTCC GCT TAT TGA TAT GC-3’), TEF1-α는 EF1-728F(5’-CAT CGA GAA GTT CGA GAA GG-3’)/EF1-986R(5’-TAC TTG AAG GAA CCC TTA CC-3’), β-tubulin은 TubF1 (5’-ATG CGT GAG ATT GTA CGT AT-3’)/TubR1(5’-GTACCAATGCAAGAAAGCCT-3’), cytB는 colaexon3-fwd (5’-TTT ACC TTA CGG TCA AAT GAG CCT-3’)/colaexon4-rev (5’-AAC TCA ACA ATA TCA CCT CCAATT CAT-3’)를 사용하였다(Fischer et al., 2017; Hily et al., 2011; Poniatowska et al., 2021; White et al., 1990). 그리고 염기서열 분석은 코스모진텍(Cosmogentech Inc., Seoul, Korea)에서 진행하였으며 확보된 염기서열은 NCBI nucleotide blast search program을 통해 동정하였다. Maximum likelihood method를 사용하여 MEGA 10 program 유사성 검증을 통해 계통 분석을 실시하였다.
복숭아 잿빛무늬병균의 살균제 EC50값 산출
복숭아 잿빛무늬병균의 살균제 감수성 평가에 사용된 살균제로는 bitertanol (a.i. 25%, WP), fluxapyroxad (a.i. 15.3%, SC), procymidone (a.i. 50%, WP), pyraclostrobin (a.i. 20%, WG)를 사용하였다. 살균제의 균사 성장 억제 최대 효과의 절반 효과를 보이는 지점인 EC50 (effective concentration (μg/mL), reducing mycelial growth by 50%)의 값을 통하여 기준을 설정하였다. 복숭아 잿빛무늬병균의 균주의 배양 조건으로는 9-cm Petri dish (SPL, Pocheon, Korea)에 PDA 배지에 계대 배양하여 25oC 정체 배양기에서 암조건으로 10일간 배양하였다. 표준균주(KACC 44711)를 이용하여 각 약제 별 생육반응을 조사한 예비시험 결과를 바탕으로(Data not shown)하여, 균사생장이 유의미하게 저해되는 약제의 농도를 사용하였다. 살균제 별로 6-well plate 배지에서 최종 농도는 bitertanol의 경우 0, 0.000025, 0.00025, 0.0025, 0.025, 0.25 μg/mL, fluxapyroxad는 0, 0.765, 1.53, 7.65, 15.3, 76.5 μg/mL procymidone은 0, 0.002, 0.02, 0.2, 2.0, 20.0 μg/mL, 그리고 pyraclostrobin은 0, 2.0, 10.0, 20.0, 100.0, 200.0 μg/mL가 되도록 배지에 첨가하였다. 살균제를 첨가한 배지를 6-well plate의 각 well에 분주한 후, 25oC의 암조건에서 10일간 배양한 병원균의 균총 선단에서 직경 4 mm의 균사 조각을 떼어내어 접종원으로 사용하였다. 접종한 병원균은 25oC의 암조건에서 5일간 배양한 후 균총의 직경을 측정하여 아래 식에서 살균제의 균사생장 억제효과를 계산하였다. 병원균에 대한 살균제의 효과는 6-well plate의 지름이 3.5 cm인 것을 감안하여 지름의 절반인 1.75 cm를 EC50 기준으로 정하여 비교하였다. 이후 EC50 값은 로지스틱 회귀분석(logistic regression)을 통하여 산출하였으며, R (version 4.3.0)의 DRC (Analysis of dose-response curves) package 사용하였다.
sdhA-D 유전자 증폭 및 염기서열 분석
SDH 살균제에 대해서 감수성 반응이 저하된 병원균에서 살균제 저항성 발현 여부를 확인하기 위하여 SDHI 살균제의 작용점 유전자 염기서열을 분석하여 점돌연변이를 확인하였다. 대상 유전자인 SdhA, SdhB, SdhC, SdhD 유전자의 증폭을 위하여 SdhA는 MfsdhaF (5’-AGA GCA GCA TTC GGT CTT G-3’)/MfsdfaR (5’-ACA GCC TTG CAC TCA TTC TC-3’), SdhB는 MfsdhbF (5’-CGC GAC CAG CTT TCA GAA C-3’)/MfsdfbR (5’-ATT TCC TTC TTG ATC TCC GC-3’) 프라이머를 사용하였다. 그리고 SdhC와 SdhD 유전자 증폭을 위한 프라이머로는 MfsdhcF (5’-GCA ACT CAA CAA TCG CTG C-3’)/MfsdfcR (5’-AAA GCA ACC AAC GCC AAA G-3’)와 MfsdhdF (5’-GTC GAA GCG TAG TTT CTC TAC-3’)/MfsdfdR (5’-CTC ATA CAA TCC AAC TCC AAC C-3’)를 사용하였다(Chen et al., 2013). PCR 반응액은 희석된 DNA 2 μL, 10 pmole primer 각각 1 μL, Taq polymerase 0.5 μL, dNTP 1 μL, 10X reaction buffer 2 μL, 멸균수 12.5 μL를 첨가하여 준비하였다. PCR 반응 조건은 Bio-Rad T100 Thermal cycler(Bio-Rad, Hercules, CA, USA)를 이용해 5분간 94oC에서 pre-denaturation 수행 후, 1분 동안 94oC에서 denaturation, 40초 동안 SdhA와 SdhC는 55oC, SdhB는 57oC, SdhD는 53oC에서 annealing, SdhA는 2분 20초, SdhB는 1분, SdhC와 SdhD는 40초 동안 72oC에서 extension을 32회 반복하였고, 72oC에서 10분 동안 final-elongation 후 종료하였다. PCR 산물들은 1% agarose gel에 전기 영동 후, gel elution을 진행하였다. 그 후, ExpinTM Gel SV kit (GeneAll, Seoul, Korea)를 이용하여 정제하였다. 정제된 PCR 산물을 코스모진텍에 염기서열 분석을 의뢰하였으며, 분석된 유전자의 염기서열을 BioEdit ver 7.2의 Clustal X를 이용하여 multiple alignment 후, MEGA X ver 10.2.6에서 정렬한 후 이전에 보고된 염기서열과 유연관계를 확인하였다.
결과 및 고찰
복숭아 잿빛무늬병균 DNA 추출 및 동정
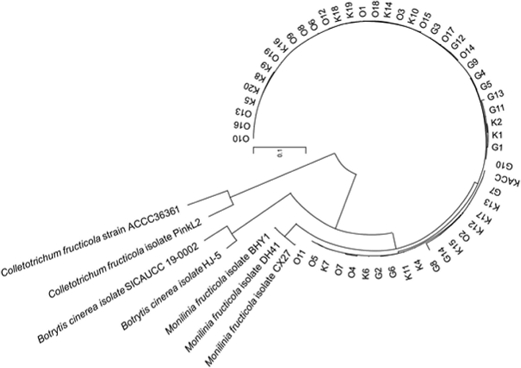
본 실험은 국립농업과학원 농업미생물은행(Korea Agricultural Culture Collection, KACC) 1개 균주, 농촌진흥청 국립원예특작과학원(National Institute of Horticultural & Herbal Science, Korea) 19개 균주 그리고 경북대학교(Kyungpook National University, Korea)에서 19개 균주, 총 39개의 복숭아 잿빛무늬병균을 분양 및 제공받았다(Table 1). 각 복숭아 잿빛무늬병균으로 추정되는 균주는 ITS, TEF1-α, β-Tubulin, 그리고 cytB 유전자를 증폭하여, 580 bp, 250 bp, 1.2 kbp, 1.2 kbp의 PCR 산물을 확인되었다. 각 염기서열을 NCBI BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)를 이용하여 유전자 상동성을 검색한 결과를 기반으로 Monilinia속과 99% 이상의 유연관계를 보였으며, 분자계통학적 유연관계 분석에서도 동일한 그룹에 속함을 알 수 있었다. 종의 정확한 분류를 위해 다른 Monilinia spp.와 ITS 영역 및 3가지 유전자(TEF1- α, β-Tubulin, cytB)의 염기서열을 이용하여 multiple alignment analysis 계통수 분석을 진행하였다. 이는 MEGA 10 프로그램을 이용해 M. fructicola와 분양 및 제공받은 균주들이 함께 분류되는 것을 확인할 수 있었다(Fig. 1).
복숭아 잿빛무늬병균의 약제별 감수성 검증
복숭아 산업이 확장됨에 따라 복숭아 재배 면적이 증가하고 있으며 약제를 이용한 병 방제가 활발히 이루어지고 있다(Rungjindamai et al., 2014). 이에 따라 화학적 방제의 오남용이 지속되어 살균제에 대한 저항성이 증가하고 있는 추세이다(Chen et al., 2013; Luo and Schnabel, 2008). 국외에서는 DMI, SDHI 그리고 QoI 계열 등 다양한 살균제에 대한 복숭아 잿빛무늬병균의 저항성 균주 출현이 보고되고 있다(Amiri et al., 2010; Chen et al., 2013; Chen et al., 2015; Lichtemberg et al., 2017; Testempasis et al., 2021). 하지만, 국내 문헌에서는 병원균에 대한 배양적 및 형태적 특징에 대해서만 알려져 있고, 2017년에 전라북도 지방에서 Monilinia에 의한 잿빛무늬병이 2~5% 발생했다는 보고만 되었다(Oh et al., 2017). 해당 병원균에 대하여 국외에서는 저항성 보고가 계속하여 되고 있지만, 국내에서는 아직 연구가 많이 부족한 상황이다(Oh et al., 2017). 또한, 살균제 저항성은 포장에서 생존, 증식을 포함한 기생적 적응력이 감수성 균주와 비교하여 평가되며, EC50 또는 EC90 값을 기준으로 평가대상 병원균의 약제 저항성을 판별하기 어려운 상황이다(Delp and Dekker, 1985).

Fungicide sensitivity assay of Monilinia fructicola. All strains with a diameter of 0.4 cm were incubated at the center of the plate and 25oC for 5 days (n = 3). A: Bitertanol; B: Fluxapyroxad; C: Procymidone; D: Pyraclostrobin are concentrations used for the experiment and images of the experimental plate of M. fructicola.
복숭아 잿빛무늬병균의 bitertanol, fluxapyroxad, procymidone, pyraclostrobin 약제에 대한 EC50값을 산출한 결과, bitertanol은 최소값으로 0.02 μg/mL 농도로 확인되었고 최대값으로는 0.14 μg/mL, fluxapyroxad 액상수화제는 0.12 μg/mL이 최소값, 87.33 μg/mL이 최대값으로 확인되었다. 그리고 procymidone의 최소값 0.13 μg/mL, 최대값으로 0.67 μg/mL 확인되었다. 마지막으로 pyraclostrobin의 최소값으로는 0.34 μg/mL, 최대값은 15.50 μg/mL 농도로 산출되었다. 4가지 약제 중 fluxapyroxad와 pyraclostrobin의 경우 EC50값의 범위가 넓고 다양하게 나타난 것으로 보아 복숭아 잿빛무늬병균 분리 균주별 약제에 대한 감수성 차이가 큰 것으로 확인되었다(Fig. 3). Delp와 Dekker(1985)가 제안한[농약에 대한 저항성 개념의 정의]에서는 저항성(Resistance)은 작물재배 포장에서 살균제의 처리에도 불구하고 병의 방제가 실패하는 경우로 정의하였다. 따라서 본 연구에서는 균주별 약제에 대한 민감도를 다음과 같이 3가지로 구분하여 사용하였다: 1) ‘불감성’(Insensitive, 사용약량 농도 이상에서도 생장이 가능한 균주), 2) ‘저감성’(Less-sensitive, EC50값 이상에서도 성장하는 균주, 하지만 사용약량 농도에서는 생장하지 못하는 균주) 그리고 3) ‘민감성’(Sensitive, EC50값 이상에서는 생장하지 못하는 균주).
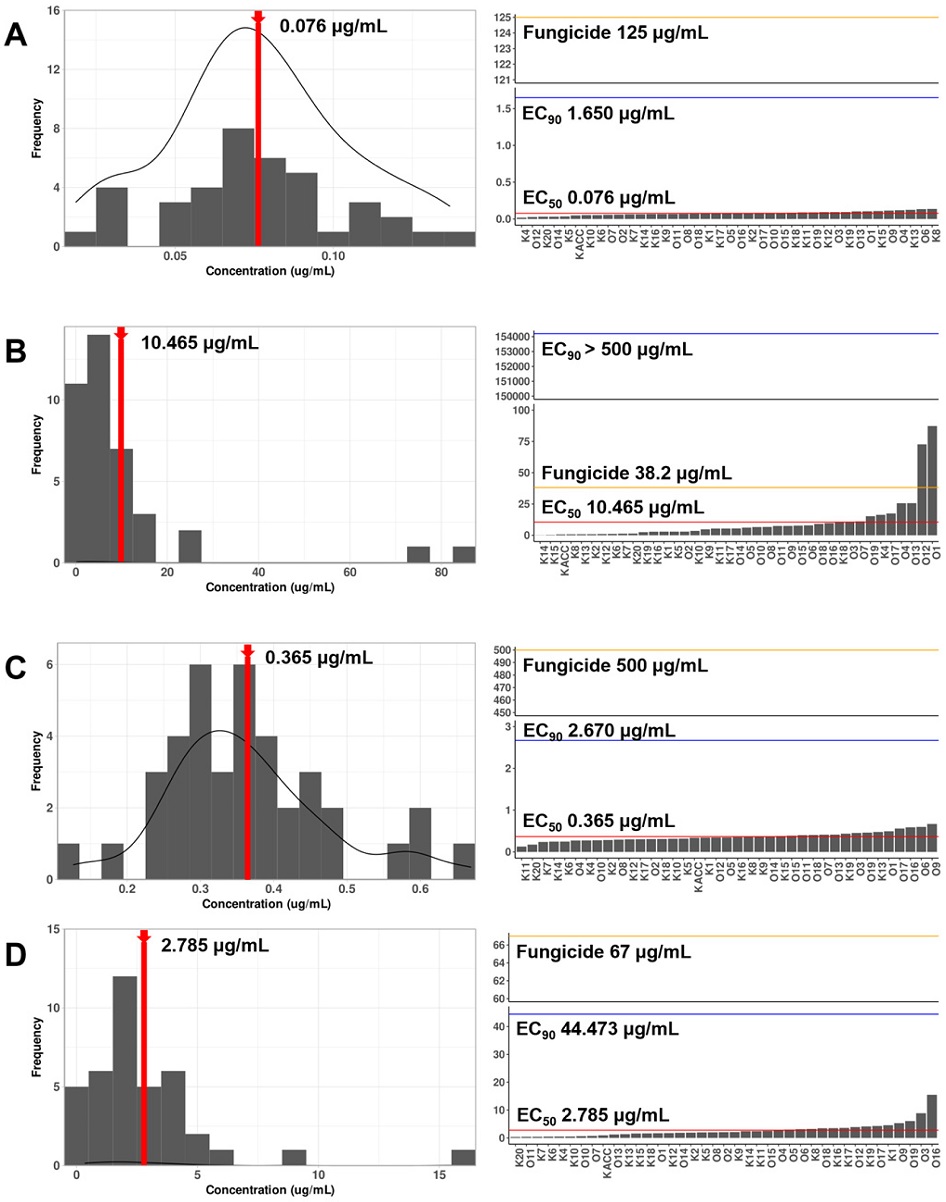
Histogram and bar graph of EC50 values for each fungicide. A: Bitertanol; B: Fluxapyroxad; C: Procymidone; D: Pyraclostrobin. The EC50 values were calculated from raw measurements using three or four parameters log-logistic model in the drc package (analysis if dose-response curve, 3.0-1) in R. On the left graph, the red dotted lines represent the median of the EC50 values, while on the right graph, the red and blue lines indicate the median of the EC50 and EC90 values. The recommended values for each fungicide are shown as yellow lines.
SDHI계열 불감성(Insenstive)균주의 SdhA-D 유전자 점돌연변이 확인
EC50값을 기준으로 분류하였을 때, 사용한 4가지 약제 중 SDHI계열의 fluxapyroxad (a.i. 15.3%. SC)에 대해 임실군과 영천시에서 분리된 균주들(O1, O12)이 약제의 권장 사용량보다 높게 측정이 되어 불감성(Insensitive)균주로 분류되었다. 불감성으로 분류된 균주들의 gDNA로부터 SDHI 살균제의 작용점인 숙신산탈수소효소의 SdhA, SdhB, SdhC, SdhD 유전자를 증폭하였다. 불감성 균주인 O1, O12의 SdhA, SdhB와 SdhD 유전자의 염기서열은 민감성 균주인 O4, O13, O19와 100% 동일한 염기서열이 확인되었다(Data not shown). SdhC 유전자 염기서열은 민감성(Sensitive)으로 분류된 M. fructicola O4, O13, O19균주의 73번째 코돈은 모두 L(Leucine)로 분석되었다. 하지만 불감성(Insensitive)으로 분류된 M. fructicola O1, O12 균주는 SdhC 유전자 73번째 코돈이 S (Serin e)로 치환된 것이 확인되었다(Fig. 4). 선행 연구에서, SDHI 약제 저항성 균주에서 SdhC 유전자 염기서열중 73번째 코돈과 134번째 코돈에서 치환이 이루어진다고 알려져 있다(Chen et al., 2013, Testempasis et al., 2021). 임실군과 영천시에서 분리된 균주(O1, O12)의 경우 모두 73번째 코돈에서만 치환이 발생한 것이 확인되었으며, 이는 SdhC 유전자의 한 부분이라도 변이가 일어나면 SDHI 계열 약제에 저항을 획득할 수 있음을 시사한다(Chen et al., 2013). 본 연구 결과를 바탕으로 국내 핵과류 잿빛무늬병균이 다양한 약제에 감수성이 감소 또는 감소하지 않았다고 결론을 짓기에는 본 연구에서 사용한 병원균주 집단의 크기가 다소 부족한 실정이다. 따라서 향후 더욱 광범위한 잿빛무늬병원균의 채집과 확보를 통해서 국내에서 상용되고 있는 살균제에 대한 감수성 평가를 진행하는 연구가 수행되어야 할 것으로 사료된다.

Alignment of deduced amino acid sequences of SdhC gene subunits of sensitive and SDHI-insensitive strains of M. fructicola. Residues involved in sensitivity to SDHI’s in both subunits are circulated with a black box. The sequences of the reference strains (B12 and B17) were reported by Testempasis et al. (2021). The amino acids of the analyzed gene were to multiple alignments using Clustal X in BioEdit ver 7.2 and then aligned using MEGA X ver 10.2.6.
Acknowledgments
본 연구는 농촌진흥청의 연구과제(PJ016906)의 지원으로 수행되었습니다.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Amiri A, Brannen PM, Schnabel G, 2010. Reduced sensitivity in Monilinia fructicola field isolates from South Carolina and Georgia to respiration inhibitor fungicides. Plant Dis. 94(6):737-743.
[https://doi.org/10.1094/PDIS-94-6-0737]

-
Carmona-Hernandez S, Reyes-Pérez JJ, Chiquito-Contreras RG, Rincon-Enriquez G, Cerdan-Cabrera CR, et al., 2019. Biocontrol of postharvest fruit fungal diseases by bacterial antagonists: a review. Agronomy, 9(3):121.
[https://doi.org/10.3390/agronomy9030121]

-
Chen F, Liu x, Chen S, Schnabel E, Schnabel G, 2013. Characterization of Monilinia fructicola strains resistant to both propiconazole and boscalid. Plant Dis. 97(5):645-651.
[https://doi.org/10.1094/PDIS-10-12-0924-RE]

-
Chen F, Everhart SE, Bryson PK, Luo C, Song X, et al., 2015. Fungicide-induced transposon movement in Monilinia fructicola. Fungal Genet. Biol. 85:38-44.
[https://doi.org/10.1016/j.fgb.2015.10.006]

-
Choi IY, Kim J, Seo KW, Oh HT, Cho JH, et al., 2016. Occurrence of brown rot on apricot caused by Monilinia fructicola in Korea. Res. Plant Dis. 22(2):122-126.
[https://doi.org/10.5423/RPD.2016.22.2.122]

-
Delp CJ, Dekker J. 1985. Fungicide resistance: definitions and use of terms. EPPO Bull. 15(3):333-335.
[https://doi.org/10.1111/j.1365-2338.1985.tb00237.x]

-
Fischer JMM, Savi DC, Aluizio R, May De Mio LL, Glienke C, 2017. Characterization of Monilinia species associated with brown rot in stone fruit in Brazil. Plant Pathol. 66(3):423-436.
[https://doi.org/10.1111/ppa.12578]

-
Fulton CE, Brown AE, 1997. Use of SSU rDNA group-l intron to distinguish Monilinia fructicola from M. laxa and M. fructigena. FEMS Microbiol. Lett. 157(2):307-312.
[https://doi.org/10.1111/j.1574-6968.1997.tb12790.x]

-
Hily JM, Singer SD, Vilani SM, Cox KD, 2011. Characterization of the cytochrome b (cyt b) gene from Monilinia species causing brown rot of stone and pome fruit and its significance in the development of QoI resistance. Pest Manag. Sci. 67(4):385-396.
[https://doi.org/10.1002/ps.2074]

-
Hrustić J, Mihajlović M, Grahovac M, Delibašić G, Tanović B, 2018. Fungicide sensitivity, growth rate, aggressiveness and frost hardiness of Monilinia fructicola and Monilinia laxa isolates. Eur. J. Plant Pathol. 151(2):389-400.
[https://doi.org/10.1007/s10658-017-1380-9]

-
Hu MJ, Cox KD, Schnabel G, Luo CX, 2011. Monilinia species causing brown rot of peach in China. PLoS One. 6(9):e24990.
[https://doi.org/10.1371/journal.pone.0024990]

- Jones AL, Ehret GR, 1976. Isolation and characterization of benomyl-tolerant strains of Monilinia fructicola [on stone fruit crops produced in Michigan, fungal diseases]. Plant dis. rep. 60(9):765-769.
- Kim CH, 2000. Review of fungicide resistance problems in Korea. Korean J. Pestic. Sci. 4(2):1-10.
-
Kim JY, Kwon SH, Jang M, Lee JY, Kim GC, et al., 2021. Analysis of Ascorbic acid, anthocyanin and carotenoid contents of parts from selected peach cultivars. J. Korean. Soc. Food. Sci. 50(9):962-970.
[https://doi.org/10.3746/jkfn.2021.50.9.962]

- Korea Crop Protection Association (KCPA). 2017. http://www.koreacpa.org, .
-
Lesniak KE, Peng J, Proffer TJ, Outwater CA, Eldred LI, et al., 2021. Survey and genetic analysis of demethylation inhibitor fungicide resistance in Monilinia fructicola from Michigan orchards. Plant Dis. 105(4):958-964.
[https://doi.org/10.1094/PDIS-07-20-1561-RE]

-
Lichtemberg PS, Luo Y, Morales RG, Muehlmann-Fischer JM, Michailides TJ, et al., 2017. The point mutation G461S in the MfCYP51 gene is associated with tebuconazole resistance in Monilinia fructicola populations in Brazil. Phytopathology. 107(12):1507-1514.
[https://doi.org/10.1094/PHYTO-02-17-0050-R]

- Lim TH, Chang TH, Cha B, 1998. Incidence of benzimidazole- and dicarboximide resistant isolates of Monilinia fructicola from overwintering mummies and peduncles on peach tree. Korean J. Plant Pathol. 14(4):367-370.
-
Luo CX, Schnabel G, 2008. The Cytochrome P450 lanosterol 14α-demethylase gene is a demethylation inhibitor fungicide resistance determinant in Monilinia fructicola field isolates from Georgi. Appl. Environ. Microbiol. 74(2):359-366.
[https://doi.org/10.1128/AEM.02159-07]

-
Martini C, Mari M, 2014. Monilinia fructicola, Monilinia laxa (Monilinia rot, brown rot). pp. 233-265. In: Postharvest decay, Academic Press.
[https://doi.org/10.1016/B978-0-12-411552-1.00007-7]

-
Oh HT, Choi IY, Kim J, Na YE, Lee WH, et al., 2017. Characteristics of brown rot caused by Monilinia fructicola on stone fruit in Korea. Res. Plant Dis. 23(4):322-333.
[https://doi.org/10.5423/RPD.2017.23.4.322]

-
Poniatowska A, Michalecka M, Pulawska J, 2021. Phylogenetic relationships and genetic diversity of Monilinia spp. isolated in Poland based on housekeeping‐and pathogenicity‐related gene sequence analysis. Plant Pathol. 70(7):1640-1650.
[https://doi.org/10.1111/ppa.13401]

-
Rungjindamai N, Jeffries P, Xu XM, 2014. Epidemiology and management of brown rot on stone fruit caused by Monilinia laxa. Eur. J. Plant Pathol. 140(1):1-17.
[https://doi.org/10.1007/s10658-014-0452-3]

-
Schnabel G, Bryson PK, Bridges WC, Brannen PM, 2004. Reduced sensitivity in Monilinia fructicola to propiconazole in Georgia and implications for disease management. Plant Dis. 88(9):1000-1004.
[https://doi.org/10.1094/PDIS.2004.88.9.1000]

- Shim MY, Jeon YJ, Kim SH, 2007. Characterization of a brown rot fungus isolated dwarf flowering almond in Korea. Mycobiology. 35(1):30-35.
- Sztejnberg A, Jones AL. 1978. Tolerance of the brown rot fungus Monilinia fructiocola to iprodione, vinclozolin and procymidone fungicides. Phytopathology News. 12:187-188.
- Testempasis S, Tsintila V, Karaoglanidis G, 2021. Assessment of sensitivity to boscalid, fluopyram and tebuconazole in Monilinia fructicola isolates obtained from peach orchards in Greece. IECPS.
-
Usman HM, Tan Q, Karim MM, Adnan M, Yin WX, et al., 2021. Sensitivity of Colletotrichum fructicola and Colletotrichum siamense of peach in China to multiple classes of fungicides and characterization of pyraclostrobin-resistant isolates. Plant Dis. 105(11):3459-3465.
[https://doi.org/10.1094/PDIS-04-21-0693-RE]

-
White TJ, Bruns T, Lee S, Taylor J, 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. pp. 315-322. In: Innis et al. (Eds.) PCR Protocols: A guide to methods and applications, Academic Press, San Diego, USA.
[https://doi.org/10.1016/B978-0-12-372180-8.50042-1]

Su In Lee, Division of Applied Life Science (BK21Plus), Gyeongsang National University, Graduate student, http://orcid.org/0000-0001-5149-7385
Youn-Sig Kwak, Research Institute of Life Science, Gyeongsang National University, Professor, http://orcid.org/0000-0003-2139-1808