
2019-2022년 국내에서 분리한 Erwinia amylovora균의 옥시테트라사이클린과 옥솔린산 항생제에 대한 저항성 평가
초록
과수 화상병은 전세계적으로 사과, 배 산업에 큰 영향을 미치는 병으로 국내에서는 2015년에 처음 발생하였다. 화상병의 방제를 위해 다양한 약제가 등록되어 사용되고 있는데, 그 중 항생제는 방제 효과가 매우 우수하나 저항성균의 출현이나 생태계 교란에 대한 우려로 유럽 등 선진국에서는 사용을 지양하고 있다. 국내에서는 2015년 화상병의 발생이래로 화상병 예방을 위해 항생제를 꾸준히 사용해왔으나 원인 병원균인 Erwinia amylovora의 항생제에 대한 저항성 수준은 아직 체계적으로 조사된 바 없다. 이에 따라 2019~2022년도에 국내에서 분리한 E. amylovora 258균주를 대상으로 화상병 방제용 약제로 등록된 옥시테트라사이클린과 옥솔린산에 대한 최소억제농도를 조사하고 저항성 발생 여부를 평가하였다. 국내에서 분리한 균주에 대한 최소억제농도는 옥시테트라사이클린 0.25~2 μg/ml, 옥솔린산 0.25 μg/ml 이하였으며, 옥시테트라사이클린의 경우 최소억제농도가 2019년에 비해 2022년도에 증가하는 양상을 나타냈다. 반면 E. amylovora를 분리한 지역이나 기주별로 항생제의 최소억제농도는 유의미한 차이를 나타내지 않았다. 본 연구의 결과에 따르면, 국내에서는 E. amylovora에서 아직까지 옥시테트라사이클린과 옥솔린산 항생제에 대한 저항성이 발생하지 않은 것으로 사료되며, 본 연구의 결과는 E. amylovora의 국내에 등록된 두 항생제에 대한 저항성 발생 여부를 평가하는 기초자료로 활용될 수 있을 것이다.
Abstract
Fire blight, a destructive plant disease causing great threats to the apple and pear industries, was first occurred in South Korea in 2015. Various pesticides have been registered and used for the control of fire blight. Among them, antibiotics are known as very effective agents, but developed countries including Europe have been avoiding their use due to concerns about the emergence of antibiotic resistance and ecosystem disturbance. Antibiotics have been used for fire blight control since 2015 in Korea, however, antibiotic resistance of the pathogen has not been systematically investigated yet. Therefore, in this study, we surveyed the minimal inhibition concentration (MIC) of Erwinia amylovora, a causal agent of fire blight, against the oxytetracycline and oxolinic acid using a total of 258 isolates that are collected from overall areas of South Korea from 2019 to 2022 to assess the presence of antibiotic resistance. The MIC of oxytetracycline was in a range of 0.25-2 µg/ml, and that of oxolinic acid was less than 0.25 µg/ml. In addition, the MIC of oxytetracycline was increased in 2022 compared to 2019. However, no significant differences in MIC existed between isolated regions or hosts. Taken together, the results indicate that oxytetracycline and oxolinic acid resistance may not occur in E. amylovora of Korea. This study also provides fundamental information to the assessment of resistance against antibiotics registered for the control of fire blight in Korea.
Keywords:
Oxytetracycline, Oxolinic acid, Minimal inhibition concentration키워드:
옥솔린산, 옥시테트라사이클린, 최소억제농도서 론
과수 화상병은 그람음성의 식물병원세균인 Erwinia amylovora에 의해 장미과 기주에 발생하는 병으로 국내에서는 주로 사과와 배에서 발생하고 있다(Van der Zwet et al., 2012; Ham et al., 2020). 발병 초기에는 꽃 마름 또는 신초, 잎, 줄기와 과실에 수침 증상이 나타나며, 병이 진행되면 갈색 또는 검은색으로 괴사 된다. 또한 과실의 표면에는 세균액이 맺히는데 흰색, 노란색, 주황색, 갈색 등 다양한 색깔로 나타나며 병원균이 분비하는 다당류 등에 의해 끈적거리게 된다(Khan et al., 2012; Slack et al., 2017). E. amylovora 는 궤양 조직이나 식물의 잔재물 등에서 월동하며 봄철에 온도가 상승하면 꽃이나 상처, 자연 개구를 통해 기주 식물에 침입하고 비, 바람, 곤충, 사람에 의해 주변으로 전파된다(Van der Zwet et al., 2012).
국내에서는 화상병이 2015년도에 배와 사과나무에서 처음으로 발견되었으며(Myung et al., 2016a; Park et al., 2016), 모과(Myung et al., 2016b), 팥배(Lim et al., 2023) 등에도 발생하여 농가에 큰 피해를 주고 있다. 화상병은 식물방역법상 금지병으로 지정되어있으며, 과원에 발병하게 되면 발병주를 제거하거나 정부의 지원을 받아 발병과원을 폐원하는 공적방제를 실시하고 있다(Park et al., 2017; Park et al., 2022). 또한 화상병 예방을 위해 동계기와 개화기에 등록된 약제로 방제를 실시하는데, 동계기에는 구리 성분이 포함된 동제를 처리하고, 개화기에는 주로 항생제나 생물방제제를 처리하고 있다(Ham et al., 2020). 이 중 항생제는 미생물이 생산하여 다른 미생물의 생장 또는 증식을 저해하는 물질로 미생물의 생육을 억제하는데 매우 효과적인 것으로 알려져 있다. 그러나 특정 항생제의 지속적인 사용은 항생제가 작용하지 않는 저항성 세균의 발생을 촉진시킬 수 있다. 전세계적으로 스트렙토마이신에 대한 저항성 세균의 발생이 많이 보고되어 있으며(Stockwell and Duffy, 2012), 유럽 등 선진국에서는 생태계 교란, 다재내성균 발생 등의 문제로 농업 생태계내에서 항생제의 사용을 지양하고 있는 추세이다(Chang et al., 2015).
국내에서 개화기에 사용하는 사과와 배 화상병에 등록된 항생제는 스트렙토마이신(streptomycin), 옥시테트라사이클린(oxytetracycline), 옥솔린산(oxolinic acid), 발리다마이신 에이(validamycin A)가 있으며 주로 사용하고 있는 것은 스트렙토마이신, 옥시테트라사이클린 및 옥솔린산이다(Ham et al., 2022b). 국내에서는 화상병 공적방제의 일환으로 사과, 배를 재배하는 지역에서 개화기에 항생제 등 등록된 약제를 2회 이상 살포하도록 하고 있으며 화상병이 처음 발생한 2015년 이래로 항생제를 꾸준히 살포하고 있다(Ham et al., 2020). 다행히도 2018년 이전에 분리된 8개 E. amylovora 균주에서 항생제에 대한 저항성이 발견되지 않았고(Lee et al., 2018), 2020-2021년도에 분리한 E. amylovora 균주에서 5 μg/ml 옥솔린산에 저항성인 균이 확인되지 않았으나(Ham et al., 2022b), 사과 및 배나무에 항생제를 살포해온 기간이나 횟수가 증가함에 따라 항생제 저항성을 획득하는 E. amylovora가 발생할 확률이 증가하고 있는 실정이다.
본 연구에서는 2019년부터 2022년까지 국내 사과 및 배나무에서 분리한 E. amylovora 균주들의 옥시테트라사이클린 및 옥솔린산에 의한 최소억제농도(MIC)를 조사하여 연도, 기주 및 지역별 MIC의 수준 및 변화 양상을 분석하였다. 본 연구의 결과는 국내에서 주로 사용하는 농용항생제에 대한 E. amylovora의 감수성 정도 및 항생제 저항성균의 발생 위험도를 파악하고, 저항성균 발생을 최소화하기 위한 방제대책을 수립하는데 기초 자료로 활용될 수 있을 것이다.
재료 및 방법
Erwinia amylovora의 분리 및 동정
화상병이 발생된 것으로 진단된 잎 또는 줄기를 70% 에탄올로 표면 소독 한 후 병반의 경계부위를 5 × 5mm 크기로 5~10조각 잘랐다. 자른 조각을 멸균 증류수 500 μl에 넣고 잘게 마쇄한 후 실온에서 30분간 정치하여 세균이 누출되도록 하였다. 세균추출액 10 μl를 취하여 tryptic soy agar(TSA, Difco) 배지에 획선도말 하여 27oC에서 48시간 동안 배양하였다. 이 때 국내 표준균주인 E. amylovora TS3128(Kang et al., 2021)을 함께 배양하여 균총 비교를 위한 양성대조구로 사용하였다. TSA 배지에서 배양한 균총은 E. amylovora TS3128의 균총과 유사한 것을 취하고 TSA 배지에 3회 계대배양하여 순수분리 하였다. 분리한 세균은 E. amylovora 특이 프라이머인 A/B (Bereswill et al., 1992) 또는 RS24580-205 (Ham et al., 2022a)를 이용하여 각 논문에 기술된 조건에 따라 colony-PCR을 실시하고, 900-1100 bp 또는 205 bp의 PCR 산물이 확인되면 E. amylovora로 동정하였다. 2020년도와 2021년도에 분리된 137균주는 Ham et al., 2022b에서 사용한 것과 동일한 균주를 사용하였다. 한편 새로운 지역에서 분리한 E. amylovora 균주는 사과 미숙과(홍로, 지름 3 cm)에 접종하여 병원성을 나타내는지 확인하였다.
최소억제농도(MIC) 조사
E. amylovora 세균에 대한 MIC는 주문 제작한 Sensititre MIC plate KRNASF (Thermo Scientific, UK)를 사용하여 액상 희석법(broth dilution) 방식으로 분석하였다 (Wiegand et al., 2008). MIC plate의 항생제별 농도는 옥시테트라사이클린 0.12, 0.25, 0.5, 1, 2, 4, 8, 16, 32, 64, 128 및 256 μg/ml, 옥솔린산 0.12, 0.25, 0.5, 1, 2 및 4 μg/ml 로 하였다.
E. amylovora는 TSA 배지에 획선도말하여 27oC에서 48시간 동안 배양하였다. 배양한 균총 약 5개를 멸균한 loop로 취하여 멸균증류수 5ml에 풀어 vortexing 하였다. E. amylovora 현탁액은 탁도계(Sensititre Nephelometer)를 이용하여 McFarland turbidity를 0.5로 맞추고, 100 μl를 Mueller Hinton Broth (Sensititre, UK) 11 ml에 넣고 vortexing 하여 세균 농도가 약 105 cfu/ml 이 되도록 하였다. 현탁액은 50 μl를 96well MIC plate에 각각 분주하여 27oC에서 24시간 동안 배양하였고, 배양이 끝난 MIC plate는 판독기(Sensititre ViZion)를 이용하여 어느 농도까지 E. amylovora가 자랐는지 확인하고, MIC를 판정하였다.
통계분석
E. amylovora의 MIC가 연도와 지역별로 유의미한 차이가 있는지 확인하기위해 일원분산분석과 Duncan’s multiple range test을 수행하였다. 또한 MIC가 기주(사과, 배)에 따라 차이가 있는지 확인하기 위해 t-검정을 수행하였다. 분석 프로그램은 SAS 9.4 (SAS Institute Inc., USA)를 사용하였다.
결과 및 고찰
2019-2022년도에 분리한 화상병균의 특성
E. amylovora는 공적 방제를 위한 병 진단을 위해서 수집된 이병 잎 또는 줄기에서 총 258균주를 분리하였고, 발생연도, 빈도, 기주 및 지역별로 목록화 하였다(Table 1). 균주의 구성은, 연도별로는 2019년 32균주, 2020년 50균주, 2021년 87균주 및 2022년 89균주였으며, 지역별로 충북 104균주, 경기 91균주, 충남 48균주, 강원 9균주, 경북 5균주 및 전북 1균주였다. 기주별로는 사과 171균주, 배 81균주, 산사 3균주, 모과 2균주 및 팥배 1균주로 구성되었다. 또한 2021년도 신규 발생지인 괴산, 남양주, 여주, 안동, 예산 영주에서 분리한 균주들을 사과 미숙과에 접종한 결과 수침과 괴사 증상을 나타냈다(Fig. 1).
옥시테트라사이클린에 대한 MIC 변화
분리한 E. amylovora 균주를 MIC plate에 배양하여 옥시테트라사이클린의 MIC를 조사하였다(Fig. 2). 옥시테트라사이클린에 대한 E. amylovora 258균주의 MIC는 0.25~2 μg/ml로 나타났으며 그 중 0.5~1 μg/ml인 것의 빈도가 높았다(Table 2). 연도별 화상병균의 옥시테트라사이클린에 대한 MIC 평균은 2019년도에서 2022년도까지 각각 0.492, 0.890, 0.624 및 0.919 μg/ml로 나타났으며, 유의수준 0.05에서 분산분석과 던컨다중분석을 수행한 결과 2019년, 2021년, 2020년 및 2022년의 세 그룹으로 구분되어 옥시테트라사이클린 MIC에 유의미한 차이가 있는 것으로 나타났다(Table 3). 특히 2019년 분리 균주들의 MIC가 대부분 0.25와 0.5 μg/ml 이었던 반면 연도가 경과할수록 MIC가 0.5와 1 μg/ml인 균주들이 많아지는 추세를 나타냈다(Fig. 3). 이는 기존에 사과 또는 배나무의 약해에 대한 우려로 항생제 사용을 꺼려하던 분위기에서 2019년을 기점으로 국내에 화상병이 대발생하면서 보다 적극적인 항생제 살포가 이루어졌기 때문으로 생각된다(Ham et al., 2020).

Determination of oxytetracycline minimal inhibition concentration (MIC) of Erwinia amylovora isolates by broth dilution method on the MIC plate. Numbers on the top refer to the concentration of oxytetracycline (μg/ml). Numbers on the left refer to MIC level of the isolates. Numbers in parentheses refer to the isolate names. Positive control, oxytetracycline resistant E. amylovora which is artificially constructed. SC, sterile control with only broth. GC, bacterial growth control with no antibiotic.

Frequency of minimal inhibition concentration (MIC) level of antibiotics in Erwinia amylovora collected from 2019 to 2022

ANOVA analysis data of minimal inhibition concentration level of oxytetracycline over year (α = 0.05)
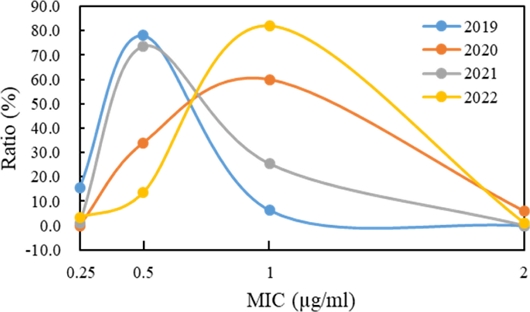
Oxytetracycline minimal inhibition concentration level and ratio of Erwinia amylovora isolates over the years.
옥시테트라사이클린이 함유된 국내 등록 약제의 살포 농도는 유효성분의 권장사용량기준에 따르면 단제는 85~170 μg/ml, 합제는 7.5~15 μg/ml 수준이다(Lee et al., 2018). 따라서 국내에서 옥시테트라사이클린 약제 살포에 따른 화상병 방제 효과는 우려하지 않아도 될 수준으로 보인다.
옥시테트라사이클린은 스트렙토마이신 보다는 방제 효과가 낮지만 스트렙토마이신의 대체제로 미국에서 사용되어왔다(Schnabel and Jones, 1999). 옥시테트라사이클린에 대한 저항성 기작은 크게 두가지로 나뉘는데, 세포막 분비 단백질(efflux protein)을 통해 에너지를 소모하여 항생제를 세포 밖으로 내보내거나, 리보솜 보호 단백질을 통하여 ribosome을 항생제의 작용으로부터 보호하는 것이다. 또한 OmpF porin protein의 변이 등을 통해 세균 외막이나 lipopolysaccharides를 이용하여 항생제의 침투를 감소시키는 기작도 알려져있다. 특히 외부 배출(efflux) 메커니즘은 그람음성세균에서 주로 외부배출 유전자(tetA, tetC, tetD, tetE, tetG, tetH, tetI)의 획득을 통해 얻어지는데, 이들 유전자는 Tn1721, Tn10, Tn5706, Tn1404 등의 transposon을 통해 이동한다고 알려져 있다(Thanassi et al., 1995; Schnabel and Jones, 1999; Guillaume et al., 2004; Sundin and Wang, 2018; Herbert et al., 2022). 아직까지 E. amylovora의 옥시테트라사이클린 저항성 발생 보고는 거의 없으나 최근에 tetB와 strA-strB를 동시에 보유한 E. amylovora에서 옥시테트라사이클린에 대한 MIC가 100 μg/ml 이상인 것으로 보고되었다(Sundin et al., in press). 이외에도 옥시테트라사이클린 저항성으로 알려진 식물병원세균의 경우 점무늬병 등을 유발하는 Pseudomonas syringae pv. syringae 균주는 옥시테트라사이클린 농도 50 또는 500 μg/ml의 농도, 핵과류에서 세균구멍병을 일으키는 Xanthomonas arboricola pv. pruni 균주는 100 또는 250 μg/ml에서 생장이 가능한 것으로 보고 되었다(Spotts and Cervantes, 1995; Herbert et al., 2022). 이상의 결과들을 종합적으로 판단하면, 옥시테트라사이클린 MIC가 2 μg/ml 인 국내의 화상병 균주에서는 아직까지 저항성이 발생되지 않은 것으로 사료된다.
옥솔린산에 대한 MIC 변화
분리한 E. amylovora 균주를 MIC plate에 배양하여 옥솔린산의 MIC를 조사하였다(Fig. 4). E. amylovora 258 균주의 옥솔린산에 대한 MIC 수준은 0.25 μg/ml 이하로 나타났으며, 2022년도에 분리된 1균주(MIC 0.25 μg/ml)를 제외한 모든 균주가 0.12 μg/ml 이하의 MIC를 나타냈다(Table 2). 국내에 등록된 옥솔린산 약제의 권장사용량에 따른 유효성분 농도는 단제 200 μg/ml (Lee et al., 2018), 합제 50~85 μg/ml 수준으로 E. amylovora에 대한 방제 효율에는 영향을 미치지 않는 수준이다.

Determination of oxolinic acid minimal inhibition concentration (MIC) of Erwinia amylovora isolates by broth dilution method on the MIC plate. Numbers on the top refer to the concentration of oxolinic acid (μg/ml). Numbers on the left refer to MIC level of the isolates. Numbers in parentheses refer to the isolate names. Positive control, oxolinic acid resistant E. amylovora which is artificially constructed. SC, sterility control with only broth. GC, bacterial growth control with no antibiotic.
옥솔린산은 quinolone계 항생제로 배추, 복숭아 등 다양한 농작물의 세균병 방제에 사용된다(Chung et al., 2003; Ryu et al., 2023). 세균에 옥솔린산 저항성이 발생하는 이유는 주로 DNA의 supercoiling을 일으키는 DNA gyrase 효소를 암호화하는 gyrA 또는 gyrB 유전자에 돌연변이가 발생하여 항생제의 작용을 방해하기 때문으로 알려져 있으며, Escherichia coli, Burkholderia glumae 및 E. amylovora 등에서 관련 연구가 보고되었다(Ruiz, 2003; Maeda et al., 2007; Ham et al., 2022b). 야생형(wild-type) B. glumae는 옥솔린산에 대한 MIC가 0.5 μg/ml인 반면, gyrA에 변이가 발생한 B. glumae에서는 MIC가 5~300 μg/ml으로 증가하였다(Maeda et al., 2004; Maeda et al., 2007). E. amylovora에서는 야생형의 MIC가 1 μg/ml 이하인 반면, 저항성이 발생한 경우 5, 50, 및 300 μg/ml 농도로 옥솔린산을 처리한 배지 또는 미숙과에서 생존하거나 병을 일으키는 것이 확인되었다(Manulis et al., 2003). 또한 quinolone계 항생제는 plasmid에 의한 저항성 획득 기작으로 qnr 유전자 등이 알려져 있으나(Rodríguez-Martínez et al., 2016) E. amylovora에서는 아직까지 보고된 바가 없다. 국내에서 분리된 E. amylovora의 경우 MIC가 0.25μg/ml 이하로 매우 낮아 gyrA에 변이가 발생했을 가능성은 거의 없다고 볼 수 있다. 다만 옥솔린산의 경우 5 μg/ml의 비교적 낮은 농도에서도 저항성이 발생할 수 있으므로 저항성균이 발생하지 않도록 약제 사용에 특히 유의하여야 할 것으로 사료된다.
기주와 지역에 따른 항생제별 최소억제농도MIC
E. amylovora 258 균주에 대하여 분리한 기주와 지역별로 옥시테트라사이클린의 MIC에 차이가 있는지 분석하였다. 옥솔린산은 국내 균주 1개를 제외한 모든 균주의 MIC가 0.25 μg/ml 이하로 나타나 분석을 실시하지 않았다.
한편, 본 연구의 실험대상 E. amylovora는 사과, 배, 산사, 모과, 팥배 등으로부터 분리되었는데, 산사, 모과 및 팥배로부터 분리한 균주는 각각 3개, 1개 및 1개로 모집단의 수가 너무 적어 분석에서 제외하였다. 따라서 두개의 기주식물 즉 사과와 배에 대하여 MIC의 범위를 조사하고 값에 차이가 있는지 등분산분석과 t-검정(유의수준 0.05)을 통해 확인하였다. 그 결과 사과(171균주)와 배(81균주)에서 분리된 대부분의 E. amylovora 균주는 옥시테트라사이클린 0.5~1 μg/ml 범위에 속하였다. 또한 MIC 평균은 각각 사과 0.763 μg/ml, 배 0.756 μg/ml로 t-검정 결과 기주에 따른 MIC에 유의미한 차이가 나타나지 않았다(Table 4).

Frequency of minimal inhibition concentration (MIC) level of oxytetracycline in Erwinia amylovora classified by isolated host (α = 0.05)
화상병이 발생한 지역별로는 1개 균주만 수집된 전북 익산을 제외하고 경기, 강원, 충북, 충남, 경북으로 구분하여 분리된 균주의 MIC에 유의미한 차이가 있는지 통계분석을 실시한 결과, 옥시테트라사이클린의 경우 지역별로 MIC 평균이 경기 0.761 μg/ml, 강원 0.833 μg/ml, 충북 0.760 μg/ml, 충남 0.750 μg/ml 및 경북 0.500 μg/ml 이었으나 이것이 유의미한 차이는 아닌 것으로 나타났다 (Table 5).

Frequency of minimal inhibition concentration (MIC) level of oxytetracycline in Erwinia amylovora classified by isolated region
옥시테트라사이클린은 아직까지 저항성 E. amylovora 발생에 관련된 보고가 많지 않고, 약제의 효과가 스트렙토마이신에 비해 비교적 약하다고 알려져 사용 빈도가 스트렙토마이신만큼 높지는 않지만(Herbert et al., 2022; Sundin et al., in press), 본 연구에 의하면 국내 균주에서 연도가 경과할수록 MIC가 증가하는 추세에 있다. 옥솔린산의 경우 국내에서 아직까지 E. amylovora에 대한 MIC가 대부분 0.12 μg/ml 이하로 매우 낮지만 저항성이 다른 항생제에 비해 빨리 발생한다고 알려져 있다(Kleitman et al., 2005; Stockwell and Duffy, 2012). 실제로 이스라엘에서는 E. amylovora에서 스트렙토마이신에 저항성이 발생하여 항생제를 옥솔린산으로 대체한 지 2년만에 저항성균이 발생한 것으로 보고되었으며, 그 중에는 개화기에 옥솔린산을 7회 살포한 과원도 있었다(Manulis et al., 2003; Kleitman et al., 2005). 동일한 작용 기작을 가진 항생제를 연용할수록 저항성균의 출현이 용이해지며(Miller et al., 2022), 저항성균이 출현하면 해당 항생제에 대한 방제효과가 감소하기 때문에 사용할 수 있는 항생제의 종류가 적어지고 방제가 더욱 어렵게 된다. 2023년 화상병 예찰∙방제사업 지침에 따르면 국내에서는 개화기에 항생제를 화상병 예측정보에 따라 살포하되, 살포 횟수는 2회 내지 3회로 하고, 동일 성분의 약제를 2회 이상 살포하지 않도록 제시하고 있다.
본 연구의 분석결과를 종합하면, 아직까지 국내에서 분리된 화상병 균주에서 옥시테트라사이클린과 옥솔린산에 대한 저항성 발생을 확인할 수는 없었으나 저항성균의 출현을 예방함으로써 최적의 방제 효과를 기대하기 위해 계속 노력해야 할 것이다. 또한 이를 위하여 화상병 예찰∙방제 지침을 준수하고, 지역별로 화상병 방제에 사용한 약제를 조사하여 이를 기반으로 동일한 항생제를 반복하여 사용하는 것을 지양해야 할 것으로 사료된다.
Acknowledgments
본 연구는 농촌진흥청 연구사업(세부과제명: 과수 화상병 경종적 방제기술 개발 및 종합방제체계 연구, PJ01505901(RS-2020-RD009337))의 지원을 받아 수행되었음.
이해상충관계
저자는 이해상충관계가 없음을 선언합니다.
References
-
Bereswill S, Pahl A, Bellemann P, Zeller W, Geider K, 1992. Sensitive and species-specific detection of Erwinia amylovora by polymerase chain reaction analysis. Appl. Environ. Microbiol. 58(11):3522-3526.
[https://doi.org/10.1128/aem.58.11.3522-3526.1992]

-
Chang Q, Wang W, Regev-Yochay G, Lipsitch M, Hanage WP, 2015. Antibiotics in agriculture and the risk to human health: How worried should we be? Evol. Appl. 8(3):240-247.
[https://doi.org/10.1111/eva.12185]

- Chung E-K, Zhang X-Z, Yeoung Y-R, Kim B-S, 2003. Screening of effective control agents against bacterial soft rot on chinese cabbage in alpine area. Korean J. Pestic. Sci. 7(1):32-37. (In Korean)
-
Guillaume G, Ledent V, Moens W, Collard J-M, 2004. Phylogeny of efflux-mediated tetracycline resistance genes and related proteins revisited. Microb. Drug Resist. 10(1):11-26.
[https://doi.org/10.1089/107662904323047754]

-
Ham H, Lee KJ, Hong SJ, Kong HG, Lee M-H, et al., 2020. Outbreak of fire blight of apple and pear and its characteristics in Korea in 2019. Res. Plant Dis. 26(4):239-249. (In Korean)
[https://doi.org/10.5423/RPD.2020.26.4.239]

-
Ham H, Kim K, Yang S, Kong HG, Lee MH, et al., 2022a. Discrimination and detection of Erwinia amylovora and Erwinia pyrifoliae with a single primer set. Plant Pathol. J. 38(3):194-202.
[https://doi.org/10.5423/PPJ.OA.03.2022.0027]

-
Ham H, Oh GR, Park DS, Lee YH, 2022b. Survey of oxolinic acid-resistant Erwinia amylovora in Korean apple and pear orchards, and the fitness impact of constructed mutants. Plant Pathol. J. 38(5):482-489.
[https://doi.org/10.5423/PPJ.OA.04.2022.0059]

-
Herbert A, Hancock CN, Cox B, Schnabel G, Moreno D, et al., 2022. Oxytetracycline and streptomycin resistance genes in Xanthomonas arboricola pv. Pruni, the causal agent of bacterial spot in peach. Front. Microbiol. 13:1-13.
[https://doi.org/10.3389/fmicb.2022.821808]

-
Kang I-J, Park DH, Lee Y-K, Han S-W, Kwak Y-S, et al., 2021. Complete genome sequence of Erwinia amylovora strain TS3128, a Korean strain isolated in an Asian pear orchard in 2015. Microbiol. Resour. Ann. 10(37):e00694-21
[https://doi.org/10.1128/MRA.00694-21]

-
Khan MA, Zhao Y, Korban SS, 2012. Molecular mechanisms of pathogenesis and resistance to the bacterial pathogen Erwinia amylovora, causal agent of fire blight disease in rosaceae. Plant Mol. Biol. Rep. 30(2):247-260.
[https://doi.org/10.1007/s11105-011-0334-1]

-
Kleitman F, Shtienberg D, Blachinsky D, Oppenheim D, Zilberstaine M, et al., 2005. Erwinia amylovora populations resistant to oxolinic acid in Israel: Prevalence, persistence and fitness. Plant Pathol. 54(2):108-115.
[https://doi.org/10.1111/j.1365-3059.2005.01146.x]

-
Lee MS, Lee I, Kim SK, Oh C-S, Park DH, 2018. In vitro screening of antibacterial agents for suppression of fire blight disease in Korea. Res. Plant Dis. 24(1):41-51. (In Korean)
[https://doi.org/10.5423/RPD.2018.24.1.41]

-
Lim Y-J, Oh H, Lee M-H, Roh E, Ham H, et al., 2023. First report of fire blight caused by Erwinia amylovora on Korean mountain ash (Sorbus alnifolia) in Korea. Res. Plant Dis. 29(1):79-81. (In Korean)
[https://doi.org/10.5423/RPD.2022.28.4.79]

-
Maeda Y, Kiba A, Ohnishi K, Hikichi Y, 2004. Implications of amino acid substitutions in gyrA at position 83 in terms of oxolinic acid resistance in field isolates of Burkholderia glumae, a causal agent of bacterial seedling rot and grain rot of rice. Appl. Environ. Microbiol. 70(9):5613-5620.
[https://doi.org/10.1128/AEM.70.9.5613-5620.2004]

-
Maeda Y, Kiba A, Ohnishi K, Hikichi Y, 2007. Amino acid substitutions in gyrA of Burkholderia glumae are implicated in not only oxolinic acid resistance but also fitness on rice plants. Appl. Environ. Microbiol. 73(4):1114-1119.
[https://doi.org/10.1128/AEM.02400-06]

-
Manulis S, Kleitman F, Shtienberg D, Shwartz H, Oppenheim D, et al., 2003. Changes in the sensitivity of Erwinia amylovora populations to streptomycin and oxolinic acid in Israel. Plant Dis. 87(6):650-654.
[https://doi.org/10.1094/PDIS.2003.87.6.650]

-
Miller SA, Ferreira JP, LeJeune JT, 2022. Antimicrobial use and resistance in plant agriculture: A one health perspective. Agriculture 12(2):289.
[https://doi.org/10.3390/agriculture12020289]

-
Myung I-S, Lee J-Y, Yun M-J, Lee Y-H, Lee Y-K, et al., 2016a. Fire blight of apple, caused by Erwinia amylovora, a new disease in Korea. Plant Dis. 100(8):1774-1774.
[https://doi.org/10.1094/PDIS-01-16-0024-PDN]

-
Myung I-S, Yun M-J, Lee Y-H, Kim G-D, Lee Y-K, 2016b. First report of fire blight caused by Erwinia amylovora on Chinese quince in South Korea. Plant Dis. 100(12):2521-2521.
[https://doi.org/10.1094/PDIS-04-16-0562-PDN]

-
Park DH, Yu J-G, Oh E-J, Han K-S, Yea MC, et al., 2016. First report of fire blight disease on Asian pear caused by Erwinia amylovora in Korea. Plant Dis. 100(9):1946-1946.
[https://doi.org/10.1094/PDIS-11-15-1364-PDN]

- Park DH, Lee YG, Kim JS, Cha JS, Oh CS, 2017. Current status of fire blight caused by Erwinia amylovora and action for its management in Korea. J. Plant Pathol. 99:59-63.
-
Park IW, Song Y-R, Trung Vu N, Oh E-J, Hwang IS, et al., 2022. Monitoring the reoccurrence of fire blight and the eradication efficiency of Erwinia amylovora in burial sites of infected host plants using sentinel plants. Res. Plant Dis. 28(4):221-230. (In Korean)
[https://doi.org/10.5423/RPD.2022.28.4.221]

-
Rodríguez-Martínez JM, Machuca J, Cano ME, Calvo J, Martínez-Martínez L, et al., 2016. Plasmid-mediated quinolone resistance: Two decades on. Drug Resist. Update 29:13-29.
[https://doi.org/10.1016/j.drup.2016.09.001]

-
Ruiz J, 2003. Mechanisms of resistance to quinolones: Target alterations, decreased accumulation and DNA gyrase protection. J. Antimicrob. Chemother. 51(5):1109-1117.
[https://doi.org/10.1093/jac/dkg222]

-
Ryu S-H, Rhee J, Yoon H, Song A, Lee D-Y, et al., 2023. Analysis of antibiotics application in peach orchards. Korean J. Pestic. Sci. 27(1):10-15. (In Korean)
[https://doi.org/10.7585/kjps.2023.27.1.10]

-
Schnabel EL, Jones AL, 1999. Distribution of tetracycline resistance genes and transposons among phylloplane bacteria in Michigan apple orchards. Appl. Environ. Microbiol. 65(11):4898-4907.
[https://doi.org/10.1128/AEM.65.11.4898-4907.1999]

-
Slack SM, Zeng Q, Outwater CA, Sundin GW, 2017. Microbiological examination of Erwinia amylovora exopolysaccharide ooze. Phytopathology 107(4):403-411.
[https://doi.org/10.1094/PHYTO-09-16-0352-R]

-
Spotts R, Cervantes L, 1995. Copper, oxytetracycline, and streptomycin resistance of Pseudomonas syringae pv. syringae strains from pear orchards in Oregon and Washington. Plant Dis. 79(11):1132-1135.
[https://doi.org/10.1094/PD-79-1132]

-
Stockwell VO, Duffy B, 2012. Use of antibiotics in plant agriculture, Rev. Sci. Tech. 31(1):199-210.
[https://doi.org/10.20506/rst.31.1.2104]

- Sundin GW, Peng J, Brown L, Zeng Q, Forster H, et al., A novel incx plasmid mediates high-level oxytetracycline and streptomycin resistance in Erwinia amylovora from commercial pear orchards in California. Phytopathology
-
Sundin GW, Wang N, 2018. Antibiotic resistance in plant-pathogenic bacteria. Annu. Rev. Phytopathol. 56(1):161-180.
[https://doi.org/10.1146/annurev-phyto-080417-045946]

-
Thanassi DG, Suh GS, Nikaido H, 1995. Role of outer membrane barrier in efflux-mediated tetracycline resistance of Escherichia coli. J. Bacteriol. 177(4):998-1007.
[https://doi.org/10.1128/jb.177.4.998-1007.1995]

- Van der Zwet T, Orolaza-Halbrendt N, Zeller W, 2012. Fire blight: History, biology, and management, APS press, Minnesota, USA. Pp.460.
-
Wiegand I, Hilpert K, Hancock REW, 2008. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat. Protoc. 3(2):163-175.
[https://doi.org/10.1038/nprot.2007.521]

Hyeonheui Ham, Crop Protection Division, National Institute of Agricultural Sciences, Researcher, Experiment design, Writing, Draft editing, http://orcid.org/0000-0002-4795-1773
Ga-Ram Oh, Crop Protection Division, National Institute of Agricultural Sciences, Technician, Bacterial collection and MIC assay
Bang Wool Lee, Crop Protection Division, National Institute of Agricultural Sciences, Technician, MIC assay
Yong Hwan Lee, Crop Protection Division, National Institute of Agricultural Sciences, Senior Researcher, Draft review
Yong Hoon Lee: Division of Biotechnology, Jeonbuk National University, Professor, Draft review and editing, http://orcid.org/0000-0001-9921-3871

