
파밤나방과 배추좀나방에 대한 곤충병원성 곰팡이 Beauveria bassiana ANU1의 온도와 습도조건에 따른 살충효과
초록
해충방제에 있어서 곤충병원성 곰팡이는 화학농약을 대체할 수 있는 생물학적 방제인자로써 개발하기 위한 연구가 진행되고 있다. 나비목의 파밤나방과 배추좀나방 유충은 다양한 작물에 피해를 주는 주요 해충이지만 다양한 살충제에 대한 높은 저항성으로 인해 효과적인 방제가 이루어지지 않고 있다. 안동에 위치한 파재배지에서 채집한 파밤나방 유충에서 곰팡이 균주를 분리하였고, 이 균주의 형태적 특성과 분자생물학적 특성에 관하여 동정하였다. 그 결과, 기존의 Beauveria bassiana와 동일함을 확인하였고, B. bassiana ANU1으로 명명하였다. B. bassiana ANU1의 병원성 조사는 파밤나방과 배추좀나방 2령 유충을 대상으로 수행하였다. 파밤나방과 배추좀나방에 대한 반수치사농도는 각각 2.7 × 103과 0.9 × 103 conidia/ml이었으며, 반수치사시간은 각각 65.6과 60.8시간으로 조사되었다. 또한 B. bassiana ANU1는 상대습도 50% 조건에서 일정온도 (20°C-30°C)와 25°C의 온도에서 40%-70%의 습도조건에 노출되었을 때 107 conidia/ml의 농도에서 파밤나방과 배추좀나방 유충을 대상으로 높은 병원성을 나타내었다.
Abstract
Entomopathogenic fungi have been studied to develop for biological control agents as an alternative to chemical control agents in insect pest management. Two Lepidopteran insects, Spodoptera exigua and Plutella xylostella, are serious insect pests infested various crops, but not effectively controlled by commercial chemical pesticides due to its high insecticide resistance. A fungal isolate was isolated from S. exigua larvae collected from green onion field in Andong, Korea. To identify the fungal isolate, 18srRNA sequence for internal transcribed spacer (ITS) and β-tubulin regions were sequenced. The ITS and β-tubulin sequence were highly matched to Beauveria bassiana and morphological characteristics also was fit to known B. bassiana. Finally, isolated fungus has identified as B. bassiana and named B. bassiana ANU1. The result of bioassay, median lethal concentrations were 2.7 × 103 and 0.9 × 103 conidia/ml and medial lethal times were 65.6 and 60.8 h to S. exigua and P. xylostella, respectively. B. bassiana ANU1 showed high pathogenicity to two insect pests from 20°C to 30°C at 50% relative humidity (RH) and more than 40% RH at 25°C with 107 conidia/ml of concentration.
Keywords:
Biological control agent, Entomopathogenic fungi, Beauveria bassiana, Spodoptera exigua, Plutella xylostella키워드:
생물학적 방제인자, 곤충병원성 곰팡이, 보베리아 바시아나, 파밤나방, 배추좀나방서 론
파밤나방(Spodoptera exigua)과 배추좀나방(Plutella xylostella)은 국내를 포함해 전 세계적으로 발생하는 나비목의 주요 농업해충이다(Han et al., 2013; Furlong et al., 2013). 파밤나방은 광범위한 기주 범위를 가지고 있어 채소, 화훼, 과수 등을 포함한 40과의 200여종에 피해를 주며(Gho et al., 1990), 배추좀나방은 배추를 포함한 다양한 십자화과의 작물을 가해하며 점차 밀도가 증가하고 있다(Talekar and Shelton, 1993). 과거 나비목 해충의 방제를 위해서는 주로 유기인계, 카바메이트계, 피레스로이드계 등의 화학 살충제 등이 사용되었다(Moulton et al., 1999). 그러나 이러한 화학살충제는 환경오염의 유발과 살충제 저항성 개체의 출현을 가져와 이를 대체할 친환경적인 생물적 방제에 대한 관심이 높아지고 있다.
나비목 해충을 방제하기 위한 생물적 방제 방법으로 이들 해충에 특이성을 가지고 있는 세균과 바이러스를 이용한 생물농약이 개발되어 이용되고 있다. 곤충병원성 바이러스는 산업적으로 대량생산이 어려워 생물농약으로 이용하기에 제약이 있다. 이러한 가운데 상용화되어 가장 많이 이용되고 있는 것은 곤충병원성 세균인 Bacillus thuringiensis가 생성하는 내독소 단백질을 이용한 비티제이다(Han et al., 2013). 그러나 비티제의 과도한 사용은 1990년대 초반 처음으로 배추좀나방에서 저항성 개체의 출현(Tabashnik et al., 1994)이 보고된 이 후, 점차 다양한 해충에서 저항성 개체가 보고되고 있다. 이와 같은 생물농약의 한계로 인해 또 다른 생물적 방제 수단의 개발이 절실한 실정이다.
곤충병원성 곰팡이인 Beauveria bassiana는 불완전균류(Hyphomycetes)에 속하며 기주곤충만 치사시켜 자연계에서 곤충의 밀도를 조절하는 역할을 한다. 또한 사람과 동물, 식물에는 무해하지만 곤충에 대해 높은 병원성을 가진다(Lacey et al., 2001). 곤충병원성 곰팡이는 대상곤충에 대한 고도의 병원성으로 인해 살충범위가 제한되어 있지만, 기주의 저항성 기작이 잘 발현되지 않아 난방제 해충의 생물적 방제를 위한 생물인자로 적합한 것으로 보고되었다(Lacey et al., 2011). 곤충의 섭식에 의해서 병원성이 발현되는 곤충병원성 바이러스와 세균과 달리 곤충병원성 곰팡이류는 곤충과의 접촉을 통해 물리적으로 표피를 침투하며 기주의 면역작용 억제와 독성물질 분비를 통하여 곤충을 치사시킨다(Charnley, 1997). 또한 감염된 곤충병원성 곰팡이는 기주의 혈강 내에 존재하는 영양분을 이용하며 대량으로 증식함으로써 기주의 영양분을 고갈시켜 사망에 이르게 한다. 치사된 기주곤충에서 형성된 포자는 이 후 다른 건전한 개체를 추가로 감염시킬 수 있는 병원성의 전파력을 가지고 있다(Hajek and Leger, 1994). 해외에서는 이러한 곤충병원성 곰팡이의 높은 살충력을 이용해 온실가루이 방제를 위한 살충제 개발에 이용하고 있다(Shin et al., 2010). 또한 국내에서는 토착 미생물 자원을 이용한 친환경 방제의 일환으로 토양과 야외에서 수집된 다양한 해충에서 고병원성 곰팡이 균주의 수집이 이루어지고 있다. 이 가운데 Metarhizium anisopliae FT83은 야외포장에서 문제시 되는 파밤나방 유충에 대한 높은 병원성으로 효과적인 방제수단으로써의 가능성을 제시하였다(Han et al., 2013). 또한 Isaria fumosorosea SDTv는 시설재배지에서 문제가 되는 온실가루이에 대한 높은 살충력과 더불어 고온 및 UV에 대한 포자 안정성으로 효과적인 미생물 살충제로써의 활용 가능성을 나타내었다(Yoon et al., 2013). 이러한 연구들은 주로 곤충병원성 곰팡이를 이용한 미생물 살충제 개발을 위한 기초연구로써 균주의 병원성과 특성에 관한 연구에 초점이 맞추어져 있었다.
본 연구에서는 난방제 해충의 생물적 방제를 위한 일환으로 국내에서 수집된 B. bassiana 균주에 대한 파밤나방과 배추좀나방에 대한 살충력 검정과 다양한 야외 환경조건에 따른 B. bassiana 균주의 병원성 검정을 하였다. 이를 통해 새로이 수집된 B. bassiana 균주의 이들 두 해충에 대한 야외조건에서의 효과적인 방제여부와 생물적 방제 인자로써 그 가능성을 확인하기 위한 기초 연구를 진행하였다.
재료 및 방법
실험곤충의 사육
본 실험에서는 나비목의 파밤나방과 배추좀나방 유충을 대상으로 생물검정을 수행하였다. 파밤나방 유충은 인공사료(Goh et al., 1990)를 이용하여 누대 사육하였다. 배추좀나방 유충은 배추를 먹이로 하여 누대 사육하였다. 성충은 10% 설탕물을 먹이로 공급하였다. 사육배양기의 조건은 온도 25 ± 1°C, 광조건 16L:8D, 상대습도 50 ± 3%를 유지하며 유충과 성충을 사육하였다.
곤충병원성 곰팡이의 분리 및 형태학적 관찰
2014년 9월 안동시 남선면에 소재한 파 재배지에서 채집한 파밤나방 5령유충 가운데 곰팡이 감염 병징을 보이며 치사한 개체에서 포자를 수거하여 PDA 배지에 접종하여 단일 콜로니를 분리하였으며, 25°C에서 곰팡이를 배양한 후 20% 글리세롤 액침표본으로 제작하여 −80°C에 보관한 후 이용하였다. 분리균주의 형태학적 관찰을 위하여 Lacey(2012)의 slide glass culture 방법을 따랐다. PDA 배지에서 3일간 배양된 균체를 2% water agar 위에 놓인 두 장의 멸균 커버슬라이드(지름 22 × 30 mm) 사이에 놓고 25°C에서 7일간 배양 후 위상차 광학현미경(BX-PHD, Olympus, Tokyo, Japan)과 주사전자현미경(S2500, Hitachi, Tokyo, Japan)을 이용하여 균사 및 포자의 형태를 관찰하였다.
곤충병원성 곰팡이의 염기서열 분석
분리된 곰팡이 균주의 genomic DNA는 2주간 PDA(Potato Dextrose Agar)배지에서 배양된 곰팡이 균체를 이용하여 DNeasy Blood and Tissue Kit (Qiagen, Seoul, Korea)로 분리하였다. 분리된 균주의 분자생물학적 동정을 위한 PCR primer는 White et al. (1990)에 따른 ITS1 (5'-TCCGTAGGTGAACCTGCGG-3')과 ITS2 (5'-TCCTCCGCTTATTGATATGC-3') 프라이머와 Tartar et al. (2002)에 따른 tubFP(5'-TGGGCYAARGGYCACTACACYGA-3')와 tubRP (5'-TCAGTGAACTCCATCTCRTCCAT-3')를 이용하여 internal transcribed spacer (ITS1-5.8S-ITS2) 부분과 β-tubulin gene을 PCR로 증폭하였다. PCR은 AmpONETM taq DNA polymerase(GeneAll, Seoul, Korea)를 이용하여 95°C에서 30초, 55°C에서 30초, 72°C에서 45초의 조건으로 35 cycle을 진행하여 1% agarose gel에서 증폭된 밴드를 확인한 후 Gel SVKit (GeneAll, Seoul, Korea)를 이용하여 순수정제 하여 마크로젠(주)에서 염기서열을 분석하였다. 분석된 염기서열은 GenBank (NCBI, http://www.ncbi.nlm.nih.gov)의 BlastN 검색 프로그램을 이용하여 유사성이 있는 염기서열과 비교분석 하였으며, ClustalW 프로그램(www.clustalw.genome.ad.jp)을 이용하여 염기서열 사이의 상동성이 결정되었다. 이 후 MEGA 6 프로그램 내의 Neighbor-Joining 방법을 사용하여 계통분석 및 계통도를 구축하였다(Tamura et al., 2013).
곤충병원성 곰팡이 B. bassiana ANU1의 살충력 조사
PDA 배지에서 2주간 배양된 B. bassiana ANU1에서 포자를 수확하여 0.02%의 Tween 80이 처리된 멸균증류수에 균일하게 현탁하였다. 이 후 포자의 수는 hemocytometer(Superior, Marienfeld, Germany)를 이용하여 위상차 광학현미경(BX-PHD, Olympus, Tokyo, Japan)으로 확인하였다. B. bassiana ANU1 포자현탁액에 대한 살충력검정은 Eom et al. (2014)의 방법에 따른 옆 침지법으로 시행하였다. 우선, 포자현탁액의 살충력 검정을 위해 농도별(1 × 101, 102, 103, 104, 105, 106, 107, 108 conidia/ml)로 준비된 포자현탁액에 배추 잎(가로 ×세로, 2 cm × 2 cm)을 10분간 침지시킨 후 30분간 공기 중에서 건조하였다. 이 후 파밤나방과 배추좀나방 2령 유충들을 처리된 배추 잎이 들어있는 six-well Constar culture plate (Corning, Lowell, MA, USA)에 각각 처리한 후 24시간 간격으로 동일한 시간에 살충율을 조사하였다. 각 처리는 시험곤충 10마리씩 3반복으로 구성되었으며, 처리 후 6일 동안 동일한 시간에 생존수를 조사하였다. 대조실험은 B. bassiana 품목의 BotaniGard®ES (1 × 107conidia/ml, Laverlam International Corporation, MT, USA)를 이용하여 위와 동일한 방법으로 생물검정을 수행하여 살충활성을 비교하였다.
다양한 온도조건에 대한 B. bassiana ANU1의 살충력 조사
동일한 습도조건에서 107 conidia/ml의 농도로 준비된 B. bassiana ANU1을 다양한 온도조건(15°C, 20°C, 25°C, 30°C)에서 처리하여 파밤나방과 배추좀나방 2령 유충에 대한 살충력을 곤충병원성 곰팡이 B. bassiana ANU1의 살충력 조사에서 기술한 바와 동일한 방법으로 조사하였다. 본 연구에서 설정된 습도조건은 상대습도 50 ± 3%로써 RH/TEMP Data Logger (EL-USB-2, Lascar Electronics Inc., Erie, PA, USA)를 이용하여 실시간으로 측정하였다. 각 처리는 시험곤충 10마리씩 3반복으로 구성되었으며, 처리 후 6일 동안 동일한 시간에 생존수를 조사하였다.
다양한 습도조건에 대한 B. bassiana ANU1의 살충력 조사
동일한 온도조건에서 107 conidia/ml의 농도로 준비된 B. bassiana ANU1을 다양한 습도조건(상대습도 30%, 40%, 50%, 60%)에서 처리하여 파밤나방과 배추좀나방 2령 유충에 대한 살충력을 위에 기술한 대로 동일한 방법으로 조사하였다. 본 연구에서 설정된 온도조건은 25°C로써 습도조건은 가습기(LUH-802MW, 리홈쿠첸, 충남)를 이용하여 설정하였다. 각 처리는 시험곤충 10마리씩 3반복으로 구성되었으며, 처리 후 6일 동안 동일한 시간에 생존수를 조사하였다.
통계분석
모든 살충효과에 대한 생물검정의 살충율은 Abbott의 공식을 이용해 보정하였으며(Abbott, 1925), 생물검정 결과는 백분율 자료로서 arsine 변환 후 SAS PROC GLM을 이용하여 ANOVA 분석 및 처리 평균간 비교를 실시하였다(SAS Institute, 1989). 또한 반수치사농도와 반수치사시간은 EPA Probit 분석 프로그램 Ver 1.5 (U.S. Environmental Protection Agency, Cincinnati, OH)를 이용하여 실시하였다.
결 과
곤충병원성 곰팡이의 동정
야외에서 채집된 파밤나방 유충가운데 곰팡이에 의한 병징으로 치사한 개체에서 곰팡이 균주를 분리하여, 파밤나방 2령 유충을 대상으로 생물검정을 수행하여 살충력을 보이는 균주를 선발하였다. 선발된 균주를 PDA 배지에 치상하여 7일간 배양하였을 때 흰색으로 균사생장을 하다 포자를 형성되었다. 위상차현미경과 주사전자현미경을 이용하여 균사에서 격벽을 확인할 수 있었으며(Fig. 1A-C), 포자는 원형으로 3~5 μm의 크기로 존재하였다(Fig. 1B). 또한 채집된 균주의 분자생물학적 동정에서 위해 PDA 배지에서 7일간 배양된 균사와 포자에서 genomic DNA가 분리되었으며, 이를 주형으로 ITS와 β-tubulin gene의 PCR을 진행하여 1% agarose gel에서 각각 600 bp와 1000 bp 크기로 증폭되었다(자료미제시). ITS 염기서열 분석 결과 채집된 곤충병원성 곰팡이는 B. bassiana Sc2533 균주와 99%, Pacilomyces cicadae 균주와 92%의 상동성을 나타내었다(Fig. 2A). 또한 β-tubulin 염기서열 분석 결과 B. bassiana ARSEF2860 균주와 99%, B. bassiana UFI5477 균주와 98%의 상동성을 나타내었다(Fig. 2B). 이러한 형태학적 및 분자생물학적 동정 결과를 통해 안동시 남선면 일대에서 채집된 파밤나방에서 분리된 병원성 곰팡이는 최종적으로 B. bassiana로 판명되어 B. bassiana ANU1으로 명명하였다.
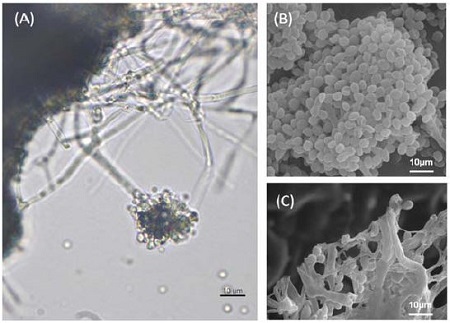
Morphology of Beauveria bassiana ANU1. B. bassiana ANU1 was inulated on PDA media and cultured at 25°C for 7 days. B. bassiana ANU1 observed under phase contrast microscope (A). Spores and hyphae from B. bassiana ANU1 observed under SEM (B and C).
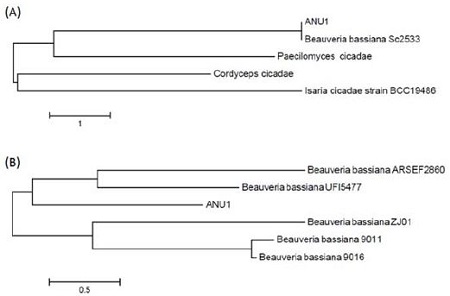
Phylogenetic analysis of Beauveria bassiana ANU1 with other fungal species based on nucleotide sequences. The tree was constructed by the neighbor-joining method based on genetic distances calculated by the maximum composite likelihood method in MEGA 6.0. Bootstrap values ≥ 70% are labeled. Phylogenetic tree constructed by ITS region (A) or β-tubulin (B) of B. bassiana ANU1 with other related fungal species. GenBank Accession No. are AY532058.1 for B. bassiana Sc2533, AF368801.1 for Paecilomyces cicadae, KF740422.1 for CCordyceps cicadae, FJ765284.1 for Isaria cicadae, DQ395070.1 for B. bassiana ARSEF2860, DQ079603.1 for B. bassiana UFI5477, EF025914.1 for B. bassiana ZJ01, AY366062.1 for B. bassiana 9011, and AY366063.1 for B. bassiana 9016.
곤충병원성 곰팡이 B. bassiana ANU1의 살충력 검정
B. bassiana ANU1의 살충력이 국내 주요 해충인 파밤나방과 배추좀나방 유충을 대상으로 조사되었다. 그 결과 분리된 B. bassiana ANU1 균주는 두 종의 나비목해충에 대해 처리 후 3일째에 50% 이상의 살충효과를 발휘하였다(Fig. 3). B. bassiana ANU1과 대조구로 사용한 상업용 B. bassiana 생물농약간의 살충활성 비교실험에서 두 처리간 살충력의 차이가 통계적으로 유의한 것으로 조사되었다. 파밤나방을 대상으로 B. bassiana ANU1의 살충력은 상업용 B. bassiana 균주와 비교하여 18%이상 살충력의 차이가 나타났으며(Fig. 3A), 배추좀나방에서도 14% 이상 B. bassiana ANU1의 살충력이 높은 것으로 조사되었다(Fig. 3B). 파밤나방과 배추좀나방에 처리된 B. bassiana ANU1 균주의 살충력은 처리 후 6일째에 포자의 농도가 증가함에 따라 통계적으로 유의하게 증가하였으며(파밤나방: F=146.19; dF=7, 16; P=0.0001, 배추좀나방: F=276.57; df==7, 16; P=0.0001), 106 conidia/ml의 포자농도로 처리 시 두 종의 해충에 대해 처리후 5일째부터 80% 이상의 치사효과가 나타났다. 특히 파밤나방을 대상으로 B. bassiana ANU1은 104 conidia/ml 이상의 포자처리 농도에서 처리 후 6일째에 60% 이상의 살충력을 나타내기 시작하여 107 conidia/ml 이상의 포자처리 농도부터 100%의 살충력을 나타내었다. 또한 배추좀나방을 대상으로 B. bassiana ANU1은 파밤나방과 동일하게 104 conidia/ml 이상의 포자처리 농도에서 처리 후 6일째에 60% 이상의 살충력을 나타내었으며, 105 conidia/ml 이상의 포자처리 농도부터 100%의 살충력을 나타내었다. B. bassiana ANU1에 대한 파밤나방과 배추좀나방의 유충에 대한 반수치사농도(LD50)가 조사되었다(Table 1). 다양한 농도별로 B. bassiana ANU1의 포자를 처리한 후 6일 동안 조사한 살충력을 바탕으로 2령의 파밤나방과 배추좀나방 유충을 대상으로 각각 2.7 × 103(1.2 × 103−6.3 × 103)과 0.9 × 103(0.5 × 103−1.6 × 103) conidia/ml의 포자농도에서 50%의 치사효과를 나타낼 수 있는 것으로 조사되었다. 또한 103 conidia/ml의 포자농도에 노출된 파밤나방과 배추좀나방 2령 유충의 반수치사시간(LT50)은 각각 65.6(60.5 −70.6)과 60.8(54.4 −66.6) 시간으로 조사되어 B. bassiana ANU1의 포자처리 후 3일 안에 50% 이상의 살충력을 갖는 것으로 나타났다(Table 2).
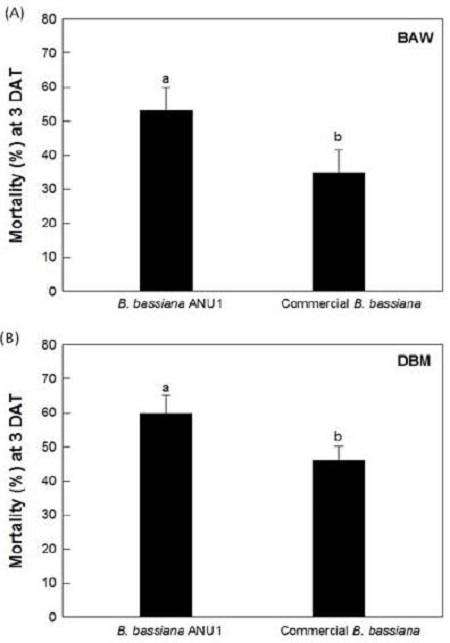
Pathogenicity of Beauveria bassiana ANU1 or commercial B. bassiana pesticide (BotaniGard®ES, Laverlam International Corporation, MT, USA) against two lepidopteran insects, Spodoptera exigua (beet armyworm, BAW) and Plutella xylostella (diamondback moth, DBM) at 25°C. Second instar larvae of S. exgua (A) or P. xylostella (B) were exposed at 1 × 107 conidia/ml. Treated insects were kept at 50% RH incubator. Each replication used 10 larvae and was replicated three times. Mortality was measured at 3 days after treatment (DAT). Error bar indicate standard deviation and different letters above strandard deviation bar indicate significant difference among means at Type I = 0.05 (LSD test).

Pathogenicity of Beauveria bassiana ANU1 against two lepidopteran insects, Spodoptera exigua (beet armyworn, BAW) and Plutella xylostella (diamondback moth, DBM) at 6 days after treatment
곤충병원성 곰팡이 B. bassiana ANU1의 온도별 살충력 검정
상대습도 50%의 동일한 습도조건에서 다양한 온도별(15°C, 20°C, 25°C, 30°C)로 B. bassiana ANU1의 살충력을 파밤나방과 배추좀나방을 대상으로 조사하여 20°C 이상의 온도에서 높은 살충력이 나타나는 것을 확인하였다(Fig. 4). 두 해충에 처리된 균주의 살충력은 처리 후 6일째에 온도가 증가함에 따라 통계적으로 유의하게 증가하였다(파밤나방: F=68.25; df==3, 8; P=0.0001, 배추좀나방: F=101.67; df==3, 8; P=0.0001). 파밤나방은 20°C에서 30°C까지의 온도에서 처리 후 4일째부터 70% 이상의 살충효과가 발휘되기 시작하여 6일째에 79% 이상의 살충효과를 나타내었으나, 15°C의 온도에서는 처리 후 3일째부터 살충효과가 나타나기 시작하여 6일째에 40% 미만의 살충력을 유지하였다(Fig. 4A). 배추좀나방도 20°C에서 30°C까지의 온도에서 처리 후 4일째에 66.6% 이상의 살충효과가 발휘되기 시작하여 6일째에 86.6% 이상의 살충효과가 나타내었으나, 15°C의 온도에서는 처리 후 6일째에 45% 미만의 살충력을 나타내었다(Fig. 4B). 따라서 B. bassiana ANU1의 두 곤충에 대한 처리시 온도가 증가할수록 살충력의 증가는 통계적으로 유의하게 나타났다.
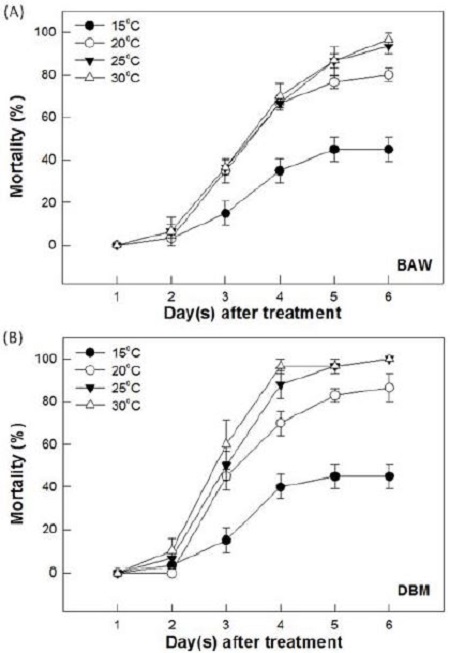
Pathogenicity of Beauveria bassiana ANU1 against two lepidopteran insects, Spodoptera exigua (beet armyworm, BAW) and Plutella xylostella (diamondback moth, DBM) with 1 × 107 conidia/ml at different temperatures. Second instar larvae of S. exgua (A) or P. xylostella (B) were exposed at different temperatures (15°C, 20°C, 25°C, and 30°C). Treated insects were kept at 50% RH incubator. Each replication used 10 larvae and was replicated three times. Mortality was measured for 6 days after treatment. Error bar indicate standard deviation.
다양한 습도조건에 대한 B. bassiana ANU1의 살충력 조사
동일한 온도조건(25°C)에서 다양한 상대습도별(30%, 40%, 50%, 60%)로 B. bassiana ANU1의 살충력을 파밤나방과 배추좀나방을 대상으로 조사하여 30%에서 60%까지의 상대습도에서 모두 살충효과가 나타났다(Fig. 5). 두 해충에 처리된 균주의 살충력은 처리 후 5일째에 습도가 증가함에 따라 통계적으로 유의하게 증가하였다(파밤나방: F=18.22; df==3, 8; P=0.0006, 배추좀나방: F=11.57; df==3, 8; P=0.0028). B. bassiana ANU1는 파밤나방 2령 유충을 대상으로 처리 후 4일째에 40~60%의 상대습도에서 66.7%의 살충력이 나타난 반면, 30%의 상대습도에서는 45%의 살충력이 나타났다(Fig. 5A). 또한 배추좀나방 2령 유충을 대상으로 30%, 40%, 50, 60%의 상대습도에서 처리 후 3일째에 각각 35%, 50%, 70%, 70%의 살충력이 나타났으며, 처리 후 6일째에 100%의 살충력이 나타났다(Fig. 5B).
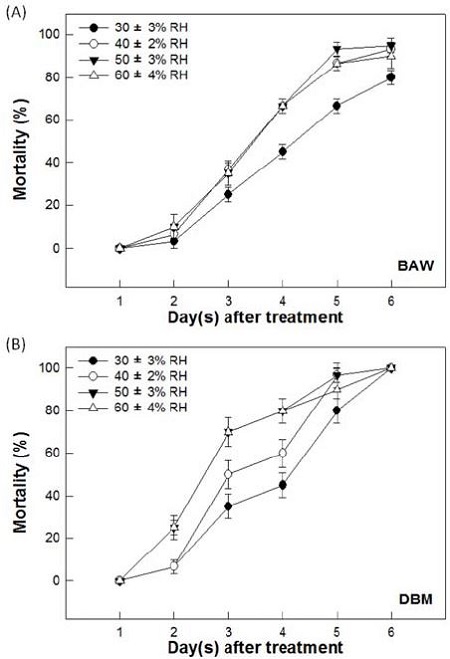
Pathogenicity of Beauveria bassiana ANU1 against two lepidopteran insects, Spodoptera exigua (beet armyworm, BAW) and Plutella xylostella (diamondback moth, DBM) with 1 × 107 conidia/ml at different relative humidities (RH). Second instar larvae of S. exgua (A) or P. xylostella (B) were exposed at different RHs (30%, 40%, 50%, and 60%). Treated insects were kept at 25°C incubator. Each replication used 10 larvae and was replicated three times. Mortality was measured for 6 days after treatment. Error bar indicate standard deviation.
고 찰
곤충병원성 곰팡이는 농생태계의 친환경적 방제인자로써 중요한 생물자원인 동시에 자연계 내에서는 다양한 곤충의 개체수 조절에 관여한다. 특히 최근에는 난방제 해충 가운데서도 흡즙성 곤충을 중심으로 효과적인 미생물 살충제로 곤충병원성 곰팡이가 여러 나라에서 연구 개발되고 있는 실정이다. 곤충병원성 곰팡이는 전 세계적으로 최소 90속의 700여종에 이른다(Goettel et al., 2005). 그리고 크게 Oomycetes, Chitridiomycetes, Zygomycetes, Ascomycetes의 4개의 분류군으로 나누어진다(Hwang et al., 2009). 이 가운데 가장 일반적으로 이용되고 있는 곤충병원성 곰팡이는 Beauveria, Entomophthora, Isaria, Metarhizium, Lecanicillium, Neozygites, Nomuraea 등이 있다(Hajek et al., 1994; Supakdamrongkul et al., 2010; Han et al., 2013). 최근 국내에서 분리되는 곤충병원성 곰팡이는 Metarhizium anisopliae (Han et al., 2013)와 Nomuraea rileyi (Hwang et al., 2009)으로써 나비목 해충방제를 목적으로 이들 균주의 병원성과 기주범위 조사가 이루어지고 있다. 곤충병원성 곰팡이의 일반적인 살충기작은 감염포자의 곤충 체벽 부착에서 시작되며, 이 후 감염포자는 곤충의 체벽에 부착된 후 키틴 및 단백질 분해과정을 통해 발아관 성장이 이루어져 혈강에 이르게 된다(Hwang et al., 2009). 혈강에 침입한 감염포자는 혈강 내에 존재하는 영양원을 이용하여 곰팡이 증식을 시작하며, 이때 기주의 영양소 결핍 또는 곰팡이가 분비하는 독소에 의해 곤충을 치사에 이르게 한다(Han et al., 2013). 기주의 영양소가 고갈되면 분생자병을 통해 생산된 분생포자가 주변의 기주를 찾아가면서 자연계에서 곤충의 밀도를 조절한다(Hwang et al., 2009).
본 연구에서는 경북 안동시 남선면에 위치한 파재배지에서 채집된 나비목의 파밤나방의 사충에서 분리한 곤충병원성 곰팡이의 동정과 이에 대한 병원성을 조사하였다. 분리된 곰팡이 균주의 동정을 위해 형태적 및 분자생물학적 기술을 이용하여 백강균으로 알져진 B. bassiana로 판명되었으며, B. bassiana ANU1으로 명명하였다. 또한, B. bassiana ANU1의 병원성은 나비목의 난방제 해충인 파밤나방과 배추좀나방 유충을 대상으로 확인되었다. 본 연구에서 분리된 B. bassiana ANU1의 병원성은 Yun et al. (2004)의 연구에 사용된 B. bassiana 균주의 파밤나방과 배추좀나방에 대한 반수치사농도가 각각 3.0 × 106과 6.3 × 106 conidia/ml의 농도인 것과 비교하여 2.7 × 103과 0.9 × 103 conidia/ml의 농도에서 반수치사효과를 가지고 있어 높은 병원성을 보유하고 있는 것을 확인할 수 있었다. 특히, B. bassiana ANU1을107 conidia/ml의 농도로 파밤나방과 배추좀나방 유충에 처리하였을 때 반수치사시간은 65.6과 60.8시간으로 조사되어 빠른 살충효과를 가지고 있음이 밝혀졌다. 이러한 B. bassiana ANU1의 높은 살충력과 속효성은 이들 곰팡이 균주가 생산하는 다양한 독소에 의해 기인하는 것으로 판단된다. 기존의 연구에서 보고된 이러한 독소는 주로 beauvericin으로 depsipeptide 대사물질(Hamil et al., 1969; Roberts and Hajek, 1992)과 beauverlides, isarolides, bassianolides의 cyclotettradepsipeptide류(Frappier et al., 1975; Suzuki et al., 1977)의 펩타이드류가 있다. 또한, 비펩타이드류 독소로서 bassianin과 tenellin이 밝혀졌으며 이들은 적혈구막의 ATPase를 억제하는 것으로 보고되었다(Jeffs and Khachatourians, 1997). 따라서 B. bassiana ANU1의 구체적인 살충기작을 연구하기 위해서는 이들이 생산하는 다양한 독소와 기주곤충의 범위에 대한 추가적인 분석이 필요하다.
곤충병원성 곰팡이의 살충력은 환경요인과 밀접한 관련이 있다(Luz and Fargues, 1997). 이를 확인하기 위해 온도별 살충효과를 조사하였고 B. bassiana ANU1는 파밤나방과 배추좀나방 유충에 대해서 20°C 이상의 온도에서 처리 후 4일째부터 70%와 66.6% 이상의 살충력이 나타난 반면, 15°C의 온도에서는 처리 후 6일째까지 40% 미만의 살충력을 나타내었다. Hwang et al. (2009)의 연구에서 곤충병원성 곰팡이의 기주곤충에 대한 포자감염은 포자접종시 유지되는 온도와 상관이 있으며 Hypomecetes가 선호하는 온도가 주로 20°C에서 30°C이며, Entomophthorales는 15°C에서 25°C라고 보고하였다. 따라서 본 연구에서 조사된 온도별 살충력의 차이는 B. bassiana ANU1가 속하는 분류군이 Hypomecetes이기 때문인 포자감염시 선호하는 온도인 20°C에서부터 살충력이 높게 나타난 것으로 보여진다. 또한, 습도별 살충효과에서는 파밤나방과 배추좀나방 유충 모두 30% 이상의 상대습도에서 처리 후 4일째부터 40% 이상의 살충력이 나타났으며, 상대습도가 높아질수록 살충력도 증가하는 것으로 조사되었다. 곤충병원성 곰팡이의 병원성은 온도 이외의 습도와 같은 환경적 요인에 의해 결정된다(Luz and Fargues 1999; Fargues and Luz 1998). B. bassiana (Bals.) Vuill는 상대습도가 90%에서 95.5% 증가함에 따라 분생포자의 발아에 걸리는 시간이 72시간에서 20시간으로 크게 감소하며 흡혈성 노린재류인 Rhodnius prolixus의 병원성을 증가시켰다(Luz and Fargues, 1997). 그러나 본 연구에 사용된 나비목의 파밤나방과 배추좀나방 유충은 노린재류와는 달리 40%의 낮은 상대습도에서도 살충효과가 나타나 노지와 시설재배지에서 해충방제의 가능성을 제시하고 있다. 전 세계적으로 B. bassiana는 다양한 해충에 대한 살충효과가 있어 이를 생물학적 방제 인자로 활용하기 위한 연구를 진행하고 있다(Ugine et al., 2007; Aslantas et al., 2008; Liu et al., 2008). 따라서 국내에서 새로이 분리된 곤충병원성 곰팡이 B. bassiana ANU1는 생물자원으로서 이용 가능성이 크며, 방제가 어려운 것으로 알려진 파밤나방과 같은 해충에 대해서 높은 살충력을 가지고 있기에 효과적인 생물농약의 인자로 활용될 수 있을 것이다.
Acknowledgments
본 연구는 농림수산식품부의 iPET 사업과 2014년도 정부(교육부)의 재원으로 한국연구재단의 기초연구사업(No. 2013R1A1A2061353)에 의해 지원되었습니다.
Literature cited
-
Abbott, W. S., (1925), A method of computing the effectiveness of an insecticide, J. Econ. Entomol, 18, p265-267.
[https://doi.org/10.1093/jee/18.2.265a]

-
Aslantas, R., C. Eken, and R. Hayat, (2008), Beauveria bassiana pathogenicity to the cherry slugworm, Caliroa cerasi (Hymenoptera: Tenthedinidae) Larvae, World J. Microbiol. Biotechnol, 24, p119-122.
[https://doi.org/10.1007/s11274-007-9447-y]

- Charnley, A. K., (1997), Entomopathogenic fungi and their role in pest control, The mycota IV environmental and microbial relationships, Berlin, Springer, p185-201.
-
Eom, S., Y. Park, H. Kim, and Y. Kim, (2014), Development of a High Efficient “Dual Bt-Plus”Insecticide using a primary form of an entomopathogenic bacterium, Xenorhabdus nematophila, J. Microbiol. Biotechnol, 24, p507-521.
[https://doi.org/10.4014/jmb.1310.10116]

-
Fargues, J., and C. Luz, (1998), Effects of fluctuating moisture and temperature regimes on sporulation of Beauveria bassiana on cadavers of Rhodnius prolixus, Biocontrol Sci. Tech, 8, p323-334.
[https://doi.org/10.1080/09583159830135]

-
Frappier, F., P. Ferron, and M. Pais, (1975), Chimie des champignons entomopathogenes-le beauvellide, nouveau cyclodepsipeptide isole d'un Beauveria tenella, Phytochemistry, 14, p2703-2705.
[https://doi.org/10.1016/0031-9422(75)85254-X]

-
Furlong, M. J., D. J. Wright, and L. M. Dosdall, (2013), Diamondback moth ecology and management: problems, progress, and prospects, Annu. Rev. Entomol, 58, p517-541.
[https://doi.org/10.1146/annurev-ento-120811-153605]

- Gho, H. G., S. G. Lee, B. P. Lee, K. M. Choi, and J. W. Kim, (1991), Simple mass-rearing of beet armyworm, Spodoptera exigua (Hbner)(Lepidoptera: Noctuidae), on an aritificial diet, Kor. J. Appl. Entomol, 29, p180-183.
-
Goettel, M. S., J. Eilenberg, and T. Glare, (2005), Entomopathogenic fungi and their role in regulation of insect populations, L. I. Gilbert, K. Iatrou, S. S. Gill Eds, Molecular Insect Science, Elsevier, New York, USA, p361-405.
[https://doi.org/10.1016/b0-44-451924-6/00088-0]

- Goh, H. G., S. G. Lee, B. P. Lee, K. M. Choi, and J. H. Kim, (1990), Simple mass-rearing of beet armyworm, Spodoptera exigua (Hbner) (Lepidoptera: Noctuidae), on an artificial diet, Kor. J. Appl. Entomol, 29, p180-183.
-
Hajek, A. E., and R. J. St. Leger, (1994), Interactions between fungal pathogens and insect hosts, Annu. Rev. Entomol, 39, p293-322.
[https://doi.org/10.1146/annurev.en.39.010194.001453]

-
Hamill, R. L., C. E. Higgens, H. E. Boaz, and M. Gorman, (1969), The structure of beauvericin, a new depsipeptide antibiotic toxic to Artemia salina, Tetrahed. Lett, 49, p4255-4258.
[https://doi.org/10.1016/S0040-4039(01)88668-8]

-
Han, J. H., H. Kim, H. T. Leam, J. J. Kim, and S. Lee, (2013), Characteristics and virulence assay of entomopathogenic fungus Metarhizium anisopliae for the microbial control of Spodoptera exigua, Korean J. Pestic. Sci, 17, p454-459.
[https://doi.org/10.7585/kjps.2013.17.4.454]

-
Hwang, J. H., B. R. Park, S. G. Lee, and Y. Kim, (2009), Identification of an entomopathogenic fungus, Nomuraea rileyi ANU101, infecting the beet armyworm, Spodoptera exigua, in Korea, Kor. J. Mycol, 37, p139-143.
[https://doi.org/10.4489/KJM.2009.37.2.139]

-
Jeffs, L. B., and G. G. Khachatourians, (1997), Toxic properties of Beauveria pigments on erythrocyte membranes, Toxicon, 35, p1351-1356.
[https://doi.org/10.1016/S0041-0101(97)00025-1]

-
Lacey, L. A., R. Frutos, H. K. Kaya, and P. Vail, (2001), Insect pathogens as biological control agents : Do they have a future? Biol, Control, 21, p230-248.
[https://doi.org/10.1006/bcon.2001.0938]

-
Lacey, L. A., Liu, T. X., Buchman, J. L., Munyaneza, J. A. Goolsby, and D. R. Horton, (2011), Entomopathogenic Fungi (Hypocreales) for control of potato psyllid, Bactericera cockerelli (Sulc) (Hemiptera: Triozidae) in an area endemic for zebra chip disease of potato, Biol. Contr, 56, p271-278.
[https://doi.org/10.1016/j.biocontrol.2010.11.012]

-
Liu, T., L. Wang, Y. X. Duan, and X. Wang, (2008), Nematocidal activity of culture filtrate of Beauveria bassiana against Meloidogyne hapla, World J. Microbiol. Biotechnol, 24, p113-118.
[https://doi.org/10.1007/s11274-007-9446-z]

-
Luz, C., and J. Fargues, (1997), Temperature and moisture requirements for conidial germination of an isolate of Beauveria bassiana, pathogenic to Rhodnius prolixus, Mycopathologia, 138, p117-125.
[https://doi.org/10.1023/A:1006803812504]

-
Luz, C., and J. Fargues, (1999), Dependence of the entomopathogenic fungus, Beauveria bassiana, on high humidity for infection of Rhodnius prolixus, Mycopathologia, 146, p33-41.
[https://doi.org/10.1023/A:1007019402490]

- Moulton, J. K., D. A. Peppe, J. Dennehy, P. Dugger, and D. Richter, (1999), Studies of resistance of beet armyworm (Spodoptera exigua) to spinosad in field populations from the southern USA and southeast Asia, Proceedings of the Beltwide Cotton Conferences, Orlando. FL. USA, 2, p884-887.
-
Roberts, D. W., and A. E. Hajek, (1992), Entomopathogenic fungi as bioinsecticides, G. F. Leatham Ed, Chapman and Hall, New York, USA, p144-159.
[https://doi.org/10.1007/978-1-4684-7112-0_10]

- SAS Institute, Inc, (1989), SAS/STAT User's Guide, release 6.03 Ed, SAS Institute, Cary, NC.
- Shin, T. Y., J. B. Choi, S. M. Bae, Y. R. Cha, J. M. Oh, H. N. Koo, and S. D. Woo, (2010), Study on selective media for isolation of entomopathogenic fungi, Int. J. Indust. Entomol, 20, p7-12.
-
Supakdamrongkul, P., A. Bhumiratana, and C. Wiwat, (2010), Characterization of an extracellular lipase from the biocontrol fungus, Nomuraea rileyi MJ and its toxicity toward Spodoptera litura, J. Invertebr. Pathol, 105, p229-235.
[https://doi.org/10.1016/j.jip.2010.06.011]

-
Suzuki, A., M. Kanaoka, A. Isogai, S. Murakpshi, M. Ichinoe, and S. Tamura, (1977), Bassianolide, a new insecticidal cyclodepsipeptide from Beauveria bassiana and Verticillium lecanii, Tetrahed Lett, 25, p2167-2170.
[https://doi.org/10.1016/S0040-4039(01)83709-6]

-
Tabashnik, B. E., N. Finson, F. R. Groeters, W. J. Moar, M. W. Johnson, K. Luo, and M. J. Adang, (1994), Reversal of resistance to Bacillus thuringiensis in Plutella xylostella, Proc. Natl. Acad. Sci. USA, 91, p4120-4124.
[https://doi.org/10.1073/pnas.91.10.4120]

-
Tamura, K., G. Stecher, D. Peterson, A. Filipski, and S. Kumar, (2013), MEGA6: Molecular evolutionary genetics analysis version 6.0, Mol. Biol. Evol.
[https://doi.org/10.1093/molbev/mst197]

-
Talekar, N. S., and A. M. Shelton, (1993), Biology, ecology, and management of the diamondback moth, Annu. Rev. Entomol, 38, p275-301.
[https://doi.org/10.1146/annurev.en.38.010193.001423]

- Tartar, A., D. G. Boucias, B. J. Adams, and J. J. Becnel, (2002), Phylogenetic identifies the invertebrate pathogen Helicosporidium sp. as a green alga (Chlorophyta), Int. J. Syst. Evol. Microbiol, 52, p273-279.
-
Ugine, T. A., S. P. Wraight, and J. P. Sanderson, (2007), Effects of manipulating spray-application parameters on efficacy of the entomopathogenic fungus Beauveria bassiana against western flower thrips, Frankliniella occidentalis, infesting greenhouse impatiens crops, Biocontrol Sci. Technol, 17, p193-219.
[https://doi.org/10.1080/09583150600937618]

- White, T. J., T. Bruns, S. Lee, and J. W. Taylor, (1990), Amplification anddirect sequencing of fungal ribosomal RNA genes for phylogenetics, M. A. Innis, D. H. Gelfand, J. J. Sninsky, and T. J. White Eds, Academic Press Inc, New York, USA, p315-322.
- Yun, J. S., H. H. Kim, D. W. Kim, S. M. Lee, D. S. Kim, and D. W. Lee, (2004), Pathogenicities of entomopathogenic fungi, Beauveria bassiana and Metarhizium anisopliae against Lepidopterous insect pests, Agrotis segetum, Artogeia rapae, Mamestra brassicae, Plutella xylostella, Spodoptera exigua and Spodoptera litura, Kor. Turfgrass Sci, 18, p1-12.