소나무재선충에 대한 방선균 균주의 살선충 및 증식억제 효과

초록
우리나라의 소나무림에 만연되어 있는 소나무재선충에 대한 살선충 및 증식억제 활성을 우리나라 산림토양으로부터 분리 한 방선균을 이용하여 수행하였다. 우리나라 산림토양에서 분리 된 32개의 방선균 균주들 중 21개 균주의 2배 배양여액에서 소나무재선충에 대한 보정사충율이 90% 이상을 나타내었다. 방선균들 중 AM210, SG16, YD116, YD315 균주의 병원성이 가장 높았으며 YD116 균주는 분자생물학적, 형태적 특성 조사결과 Streptomyces atratus로 동정되었다. S. atratus로부터 몇 가지 활성 물질들이 알려져 있으며 그들 중 세포독성을 가지는 hydrazidomycin과 유사한 hydrazine hydrate를 이용하여 소나무재선충에 대한 살선충 활성을 검정하였다. 10 ppm 농도의 hydrazine hydrate는 소나무재선충에 대하여 60.8%의 보정사충율을 보였다. S. atratus YD116 균주의 실용화를 위한 부가적인 연구가 필요할 것이다.
Abstract
Thirty-two actinomycetes isolates from Korean forest soil were screened for their nematicidal and reproduction suppression activity against pine wood nematode (PWN) which is widely spread in Korea. Culture filterates of 21 isolates showed more than 90% mortality at 2-fold concentration. Among them, AM210, SG16, YD116 and YD315 were more effective than others on reproduction of PWN. The YD116 isolate was identified as Streptomyces atratus by morphological and 16S rDNA analyses. Hydrazine hydrate, similar to hydrazidomycin which has cytotoxicity among substances from S. atratus against PWN, was tested for its nematicidal activity. Ten ppm of the hydrate showed 60.8% mortality. Additional studies are needed for practical use of the S. atratus YD116 isolate.
Keywords:
Environmental friendly control, pine tree, pine wilt disease, Streptomyces atratus키워드:
소나무, 소나무재선충병, 환경친화적 방제서 론
소나무재선충병은 1905년 일본에서 처음 발생이 보고된 이후, 미국(1934년), 중국(1982년), 대만(1985년) 및 포르투갈(1999년) 등에서 발생하고 있다(Yano, 1913; Mota et al., 1999; Yang, 2002). 소나무재선충(Bursaphelenchus xylophilus)은 미국이나 캐나다, 멕시코 등의 북미 지역이 원산으로(Dwinell, 1997) 원산지인 북미 지역에서는 소나무류가 저항성이라 피해를 받고 있지 않으나 우리나라를 비롯하여 일본, 대만, 중국 및 포르투갈 등지의 Pinus속 소나무류는 감수성을 가지고 있어 치명적인 피해가 유발되고 있다(Cheng et al., 1983; Mamiya, 1988; Yi et al., 1989; Mota and Vieira, 2008). 그로 인해 소나무재선충병은 국내외적으로 소나무에 심각한 피해를 일으키고 있는 국제검역대상 제 1호로 분류되어있는 식물 병으로, 우리나라에서는 1988년 부산 동래구 금정산에서 최초로 발생한 이래 1997년 이후 급격하게 확산되어 피해가 확산되고 있는데 현재까지 알려진 주요 피해 수종은 소나무(Pinus densiflora), 곰솔(P. thunbergii), 잣나무(P. koraiensis)로(Shin, 2008) 그 중 우리나라와 일본에 주로 분포하는 소나무와 곰솔의 경우 소나무재선충에 감염시 100% 고사되고 있는 실정이다(Takeuchi, 2008).
우리나라의 국토면적은 2010년 말 현재 10,003천 ha(MLTM, 2012)이며 산림법상 실질적인 산림면적은 6,369천 ha로서 국토의 63.7%를 차지하고 있는데 전국 산림의 임상 분포는 침엽수림이 2,581천 ha (40.5%)로 구성되어 있다. 그중 소나무재선충의 기주가 되는 소나무림은 1,447천 ha로 침엽수림의 56%를 차지하고 있다(KFS, 2012; 2013).
소나무재선충은 기주식물에 침입하여 초기에는 식물체에서 영양분을 섭취하고, 기주가 고사하면 사상균인 Botrytis cinerea를 먹고 살면서 급격히 증식되어 기주식물의 가도관을 막아 수분의 상승을 차단하고, cellulase를 분비하여 조직을 파괴해 기주식물을 고사시킨다(Lee et al., 2006). 그러나 소나무재선충은 기주 간에 스스로 이동을 할 수 없으므로 다른 기주로 이동할 경우에는 솔수염하늘소(Monochamus alternatus)와 같은 매개충의 도움을 받아야 한다.
소나무재선충의 방제 방법으로는 소나무재선충 자체를 방제 대상으로 하는 방법과 매개충인 하늘소류를 방제하는 방법이 있다. 소나무재선충을 방제 대상으로 하는 방법으로는 아바멕틴이나 에마멕틴벤조에이트와 같은 살선충제의 나무주사나 포스티아제이트와 같은 지면 살포 등의 방법이 있고, 매개충을 대상으로 하는 방제는 항공약제 살포, 지상약제 살포, 피해목 내 유충을 제거하기 위한 벌채 및 훈증, 파쇄, 소각 등의 방법이 있다(Kishi, 1995; Moon et al., 1995; Lee et al., 2003).
소나무재선충을 대상으로 하는 방제는 매개충을 대상으로 하는 방제에 비하여 방제 효과가 높고, 사전예방 효과를 거둘 수 있으나 노동력의 집약적 투입이 필요하고, 비용이 많이 들며 산림 내에서 작업의 어려운 점 등이 있어 대규모 산림에 적용하기는 어려운 단점이 있다(Kamata, 2008; Lee et al., 2008b). 특히 대부분의 수간주입용 소나무재선충 방제약제들이 상대적으로 고가여서 방제비용 증가의 주요인이 되고 있다. 또한, 수체 내 주입된 이들 살선충제들이 산림생태계나 인축에 미치는 악영향에 대해 구체적으로 밝혀진 바는 없지만, 솔잎을 식용으로 사용하였을 때 나타날 수 있는 상황이나 송편을 찔 때와 같이 간접적인 식용목적으로 사용하는 것과 같은 상황에 대한 잠재적 위험성을 내포하고 있다. 따라서 이러한 단점을 보완하기 위하여 최근에는 화학농약을 대체하는 소나무재선충 살선충 물질에 대한 연구가 활발히 이루어지고 있는데 살선충 활성 물질을 생산하는 미생물 이용도 주요한 방법의 하나이다(Park et al., 2010).
미생물은 부가가치가 매우 높아 생물 소재 산업에서 중요한 위치를 차지하고 있는데 지금까지 10,000여 종의 신물질이 미생물로부터 발견되었으며 이 중 100여 종이 실용화되고 있다. 특히 방선균은 2차 대사산물에 있어서 화학구조의 다양성과 수의 풍부함으로 인하여 산업적으로 가장 중요한 미생물로서 인식되고 있으며 지금까지 미생물로부터 발견된 생리활성물질 중 약 2/3가 방선균으로부터 유래하였다(Kim et al., 2004; MRDB, www.mrdb.or.kr).
미생물 대사산물 등의 천연물질은 활성 성분의 직접적인 이용뿐만 아니라 신농약 개발을 위한 선도물질과 신규 작용점 연구 분야에 이용가치가 높다(Lange et al., 1993; Katz and Demain, 1997).
소나무재선충의 경우 실험방법에 따라 효과에 많은 차이를 보인다. 특히, 직접접촉 조건에서는 살선충 활성이 높으나 실제 수간주사의 경우 효과가 없는 경우가 있기 때문에(Lee et al., 2009) 다양한 방법으로 살선충 활성 검정이 필요하다. 따라서 본 연구에서는 산림토양으로부터 분리된 방선균을 이용하여 살선충 활성을 검정하여 소나무재선충 방제에 활용할 수 있는 환경친화적 대체 물질 탐색을 위하여 수행하였다.
재료 및 방법
소나무재선충
실험에 이용한 소나무재선충은 경남 진주의 소나무재선충 감염목으로부터 깔때기법으로 분리해 직접 사용하거나 분리후 소나무재선충의 먹이인 잿빛곰팡이병균(Botrytis cineria)을 이용하여 실내에서 배양 후 깔때기법으로 분리하여 사용하였다(Kishi, 1995; Lee et al., 2006).
방선균 분리 및 배양
방선균 분리를 위한 토양 채집은 충북 영동, 충남 태안군 안면도, 경북 문경과 상주의 산림에서 채집하였다. 채집한 토양은 상온에서 24시간 건조 후 토양 10 g을 멸균 증류수 90 ml가 들어있는 삼각플라스크에 넣고, 30분 동안 20°C에서 진탕 배양 후 시료를 10−3까지 10배 단위로 단계적으로 멸균 증류수를 이용하여 희석한 후 희석액 50 μl를 취하여 방선균 분리용 배지(Actinomycete Isolation Agar, DifcoTM)에 분주하여 도말 후 20°C의 배양기(HB-303DH-0, Hanbaek Scientific Co.)에 배양하면서 전형적인 방선균 균총을 형성하는 균을 분리하여 사용하였다.
방선균 배양 및 보관
고체 배지에서 배양하던 방선균의 균총을 yeast mold broth (YM broth 21 g/l) 200 ml가 들어있는 삼각플라스크에 접종한 후 진탕배양기(23°C, 130 rpm)에서 약 10일간 진탕 배양 후 멸균한 filter paper (150 mm, Advantec No.2)를 이용하여 배양액을 여과하여 실험에 이용하였다. 배양 여액은 4°C 냉장고에 보관하면서 사용하였다. 실험에 이용한 방선균의 균주는 총 32균주로서 Table 1과 같다.
소나무재선충에 대한 방선균의 살선충 활성 검정
방선균의 살선충 활성을 검정하기 위하여 12 well cell culture plate (85.4 × 127.6 mm, SPL)에 소나무재선충 현탁액(100마리/0.5 ml)을 0.5 ml씩 분주한 후 방선균 배양 여액 원액을 0.5 ml씩 처리하였다. 무처리는 소나무재선충 현탁액 0.5 ml와 멸균 증류수 0.5 ml를 처리하였다. 처리 후 상온에서 48시간 방치 후 해부현미경(SMZ800, Nikon)으로 선충의 치사 여부를 조사하였다. 선충의 치사 여부는 핀으로 자극하였을 때 반응이 없는 것은 죽은 것으로 간주하였으며, 본 실험은 4회 반복 실시하였다.
원액 처리구에서 효과가 좋았던 균주 15개를 선발하여 2, 3차 실험을 진행하였다. 실험은 1차와 동일하게 진행하였으며 방선균 배양 여액의 농도를 2차에서는 2배액, 3차에서는 5배액으로 희석한 후 각각 0.5 ml씩 처리하였다. 소나무재선충 현탁액은 0.5 ml당 100마리의 농도로 0.5 ml씩 처리하였다. 무처리는 멸균 증류수 0.5 ml와 소나무재선충 현탁액 0.5 ml를 처리하였다. 처리 후 상온에서 48시간 방치 후 해부현미경으로 선충의 치사 여부를 조사하였으며, 2, 3차 실험 모두 4회 반복 실험하였다.
방선균이 소나무재선충의 증식에 미치는 영향
방선균이 증식에 미치는 영향을 알아보기 위하여 각각의 conical tube (50 ml, SPL)에 소나무재선충 현탁액(200마리/1 ml)을 5 ml씩 분주한 후 방선균 배양 여액 10배 희석액을 5 ml (방선균 배양 여액 0.5 ml +멸균 증류수 4.5 ml)씩 처리하였다. 무처리는 소나무재선충 현탁액 5 ml와 멸균 증류수 5 ml를 처리하였다. 처리 후 상온에서 48시간 방치 후 1ml씩 취하여 B. cineria가 충분히 자란 PDA (potato dextrose agar, DifcoTM)평판 배지에 접종 후 15일에서 30일 동안 24°C의 배양기(HB-303DH-0, Hanbaek scientific Co.)에 보관하였다. 소나무재선충의 증식 수를 알아보기 위하여 깔때기법으로 소나무재선충을 배지로부터 분리하여 해부현미경으로 조사하였다. 본 실험은 3회 반복 실시하였다.
YD116 균주의 농도별 살선충 활성 및 증식에 미치는 영향
방선균 배양 여액을 이용한 소나무재선충 증식 억제 실험에서 효과가 우수한 균주들 중 YD116 방선균 균주를 이용하여 농도별로 소나무재선충 증식억제 효과를 검토하였다. 살선충 활성 실험은 각각의 conical tube (50 ml, SPL)에 소나무재선충 현탁액(200마리/1 ml)을 5 ml씩 분주한 후 방선균 균주 YD116 배양 여액을 농도별(원액, 5, 10, 50, 500배 희석액)로 5 ml씩 처리하였다. 무처리는 소나무재선충 현탁액 5 ml와 멸균 증류수 5 ml를 처리하였다. 처리 후 상온에서 48시간 방치 후 1 ml를 취하여 해부현미경(SMZ800, Nikon)하에서 선충의 치사 여부를 조사하였다. 실험은 5 반복으로 수행하였다.
증식에 미치는 영향은 방선균이 소나무재선충의 증식에 미치는 영향 실험과 동일한 방법으로 수행하였으며 배양 여액의 농도는 원액과 5, 10, 50, 500배액으로 하여 수행하였고, 5회 반복으로 실험하였다.
방선균 동정
소나무재선충에 대한 살선충 효과가 높았던 YD116 균주의 16S rDNA의 염기서열을 분석하였다. 선발 균주의 chromosomal DNA를 분리한 후 primer 518F (5'-CCAGCAGCCGCGGTAATACG-3')와 800R (5'-TACCAGGGTATCTAATCC-3') primer를 사용하여 94°C에서 1분간 denaturation, 60°C에서 1분간 annealing, 72°C에서 1분 30초 동안 polymerization시키는 조건에서 PCR로 증폭하였다. 증폭된 PCR 결과물을 0.8% agarose gel electrophoresis를 수행한 후 분리 정제하여 ABI PRISM 3700 DNA Analyzer를 이용하여 염기서열을 분석하였다. 분석된 염기서열은 BLASTN 프로그램을 이용하여 GENEBANK의 RDP (RNA database project)를 활용하여 분석하였다.
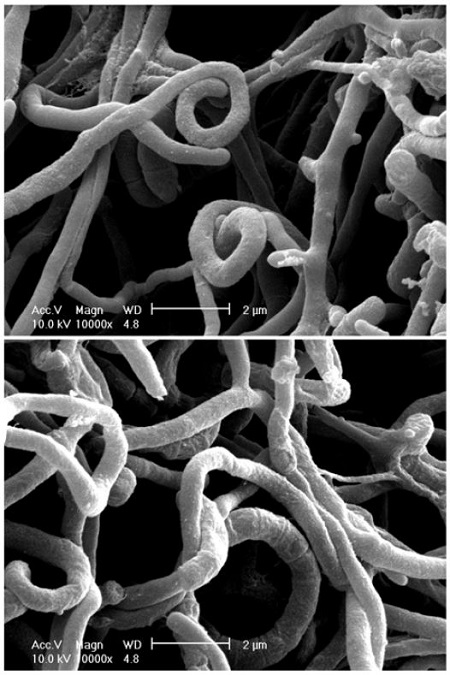
형태적 동정을 위하여 YM agar (YM broth 21 g + agar powder 15 g +증류수 1 l)에 24°C 배양기(HB-303DH-0, Hanbaek Scientific Co.)에서 1주일간 배양한 YD116 균주를 전처리 한 후 전계방출형주사전자현미경(FE-SEM, XL30S FEG, Philips)으로 사진을 촬영하였다.
소나무재선충에 대한 hydrazine hydrate의 살선충 활성 및 증식에 미치는 영향
소나무재선충의 증식에 미치는 영향에서 효과가 있었던 방선균 YD116 균주를 동정한 결과, Streptomyces atratus strain NRRL B-16927로 동정 되었다. S atratus에서는 glucose isomerase (Tashpulatova, 1990), hydrazidomycin (Ueberschaar, 2011)과 malate dehydrogenase (Rommel et al., 1989), N-acylamino acid racemase (Tokuyama et al., 1994)가 분리되었다. 이들 물질 중 세포 독성을 가지고 있는 hydrazidomycin과 유사한 물질이면서 구매가 용이한 hydrazine hydrate를 이용하여 소나무재선충에 대한 살선충 활성을 검정하였다. 살선충 활성은 상기의 실험들과 동일하게 수행하였다. 각각의 conical tube (50 ml, SPL)에 소나무재선충 현탁액(200마리/1 ml)을 5 ml씩 분주한 후 hydrazine hydrate를 2, 20, 200, 2000ppm 농도로 5 ml씩 처리하였다. 무처리는 소나무재선충 현탁액 5 ml와 멸균 증류수 5 ml를 처리하였다. 처리 후 상온에서 48시간 방치 후 1 ml를 취하여 해부현미경(SMZ800, Nikon)으로 선충의 치사 여부를 조사하였다. 실험은 5 반복으로 수행하였다.
Hydrazine hydrate가 소나무재선충의 증식에 미치는 영향을 알아보기 위하여 농도별로 실내 스크리닝 실험에 이용하고 남은 5 ml 중 각각 1 ml 씩 취하여 B. cineria가 충분히 자란 PDA (potato dextrose agar, DifcoTM)평판 배지에 접종 후 20일 동안 24°C의 배양기(HB-303DH-0, Hanbaek Scientific Co.)에 보관하였다. 소나무재선충의 증식 수를 알아보기 위하여 밀도를 조사하였는데 깔때기법을 이용하여 소나무재선충을 배지로부터 분리하여 해부현미경으로 조사하였다. 각 처리구 모두 4 반복씩 수행하였다.
통계분석
실험 결과는 Tukey's HSD test로 처리평균간 차이를 분산 분석하였다(Analytic software, 2003). 결과는 평균 ± 표준편차로 표기하였다.
결 과
소나무재선충에 대한 방선균의 살선충 활성 검정
방선균 배양 여액 2배액의 소나무재선충에 대한 살선충활성은 Table 2와 같다. 상주 갑장산 지역에서 분리한 SG4, SG7, SG8, SG16, SG17 균주의 보정사충률이 100%를 나타내었으며 전체적으로 보정사충률이 90% 이상인 처리구는 모두 21개 였다(df=33, 102, F=82.1, P<0.0001). 이들 균주들 중 효과가 높은 15 개의 균주를 선발하여 2차와 3차 살선충 활성을 검정하였다(Table 3).

Effect of Actinomycetes on mortality of Bursaphelenchus xylophilus after 48h exposure in 2 fold aquatic suspension
2배액에서 효과가 높았던 15개 방선균 균주를 이용하여 4배액에서 소나무재선충에 대한 살선충 활성을 검정한 결과, SG16 균주의 보정사충률이 81.3%로 가장 높았으며 YD419 균주를 비롯한 10개 균주가 70% 이상의 보정사충률을 보였다(Table 3; df=15, 48, F=61.1, P<0.0001).

Effect of Actinomycetes on mortality of Bursaphelenchus xylophilus after 48h exposure in 4 and 10 fold aquatic suspension
방선균 배양액 10배액에 대한 소나무재선충 살선충율은 전체적으로 20~50%대로 낮았는데 MS415 균주와 SG16 균주의 보정사충률이 가장 높았다(Table 3; df=15, 48, F=12.4, P<0.0001).
방선균이 소나무재선충의 증식에 미치는 영향
방선균 배양 여액이 증식에 미치는 영향을 알아보기 위하여 20배액 배양 여액에 대한 상대적 증식 증가율을 알아본 결과는 Table 4와 같다. AM210, SG16, YD116, YD315 균주에서 소나무재선충의 증식률이 10% 미만으로 다른 처리에 비하여 증식억제 효과가 높았다(df=32, 66, F=16.8, P<0.0001).
YD116 균주의 농도별 살선충 활성 및 증식 영향
방선균 균주의 배양 여액 중에서 소나무재선충의 증식 증가율이 낮았던 방선균 중 YD116 균주를 선별하여 농도별 살선충 활성을 검정한 결과는 Table 5와 같다. 배양 여액 2배 희석액에서는 모든 소나무재선충이 치사되었으나 10배액에서는 38.8%의 보정사충률을 보였고, 20배액 이상에서는 치사율이 급격히 낮아졌다(df=5, 24, F=137, P<0.0001).
YD116 균주 배양 여액에서 소나무재선충의 증식 수를 조사한 결과는 Table 5와 같았다. 2배액에서는 증식이 전혀 이루어지지 않았으며 10배액에서 1000배액까지는 증식은 이루어졌으나 무처리 대비 증식억제율은 98.7% 이상으로 높게 나타났다(df=5, 12, F=7.3, P<0.005).
방선균 동정
증식 억제 효과가 뛰어난 YD116 균주를 16S rDNA의 염기서열을 분석하여 BLASTN 프로그램을 이용하여 GENEBANK와 RDP (RNA database project)의 ribosomal RNA sequencing과 비교한 결과, Streptomyces atratus strain NRRL B-16927과 100%의 상동성을 보였으며 S. sanglieri strain NBRC 100784와는 99%의 상동성을 보였다(Fig. 1). 이에 따라 선발된 균주는 S. atratus YD116으로 명명하였다.
YD116 균주의 형태적 특징은 Yeast Mold 배지 상에서 초기에는 연노란색의 투명한 기중균사를 형성하다 이후 흰색의 기중 균사를 형성하였고, 기중 균사의 두께는 0.7 μm 내외로 일부가 코일처럼 말리는 모양을 형성하였다(Fig. 2A). 성숙해진 균사는 0.7 μm 내외로 분할되어 포자를 형성하였다(Fig. 2B). 이러한 특징은 Shibata et al. (1962)이 보고한 S. atratus와의 형태적 특징과 유사하였다.

16S rDNA sequences of Actinomycetes YD116 isolate. This isolate was identified as Streptomyces atratus based on the 100% similarity to the species.
소나무재선충에 대한 Streptomyces atratus분리 유사물질 hydrazine hydrate의 활성 검정
방선균 배양 여액 중 소나무재선충의 증식 억제 효과가 높았던 YD116을 동정한 결과 S. atratus YD116으로 동정되었는데 S. atratus에서는 다양한 물질들이 확인되어 있다. 이들 중 세포독성을 가지는 것으로 알려진 hydrazidomycin과 유사한 hydrazine hydrate를 이용하여 농도별로 소나무재선충의 살선충 활성을 검정한 결과 Table 6과 같이 농도별로 차이를 보였는데 100 ppm 이상에서 87.9% 이상의 보정사충률을 보였다(df=4, 20, F=62.4, P<0.0001).
Hydrazine hydrate를 이용하여 소나무재선충 증식에 미치는 영향을 검정한 결과는 Table 6과 같이 1000 ppm에서는 증식이 일어나지 않았으나 통계적 유의성은 없었다(df=4, 10, F=3.43, P<0.0518).
고 찰
소나무재선충병은 현재 우리나라 산림에서 가장 위협이 되고 있는 병으로 지속적인 방제작업에도 불구하고 1988년 이래 매년 피해면적이 증가하고 있다(Shin, 2008; KFS, 2013). 소나무재선충병에 의한 손실은 전 세계적으로 연 10억$ 정도로 추산되고 있다(Hajime et al., 2001). 때문에 소나무재선충병 방제를 위한 다양한 방법들이 연구되고 있는데 주로 소나무재선충 자체를 대상으로 하는 연구와 소나무재선충의 매개충을 대상으로 하는 연구 또는 소나무의 저항성을 이용하는 연구들이 이루어지고 있다(Kamata, 2008; Nose and Shiraishi, 2008; Shimazu, 2008).
이들 중 소나무재선충을 대상으로 하는 연구는 살선충 활성을 가지는 농약의 선발이나 이용(Takai et al., 2000; Lee et al., 2009), 소나무재선충에 살선충 활성을 가지는 식물체의 탐색과 유용물질의 분리(Kong et al., 2006; Kang et al., 2013), 살선충 활성 미생물의 탐색(Kwon et al., 2007; Lee et al., 2008a; Park et al., 2008) 등에 관한 연구들이 있는데 Streptomyces avermitilis에서 분리 된 abamectin과 같이(Tomlin, 2006) 실용화된 경우는 매우 제한적인 실정이다.
소나무림과 같은 산림생태계는 일반 농업생태계와는 달리 해충군과 천적군의 먹이사슬이 안정화되어 특정 해충 방제를 대상으로 다량의 화학적 방제제를 투입할 경우 산림 생태계에 다양한 악영향을 미칠 수 있다(Siemann et al., 2004). 따라서 비록 당장 실용적으로 사용할 수 없는 연구일지라도 기존의 화학적 방제를 대체할 수 있는 친환경적 방제 방법에 대한 다양한 연구가 지속적으로 필요하다.
방선균은 1963년 Micromonospora속으로부터 gentamicin이 발견된 이래(Weinstein et al., 1963) 생물 소재산업에서 다양한 유용물질 탐색원으로 이용되고 있다(Porter and Fox, 1993). 이러한 방선균들은 주로 토양으로부터 분리되고 있는데(Lim et al., 2007) 소나무재선충에 대한 살선충 활성방선균도 Park et al. (2010)에 의하여 보고된 바 있다. 본 연구에서도 3개도 4개시의 다섯 지역 산림토양으로부터 방선균을 분리하여 소나무재선충에 대한 살선충 활성과 증식억제력을 검정하였는데 2배 농도의 배양 여액에서 소나무재선충을 100% 치사시키는 5개의 균주를 확인할 수 있었으며 90% 이상의 방제가를 보이는 균주는 전체 실험 균주의 65.6%인 21개 균주였다. 또한, 10개 균주에서 통계적으로 유의한 증식억제 효과를 보였다. 살선충 효과가 높으면서 증식억제 효과가 있는 4개의 방선균 균주(AM210 균주와 SG16, YD315, YD116 균주)는 무처리 대비 상대적 소나무재선충 증식률이 10% 이하로 매우 낮았다. 이 균주 중 YD116 균주를 동정한 결과 S. atratus YD116으로 확인되었다. 이 균주는 배양 여액 2배액에서는 소나무재선충에 대한 살선충 활성이 100%를 보였으며 증식억제도 100%를 보였으나 10배액에서는 활성이 떨어졌다.
S. atratus는 1962년 Shibata et al.에 의해 동정되었는데 이들이 ilamycin을 생산하고 이외에도 항산성 세균에 활성을 가지는 rufomycin A와 B를 생산하는 것으로 밝혔다. 또한, Ueberschaar et al. (2011)에 의해 세포독성을 가지는 hydrazidomycin A와 B, C가 확인된 바 있다. 그러나 이 균의 살선충 활성에 대한 연구는 전혀 수행된 바 없어 본 연구에서는 이 균이 생산하는 물질 중 hydrazidomycin과 유사하면서 구입이 용이한 유사물질인 hydrazine hydrate를 이용하였는데 1,000 ppm에서는 살선충과 선충증식 억제효과가 높았으나 1 ppm 농도에서는 살선충 활성이 현저히 감소하였다.
Hydrazine은 농약이나 폴리머, 의약품, 염료 등으로 활용되는데 hydrazine hydrate는 청관제나 귀금속의 정제나 불순물 제거 시 환원제로 사용되는데 유도체는 의약품이나 식물생장 억제제 등으로 사용되고 있다(Schmidt, 1984; Meyer et al., 2013). 특히 hydrazine RH-5948이나 RH-5992, RH-0345와 같은 비스테로이드계 엑디스테로이드 길항제는 곤충과 같은 절지동물류의 탈피과정에 관여하는 호르몬의 하나인 엑디스테로이드 수용체에 결합하여 엑디스테로이드 호르몬의 생물적 반응을 유기하여 해충방제제로의 활용가능성이 있는 것으로 알려져 있는 물질이다(Klowden, 2009).
본 연구에서는 소나무재선충에 살선충 활성이 있는 새로운 방선균 균주들의 탐색과 이들 중 일부 균주의 활용 가능성을 확인할 수 있었는데 소나무 수체 내에서 이동과 소나무재선충에 대한 활성 여부 및 살선충 활성 물질들에 대한 연구들은 추가로 수행되어야 할 것으로 생각된다.
Literature cited
- Analytical Software, (2003), Statistix 8 user's manual, Tallahassee, FL, p369.
- Cheng, H. R., M. Lin, W. Li, and Z. Fang, (1983), The occurrence of a pine wilting disease caused by a nematode found in Nanjing, Forest Pest and Disease, 4, p1-5.
-
Dwinell, L. D., (1997), The pinewood nematode: regulation and mitigation, Ann. Rev. Phytopathol, 35, p153-166.
[https://doi.org/10.1146/annurev.phyto.35.1.153]

-
Hajime, K., A. Takuya, O. Nobuo, T. Katsuhiro, and K. Tomoya, (2001), Pine wilt disease caused by the pine wood nematode: the induced resistance of pine trees by the avirulent isolates of nematode, Eur. J. Plant Pathol, 107, p667-675.
[https://doi.org/10.1023/A:1011954828685]

-
Kamata, N., (2008), Integrated pest management of pine wilt disease in Japan; tactics and strategies, In Pint wilt disease: Zhao, B. G. Eds, Springer, Japan, p304-322.
[https://doi.org/10.1007/978-4-431-75655-2_32]

-
Kang, J. S., E. A. Kim, S. H. Lee, and I. K. Park, (2013), Inhibition of acetylcholinesterases of the pinewood nematode, Bursaphelenchus xylophilus, by phytochemicals from plant essential oils, Pestic. Biochem. Physiolo, 105, p50-56.
[https://doi.org/10.1016/j.pestbp.2012.11.007]

- Katz, E., and A. Demain, (1997), The peptide antibiotics of Bacillus: chemistry, biogenesis and possible functions, Bacteriol. Rev, 41, p449-474.
- KFS (Korea Forest Service), (2012), Statistical yearbook of forestry 2012, Daejeon, Korea.
- KFS (Korea Forest Service), (2013), Statistical yearbook of forestry 2013, Daejeon, Korea.
- Kim, S. G., C. H. Kim, and C. G. Lee, (2004), Bioscience and Actinomycetes, Worldscience, Seoul, Korea.
- Kishi, Y., (1995), The pine wood nematode and the Japanese pine sawyer, Thomas Company Limited, Tokyo, Japan, p302.
- Klowden, M. J., (2009), Physiological systems in insects, GCO Sciences, Korea.
-
Kong, J. O., S. M. Lee, Y. S. Moon, S. G. Lee, and Y. J. Ahn, (2006), Nematicidal activity of plant essential oils against Bursaphelenchus xylophilus (Nematoda: Aphelenchoididae), J. Asia-Pacific Entomol, 9(2), p173-178.
[https://doi.org/10.1016/S1226-8615(08)60289-7]

-
Kwon, H. R., S. W. Son, H. R. Kim, G. J. Choi, K. S. Jang, Y. H. Choi, S. Lee, N. D. Sung, and J. C. Kim, (2007), Nematicidal activity of bikaverin and fusaric acid isolated from Fusarium oxysporum against pine wood nematode, Bursaphelenchus xylophilus, Plant Pathol. J, 23(4), p318-321.
[https://doi.org/10.5423/PPJ.2007.23.4.318]

-
Lange, L., J. Breinholt, F. W. Rasmussen, and R. I. Nielsen, (1993), Microbial fungicide the natural choice, Pestic. Sci, 39, p155-160.
[https://doi.org/10.1002/ps.2780390209]

-
Lee, G. J., C. D. Koo, and J. H. Sung, (2008a), Characteristics of pinewood nematode trapping by nematophagous Arthrobotrys spp, Kor. J. Mycol, 36(2), p153-162.
[https://doi.org/10.4489/KJM.2008.36.2.153]

- Lee, S. M., D. S. Kim, C. S. Kim, H. Y. Choo, and D. W. Lee, (2008b), Possibility of simultaneous control of pine wilt disease and Thecodiplosis japonensis and or Matsucoccus thunbergianae on black pine (Pinus thunbergii) by abamectin and emamectin benzoate, Korean J. Pestic. Sci, 12(4), p363-367.
- Lee, S. M., D. S. Kim, S. G. Lee, N. C. Park, and D. W. Lee, (2009), Selection of trunk injection pesticides for preventive of pine wilt disease by Bursaphelenchus xylophilus on japanese black pine (Pinus thunbergii), Korean J. Pestic. Sci, 13(4), p267-274.
- Lee, S. M., Y. S. Moon, Y. J. Chung, S. G. Lee, D. W. Lee, H. Y. Choo, and C. G. Park, (2003), Toxic effects of some insecticides on the Japanese pine sawyer, Monochamus alternatus, J. Kor. For. Soc, 92(4), p305-312.
- Lee, S. M., S. G. Lee, C. S. Kim, Y. S. Moon, J. B. Kim, N. C. Park, D. S. Kim, H. M. Cheon, S. T. Lee, H. S. Noh, and H. S. Heo, (2006), Knowing pine wilt disease right, Korea Forest Research Institute (KFRI), Seoul, Korea.
-
Lim, T. H., S. H. Cho, and J. H. Kim, (2007), Effects of Streptomyces sp. MG 121 on growth of pepper plants and antifungal activity, Res. Plant Dis, 13(2), p93-97.
[https://doi.org/10.5423/RPD.2007.13.2.093]

- Mamiya, Y., (1988), History of pine wilt disease in Japan, J, Nematol, 20, p219-226.
-
Meyer, F., N. Ueberschaar, H. M. Dahse, and C. Hertweck, (2013), Synthesis and biological evaluation of hydrazidomycin analogues, Bioorg. Med. Chem. Lett, 23, p6043-6045.
[https://doi.org/10.1016/j.bmcl.2013.09.033]

- MLTM (Minister of Land, Transport and Maritime Affairs), (2012), Statistical yearbook of Ministry of Land, Transport and Maritime Affairs 2012, Sejong, Korea.
- Moon, Y. S., S. M. Lee, J. D. Park, and W. H. Yeo, (1995), Distribution and control of the pine wood nematode, Bursaphelenchus xylophilus and its vector Japanese pine sawyer, Monochamus alternatus, FRI. J. For. Sci, 51, p119-126.
-
Mota, M. M., H. Braasch, M. A. Bravo, A. C. Penas, W. Burgenrmeister, K. Metge, and E. Sousa, (1999), First report of Bursaphelenchus xylophilus in Portugal and in Europe, Nematology, 1, p727-734.
[https://doi.org/10.1163/156854199508757]

-
Mota, M. M., and P. C. Vieira, (2008), Pine wilt disease in Portugal, In Pine wilt disease: Zhao, B. G. Eds, Springer, Japan, p33-38.
[https://doi.org/10.1007/978-4-431-75655-2_6]

- MRDB (Microbial Resources Data Base), www.mrdb.or.kr.
-
Nose, M., and Shiraishi, S., (2008), Breeding for resistance to pine wilt disease, In Pine wilt disease: Zhao, B. G. Eds, Springer, Japan, p334-350.
[https://doi.org/10.1007/978-4-431-75655-2_34]

- Park, D. J., J. C. Lee, P. K. Kim, and C. J. Kim, (2008), Isolation and identification of Micromonospora sp. showing nematocidal activity against pine wood nematode, Korean J. Pestic. Sci, 12(1), p97-101.
- Park, D. J., J. C. Lee, Y. H. Chang, and C. J. Kim, (2010), Control effects of Micromonospora sp. AW050027 by media optimization and microbial treatment against pine wood nematode, Kor. J. Pestic. Sci, 14(2), p138-147.
-
Porter, N., and F. M. Fox, (1993), Diversity of microbial products-discovery and application, Pestic Sci, 39, p161-168.
[https://doi.org/10.1002/ps.2780390210]

-
Rommel, T. O., H. K. Hund, A. R. Speth, and F. Lingens, (1989), Purification and N-terminal amino-acid sequences of bacterial malate dehydrogenases from six actinomycetales strains and from Phenylobacterium immobile, strain E, Biol. Chem. Hoppe-Seyler, 370(7), p763-768.
[https://doi.org/10.1515/bchm3.1989.370.2.763]

- Schmidit, E. W., (1984), Hydrazine and its derivatives: preparation, properties and applications, Wiley, New York, U.S.A.
-
Shibata, M., E. Higashide, H. Yamamoto, and K. Nakazawa, (1962), Studies on Streptomycetes part I. Streptomyces atratus nov. sp., producing new antituberculous antibiotics rufomycin A and B, Agr. Biol. Chem., 26(4), p228-233.
[https://doi.org/10.1271/bbb1961.26.228]

-
Shimazu, M., (2008), Biological control of the Japanese pine sawyer beetle, Monochamus alternatus, In Pine wilt disease: Zhao, B. G. Eds, Springer, Japan, p351-370.
[https://doi.org/10.1007/978-4-431-75655-2_35]

-
Shin, S. C., (2008), Pine wilt disease in Korea, In Pine wilt disease Zhao, B. G. Eds, Springer, Japan, p26-32.
[https://doi.org/10.1007/978-4-431-75655-2_5]

-
Siemann, E., W. P. Carson, W. E. Rogers, and W. W. Weisser, (2004), Reducing herbivory using insecticides, In Insects and ecosystem function Weisser, W. W. Eds, Springer, Germany, p303-327.
[https://doi.org/10.1007/978-3-540-74004-9_15]

-
Takai, K., T. Soejima, T. Suzuki, and K. Kawazu, (2000), Emamectin benzoate as a candidate for a trunk-injection agent against the pine wood nematode, Bursaphelenchus xylophilus, Pest Manag. Sci, p937-941.
[https://doi.org/10.1002/1526-4998(200010)56:10<937::AID-PS213>3.0.CO;2-B]

-
Takeuchi, Y., (2008), Host fate following infection by the pine wood nematode, In Pine wilt disease Zhao, B. G. Eds, Springer, Japan, p235-249.
[https://doi.org/10.1007/978-4-431-75655-2_23]

-
Tashpulatova, B. A., Z. K. Dierov, and K. D. Davranov, (1990), Isolation, purification, and some physicochemical properties of glucose isomerase from Streptomyces atratus, Chem. of Nat. Comp, 26(4), p444-447.
[https://doi.org/10.1007/BF00599002]

-
Tokuyama, S., H. Miya, K. Hatano, and T. Takahashi, (1994), Purification and properties of a novel enzyme, N-acylamino acid racemase, from Streptomyces atratus Y-53, Appl. Microbiol. Biotechnol, 40(6), p835-840.
[https://doi.org/10.1007/BF00173984]

- Tomlin, C. D. S., (2006), A world compendium, The pesticide manual, BCPC, Hampshire, UK.
-
Ueberschaar, N., B. S. Ndejouong, L. Ding, A. Maier, H. Fiebig, and C. Hertweck, (2011), Hydrazidomycins, cytotoxic alkylhydrazides from Streptomyces atratus, Bioorg. Med. Chem. Lett, 21(19), p5839-5841.
[https://doi.org/10.1016/j.bmcl.2011.07.108]

- Weinstein, M. J., G. M. Luedmann, E. M. Oden, and G. H. Wagmn, (1963), Gentamicin, a new broad-spectrum antibiotic complex, Antimicrob. Agents Chemother, p1-7.
- Yang, B. J., (2002), Advance in research of pathogenetic mechanism of pine wood nematode, For. Pest Dis, 1, p27-31.
- Yano, M., (1913), Investigations on the cause of pine mortality in Nagasaki prefecture, Sanrin-Koho, 4, p1-14.
- Yi, C. K., B. H. Byun, J. D. Park, S. I. Yang, and K. H. Chang, (1989), First finding of the pine wood nematode, Bursaphelenchus xylophilus (Steiner et Buhere) Nickle, and its insect vector in Korea, Res. Rep. For. Res. Inst, 38, p141-149.