가스 크로마토그래피를 이용한 수입농산물 중 국내 미등록 농약의 다성분 동시분석법 적용
초록
본 연구는 한국의 주요 농식품 수입대상국인 중국과 동남아국가에서 사용하고 있는 국내 미등록 농약 중 GC/ECD 및 GC/NPD로 분석 가능한 농약 24종에 대하여 농산물안전성 분석을 위한 다성분 잔류분석법을 확립하고자 오렌지, 현미, 바나나를 대표 농산물로 선정하여 식품공전상의 다종농약 다성분 동시분석법 적용 시험을 실시하였다. 시료의 추출은 acetonitrile을 사용하였고, 추출 후 잔류물은 Florisil SPE cartridge를 이용해 정제한 다음, GC/ECD 및 GC/NPD로 기기분석 하였다. 분석법의 유효성 확인을 위해 농산물 시료에 첨가농도 0.02~0.05, 0.2 mg/kg 수준에서 위의 분석법을 적용하여 회수율 실험을 진행하였으며 분석법의 정량한계는 0.02~0.05 mg/kg, 직선성은 0.05~5 mg/kg 범위에서 R2> 0.99 이상으로 나타났다. GC/ECD로 분석한 평균 회수율은 공통적으로 분석되지 않은 3성분(ethiprole, picloram, sulcotrione) 및 회수율 초과한 성분을 제외한 농약에 대해 0.02(0.05) mg/kg 수준에서 70.3%~114.1%로 나타났고, 0.2 mg/kg 수준에서 71.9%~117.6%로 나타났다. GC/NPD로 분석한 평균 회수율은 0.02 mg/kg 수준에서 71.2%~119.9%, 0.2 mg/kg 수준에서 82.7%~115.0%로 나타났으며 20% 이내의 변이계수 조건을 충족시켰다. 잔류분석의 확인분석을 위해 GC/MS를 이용하여 GC/ECD 및 GC/NPD로 분석된 성분에 대한 total-ion chromatogram (TIC)을 획득하고 각 성분의 mass spectrum을 해석하여 각 성분의 재확인을 위한 이온을 선정하였다. 본 연구에서 검토된 농약 24종 중 19종은 식품공전상의 잔류농약분석법의 적용이 가능하여 수입농산물의 분석에 사용될 수 있을것으로 판단된다.
Abstract
The multiresidue method 4.1.2.2 in Korea Food Code was extended for the analysis of 24 unregistered pesticide residues. The method includes acetonitrile extraction, liquid-liquid partition, Florisil SPE clean-up and GC analysis. The limits of quantification (LOQ) range of the method was 0.02~0.05 mg/kg for orange, brown rice and banana. The linearity for targeted pesticides were R2 > 0.99 at the level ranged from 0.05 to 5 mg/L. Recovery test was performed at two concentration levels of LOQ and 4~10 times of LOQ. Recoveries and relative standard deviations (RSDs) of target pesticides were acceptable, showing 70~120% range and less than 20%, respectively, except for ethiprole, picloram and sulcotrion. This method is effectively applicable to routine analysis of target pesticides in orange, brown rice and banana.
Keywords:
Pesticide residue, Unregistered pesticide, Multiresidue analysis, GC키워드:
잔류농약, 미등록 농약, 분석법, 가스크로마토그래피서 론
1995년 WHO출범 이후 국가 간 자유무역협정(FTA) 체결 확대로 교역이 활발해지면서 우리나라에서도 수입농산물이 증가하는 추세에 있다. 2010년도에는 중국, 일본, 미국 등 129개 국가(제조국 기준)로부터 총 312,723건, 중량은 13,471톤, 금액으로는 13,195백만 달러 수입되어 1995년도 대비 건수는 229%, 중량은 44%, 금액은 362% 증가하였다(식품 등의 수입신고 및 검사연보, 2012). 이처럼 수입농산물의 수입량은 계속 증가하고 있으며, 이에 수입농산물에 대한 소비자의 수요도 증가함에 따라 수입농산물의 안전성에 대한 소비자들의 우려도 점점 커지고 있다. 따라서 국내 소비 농산물의 안전성을 확보하기 위해서는 수입농산물에 대한 잔류농약의 지속적인 모니터링이 필요하다. 현재 세계 각국에서는 농산물 안전성 확보를 위하여 자국에서 생산된 농산물뿐만 아니라 수입산 농산물에 대해서도 유해물질 규제와 검역기준을 대폭 강화하였다(Kim 등, 2012). 또한 식품을 통해 섭취될 수 있는 잔류농약에 대한 안전성을 확보하기 위하여 국가마다 식품에 대한 잔류허용기준을 설정하여 관리하고 있으며, CODEX를 통해 공통의 기준을 정하여 국가간 교역 시 기준으로 활용하고 있다. 수입농산물의 경우 우리나라에 등록되지 않은 농약을 사용하였을 경우에 대비하여 국내에 미등록 된 농약을 대상으로 공정분석법을 확립하고자 일부 연구들이 진행되었다(Chang 등, 2012; Do 등, 2013; Jeon 등, 2011; Jeon 등, 2012). 국내에 등록되어 있지 않으나 수입 식품 중 잔류 가능성이 있는 농약은 국내에서 제대로 관리해야 하며, 새로운 농약의 등록과 기존 농약에 대한 추가적 위해성 연구가 지속적으로 수행되기 위해서는 신뢰성 있는 공정 잔류분석법 확보가 필수적이라 할 수 있을 것이다(Chang 등, 2012). 따라서 본 연구는 한국의 주요 농식품 수입대상국인 중국 산동성과 동남아국가에서 사용하고 있는 농약 중 국내에 등록되지 않은 농약에 대한 잔류분석법을 확립하기 위하여 gas chromatography (GC)로 분석 가능한 농약 24종에 대하여 오렌지, 현미, 바나나를 대표 농산물로 선정하여 식품공전상의 다종농약 다성분 동시분석법 적용 시험을 수행하였다.
재료 및 방법
농산물 시료
대표농산물은 2012년도 농산물 수입량을 조사(한국농수산식품유통공사, 2012)하여 수입이 많았던 농산물 중 과실류의 경우 오렌지, 바나나, 곡류의 경우 현미를 선정하였고 각각 1 kg씩 준비하였다. 준비된 시료의 전처리는 식품공전 및 농촌진흥청 잔류성 시험기준 및 방법에 따라 현미의 경우 표준체 420 μm를 통과하도록 분쇄하였고, 바나나는 꼭지부분을 제거하여 분쇄하였으며, 오렌지는 과실전체를 분쇄하여 -20°C에서 냉동보관하였다.
농약표준용액 및 시약
농약 24종의 표준품은 Dr. Ehrenstorfer GmbH (Germany), Chem service (USA), Accustandard (USA)의 제품을 사용하였다. 각각의 농약은 용해도에 따라 acetone과 acetonitrile을 이용하여 1,000 mg/L의 stock solution을 조제하고 분석 그룹별 혼합표준용액 10 mg/L를 만들어 0.05, 0.1, 0.25, 0.5, 1, 2.5, 5 mg/L가 되도록 acetone/n-hexane (20/80, v/v)에 희석하여 working solution 으로 사용하였으며, GC 크로마토그램의 peak 면적을 기준으로 각각의 농약에 대한 표준검량선을 작성하였다. 분석에 사용된 acetone, acetonitrile, n-hexane, sodium chloride 및 sodium sulfate는 Merck사 (Darmstadt, Germany)의 잔류분석용 시약을 구입하여 사용하였으며, 정제에 사용된 Solid Phase Extraction (SPE) cartridge는 phenomenex사(Torrance, CA)의 Strata Florisil (500 mg, 6 mL) 제품을 사용하였다.
전처리 방법
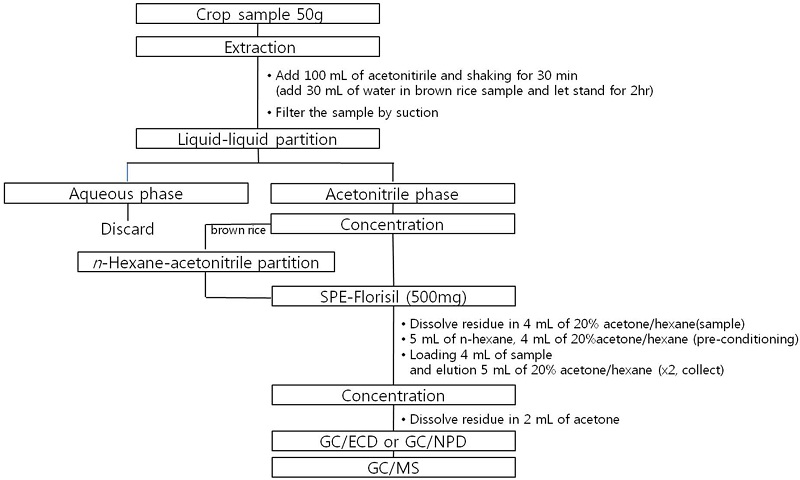
현미 분쇄한 시료 50 g에 물 30 mL를 넣고, 2시간 습윤화시켜 분석 시료로 사용하였고, 분쇄한 오렌지 및 바나나 시료 50 g을 습윤화 과정 없이 시험에 사용하였다. 각각의 시료 50 g에 100 mL의 acetonitrile을 정확히 가하고 혼합추출 분쇄기로 1분간 균질화 시켜 30분간 300 rpm에서 진탕추출 하였다. 추출물을 흡인여과하고 NaCl 10 g을 가하여 약 2분간 격렬하게 진탕한 다음 정치한 후, acetonitrile-water층을 분리하였다. Acetonitrile층을 무수황산나트륨에 통과시켜 탈수한 후 20 mL를 취하여 40°C 이하의 수욕상에서 1 mL 정도의 용매가 남을 때까지 감압농축하고 질소기류 하에서 서서히 증발, 건고 한 후 건고물을 4 mL의 acetone/n-hexane (20/80, v/v)으로 재용해하여 SPE-Florisil cartridge (500 mg)로 정제하였다. n-Hexane 5 mL와 acetone/n-hexane (20/80, v/v) 5 mL로 활성화 시킨 SPE-Florisil cartridge에 acetone/n-hexane (20/80, v/v)으로 재용해 한 시료 4 mL를 가하고, 계속해서 acetone/n-hexane (20/80, v/v) 5 mL로 용출시켰다. 용출액을 질소기류 하에서 증발시킨 후 acetone/n-hexane (20/80, v/v) 2 mL로 재용해하여 GC/ECD 및 GC/NPD로 분석하였다(Fig. 1).
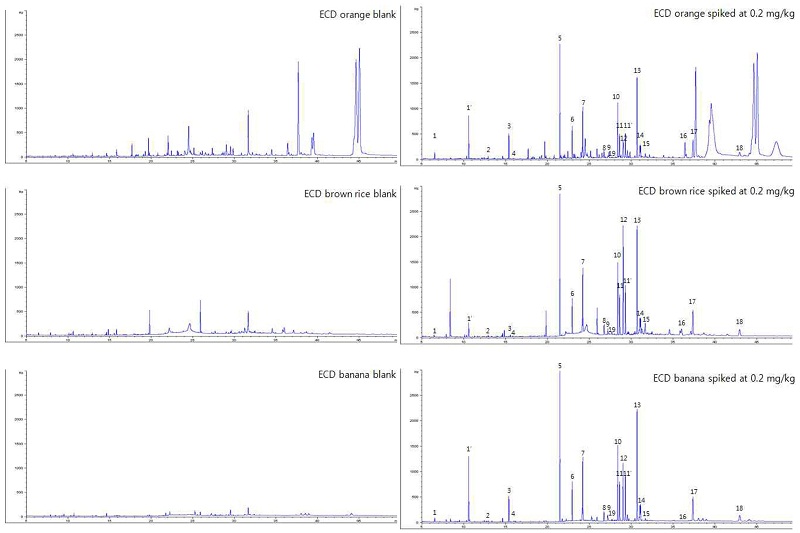
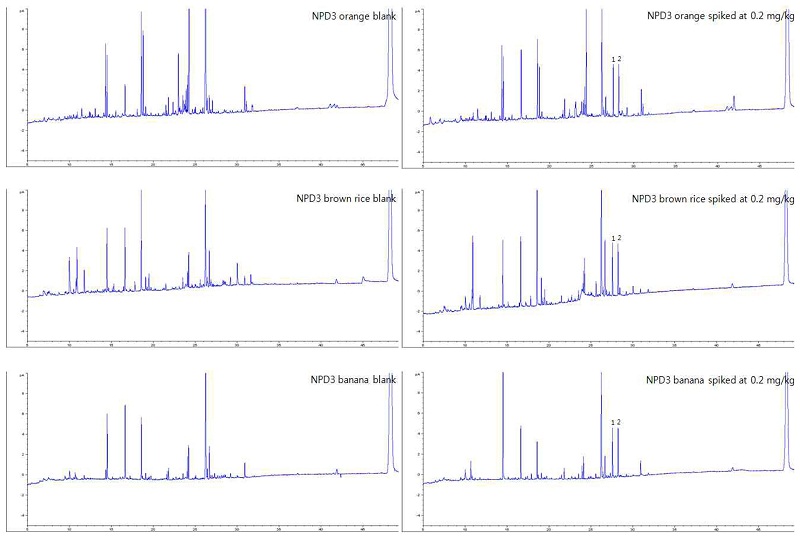
GC/ECD chromatograms of orange, brown rice and banana extracts; blank (left) and spiked at 0.2 mg/kg (right).
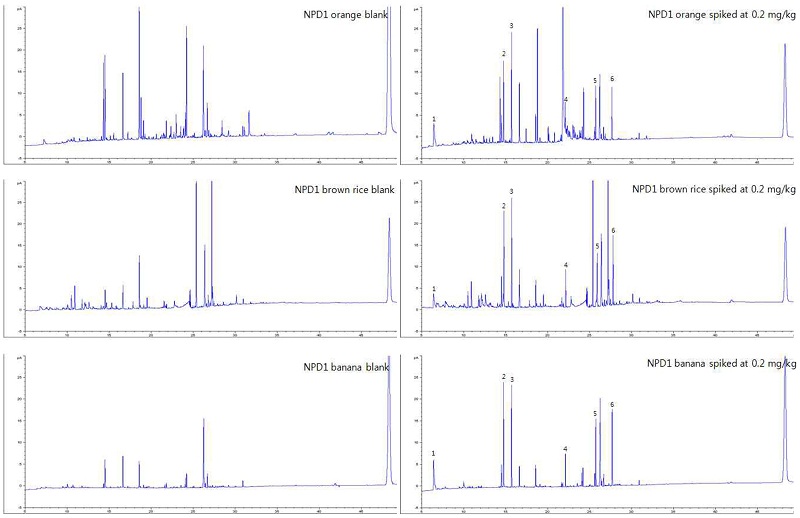
GC/NPD group 1 chromatogram of orange, brown rice and banana extracts: blank (left) and spiked at 0.2 mg/kg (right).
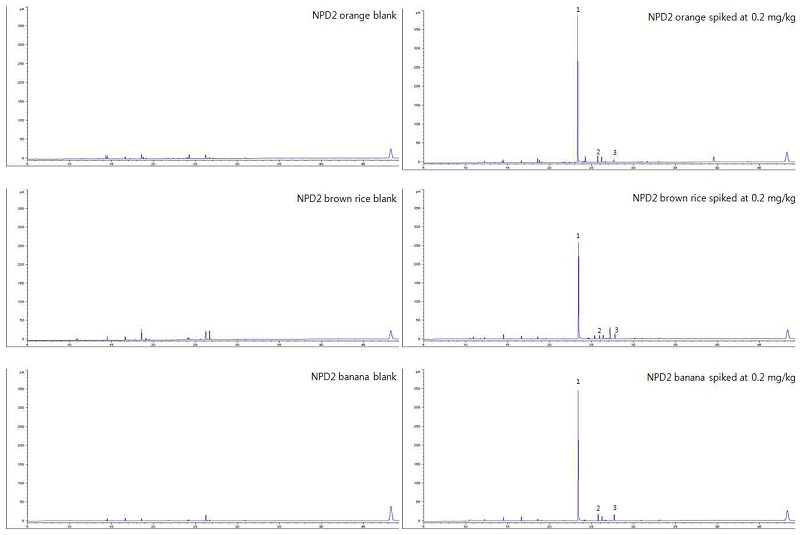
GC/NPD group 2 chromatogram of orange, brown rice and banana extracts: blank (left) and spiked at 0.2 mg/kg (right).
회수율 시험
본 연구에서 확립한 농약 다성분잔류분석법의 효율 및 신뢰성을 검증하기 위하여 회수율 시험을 수행하였다. 무처리 시료 50 g에 기기 검출 감도를 고려한 최저농도를 LOQ로 하여 첨가농도가 0.02 mg/kg, 0.2 mg/kg이 되도록 표준용액을 첨가한 다음 상기 전처리방법에 따라 회수율 시험을 하였다. 기기 감도가 낮은 농약에 대해서는 최저 첨가농도를 0.04 mg/kg 또는 0.05 mg/kg으로 조절하여 시험하였다.
GC 기기분석 조건
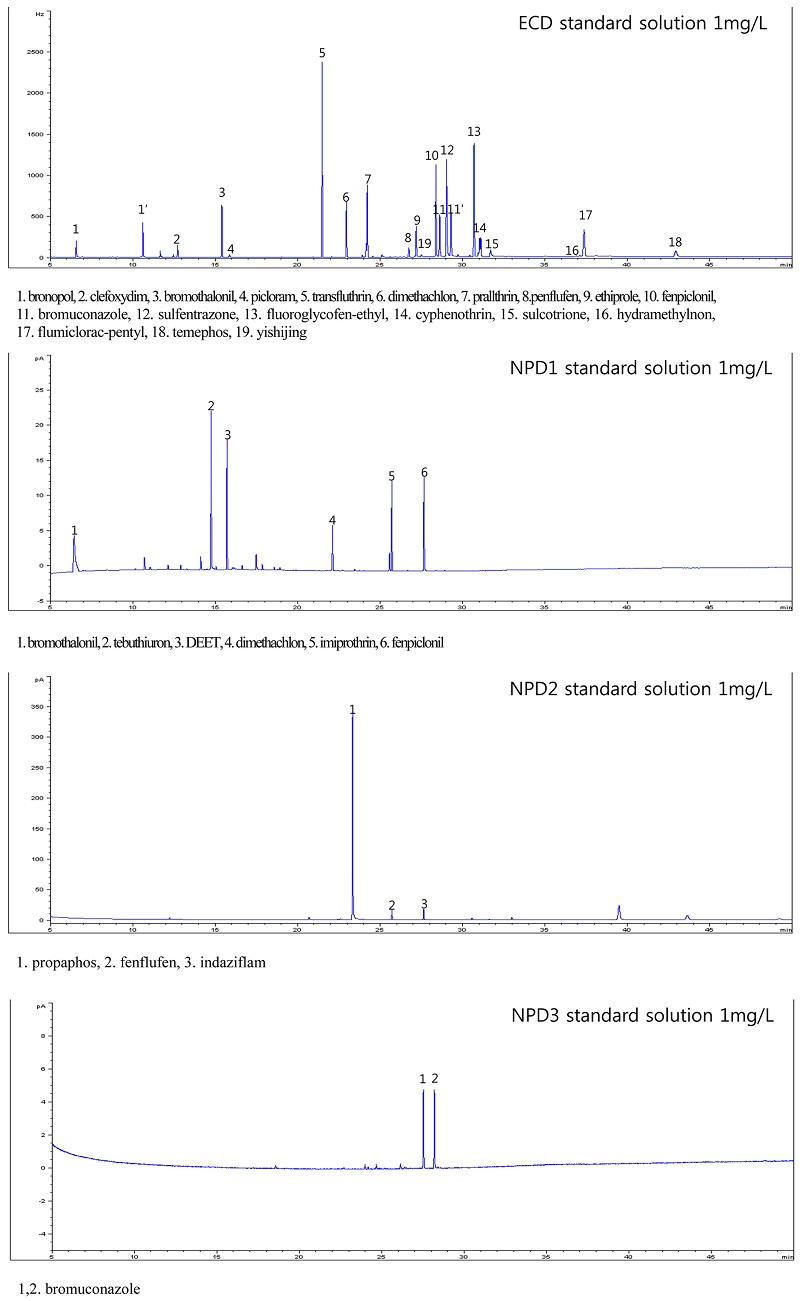
GC분석을 위해 머무름 시간, 농약의 물리화학적 특성 및 검출기에 대한 반응성에 따라 GC/ECD 1개 그룹과 GC/NPD 3개 그룹으로 분류하여 분석하였다(Table 2). 이는 정량분석을 할 때 머무름 시간의 겹침으로 인한 정량분석의 어려움을 예방하고자 retention time이 미세하게 차이나거나 겹치는 성분을 회피하여 농약 분석그룹을 분류하였다. 대상 농약의 분석은 μECD (63Ni micro-electron capture detector)와 NPD (nitrogen-phosphorous detector)가 장착된 Agilent 7890 GC (USA)를 사용하였고, 자세한 분석조건은 Table 3에 나타내었다.
GC/MS에 의한 분석성분 재확인
GC/ECD 및 GC/NPD로 확립한 분석법에서 검출된 잔류분의 재확인을 위해 GC/MS의 분석조건을 확립하였다. 분석조건은 Table 3에 나타냈으며 분자량 범위를 50~500 m/z로 스캔하여 Total ion chromatogram (TIC)에서 얻은 각 분석성분의 EI (Electron ionization) mass spectrum으로부터 intensity를 고려하여 최적 fragment ion을 선정하였다.
결과 및 고찰
전처리 및 기기분석 조건 검증
분석법을 확립하기 위해 먼저 식품공전의 다종농약다성분 분석법-제2법에 제시되어 있는 acetone추출법과 acetonitrile 추출법을 모두 적용하여 효과적인 분석방법을 확립하고자 시료대신 물을 이용하여 비교분석 시험을 실시하였다. 추출용매에 따른 각 농약의 추출효율을 비교하기 위해 물 50 mL에 ECD 분석농약 19종 및 NPD 분석농약 10종을 처리하여 acetone 및 acetonitrile 추출법을 이용해 회수율을 구하였다. 그 결과 Table 4와 같이 두 추출법에서 비슷한 회수율을 나타내었으나 acetone추출법에 비해 추출과정이 용이한 acetonitrile추출법을 분석법에 적용하였으며 정제방법은 앞선 시험방법에 서술한 바와 같이SPE cartridge를 이용한 정제방법을 적용하여 분석법을 확립하였다. 또한 본 시험에서 적정회수율 범위에 들어가지 않았으나 물과 농산물 시료간 분배계수 및 산도의 차이로 검출에 문제가 있을 수 있으므로 낮은 회수율을 나타내는 성분도 회수율 시험에 적용하였다.
농산물 중 농약의 회수율 및 정량한계
ECD 분석대상 농약에 대한 농산물별 분석법 확립 결과 표준곡선의 직선성은 0.05~5.0 mg/L 범위에서 R2> 0.99이었으며, 회수율 시험결과는 Table 5와 같았다.
분석대상 농약 중 분석되지 않은 3성분(ethiprole, picloram, sulcotrione)은 본 실험의 GC/ECD 분석 조건에서 회수율이 낮거나 분석이 불가능 하였으며, 정량한계는 clefoxydim과 hydramethylnon, penflufen, yishijing을 제외한 나머지 성분에서 0.02 mg/kg으로 나타났다. 오렌지의 경우 70% 이하의 회수율을 나타낸 hydramethylnon과 120%의 회수율 범위를 초과한 sulfentrazone을 제외한 14종은 적정 회수율 범위를 나타내었고, 바나나의 경우 120%를 초과한 3성분(bronopol, penflufen, temephos)을 제외한 13성분이 적정 회수율 범위를 나타내었다. 현미시료의 경우 70% 미만의 회수율을 나타낸 2성분(clefoxydim, yishijing)과 120%를 초과한 2성분 (penflufen, temephos)을 제외한 12성분만이 적정 회수율 범위를 보였다. 현미시료의 경우 오렌지나 바나나 시료에 비해 정제법이 복잡하고, 상대적으로 적용 가능한 농약성분이 적었는데 이는 현미가 도정미 보다 많은 지방질을 함유하고 있어 분석시 분리효율에 문제를 유발 할 가능성이 크고, 다양한 저분자물질의 존재로 인해 많은 간섭 피크를 일으켜 정량분석에 영향을 줄 수 있기 때문이다(Pareja 등, 2011; Zhang 등, 2006).
NPD 분석대상 농약에 대한 농산물 별 분석법 확립 결과 표준곡선의 직선성은 0.05~5.0 mg/L 범위에서 R2> 0.99이었으며, 회수율 시험결과는 Table 6과 같았다.
오렌지의 경우 평균회수율이 71.2~116.0%로 나타났으나 indaziflam이 0.02 mg/kg와 0.2 mg/kg 수준에서 70% 이하의 회수율을, propaphos가 0.02 mg/kg 수준에서 120%를 상회하는 결과를 보였다. 현미의 경우 평균 회수율이 88.2~117.9%였고, propaphos만이 0.02 mg/kg 수준에서 120%를 상회하는 결과를 보였다. 바나나의 평균 회수율은 70.1~119.9% 였고, indaziflam만이 0.02 mg/kg 수준에서 120%를 상회하는 결과를 보였다.
GC/ECD와 GC/NPD 분석 결과를 비교해 볼 때, 공통적으로 분석 가능한 성분 5종 중 penflufen의 경우 GC/NPD로 분석하는 것이 더 효과적으로 나타났고, 나머지 4종(dimethachlon, fenpiclonil, bromothalonil, bromuconazole)의 경우 ECD와 NPD 모두에서 양호한 결과를 나타냄을 확인할 수 있었다.
또한, 회수율 시험 결과로 같은 농약일지라도 시료에 따라 회수율에 영향이 다름을 확인하였는데 ECD분석 농약 중 hydramethylnon, picloram, sulcotrione의 경우 농약이 첨가되지 않은 모든 농산물시료에서 대상농약과 동일 머무름 시간에 간섭 peak가 존재하였으며, clefoxydim의 경우 오렌지 시료에서 간섭 peak의 존재로 인해 분석에 어려움이 있는 것으로 나타났다. 그러나 모든 농산물 시료의 ethiprole과 일부 농산물 시료에서의 clefoxydim, sulfentrazone, penflufen, temephos, bronopol의 경우 농약이 첨가되지 않은 농산물 시료에 peak가 존재하지 않았음에도 불구하고 회수율 범위를 초과하는 경향을 보이고 있어 matrix response enhancement (Erney 등, 1993; Hajoelova 등, 1998, 2003; Zhang 등, 2006)를 의심해 볼 수 있다.
정량한계(LOQ, Limit of Quantification)는 EU가이드라인 (SANCO/12571/2013 Guidance document on analytical quality control and validation procedures for pe residues analysis in food and feed)에서 제시한 바와 같이 분석법이 만족되는는 가장 낮은 첨가농도로 표시한 결과(Table 5, 6), 정량한계가 0.02 mg/kg인 성분이 18개, 정량한계가 0.04 mg/kg인 성분이 1개, 정량한계가 0.05 mg/kg인 성분이 3개였다. 본 연구에서는 수입농산물 중 국내 미등록 농약의 분석을 위해 현재 현실적으로 현장에서 적용이 가능한 방법인 식품공전상의 GC를 이용한 다종농약동시분석법의 적용 결과를 나타냈고 추후 더 낮은 정량한계를 확보하기 위해서는 전처리법의 개선 또는 MS와 같은 고감도의 기기를 이용한 분석법 등의 적용이 필요할 것으로 보인다.
GC/MS에 의한 분석성분 재확인
각 농약의 EI mass spectrum은 Fig. 7과 같았고 EI mass spectrum으로부터 분석된 대상성분들의 머무름시간 및 확인분석을 위해 선정된 ion은 Table 7과 같았다. Bronopol과 sulfentrazone의 경우 GC/MS의 감도 및 재현성이 양호하지 못하여 정성확인이 불가능 하였다.
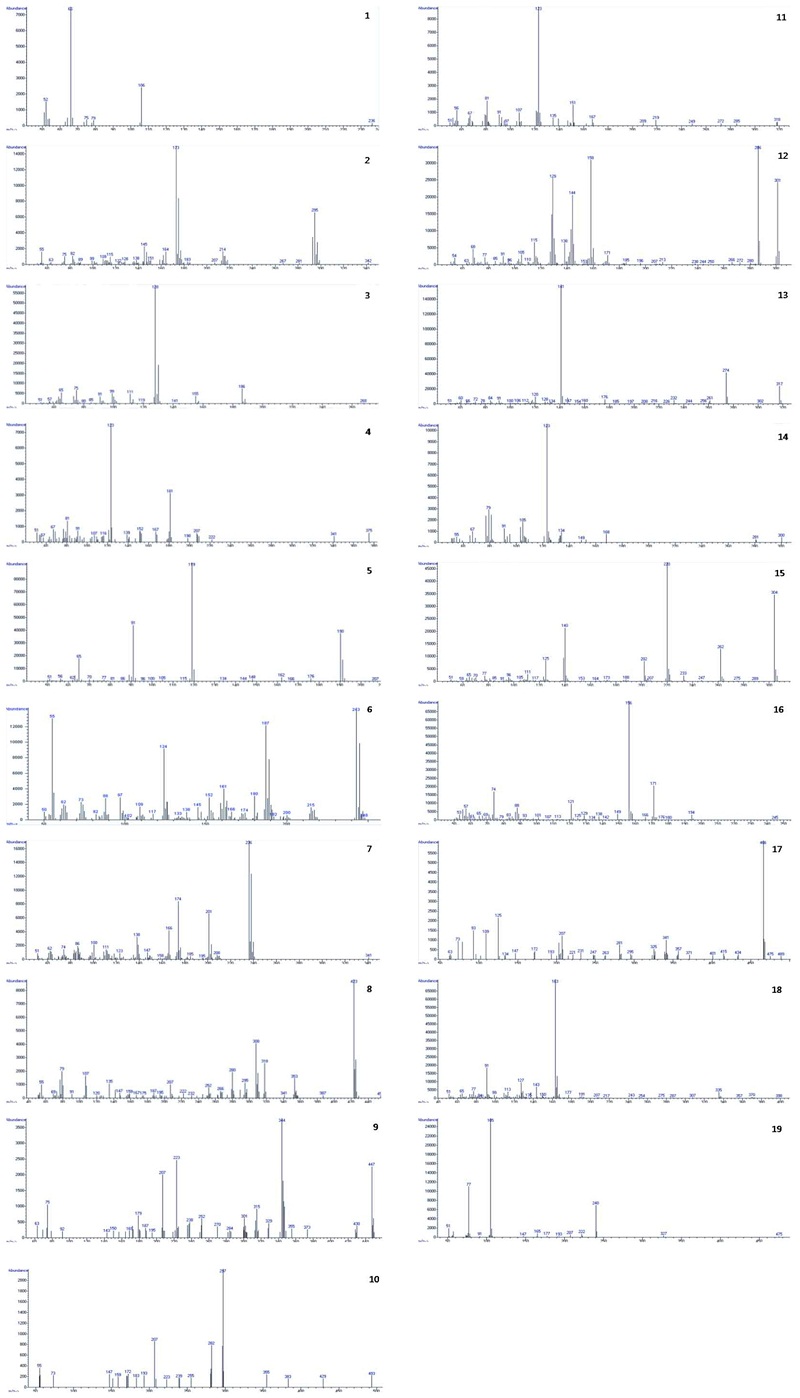
Mass spectra of 19 pesticides. 1. bromothalonil, 2. bromuconazole, 3. clefoxydim, 4. cyphenothrin, 5. DEET, 6. dimethachlon, 7. fenpiclonil, 8. flumiclorac-pentyl, 9. fluoroglycofen-ethyl, 10. hydramethylnon, 11. imiprothrin, 12. indaziflam, 13. penflufen, 14. prallethrin, 15. propaphos, 16. tebuthiuron, 17. temephos, 18. transfluthrin, 19. yishijing
결 론
수입 농산물의 안전성을 확보하기 위해 중국과 동남아 국가에 등록된 농약 중 국내 미등록 농약 24종에 대하여 오렌지, 현미, 바나나를 이용하여 식품공전상의 다종농약 다성분 동시분석법 적용 시험을 실시하였다. 검토된 농약 중 bronopol, ethiprole, picloram, sulcotrione, sulfentrazone을 제외한 19종은 GC/ECD 및 GC/NPD에서 회수율이 70.3%~119.9%, 변이계수가 20% 이내였으며, GC/MS에서 분석성분의 재확인이 가능하였다. 따라서 이러한 19종 농약의 경우 식품공전상의 다종농약 동시분석 전처리법과 GC를 이용하여 수입 농산물의 안전성 검사가 가능할 것으로 판단된다.
Acknowledgments
본 연구는 농촌진흥청 국립농업과학원 농업과학기술 연구개발사업(과제번호: PJ010161)의 지원에 의해 이루어진 것임.
Literature Cited
-
Chang, H. R., H. R. Kang, J. H. Kim, J. A. Do, J. H. Oh, K. S. Kwon, M. H. Im, and K. Kim, (2013), Development of analytical method for the determination and identification of unregistered pesticides in domestic for orange and brown rice, Korean J. Environ. Agric, 31(2), p157-163.
[https://doi.org/10.5338/KJEA.2012.31.2.157]

-
Do, J. A., J. H. Choi, H. J. Park, Y. C. Park, H. J. Yoon, D. M. Choi, and J. H. Oh, (2013), Development of an analytical method for chloropicrin determination in hulled rice by GC-ECD and GC-MS, J. Fd Hyg. Safety, 28(3), p222-226.
[https://doi.org/10.13103/JFHS.2013.28.3.222]

-
Erney, D. R., A. M. Gillespie, D. M. Gilvydis, and C. F. Poole, (1993), Explanation of the matrix-induced chromatographic response enhancement of organophosphorus pesticides during open tubular column gas chromatography with splitless or hot on-column injection and flame photometric detection, J. Chromatogr. A, 638(1), p57-63.
[https://doi.org/10.1016/0021-9673(93)85007-T]

-
Fenik, J., M. Tankiewicz, and M. Biziuk, (2011), Properties and determination of pesticides in fruits and vegetables, TrAC, 30(6), p814-826.
[https://doi.org/10.1016/j.trac.2011.02.008]

- Hajṡlova, J., K. Holadová, V. Kocourek, J. Poustka, M. Godula, Petr Cuhra, and Milan Kempny, (1998), Matrix-induced effects: a critical point in the gas chromatographic analysis of pesticide residues, J. Chromatogr. A, 800, p283-295.
- Hajṡova, J., and J. Zrostlikova, (2003), Matrix effects in (ultra) trace analysis of pesticide residues in food and biotic matrices, J. Chromatogr. A, 1000(1-2), p181-197.
-
Jeon, Y. H., H. Y. Kim, J. I. Hwang, J. H. Kim, J. A. Do, M. H. Im, J. H. Oh, K. S. Kwon, J. K. Lee, Y. D. Lee, and J. E. Kim, (2011), Application of Multiresidue Analysis Method of Unregistered Pesticides in Korea for Imported Food, Korean J. Environ. Agric, 30(3), p339-345.
[https://doi.org/10.5338/KJEA.2011.30.3.339]

-
Jeon, Y. H., J. I. HwangI, J. W. Ahn, H. Y. Kim, J. A. Do, J. H. Oh, I. G. Hwang, M. H. Im, J. K. LEE, Y. D. Lee, and J. E. Kim, (2012), Multiresidue Analysis Method for Determination of Unregistered Organophosphorus Pesticides in Korea for Imported Agri-Food, Korean J. Environ. Agric, 31(3), p277-285.
[https://doi.org/10.5338/KJEA.2012.31.3.277]

- Kim, C. H., J. H. Lee, P. T. Ku, S. J. Hwang, K. Y. Ju, E. C. Yoo, and S. H. Jin, (2012), The Survey on Pesticide Residues of Imported Agricultural Products in Busan Area, The Annual Report of Busan Metropolitan city Institute of Health & Environment, 22(1), p49-56.
- Korea Food and Drug Administration (KFDA), (2012), Yearbook of imported food inspection.
- Korea Food and Drug Administration (KFDA), (2013), 4.1.2.2 Multi class pesticide multiresidue methods, Food korea code.
-
Lee, J. Y., S. M. Hong, T. K. Kim, Z. W. Min, Y. H. Kim, K. A. Song, H. Y. Kwon, H. D. Lee, G. J. Im, D. H. Kim, and J. E. Kim , (2012), Modified QuEChERS Multi-Residue Analysis Method for 61 pesticides in Fruits using with HPLC and GC-ECD/NPD, Korean J. Pestic, Sci.16(3), p242-256.
[https://doi.org/10.7585/kjps.2012.16.3.242]

-
Pareja, L., A. R. Fernández-Alba, V. Cesio, and H. Heinzen, (2011), Analytical methods for pesticide residues in rice, TrAC, 30(2), p270-291.
[https://doi.org/10.1016/j.trac.2010.12.001]

-
Poole, C. F., (2007), Matrix-induced response enhancement in pesticide residue analysis by gas chromatography, J. Chromatogr. A, 1158(1-2), p241-250.
[https://doi.org/10.1016/j.chroma.2007.01.018]

-
Yang, I. C., S. M. Hong, H. Y. Kwon, T. K. Kim, and D. H. Kim, (2013), Multi-residue pesticide analysis in cereal using modified QuEChERS sample preparation method, Korean J. Pestic. Sci, 17(4), p314-334.
[https://doi.org/10.7585/kjps.2013.17.4.314]

-
Zhang, W. G., X. G. Chu, H. X. Cai, J. An, and C. J. Li, (2006), Simultaneous determination of 109 pesticides in unpolished rice by a combination of gel permeation chromatography and Florisil column purification, and gas chromatography/ mass spectrometry, Rapid Commun. Mass Spectrom, 20(4), p609-617.
[https://doi.org/10.1002/rcm.2341]