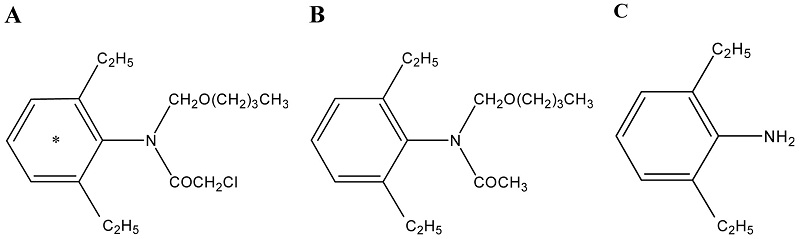
[14C]Butachlor의 벼에 대한 흡수 및 대사
초록
OECD Test guideline 501에 따라, 벼에서의 [14C]butachlor의 식물대사 시험을 실시하였다. 시험토양은 국내 논토양의 대표적인 토성인 양토였으며, 사용지침서상의 사용법에 준하여 이앙 6일 후 [14C]butachlor를 입제로 조제하여 1.5 kg/ha 수준으로 토양 수면에 처리하였다. 시료는 시험물질 처리 후 85일과 126일에 채취하였다. 85일 시료는 이삭, 벼 잎, 뿌리로 126일 후 시료는 현미, 왕겨, 볏짚, 뿌리로 분리하였다. 모든 식물 부위의 총 방사성 잔류량은 0.01 mg/kg 이상이었다. 그 후, 대사산물과 모화합물를 확인하기 위하여 극성이 다른 유기용매와 물 혼합용액을 이용하여 시료를 추출 후 Radio-HPLC로 분석하였다. 벼 추출액 중 butachlor는 검출되지 않았고, 5개의 잠정적 주요대사산물(M1, M2, M3, M4 그리고 M5)이 검출되었으며, 대사산물 중 M4는 2,6-diethylanline로 동정되었다. 토양추출액에서 N-(butoxymethyl)-N-(2,6-diethyl phenyl)acetamide, 2,6-diethylaniline, M2, M3 그리고 M5가 검출되었으며 butachlor의 농도는 낮은 수준 (약 0.03 mg/kg)으로 검출되었다.
Abstract
In the present study, the metabolism of [14C]butachlor was investigated in rice plant according to the OECD test guideline No. 501. [14C]butachlor was treated as granule to paddy water by application of 1.5 kg ingredient (a.i.)/ha at the 3~4 leave stage of rice plant. At 85 days after treatment (DAT), samples of panicle, foliage, and roots were taken for radioactivity analysis. Upon harvest at 126 DAT, rice plants were separated into brown rice, husk, straw, and root parts. Amounts of total radioactivity absorbed by rice plant ranged from 8.6 to 9.8% of applied radioactivity (AR). Total radioactive residues (TRRs) of rice plant at 126 DAT was the highest as 4.0421 mg/kg (7.3% AR) in the straw followed by 1.4595 mg/kg (2.4% AR) in the root, 0.7257 mg/kg (0.1% AR) in the husk. The lowest level recording 0.1020 mg/kg (0.1% AR) was found in brown rice. Each part was extracted with various solvents and solvent/water mixtures. Greater than 70% of TRRs was readily extractable from foliage, panicle, husk and straw. Only 34.0% of the brown rice and 43% of root based on TRRs were extractable showing that the residues were completely assimilated in the plant tissue. The level of non-extractable radioactivity was ranged from 26.2 to 66.0% of TRRs. From this study, five tentative major metabolites (M1, M2, M3, M4 and M5) were observed in rice extracts. Among the metabolites, 2,6-diethylaniline assigned as M4 was identified in rice plant by comparing to retention time of reference standard. Un-metabolized butachlor was not detected in any fractions. In soil extracts, N- (butoxymethyl)-N-(2,6-diethyl phenyl)acetamide, 2,6-diethylaniline, M2, M3 and M5 were observed. And the concentration of butachlor was low level (ca. 0.03 mg/kg).
Keywords:
Environmental fate, Plant metabolism, Total radioactive residues, OECD TG 501, Butachlor키워드:
환경동태, 식물대사, 총 방사성 잔류량서 론
농약이 식물체에 처리되거나 또는 비산 또는 토양에 유입되고 일부의 농약이 식물에 존재하게 된다. 농약은 식물체 표면에 분포하거나 또는 친유성에 의해 잎, 열매, 줄기 그리고 뿌리의 표피를 통해 침투하여 남게 되는데(Menn, 1978), 대부분의 농약들이 주로 잎 표면과 열매와 뿌리를 통해 식물에 흡수된다(Stevens과 Baker, 1987; Stevens 등, 1988; Sicbaldi 등 1996). 흡수된 농약의 유효성분은 체관부와 물관부를 통해 식물체내에 분포하게 되어 분해 및 대사가 이루어진다(EU, 1997). 식물 중 농약 유효 성분의 대사연구는 식물의 수확 시 식물에 존재할 수 있는 최종 잔류물의 구성요소를 동정하거나 또는 분포를 확인하고(US EPA, 1996; OECD, 2007) 규제가 필요한 잔류물을 결정하는 역할을 한다. 또한, 농약의 포장 잔류 실험에서 분석하기 위한 잔류물의 선정과 분석물질에 대한 방법의 평가 지침을 제공하기도 한다(Roberts, 2000). 이와 같이 농약의 식물대사 연구는 잠재적으로 인간, 동물, 환경에 대한 위험을 평가할 수 있는 자료 사용되어 안정성평가 측면에서 매우 중요한 역할을 하는 시험이다. 따라서, 미국, 유럽 및 일본에서는 신규농약등록 시, 식물대사에 대한 자료를 요구하고 있으며, 식물 내 정확한 분해경로를 추적하기 위해 방사성동위원소가 표지된 유효성분을 사용하여 최종 농약제품에 함유되어있는 제재와 함께 식물에 처리하여 시험하도록 하고 있다(US EPA, 1996; OECD, 2007).
국내에서도 방사성동위원소가 표지된 농약을 이용한 식물 대사의 관한 연구가 보고되고 있으나 이들은 작용기작을 규명하기 위한 연구결과이며 실제 농약 제형으로 식물에 처리하여 대사과정을 예측한 연구는 소수에 불과하다(Park 등, 1991; Kang과 Pyon, 1995; Piao, R.Z. 등 1999; Chang 등, 2011).
본 연구에서는 OECD 시험법 No. 501에 따라 [14C]butachlor를 입제 제형으로 처리하고 pot에서의 벼 대사시험을 수행하여 식물체내 흡수된 총 방사성 잔류량과 벼의 각 부위에 분포된 잔류량 및 대사산물을 확인 하고자 하였다.
재료 및 방법
시험물질
방사성동위원소표지 [14C]butachlor는 (주)한국표지화합물연구소에서 합성하였고 specific activity는 0.65 MBq/mg로서 방사성 순도는 98.7%이었으며 냉동보관하면서 사용하였다. 비표지 butachlor 표준품은 AccuStandard, Inc(USA)사로 부터 구입하였으며 순도는 99.0%였다. 국내 토양 중의 butachlor의 대사체로 보고된(Lee 등, 1982; Lee, 1983) N-(butoxymethyl)-N-(2,6-diethylphenyl)acetamide와 2,6-diethylaniline의 표준 대조물질은 Tractus chemical (USA)와 Sigma-Aldrich Chemical Co. (USA)에서 구입하였다.
HPLC급의 hexane, acetonitrile, ethyl acetate 및 water는 Burdick&Jackson Inc. (USA)에서, GR급의 dimethyl sulfoxide, sodium chloride, sodium hydroxide, sodium sulfate는 Junsei Chemical Co. (Japan)에서 구입하였다. Potassium phosphate monobasic와 ethylenediaminetetraacetic acid disodium salt는 Sigma-Aldrich Chemical Co. (USA)의 분석용 등급 제품을 사용하였다. 방사능 측정에 사용 된 Ultima-GoldTM (aqueous 및 non-aqueous용), Ultima-Flo M (HPLC용) Permafluor E+(sample oxidizer용), Carbo-sorb E (sample oxidizer용)은 PerkinElmer (USA)에서 구입하였다. 비추출성잔류물 특성 확인에 사용된 α-amylase와 protease는 Sigma-Aldrich Chemical Co. (USA)의 제품이었다.
시험계
시험토양은 경남 사천시 인근의 논에서 채취된 표토(0~20 cm)를 사용하였다. 채취한 토양은 풍건하여 4 mm 체로 체거름 하였으며 사용하기 전까지 상온에서 보관하였다. 시험토양은 oxidizer로 연소하여 토양 내 방사성잔류물이 없음을 확인한 후 식물재배에 사용하였다. 시험토양의 물리화학적 특성은 Table 1과 같다.
시험에 사용된 품종은 삼덕으로 국립식량과학원 영덕출장소에서 분양 받았다. 볍씨를 2,000배 희석된 약제(삼공스포탁)에 담가 하루 동안 소독 하였으며, 소독 후 침종은 3일간 실시하였으며 매일 맑은 물로 갈아 주었다. 볍씨의 싹이 약 1~2 mm 트는 것을 확인하고 모판에 파종 하였으며 파종 후 3일 모판을 온실에 옮겨 정기적으로 관수 하였다. 3~4 엽기 때 시험 pot(1/3,000 a)에 토양을 약 24 ± 1 cm (약 8 kg)되게 채우고 물 높이가 4 ± 1 cm가 되도록 물을 가하여 준 다음 비료(동부한농 파워21, N-P-K 21-17-17) 0.8 g을 가하여 충분히 혼합하였다. 일정시간 경과 후 물 높이를 확인하여 필요한 경우 물을 가하여 높이가 4 ± 1 cm가 되도록 한 뒤, pot당 3~5모를 2~3 cm 깊이로 이앙하였다. 시험기간 중 시험 pot의 물 수준을 일정 간격으로 모니터링 하였으며, 식물의 정상적인 생육과 수량 확보를 위해 비료 시비 및 병해방제 처리를 결정하였다.
Radioassay
모든 액체시료의 방사능량은 LSC (liquid scintillation counter, PerkinElmer, Tri-Carb 2900TR, USA)를 이용하여 측정하였다. 방사능량은 dpm (disintegration per minute)으로 나타내었다. LSC는 시료 내의 색, 화학적 및 물리적 quenching을 보정곡선으로 자동 보정하였다. 약 0.05~0.6 mL의 추출액에 Ultima-GoldTM (PerkinElmer, USA)을 4 mL을 첨가하여 5분간 측정하였다. 모든 분석은 3반복 측정하였으며, 시료에 따른 바탕시료 값(background dpm)을 측정하여 시료별 결과 계산 시 바탕시료의 결과 값을 제외하고 계산하였다. 비추출성 잔류물의 방사능량은 sample oxidizer (PerkinElmer, Model 307, USA)로 연소 시킨 후 LSC를 이용하여 측정하였다. 비추출성 잔류물 0.3 g을 취하여 0.1 g의 cellulose 분말과 혼합한 다음 sample oxidizer로 1분간 연소시켰으며, 연소 시 발생한 14CO2는 5 mL Carbosorb E (PerkinElmer, USA) 흡수시키고 10 mL Permafluor E+와 혼합한 후 LSC로 측정하였다. Sample oxidizer의 연소효율 및 방사능 회수율은 14C-표준품을 무처리 시료에 처리한 후 연소하여 확인하였다. 시료의 방사능 측정 결과는 별도의 보정은 수행하지 않았다.
Chromatography
Radio-HPLC를 이용하여 시료 추출액 중 방사성 잔류물의 확인을 수행하였다. 표준대조물질과 co-chromatography를 수행하여 대사산물을 확인하고자 하였다. C-18 column (Phenomenex, Luna 5 μ (2) 100A, 250 mm × 4.6 mm, USA)이 장착된 HPLC (Agilent, 1260 infinity, USA)와 Flow scintillation analyzer (PenkinElmer, Radiomatic 610TR, USA)를 사용하였다. 분석 시 column으로 부터 용출된 용액을 수집하여 LSC로 방사능을 측정하여 주입된 방사능과 용출된 방사능을 비교함으로써 column recovery를 확인하였다. 시험기간 column recovery는 90.7~106.9% 이상으로 주입된 방사능의 대부분이 용출된 것을 확인하였다. Radio-HPLC의 조건은 Table 2와 같다.
시험약제의 조제 및 처리
Acetonitrile에 희석한 방사성표지물질과 비표질 물질을 1:1 비율로 혼합하여 31.4 mg/mL의 처리용액을 조제하였다. Glass weight boat에 blank formulation 100 mg을 칭량하고 위의 처리용액 0.159 mL (=ca. 5 mg, 1.625 MBq)을 도포한 다음 휘발시켜 5% 입제를 조제하였다.
총 6개의 시험 pot의 수면에 조제한 입제를 처리하였고 (30 kg/ha; 1.5 kg ai/ha), 처리 후 4일간 물 높이가 4 ± 1 cm가 유지되도록 하였다.
시료채취 및 전처리
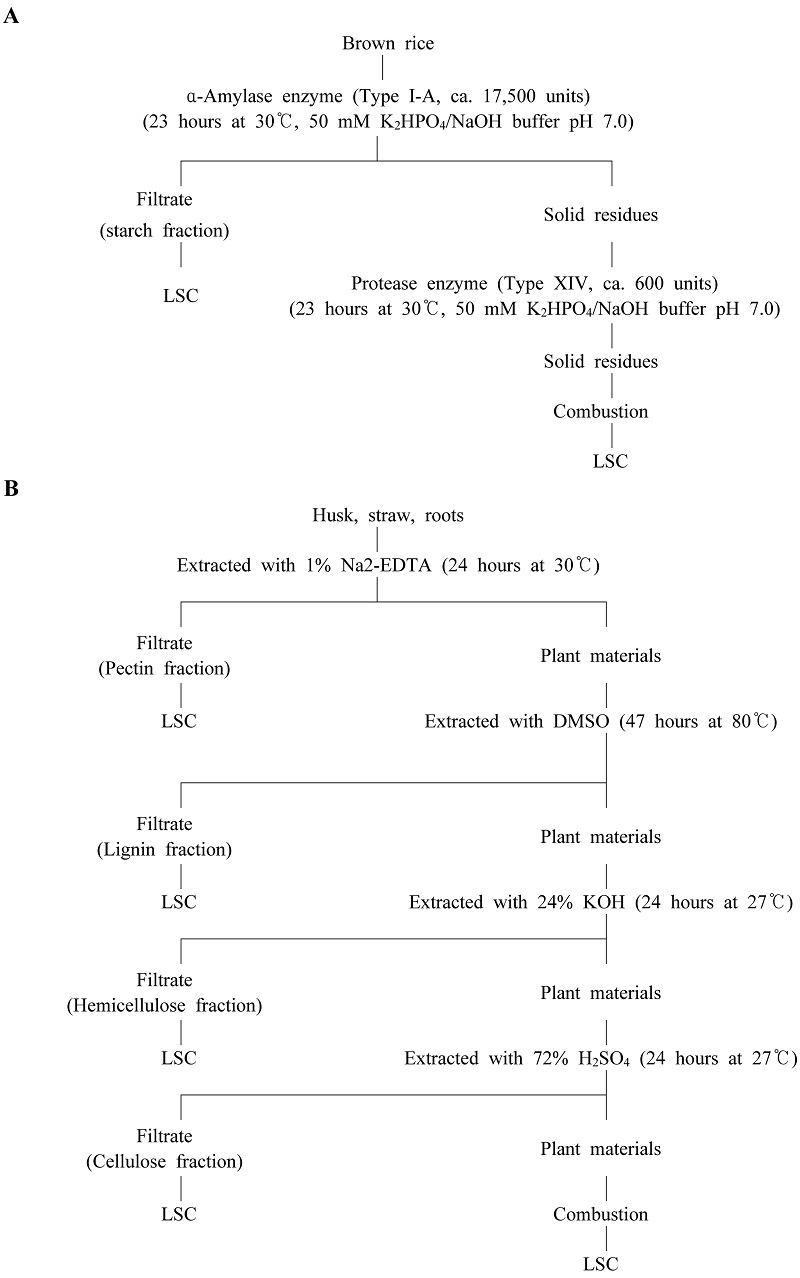
시료는 3반복의 pot를 시험물질 처리 후 85일과 126일에 각각 채취하였다. 시료 채취 전 약 7~15일전부터 물 공급을 중단하고 pot의 물을 말려주었다. 시료 채취는 식물의 토양으로부터 약 3 cm 높이의 부분을 자른 다음 각 부위별로 분리하고 무게를 측정하였다. 뿌리는 토양과 분리하고 가능한 한 물로 세척 하여 토양을 제거하였다. 시험물질 처리 후 126일의 벼 이삭은 막자사발을 이용하여 왕겨와 현미를 분리하였다. 채취한 시료는 전처리 전까지 냉동보관(<-18°C) 하였다. 각 부위별 시료는 세절 한 후, 드라이아이스를 넣어 마쇄하였다. 그런 다음 실온에 일정시간 방치하여 드라이아이스를 휘발시켜 제거한 후 전처리 후의 무게를 재측정 하였다. 전처리 완료 후 시료의 무게는 Table 3와 같다. 전처리 완료 시료는 분석 전까지 냉동보관(<-18°C)하였다.
총 방사성 잔류물
부위별 총 방사성 잔류량(Total radioactive residues; TRRs)을 확인하기 위하여 전처리 완료 시료 0.3 g을 sample oxidizer로 연소시켜 LSC로 방사능량을 측정하였다.
다음의 식에 따라 TRRs를 계산하였다.
*: dpm = 1/6.0 × 107MBq
W: Homogenized weight of the sample in kg dry weight
Specific radioactivity: 0.3125 MBq/mg
추출성 방사성 잔류물
전처리 시료 3~20 g을 원심분리 병에 옮겨 담고 hexane을 넣어 30분간 sonication하였다. 그 후 280 rpm으로 진탕추출한 후 4,000 rpm로 10분간 원심분리하여 시료와 상징액을 분리하고, 추출액의 부피를 측정하였다. 상기 과정을, acetonitrile (9:1,v/v, 3회), acetonitrile/water (1:1, v/v, 4회), acetone (1회)로 반복 수행하였다. 추출 후 시료는 약 1시간 풍건한 다음 추출 cell (66 mL)에 담고 가속 용매 추출기(ASE, Accelerated Solvent Extraction, Dionex, ASE 350, USA)로 추출하였다. 가속 용매 추출기 조건은 Table 4와 같다. 각 단계별 추출액은 일정량(0.2~0.6 mL) 취하여 LSC로 방사능을 측정하였다.
추출액은 추출 용매에 따라 합한 다음 농축하였다. Hexane은 감압 농축하여 건고시킨 후 잔류물을 acetonitrile로 용해하였고 acetonitrile 추출액은 감압 농축하였다. 50% acetonitrile, acetone, ASE 추출액은 합한 다음 그 중 일부를 취하여 감압농축기로 유기용매를 휘발시킨 후 남은 물 층을 SPE-C18 cartridge (Bond Elut certify cartridge, Agilent 6 cc, 1000 mg)을 이용하여 추출 후 농축하였다(Vryzas 등, 2007). SPE 전처리 과정은 C18 cartridge를 2 mL methanol, 6 mL ethyl acetate, 4 mL methanol, 4 mL 탈이온수 순으로 activation하고, 약 5 mL 추출 시료를 cartridge에 loading하였다. 이후, 30분간, cartridge를 건조 시킨 다음 10 mL methanol로 용리하여 농축하였다. 추출 농축액은 일정량 (0.2~0.4 mL) 취하여 Radio-HPLC로 분석하였다.
비추출성 방사성 잔류물
추출 후 시료는 풍건, 균질화 하여 0.3 g를 sample oxidizer로 연소시켜 LSC로 방사능을 측정하였다. 시험물질 처리 후 126일 시료(현미, 왕겨, 볏짚, 뿌리)는 효소, 염기/산 및 화학 물질 처리방법으로 비추출성 잔류물의 특성을 확인하였다.
50 mM sodium phosphate 완충용액(pH 7.0)에 추출 후 현미시료 10 g을 넣고 α-amylase를 17,500 unit 첨가 후 30°C에서 23시간 반응시켰다. 추출 후 buchner funnel 감압여과하여 여액과 시료를 분리하였다. 시료에 50mM sodium phosphate 완충용액(pH 7.0)과 protease 600 unit를 첨가 후 30°C에서 23시간 반응시키고 이를 다시 감압 여과하였다. 여액은 0.2 mL 취하여 LSC로 분석하였다. 왕겨, 볏짚, 뿌리의 비추출성 잔류물(1~4 g)는 1% Na2-EDTA, DMSO, 24% KOH와 72% H2SO4 순서로 추출하여 펙틴, 리그닌, 헤미셀룰로오스, 셀룰로오스로 분획하였고 추출액을 LSC로 분석하여 방사성 잔류물의 분포를 확인하였다(Langebartlels과 Harms, 1985; Fig. 2).
토양 시료 추출 및 분석
토양에서의 추가적인 대사과정을 확인하기 위하여 시험물질 처리 126일 후 대표적 토양시료를 일정량 취하여 추출하였다. 토양 시료(건토기준 80 g)는 250 mL 원심분리병에 옮겨 담고 acetonitrile (150 mL)을 넣고 280 rpm으로 진탕추출 한 후 4,000 rpm로 10분간 원심분리 하여 상징액을 취하였다. 상기 과정을, acetonitrile/water (9:1,v/v, 150 mL), acetonitrile/water (1:1, v/v, 150 mL), acetonitrile/water (1:1, v/v, pH 4.5, 150 mL), acetone (150 mL)의 순서로 반복 수행하였다. 추출 후 토양은 약 1시간 풍건한 다음 두 개의 추출 cell (66 mL)에 나누어 담고 가속 용매 추출기로 추출하였다. 추출액은 모두 합해 여과한 다음 그 중 절반에 해당하는 부피를 취하여 감압 농축하여 유기용매를 휘발시켰다. 남은 잔량은 500 mL 분액여두에 옮겼다. 여기에 sodium chloride 소량과 0.5% formic acid 10 mL 넣고 ethyl acetate 100 mL로 10분간 4회 반복 분배추출 하였다. 추출된 ethyl acetate는 sodium sulfate를 통과시키고 감압농축 하였으며, 약 5 mL의 잔류물을 남겨 15 mL collection tube에 옮긴 뒤 질소 가스 농축 후 acetonitrile 2 mL로 정용하였다. 이를 0.2 mL씩 2반복 취하여 Radio-HPLC로 분석하였다(Kim 등, 2014).
분배 후 물 층의 남은 방사성 잔류물은 SPE-C18 cartridge을 이용하여 추출 후 농축하였다. SPE 전처리 과정은 C18 cartridge를 2mL methanol, 6mL ethyl acetate, 4mL methanol, 4 mL 탈이온수 순으로 activation 하고 약 5 mL 추출 시료를 cartridge에 loading하였다. 이 후, 30분간, cartridge를 건조 시킨 다음 10 mL methanol로 용리하여 농축하였다.
결과 및 고찰
벼에서 [14C]butachlor의 흡수 및 부위별 총 방사성 잔류물
채취 시기에 따른 부위별 총 방사성 잔류물은 Table 5와 같다. 모든 시료의 부위별 총 방사성 잔류물은 0.1020 mg/kg 이상이었다. 시험물질 처리 85일과 126일 후 벼 중의 TRRs은 85일 2.6148 mg/kg에서 126일 6.3294 mg/kg으로 약 2배 가량 증가하였다. 이는 126일 시료 채취 전 15일간 pot의 물 공급을 중단하여 벼의 생중량이 85일에 비해 2배 수준 감소하였기 때문이다. 실제 벼가 흡수한 방사능량은 초기 처리 방사능량(Applied radioactivity; 1.625 MBq) 대비 각각 8.6%와 9.8%로 비슷한 수준이었다. 85일과 126일 후 벼 중 방사능량이 가장 많이 분포한 부위는 벼 잎 및 볏짚으로써 초기 처리 방사능량 대비 각각 6.1%, 7.3%수준으로 TRRs의 농도는 각각 1.6424 mg/kg과 4.0421 mg/kg이었다. 다음으로 뿌리에서 높은 방사능량의 분포를 보였는데 초기 처리 방사능량 대비 2.4% 수준으로 농도는 각각 0.8002 mg/kg과 1.4595 mg/kg이었다. 반면, 가장 낮은 수준의 방사능량의 분포를 보인 것은 이삭과 현미로 초기 처리 방사능량 대비 0.1% 수준이었으며 TRRs의 농도는 각각 0.1722 mg/kg과 0.1021 mg/kg이었다. Butachlor는 주로 신초 및 뿌리에 의해 흡수되며 뿌리를 통해 흡수된 경우 신초를 통해 지상부로 이행되어지는 것으로 알려져 있다(Rao, 2000).
추출성과 비추출성 방사성 잔류물의 분포
다양한 극성의 용매를 통해 벼 잎, 볏짚, 이삭과 왕겨에서 방사성 잔류물이 70.7% TRRs (1.1612 mg/kg), 73.8% TRRs (2.9831 mg/kg), 66.4% TRRs (0.1143 mg/kg), 72.4% TRRs (0.5254 mg/kg) 추출되어졌다. 뿌리에서 42.6~43.6% TRRs이 추출되었으며 현미는 34.0% TRRs로 가장 낮은 수준의 방사성 잔류물이 추출되어졌다. 부위별 비추출성 방사성 잔류물은 26.2~66.0% TRRs 수준으로 0.05 mg/kg 이상이었다.
추출성 방사성 잔류물의 특성 확인
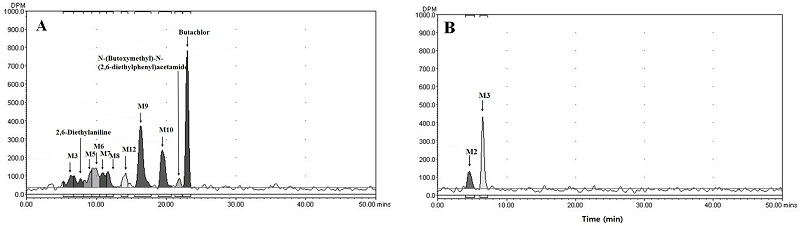
시험기간 중 모든 부위의 시료에서 butachlor는 검출되지 않았다. 이전 연구결과도 벼 대사시험에서 butachlor는 검출되지 않음이 보고된 바 있다(Roberts, 1998). 총 10개의 대사산물과 5개의 주요대사산물(≥ 10% TRRs) M1, M2, M3, M4, M5가 검출되었다. 시험물질 처리 후 85일에 벼 잎에서 총 7개의 대사산물(≥ 0.01 mg/kg)이 검출되었고 그 중 38.3% TRRs (0.629 mg/kg)의 M1이 주요대사산물(≥ 10% TRRs)로 검출되었다(Fig. 3, Table 6). 시험물질 처리 후 126일 볏짚 추출액에서 주요대사산물 M1, M3, M4와 M5가 acetonitrile과 acetonitrile:water (1:1,v/v) 추출 농축액에서 검출되었으며 이들은 각 19.0% (0.768 mg/kg), 12.8% (0.5174 mg/kg), 14.7% (0.5942 mg/kg), 10.3% TRRs (0.4163 mg/kg) 수준 이었다(Fig. 4, Table 6). 또한 시험물질 처리 후 85일 벼 잎 시료에서는 확인되지 않았던 M6, M7, M8이 대사산물이 acetonitrile:water (1:1, v/v) 추출액에서 1.4~2.0% TRRs 검출되었다. 시험물질 처리 후 85일 채취된 이삭 시료의 추출성 잔류물이 0.1143 mg/kg 수준이었지만 채취된 시료량이 적어 추출액 중의 낮은 방사능량으로 인해 Radio-HPLC 분석 시 butachlor를 비롯한 대사산물이 검출되지 않았다 (Table 7). 왕겨의 acetonitrile:water (1:1, v/v)의 추출액에서 총 3개의 주요대사산물 M2, M4, M7가 각각 17.8% (0.1424 mg/kg), 27.9% (0.2233 mg/kg), 20.7% TRRs (0.5254 mg/kg) 검출되었다(Table 7). 현미는 유일하게 acetonitrile:water (1:1, v/v)의 추출액에서 대사체가 검출 되었는데 M2로 24.6% TRRs (0.0251 mg/kg) 검출되었다(Table 7). 시험 기간 중 뿌리는 acetonitrile과 acetonitrile:water(1:1, v/v) 추출액에서 2개의 잠정적 주요대사산물 M1, M2가 확인 되었다. M1의 경우 시험물질 처리 후 85일과 126일에 12.7% (0.1016 mg/kg), 11.4% TRRs (0.1664 mg/kg)이었고, M2의 경우 시험물질 처리 후 85일과 126일에 15.8% TRRs (0.1264 mg/kg), 12.4% TRRs (0.1810 mg/kg) 수준 검출되었다(Table 8). 검출된 주요대사산물 확인을 위한 대조물질과 추출액의 co-chromatography를 통해 M4는 2,6-diethylaniline이 확인되었다(Fig. 3). 나머지 주요대사산물의 경우 대조물질이 확보되지 않거나, 생성된 대사산물의 양이 매우 소량으로 동정이 불가능 하였지만, 비극성 고성상에서 모화합물인 butachlor보다 용출시간이 빠른것으로 분석되어, 검출된 주요대사산물은 모화합물보다 극성이 큰 물질이며 식물체 세포의 수용성 부분들로 부터 나온 극성물인 것으로 판단된다.
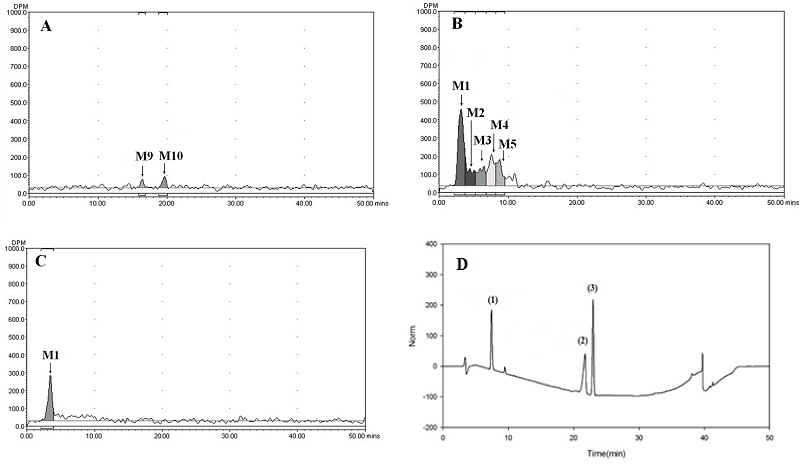
Representative Radio-HPLC (A, B, C) and HPLC chromatograms of the concentrated foliage extracts at 85 DAT. A, Hexane extract; B, Acetonitrile extract; C, Acetonitrile:water (1:1, v/v) extract; D, Reference substance (1) 2,6-diethylaniline, (2) N-(butoxymethyl)-N-(2,6-diethylphenyl)acetamide and (3) Butachlor.
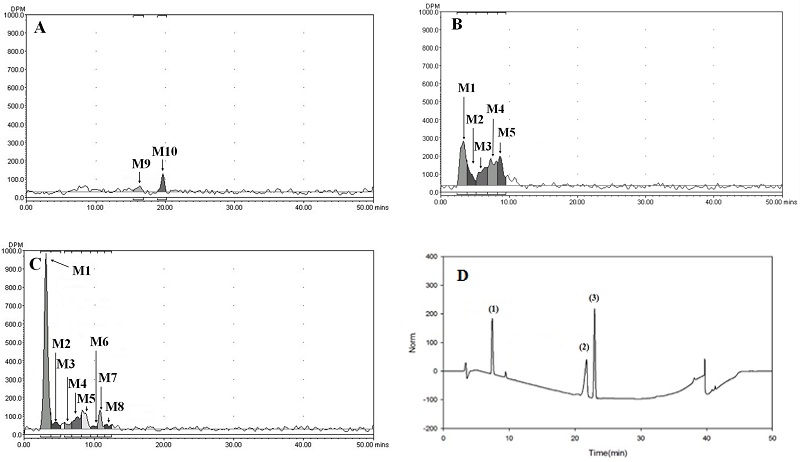
Representative Radio-HPLC (A, B, C) and HPLC chromatograms of the concentrated straw extract at 126 DAT. A, Hexane extract; B, Acetonitrile extract; C, Acetonitrile:water (1:1, v/v) extract; D, Reference substance (1) 2,6-diethylaniline, (2) N-(butoxymethyl)-N-(2,6-diethylphenyl)acetamide and (3) Butachlor.

Distribution of [14C]butachlor and its metabolites in panicle and brown rice/husk at each sampling time
Butachlor를 포함한 모든 chloroacetanilide계 제초제는 염소 원자의 glutathione 매개 친핵성 치환이 주된 반응을 통해 homoglutathione 복합체의 초기 glutathione을 형성하며, 이 초기 복합체는 이 후 황을 포함하는 다양한 수준의 이차대사산물로 분해되는 것으로 알려져 있으며, 벼에서 butachlor는 sulfonic acid, oxanilic acid, sulfone, sulfoxide 등의 주요대사산물이 검출된다는 결과가 보고된 바 있다(Roberts, 1998).
비추출성 방사성 잔류물의 분획
비추출성 방사성 잔류물의 분획 결과는 Table 9~10과 같다. 현미는 α-amylase와 protease의 효소를 처리하여 결합된 방사능을 해리시켰다. 소량의 방사능만 효소의 의해 해리되었는데 탄수화물로부터 해리된 방사성 잔류물은 7.8% TRRs (0.0080 mg/kg)고, 단백질로부터 해리된 방사성 잔류물은 13.4% TRRs (0.0137 mg/kg)였다. 왕겨, 볏짚 및 뿌리의 비추출성 잔류물은 화학적 방법에 따라 비추출성 잔류물을 분획하여 펙틴, 리그닌, 헤미셀룰로스 및 셀룰로스에 비추출성 방사성잔류물의 분포를 확인하였다. 헤미셀룰로스의 TRRs는 각각 12.3% TRRs (0.0892 mg/kg), 15.8% TRRs (0.6378 mg/kg), 30.4% TRRs (0.4436 mg/kg)로 방사성 잔류물이 헤미셀룰로스에 분포되어 있었다. 이 결과를 통해 일부 비추출성 잔류물은 탄수화물, 단백질 및 세포벽 구성 성분으로 통합되어 있으며 이는 pot 토양으로 부터 분해되어 발생된 14CO2를 식물이 흡수하여 탄소 동화 작용을 통해 식물의 구성성분을 이루고 주요 방사성잔류물을 생성하였음을 예측 할 수 있었다.
토양 잔류물의 특성 확인
대표 토양 시료분석 결과 butachlor를 포함한 총 11개의 대사산물이 검출 되었다(Fig. 5, Table 11). 토양 중 잔류농도는 butachlor가 가장 높았으며 0.0313 mg/kg로 초기 처리 방사능량 대비 5% 수준이었다. 또한, 국내 논 토양 중의 butachlor의 주요 대사산물로 보고된(Lee, 1982; Lee 등, 1983) N-(butoxymethyl)-N-(2,6-diethylphenyl)acetamide와 2,6-diethylaniline가 검출되었으며 각각 0.0054 mg/kg, 0.0026 mg/kg 수준이었다. M1을 제외한 벼 중 주요 대사산물 M2, M3, M4, M5가 토양 추출액으로 부터 검출되었다. M2는 물 층 농축액에서 검출되었으며 높은 극성의 대사산물로 판단된다.
Representative Radio-HPLC chromatograms of the concentrated extract from soil (A, Organic phase; B, Water phase).
본 시험의 연구결과 벼에서 [14C]butachlor의 흡수는 처리 후 85일과 126일에 초기 처리 방사능량 대비 각각 8.6%와 9.6%이었다. 흡수된 방사능은 벼 잎 및 볏짚에 가장 높게 분포하였다. Butachlor는 벼 중에서 대사되어 잠정적 주요대사산물 M1, M2, M3, M5와 2,6-diethylaniline 생성하거나 벼의 구성성분과 결합되어 비추출성 잔류물로 존재하는 것을 확인할 수 있었다.
Acknowledgments
본 연구는 농업진흥청 공동연구사업(과제번호 : PJ009286)의 지원에 의해 수행되었으며, 농촌진흥청의 연구비 지원에 감사드립니다.
Literature Cited
- European Commission, (1997), EU Communities Working Document 7028/VI/95 rev.3 : Appendix A - Metabolism and distribution in plants, Commission of the European Communities.
-
Chang, H. R., Y. S. Keum, S. J. Ko, J. K. Moon, K. Kim, and J. H. Kim, (2011), Metabolism of a New Herbicide, [14C]Pyribenzoxim, in Rice, J. Agric. Food Chem, 59, p1918-1923.
[https://doi.org/10.1021/jf1039469]

- Kang, T. G., and J. Y. Pyon, (1995), Absorption, translocation and metabolism of bensulfuron in rice and weeds at different temperatures, Kor. J. Weed Sci, 15, p321-328.
- Kim, J. H., J. W. Kim, D. W. Kim, B. J. Lee, C. S. Kim, Y. B. Ihm, and J. S. Seo, (2014), Establishment aerobic soil metabolism system using [14C]butachlor, Kor. J. Pestic. Sci, 18(4), p258-268.
-
Langebartels, C., and H. Harms, (1985), Analysis for nonextractable (bound) residue of pentachlorophenol in plant cells using a cell wall fraction procedure, Ecotox. Environ. Safety, 10, p269-279.
[https://doi.org/10.1016/0147-6513(85)90073-9]

- Lee, J. K., R. D. Minard, and J. M. Bolarg, (1982), Anaerobic metabolism of the herbicide, butachlor in soil, J. Kor. Agri. Chem. Soc, 25(2), p83-92.
- Lee, J. K., (1983), Degradation of the herbicide, butachlor, in soil, J. Kor. Agri. Chem. Soc, 26(1), p53-57.
-
Menn, J. J., (1978), Comparative aspects of pesticide metabolism in plants and animals, Environ. Health Perspect, 27, p113-124.
[https://doi.org/10.1289/ehp.7827113]

- OECD (Organisation for Economic Co-operation and Development), (2007), Metabolism of crops, OECD 501, OECD guideline for the testing of chemicals, section 5, Test guidelines programme, Organization for economic cooperation and development, Paris.
- Park, C. W., J. Y. Pyon, and Y. W. Kim, (1991), Absorption, translocation and metabolism of Naproanilide in rice and paddy weeds under different temperature conditions, Kor. J. Weed Sci, 11, p187-194.
- Piao, R. Z., C. S. Kwon, B. S. Ahn, S. W. Rho, and J. Y. Pyon, (1999), Efect of terbufos and piperonyl butoxide on absorption, translocation and metabolism of primisulfuron in corn cultivars, Kor. J. Weed Sci, 19, p27-33.
- Rao, V. S., (2000), Principles of Weed Science, Second Edition, p128, CRC Press, U.S.A.p.
- Schmidt, B., C. Rivero, and B. Thiede, (1996), 3,4-dichloroaniline N-glucosyl-and N-malonultransferase activities in cell cultures and plants of soybean and wheat, Phytochem, 36, p81-84.
-
Sicbaldi, F., A. T. Sacch, M. Trevisan, and A. A. M. Del Re, (1997), Root uptake and xylem translocation of pesticides from different chemical classes, Pestic. Sci, 50, p111-119.
[https://doi.org/10.1002/(SICI)1096-9063(199706)50:2<111::AID-PS573>3.0.CO;2-3]

-
Stevens, P. J. G., and E. A. Baker, (1987), Factors affecting the foliar absorption and redistribution of pesticides. 1. Properties of leaf surfaces and their interactions with spray droplets, Pestic. Sci, 19, p265-281.
[https://doi.org/10.1002/ps.2780190404]

-
Stevens, P. J. G., E. A. Baker, and N. H. Anderson, (1988), Factors affecting the foliar absorption and redistribution of pesticides. 2. Physicochemical properties of the active ingredient and the role of surfactant, Pestic. Sci, 24, p31-53.
[https://doi.org/10.1002/ps.2780240105]

- Roberts, T., (2000), Part 1. Regulatory considerations, Metabolism of agrochemicals in plant, p1-4, Wiley, U.S.A.
- US EPA, (1996), Nature of the residue - plant, live stock, OPPTS 860. 1300/EPA 712-C-96-172, US Environmental Protection Agency, Office of Prevention, Pesticides, and Toxic Substances, USA.
-
Vryzas, Z., A. Tsaboula, and E. Papadopulou-Mourkidou, (2007), Determination of alachlor, metolachlor, and their acidic metabolites in soils by microwave-assisted extraction (MAE) combined with solid phase extraction (SPE) coupled with GC-MS and HPLC-UV analysis, J. Sep. Sci, 30, p2529-2538.
[https://doi.org/10.1002/jssc.200700198]