GC-ECD를 이용한 농산물 중 Ipfencarbazone의 신규분석법 개발 및 검증
초록
Ipfencarbazone은 tetrazolinone계 화합물로 잡초 세포막의 주성분인 장쇄지방산(VLCFAs) 합성을 억제하여 세포 분열을 저해하는 작용을 하는 제초제이다. 본 연구에서는 국내 신규농약 ipfencarbazone에 대한 안전관리를 위해 농산물 중 ipfencarbazone의 잔류분석법을 개발하였다. 농산물 시료(현미, 대두, 고추, 감귤, 감자) 중 ipfencarbazone을 acetone으로 추출한 뒤 n-hexane을 이용해 분배하고 silica SPE 카트리지를 통한 흡착크로마토그래피법을 이용해 정제하였다. 이를 GC-ECD를 이용해 분석해 정량평가를 하였으며, 재확인을 위해 GC/MS로 분석하였다. 분석법의 직선성은 농도 대비 피크면적과의 결정계수(r2)가 0.999 이상으로 우수하였으며, 검출한계 및 정량한계는 각각 0.003, 0.01 mg/kg으로 높은 감도를 나타냈다. 농산물 시료 중 모든 처리구에서 평균 회수율은 80.6%-112.3% (RSD 10% 이내)였고, 경인청과의 실험실간 검증결과에서도 95.1-106.1%를 나타냈다. 모든 결과를 종합해볼 때 개발된 분석법은 모두 CODEX 가이드라인(CAC/GL 40, 2003)의 기준이내를 만족하는 값으로 확인되었다. 따라서 개발된 분석법의 낮은 검출한계 및 정량한계, 우수한 직선성, 회수율 시험을 통한 양호한 정밀성 및 재현성 등을 종합해볼 때 이는 농산물 중 ipfencarbazone을 분석하기 위한 공정분석법으로 사용되기에 적합할 것으로 판단된다.
Abstract
Ipfencarbazone is a herbicide of the tetrazolinone class, and is believed to be an inhibitor of very long chain fatty acids (VLCFAs), which control cell division in weeds. The objective of this study was to develop and validate an official analytical method for ipfencarbazone determination in agricultural products. The ipfencarbazone residues in agricultural products were extracted with acetone, partitioned with n-hexane, and then purified through silica SPE cartridge. Finally, the analyte was quantified by gas chromatographelectron capture detector (GC-ECD) and confirmed with gas chromatograph/mass spectrometer(GC/MS). The linear range of ipfencarbazone was 0.01 to 1.0 mg/L with the coefficient of determination (r2) of 0.9999. The limit of detection (LOD) and quantification (LOQ) was 0.003 and 0.01 mg/kg, respectively. In addition, average recoveries of ipfencarbazone ranged from 80.6% to 112.3% at the different concentration levels LOQ, 10LOQ and 50LOQ, while the relative standard deviation was 2.2-8.6%. All values were consistent with the criteria ranges requested in the CODEX guidelines. Furthermore, and inter-laboratory study was conducted to validate the method. This proposed method for determination of ipfencarbazone residues in agricultural products can be used as an official analytical method.
Keywords:
Ipfencarbazone, GC-ECD, GC/MS, Herbicide, Maximum Residue Limits키워드:
제초제, 잔류허용기준서 론
Ipfencarbazone은 tetrazolinone계 제초제로 잡초의 세포막 주성분인 장쇄지방산(VLCFAs, very long chain fatty acids) 합성을 억제함으로써 세포 신장을 저해시켜 잡초를 고사시킨다(Hubert 등, 2008; 일본 약사·식품 위생 심의회, 2013; Corbin 등, 2013). Ipfencarbazone은 잡초가 발생하기 전 혹은 잡초가 발생한 초기에 사용하는 것이 적합하며 특히 일년생 광엽잡초 및 방동사니과 잡초 등에 대해 장기적 잔효성이 높은 것이 그 특징이다(Hokko 화학공업주식회사, 2012).
2013년 일본 후생노동청(MHLW, ministry of health, labour and welfare)은 현미에 ipfencarbazone에 대한 잔류허용기준(MRL, maximum residue limit)을 0.05 mg/kg로 설정하였다(일본 약사·식품 위생 심의회, 2013). 우리나라도 쌀에 대해 잔류허용기준(MRL)을 설정할 예정이고, 이에 따라 ipfencarbazone의 농산물 중 잔류분석을 위한 신규 분석법 개발이 필요하였다.
잔류농약 분석법 개발 과정에서 노출가능성이 높거나 독성이 강한 대사산물은 식품섭취 과정에서 위해하게 작용할 수 있으므로 ‘잔류물의 정의’로 정하여 분석법 확립대상에 포함시키고 있다. 하지만, ipfencarbazone은 독성이 강하거나 잔류량이 많은 대사산물은 없어 모화합물인 ipfencarbazone만 분석 대상으로 정하였다(동방아그로, 2012; 2013).
그간 학계에 보고된 ipfencarbazone의 잔류분석법으로는 Sun 등(2012)의 HPLC-DAD (high performance liquid chromatograph-diode array detector)를 이용한 분석법이 유일하며, 일본(일본 약사·식품 위생 심의회, 2013)에서는 기준설정을 위해 LC-MS/MS(liquid chromatograph-tandem mass spectrometer)로 분석을 한 사례가 있다. 하지만, ipfencarbazone은 휘발성이 있고 질소와 할로겐족 원소를 포함하고 있어 기체크로마토그래프(GC, gas chromatograph)를 이용한 선택적 검출기(전자포획검출기 또는 질소인검출기)에 우수한 감도를 보일 것으로 예상되었다. 이에 본 연구에서는 GC를 이용한 ipfencarbazone의 농산물 중 신규 잔류분석법을 개발하였다.
본 연구에서 개발된 분석법은 CODEX 가이드라인(CAC/GL 40, 2003)에 따라 분석법의 직선성, 선택성, 정밀성, 정확성, 재현성을 검증하였으며, 실험실간 검증을 통해 분석법의 신뢰성 및 유효성을 확보하였다. 확립된 분석법은 국내 유통되는 농산물 중 ipfencarbazone의 안전관리를 위한 공정분석법으로 활용될 것이다.
재료 및 방법
시약 및 재료
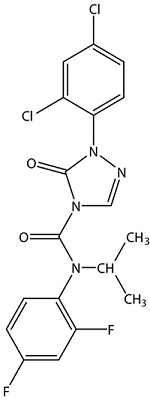
Ipfencarbazone (Table 1) 표준품(99.7%)은 동부한농(Lot No. 120420)에서 제공받아 사용하였고, acetone, n-hexane, ethyl acetate 등은 HPLC 등급으로 Merck (Darmstadt, Germany)에서 구입하여 사용하였다. Sodium chloride는 Wako (Osaka, Japan)에서, florisil (6 cc, 1 g) 및 silica (6 cc, 1 g) SPE 카트리지는 Waters (Milford, USA)에서 구입하였다. 여과보조제인 celite 545 및 anhydrous sodium sulfate는 Merck (Darmstadt, Germany)에서 구입하였다.
분석에 사용된 농산물 시료는 국내 사용기준 설정을 위한 곡류(쌀)의 대표작물인 현미와 각 식품군의 대표작물인 대두(콩류), 고추(과채류), 감귤(과일류), 감자(서류)는 모두 무농약 농산물을 구입하여 균질화한 후 밀봉된 용기에 담아 -50°C에 보관하고 실험에 사용하였다.
표준원액 및 표준용액
Ipfencarbazone 표준품은 10.03 mg을 acetone 10 mL에 용해하여 1000 μg/mL의 표준원액을 조제하고, 이를 acetone으로 희석하여 0.01, 0.02, 0.05, 0.1, 0.2, 0.5 및 1.0 μg/mL의 표준용액을 조제하였다. 표준원액과 표준용액은 모두 갈색병에 담아 4°C에 보관하여 실험에 사용하였다.
추출
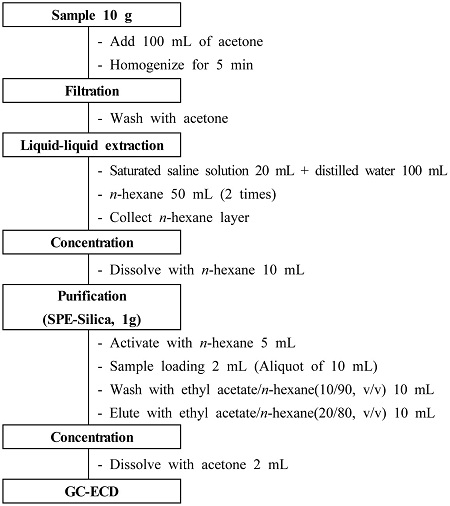
검체를 분쇄하여 균질화한 후 10 g(곡류 및 콩류는 약 1 kg을 혼합하여 표준체 420 μm를 통과하도록 분쇄한 10 g, 채소류·과일류·서류는 약 1 kg을 잘게 갈아 혼합한 후 10 g)을 정밀히 달아 균질기 용기에 넣었다(곡류 및 콩류의 경우 증류수 10 mL를 가한 후 30분간 방치). 시료에 100 mL의 acetone을 가하여 진탕기에서 5분간 진탕 후 추출물을 여과지가 깔려있는 부흐너깔때기로 여과보조제(celite 545) 10 g을 이용해 흡인여과한 뒤 acetone 30 mL로 잔사 및 용기를 씻어내려 앞의 여액과 합하였다. 합친 여액을 500 mL 용량의 분액여두에 옮기고 포화식염수 20 mL와 물 100 mL을 차례로 가한 후 n-hexane 50 mL를 가하여 2분간 격렬하게 진탕하고 층이 완전히 분리될 때까지 정치시켰다. n-Hexane 층을 무수황산나트륨에 통과시켜 감압농축플라스크에 받고, 남아있는 수용액 층에 50 mL를 추가적으로 가하여 위의 과정을 반복하였다. 이를 40°C 이하의 수욕상에서 감압농축, 건고하고 잔류물을 10 mL의 n-hexane에 녹여 정제 시료로 사용하였다.
카트리지 정제
Silica 카트리지에 n-hexane 5 mL를 2~3 방울/초의 속도로 유출하여 버린 후 고정상 상단이 노출되기 전에 정제 시료 10 mL 중 2 mL를 카트리지 상단에 넣고 1~2 방울/초의 속도로 용출시켜 씻어 버렸다. 다음 고정상 상단이 노출되기 전에 ethyl acetate/n-hexane (10/90, v/v) 10 mL를 유출시켜 버린 후 ethyl acetate/n-hexane (20/80, v/v) 10 mL를 유출시켜 받은 시험액을 감압농축플라스크에 취하였다. 이를 40°C 이하 수욕상에서 감압농축하고 acetone을 가하여 최종부피 2 mL가 되게 하여 시험용액으로 사용하였다. 추출 및 정제 방법을 Fig. 1에 흐름도로 간략하게 나타내었다.
GC-ECD 분석조건
Ipfencarbazone의 분석은 기체크로마토그래프-전자포획검출기(GC-ECD, Agilent GC model 6890A, Agilent, CA, USA)를 사용하였고, 분석용 칼럼은 DB-5 (0.25 mm i.d. × 30 m, 0.25 μm; Agilent Technologies, CA, USA), 이동상가스(N2) 유량은 1 mL/min, 주입량은 1 μL로 split mode (20:1)를 이용하여 분석하였다. 이때의 주입구 온도는 250°C, 검출기 온도는 280°C이었으며, 오븐온도는 200°C에서 시작하여 10°C/min의 비율로 온도를 280°C까지 상승시켜 10분간 유지하는 조건을 적용하였다.
GC/MS 분석조건
분석법의 신뢰성 확보를 위해 기체크로마토그래프-질량분석기(GC/MS, Agilent Technologies 5793 MSD, Agilent, CA, USA)를 이용하여 재확인 과정을 수행하였다. 분석용 칼럼은 DB-5MS (0.25 mm i.d. × 30 m, 0.25 μm; Agilent Technologies, CA, USA), 이동상가스(He) 유량은 1 mL/min, 주입량은 1 μL로 splitless mode를 이용하여 분석하였다. 이때의 주입구 온도는 260°C, interface 온도는 280°C이었으며, 오븐온도는 200°C에서 검체를 주입하고 10°C/min의 비율로 온도를 280°C까지 상승시켜 10분간 유지하는 조건을 적용하였다. 질량분석기 조건의 확립은 EI (electron impact ionization, 70 eV)를 이용하여 분자량 범위 50-550 m/z의 스캔모드에서 총 이온크로마토그램과 질량 스펙트럼을 확인하고 최적의 특성이온을 선정하였고, 선정된 이온만을 분석하는 SIM (selected ion monitoring) 모드로 재확인하였다.
분석법 검증
본 연구에서는 CODEX 가이드라인(CAC/GL 40, 2003)에 따라 분석법의 직선성(linearity), 검출한계(LOD, limit of detection), 정량한계(LOQ, limit of quantification)을 평가하였다. 또한 회수율 시험으로 분석법의 정확성(accuracy), 정밀성(precision), 재현성(repeatability)을 확인 후 실험실간 검증을 실시해 분석법의 신뢰성 및 유효성을 확보하였다. 직선성의 확인을 위하여 ipfencarbazone 표준용액 0.01, 0.02, 0.05, 0.1, 0.2, 0.5 및 1.0 μg/mL의 농도 범위에 대한 각각의 피크 면적을 이용하여 검량선을 작성하였고, 검량선의 결정계수(coefficient of determination, r2)를 구하였다. 또한, 검출한계(LOD)와 정량한계(LOQ)는 크로마토그램 상에서 신호 대 잡음비(S/N ratio) 각각 3, 10 이상으로 하였다. 분석법의 정확성, 정밀성 및 재현성을 평가하기 위하여 회수율 시험을 실시하였으며, 곡류, 콩류, 채소류, 과일류, 서류의 각 대표농산물인 현미, 대두, 고추, 감귤, 감자의 무처리 시료에 ipfencarbazone 표준용액을 첨가하여 분석하였다. 처리농도는 정량한계(LOQ), 정량한계의 10배(10LOQ), 정량한계의 50배(50LOQ)에 해당하는 농도로 수행하였으며 각각의 농도 및 시료에 대해 5반복 실험을 수행하여 평균 및 상대표준편차(RSD, relative standard deviation)를 계산하였다. 또한, 경인지방식품의약품안전청과 실험실간 검증을 실시하여 분석법의 유효성을 확인하였다.
결과 및 고찰
기기선정과 기기분석 조건 확립
Ipfencarbazone은 할로겐족 원소인 염소(Cl, chloride)와 불소(F, fluoride)를 가지고 있기 때문에 이를 선택적으로 검출하는 검출기인 GC-ECD를 분석기기로 선정하였다. Ipfencarbazone의 기기 상 감도를 높이고, 시료에 존재하는 간섭 물질로부터 선택적으로 분리하기 위해 칼럼의 온도를 조절하여 기기분석 조건을 확립하였다.
한편, ipfencarbazone의 질소원소(N, nitrogen)를 선택적으로 검출하는 GC-NPD (gas chromatograph-nitrogen phosphorous detector)에 적용하였을 때에는 ipfencarbazone의 머무름 시간에 농산물 시료에 의한 간섭물질의 영향이 있었기 때문에 분석기기로 선정하지 않았다.
추출용매 선택
Ipfencarbazone은 Log POW이 3.0 (25°C)으로 비극성이므로 비극성 농약의 추출에 주로 사용하는 용매인 acetone, acetonitrile으로 추출 효율을 비교하였다. 두 용매의 추출 효율은 각각 acetone 101.1% acetonitrile 98.7%로 확인되었으며, 그 중 추출효율이 더 높고 여과와 농축이 용이하였던 acetone을 추출용매로 선정하였다. 추출 후 검체추출액은 여과보조제인 celite 545를 이용해 감압여과한 뒤 1차적으로 불순물 제거를 위해 액액분배법을 적용하였다. Acetone 추출물을 각각 ethyl acetate (82.4%), dichloromethane (91.5%), n-hexane (98.7%)으로 액액분배를 수행하여 추출율이 가장 좋은 n-hexane을 분배용매로 선정하였으며, ipfencarbazone이 비극성이므로 비극성 용매에 대한 액액분배의 효율이 높았던 것으로 판단된다. 또한, 포화식염수를 첨가하여 염석효과로 수용액 층의 극성도를 높여서 ipfencarbazone의 유기용매(n-hexane) 층으로의 분배효율을 향상시켰다.
SPE 카트리지 정제
n-Hexane 분배 추출물 중 비극성 간섭물질의 제거를 위해 흡착 크로마토그래피를 이용하여 정제하였다. 흡착제의 종류에는 alumina, florisil, silica gel 및 활성탄 등이 사용되나 활성탄이나 alumina는 흡착력이 강해 비극성인 농약과 방해물질을 분리하기에는 적합하지 않다고 판단하여 florisil과 silica를 선택해 비교하였다. 정제용매 또한 비극성 유기용매인 acetone/n-hexane 및 ethyl acetate/n-hexane를 사용하여 각 용매 분획별 정제효율을 비교하였다.
Acetone/n-hexane을 이용한 florisil과 silica 카트리지 정제 시 10/90 분획 10 mL 이내에서 ipfencarbazone이 모두 90% 이상 회수됨을 확인하였다. 또한, ethyl acetate/n-hexane을 사용했을 때는 10/90 분획 10 mL 이내에서 용출되지 않았고 이후 20/80 분획 10 mL 이내에서 모두 90% 이상 용출됨을 확인하였다. 이에 ethyl acetate/n-hexane을 이용해 10/90 분획에서 wash 과정을 거쳐 불순물을 효과적으로 제거하는 방법을 선택하였다.
이때 silica 카트리지가 florisil 카트리지 보다 높은 회수율을 보였는데 이는 같은 용출조건에서 florisil 카트리지가 ipfencarbazone에 대한 흡탈착이 상대적으로 약하기 때문인 것으로 판단되었다(Table 2). 따라서 최종 정제는 silica 카트리지를 이용해 ethyl acetate/n-hexane (10/90, v/v) 10 mL로 불순물 제거 후 ethyl acetate/n-hexane (20/80, v/v) 10 mL로 용출하는 방법을 선택하여 농산물 추출 시료 중 간섭물질로부터 ipfencarbazone을 효과적으로 정제할 수 있었다.
분석법의 검증
본 연구에서 확립한 시험용액 조제 및 기기분석법을 이용하여 검체 중 ipfencarbazone의 검출한계 및 정량한계를 계산하였다. 검출한계는 아래의 식을 이용해 계산하였으며 최소검출량이 0.003 ng (S/N > 3)에 따라 0.003 mg/kg이었다. 정량한계 또한 아래의 식을 이용하여 최소검출량 0.01 ng (S/N > 10)에 따라 0.01 mg/kg이었다.
분석법의 직선성
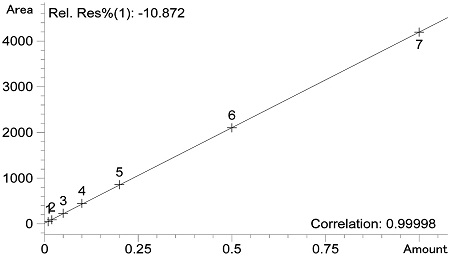
분석법의 직선성 확인을 위해 ipfencarbazone 표준용액 0.01, 0.02, 0.05, 0.1, 0.2, 0.5 및 1.0 μg/mL을 제조하여 1 μL씩 GC-ECD에 주입하여 분석한 결과 농도 대비 peak 면적과의 결정계수(r2)가 0.999 이상으로 나타남을 확인하였으며 이는 CODEX 가이드라인(CAC/GL 40, 2003)에 부합함을 알 수 있었다(Fig. 2).
분석법의 회수율 시험
확립된 분석법은 현미, 대두, 고추, 감귤, 감자의 무처리 시료에 ipfencarbazone 표준용액을 첨가한 회수율 시험결과를 통해 분석법의 선택성, 정확성, 정밀성, 재현성을 평가할 수 있었다. 분석법의 선택성(selectivity)은 추출 및 정제과정을 거쳐 분석된 무처리 시료구의 크로마토그램에서 ipfencarbazone과 같은 머무름 시간의 간섭물질이 발견되지 않는 것으로 확인할 수 있었다(Fig. 3).
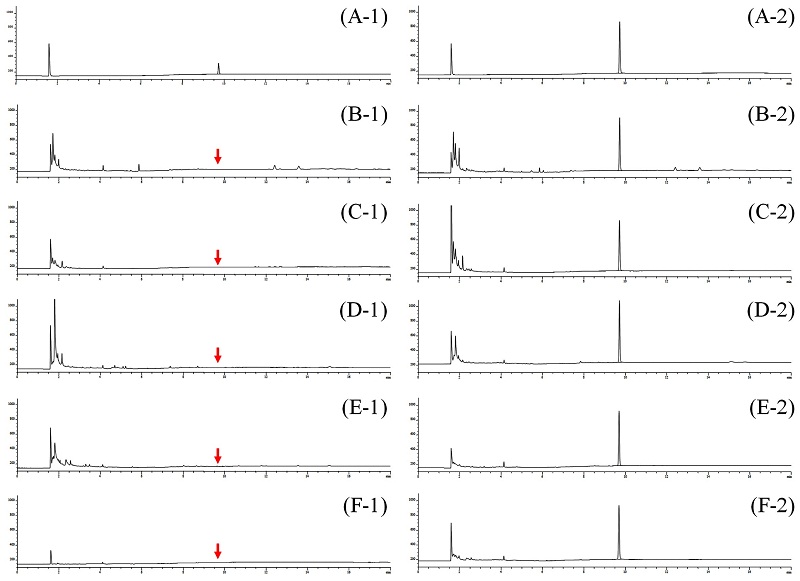
Chromatograms of ipfencarbazone (A) standard of ipfencarbazone 0.1, 0.5 mg/kg; (B) blank and recovery of hulled rice; (C) blank and recovery of soybean; (D) blank and recovery of pepper; (E) blank and recovery of mandarin and (F) blank and recovery of potato.
평균 회수율은 곡류인 현미에서 80.6-95.9%, 콩류인 대두에서 91.9-105.3%, 과채류인 고추에서 103.0-110.7%, 과일류인 감귤에서 100.6-112.3%, 서류인 감자에서 90.9-108.6%이었고, 분석오차는 모두 10% 미만으로 확인되었다(Table 3). 이를 통해 분석법의 정확성(accuracy), 정밀성(precision), 재현성(repeatability)을 검증할 수 있었고, CODEX 가이드라인(CAC/GL 40, 2003)에서 제시한 잔류농약 분석법의 조건에 부합하는 것을 확인하였다. 이때 분석된 크로마토그램이 Fig. 3에 제시되었다.
실험실간 검증
분석법의 유효성 입증을 위해 경인지방식품의약품안전청 유해물질분석팀과 실험실간 검증을 수행하였다. 개발된 분석법을 경인지방식품의약품안전청에 제공하고 동일한 방법으로 분석을 수행한 후 회수율 및 표준편차를 비교하였다. 경인지방식품의약품안전청의 각 농도별 평균 회수율은 94.6-113.7%이고 표준편차는 10% 미만으로 측정되었다. 두 실험실간 회수율 결과에 따른 평균값은 95.1-106.1%, 변이계수 (CV, %) 또한 모든 처리구에서 CODEX 가이드라인(CAC/GL 40, 2003)에서 제시한 기준 처리농도 > 1 μg/kg, ≤ 0.01 mg/kg의 45%, 처리농도 > 0.01 mg/kg, ≤ 0.1 mg/kg의 32% 보다 낮아 적합한 것으로 확인되었다(Table 4).
GC/MS를 이용한 재확인
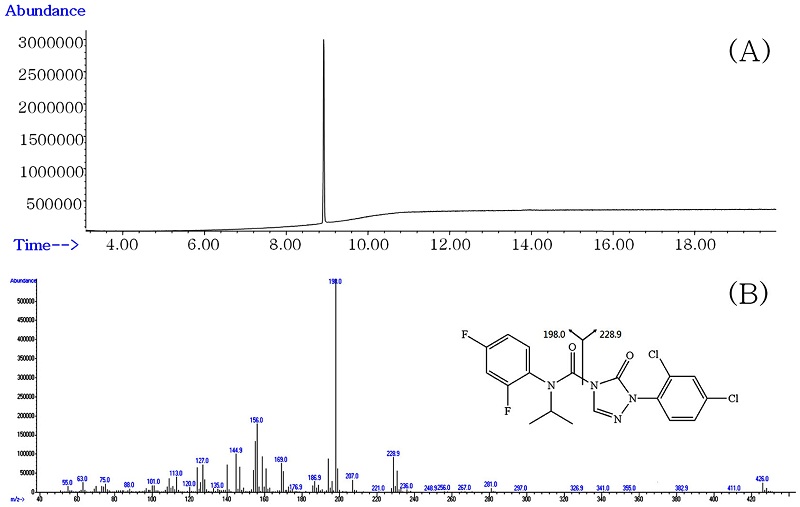
검체 중 ipfencarbazone의 재확인을 위해 GC/MS의 EI 모드를 이용해 분석하였으며, 70 eV에서 용이하게 이온화되었다. Ipfencarbazone의 평균분자량인 427.23을 포함하는 범위인 50-550 m/z의 스캔모드에서 ipfencarbazone 표준용액을 직접 주입한 총 이온 크로마토그램과 질량 스펙트럼을 확인하여 특성이온을 선정하였다(Fig. 4). Ipfencarbazone의 exact mass 값은 426.0 m/z이며 스펙트럼 상에서 분자이온은 거의 검출되지 않았다. Ipfencarbazone의 특성이온으로는 스펙트럼 상에서 충분한 intensity를 갖는 198, 228 m/z을 선정하였으며 이는 아민기(N-H)와 카복실기(C=O) 결합을 하고 있는 아미드 결합이 끊어져 생성된 두 분자의 이온임을 확인하였다. 분석된 스캔 모드의 크로마토그램과 질량스펙트럼 및 특성이온의 분자구조식을 Fig. 4에 제시하였으며, 이때 ipfencarbazone의 머무름 시간은 8.9분이었다(Table 5).
결 론
본 연구에서는 GC-ECD를 이용한 농산물 중 제초제 ipfencarbazone의 신규 잔류분석법을 개발하였다. 농산물 시료(현미, 대두, 고추, 감귤, 감자)는 acetone을 이용해 추출하고 n-hexane을 이용해 액액분배한 뒤 silica SPE 카트리지로 정제한 뒤 기기 분석하였다. Ipfencarbazone의 정량적 분석을 위해 GC-ECD를 이용하였으며, 신뢰성을 확보하기 위해 GC/MS로 재확인을 하였다. 분석법의 검출한계(LOD)는 0.003 mg/kg이었고, 정량한계(LOQ)는 0.01 mg/kg이었다. 회수율 시험은 LOQ, 10LOQ, 50LOQ의 세 농도에서 5 반복으로 수행하였으며, 모든 농산물에서 80.6-112.3% 수준이었다. 또한 경인청과의 실험실간 검증 결과도 농산물 시료 및 처리수준에 관계없이 회수율 결과 95.1-106.1%를 나타내어 모두 CODEX 가이드라인(CAC/GL 40, 2003)의 조건을 만족하는 수준임을 확인하였다. 따라서 본 연구에서 개발된 분석법은 국내 유통되는 농산물 중 ipfencarbazone의 안전관리에 이용될 공정분석법으로 사용가능할 것으로 판단된다.
Acknowledgments
This study was carried out with the support of "Safety Evaluation and Analysis Method on Pesticide Residues in Foods-2014(14161MFDS009)" from Ministry of Food and Drug Safety, Republic of Korea in 2014.
Literature Cited
- CAC (CODEX Alimentarius Commission), (2003), Guidelines on good laboratory practice in residue analysis, CAC/GL 40-1993, Rev. 1-2003, Rome, Italy.
- EFSA (European Food Safety Authority), (2014), http://www.efsa.europa.eu/fr/efsajournal/doc/3737.pdf.
- Hokko 화학공업주식회사, (2013), 농약초록(일반명: Ipfencarbazone), http://www.acis.famic.go.jp/syouroku/ipfencarbazone/ipfencarbazone_01.pdf.
- Hubert Menne and Helmut Köcher, (2008), HRAC Classification of Herbicides and Resistance Development, Modern crop protection compounds, 3, p5-24.
- Jane Elisabeth Corbin, Christopher John Mathews, Glynn Mitchell, Claudio Screpanti, (2013), Novel herbicide, United states patent application publication, PCT/GB10/02268, http://images3.freshpatents.com/pdf/US20130252811A1.pdf.
- MHLW (Ministry of Health, Labour and Welfare), (2014), http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=7550.
- Sun, Qixia., Yifei. Jang, Youshun. Li, Shengxiang. Wang, Qian. Chen, (2012), Analysis of ipfencarbazone in 2.5% GR by HPLC, Pesticide Science and Administration, 12, p50-52.
- 동방아그로, (2012), Benzobicyclon+mazosulfuron+Ipfencarbazone SC 중 ipfencarbazone의 작물 (벼) 잔류성 시험 보고서.
- 동방아그로, (2013), 원제초록: ipfencarbazone.
- 일본 약사·식품 위생 심의회, (2013), Ipfencarbazone에 따른 식품 규격(식품 중 농약 잔류기준 설정)의 설정, http://www.mhlw.go.jp/shingi/2004/04/dl/s0420-4-t17.pdf.