
2013년 경북 상주지역 감나무로부터 분리한 Colletotrichum gloeosporioides 탄저병균의 스테롤 생합성 저해 살균제에 대한 감수성
 ; Oh Gyeong Kwon3 ; Sangsub Han4 ; Byeongjin Cha5 ; In Kyu Song6
; Oh Gyeong Kwon3 ; Sangsub Han4 ; Byeongjin Cha5 ; In Kyu Song6
초록
Colletotrichum gloeosporioides탄저병균은 우리나라 감 재배지 주요 병의 하나이다. 2013년 상주 지역 감(Diosprosi kaki) 과원에서 C. gloeosporioides에 의하여 감염된 신초, 과일 및 잎으로부터 병원균을 분리하여 prochloraz manganese complex, tebuconazole, mancozeb+myclobutanil, fluquinconazole+prochloraz, tebuconazole+tolyfluanid 등 총 5종의 살균제에 대한 반응을 조사하였다. 분리된 67 균주 모두 공시 약제의 포장적용 농도에서 균사생육이 완전히 억제되었다. Tebuconazole의 EC50값의 범위는 0.02-1.04 μg/ml이었으며 평균 0.31 μg/ml이었다. Pochloraz manganese complex의 EC50값의 범위는 0.02~0.23 μg/ml이었으며 평균 EC50값은 0.078 μg/ml이었다. Fluquinconazole+Prochloraz(FP)에 대한 EC50값을 조사한 결과, 평균 0.029 μg/ml이었다. EC50값에 기초한 약제간 상관계수 r은 tebuconazole과 prochloraz manganese complex간에는 0.42이었으며, prochoraz manganese complex와 FP 합제 간에는 0.44, tebuconazole과 FP 합제 간은 0.27이었다.
Abstract
Colletotrichum gloeosporioides is one of the most serious pathogens of persimmon in Korea. In 2013, 67 isolates of C. gloeosporioides were isolated from infected fruits, leaf and twigs of persimmon (Diosprosi kaki) at Sangju, Gyeongsangbukdo and fungal responses against five fungicides (prochloraz manganese complex, tebuconazole, mancozeb+myclobutanil, fluquinconazole+prochloraz, and tebuconazole+tolyfluanid) were evaluated by their growth on the fungicide-medium. All isolates were inhibited mycelium growth on the medium with each recommended application concentration of flied. EC50 (μg/ml) of tebuconazole was from 0.02 to 1.04 and average was 0.31. EC50 (μg/ml) of prochloraz manganese complex was 0.02~0.23 average was 0.078. Average EC50 values (μg/ml) of Fluquinconazole+Prochloraz (FP) was 0.029. On the basis EC50 (μg/ml), the correlation coefficient (r) between tebuconazole and prochloraz manganese complex, prochloraz manganese complex and FP, tebuconazole and FP were 0.42, 0.44 and 0.27, respectively.
Keywords:
Colletotrichum gloeosporioides, fungicide, tebuconazole, prochloraz키워드:
살균제서 론
C. gloeosporioides에 의한 탄저병은 넓은 기주 범위로 인하여 국내 재배 주요 경제 작물의 수확량과 품질에 막대한 피해를 주고 있다(Adaskaveg and Försyer, 2000; Kim et al., 2002). 특히, 탄저병은 경남 지역과 경북 상주를 비롯한 단감 및 곶감용 떫은 감의 주요 생산 지역에서 매년 심각한 피해를 주고 있다(Jung et al., 2014; Lim et al., 2008).
떪은 감의 생산량은 단위 면적당 낮은 투입비용으로 인한 신규 과수원 개원 면적의 증가와 가계 소득 향상에 따른 가공품인 곶감의 소비 시장 확대로 증가하고 있다(Anonymous, 1999, 2005; Lim et al., 2008; Cho et al., 2014). 그러나 국내 최대 떫은 감 생산지인 상주의 생산량은 연도별 변화가 심하여 최대 23%에 달하고 있는데(Sangju city, 2014), 이는 지역내의 감수성 품종인 상주둥시의 많은 기주량과 기후변화에 따른 주요 병해충의 발생 양상 변화 및 경종적 측면 등을 들 수 있다(Adaskaveg and Försyer, 2000). 특히, 재배 품종의 획일화에 따른 기주 량 증가는 병해충의 발생양상과 피해 정도를 다양하게 변화시키고 있으며, 재배자들 사이에 널리 퍼져있는 다른 작물과 비교하여 적은 농약 사용으로 재배가 가능하다는 사고에 따른 방제 소홀이 상주지역의 주요 경제작물인 떪은 감의 안정적 생산을 제한하는 한 요인이다(Lim et al., 2008). 또한 다수확 및 조기 수확을 위한 질소를 포함 한 비료의 과다시용이 병해충의 발생에 유리한 환경을 조장하는 것이 또 다른 원인이 될 수 있다(Kim et al., 2002).
감 재배에 있어 C. gloeosporioides에 의한 탄저병은 묘목 생산 단계에서부터 줄기, 잎자루, 눈 및 과일 등 지상부의 모든 부위에 발생하여 생산량 감소는 물론 어린 나무의 고사로 재배자에게 큰 어려움을 주고 있다(Lim et al., 2009). 특히, 어린 나무의 고사는 재식을 위한 초기 비용의 증가로 농업인들에게 많은 경제적 어려움을 초래한다. 탄저병 방제는 스테롤 생합성 저해제를 비롯한 다양한 살균제 사용에 의존하고 있다. 스테롤 생합성 저해제는 스테롤 생산을 저해하고 이로 인해 세포막 기능을 손상시켜 자낭균류를 포함한 곰팡이에 의한 다양한 식물병 방제에 활용되고 있다(Hargreaves et al., 1996).
이에 본 연구에서는 상주지역 떪은 감 생산 과수원의 감염 신초, 과일 및 잎으로부터 탄저병균을 분리하여 상주지역 농가 선호도가 높은 스테롤 생합성 저해제에 대한 감수성을 비교하여 현장 요구형 탄저병 방제체계 확립을 위한 기초 자료를 확보하고, 또한 Lim 등이 2008년에 조사한 결과와 비교하여 해당 약제에 대한 포장 분리 균의 감수성 변화를 비교하고자 수행 하였다.
재료 및 방법
병원균 분리 및 보관
2013년 6월부터 9월 사이 상주 지역의 감 과수원에서 탄저병균에 의한 감염이 의심되는 과일, 잎 및 신초를 채집하여 병원균을 분리하였다. 채집대상 과수원은 상호 교차 감염 가능성을 최소화하기 위하여 최소 8 km 거리를 두고 선정하였다. 병원균 분리는 2겹의 키친타올을 깔고 50 ml의 살균 증류수를 넣어 포화습도를 유지시킨 플라스틱 용기(250 × 250 × 70 mm, L ×W× H)에 채집 된 시료를 넣어 24~48시간 동안 25~28°C 항온기에서 포자를 형성 시켰다. 살균 증류수로 병반부위에 형성된 포자를 수확·현탁하여 100~200개/ml로 포자 농도를 조절하였다. 포자현탁액은 세균의 생육을 억제하기 위하여 300 μg/ml 농도의 streptomycin이 함유된 감자한천배지에 100 μl씩 분주 후 도말 건조하였다. 포자현탁액이 도말 된 배지는 25~28°C에서 2~3일간 배양 후 자란 균총 선단을 떼어내어 새로운 감자한천 배지에 옮겨 배양하였다. 3곳의 과수원으로부터 총 67 균주를 분리하였다.
분리된 탄저병균들은 신선한 균총 선단에서 직경 5 mm의 균사 조각을 cork borer로 떼어내어 직경 18 mm, 길이 20 cm의 시험관 사면배지에 접종하여 25~28°C에서 7일간 배양 후 4°C 냉장 보관하며 실험에 사용하였다.
살균제 감수성 검정
현재 감 탄저병의 방제를 위하여 등록되어 사용되고 있는 스테롤 생합성 저해제 단제와 혼합제 중 Lim 등(2009)이 사용한 prochloraz manganese complex, tebuconazole, fluquinconazole+prochloraz 등 총 5종의 살균제에 대한 감수성을 조사하였다(Table 1).
이들의 제형과 활성성분의 함량 및 권장처리 농도는 Table 1과 같다.
공시 살균제 중 tebuconazole, prochloraz및 fluquinconazole+prochloraz에 대한 감수성 차이는 약제 농도를 0.01, 0.1, 1 및 10 μg/ml가 되도록 제조한 감자한천배지를 이용하였다.
감수성 조사를 위한 병원균의 접종원은 냉장 보관 중인 균을 25~28°C에서 7일간 감자한천배지에 배양 후 균총 선단에서 직경 5 mm의 균사 조각을 cork borer로 떼어내어 사용하였다. 접종된 살균제 배지들은 28°C에서 7일간 배양 후 균총의 길이를 측정하였으며 억제율(%)은 다음 식에 의하여 산출 비교하였다. 억제율(%) = 1 − [처리구 균총 길이(mm)/대조구 균총 길이(mm)] × 100. 약제간 상호 관계와 EC50 값은 SAS program을 이용하여 분석하였다(SAS Institute, 1999).
결과 및 고찰
Prochloraz manganese complex에 대한 감수성
Imidazole 계열의 살균제인 prochloraz는 적용 스펙트럼이 넓어 Alternaria spp., Botrytis spp., Colletotrichum spp. 및 Septoria spp. 등에 의한 식물 병 방제에 등록 사용되고 있으며, 종자소독제로도 널리 사용되고 있다(Tomlin, 2006). 2008년도에 분리한 110균주 중 97.3%의 균주가 prochloraz의 포장 권장농도인 250 μg/ml 농도로 첨가된 배지에서 균사생육이 91%이상 억제 되었고, 2.7%의 균주 만이 81~90% 사이의 균사생육이 억제되는 균주를 보였으나(Lim et al., 2009), 2013년 분리한 모든 분리 균주가 포장 적용 농도에서 균사생육이 완전히 억제되었다(Table 2). 2008년과 2013년 분리 균주의 prochloraz manganese complex에 대한 감수성 분리 균주 수의 차이와 대상 포장의 약제 사용 변화로 추측된다(Brent and Hollomon, 1998).
Tebuconazole에 대한 감수성
Tebuconazole은 1986년 출시 된 약제로 감, 사과, 고추, 포도 및 배 등의 주요 경제 작물의 탄저병을 비롯한 다양한 진균성 병 방제에 등록 사용 되고 있는 triazole 계열 약제이다(Tomlin, 2006; KCPA, 2013). 2013년 분리한 모든 균주가 포장 사용 권장농도 권장농도인 150 μg/ml에서 균사의 생육이 완전히 억제되어 2008년 조사에서의 감수성과 유사한 결과를 보였다(Table 2).
2008년에 분리된 감나무 탄저병균 C. gloeosporioides의 prochloraz와 tebuconazole에 대한 감수성을 비교할 경우(Lim et al., 2009) 감수성의 차이는 나타나지 않았지만 상주지역에서의 동일 약제의 효율적이고 지속적 사용을 위해서는 균주 분리 포장과 모집단을 확대하여 장기적이고 정기적인 모니터링이 필요할 것으로 생각된다. 살균제에 대한 감수성 저하는 탄저병 발생증가에 따른 방제효율이 높은 약제의 선호도 및 사용횟수 증가와 밀접한 관계가 있다(Brent and Hollomon, 1998; Yasunori and Ishii, 1998).
Mancozeb+Myclobutanil (MM)에 대한 감수성
2008년 분리한 110균주 중 권장농도 처리구에서 96.4%의 균주가 완전히 균사생육이 억제되었으나(Lim et al., 2009), 2013년 분리한 모든 균주가 mancozeb 1,300 μg/ml와 myclobutanil 40 μg/ml 농도로 합제 형태의 공시 약제가 처리된 공시 배지에서 균사의 생육이 완전히 억제되어 상주 지역에서 떫은 감 생산의 제한 요인 중의 하나인 탄저병 방제에 유용할 것으로 생각된다(Table 2).
Fluquinconazole+Prochloraz (FP)에 대한 감수성
2013년과 2008년 분리한 균주의 Imidazole과 triazole 합제인 FP에 대한 감수성(Lim et al., 2009)을 비교한 결과, 포장 권장농도에서 균사생육이 완전히 억제되어 2008년 분리 균주에 비하여 감수성이 다소 높게 나타났다. 그러나 2008년 분리 균주들의 경우 prochloraz 단제에 대한 감수성 보다는 합제인 FP에 대한 감수성이 높았던 점을 고려할 경우 안정적이고 효율적 탄저병의 방제를 위하여 합제의 효율성이 높을 수 있음을 시사하는 것이다(Brent and Hollomon, 1998; Fry, 1982).
Tebuconazole+Tolyfluanid (TT)에 대한 반응
Tebuconazole를 포함한 스테롤 생합성 저해제들의 경우 다른 다양한 작용점을 지닌 약제들과 합제로 다양한 병 방제에 활용되고 있다. TT의 경우 tebuconazole의 최종 적용 농도는 75 μg/ml으로 단제의 1/2 수준이다. 2013년 분리된 균주 모두가 포장 권장농도에서 균사생육이 완전히 억제되어 2008년 분리 균주에 비하여 감수성이 다소 높게 나타났다(Table 2). 2008년과 2013년 분리한 균주의 tebuconazole 단제와 합제에 대한 감수성을 비교할 경우, 포장 분리 균주를 대상으로 한 모니터링을 강화하여 감수성 변화 정도에 대한 기초자료의 제공이 C. gloeosporioides 에 의한 탄저병의 효율적 관리를 위하여 필요할 것으로 생각된다(Delp, 1988; Lim et al., 1998; 2009; Staub, 1991, Yasunori and Ishii, 1998).
2008년 스테롤 생합성 저해제 단제 또는 합제에 대한 감수성을 조사한 결과, 2005년 현장 분리 균과 비교할 때 감수성 감소 저하현상이 관찰 되었으나, 2013년 분리 균주를 대상으로 조사한 결과, 감수성의 큰 변화는 없는 것으로 추측된다(Lim et al., 2009). 특히 2013년 분리한 균주 모두 시험에 공시한 약제의 포장 권장농도에서 균사 생육이 완전히 억제되었으나, 다양한 분리원(과수원)과 모집단의 확대를 통한 보다 면밀한 모니터링이 탄저병뿐 만 아니라 감 재배과정에서 문제되는 병 관리에 도움이 될 것으로 생각된다(Delp, 1988; Staub, 1991, Tomlin, 2006). 전염원의 포장 내밀도, 발병 정도, 방제 횟수 및 사용약제의 계열 등 다양한 변수에 의하여 약제에 대한 감수성의 차이 나타날 수 있으므로 선정 과수원의 방제 프로그램에 대한 보다 면밀한 조사를 병행하여 감수성 변화를 추적 할 필요가 있을 것으로 생각된다(Brent and Hollomon, 1998; Delp, 1988).
Tebuconazole과 prochloraz에 대한 EC50값 비교
분리된 67균주를 tebuconazole과 prochloraz 각각 25%와 50% 함유한 약제를 0.01, 0.1, 1 및 10 μg/ml 되도록 제조한 배지에서 EC50값을 조사한 결과, tecoconazole 함유 약제에 대한 EC50값은 0.02~1.04 μg/ml 이었으며, 평균 값은 0.31 μg/ml 이었다(Table 3). 분리 균주들 중 22균주(32.8%)의 EC50값의 범위는 0.125~0.24 μg/ml이었고, 28.6%의 균주는 0.25~0.49 μg/ml이었다. 또한 1 μg/ml 이상의 높은 EC50값을 보이는 균주의 비율은 1.5%였으며, 0.063 μg/ml 의 낮은 EC50값을 보이는 균주의 비율은 6% 정도였다(Fig. 1). Prochloraz 함유 약제의 EC50값의 범위는 0.02~0.23 μg/ml으로 최대값의 경우 teuconazole의 EC50값보다 약 1/5 정도 낮게 나타나 감수성 높은 것으로 나타났다(Table 3). 분리된 67균주의 평균 EC50값은 0.078 μg/ml로 tebuconazole에 대한 평균 값의 1/4 수준이었다(Table 3). EC50값이 0.05~0.09 μg/ml 범위의 균주 비율이 68.7%으로 가장 높았으며, 0.025 μg/ml 이하의 EC50값을 나타낸 균주의 비율은 약 3% 였으며, 0.1 μg/ml 이상은 19.4% 였다(Fig. 1). FP (Fluquinconazole+Prochloraz)에 대한 EC50값을 조사한 결과, 평균 0.029 μg/ml이었으며, 0.01~0.04 μg/ml 범위의 EC50값을 보이는 균주의 비율이 가장 높았다(Table 2, Fig. 1). Prochloraz과 tebuconazole과 사이 EC50값의 상관계수 r값은 0.42로 방제가에 근거한 2008년도의 0.42와 같게 나타났다(Table 4). 그러나 tebuconazole보다 늦게 등록된 prochloraz 단제 및 합제의 사용 증가를 고려할 경우 지속적 사용을 위한 정기적 모니터링이 필요할 것으로 추축된다(Brent and Hollomon, 1998). prochloraz과 FP (Fluquinconazole+Prochloraz) 사이 EC50값의 r값은 0.44로 방제가에 근거한 2008년도의 0.61보다 낮게 나타났다(Table 4). Tebuconazole과 FP (Fluquinconazole+Prochloraz) 사이 EC50값의 r 값은 0.27로 방제가에 근거한 2008년도의 −0.01과 비교하여 높게 나타났다(Table 4). 이러한 약제간 상관계수의 변화는 실제 영농 현장에서의 사용약제의 계열 또는 방제횟수와 연관성이 높을 것으로 생각되며 이 부분에 대한 세밀한 연구가 진행되어야 할 것이다(Brent and Hollomon, 1998). Tebuconazole과 prochloraz, tebuconazole과 FP (Fluquinconazole+Prochloraz) 및 prochloraz과 FP (Fluquinconazole+Prochloraz) 사이의 상호 영향을 분석하기 위하여 단순직선회귀식을 구한 결과, 각각 Y=0.062x+0.058, R2=0.173, Y=0.048x+0.014, R2=0.072, Y=0.525x-0.011, R2=0.197과 같은 회귀식을 얻어 공시 약제간 상호 영향은 적은 것으로 나타났다(Fig. 2). 포장 분리균을 대상으로 한 스테놀 합성 저해제를 원제로 한 단제 또는 합제에 대한 감수성의 정기적인 모니터링이 약제의 지속적이고 효율적 사용을 위하여 필요할 것으로 생각되며 농민들의 약제 사용에 있어 상표명 보다 원제에 대한 이해와 인식 또한 중요 할 것으로 판단된다(Brent and Hollomon, 1998).

EC50 of C. gloeosporioides isolates obtained from fruits, leaf, and twigs of persimmon trees in Sangju
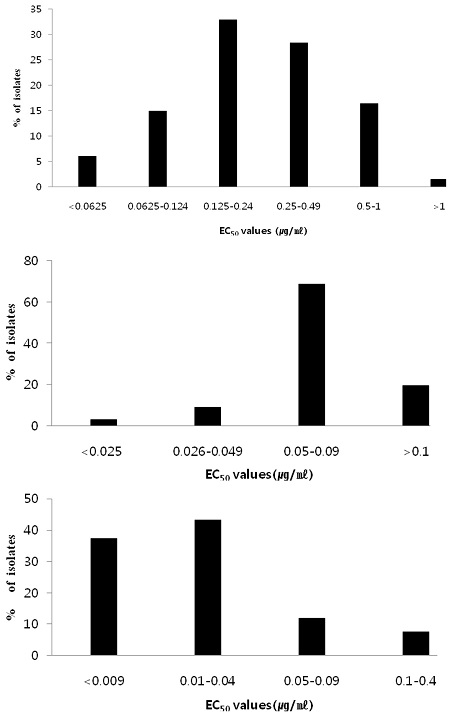
Distribution of EC50 (μg/ml) of tebuconazole (upper), prochloraz manganese complex (middle), and fluquinconazole +prochloraz mancozeb (bottom) to C. gloeosporioides isolates obtained from persimmons collected at Sangju in 2013.
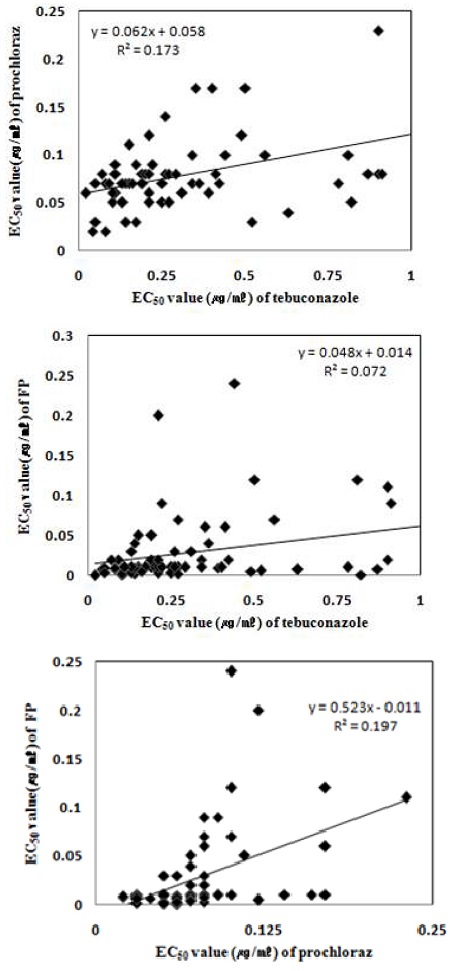
Correlation between tebuconazole and prochloraz manganese complex (upper), prochloraz manganese complex and FP (middle), and tebuconazole and FP (bottom) of C. gloeosporioides isolates obtained from persimmons collected at Sangju in 2013.
Multi-step에 의하여 저항성이 발현되는 스테놀합성 저해제는 benzimidazole, dicarboximide 및 strobilurin 계열 약제들에 비하여 저항성에 의한 급속한 약효 저하현상 위험성은 낮으나, Rhynchosporium secalis의 20년간triadimenol 에 대한 감수성 변화 보고를 고려할 경우 사용에 각별한 주의가 요구되는 것으로 사료된다(Brent and Hollomon, 1998; Fletcher and Wolfe, 1981).
한편 Lim 등(2009)은 2007년과 2008년 감 과원에서 농가의 농약 사용 실태 조사를 수행한 바 있는데, 상주지역과 같이 탄저병에 대한 감수성 품종의 재배면적이 넓은 지역에서는 정기적인 농가의 농약 사용 실태를 파악하여 저항성 문제에 효과적으로 대응할 수 있는 방안을 강구하는 것이 필요할 것이다. 특히 동일 계열 살균제의 연용 및 과다 사용에 의한 약효 저하 현상에 따른 문제점을 해결하기 위하여 단제 보다는 합제, 동일계열의 합제 보다는 다른 계열간의 합제 및 작용기작이 다른 약제를 활용한 합리적 방제 프로그램의 활용이 필요할 것이다.
Acknowledgments
병원균 분리와 실내실험을 도와준 이가영에 감사를 표한다.
Literature Cited
- Adaskaveg, J. E., and H. Försyer, (2000), Occurrence and management of anthracnose epidemics caused by Colletotrichum species on tree fruits crops in California, In Colletotrichum-host specificity, pathology and host-pathogen interaction, D. Prusky Eds, APS Press, Minnesota, USA, p300-316.
- Anonymous, (1999), Working hours depending on crops and working steps, Research report of agricultural management, p84.
- Anonymous, (2005), Regional income data of agricultural products on 2004, Research report of agricultural management, p112.
- Brent, K. J., and D.W. Hollomon, (1998), Fungicide resistance: The assessment of risk. Eds, FRAC, Brussels, Belgium, p48.
- Cho, K. S., K. B. Ma, H. C. Lee, J. H. Choi, S. T. Choi, and K. U. Lee, (2014), Persimmon, food of the gods, RDA Interrobang, 134, p1-20.
- Delp, C. J., (1988), Fungicide resistance in North America, The American Phytopathological Society, St. Paul, Mn, p133.
- Fletcher, J. S., and M. S. Wolfe, (1981), Insensitivity of Erysiphe graminis f. sp. hordei to triadimefon, triadimenol and other fungicides, Brighton Crop Protection Conference; pests and diseases, 2, p633-640.
- Fry, W. E., (1982), Principles of plant disease management, Academic Press, Orlando, USA, p378.
- Hargreaves, J. A., J. P. R. Keon, and R. Croxen, (1996), Molecular genetics of ergosterol biosynthesis, In Ustilago maydis, in modern fungicides and antifungal compounds, H. Lyr Eds, Intercept Ltd, Andover,UK, p117-123.
-
Jung, Y. H., E. J. You, D. Y. Son, J. H. Kwon, D. W. Lee, S. M. Lee, and H. Y. Choo, (2014), A survey on disease and insect pests in sweet persimmon export complexes and fruit for export in Korea, Korean J. Appl. Entomol, 53(2), p157-169.
[https://doi.org/10.5656/KSAE.2014.03.1.059]

- KCPA (Korea Crop Protection Association), (2013), 2013 guide book of crop protection agents, Korea Crop Protection Association, Seoul, Korea.
- Kim, T. C., G. C. Lee, and Y. M. Lee, (2002), Cultivation of new technology and physiology and ecology of persimmon, Jungangsenghwalsa, Seoul, Korea, p332.
- Lim, T. H., T. H. Chang, and B. J. Cha, (1998), Incidence of benzimidazole- and dicarboximide-resistant isolates of Monilinia fructicola from overwintering mummies and peduncles on peach trees, Korean. J. Plant Pathol, 14, p367-370.
- Lim, T. H., Y. H. Choi, I. K. Song, K. R. Kim, D. W. Lee, and S. M. Lee, (2008), Survey of actual condition of management of persimmon orchards in Sangju, Gyeongbuk in 2007 and 2008, Kor. J. Pesticide Sci, 12, p414-420.
- Lim, T. H., D. W. Lee, Y. H. Choi, S. M. Lee, S. S. Han, and B. J. Cha, (2009), Sensitivity to ergosterol biosynthesis inhibiting-fungicides of Colletotrichum gloeosporioides isolated from persimmon trees, Kor. J. Pesticide Sci, 13, p171-176.
- Sangju city, (2014), 2013 statistical year book, http://www.sangju.go.kr.
- SAS Institute, (1999), SAS OnlineDoc, version 8, SAS Institute, Cary, NC.
-
Staub, T., (1991), Fungicide resistance: Practical experience with antiresistance strategies and the role of integrated use, Ann. Rev. Phytopathol, 29, p421-442.
[https://doi.org/10.1146/annurev.py.29.090191.002225]

- Tomlin, C. D. S., (2006), Prochloraz, in the pesticide manual, edition no.14, BCPC, Hampshire, U.K, p859.
-
Yasunori, T., and H. Ishii, (1998), Reduced sensitivity to fenarimol in Japanese filed strains of Venturia nashicola, Pestic. Sci, 54, p150-156.
[https://doi.org/10.1002/(SICI)1096-9063(1998100)54:2<150::AID-PS797>3.0.CO;2-A]
