
CpBV-ELP1 발현 재조합 벡큘로바이러스의 대량 증식과 파밤나방 방제 기술
초록
프루텔고치벌 브라코바이러스(CpBV)는 배추좀나방(Plutella xylostella)의 어린 유충에 기생하는 프루텔고 치벌(Cotesia plutellae) 공생 폴리드나바이러스이다. 일부 CpBV 유전자들은 피기생체 유충의 면역반응을 낮추는 데 중요한 역할을 담당한다. 본 연구는 기주의 면역작용을 억제하는 CpBV 유전자를 이용하여 살충력이 높은 재조합 벡큘로바이러스를 개발하는 데 응용할 목적으로 수행되었다. 기보고 자료에 기초하여 CpBV-ELP1를 발현하는 재조합 벡큘로바이러스(AcMNPV-ELP1)를 선발하여 파밤나방(Spodoptera exigua) 충체에서 증식시켰다. 충체에서 증식된 재조합바이러스들은 파밤나방 유충 한 마리 당 5 × 1010 polyhedral inclusion body (PIB)를 생산하였다. 배양된 AcMNPV-ELP1은 파밤나방 유충에 높은 병원성을 보였다. 특히 파밤나방 1령과 노숙령기에 높은 살충력을 나타냈다. 파밤나방 유충이 가해하는 배추에 재조합 벡큘로바이러스(5 × 106 PIB/mL)를 살포한 결과 처리 7일 후에 화학 농약인 테부페노자이드 보다 높은 방제효과(약 88%)를 나타냈다. 이 결과는 충체에서 대량배양된 AcMNPV-ELP1이 높은 병원성을 나타내 새로운 미생물방제제로 응용될 수 있음을 제시한다.
Abstract
Cotesia plutellae bracovirus (CpBV) is a polydnavirus symbiotic to C. plutellae parasitizing young larvae of the diamondback moth, Plutella xylostella. Several CpBV genes play important roles in suppressing immune responses of the parasitized larvae. This study tested a hypothesis that the CpBV genes inducing host immunosuppression could be applied to develop a potent recombinant baculovirus. Based on a previous study, a recombinant baculovirus expressing CpBV-ELP1 (AcMNPV-ELP1) was selected and multiplied using larvae of the beet armyworm, Spodoptera exigua. The recombinant viruses were produced in a yield of 5 × 1010 polyhedral inclusion body (PIB)/larva. The cultured AcMNPV-ELP1 exhibited a much higher pathogenicity against S. exigua larvae. However, its insecticidal activity was varied among larval instars of S. exigua, in which first and late instars were high susceptible. Spray of the recombinant baculovirus (5 × 106 PIB/mL) exhibited higher control efficacy (≈ 88%) against S. exigua larvae infesting cabbage than a chemical insecticide, tebufenozide, at 7 days after treatment. These results indicate that AcMNPV-ELP1 mass-cultured using host insect system is highly pathogenic and can be applied to develop a novel microbial control agent.
Keywords:
Baculovirus, Cotesia plutellae, Plutella xylostella, Polydnavirus, Recombinant, Spodoptera exigua키워드:
벡큘로바이러스, 프루텔고치벌, 배추좀나방, 폴리드나바이러스, 재조합체, 파밤나방서 론
공생은 서로 다른 생명체들 사이에 여러 형태의 생활양상을 통칭하는 생명현상이다. 다양한 병원미생물이 기주 곤충의 생존을 위협하는 기생(parasitism)을 보이고 있는 반면에 일부 미생물은 기주 곤충의 부족한 영양원의 보충, 독성물질의 처리 및 타 생명체로부터 보호의 기능을 수행하면서 상리공생(mutualism)을 이루고 있다. 폴리드나바이러스(polydnavirus: PDV)는 숙주 및 기주를 가지고 각각 상리공생 및 기생의 생명현상을 보이고 있다(Kim et al., 2007).
PDV는 일부 맵시벌상과(Ichneumonoidea)의 벌목 곤충을 숙주로 생활하며, 이들 숙주의 벡터 역할의 도움을 받아 피기생체 나비목 유충 체내로 침입하게 된다(Webb and Strand, 2005). 이때 PDV는 자신의 유전자를 발현하여 기주 나비목 유충의 생리현상을 교란하며 숙주 기생봉의 생존을 도모하게 된다. PDV의 숙주 곤충은 맵시벌과(Ichneumonidae)와 고치벌과(Braconidae)를 포함하며, 이들에 공생하는 바이러스를 각각 Ichnovirus (IV) 그리고 Bracovirus (BV)의 두 속으로 분류하게 된다(Webb et al., 2000). 두 종류의 바이러스는 바이러스 입자의 모양에서도 차이를 보여 IV는 이중막의 외피 구조를 갖으나 BV는 단일막으로 구성되어 있으며, 서로 상이한 유전자 조성을 지니고 있어 이들이 독립적으로 기원하여 수렴 진화 과정을 통해 발달되어 온 것으로 추정하고 있다(Strand, 2010). BV의 경우 Nudivirus의 조상형을 기원으로 유래된 것으로 밝혀지고 있으나, IV의 경우는 아직 조상형 바이러스 기원을 찾지 못하고 있다(Bezier et al., 2009; Volkoff et al., 2010).
PDV의 게놈은 숙주 곤충의 염색체 상에 존재하는 프로바이러스이다. 따라서 해당 곤충 체내 모든 세포에 이 바이러스 게놈은 존재하나, 바이러스 입자를 형성하는 복제과정은 암컷 난소소관 기부의 난소받침 조직에서만 일어나게 된다(Wyler and Lanzrein, 2003). 형성된 바이러스 입자는 산란관 내강에 자리하고 기생봉 숙주가 나비목 유충 기주에 기생할 때 기생봉 알과 함께 기주 혈강으로 옮겨지게 된다. 이때 기주 혈강에 옮겨진 PDV 입자들은 기주 세포에 침입하고, 기주 유전자 발현 시스템을 이용하여 바이러스 자신의 유전자들을 발현시키게 된다. PDV 유래 다양한 유전자 산물은 기주의 면역을 억제하고, 발육을 지연시켜 숙주 기생봉의 발육을 도모하게 된다(Kim et al., 2007).
프루텔고치벌(Cotesia plutellae)은 자신의 공생 PDV인 CpBV (C. plutellae bracovirus)를 가지고 기주인 배추좀나방(Plutella xylostella) 유충을 기생하게 된다(Bae and Kim, 2004). 기생된 배추좀나방 유충은 면역반응이 억제되고 발육이 지연되며, 이 과정 속에서 숙주 프루텔고치벌 알은 부화 및 유충 발육을 진행하여 형성된 노숙 유충이 기주의 몸 밖으로 빠져나와 용화하게 된다(Kim and Son, 2009; Kwon and Kim, 2010). 이때 피기생체 배추좀나방은 치사하게 되고, 우화된 프루텔고치벌은 다음 기주를 찾게 된다.
복제된 CpBV 바이러스 입자에 존재하는 유전체가 모두 판독되었고 전체 157 개의 유전자를 추정하였다(Chen et al., 2011). 이들 유전자들의 생리적 기능을 결정하기 위해 SERI (segment expression and RNA interference) 기술이 개발되었다(Barandoc and Kim, 2009). 즉, 복제된 바이러스 형태의 CpBV 게놈은 고리모양의 DNA 조각으로 구성되어 있으며, 이들 각각의 고리게놈은 여러 개의 바이러스 유전자를 갖고 있다(Choi et al., 2005). 이들 고리게놈을 각각 클로닝하여 배추좀나방 유충에 삽입하여 일시발현을 일으킨 후 특정 유전자의 RNA 간섭(RNA interference: RNAi)을 일으켜 이 유전자의 기능을 추정하는 과정이 SERI 기술이다. 이 기술을 통해 CpBV 유전자들의 기능을 추정한 결과 대부분 기주 면역을 억제하는 기능을 보였다. 이 가운데 CpBV-ELP1은 Cotesia 속에 속한 BV 바이러스들이 공통적으로 가지고 있는 EP1 유전자와 높은 상동성을 가지며, 세포독성을 지니는 것으로 추정되었다(Kwon and Kim, 2008). 모두 7개의 CpBV-ELP 유전자가 밝혀졌으며, CpBV-ELP2를 제외하고 6개의 유전자가 피기생체 배추좀나방에서 발현되었으며, 이 가운데 CpBV-ELP1은 대부분 피기생체 발육시기 그리고 조직에서 높게 발현되는 유전자이다(Kwon and Kim, 2008).
CpBV-ELP1을 벡큘로바이러스에 재조합하여 새로운 살충제 개발로의 연구가 진행되었다(Kim et al., 2008). 총 6 종류의 CpBV 유래 유전자를 이용하여 재조합 벡큘로바이러스를 제작하였고, 이들의 살충력을 비교한 결과 CpBV-ELP1이 재조합된 벡큘로바이러스 가운데 가장 높은 살충력을 지니는 것으로 나타났다. 그러나 분석된 벡큘로바이러스는 Sf9 곤충 세포주를 이용하여 증식되었으나, 실용적으로 해충 방제에 사용하기 위해서는 기주 곤충에서 대량 증식이 필요했고, 이를 통해 얻은 바이러스의 살충력을 재검정할 필요가 있었다. 또한 이 재조합바이러스에 대한 다양한 유충 영기별 감수성 분석이 필요하였다. 이를 수행하기 위해 본 연구는 CpBV-ELP1의 재조합 벡큘로바이러스를 파밤나방(Spodoptera exigua)에서 대량증식하였고, 이를 통해 얻은 재조합 벡큘로바이러스에 대해서 파밤나방의 영기별 감수성 및 포트 조건에서 바이러스 현탁액을 살포하면서 해충 방제제로 개발 가능성을 분석하였다.
재료 및 방법
곤충 사육
본 실험에 사용된 파밤나방은 온도 25 ± 1°C, 광조건 16:8시간(L:D), 상대습도 60 ± 10% 사육실에서 누대 사육하였다. 유충의 경우 인공사료(Goh et al., 1991)를 먹이로 제공하였고, 성충은 10%의 설탕물을 제공하여 사육하였다. 상기의 사육 조건에서 배추좀나방 유충은 배추를 먹이로 제공하였고, 성충은 10% 설탕물을 제공하여 사육하였다.
재조합 벡큘로바이러스 증식
벡큘로바이러스 제작은 Kwon et al. (2008)에 기술하였다. 출아형(budded form) 바이러스를 107 plaque-froming unit(pfu)/mL의 농도로 Sf9 세포주에 접종하고, fetal bovine serum이 포함된 TC-100 곤충세포배양액에서 5일 동안 배양하여 출아형과 다각체형(polyhedrin inclusion body: PIB)으로 증식하였다. 증식된 바이러스는 3,000 × g의 원심분리로 다각체형을 포함하는 Sf9 세포와 출아형이 포함된 상등액으로 나누었다. 이 상등액은 다시 새로운 세포를 감염시키는데 사용하였다. 다각체 바이러스 밀도는 위상차현미경(S730, Olympus, Tokyo, Japan)을 이용하여 검경하고, 세포계수기(Marienfeld, Germany)를 이용하여 계수하였다.
바이러스 혈강주입
미량주사위(Hamilton microsyringe, Reno, Nevada, USA)를 이용하여 유충 혈강으로 출아형 재조합바이러스를 연구목적에 맞도록 각 pfu 농도를 1 μL 부피로 주입하였다. 사용된 파밤나방은 5령충으로 복부 첫마디의 헛다리를 통해 바이러스를 주입하였다. 혈강주입 후 파밤나방은 먹이를 공급하고, 상기의 사육 조건에 바이러스 증식을 도모하였다.
재조합 벡큘로바이러스의 파밤나방과 배추좀나방에 대한 섭식처리
배추좀나방 4령충과 파밤나방 5령충에 대해 재조합바이러스의 살충력을 검정하였다. Sf9 세포주에서 증식된 다각체형 바이러스를 3 × 3 cm의 배추 잎 조각에 처리하였다. 이를 원형 용기(직경 9 cm)에 여과지를 깔고 올려놓았다. 처리된 배추잎 주변으로 6시간 절식된 유충을 옮겨 놓고 24시간 섭식시켰다. 이후 건전 배추잎을 제공하고 매 24시간 마다 치사된 개체를 조사하였다. 각 처리는 10마리씩 3반복으로 실시하였다. 이때 치사 유충은 외부 자극에 대해서 능동적 반응 움직임이 없는 개체로 규정하였다.
재조합 벡큘로바이러스에 대한 파밤나방 유충 시기별 감수성 변이
AcMNPV-ELP1 현탁액(5 × 106 PIB/mL)을 파밤나방 유충영기별(1령-5령)로 처리하였다. 각 유충령은 10마리씩 3반복으로 분석되었다. 처리 방법은 상기의 바이러스 처리 방법으로 실시되었다. 살충효과는 처리 후 7일째 사망율로 비교하였다. 대조구 바이러스 처리는 AcMNPV-EGFP를 같은 농도로 처리하였다.
간이 포장 조건에서 재조합 벡큘로바이러스의 파밤나방방제 효과
각 포트(30 × 60 cm)에 배추(높이 약 20 cm) 4포기를 키웠다. 각 배추 포기에 파밤나방 3령충을 20마리 접종하였다. 처리구는 곤충 체내에서 증식된 AcMNPV-ELP1을 5 × 106 PIB/mL의 농도로 살포하였다. 두 대조구로서 같은 농도의 AcMNPV-EGFP 처리와 화학 농약인 테부페노자이드(8% active ingredient, 미믹Ⓡ, 경농, 서울, 한국) 1,000 ppm을 각각 살포하였다. 무처리는 희석에 사용된 물만 살포하였다. 각 처리는 3반복(=포트)으로 실시되었다. 생존수는 처리 후 3일 및 7일 후에 각각 조사하여 대조구 대비 방제가를 산출하였다.
통계분석
모든 살충효과 시험 결과는 백분율 자료로서 arcsine 변환 후 SAS의 PROC GLM (SAS Institute, 1989)을 이용하여 ANOVA 분석후 처리평균간 비교를 실시하였다.
결 과
곤충 체내 재조합 벡큘로바이러스 대량 증식
곤충 체내에서 재조합 벡큘로바이러스를 대량 증식하기 위해, Sf9 세포주에서 증식된 출아형 벡큘로바이러스를 파밤나방 5령 유충 혈강에 주입하였다. 주입 후 3-5일 경과 후 치사된 개체를 모아서 알칼리 용액으로 용해시킨 후 바이러스 순화를 실시하였다. 순화된 바이러스 입자는 전형적인 벡큘로바이러스 다각체 구조를 보였다. 파밤나방 5령 유충 개체당 5 × 1010 PIB가 수거되었다.
재조합바이러스의 살충력 스크리닝
곤충 체내에서 증식된 재조합바이러스들의 파밤나방과 배추좀나방에 대한 살충력이 비교되었다(Fig. 1). 배추 먹이를 이용하여 동일한 양으로 섭식 투여한 결과(Fig. 1A) 모든 재조합 벡큘로바이러스는 배추좀나방과 파밤나방에 살충력을 나타냈다. 그러나 대상 기주에 따라 이들 살충력을 차이를 보여 파밤나방이 배추좀나방에 비해 높은 감수성을 나타냈다. 특히 파밤나방에서 이들 재조합 유전자에 따라 벡큘로 바이러스의 살충력에 변이를 나타내어, ELP1 유전자가 재조합된 벡큘로바이러스(AcMNPV-ELP1)가 비교적 우수한 방제력을 나타냈다. 파밤나방에 대한 AcMNPV-ELP1의 높은 감수성은 혈강으로 주입한 출아형 벡큘로바이러스에서도 유사하게 나타났다(Fig. 1B).
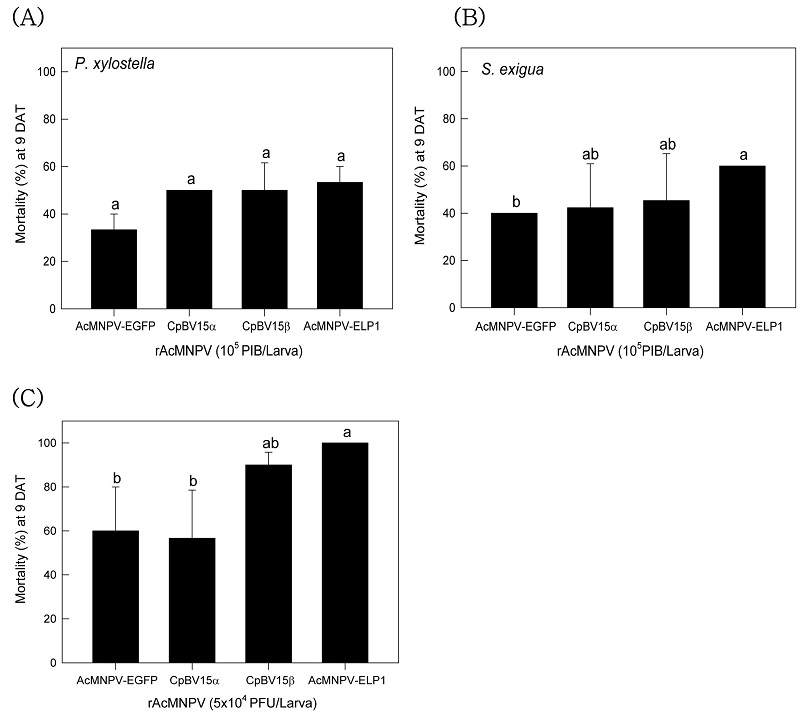
Toxicity of different recombinant AcMNPV (‘rAcMNPV’) against two different lepidopteran insects. Oral toxicity against fourth instar larvae of P. xylostella (A) and fifth instar larvae of S. exigua (B). Each larva was fed 105 polyhedral inclusion bodies (PIB) on diet cabbage. (C) Hemocoelic injection of the rAcMNPVs to fifth instar larvae of S. exigua. Mortality was measured 9 days after treatment (‘DAT’). Each treatment used 10 larvae and replicated three times. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
CpBV-ELP1 재조합 벡큘로바이러스에 대한 파밤나방 유충 시기별 감수성 변이
AcMNPV-ELP1 현탁액을 살포에 따른 파밤나방 방제 효과를 분석했다(Fig. 2). AcMNPV는 대조 바이러스인 AcMNPV-EGFP에 비해 높은 살충력을 나타냈고, 처리 농도가 높아짐에 따라 방제 효과도 높아졌다.
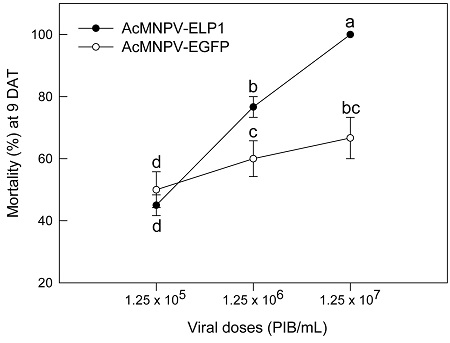
Leaf-dipping assay of AcMNPV-ELP1 toxicity against fifth instar larvae of S. exigua. AcMNPV-EGFP was used as a control viral treatment. Treated leaves were fed for first three days and then replaced with fresh cabbage. Mortality was measured 9 days after treatment (‘DAT’). Each treatment used 10 larvae and replicated three times. Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
잎침지법에 따라 나타난 AcMNPV-ELP1의 방제 효과를 모든 파밤나방 유충 발육태에 처리하여 살충력을 비교하였다(Fig. 3). 대조구인 AcMNPV-EGFP는 유충 발육태가 증가할수록 방제 효율이 증가하였다. 처리구인 AcMNPV-ELP1도 비교적 높은 방제력이 노숙 유충(4-5령)에서 나타나지만, 대조구와 달리 1령충에 대해서 가장 높은 살충력을 보였다.
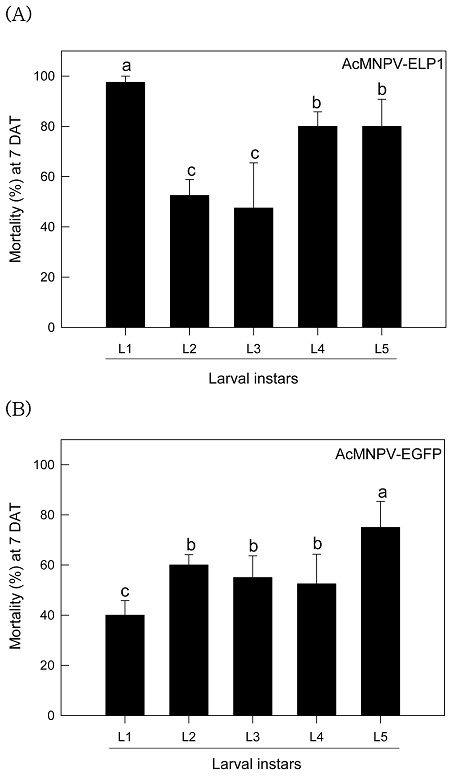
Variation in control efficacy of AcMNPV-ELP1 against different larval instar of S. exigua. Leaf-dipping method was used to test insecticidal activity. As a control recombinant baculovirus, AcMNPV-EGFP, was used. All viral treatments used a dose of 5 × 106 PIB/mL. Each instar used 10 larvae and was replicated three times. Mortality was measured 7 days after treatment (DAT). Different letters above standard deviation bars indicate significant difference among means at Type I error = 0.05 (LSD test).
간이 포장 조건에서 CpBV-ELP1 재조합 벡큘로바이러스의 파밤나방 방제 효과
곤충 체내에서 증식된 AcMNPV-ELP1의 파밤나방에 대한 방제력 시험은 포트에서 자란 배추를 대상으로 피해를 주는 유충에 대해서 실시되었다(Fig. 4). 대조구로서 AcMNPV-EGFP 처리와 화학 농약인 테부페노자이드를 병행하여 처리하였다. 처리 후 3일 및 7일 후에 각각 조사하여 AcMNPV-ELP1의 방제 속도도 분석하였다. 처리 3일 후에 AcMNPV-ELP1은 대조구인 AcMNPV-EGFP에 비해 높은 방제력을 나타내어 CpBV-ELP1 유전자에 의한 벡큘로바이러스 살충력 증가를 확인하였으나, 화학약제인 테부페노자이드에 비해서는 낮은 살충력을 나타냈다. 그러나 처리 7일 후에는 AcMNPV-ELP1의 처리가 대조구 재조합바이러스는 물론이고 화학농약인 테부페노자이드에 비해서도 높은 살충 효율을 나타냈다.
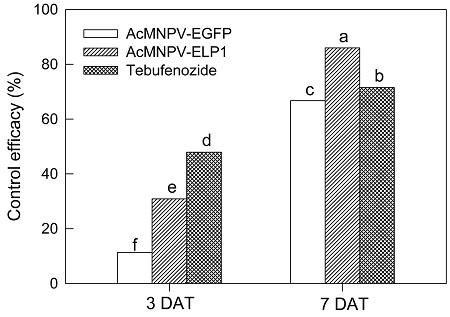
Pot assay to test the control efficacy of AcMNPV-ELP1 against S. exigua infesting Chinese cabbage. As a control recombinant baculovirus, AcMNPV-EGFP, was used. Both viral sprays used a concentration of 5 × 106 PIB/mL. As a chemical insecticide, tebufenozide (8% active ingredient) was sprayed at 1,000 ppm. Initial population was over 20 larvae in each replication. Each treatment was replicated with three pots. Live larvae were counted at 3 and 7 days after treatment (‘DAT’). Mean control efficacies are depicted. Different letters above standard deviation bars indicate significant difference among means at Type I error =0.05 (LSD test).
고 찰
파밤나방은 다양한 작물을 가해하는 주요 전작해충이다. 특히 거의 대부분의 화학농약 계통에 대해서 저항성을 발현시켜 방제에 어려움을 주고 있다(Kim et al., 1997). 이러한 저항성 문제는 생물농약인 Bt (Bacillus thuringiensis) 살충제에 대해서도 나타나(Moar et al., 1995) 대체 약제의 개발이 시급한 상황이다. 본 연구는 파밤나방이 벡큘로바이러스에 대해서 비교적 감수성이라는 보고에 바탕을 두고 이 바이러스의 살충력을 증가시키는 전략에 기초하여 재조합 벡큘로바이러스 개발에 역점을 두었다. 이를 위해 파밤나방자체가 바이러스에 대한 면역력을 억제하여 벡큘로바이러스의 살충력을 증가시키는 전략을 세웠다. 곤충의 면역력을 억제하는 인자들 가운데 PDV는 가장 잘 알려져 있으며, 이는 이 바이러스의 유전자가 대부분 나비목 유충의 세포성 및 체액성 면역을 억제하는 것으로 알려졌기 때문이다(Strand, 2010). 본 연구에서는 국내 자생하는 프루텔고치벌에서 유래한 CpBV 유전체를 통해 얻은 CpBV-ELP1 유전자를 재조합 벡큘로바이러스 제작에 이용하여 해충 방제에 응용하려 시도되었다. 이는 기존의 연구에서 CpBV-ELP1과 재조합된 벡큘로바이러스가 다른 CpBV 유래 유전자들의 재조합 벡큘로바이러스들 보다 높은 살충력을 지니기 때문에(Kim et al., 2008) 선발되었다. 그러나, 포장에서 이 재조합 벡큘로바이러스를 살포하여 파밤나방을 방제하기 위해서는 기존에 Sf9 세포주를 이용하여 이 바이러스를 생산하는 시스템으로는 다량으로 살포해야 하는 현실에 맞지 않았다. 이를 해결하기 위해 이 재조합 바이러스를 기주 충체에서 증식시켜 대량으로 바이러스를 생산하는 방식을 적용하였다. 본 연구는 파밤나방 5령 유충 개체 당 5 × 1010개 다각체를 형성하는 것으로 나타냈다. 이는 파밤나방에 대해 유효한 방제를 위해 배추 한 포기당 AcMNPV-ELP1을 5 × 106 PIB/mL 농도로 약 50 mL을 살포하기 때문에 파밤나방 한 마리에서 생산되는 재조합 벡큘로바이러스는 약 200포기의 배추에 발생하는 파밤나방을 처리할 수 있다. 동일한 계산법으로 약 1,000평의 농지에 재배되는 배추 약 1만 포기를 재배하고, 여기에 2.5 × 1012개 PIB가 투여되어야 하기에 약 50마리의 파밤나방에서 생산된 바이러스 량으로 충당할 수 있다고 추정된다.
곤충에서 증식된 재조합 벡큘로바이러스는 모두 파밤나방에 살충력을 보였다. CpBV 유전자가 재조합된 모든 벡큘로바이러스는 대조구 바이러스에 비해 높은 살충력을 나타내서 이들 유전자가 병원력 상승에 영향을 주었다고 판단된다. CpBV-H4의 경우 이 유전자의 구조가 진핵생명체의 히스톤 H4 단백질과 매우 유사성이 높아 기주의 유전자 발현을 변동시키는 인자로 알려져 있고 또한 이러한 기능을 통해 곤충의 세포성 면역을 억제시켰다(Hepat and Kim, 2011; Hepat et al., 2013). CpBV15α와 CpBV15β는 모두 15 kDa 단백질을 암호하고 있는 유전자로서 이들의 단백질은 배추좀나방과 파밤나방의 혈구세포의 행동을 억제하는 것으로 밝혀졌다(Lee and Kim, 2008). CpBV-ELP1은 혈구세포에 대한 세포독성을 나타내어 면역을 억제하는 것으로 알려졌다(Kwon and Kim, 2008). 따라서 이들 유전자들이 모두 곤충의 면역을 억제하고 이를 통해 벡큘로바이러스의 병원력을 상승시킨 것으로 해석된다. 이 가운데 CpBV-ELP1이 재조합된 벡큘로바이러스가 가장 높은 병원력 상승을 유도하였다. 이는 기존의 Kim et al. (2008)의 결과를 다시 재입증한 결과로서 곤충에서 생성된 재조합바이러스가 Sf9 세포주에서 생성된 재조합바이러스와 유사한 살충력을 나타내는 것으로 판명되었다.
AcMNPV-ELP1 재조합 바이러스는 옆면 살포로 살충력을 나타낼 수 있다. 이러한 결과는 본 연구에서 옆침지법 실험에서 입증되었다. 다양한 농도로 재조합바이러스를 조제하고 이를 잎침지법으로 처리한 결과 처리 농도에 비례하여 살충력이 높아진 결과로 미뤄 살포에 따른 방제력을 기대할 수 있다고 해석된다. 특별히 유충의 발육시기에 따라 재조합바이러스의 살충력은 상이했다. 파밤나방 유충 발육시기는 벡큘로바이러스의 병원력에 차등을 줄 수 있다는 것이 기존 연구에서 보고되었다(Kim et al., 2004). 본 연구에서는 AcMNPV-ELP1이 노숙 유충은 물론이고 1령충에서 높은 방제효율을 나타냈다. 파밤나방 노숙 유충에 대한 AcMNPV-ELP1의 높은 살충력은 대조 바이러스와 마찬가지로 어린 유충 시기에 비해 섭식량이 많아 이에 따라 체내로 들어온 바이러스 함량의 증가에 기인된 것으로 사료된다. 예를 들어, 파밤나방 5령충의 경우 1 일차에는 약 10 mg의 체중이 3일경에는 약 100 mg으로 약 10배의 체중 증가가 이뤄진다(Kim et al., 1998). 그러나 대조구 바이러스에 비해 1령충에 대해 AcMNPV-ELP1의 높은 살충력은 CpBV-ELP1의 높은 독성에 기인된 것으로 추정된다. 이는 기존의 연구에서 밝혀진 CpBV-ELP1의 높은 세포독성에 기인된다(Kwon and Kim, 2008). 본 연구 결과는 특별히 1령 유충이 이러한 세포독성에 매우 감수성이 높은 것으로 해석된다.
선발된 AcMNPV-ELP1을 살포액으로 제조하여 배추를 가해하는 파밤나방 유충에 처리한 결과 대조구 바이러스에 비해 살충력이 뚜렷이 높아지는 실내 검정 결과를 재확인시켜 주었다. 더욱이 이 재조합 벡큘로바이러스는 비록 3일차에서는 화학농약인 테부페노자이드에 비해 낮은 살충력을 보였으나, 처리 7일이 경과하면서 화학농약에 비해 월등히 높은 살충력을 나타냈다. 파밤나방 방제 적용약제인 테부페노자이드는 곤충 탈피호르몬인 엑다이손의 동력제로서 처리 해충의 탈피를 과도하게 촉진시켜 살충력을 발휘하는 곤충 성장조절제 화학 농약이다(Wing et al., 1988). 이 농약에 대해 파밤나방의 저항성 발달을 보고하였다(Jia et al., 2008). 본 연구에서는 테부페노자이드 추천농도 처리에서 파밤나방이 불과 71.5%의 방제효과를 나타냈다. 이는 본 연구에 사용된 파밤나방이 테부페노자이드에 대해서 감수성 저하를 보였다고 해석된다. 이러한 약제 저항성 파밤나방에 대해서도 재조합 벡큘로바이러스의 높은 살충력은 이 생물농약이 화학농약을 대체할 수 있는 방제제로 개발될 수 있다는 것을 의미하고 있다. 그러나 재조합 벡큘로바이러스의 비교적 느린 약효는 처리 후 CpBV-ELP1의 발현 소요시간과 이 단백질 산물의 살충 작용 기간을 의미하고 있다.
본 연구는 CpBV-ELP1을 재조합 벡큘로바이러스의 곤충 기주를 이용한 대량 생산이 살충력에 보전에 큰 변수가 되지 않았다는 것을 밝혔다. 또한 화학농약에 감수성이 저하된 파밤나방의 경우에도 이 재조합 벡큘로바이러스의 높은 살충력을 유지한다는 것을 의미하고 있다. 이상의 결과는 재조합 벡큘로바이러스가 다양한 화학농약에 저항성을 발휘하여 방제 효율을 떨어뜨리는 파밤나방에 대해서 CpBV-ELP1으로 재조합된 벡큘로바이러스가 대체 방제제로 응용이 가능하다는 것을 제시하고 있다.
Acknowledgments
본 연구는 농림축산식품부의 재원으로 농림수산식품기술평가원의 생명산업기술개발사업의 지원을 받아 연구되었음(313006-3).
Literature Cited
-
Bae, S., and Y. Kim, (2004), Host physiological changes due to parasitism of a braconid wasp, Cotesia plutellae, on diamondback moth, Plutella xylostella, Comp. Biochem. Physiol. A, 138, p39-44.
[https://doi.org/10.1016/j.cbpb.2004.02.018]

- Barandoc, K. P., and Y. Kim, (2009), A technique of segment expression and RNA interference (SERI) reveals a specific physiological function of a cysteine-rich protein gene encoded in Cotesia plutellae bracovirus, J. Microbiol. Biotechnol, 19, p610-615.
-
Bézier, A., M. Annaheim, J. Herbinière, C. Wetterwald, G. Gyapay, S. Bernard-Samain, P. Wincker, I. Roditi, M. Heller, M. Belghazi, R. Pfister-Wilhem, G. Periquet, C. Dupuy, E. Huguet, A.N. Volkoff, B. Lanzrein, and J. M. Drezen, (2009), Polydnaviruses of braconid wasps derive from an ancestral nudivirus, Science, 323, p926-930.
[https://doi.org/10.1126/science.1166788]

-
Chen, Y., F. Gao, X. Ye, S. Wei, M. Shi, H. Zheng, and X. Chen, (2011), Deep sequencing of Cotesia vestalis bracovirus reveals the complexity of a polydnavirus genome, Virology, 414, p42-50.
[https://doi.org/10.1016/j.virol.2011.03.009]

-
Choi, J. Y., J. Y. Rho, J. N. Kang, H. J. Shim, S. D. Woo, B. R. Jin, M. S. Li, and Y. H. Je, (2005), Genomic segments cloning analysis of Cotesia plutellae polydnavirus using plasmid capture system, Biochem. Biophys. Res. Commun, 322, p487-493.
[https://doi.org/10.1016/j.bbrc.2005.04.146]

- Goh, H. K., S. G. Lee, B. P. Lee, K. M. Choi, and J. H. Kim, (1991), Simple mass-rearing of beet armyworm, Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae), on an artificial diet, Kor. J. Appl. Entomol, 29, p180-183.
-
Hepat, R., and Y. Kim, (2011), Transient expression of a viral histone H4 inhibits expression of cellular and humoral immune-associated genes in Tribolium castaneum, Biochem. Biophys. Res. Commun, 415, p279-283.
[https://doi.org/10.1016/j.bbrc.2011.10.040]

-
Hepat, R., J. J. Song, D. Lee, and Y. Kim, (2013), A viral histone H4 joins to eukaryotic nucleosomes and alters host gene expression, J. Virol, 87, p11223-11230.
[https://doi.org/10.1128/JVI.01759-13]

-
Jia, B., Y. Liu, Y. C. Zhu, X. Liu, C. Gao, and J. Shen, (2008), Inheritance, fitness cost and mechanism of resistance to tebufenozide in Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae), Pest Manag. Sci, 65, p996-1002.
[https://doi.org/10.1002/ps.1785]

- Kim, S., J. Park, D. Kim, H. Choi, S. Kim, and I. Hwang, (2004), Effects of different temperatures on pathogenicity of Spodoptera exigua nucleopolyhedrovirus (SeNPV), Kor. J. Appl. Entomol, 43, p329-332.
-
Kim, Y., J. Y. Choi, and Y. H. Je, (2007), Cotesia plutellae bracovirus genome and its function in altering insect physiology, J. Asia Pac. Entomol, 10, p181-191.
[https://doi.org/10.1016/S1226-8615(08)60351-9]

- Kim, Y., B. Kwon, S. Bae, J. Y. Choi, and Y. H. Je, (2008), Enhanced pathogenicity of baculovirus using immunosuppressive genes derived from Cotesia plutellae bracovirus, Kor. J. Pestic. Sci, 12, p283-290.
- Kim, Y., J. Lee, S. Kang, and S. Han, (1997), Variation in insecticide susceptibilities of the beet armyworm, Spodoptera exigua (Hübner): esterase and acetylcholinesterase activities, Kor. J. Appl. Entomol, 36, p172-178.
-
Kim, Y., J. Lee, S. Kang, and S. Han, (1998), Age variation in insecticide susceptibility and biochemical changes of beet armyworm, Spodoptera exigua (Hübner), J. Asia Pac. Entomol, 1, p109-113.
[https://doi.org/10.1016/S1226-8615(08)60012-6]

-
Kim, Y., and Y. Son, (2006), Parasitism of Cotesia plutellae alters morphological and biochemical characters of diamondback moth, Plutella xylostella, J. Asia Pac. Entomol, 9, p37-42.
[https://doi.org/10.1016/S1226-8615(08)60273-3]

-
Kwon, B., and Y. Kim, (2008), Transient expression of an EP1- like gene encoded in Cotesia plutellae bracovirus suppresses the hemocyte population in the diamondback moth, Plutella xylostella, Dev. Comp. Immunol, 32, p932-942.
[https://doi.org/10.1016/j.dci.2008.01.005]

-
Lee, S., and Y. Kim, (2008), Two homologous parasitism-specific proteins encoded in Cotesia plutellae bracovirus and their expression profiles in parasitized Plutella xylostella, Arch. Insect Biochem. Physiol, 67, p157-171.
[https://doi.org/10.1002/arch.20218]

- Moar, W. J., M. Pusztai-Carey, H. Van Faassen, D. Bosch, R. Frutos, C. Rang, K. Luo, and M. J. Adang, (1995), Development of Bacillus thuringiensis CryIC Resistance by Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae), Appl. Environ. Microbiol, 61, p2086-2092.
- SAS Institute, Inc, (1989), SAS/STAT user's guide, Release 6.03, Ed, Cary, N.C.
- Strand, M. R., (2010), Polydnaviruses, In Insect Virology, S. Asgari, and K.N. Johnson (Eds.), Caister Academic Press, Norwich, p171-197.
-
Volkoff, A. N., V. Jouan, S. Urbach, S. Samain, M. Bergoin, P. Wincker, E. Demettre, F. Cousserans, B. Provost, F. Coulibaly, F. Legeai, C. Beliveau, M. Cusson, G. Gyapay, and J. M. Drezen, (2010), Analysis of virion structural components reveals vestiges of the ancestral ichnovirus genome, PLoS Pathog, 6, pe1000923.
[https://doi.org/10.1371/journal.ppat.1000923]

- Webb, B. A., N. E. Beckage, Y. Hayakawa, P. J. Krell, B. Lanzrein, D. B. Stoltz, M. R. Strand, and M. D. Summers, (2000), Polydnaviridae, In Virus Taxonomy, van Regenmortel, M. H. V., C. M. Faquet, D. H. L. Bishop, E. B. Carstens, M. K. Estes, S. M. Lennon, J. Maniloff, M. A. Mayo, D. J. McGeoch, C. R. Pringle, and R. B. Wickner (Eds.), Academic Press, New York, p253-260.
-
Webb, B. A., and M. R. Strand, (2005), The biology and genomics of polydnaviruses, In: Gilbert, L., K. Iatrou, S.S. Gill (Eds.), Comprehensive Molecular Insect Science, Elsevier Inc, San Diego, p323-360.
[https://doi.org/10.1016/b0-44-451924-6/00086-7]

-
Wing, K. D., R. A. Slawecki, and G. R. Carlson, (1988), RH- 5849, a non-steroidal ecdysone agonist: effects on larval Lepidoptera, Science, 241, p470-472.
[https://doi.org/10.1126/science.241.4864.470]

-
Wyler, T., and B. Lanzrein, (2003), Ovary development and polydnavirus morphogenesis in the parasitic wasp Chelonus inanitus. II. Ultrastructural analysis of calyx cell development, virion formation and release, J. Gen. Virol, 84, p1151-1163.
[https://doi.org/10.1099/vir.0.18830-0]
